Инфицирование атипичными микобактериаями. Инфекции атипичных микобактерий.
Добавил пользователь Владимир З. Обновлено: 27.01.2026
После открытия Р. Кохом возбудителя туберкулеза человека были предприняты активные бактериологические исследования предметов окружающей среды, животных, продуктов питания, воды и почвы с целью поиска единого источника микобактерий (МБ). Исследования завершились открытием большого числа различных видов кислотоупорных микробов, отличных от микобактерий туберкулеза (МВТ), но с медицинской точки зрения их рассматривали как курьезные находки. Только в 1954 г. Timpe и Runyon, собрав значительную коллекцию МБ, других, чем МВТ, выделенных из патологического материала от больных, сделали эпохальное научное открытие о важной этиологической роли нетуберкулезных микобактерий (НТМБ) в заболевании человека и животных. Эта работа послужила толчком к интенсивному изучению НТМБ и заболеваний, которые они вызывают, микробиологами, клиницистами и эпидемиологами.
Среди отечественных ученых, которые с энтузиазмом взялись за изучение НТМБ, необходимо отметить сотрудницу ЦНИИТ (Москва) Н.М. Макаревич, которая защитила в 1973 г. докторскую диссертацию на тему "Атипичные микобактерии: методы идентификации, источники выделения и значение в клинике туберкулеза". Профессор М.П. Зыков (Ленинград) в своей докторской диссертации "Микробиологические аспекты туберкулеза в странах тропической Африки" (1967 г.) также проводил исследования по идентификации и определению лекарственной чувствительности НТМБ. Основателем бактериологических исследований НТМБ в нашем институте является к.б.н. Т.Б. Ильина. Вот уже более 30 лет СПбНИИФ ведет работу по изучению НТМБ, разработке методов их идентификации, диагностике микобактериозов, обучению врачей-бактериологов ПТД методам идентификации МБ. За истекший период в лаборатории института идентифицировано более 3500 культур НТМБ, под наблюдением в клиниках института и городских стационарах находилось 269 больных микобактериозом легких. В последние годы институтом выпущен в свет ряд методических рекомендаций: "Бактериологическая и биохимическая идентификация микобактерий" (1994 г.), "Лечение туберкулеза и микобактериоза легких с применением беталактамных антибиотиков" (1995 г.), "Диагностика и прогнозирование клинического течения микобактериоза легких" (1997 г.).
Род микобактерий по определителю бактерий Берджи (1997 г.) насчитывает более 50 видов и подвидов микобактерий. По способности вызывать заболевания человека и животных микобактерий можно разделить на 3 группы. В одну группу входят безусловно патогенные (опасные) для человека и животных виды микобактерий М. tuberculosis и M. bovis, которые вызывают туберкулез человека и крупного рогатого скота, M. leprae - возбудитель заболевания проказы. В другую - сапрофитные микобактерии, которые свободно живут в окружающей среде и, как правило, не опасны для человека. К ним относятся M. terrae - выделенная из почвы (земли), M. phlei - найдена на траве тимофеевке, M. gordonae (M. aqual) - выделена из водопроводной воды. Промежуточное положение занимает группа условно (потенциально) патогенных микобактерий, которые при определенных условиях могут вызвать заболевания человека.
Термин "нетуберкулезные микобактерий" объединяет сапрофитные и потенциально-патогенные МБ и наиболее точно, с нашей точки зрения, характеризует ту разнообразную группу МБ, которые необходимо отделять от микобактерий туберкулезного комплекса. Заболевания человека, вызванные НТМБ, называются микобактериозами. Международная классификация болезней (десятый пересмотр) включает инфекции, вызванные НТМБ, в рубрику А 31.
В настоящее время повсеместно отмечается нарастание заболеваний микобактериозом, что, вероятно, связано с увеличением числа больных с поражением иммунной системы с хроническими неспецифическими заболеваниями легких, а также с возросшим числом исследований на НТМБ и улучшением их диагностики. Немаловажную роль в увеличении микобактериоза играет ухудшение экологической обстановки в отдельных регионах.
Фтизиатрическая служба, где лечатся и состоят на учете больные микобактериозом, уже хорошо знакома с этим заболеванием, однако врачи практического здравоохранения, как и население в целом, мало информированы об этом заболевании. В то же время трудности диагностики, высокая естественная резистентность НТМБ к антибактериальным препаратам приводит к развитию хронических деструктивных поражений легких или диссеменированным процессам. Заболевание имеет неблагоприятный прогноз, с частыми обострениями, постоянным бактериовыделением и высоким процентом летальных исходов.
НТМБ вызывают заболевания легких, лимфатических узлов, кожи, мягких и костных тканей. У нас в стране наиболее часто встречаются микобактериозы легких. Они наблюдаются главным образом у лиц старше 50 лет, имеющих предшествующие деструктивные или обструктивные поражения легких: хронические бронхиты, эмфиземы, бронхоэктазы, пневмоконеозы, силикозы, у больных, излеченных от хронических инфекций, таких как туберкулез и микоз. Лимфангоиты встречаются исключительно в детском возрасте от 1,5 до 10 лет. Поражаются подчелюстные и околоушные лимфатические узлы. Быстрорастущие микобактерии часто становятся причиной раневой инфекции, послеоперационных осложнений при трансплантации органов, перитональном диализе. В последнее время отмечается течение микобактериоза в виде диссеминированной инфекции. Заболевание развивается на фоне иммунодефицитного состояния организма, связанного с предшествующими заболеванием или применением лекарственных препаратов (иммунодепрессантов). Диссеминированные процессы развиваются также как позднее осложнение у больных с синдромом иммунодефицита.
Если главным источником МТБ является больной человек, то микобактериозы до настоящего времени расцениваются как неконтагиозные заболевания. Считается, что больной микобактериозом не представляет опасности для окружающих, так как НТМБ не передаются от человека к человеку. Эпидемиологиеское изучение источника НТМБ и путей передачи возбудителя показало высокий процент содержания НТМБ на различных объектах окружающей среды. Почва и вода являются естественным резервуаром обитания НТМБ, поэтому иногда их называют "микобактериями окружающей среды". Известно, что главным местом обитания M. avium intracellulare служат открытые водоемы. Из воды M. avium передается человеку воздушно-капельным путем, в результате естественного образования аэрозолей над поверхностью воды. Наши наблюдения показали, что часто источником заболевания микобактериозом становятся больные туберкулезом домашние птицы, выделяющие M. avium. M. kanssasii в большом количестве выделяются из водопроводной воды и от некоторых видов домашних животных. M. xenopi обнаруживаются исключительно в воде, особенно в системах горячего водоснабжения и питьевых бачках, где при оптимальной температуре роста (43-45°С) интенсивно размножаются. Быстрорастущие микобактерии - M. fortuitum и M. chelonai - выделяются из почвы и естественных водоемов. Таким образом, широкое растпространение M. avium в природе часто способствует инфицированию человека и обнаружению их при посеве патологического материала.
Выделение НТМБ из патологического материала не свидетельствует о безусловной этиологической значимости данного микроба, как это бывает в случае выявления МВТ. Выделение культуры НТМБ может происходить вследствие ряда причин:
1. Случайное загрязнение материала НТМБ из окружающей среды.
2. Носительство НТМБ, которые могут заселять (колонизировать) отдельные органы и системы человека (респираторный, желудочно-кишечный тракт, мочевыделительные пути), жить там и размножаться, не вызывая клинических проявлений.
3. Заболевание микобактериозом. Следовательно, выделение НТМБ требует от врача тщательного клинического разбора больного для определения этиологического значения выделенной культуры. НТМБ вызывают заболевания, по клиническим, рентгенологическим и патологическим признакам сходные с туберкулезом, поэтому главным критерием при постановке диагноза микобактериоза является бактериологическое исследование больного с выделением культуры микобактерии и их идентификацией.
За последние годы в Санкт-Петербурге и Ленинградской области ежегодно регистрируется от 11 до 15 случаев микобактериоза легких. В течение 1994-1998 гг. в регионе Северо-Запада как возбудители микобактериоза определяются пять видов НТМБ. M. avium-intracellulare считается основным возбудителем заболеваний человека, на их долю приходится 57% заболеваний. На втором месте по этиологической значимости новый для нашего региона возбудитель M. malmoense - 24,5%. Остальные заболевания вызваны M. xenopi, M. kanssasii и M. scrofulaceum.
Первую оценку этиологической значимости выделенной культуры НТМБ лечащий врач делает при получении результатов идентификации МБ, которая складывается из исследуемого патологического материала и вида выделенных НТМБ. Установлено, что для каждого патологического материала характерен свой видовой состав МБ, что дает возможность сделать предварительную оценку выделенных микроорганизмов и определить тактику ведения больного.
Из диагностического материала при заболевании бронхолегочной системы (мокрота, промывные воды бронхов), как правило, выделяются потенциально патогенные МБ - M. avium, M. xenopi, M. kanssasii, M. malmoense (таблица). Именно эти НТМБ являются главными этиологически значимыми микроорганизмами и вызывают почти 95% микобактериозов человека. Следовательно, при первом выделении этих НТМБ врачу следует подумать о возможности микобактериоза и провести целенаправленное многократное бактериологическое обследование больного. Однократное выделение сапрофитных МБ из респираторного тракта при заболевании легких носит случайный характер и может быть расценено как загрязнение или носительство. Исключение составляют быстрорастущие M. fortuitum и M. chelonai, которые также могут быть возбудителями микобактериозов, но в этом случае выделение носит многократный характер.
В 90% случаен из мочи выделяются сапрофитные МБ, что указывает на возможность значительного загрязнения (контаминации) материала при сборе анализов. В то же время наблюдаются случаи многократного (до 10 культур) выделения M. fortuitum из мочи, сопровождающегося массивным ростом культуры. У этих больных, как правило, отмечаются патологические изменения в почках, подтвержденные клинико-лабораторными исследованиями. Но ни в одном из клинических наблюдений диагноз микобактериоза мочевыделительной системы не был поставлен. У всех больных многократное выделение НТМБ из мочи было расценено как носительство. В операционном материале в 100% случаев выделяются потенциально патогенные МБ, что служит неоспоримым критерием для постановки диагноза микобактериоза. В некоторых случаях имеет место выделение НТМБ только в резецированной легочной ткани, что также указывает на большие трудности выделения этих видов МБ из патологического материала больных с заболеваниями легких.
Таблица. Группировка микобактерий по степени патогенности для человека (наиболее часто встречающиеся НТМБ в нашем регионе)
| Патогенные | M. tuberculosis, M. bovis, M. leprae |
| Потенциально патогенные | M. avium, M.intracellulare, M. kanssasii, M. malmoense, M. xenopi, M. fortuitum, M. chelonai |
| Сапрофиты | M. gordonae, M. terrae, M. triviale, M. phlei, M. flavescens, M. gastri |
Для постановки диагноза микобактериоза легких общепринятым критерием является многократное выделение одного и того же вида НТМБ с учетом соответствующей клинико-рентгенологической картины заболевания при условии отсутствия у больного МВТ. Безусловным диагностическим признаком считается выделение НТМБ из закрытого очага, из которого проба получена в стерильных условиях (абсцесс, биопсия, операционный материал). Однако, учитывая несовершенство бактериологических методов исследования, так же как и неудовлетворительное обследование больных, выделение НТМБ из патологического материала встречается крайне редко.
Детальный анализ историй болезни больных микобактериозом позволил сделать вывод о том, что в ряде случаев диагноз можно ставить и по однократному выделению НТМБ. За основу клинико-бактериологического критерия диагностики микобактериоза взята ОДНОВРЕМЕННОСТЬ появления клинико-рентгенолабораторных признаков заболевания, характерных для туберкулезного процесса, и выделение культуры НТМБ.
В 70% случаев заболевания микобактериозом легких выявляются в период профилактических осмотров или диспансерного наблюдения. В этих условиях симптоматика заболевания может быть стертой, но данные рентгенологического или флюорографического обследования свидетельствуют о появлении специфического процесса в легких или его активизации (свежие очаговые изменения, инфильтрат с распадом, зона деструкции и др.). Такой больной направляется для дообследования и лечения в противотуберкулезный диспансер, где он проходит первичное бактериологическое обследование методом бактериоскопии и посева на МБ. Если в диагностическом материале выделены потенциально патогенные микобактерии, то заболевание следует расценивать как микобактериоз, так как имеется тесная временная связь между выделением культуры НТМБ и наличием рентгено-флюорографических данных о патологическом процессе в легких. У 60% больных микобактериозом выделение НТМБ наблюдается в первые два месяца после обнаружения специфической патологии в легких и дает возможность правильно верифицировать заболевание.
В 30% случаев патологические изменения в легких диагностируются при обращении за медицинской помощью. Основным поводом для обращения к врачу является симптоматика острого респираторного заболевания или обострения хронического неспецифического процесса в легких, в некоторых случаях первым проявлением заболевания бывает кровохарканье. В связи с подобной патологией больных, как правило, направляют на бактериологическое обследование с посевом материала на МБ. В 64% наблюдений дата обращения за медицинской помощью и дата выделения первичной культуры НТМБ у больных микобактериозом укладывается в двухмесячный срок. Следовательно, одновременное появление клинико-рентгенолабораторных признаков заболевания и выделение культуры НТМБ является научно обоснованным критерием для постановки диагноза микобактериоза легких.
Таким образом, если появление выраженной клинико-лабораторной симптоматики (кашель с мокротой, одышка, катаральные явления в легких, повышение температуры, ускорение СОЭ) и рентгенологическое выявление картины специфического процесса в легких совпадают с датой выделения НТМБ из диагностического материала, диагноз микобактериоза легких впервые выявленным больным ставится по однократному (первичному) выделению НТМБ. Аналогичное сопоставление даты активизации процесса и даты выявления культуры НТМБ может иметь место и у больных, ранее перенесших туберкулез, которые в момент клинического прогрессирования процесса в легких на фоне интенсивной противотуберкулезной терапии выделяют культуру НТМБ. В этих случаях диагноз микобактериоза также можно ставить по однократному выделению НТМБ.
Следует еще раз подчеркнуть, что НТМБ вызывают у человека заболевания, сходные с туберкулезом, и для постановки диагноза необходимо пользоваться "Клинической классификацией туберкулеза" (приложение N8 к приказу МЗ РФ от 22.11.95 г. N324), заменив термин "туберкулез" на "микобактериоз", вместо "МБТ+" указывать вид НТМБ, выделенных у больного, как-то: M. avium, M. xenopi и др.
Во всех случаях выделения НТМБ одновременно с МБТ приоритет отдается классическим МВТ. Выделение НТМБ признается простым носительством и не требует специальной терапии в редких случаях, когда больные микобактериозом заражаются туберкулезом как вторичной инфекцией и выделяют два вида МБ, и туберкулезные и нетуберкулезные микобактерии оцениваются как этиологически значимые микроорганизмы.
Инфицирование атипичными микобактериаями. Инфекции атипичных микобактерий.
Инфицирование атипичными микобактериаями. Инфекции атипичных микобактерий.
По данным исследований, проведенных в Москве, Киеве, Ленинграде, Львове, Фрунзе и других городах, атипичные микобактерий составляют в среднем 1,67% среди 17 495 выделенных культур. Неодинакова и частота различных видов атипичных микобактерий. По данным Н. М. Макаревич (1973), среди общего числа ското-хромогенные штаммы высеваются в 55,8% случаев, нефотохромогенные— в 25%, быстро растущие — в 10,8%, фотохромогенные — в 8,3%.
Сравнительно чаще выделяют атипичные микобактерий из пораженных периферических лимфатических узлов у детей. По данным Schroder (1969), они составили 12% среди всех видов микобактерий туберкулеза, обнаруженных при этой форме процесса в 1958—1966 гг. в ФРГ.
Следует, однако, подчеркнуть, что патогенными считаются лишь те атипичные кислотоустойчивые микобактерий, которые повторно высеиваются из мокроты одного и того же больного или из резецированного легкого и другого органа, образуют многочисленные колонии в культурах и вызывают патологические изменения в организме у некоторых лабораторных животных, например у белых мышей.
Уверенность в заражении такими микобактериями возрастает, если больные реагируют на гомологичные сенситины, полученные из того или иного вида типичных микобактерий, более интенсивными внутрикожными реакциями, чем на стандартный туберкулин. Известным подтверждением этиологической роли атипичных микобактерий в генезе болезни служит также обнаружение методом двойной диффузии в агаре специфических антител в сыворотке крови больных (Jenkins, 1959).
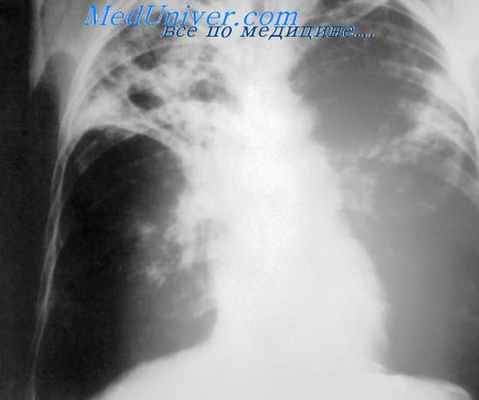
Атипичные микобактерии могут проникнуть в организм различными путями: с воздухом, пылью, водой, с плохо обработанными продуктами от животных, при контакте с зараженными домашними животными и птицами. Возможность передачи инфекции от человека человеку не установлена.
Возникающие при заражении патологические изменения в органах и клинические проявления болезни весьма разнообразны и объединяются понятием «микобактериозы». Penso, предложивший этот термин в 1959 г., различает 4 основные клинические формы процесса: бронхо-легочную, почечную, лимфожелезистую и кожную. Наиболее частая из них — бронхо-легочная — проявляется в виде хронической пневмонии, пневмокониоза, бронхоэктатической болезни, плеврита, но чаще всего протекает под видом фиброзно-кавернозного, хронического диссеминированного, реже очагового и инфильтративного туберкулеза легких). Клинически отличить эти формы микобактерио-зов от специфического туберкулезного процесса часто трудно.
Н. М. Макаревич (1973) выделила атипичные микобактерий из мокроты 102 больных, 84 из которых поступили в клинику с диагнозом: туберкулез легких. Однако этиологическая роль этих видов микробов в развитии болезни была подтверждена лишь в 25 случаях; в остальных — они были сопутствующими микобактериями и не влияли на клинику и течение специфического легочного процесса.
Обращает на себя внимание, что большинство больных микобактериозами — мужчины преимущественно среднего и пожилого возраста. Часть из них заняты в профессиях, связанных с уходом за животными и с вдыханием угольной или металлической пыли. У них не отмечается контакта с бацилловыделителями. Заболевание протекает хронически на протяжении многих лет с выраженной наклонностью к фиброзу, развитию эмфиземы и возникновению кровохарканья. Образующиеся каверны в легких часто тонкостенные и не сопровождаются бронхогенпым обсеменением. При всех указанных формах болезни туберкулостатические препараты I ряда оказываются неэффективными из-за устойчивости к ним атипичных штаммов микобактерий. В последнее время установлено известное терапевтическое действие в этих случаях циклосерина, канамицина, этамбутола и рифампицина, к которым атипичные микобактерий оказываются чувствительными.
Совместно с Н. М. Макаревич и Б. Я. Бакаповой мы имели возможность наблюдать больного М., 65 лет, страдавшего микобактериозом, вызванным М. fortuitum.
Микобактериоз — болезнь будущего, утверждают некоторые авторы. Трудно сказать, оправдается ли это предположение. Тем не менее повсеместно накапливающиеся клинико-лабораторные наблюдения побуждают к дальнейшим углубленным исследованиям в этой области и уточнению взаимосвязи туберкулеза и микобактериоза.
Обобщая приведенные данные, следует, таким образом, прийти к выводу, что форма и характер течения туберкулеза в какой-то степени определяются теми или иными биологическими свойствами микобактерий.
Известную роль в клинических проявлениях болезни играют пути заражения. При крайне редко встречающемся внутриутробном инфицировании поражаются главным образом печень, селезенка, брюшина, мезен-териальные лимфатические узлы и в меньшей степени — легкие. Подобное явление отмечается и при заражении большой дозой микобактерий алиментарным путем. На это указывают, например, результаты клинического и секционного исследования детей в Любеке, которым при вакцинации ошибочно была введена культура вирулентных микобактерий человеческого типа. Первичный комплекс среди умерших у 85% находился в брюшной полости и у 15% — в легких. У 104 человек из 174 оставшихся в живых и длительно наблюдавшихся крупные обызвествленные очаги обнаруживались в забрюшинных лимфатических узлах, у 59 — в шейных и лишь у 11 — в легких и во внутригрудных лимфатических узлах.
В Баварии, где еще в 1952 г. был широко распространен туберкулез среди рогатого скота, а население часто пользовалось сырым молоком и непастеризованными молочными продуктами, при обследовании большой группы клинически здоровых школьников у 43% из них были обнаружены обызвествленные забрюшинные и брыжеечные лимфатические узлы. В этих случаях, очевидно, имело место энтеральное заражение микобактериями бычьего типа.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Публикации в СМИ
Атипичная микобактериальная инфекция — комплекс гранулематозных поражений, вызываемых микобактериями, отличающимися от классических патогенов — возбудителей туберкулёза и лепры.
Этиология. Возбудители — кислотоустойчивые бактерии Mycobacterium ulcerans, M. marinum (M. balnei), M. kansasii, M. avium-intracellulare, M. xenopi, M. scrofulaceum.
Эпидемиология. Большинство возбудителей широко распространено в окружающей среде; некоторые обитают в воде и прибрежной зоне, вызывая заболевания у рыб, другие (например, Mycobacterium avium-intracellulare) — у птиц. Наиболее часто заражение происходит при вдыхании микобактерий, употреблении заражённых продуктов и проникновении возбудителя через микротравмы кожи и слизистых оболочек.
Патогенез. Проникшие микобактерии фагоцитируются макрофагами и транспортируются в регионарные лимфатические узлы; фагоцитарные реакции незавершённые, и возбудитель персистирует в цитоплазме макрофагов. Воспалительная реакция незначительная, но в месте проникновения развивается первичный аффект. В динамике по ходу регионарных лимфатических путей и узлов формируется первичный комплекс, характеризующийся развитием гранулём. Микроскопия биоптатов выявляет в последних очаги неказеозного некроза, содержащие кислотоустойчивые бактерии.
Клиническая картина
• Туберкулёзоподобные поражения. В патологический процесс вовлекаются лёгкие, почки, кожные покровы и костно-суставная система. Часто осложняют течение эмфизематозных процессов. У 40–50% больных с иммунодефицитными состояниями вызывают генерализованные поражения.
• Лимфадениты. Клинически чаще проявляются поражениями шейных лимфатических узлов (так называемые скрофулы); последние безболезненны, могут изъязвляться либо дренироваться наружу; системные проявления слабые или чаще отсутствуют.
• Кожные поражения. Типичным считают инфицирование ран конечностей, полученных при ударе о стенку бассейна или любой объект на дне и берегах водоёма. Чаще наблюдают образование изъязвляющейся гранулёмы, спонтанно ограничивающейся в течение нескольких недель, в более редких случаях формируется хроническая инфекция.
Методы исследования • Выделение и идентификация возбудителя по скорости роста, образованию пигментов (на свету или в темноте) и патогенности для лабораторных животных • АТ к Mycobacterium kansasii перекрёстно реагируют с Аг Mycobacterium tuberculosis и у инфицированных лиц отмечают положительную реакцию Манту.
Дифференциальная диагностика • Лепра • Туберкулёз • Боррелиоз • Чума.
Лечение • При лёгочных поражениях •• Рекомендовано сочетание изониазида 600 мг, рифампицина 300 мг, стрептомицина 1 г и этамбутола 15–25 мг/кг 1 р/сут •• При поражении M. marinum — миноциклин по 100 мг каждые 12 ч в течение 6–8 нед •• При поражении M. kansasii и M. xenopi эффективна стандартная противотуберкулёзная терапия с обязательным назначением рифампицина •• Оперативное вмешательство рекомендовано при локализованных поражениях у пациентов молодого возраста без патологии других органов и систем • При лимфадените — у детей от 1 до 5 лет показано хирургическое лечение • При кожных поражениях, вызванных M. marinum, — тетрациклин (1–2 г/сут) и сочетание рифампицина и этамбутола в течение 3–6 мес • При инфекциях, вызванных ранами или инородными телами •• Хирургическая обработка раны и удаление инородного тела •• Лекарственная терапия: доксициклин (200–400 мг/сут), цефокситин (200 мг/кг/сут), амикацин (10–15 мг/сут) в течение 3–6 мес • При диссеминированных поражениях — сочетание противотуберкулёзных средств (как при лёгочных поражениях) лишь уменьшает бактериемию и временно ослабляет симптомы.
Течение и прогноз. Течение — прогрессирующее. Более чем у 20% пациентов отмечают рецидивы заболевания в течение 5 лет.
МКБ-10. A31 Инфекции, вызванные другими микобактериями
Код вставки на сайт
Инфекция микобактериальная атипичная
Атипичная микобактериальная инфекция — комплекс гранулематозных поражений, вызываемых микобактериями, отличающимися от классических патогенов — возбудителей туберкулёза и лепры.
Этиология. Возбудители — кислотоустойчивые бактерии Mycobacterium ulcerans, M. marinum (M. balnei), M. kansasii, M. avium-intracellulare, M. xenopi, M. scrofulaceum.
Эпидемиология. Большинство возбудителей широко распространено в окружающей среде; некоторые обитают в воде и прибрежной зоне, вызывая заболевания у рыб, другие (например, Mycobacterium avium-intracellulare) — у птиц. Наиболее часто заражение происходит при вдыхании микобактерий, употреблении заражённых продуктов и проникновении возбудителя через микротравмы кожи и слизистых оболочек.
Патогенез. Проникшие микобактерии фагоцитируются макрофагами и транспортируются в регионарные лимфатические узлы; фагоцитарные реакции незавершённые, и возбудитель персистирует в цитоплазме макрофагов. Воспалительная реакция незначительная, но в месте проникновения развивается первичный аффект. В динамике по ходу регионарных лимфатических путей и узлов формируется первичный комплекс, характеризующийся развитием гранулём. Микроскопия биоптатов выявляет в последних очаги неказеозного некроза, содержащие кислотоустойчивые бактерии.
Клиническая картина
• Туберкулёзоподобные поражения. В патологический процесс вовлекаются лёгкие, почки, кожные покровы и костно-суставная система. Часто осложняют течение эмфизематозных процессов. У 40–50% больных с иммунодефицитными состояниями вызывают генерализованные поражения.
• Лимфадениты. Клинически чаще проявляются поражениями шейных лимфатических узлов (так называемые скрофулы); последние безболезненны, могут изъязвляться либо дренироваться наружу; системные проявления слабые или чаще отсутствуют.
• Кожные поражения. Типичным считают инфицирование ран конечностей, полученных при ударе о стенку бассейна или любой объект на дне и берегах водоёма. Чаще наблюдают образование изъязвляющейся гранулёмы, спонтанно ограничивающейся в течение нескольких недель, в более редких случаях формируется хроническая инфекция.
Методы исследования • Выделение и идентификация возбудителя по скорости роста, образованию пигментов (на свету или в темноте) и патогенности для лабораторных животных • АТ к Mycobacterium kansasii перекрёстно реагируют с Аг Mycobacterium tuberculosis и у инфицированных лиц отмечают положительную реакцию Манту.
Дифференциальная диагностика • Лепра • Туберкулёз • Боррелиоз • Чума.
Лечение • При лёгочных поражениях •• Рекомендовано сочетание изониазида 600 мг, рифампицина 300 мг, стрептомицина 1 г и этамбутола 15–25 мг/кг 1 р/сут •• При поражении M. marinum — миноциклин по 100 мг каждые 12 ч в течение 6–8 нед •• При поражении M. kansasii и M. xenopi эффективна стандартная противотуберкулёзная терапия с обязательным назначением рифампицина •• Оперативное вмешательство рекомендовано при локализованных поражениях у пациентов молодого возраста без патологии других органов и систем • При лимфадените — у детей от 1 до 5 лет показано хирургическое лечение • При кожных поражениях, вызванных M. marinum, — тетрациклин (1–2 г/сут) и сочетание рифампицина и этамбутола в течение 3–6 мес • При инфекциях, вызванных ранами или инородными телами •• Хирургическая обработка раны и удаление инородного тела •• Лекарственная терапия: доксициклин (200–400 мг/сут), цефокситин (200 мг/кг/сут), амикацин (10–15 мг/сут) в течение 3–6 мес • При диссеминированных поражениях — сочетание противотуберкулёзных средств (как при лёгочных поражениях) лишь уменьшает бактериемию и временно ослабляет симптомы.
Течение и прогноз. Течение — прогрессирующее. Более чем у 20% пациентов отмечают рецидивы заболевания в течение 5 лет.
Нетуберкулёзные микобактериальные инфекции
Другие микобактерии, кроме туберкулезной палочки, иногда заражают людей. Эти возбудители (называемые нетуберкулезными бактериями) обычно присутствуют в почве и воде и являются намного менее вирулентными для людей, чем Mycobacterium tuberculosis. Инфекции, вызванные этими организмами, называют нетипичными инфекциями окружающей среды и нетуберкулезными микобактериальными инфекциями.
Большинство заражений и инфицирований этими организмами не вызывают заболевания, которому обычно требуется дефект в местных или системных защитных силах хозяина; ослабленные пожилые люди и люди с ослабленным иммунитетом находятся в группе самого высокого риска. M. aviumM. avium комплекс (MAC) — при большинстве заболеваний подсчет возбудителей близкородственных видов M. avium и M. intracellulare. К другим видам, являющимся причиной заболеваний, относятся M. kansasii, M. xenopi, M. marinum, M. ulcerans, M. fortuitum, M. abscessus и M. chelonae. Передача от человека к человеку не была документирована.
Легкие – наиболее распространенное место поражения; большинство этих легочных инфекций вызваны МАК, но могут быть связаны и с M. kansasii, M. xenopi и M. abscessus. В отдельных случаях поражаются лимфоузлы, кости и суставы, кожа и раны. Однако заболеваемость диссеминированным заболеванием МАК возрастает у ВИЧ-инфицированных пациентов, а резистентность к противотуберкулёзным препаратам является нормой (кроме M. kansasii и M. xenopi).
Диагностика нетуберкулезной микобактериальной инфекции, как правило, осуществляется с помощью окраски по Цилю-Нильсену и бактериологическому анализу образцов.
По нетуберкулезным микобактериальным инфекциям лучше всего обращаться к специалисту в этой области. The American Thoracic SocietyАмериканское общество специалистов по заболеваниям грудной клетки (The American Thoracic Society) издает обновленные руководства по диагностике и терапии этих инфекций.
Заболевания легких
Типичным пациентом является женщина среднего или пожилого возраста с расширением бронхов, сколиозом, деформацией грудной клетки или пролабированием створок митрального клапана, но без известных фоновых патологий легких. MAC также вызывает заболевания легких у белых мужчин среднего или пожилого возраста, имеющих проблемы с легкими в анамнезе, такие как хронический бронхит Хроническая обструктивная болезнь легких (ХОБЛ) , пролеченный туберкулез, расширение бронхов Бронхоэктазы Бронхоэктазы представляют собой расширение и деструкцию крупных бронхов, вызванные хронической инфекцией и воспалением. Частые причины – муковисцидоз, иммунные нарушения и рецидивирующие инфекции. Прочитайте дополнительные сведения . Не всегда бывает ясно вызывает ли MAC бронхоэктазы или бронхоэктазы приводят к MAC. У пожилых, худощавых женщин с хроническим непродуктивным кашлем, этот синдром часто называется синдром леди Уиндермир; похоже, увеличение частоты его встречаемости происходит по неизвестным причинам.
Кашель и откашливание распространены, часто связаны с утомляемостью, потерей веса и небольшой лихорадкой. Течение заболевания может медленно прогрессировать или быть устойчивым в течение длительных периодов. Дыхательная недостаточность и постоянное кровохарканье может прогрессировать. Фиброзно-очаговые инфильтраты при рентгенографии грудной клетки такие же, как и при легочном туберкулезе, но реинфекция имеет тенденцию быть тонкостенной, и плевральные выпоты наблюдаются. Так называемые инфильтраты «дерево с набухшими почками», обнаруживаемые при КТ грудной клетки, также характерны для болезни, обусловленной MAC.
Анализ мокроты и бакпосев выполняются для выявления микобактериозов и для дифференциальной диагностики МАК-инфекции и туберкулеза.
Определение восприимчивости препарата может быть полезным для определенного микроорганизма/сочетаний лекарств, но может быть сделано только в узкоспециализированных лабораториях. Для MAC восприимчивость к кларитромицину является предиктором терапевтического ответа.
При умеренной симптоматике с положительными результатами микроскопии мазка мокроты и бактериологического анализа применяют кларитромицин 500 мг перорально 2 раза/день или азитромицин 600 мг перорально 1 раз/день, рифампин 600 мг перорально 1 раз/день и этамбутол 15–25 мг/кг перорально 1 раз/день в течение 12–18 месяцев, или, пока результаты бактериологического анализа не станут отрицательными - на протяжении 12 месяцев.
При прогрессирующих случаях, без реакции на стандартные препараты, можно пробовать комбинации из 4–6 препаратов, которые включают кларитромицин 500 мг перорально 2 раза/день или азитромицин 600 мг перорально 1 раз/день, рифабутин 300 мг перорально 1 раз/день, ципрофлоксацин 250–500 мг перорально или внутривенно 2 раза/день, клофазимин 100–200 мг перорально 1 раз/день и амикацин 10–15 мг/кг внутривенно 1 раз/день.
Резекция рекомендуется в исключительных случаях, включая четко локализованное заболевание у молодых, в остальном здоровых пациентов.
Инфекции, вызываемые M. kansasii и M. xenopi, поддаются лечению изониазидом, рифабутином и этамбутолом с или без назначения стрептомицина или кларитромицина в течение 18–24 мес. Инфекции, вызываемые M. abscessus, лечат с назначением 3 лекарственных средств: амикацина, имипенема или цефокситина и макролидов перорально.
Все нетуберкулезные микобактерии являются стойкими по отношению к пиразинамиду.
Лимфаденит
У детей возрастом 1–5 лет хронический верхнечелюстной и нижнечелюстной шейный лимфаденит обычно вызывается комплексом M. Avium или M. scrofulaceum. Передается, по-видимому, при приеме с пищей организмов, находящихся в почве.
Диагноз обычно ставится по биопсии иссечения.
Обычно вырезание является соответствующим лечением и химиотерапия не требуется.
Заболевание, поражающее кожу
Гранулема пловцов является затяжным, но самоограничивающимся поверхностным гранулематозным заболеванием с образованием язв; как правило, вызывается M. marinum, связано с купанием в загрязненных бассейнах или очисткой домашнего аквариума. Иногда бывают вовлечены M. ulcerans и M. kansasii. Поражения выглядят как красноватые подтеки, которые увеличиваются и становятся фиолетовыми, наиболее часто появляются на верхних конечностях или коленях. Выздоровление может произойти спонтанно, но против M. marinum эффективны миноциклин или доксициклин 100–200 мг перорально 1 раз/день, кларитромицин 500 мг перорально 2 раза/день или рифампин плюс этамбутол в течение 3–6 месяцев.
Заболевание язвой Бурули, вызываемой M. ulcerans, происходит в сельской местности в более чем 30 тропических и субтропических стран: большинство случаев приходится на Западную и Центральную Африку. Она начинается как подкожный безболезненный узелок, большая безболезненная уплотненная область или диффузный безболезненный отек ног, рук или лица. Инфекция прогрессирует, вызывая значительное разрушение кожи и мягких тканей, на ногах или руках могут образовываться обширные язвы. Исцеление может привести к тяжелой контрактуре, рубцам и деформациям. Для диагностики следует использовать ПЦР. ВОЗ рекомендует проведение в течение 8 недель 1 раз/день комбинированной терапии рифампином 10 мг/кг перорально плюс либо стрептомицин 15 мг/кг внутримышечно, либо кларитромицин 7,5 мг/кг перорально (предпочтительно во время беременности), либо моксифлоксацин 400 мг перорально.
Раны и инфекции, связанные с инородным телом
Нетуберкулезные микобактерии образуют биопленки, местом обитания этих бактерий являются системы водоснабжения в жилых, офисных и медицинских учреждениях. Их трудно искоренить с помощью общих методов обеззараживания (например, с использованием хлора, ртутьорганических соединений или щелочного глутаральдегида).
Быстрорастущие нетуберкулезные микобактерии (M. fortuitum complex, M. chelonae, M. abscessus complex) могут вызывать внутрибольничные вспышки инфекций, как правило, при инъекциях зараженных растворов, загрязнении ран нестерильной водой, использовании зараженных инструментов или имплантации зараженных устройств. Заражение этими инфекциями возможно и после косметических процедур, иглоукалывания или при нанесении татуировок. M. fortuitum complex вызывает серьезные инфекции в виде проникающих ран глаз и кожи (особенно на ногах), при татуаже, а также у пациентов, получивших зараженные материалы (например, сердечные свиные клапаны, имплантаты груди, костный воск).
Лечение обычно требует обширной санации и удаления инородного материала. Используемые препараты включают
Имипенем 1 г внутривенно каждые 6 часов
Левофлоксацин 500 мг внутривенно или перорально 1 раз/день
Кларитромицин 500 мг перорально 2 раза в день
Триметоприм/сульфаметоксазол форте 1 таблетка перорально 2 раза в день
Доксициклин 100-200 мг перорально 1 раз/день
Цефокситин 2 г внутривенно каждые 6-8 ч
Амикацин 10-15 мг/кг внутривенно 1 раз/день
При комбинированной терапии рекомендуется назначение, по крайней мере, 2 лекарственных средств, активных in vitro по отношению к возбудителям. Продолжительность терапии составляет в среднем 24 месяца и может длиться дольше, если инфекция остается в теле. Амикацин обычно добавляется в схему лечения в течение первых 3–6 месяцев. Инфекционные заболевания, вызванные M. abscessus и M. chelonae, обычно являются устойчивыми к большинству антибиотиков, и их чрезвычайно трудно или невозможно вылечить, ими должен заниматься опытный специалист.
Диссеминированная форма заболевания
Комплекс Avium (MAC) обычно вызывает диссеминированное заболевание у пациентов с прогрессирующим СПИДом и иногда у людей с ослабленным иммунитетом, включая состояние после трансплантации органа и лейкоз ворсистых клеток. У больных СПИДом такое диссеминированное состояние обычно развивается поздно (в отличие от туберкулеза, который развивается рано), одновременно с другими оппортунистическими инфекциями.
Диссеминированное заболевание, обусловленное комплексом МАК, вызывает лихорадку, анемию, тромбоцитопению, диарею и боль в животе (симптомы похожи на болезнь Уиппла).
Диагноз диссеминированного заболевания, обусловленного комплексом Mycobacterium avian, может быть подтвержден выделением культуры из крови или костного мозга или биопсией (например, перкутанная биопсия печени или некротических лимфоузлов). Микроорганизмы могут быть выделены и идентифицированы в стуле и респираторных органах, но в этих случаях находки могут свидетельствовать скорее о колонизации, чем о настоящем заболевании.
Комбинированная терапия при бактериемии обычно включает 2–3 лекарственных средства. Первое – это кларитромицин 500 мг перорально 2 раза/день или азитромицин 600 мг перорально 1 раз/день, плюс этамбутол 15–25 мг/кг 1 раз/день. Иногда также назначают рифабутин 300 мг 1 раз/день. После успешного лечения необходимо длительное применение кларитромицина или азитромицина с этамбутолом, чтобы предотвратить рецидив.
ВИЧ-инфицированные пациенты, которые не были диагностированы до представления диссеминированного МАК, должны перед началом антиретровирусной терапии получать в течение 2 недель антимикобактериальную терапию для уменьшения риска развития воспалительного синдрома восстановления иммунитета Воспалительный синдром восстановления иммунной системы (ВСВИС) Инфекция вирусом иммунодефицита человека (ВИЧ) вызывается одним из 2 похожих ретровирусов (ВИЧ-1 и ВИЧ-2), которые разрушают CD4+ лимфоциты и ослабляют клеточный иммунитет, увеличивая риск оппортунистических. Прочитайте дополнительные сведенияИнфицированные ВИЧ пациенты с показателями CD4 100 клеток/мкл нуждаются в профилактике диссеминированного МАК с применением азитромицина 1,2 г перорально 1 раз/неделю или кларитромицина 500 мг перорально два раза в день.
Дополнительная информация
The American Thoracic Society: An Official ATS/IDSA Statement: Diagnosis, Treatment, and Prevention of Nontuberculous Mycobacterial Diseases
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Микобактериозы у хорьков
Микобактериозы – это заболевания, вызываемые кислотоустойчивыми бактериями. Условно этих бактерий можно разделить на две группы. Микобактерии возбудители туберкулеза и атипичные микобактерии. К микобактериям возбудителям туберкулеза относятся Mycobacterium tuberculosis typ bovis, Mycobacterium tuberculosis typ avium , Mycobacterium tuberculosis typ humanus.
атипичным микобактериозомЗаражение: Mycobacterium tuberculosis как правило алиментарно: при поедании зараженного мяса и мясопродуктов больных животных, непастерилизованного молока, возможен воздушно-капельный путь распространения инфекции между животными.
Заражение от хорька человека не регистрировалось. Атипичные микобактерии распространены повсеместно, они обнаруживаются у различных животных, в почве, воде и продуктах, поэтому предотвратить заражение ими невозможно.
Клинические признаки, описываемые этими авторами, в общем, схожи и для туберкулеза и для атипичного микобактериоза. Клинические признаки часто неспецифичны., Заболевшие животные как правило истощены, отмечается летаргия, хроническая потеря веса вплоть до кахексии, анорексия, в двух случаях регистрировали отек конъюнктивы третьего века и ее гиперплазию , дегидратация, плохой и тусклый шерстный покров, может быть кашель и одышка, нижний парапарез, периферическая лимфоаденопатия. У одного хорька при рентгенографии грудной полости отмечались множественные дессименированные нодулярные и бронхиальные уплотнения.
Паталогоанатомические изменения характеризовались гранулематозными очагами в легких, увеличенными мезентериальными лимфоузлами, с творожистыми гноевидными фокусами, гранулемы обнаруживаются также на стенке кишечника и желудка. Подчелюстные и околоушные лимфоузлы увеличены, некоторые вскрываются и из них вытекает гноевидная тягучая масса. У норок обнаруживают такие же изменения, кроме того, отмечается сплено- и гепатомегалия, увеличение портальных лимфоузлов, под капсулой почек обнаруживают узелки серо-желтого цвета величиной с пшеничное зерно или более, иногда поражается матка, в полости тела матки и рогов обнаруживают очаги округлой формы с гноевидным содержимым. Подчелюстные и околоушные лимфоузлы увеличены. В лимфатических узлах наблюдаются обширные фокусы казеозного некроза, капсулы лимфоузлов разрушаются и прорастают соединительной тканью. У норок при гистологическом исследовании туберкулезных гранулем имеются некоторые особенности. Преобладают эпителиоидные клетки, отсутствуют гигантские клетки Пирогова-Лангганса, крайне редко встречаются очаги обызвествления.
атипичного микобактериоза Попытка лечения атипичного микобактериоза такими препаратами как рифампицин, клофазимин, кларитромицин так или иначе приводила в лучшем случае к временному улучшению, а после отмены к ухудшению состояния или смерти животного.
Как известно заболеваемость атипичным микобактериозом у человека вызвана иммунодефицитом, и обычно сопровождает СПИД. Однако у заболевших атипичным микобактериозом хорьков не было найдено заболеваний, так или иначе ослабляющих иммунитет. Ряд авторов на этом основании выдвигает предположение о возможном существовании вируса иммунодефицита у хорьков, однако такой вирус на данный момент не выделен.
Клинический случай: на прием в нашу клинику в августе 2010 г поступил хорек.
Возраст 4.5 года, самец. Вес 1600 г.
Жалобы: хроническая потеря веса, анорексия, слабость задних конечностей.
Анамнез: куплен в зоомагазине, содержался в московской квартире, контактов с другими животными не было с момента приобретения, уход хороший, кормление сухим кормом д/кошек премиум класса. Вакцинирован ежегодно.
При осмотре: истощен, сознание ясное, оживленно реагирует на происходящее, нижний парапарез, снижена проприоцептивная чувствительность, поверхностная и болевая чувствительность сохранена, повреждения ЧМН нет. Паравертебральной болезненности нет. Тургор кожи снижен, шерстный покров тусклый, алопеций нет, зуда нет.. Температура 38.9, Дыхание 40, ЧСС 220, Слизистые розовые, СНК 3 сек, в ротовой полости на десне нижней челюсти обнаруживается новообразование в виде гранулемы с гнойно-некротическим отделяемым. Серозный ринит. Подчелюстные и подколенные лимфоузлы значительно увеличены, размером с грецкий орех. В легких хрипов нет, дыхание жесткое, проводиться во все отделы легких. Живот мягкий , безболезненный, в остальном без особенностей.
ОКА: RBC -7.64, HGB-105, HTC-30.1, MCV-39.4, MCH-13.7, MCHC-348.8, RDW-15,9
WBC-5.6, П-2, С-65, Э-0, М-2, Л-31, тромбоциты-.252.
Биохимия: Са – 3.2ммол/л, Р- 3.67 ммол/л. Мочевина – 38.3 ммол/л, креатинин -68 ммол/л, глюкоза – 5.7 мкмол/л, КФК-115 Ед/л, AST-148 Ед/л; ALT-557, общий белок 92г/л; альбумин – 41г/л; глобулин- 51 г/л;
Тест « Avecon» ELISA на алеутскую болезнь (видоспецифичный для хорьков) отрицательный.
УЗИ брюшной и грудной полости: патологии не выявлено, органы брюшной полости без особенностей.
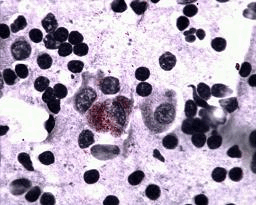
Тонкоигольная биопсия лимфоузлов: не выявила лимфобластного процесса, характерного для лимфомы. Цитологическая картина характеризовалась гранулематозным лимфаденитом с наличием в препарате палочковидных плохопрокрашиваемых бактерий.
При окрашивании по Циль Нильсену в пунктате лимфоузлов были обнаружены кислотоустойчивые бактерии. Таким образом мы смогли подтвердить наличие у животного микобактериоза. Однако какой вид микобактерий вызвал заболевание, мы не знали.
Далее в Центральную Московскую ГОСВЕТЛАБОРАТОРИЮ были отправлены пунктаты из лимфоузлов, смывы из глотки и кал. Методом ПЦР материал был протестирован на Mycobacterium tuberculosis typ bovis, Mycobacterium tuberculosis typ avium , Mycobacterium tuberculosis typ humanus. Результат исследования: отрицательный. В связи с чем у нашего пациента подтверждался атипичный микобактериоз. Однако мы не смогли найти заболевание вызвавшее иммунодефицит у нашего пациента. Курс стрептомицина не привел к улучшению состояния и уменьшению лимфоузлов. Проанализировав данные литературы, а также данные за 2009г Московского тубдиспансера о распространении и антибиотикочувствительности атипичных микобактерий в г. Москве, нами было принято решение о назначении ципрофлоксацина.
Животное было отправлено на лечение в домашних условиях с рекомендацией провести рентгенографию грудной полости и проводить лечение ципрофлоксацином перорально. В течении месяца со слов владельца отмечалось значительное улучшение общего состояния. Прибавка в весе 150г, исчез парапарез, появился аппетит, лимфоузлы уменьшились до нормы. Однако, ровно через месяц животное было найдено мертвым. Патологоанатомическое вскрытие не проводилось.
Хорьки восприимчивы ко всем возбудителям туберкулеза
Атипичный микобактериоз у хорьков встречается в России.
Следует вводить это заболевание в дифференциальную диагностику при вышеописанных клинических признаках.
Заболевание видимо летально, но возможно получение некоторой ремиссии на фоне приема антибиотиков. В нашем исследовании это ципрофлоксацин.
Атипичный микобактериоз у человека возникает при иммунодефиците. Причин иммунодефицита у хорьков обнаружено не было.
Главный ветеринарный врач клиники «ЮНИОР» СТРОГИНО Зинкина Т.С., Поплавская А.С. ветеринарная клиника «Добрый мир» г. Москва. Сысоев А., лаборатория "Глобал Вет". Микобактериозы – это заболевания, вызываемые кислотоустойчивыми бактериями. Условно этих бактерий можно разделить на две группы. Микобактерии возбудители туберкулеза и атипичные микобактерии. К микобактериям возбудителям туберкулеза относятся Mycobacterium tuberculosis typ bovis, Mycobacterium tuberculosis typ avium , Mycobacterium tuberculosis typ humanus.
Читайте также:
