Изменения ЭКГ. Нарушения распространения возбуждения.
Добавил пользователь Morpheus Обновлено: 30.01.2026
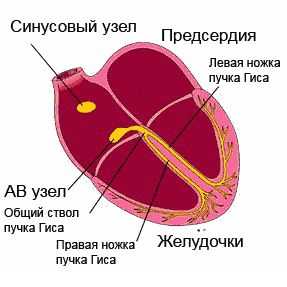
Проводимость сердечной мышцы – это понятие, отражающее проведение возбуждения по участкам проводящей системы, которая представлена синоатриальным узлом в правом предсердии, проводящими волокнами в стенке предсердий, атриовентрикулярным узлом между предсердиями и желудочками, и двумя ножками пучка Гиса в толще желудочков, заканчивающимися волокнами Пуркинье. Электрический сигнал возникает в клетках синоатриального узла и проходит по этим структурам последовательно, приводя к возбуждению сначала предсердий, а затем и желудочков. Это способствует эффективному изгнанию крови из сердца в аорту.
работа проводящей системы сердца, обозначены её ключевые компоненты
В норме сердечный ритм осуществляется с частотой 60 – 80 сокращений в минуту. Задержка проведения импульса, способная возникнуть в любом участке сердечной мышцы, приводит к тому, что ритм «сбивается» с нормальной частоты и развивается полная или частичная блокада сердца. Причины этого могут быть как довольно безобидными, так и обусловленными серьезными заболеваниями сердца.
Следует различать понятия «замедление» и «нарушение» проводимости. К примеру, если пациент увидел в заключении ЭКГ такую фразу, как «замедлена атриовентрикулярная проводимость», то это означает, что у него встречаются эпизоды атриовентрикулярной блокады 1 степени.
Замедление проводимости говорит о наличии у пациента блокады 1 степени, в принципе, не опасной на данный момент, но с большой вероятностью прогрессирующей до блокады 2 и 3 степени, что уже может представлять угрозу для здоровья и даже для жизни.
Если же в протоколе ЭКГ речь идет о нарушении проводимости, то это значит, что у пациента имеется соответствующая блокада 2 или 3 степени.
Нарушение проводимости сердца может быть полным, когда импульс не проводится совсем через тот или иной участок сердца, или частичным (неполным), когда импульс проводится, но с задержкой. Полные блокады гораздо опаснее, чем неполные.
Нарушение синоатриальной проводимости
По-другому это называется синоатриальной блокадой. Электрический импульс, зародившийся в синусовом узле, не может полноценно достичь предсердий, и их возбуждение происходит с задержкой. Часто встречается у здоровых людей и не требует активного лечения, но может встречаться и при органических заболеваниях сердечной ткани.
- Нейроциркуляторная дистония с преобладающим влиянием на синусовый узел блуждающего нерва, способного замедлять сердцебиение,
- Увеличенное (гипертрофированное) сердце у спортсменов,
- Передозировка сердечными гликозидами (строфантин, коргликон, дигоксин), применяемых в терапии других видов аритмий,
- Различные пороки сердца,
- Ишемия миокарда.
- При частичном нарушении проводимости симптомы возникают редко,
- При полном нарушении проводимости возникают чувство перебоев в сердце, неприятные ощущения в грудной клетке, головокружение, обусловленное ухудшением кровоснабжения головного мозга из-за редких сердечных сокращений,
- Пульс становится редким – менее 50 в минуту.
ЭКГ при синоатриальной блокаде – выпадение сокращения предсердий и желудочков (комплекс PQRS)
Замедление внутрипредсердной проводимости
Внутрипредсердная блокада непосредственной угрозы для жизни не несет, однако, ее наличие у пациента может свидетельствовать о том, что у него велик риск возникновения мерцательной аритмии, способной привести к опасным осложнениям.
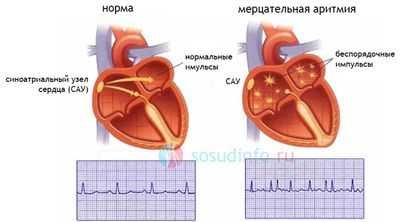
мерцательная аритмия – опасное осложнение внутрипредсердной проводимости
- Гликозидная интоксикация,
- Ревматическая лихорадка,
- Пороки сердца,
- Гипертоническая болезнь.
- Как правило, замедление внутрипредсердной проводимости специфических симптомов не имеет и проявляется только на ЭКГ,
- Характерны симптомы причинного заболевания – одышка при ходьбе или в покое, отеки нижних конечностей, синюшнее окрашивание кожи, боли в грудной клетке и др.
Нарушение проводимости по атриовентрикулярному узлу
АВ-блокада 1 и 2 степени означает, что проведение возбуждения к желудочкам от предсердий осуществляется с задержкой, но импульсы все же достигают желудочков. Полная блокада 3 степени свидетельствует о том, что ни один импульс к желудочкам не проходит, и они сокращаются отдельно от предсердий. Это опасное состояние, так как 17% всех случаев внезапной сердечной смерти обусловлены блокадой 3 степени.
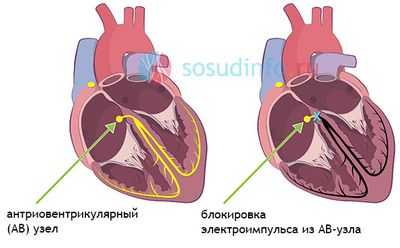
- Как правило, атриовентрикулярная блокада развивается при пороках, ишемической болезни сердца, в остром периоде инфаркта миокарда, при миокардите (воспалительном поражении миокарда), кардиосклерозе (замещение нормальной сердечной мышцы рубцовой тканью вследствие инфаркта миокарда, миокардита),
- Причиной такой блокады может служить токсическое действие на сердце некоторых гормонов при их избытке – тиреоидит, гипертиреоз, феохромоцитома (опухоль надпочечников),
- При отсутствии терапии причинного заболевания наблюдается прогрессирование блокады.
- Блокада 1 и 2 степени может не выражаться симптомами, если имеется незначительное урежение пульса (50 – 55 в минуту),
- При блокаде 3 степени, а также, если наблюдается значительная брадикардия (менее 40 в минуту) развиваются приступы Морганьи – Эдемса – Стокса (приступы МЭС) – внезапная слабость, холодный пот, предобморочное состояние и потеря сознания на несколько секунд. Возможны судороги вследствие обеднения кровотока в сосудах головного мозга. Приступ требует оказания неотложной помощи, так как может вызвать полную остановку сердца и летальный исход.
На ЭКГ изображено выпадение желудочковых комплексов при нормальной частоте сокращений предсердий (количество зубцов Р больше, чем комплексов QRS)
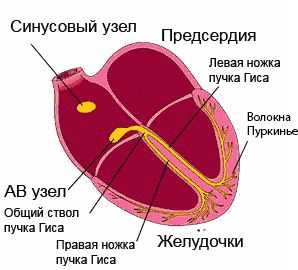
Нарушение внутрижелудочковой проводимости
К этому типу относятся полные или неполные блокады ножек пучка Гиса. Если имеется нарушение желудочковой проводимости по правой ножке пучка Гиса, то страдает сокращение правого желудочка, если по левой, то, соответственно, левого.
- Неполная блокада правой ножки может иметь место у здоровых людей,
- У детей к локальному нарушению внутрижелудочковой проводимости может привести открытое овальное окно в сердце,
- Полная блокада любой из ножек свидетельствует о заболеваниях сердца, например, о гипертрофии (разрастании и утолщении) миокарда при пороках клапанов, ишемической болезни сердца, остром инфаркте миокарда, гипертрофии миокарда при бронхолегочных болезнях (обструктивный бронхит, бронхиальная астма, бронхоэктазы), миокардите, постинфарктном кардиосклерозе, кардиомиопатии.
виды внутрижелудочковых блокад – нарушения проводимости по ножкам пучка Гиса
- Частичное нарушение проводимости может никак не проявлять себя клинически,
- Полная блокада характеризуется такими признаками, как редкий пульс, боли в груди, потеря сознания,
- Если у пациента внезапно возникли интенсивные давящие боли за грудиной, резкая слабость, холодный пот, чувство дурноты, редкий пульс, а на ЭКГ выявленна полная левая блокада, скорее всего, развивается острый инфаркт миокарда, «замаскированный» на ЭКГ за блокадой. Именно в связи с невозможностью определить инфаркт на однократной ЭКГ при таких жалобах требуется срочная госпитализация в стационар.
Неспецифическое нарушение внутрижелудочковой проводимости – это блокирование импульса в самых отдаленных участках сердечной мышцы – в волокнах Пуркинье. Причинами служат те же заболевания, что и при блокадах пучка Гиса, признаки на ЭКГ минимальные, а клинических симптомов не возникает.
На ЭКГ – деформированные желудочковые комплексы
Итак, в большинстве случаев диагноз “нарушение внутрижелудочковой проводимости” у относительно здоровых людей является вариантом нормы и обусловлен неполной блокадой правой ножки пучка Гиса.
Синдром Вольфа – Паркинсона – Уайта (ВПВ – синдром)
Проведение возбуждения по сердцу может быть не только замедлено, но и ускорено. Это происходит из-за функционирования дополнительных путей проведения импульса, при данной патологии пучков Кента через атриовентрикулярное соединение. В результате возбуждение передается к желудочкам гораздо быстрее, чем в норме, обуславливая более частое их сокращение, и более того, импульсы двигаются в обратном направлении к предсердиям, провоцируя наджелудочковые тахикардии.
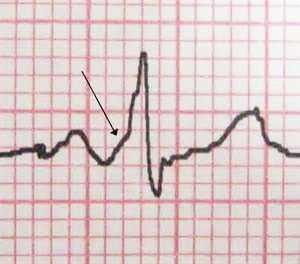
На ЭКГ стрелкой указан характерный признак ВПВ-синдрома – «дельта»-волна в начале желудочкового комплекса
Причины
ВПВ – синдром является врожденным заболеванием, так как в норме дополнительные пути у плода закрываются после 20 недели беременности. В случае ВПВ – синдрома они остаются функционирующими. Повлиять на возникновение этой патологии могут генетическая предрасположенность, негативные факторы, действующие на плод (радиация, употребление наркотиков, алкоголя, токсических лекарственных препаратов беременной женщиной).
Симптомы
Синдром может проявиться как в детском, так и во взрослом возрасте, а может не проявиться вообще, и тогда его диагностируют только по ЭКГ. Характерны признаки синусовой тахикардии или мерцательной аритмии – учащение пульса более 200 в минуту, боль в груди, одышка, чувство нехватки воздуха. В очень редких случаях возможно развитие жизнеугрожающей аритмии – фибрилляции желудочков.
Синдром укороченного интервала PQ
Является своеобразной формой ВПВ – синдрома, только в качестве аномальных путей проведения здесь выступают пучки Джеймса между предсердиями и нижней частью атриовентрикулярного узла. Также является врожденной особенностью. Если диагностируется только по ЭКГ, не сопровождаясь симптомами, то говорят о феномене укороченного PQ, а если сопровождается признаками тахикардии, то о синдроме укороченного PQ. Различия между синдромами ВПВ и PQ в признаках на ЭКГ.
К какому врачу обращаться для диагностики нарушений проводимости?
Если пациент обнаружил подобные симптомы, ему нужно обратиться к кардиологу, а лучше к аритмологу для дальнейшего обследования и решения вопроса о необходимости лечения.
Врач назначит дополнительные методы исследования:
- Мониторирование ЭКГ по Холтеру для более точной диагностики нарушений проводимости в разное время суток,
- Пробы ЭКГ с нагрузкой – тредмил – тест, велоэргометрия. Ходьба по беговой дорожке или вращение педалей на устойчивом велосипеде с наложенными электродами ЭКГ помогут точнее выявить связь нарушений проводимости с нагрузкой,
- УЗИ сердца (эхокардиография) визуализирует анатомические структуры сердца, выявляет заболевания сердца, а также позволяет оценить функции сократимости миокарда.
Важно! Если Вы заметили у себя симптомы нарушений проводимости, или они были выявлены на ЭКГ, следует как можно раньше получить консультацию врача для того, чтобы исключить опасные заболевания сердца, требующие активного лечения.
Немедленно вызывать скорую помощь нужно, если наблюдаются такие признаки:
- Редкий пульс менее 45 – 50 в минуту или частый пульс более 120 в минуту,
- Потеря сознания, предобморочное состояние,
- Боли в сердце,
- Холодный пот, слабость,
- Выраженная одышка.
Лечение нарушений проводимости
Лечение проводится под контролем участкового врача в поликлинике или в отделении кардиологии (аритмологии). Терапия должна начинаться с устранения причины, спровоцировавшей нарушение проводимости. Если сердечных заболеваний не выявлено, назначаются витамины и препараты, улучшающие питание сердечной мышцы, например, предуктал, АТФ и др.
При полном нарушении проводимости, которое вызывает выраженную брадикардию, решается вопрос об установке искусственного кардиостимулятора.
При синдроме ВПВ и укороченного PQ с выраженными симптомами тахиаритмий возможно проведение радиочастотной абляции (РЧА). Это разрушение дополнительных пучков проведения путем внедрения аппаратуры через артерии в полость сердца.
Осложнения и прогноз
При частично нарушенной проводимости по сердцу прогноз благоприятный. Если развивается полная блокада какого – либо участка сердечной мышцы, прогноз неблагоприятный, так как это может привести к осложнениям – остановке сердца и внезапной смерти, к фибрилляции желудочков и к тромбоэмболическим осложнениям, таким как тромбоэмболия легочной артерии и ишемический инсульт.
Изменения ЭКГ. Нарушения распространения возбуждения.
Аномальное предсердное возбуждение и проведение. Отклонения от нормы левого предсердия
Различные патологические и патофизиологические явления изменяют нормальную последовательность возбуждения предсердий и создают на ЭКГ картину аномального зубца Р. Здесь описаны 3 основные категории изменений зубца Р, отражающие очаги возбуждения в аномальных ЛП и ПП.
Смещение участка начальной активации в границах или за границы СА-узла в другие эктопические участки может существенно изменить картину предсердного возбуждения и, как следствие, морфологию зубцов Р. Эта нарушения можно встретить либо в виде замещающих ритмов, если пейсмекер СА-узла истощен, или как ускоренные эктопические ритмы, если автоматизм эктопического очага повышен. Обобщенные нарушения на ЭКГ чаще включают отрицательные зубцы Р в отведениях, в которых в норме они направлены вверх (отведения I, II, aVF и V4-V6), с укорочением интервала PR или без его укорочения.
На основе простых векторных принципов по виду зубца Р можно предположить местонахождение импульсообразующей зоны. Например, отрицательные зубцы Р в отведении 1 указывают на то, что очаг возбуждения находится в ЛП. Инвертированные зубцы Р в нижних отведениях обычно соответствуют заднепредсердному очагу. Однако корреляции с локализацией очага имеют высокую вариабельность, поэтому описанным изменениям можно дать групповое название «эктопические предсердные ритмы».
Задержки проведения в пределах предсердий изменяют и длительность, и вид зубцов Р. Когда проведение из ПП в ЛП по пучку Bachmann задерживается, длительность зубца Р удлиняется > 120 мсек, а у зубцов Р в отведении II появляются две округлые вершины (P-mitrale). При увеличении степени блокирования синусовые импульсы достигают ЛП, пройдя вниз до АВ-соединения и только затем — вверх через ЛП. В этом случае зубцы Р становятся широкими и двухфазными в нижних отведениях с начальной положительной фазой, отражающей движение вниз в границах ПП, и с последующей отрицательной фазой, созданной движением вверх в границах ЛП.
Эти условия следует ассоциировать с предсердными аритмиями, включая фибрилляцию предсердий.
Отклонения от нормы левого предсердия
Анатомические или функциональные отклонения от нормы ЛП изменяют морфологию, длительность и амплитуду зубцов Р на клинической ЭКГ. Характерные изменения включают увеличение амплитуды и длительности зубца Р в отведениях от конечностей, а также увеличение амплитуды конечной отрицательной фазы зубца Р в отведении V1. Увеличение массы ЛП или размера его полости увеличивает амплитуду и длительность зубца Р. Поскольку ЛП обычно возбуждается с некоторым запозданием относительно начала зубца Р, повышенная электродвижущая сила проявляется увеличением длительности зубца Р И конечной фазы зубца Р в правых прекордиальных отведениях.
Сравнение различных нарушений на ЭКГ с эхокардиографическими критериями увеличения ЛП выявило низкую чувствительность, но высокую специфичность стандартных ЭКГ-критериев. Например, наличие классически широкого и раздвоенного зубца Р имеет чувствительность лишь 20%, по специфичность > 90% относительно установленного на ЭхоКГ увеличения ЛП. Другие исследования выявили более эффективную связь этих нарушений с желудочковой дисфункцией (со сниженной экскурсией стенки желудочка), чем с патологией предсердий.
Поскольку описанные показатели ЭКГ коррелируют с высоким давлением в ЛП, нарушениями внутрипредсердного проведения и желудочковой дисфункцией, а не только с увеличенным размером предсердия, их предпочтительнее именовать показателями изменений ЛП, а не показателями увеличения ЛП.
ЭКГ-признаки изменений ЛП связаны с более тяжелой ДЛЖ у больных с ишемической болезнью сердца и с более тяжелыми дефектами клапанного аппарата у больных с заболеваниями митрального или аортального клапана. Больные с изменениями в ЛП также имеют более высокую, чем здоровые люди, распространенность пароксизмальных предсердных тахиаритмий, включая ФП.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром преждевременного возбуждения желудочков.
Нарушения ритма сердца считаются важной кардиологической проблемой, поскольку нередко осложняют течение и ухудшают прогноз многих заболеваний и являются одной из самых частых причин внезапной смерти.
Особый интерес как клиницистов, так и электрофизиологов вызывает синдром преждевременного возбуждения желудочков (СПВЖ), который в одних случаях, при отсутствии клинических проявлений, может быть электрокардиографической находкой, а в других – сопровождаться опасными для жизни тахиаритмиями.
Несмотря на успехи, достигнутые в изучении СПВЖ, вопросы его диагностики, тактики ведения больных и лечения остаются актуальными и в настоящее время.
СПВЖ (синдром предвозбуждения, преэкситации, preexcitation syndrome) – это ускоренное проведение импульса возбуждения от предсердий к желудочкам по дополнительным аномальным проводящим путям. В результате часть миокарда или весь миокард желудочков начинают возбуждаться раньше, чем при обычном распространении возбуждения по атриовентрикулярному узлу, пучку Гиса и его ветвям.
Согласно рекомендациям группы экспертов ВОЗ (1980) преждевременное возбуждение желудочков, не сопровождающееся клинической симптоматикой, называют "феноменом предвозбуждения", а в случае, когда имеются не только электрокардиографические признаки предвозбуждения, но и развиваются пароксизмы тахиаритмии, – "синдромом предвозбуждения".
Анатомическим субстратом СПВЖ служат пучки специализированных мышечных волокон вне проводящей системы сердца, способные проводить электрические импульсы к разным участкам миокарда, вызывая их преждевременное возбуждение и сокращение.
Дополнительные предсердно-желудочковые соединения классифицируют по их расположению относительно фиброзных колец митрального или трикуспидального клапанов, типу проводимости (декрементный тип – нарастающее замедление проведения по дополнительному пути в ответ на увеличение частоты стимуляции – или недекрементный), а также по их способности на антеградное, ретроградное или сочетанное проведение. Обычно дополнительные проводящие пути имеют быстрое недекрементное проведение, аналогичное таковому в нормальной ткани проводящей системы Гиса–Пуркинье и миокарда предсердий и желудочков.
В настоящее время известно несколько видов аномальных проводящих путей (трактов):
- предсердно-желудочковый (Кента), соединяющий миокард предсердий и желудочков в обход атриовентрикулярного узла;
- атрионодальный (Джеймса), расположенный между синоатриальным узлом и нижней частью атриовентрикулярного узла;
- нодовентрикулярный (Махейма), связывающий атриовентрикулярный узел (или начало пучка Гиса) с правой стороной межжелудочковой перегородки или разветвлениями правой ножки пучка Гиса;
- атриофасцикулярный (Брешенмаше), соединяющий правое предсердие с общим стволом пучка Гиса.
Существуют также и другие дополнительные пути проведения, в том числе "скрытые", способные проводить электрический импульс ретроградно от желудочков к предсердиям. У небольшой (5–10 %) части больных имеется несколько аномальных путей проведения.
В клинической практике выделяют:
- синдром Вольфа–Паркинсона–Уайта (синдром WPW), обусловленный наличием пучков Кента;
- синдром Клерка–Леви–Кристеско (синдром CLC, синдром укороченного интервала Р-Q (R)), обусловленный наличием пучка Джеймса.
Электрокардиографические проявления СПВЖ зависят от степени преэкситации и постоянства проведения по дополнительным путям. В связи с этим выделяют следующие варианты синдрома:
- манифестный СПВЖ (на ЭКГ постоянно имеются признаки предвозбуждения);
- интермиттирующий (преходящий) СПВЖ (на ЭКГ признаки предвозбуждения имеют преходящий характер);
- латентный СПВЖ (ЭКГ в обычных условиях нормальная, признаки предвозбуждения появляются только в период пароксизма тахикардии или при провокации – физической нагрузке, электрофизиологическом исследовании (ЭФИ), вагусных или медикаментозных пробах);
- скрытый (на стандартной ЭКГ изменения не выявляются из-за проведения возбуждения по дополнительным путям только ретроградно).
По разным данным, распространенность СПВЖ в общей популяции составляет примерно 0,15 %. При этом пароксизмы тахиаритмий возникают у каждого второго пациента (в 80–85 % случаев – ортодромная тахикардия, 20–30 % – фибрилляция предсердий (ФП), 5–10 % – трепетание предсердий и антидромная тахикардия). Скрытый СПВЖ выявляют у 30–35 % больных.
СПВЖ – это врожденная аномалия, но клинически может проявиться в любом возрасте, спонтанно или после какого-либо заболевания. Обычно данный синдром манифестирует в молодом возрасте. В большинстве случаев иной патологии сердца у пациентов нет. Однако описываются сочетания СПВЖ с аномалией Эбштейна, кардиомиопатиями, пролапсом митрального клапана. Существует предположение о наличии взаимосвязи между СПВЖ и дисплазией соединительной ткани.
В семьях больных, страдающих этим синдромом, был выявлен аутосомно-доминантный тип наследования дополнительных проводящих путей у родственников I, II, III степени родства с различными клинико-электрокардиографическими проявлениями.
Частота случаев внезапной смерти у пациентов с СПВЖ составляет 0,15–0,6 % в год. Почти в половине случаев остановка сердца у лиц с СПВЖ – его первое проявление.
Исследования больных с СПВЖ, перенесших остановку сердца, ретроспективно определили ряд критериев, с помощью которых можно выявить лиц с повышенным риском внезапной смерти. К ним относят наличие следующих признаков:
- укороченного интервала R-R – менее 250 мс во время спонтанной или индуцированной ФП;
- симптоматической (гемодинамически значимой) тахикардии в анамнезе;
- множественных дополнительных путей;
- аномалии Эбштейна.
ЭКГ с укороченным интервалом P-Q и одновременно уширенным комплексом QRS впервые описали A. Cohn и F. Fraser в 1913 г. Единичные подобные случаи были описаны в последующем и некоторыми другими авторами, однако в течение многих лет причиной такой картины ЭКГ считалась блокада ветвей пучка Гиса.
В 1930 г. L. Wolff, J. Parkinson и P. White представили доклад, в котором электрокардиографические изменения такого типа рассматривали как причину пароксизмальных нарушений ритма сердца. Эта работа дала основание для проведения всесторонних исследований, направленных на выяснение патогенеза указанных изменений на ЭКГ, названных в последующем синдромом Вольфа–Паркинсона–Уайта.
Спустя два года M. Holzman и D. Scherf предположили, что в основе синдрома WPW лежит распространение импульса возбуждения по дополнительным предсердно-желудочковым путям. В 1942 г. F. Wood предоставил первое гистологическое подтверждение наличия мышечного соединения между правым предсердием и правым желудочком, выявленного при аутопсии больного 16 лет с эпизодами пароксизмальной тахикардии в анамнезе.
Несмотря на эти данные, активный поиск альтернативных механизмов развития синдрома продолжался до 1970-х, когда ЭФИ и хирургические методы лечения подтвердили теорию дополнительных проводящих путей.
Проведение импульсов от предсердий к желудочкам при СПВЖ происходит одновременно по нормальной проводящей системе сердца и по дополнительному пути. В проводящей системе на уровне атриовентрикулярного узла всегда наблюдается некоторое замедление проведения импульсов, не характерное для аномального тракта. В результате этого деполяризация определенного участка миокарда желудочков начинается преждевременно еще до распространения импульса по нормальной проводящей системе.
Степень предвозбуждения зависит от соотношения скоростей проведения в нормальной проводящей системе сердца, прежде всего в атриовентрикулярном узле, и в дополнительном пути проведения. Увеличение скорости проведения по дополнительному проводящему пути или замедление скорости проведения по атриовентрикулярному узлу приводят к повышению степени предвозбуждения желудочков. В некоторых случаях деполяризация желудочков может быть целиком обусловлена проведением импульсов по дополнительному пути. В то же время при ускорении проведения импульсов по атриовентрикулярному узлу или замедлении проведения по дополнительному пути степень аномальной деполяризации желудочков снижается.
Основное клиническое значение дополнительных путей проведения состоит в том, что они нередко включаются в петлю кругового движения волны возбуждения (re-entry) и способствуют таким образом возникновению наджелудочковых пароксизмальных тахиаритмий.
При СПВЖ чаще всего встречается ортодромная реципрокная наджелудочковая тахикардия, при которой импульс проводится антеградно по атриовентрикулярному узлу, а ретроградно – по дополнительному проводящему пути. Пароксизм ортодромной наджелудочковой тахикардии характеризуется частыми (140–250 в 1 мин), лишенными признаков преэкситации нормальными (узкими) комплексами QRS. В ряде случаев после комплекса QRS наблюдаются инвертированные зубцы Р, что указывает на ретроградную активацию предсердий.
При антидромной наджелудочковой тахикардии импульс циркулирует в противоположном направлении: антеградно – по аномальному проводящему пути, ретроградно – по атриовентрикулярному узлу. Пароксизм антидромной наджелудочковой тахикардии у больных с СПВЖ проявляется на ЭКГ частым регулярным ритмом (150–200 в 1 мин) с желудочковыми комплексами по типу максимально выраженной преэкситации (QRS і 0,11 с), после которых иногда выявляются инвертированные зубцы Р.
У 20–30 % пациентов с СПВЖ возникают пароксизмы ФП, при которых в результате антеградного проведения по дополнительному пути большого числа предсердных импульсов частота сокращений желудочков (ЧСЖ) может превышать 300 в 1 мин.
Во многих случаях СПВЖ протекает бессимптомно и выявляется только электрокардиографически. У 50–60 % больных имеются жалобы на приступы сердцебиений, одышку, боль или дискомфорт в груди, чувство страха и обмороки. Особую опасность при СПВЖ приобретают пароксизмы ФП, поскольку они сопровождаются большой ЧСЖ, гемодинамическими нарушениями и нередко могут трансформироваться в фибрилляцию желудочков. В таких случаях у больных не только наблюдают синкопальные состояния, но и имеется высокий риск внезапной смерти.
Независимыми факторами риска развития ФП у пациентов с СПВЖ являются возраст, мужской пол и наличие в анамнезе синкопальных состояний.
Основным методом диагностики СПВЖ является ЭКГ.
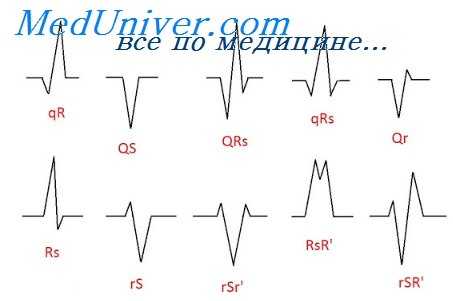
Электрокардиографическими признаками синдрома CLC являются укорочение интервала P-Q (R), продолжительность которого не превышает 0,11 с, отсутствие в составе комплекса QRS дополнительной волны возбуждения – D-волны, наличие неизмененных (узких) и недеформированных комплексов QRS (за исключением случаев сопутствующей блокады ножек или ветвей пучка Гиса).
При СПВЖ, обусловленном функционированием пучка Махейма, определяется нормальный интервал P-Q при наличии D-волны.
Одновременное функционирование пучков Джеймса и Махейма приводит к появлению на ЭКГ признаков, характерных для синдрома WPW (укорочение интервала P-Q (R) и наличие D-волны).
В связи с распространением в последние годы хирургических методов лечения больных с СПВЖ (деструкция аномального пучка) постоянно совершенствуются способы точного определения его локализации.
На ЭКГ местоположение пучка Кента обычно определяют по направлению начального моментного вектора деполяризации желудочков (первых 0,02–0,04 с), который соответствует времени формирования аномальной D-волны. В тех отведениях, активные электроды которых располагаются непосредственно над участком миокарда, возбуждающимся аномально за счет пучка Кента, регистрируется отрицательная D-волна. Это указывает на распространение раннего аномального возбуждения в сторону от активного электрода данного отведения.
Особый практический интерес представляют возможности метода пространственной вектор-электрокардиографии, позволяющего с высокой точностью установить локализацию дополнительных проводящих путей.
Более подробную, по сравнению с данными ЭКГ, информацию о местоположении дополнительных путей проведения можно получить с помощью магнитокардиографии.
Однако наиболее достоверными и точными являются методы внутрисердечного ЭФИ, в частности эндокардиальное (предоперационное) и эпикардиальное (интраоперационное) картирование. При этом с помощью сложной методики определяют область наиболее ранней активации (предвозбуждения) миокарда желудочков, которая соответствует локализации дополнительного аномального пучка.
У больных с бессимптомным течением СПВЖ лечения обычно не требуется. Исключение составляют лица, в семейном анамнезе которых были случаи внезапной смерти, спортсмены и те, чья работа связана с опасностью для самих себя и окружающих (например, водолазы и летчики).
При наличии пароксизмов наджелудочковой тахикардии лечение заключается в купировании приступов и их профилактике с помощью различных медикаментозных и немедикаментозных методов. При этом важное значение имеет характер аритмии (орто-, антидромная тахикардия, ФП), ее субъективная и объективная переносимость, ЧСЖ, а также наличие сопутствующих органических заболеваний сердца.
При ортодромной реципрокной наджелудочковой тахикардии импульс возбуждения проводится антеградно нормальным путем, поэтому ее лечение должно быть направлено на угнетение проводимости и блокаду импульсов в атриовентрикулярном узле. С этой целью используют рефлекторные вагусные пробы, которые наиболее эффективны при возможно более раннем применении.
Препаратом первого ряда для купирования ортодромной реципрокной наджелудочковой тахикардии считают аденозин, потенциальным недостатком которого является преходящее повышение возбудимости предсердий, способное провоцировать их экстрасистолию и фибрилляцию сразу же после купирования пароксизма такой тахикардии. Другим средством выбора для купирования ортодромной тахикардии при отсутствии выраженной артериальной гипотензии и тяжелой систолической сердечной недостаточности принято считать верапамил. В качестве препаратов второго ряда обычно используют b-адреноблокаторы.
При неэффективности этих средств применяют новокаинамид с целью блокады проведения через добавочный атриовентрикулярный путь. По своей безопасности и эффективности новокаинамид является препаратом выбора при лечении тахикардии с широкими комплексами QRS, когда диагноз ортодромной реципрокной наджелудочковой тахикардии вызывает сомнения.
Препаратами резерва являются амиодарон, соталол и антиаритмические препараты (ААП) 1С класса: пропафенон или флекаинид.
При антидромной реципрокной наджелудочковой тахикардии импульс проводится ретроградно через атриовентрикулярный узел, поэтому применение верапамила, дилтиазема, лидокаина и сердечных гликозидов для ее купирования противопоказано в связи со способностью данных препаратов ускорять антеградное проведение по добавочному пути и тем самым увеличивать ЧСЖ. Применение этих средств, а также аденозина может провоцировать переход антидромной наджелудочковой тахикардии в ФП. Препаратом выбора для купирования такой тахикардии является новокаинамид, при неэффективности которого используют амиодарон или ААП 1С класса.
При возникновении пароксизма ФП основной целью медикаментозной терапии является контроль частоты ритма желудочков и замедление проводимости одновременно по добавочному пути и АВ узлу. Препаратом выбора в таких случаях также является новокаинамид. Высокоэффективно и внутривенное введение амиодарона и ААП 1С класса.
Следует отметить, что применение верапамила, дигоксина и b-адреноблокаторов при ФП с целью контроля ЧСЖ у лиц с СПВЖ противопоказано из-за их способности увеличивать скорость проведения по добавочному пути. Это может перенести фибрилляцию с предсердий на желудочки.
Для профилактики пароксизмов наджелудочковых тахиаритмий, обусловленных наличием дополнительных проводящих путей, используют ААП IА, IС и III классов, обладающие свойством замедлять проведение по аномальным путям.
К немедикаментозным методам купирования приступов наджелудочковых тахиаритмий относят трансторакальную деполяризацию и предсердную (чреспищеводную или эндокардиальную) электрокардиостимуляцию, а для их профилактики – катетерную или хирургическую абляцию добавочных путей.
У больных с СПВЖ электрическую кардиоверсию применяют при всех формах тахикардии, которые сопровождаются выраженными нарушениями гемодинамики, а также при неэффективности медикаментозной терапии и в случаях, когда она вызывает ухудшение состояния больного.
Радиочастотная катетерная абляция добавочных путей является в настоящее время основным методом радикального лечения СПВЖ. Показаниями к ее выполнению являются высокий риск внезапной смерти (прежде всего наличие пароксизмов ФП), неэффективность или плохая переносимость медикаментозной терапии и профилактики приступов наджелудочковой тахикардии, а также нежелание больного принимать ААП. В случае выявления короткого эффективного рефрактерного периода аномального тракта у лиц с редкими и нетяжелыми пароксизмами аритмии, вопрос о целесообразности абляции в целях профилактики внезапной смерти решается индивидуально.
Перед катетерной абляцией выполняется ЭФИ, цель которого – подтверждение наличия дополнительного проводящего пути, определение его электрофизиологических характеристик и роли в формировании тахиаритмии.
Эффективность радиочастотной катетерной абляции высока (достигает 95 %), а летальность, связанная с процедурой, не превышает 0,2 %. Наиболее частыми серьезными осложнениями данного метода лечения являются полная атриовентрикулярная блокада и тампонада сердца. Рецидивы проведения по дополнительному пути возникают приблизительно в 5–8 % случаев. Повторная радиочастотная абляция, как правило, полностью устраняет проведение по дополнительным путям.
В настоящее время область применения хирургической деструкции добавочных путей значительно сузилась. При тех же показаниях, что и к катетерной абляции, к хирургическому лечению прибегают в случаях невозможности выполнения последней по техническим причинам или ее безуспешности, а также при необходимости проведения операции на открытом сердце в связи с сопутствующей патологией.
Н.Т. Ватутин, Н.В. Калинкина, Е.В. Ещенко.
Донецкий национальный медицинский университет им. М. Горького;
Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины.
Синдром ранней реполяризации желудочков.
Синдром ранней реполяризации желудочков (СРРЖ) – это идиопатический электрокардиографический (ЭКГ) феномен, характеризующийся наличием J-волны на нисходящей части комплекса QRS и псевдокоронарным подъемом сегмента ST выше изоэлектрической линии преимущественно в левых сердечных отведениях [23, 36, 51]. Ранее СРРЖ рассматривали только как ЭКГ-феномен без каких-либо клинических проявлений. В настоящее время, в связи с получением новых научных данных, эта позиция пересматривается [26].
СРРЖ впервые был описан R. Shipley и W. Halleran в 1936 г. и долгое время считался вариантом нормы [38]. Лишь в конце 70-х годов прошлого века этот синдром вновь привлек внимание исследователей. Предметом изучения стало его клиническое течение, механизмы возникновения, а также уточнение ЭКГ-признаков [3, 11].
СРРЖ выявляют при проведении ЭКГ у 1–9 % лиц в общей популяции [13, 26]. C увеличением возраста частота выявления СРРЖ снижается, вероятно, в связи с тем, что этот синдром может маскироваться приобретенными нарушениями реполяризации [36]. У мужчин, особенно ведущих сидячий образ жизни [17], спортсменов [46] и лиц с темной кожей его выявляют чаще [13, 26]. Так, среди африканцев распространенность этого синдрома составляет 9,1 %, а среди жителей Латинской Америки и Азии – соответственно 2,2 и 2,4 % [13]. У мужчин СРРЖ выявляют в 2–3 раза чаще, чем у женщин [31]. Более часто этот синдром наблюдают у пациентов с дисплазией соединительной ткани (ДСТ) [12], различными заболеваниями нервной системы, желудка и кишечника [36]. У пациентов с поражением сердечно-сосудистой системы СРРЖ выявляют значительно чаще, чем у больных с экстракардиальной патологией [11]. Настораживает тот факт, что этот синдром выявляют у 13–48 % лиц, поступающих в отделения интенсивной терапии с болью в грудной клетке [24, 45]. По данным исследования CASPER, у пациентов, которые выжили после необъяснимой остановки сердца при отсутствии органических кардиальных заболеваний, распространенность СРРЖ достигает 8 % [33]. У больных с синдромом укороченного интервала QT, ЭКГ-признаки ранней реполяризации встречаются в 65 % случаев, а их наличие считается фактором риска развития аритмических эпизодов [54].
Поскольку СРРЖ выявляют как у здоровых лиц, так и у людей с различными заболеваниями, на сегодняшний день нет однозначного мнения о его происхождении. Известно, что СРРЖ могут вызывать:
- Прием медикаментов, например, a2-адреномиметиков (клонидин). Передозировка этого препарата может провоцировать появление СРРЖ [6].
- Некоторые физические факторы. Так, описаны случаи возникновения преходящего СРРЖ после переохлаждения [27].
Особенно часто этот синдром регистрируют при некоторых заболеваниях и патологических состояниях:
А) Семейной гиперлипидемии. По данным Е.В. Мурашко [8], ЭКГ-изменения, характерные для СРРЖ, наблюдали у всех детей из семей, в которых отмечали случаи раннего (в возрасте до 50 лет) развития сердечно-сосудистой патологии. Это ассоциировалось с изменением липидного спектра сыворотки крови – повышением уровня атерогенных и снижением уровня антиатерогенных липидов.
Б) ДСТ. Ряд авторов рассматривают СРРЖ как кардиальный маркер такой дисплазии. По данным С.Н. Шуленина и соавторов [11], у обследуемых с СРРЖ достоверно чаще (57,1 %), чем у лиц без данного феномена (33,3 %), выявляют некоторые изолированные признаки недифференцированной ДСТ (долихоморфия, гипермобильность суставов, арахнодактилия, наличие дополнительных хорд и пролапса митрального клапана). По мере нарастания выраженности синдрома количество регистрируемых признаков ДСТ заметно увеличивается. Особенно часто СРРЖ регистрируют при наличии продольных добавочных хорд левого желудочка (ЛЖ). Наличие косых и поперечных добавочных хорд сопровождается СРРЖ в 35 и 12,5–22 % случаев соответственно [10]. У лиц с ДСТ без СРРЖ добавочные хорды обнаруживают значительно реже [19].
В) Гипертрофической кардиомиопатии.
J.P. Guillem, M. Haissaguerre и соавторы [28] еще в 1988 г. высказывали предположения о взаимосвязи СРРЖ с пограничными формами обструктивной гипертрофической кардиомиопатии (ГКМП) на основании схожих эхокардиографических признаков (состояние базальных отделов межжелудочковой перегородки, желудочковая гиперкинезия, характер движения передней створки митрального клапана, уменьшение площади выносящего тракта ЛЖ).
Кроме того, особенно часто СРРЖ регистрируют при врожденных и приобретенных пороках сердца, а также врожденных аномалиях строения проводящей системы сердца [5].
В последние годы высказываются предположения о генетической природе этого синдрома и наличии конкретных генов, отвечающих за его выраженность [18, 25].
Патогенез и патоморфология
По-видимому, в основе СРРЖ лежат врожденные индивидуальные особенности электрофизиологических процессов в миокарде, приводящие к ранней реполяризации его субэпикардиальных слоев, такие как:
1. Дополнительные пути проведения
Считается, что этот феномен является проявлением аномалии предсердно-желудочкового проведения с функционированием дополнительных антеградных атриовентрикулярных или паранодальных путей. Исследователи
полагают, что зазубрина на нисходящем колене комплекса QRS представляет собой отсроченную дельта-волну. В качестве доказательства наличия дополнительного пути проведения как причины СРРЖ приводятся данные об одновременном укорочении интервала P-Q у таких пациентов [44].
2. Неравномерность течения процессов де- и реполяризации желудочков
По данным электрофизиологических исследований установлено [12], что в основе СРРЖ лежит аномальная хронотопография де- и реполяризации отдельных, возможно добавочных, миокардиальных структур, расположенных в базальных отделах сердца, в ограниченной области верхушки и передней стенки ЛЖ.
В норме процесс реполяризации начинается на основании, а завершается в области верхушки сердца и происходит в направлении от эпикарда к эндокарду. В последнюю очередь деполяризуется заднебазальная область миокарда желудочков, расположенная вокруг межжелудочковой перегородки. При СРРЖ отмечают ускорение реполяризации субэпикардиальных слоев миокарда, механизм которого не достаточно изучен. Предполагают [32, 47, 48], что это происходит вследствие:
- чрезмерного перекрывания процессов де- и реполяризации из-за их замедления, но в разной степени, или преобладания одного из них;
- одновременного возбуждения части миокарда желудочков с различных направлений по так называемым путям желудочковой деполяризации.
Подъем сегмента ST в грудных отведениях при СРРЖ отражает передненаправленное смещение вектора сегмента ST как результат задержанной реполяризации в субэндокардиальной зоне либо преждевременной (ранней) реполяризации субэпикардиальной зоны. Эта точка зрения доминирует сейчас, полностью оправдывая термин "ранняя реполяризация желудочков" [34, 39].
В рамках этих двух механизмов объясняют и связь СРРЖ с наличием желудочковых хорд. Существует мнение [10], что при наличии продольно расположенных хорд импульс от верхней трети межжелудочковой перегородки быстро проводится к верхушке в зоне расширения передней ветви пучка Гиса, что создает условия для преждевременного возбуждения ЛЖ.
Однако некоторые авторы считают, что добавочные хорды не принимают непосредственное участие в формировании СРРЖ, а только генетически связаны с врожденной морфологической особенностью миокарда, которая обусловливает возникновение СРРЖ [12].
3. Дисфункция вегетативной нервной системы
Такая дисфункция также может вызывать СРРЖ. Имеются данные, что СРРЖ возникает при преобладании как парасимпатического, так и симпатического отдела вегетативной нервной системы [45].
В пользу вагусного генеза СРРЖ свидетельствуют [12] проба с физической нагрузкой, при которой признаки синдрома исчезают; медикаментозная проба с изопротеренолом, которая также способствует нормализации ЭКГ; усиление признаков СРРЖ во время сна, что выявляется при суточном мониторировании ЭКГ.
Ранняя реполяризация передневерхушечной области может быть связана и с повышенной активностью правого симпатического нерва, ветви которого предположительно проходят в межжелудочковой перегородке и передней стенке сердца: при стимуляции правого возвратного нерва или правого звездчатого ганглия у экспериментальных животных всегда возникает подъем сегмента ST, аналогичный подъему при СРРЖ [18].
4. Электролитные нарушения
Гиперкальциемическую теорию J-образной волны впервые предложил еще в 1920–1922 гг.
F. Kraus, обративший внимание на появление точки J на ЭКГ во время экспериментально вызванной гиперкальциемии. Наиболее важные отличия гиперкальциемической волны J от волны J при СРРЖ – наличие куполообразной конфигурации и укорочение интервала Q-Т.
В экспериментах показано [2, 11], что при гиперкалиемии снижается продолжительность локальной реполяризации на многих участках миокарда, а в области верхушки сердца и на уровне эндокарда укорочение времени реполяризации особенно значительно. При этом нормальный градиент времени реполяризации эндокард-эпикард был повышен у основания и снижен на верхушке сердца, то есть возникала ситуация, характерная для СРРЖ. При проведении калиевой пробы в 100 % случаев наблюдали усиление признаков СРРЖ.
Однако первичное изменение электролитного баланса в качестве причины возникновения СРРЖ в настоящее время считается сомнительным [36], так как отклонений от нормы содержания электролитов у лиц с "чистым" СРРЖ не выявлено. Вероятно, электролитными нарушениями можно объяснить лишь ЭКГ-динамику некоторых признаков синдрома, например изменение полярности зубца Т или длительности интервалов ЭКГ.
Как известно, реполяризация желудочков на ЭКГ включает в себя волну J, сегмент ST, а также волны Т и U, которые динамически изменяют свою морфологию в зависимости от различных патофизиологических состояний. Трансмуральный градиент напряжения в начальной фазе желудочковой реполяризации при СРРЖ манифестируется волной J. Этот градиент, по всей видимости, является следствием кратковременного выходящего калиевого тока (Ito), который медиирует появление этой зазубрины (волны соединения) на нисходящей части зубца R [56]. Элевация сегмента ST возникает, вероятно, вследствие аномального падения Ito в эпикардиальных слоях миокарда [47].
Общепринятой классификации СРРЖ нет. A. Скоробогатый (1985) [49] предложил классификацию СРРЖ на основании таких критериев, как наличие сопутствующей патологии сердечно-сосудистой системы, топография синдрома и его постоянство. Он выделил два основных варианта синдрома:
1) CРРЖ без поражения сердечно-сосудистой и других систем;
2) CРРЖ с поражением сердечно-сосудистой и других систем.
К особым вариантам автор отнес СРРЖ с альтернирующими признаками и СРРЖ в сочетании с нарушениями ритма и проводимости.
На основании локализации ЭКГ-признаков автор также выделил три типа СРРЖ:
1-й тип – с преобладанием признаков в отведениях V1-V2;
2-й тип – с преобладанием в отведениях V4-V6;
3-й тип (промежуточный) – без преобладания признаков в каких-либо отведениях.
Кроме того, по характеру течения СРРЖ были разделены на постоянные и преходящие (скрытые).
А.Л. Бобров и С.Н. Шуленин (2006) [1, 11] предложили классификацию СРРЖ по степени его выраженности, за основу брали общее количество отведений, в которых выявляются признаки СРРЖ. По этой классификации все лица с СРРЖ делятся на три класса. Выраженность синдрома определяется общим количеством отведений, в которых выявляют эти признаки.
I класс – с минимальными ЭКГ-проявлениями синдрома (изменения, характерные для СРРЖ, выявляют в 2–3 ЭКГ-отведениях);
II класс – с умеренными проявлениями (в 4–5 отведениях);
III – с максимальными проявлениями (в 6 и более отведениях).
Согласно классификации C. Antzelevich, G.X. Yan [15] выделяют три типа СРРЖ:
1-й тип – специфические ЭКГ-признаки синдрома выявляют преимущественно в боковых прекардиальных отведениях (этот вариант преобладает у атлетически развитых мужчин и отличается благоприятным течением);
2-й тип – изменения на ЭКГ определяются в нижних и нижне-боковых отведениях (он связан с более высоким сердечно-сосудистым риском);
3-й – типичные для СРРЖ ЭКГ-проявления регистрируют в нижних, боковых и правых прекардиальных отведениях (такой тип, по мнению авторов, ассоциируется с наиболее высоким риском развития злокачественных аритмий).
По определению СРРЖ является ЭКГ-феноменом, не имеющим определенной клинической картины. Он может быть выявлен случайно у здоровых лиц, а может являться симптомом некоторых заболеваний и патологических состояний [18, 44]. По данным некоторых исследований [23, 37, 47], при СРРЖ наблюдают такие же патогенетические механизмы и клинические проявления, как и при идиопатической фибрилляции желудочков и синдроме Бругада, поэтому некоторые авторы предлагают объединить их в один синдром "J wave" [35, 41].
Считается [7], что СРРЖ может провоцировать нарушения ритма. Так, стабильные нарушения ритма и проводимости у больных с сердечно-сосудистыми заболеваниями при наличии СРРЖ встречаются в 2–4 раза чаще и могут сочетаться с пароксизмами различных тахиаритмий. В структуре нарушений ритма преобладает фибрилляция предсердий и желудочков [26]. Причинами аритмогенности СРРЖ могут быть как врожденные аномалии строения проводящей системы сердца, так и повышенный тонус парасимпатического отдела вегетативной нервной системы, непосредственно влияющий на возникновение жизнеопасных аритмий.
В связи с этим необходимо остановиться на результатах недавно закончившегося многоцентрового исследования [26, 55], в котором анализировали связь СРРЖ с внезапной остановкой сердца.
В исследование, которое проходило в 22 аритмологических центрах Европы, Японии и Северной Америки, было включено 206 пациентов (123 мужчины, 83 женщины, средний возраст (35±13) лет), реанимированных после внезапной остановки сердца. В процессе обследования всем больным был поставлен диагноз идиопатическая фибрилляция желудочков и имплантирован кардиовертер-дефибриллятор (КВД) со специальным записывающим устройством, с помощью которого фиксировали рецидивы фибрилляции желудочков. Контрольную группу составили 412 здоровых лиц, сопоставимых по возрасту, соотношению полов, расовой принадлежности и физической активности. Исходно всем наблюдаемым выполняли ЭКГ на предмет наличия у них СРРЖ, который диагностировали по следующим признакам: подъем точки J (соединения QRS-ST) более 1 мм (0,1 мВ) в двух или более отведениях. Правые прекардиальные отведения (V1-V2) исключали из анализа во избежание включения в исследование больных с аритмогенной дисплазией правого желудочка или синдромом Бругада. Исключали из исследования и лиц с коротким ( < 340 мс) или длинным (>440 мс) интервалом QTс. Осмотр участников исследования и контроль функции КВД осуществляли каждые 6–12 мес.
Среди реанимированных больных с СРРЖ было больше мужчин, чем среди пациентов без СРРЖ (соответственно 72 и 54 %, Р=0,07), чаще регистрировали остановку сердца во время сна (19 по сравнению с 4 %, Р=0,03), обмороки (38 по сравнению с 25 %, Р=0,01).
В исследовании [50] в результате наблюдения в течение 30 лет были получены данные о том, что у пациентов с СРРЖ риск развития смерти от кардиальных причин увеличивается на 28 %, а у лиц с элевацией точки J на 0,2 мВ и более – почти в 3 раза. Риск развития опасных для жизни тахиаритмий и внезапной смерти существенно возрастает и при сочетании СРРЖ с синдромом Вольфа–Паркинсона–Уайта или синдромом укороченного интервала QT [44, 54].
Существует мнение [1], что СРРЖ может приводить к скрытой систолической и диастолической дисфункции сердца. Причем по мере увеличения ЭКГ-проявлений данного синдрома усиливаются и отклонения в параметрах центральной гемодинамики.
Дополнительные методы исследования
ЭКГ-признаки СРРЖ[7, 30, 41, 45, 46]:
- горизонтальный или косонисходящий подъем сегмента ST на 1–6 мм выпуклостью книзу;
- быстрое и резкое увеличение зубца R в грудных отведениях и одновременное исчезновение зубца S, что приводит к смещению переходной зоны (чаще вправо) или ее исчезновению;
- наличие точки соединения – отчетливой зазубрины (псевдозубец r) или волны соединения (волна J) на нисходящем колене зубца R;
- удлинение QRS до (90±10) мс (у здоровых лиц этот показатель составляет в среднем (80±10) мс);
- наличие в зоне повышения сегмента ST высоких положительных или отрицательных зубцов Т;
- поворот электрической оси сердца против часовой стрелки;
- высокие волны R и Т;
- так называемый "лабильный" или "ювенильный" рисунок волн Т;
- изолированный "Т-отрицательный синдром";
- часто имеет место укорочение интервала QTc в среднем до (392±22) мс по сравнению с (401±13) мс у здоровых лиц.
Наиболее информативными отведениями для выявления СРРЖ являются II, V2-5, A, D по Небу, а также стернальное отведение S [45].
По данным L.J. Vacanti [52], диагностическими критериями СРРЖ являются:
- элевация сегмента ST;
- вогнутость кверху;
- зазубрина на комплексе QRS;
- асимметричные волны Т большой амплитуды;
- наличие волн U.
Для диагностирования СРРЖ, по мнению автора, необходимо наличие двух и более положительных критериев.
СРРЖ дифференцируют с перикардитом, синдромом Бругада, аритмогенной дисплазией правого желудочка и инфарктом миокарда (острым коронарным синдромом с подъемом сегмента ST) [21, 24, 26, 29, 41, 42, 43]. В последнем случае, помимо клинической картины, большое значение имеет динамическое исследование ЭКГ и уровня маркеров повреждения миокарда (миоглобина, тропонинов). Иногда для уточнения диагноза необходимо проведение коронарографии.
Методы лечения СРРЖ не разработаны. Для предупреждения аритмий у таких пациентов иногда используют антиаритмические препараты [4, 11, 22] и соли магния [9].
В связи с недавно полученными данными [26, 53, 55] у пациентов с СРРЖ и синкопальными приступами в анамнезе следует рассмотреть вопрос об имплантации КВД.
Таким образом, СРРЖ представляет собой важную кардиологическую проблему. Вместе с тем, многие стороны ее требуют дальнейшего изучения и решения. В частности, актуальными остаются вопросы классификации, диагностики и лечения.
Читайте также:
- Внутрисуставная инъекция контраста под флюороскопическим контролем (артрография): показания, противопоказания, методика
- Отравление гвоздичным маслом (Syzygium aromaticum, Eugenia caryophyllus)
- Отравление микотоксинами - ядами грибов
- Показания для стереотаксической операции при менингиоме и ее эффективность
- Клиника и диагностика липоидоклеточных опухолей
