Калорический нистагм при шейном остеохондрозе
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Что обычно подразумевают под головокружением? С чем связано изолированное системное головокружение? Как лечить доброкачественное позиционное головокружение? Головокружение — одна из самых распространенных жалоб во врачебной практике.
Что обычно подразумевают под головокружением?
С чем связано изолированное системное головокружение?
Как лечить доброкачественное позиционное головокружение?
Головокружение — одна из самых распространенных жалоб во врачебной практике. Оно возникает при разнообразных заболеваниях нервной системы, внутреннего уха и др. Головокружением больные нередко называют ощущения дурноты, предобморочные состояния, неустойчивость, что еще больше затрудняет диагностику. Термином же «головокружение» обозначают иллюзию движения (обычно вращения). Такое головокружение, как правило, возникает вследствие патологии структур периферического вестибулярного аппарата.
Несмотря на множество причин, приводящих к головокружению, один из самых частых диагнозов у таких больных — это «вертебробазилярная недостаточность». Нередко встречаются больные с позиционным головокружением, у которых оно возникает при поворотах или наклонах головы. При обследовании у них, как правило, обнаруживают остеохондроз шейного отдела позвоночника, иногда — изгиб одной или обеих позвоночных артерий — при ультразвуковом дуплексном сканировании. Эти изменения считают достаточным основанием для заключения о недостаточности вертебробазилярного кровообращения. Между тем в настоящее время доказано, что изолированное системное головокружение, не сопровождающееся очаговыми неврологическими симптомами, в подавляющем большинстве случаев является результатом поражения периферического вестибулярного аппарата. В качестве примера приводим следующую историю болезни.
Больная М., 39 лет, обратилась с жалобами на головокружение, возникающее при запрокидывании головы и поворотах головы влево, ощущения сердцебиения. Заболела за месяц до обращения, когда впервые без видимых причин внезапно при запрокидывании головы появилось системное головокружение. Больная сразу обратилась к неврологу, который назначил обследование — рентгенографию шейного отдела позвоночника, ультразвуковую экстракраниальную и транскраниальную допплерографию. При рентгенографии были выявлены начальные проявления межпозвонкового хондроза, ункоартроз. При ультразвуковом дуплексном сканировании сосудов шеи обнаружено уменьшение линейной скорости кровотока в правой позвоночной артерии, что расценено как недостаточность кровотока. При транскраниальной допплерографии изменений выявлено не было. Пациентке была назначена медикаментозная (никошпан, глицин, феназепам) и мануальная терапия. На фоне лечения положительной динамики в состоянии больной отмечено не было, и на момент обращения головокружение сохранялось в той же степени, что и в начале заболевания. При обследовании: состояние удовлетворительное, артериальное давление 120/80 мм рт. ст., ЧСС - 86 в минуту. В неврологическом статусе менингеальных симптомов не выявлено, очаговой неврологической симптоматики нет. Отмечается легкий вертебральный синдром в шейном отделе позвоночника в виде напряжения паравертебральных мышц (чуть больше слева), небольшого ограничения поворотов головы влево. Следует отметить, что во время последнего посещения центра мануальной терапии пациентке была дана рекомендация значительно сократить движения головой, что она добросовестно и выполняла. Отоневрологическое обследование: при исследовании спонтанной активности движения глаз в очках Блессинга — спонтанный нистагм отсутствует, при выполнении пробы Hallpike и повороте головы влево возникал позиционный нистагм, ротаторный, направленный в сторону левого уха, сопровождающийся системным головокружением длительностью до 10 секунд. Спонтанный нистагм возникал после кратковременного латентного периода (2-3 секунд). Головокружение прекращалось самостоятельно с окончанием позиционного нистагма. При выполнении пробы с поворотом головы вправо позиционный нистагм и головокружение не возникали. Клинический анализ крови без изменений. В биохимическом анализе крови выявлена незначительная гипербилирубинемия. При холтеровском мониторировании ЭКГ выявлено преобладание тахикардии, без четкой связи между ощущениями больной и изменениями на ЭКГ.
На основании проведенного обследования был установлен диагноз «Отолитиаз заднего полукружного канала левого уха». После проведения реабилитационного маневра головокружение полностью прекратилось. Спустя четыре недели после проведения маневра больная была осмотрена повторно. Головокружение не беспокоит; в пробе Hallpike головокружения и позиционного нистагма не возникает.
Приведенное наблюдение иллюстрирует широко распространенное явление, когда минимальные изменения на рентгенограммах шейного отдела позвоночника и при ультразвуковом дуплексном сканировании магистральных артерий головы расцениваются как единственная причина головокружения, вследствие чего назначается неадекватная терапия.
Доброкачественное позиционное головокружение — одна из самых частых форм головокружения. Несмотря на это, оно часто не диагностируется. Впервые позиционное головокружение было описано Робертом Барани в 1921 году. В 1952 году Dix и Hallpike предположили, что это заболевание связано с поражением статолитовых органов, поскольку приступ головокружения вызывается поворотами головы, и разработали провокационную диагностическую пробу. Дальнейшие патоморфологические исследования показали, что на куполе полукружного канала у больных, страдавших доброкачественным позиционным головокружением, откладывается базофильное вещество. Предполагается, что в большинстве случаев отложение появляется из статоконий дегенерирующей статолитовой мембраны эллиптического мешочка, которые под действием гравитации при критическом положении головы вызывают движение купола полукружного канала, что и является причиной головокружения.
Обычно больные жалуются на головокружение в положении лежа, при поворотах в постели или при запрокидывании головы. По этой причине головокружение сильнее утром. Приступ обычно быстро проходит и редко продолжается больше минуты. Однако после приступа в течение нескольких часов или даже дней больные нередко отмечают несистемное головокружение, слабость или ощущение неустойчивости. Иногда сильное головокружение возникает ночью, во время сна, заставляя больного проснуться. Головокружение может сопровождаться тошнотой и рвотой.
Заболевание протекает доброкачественно: периоды обострения, когда приступы повторяются ежедневно, сменяются спонтанной ремиссией, которая может продолжаться несколько лет.
Этиология заболевания в большинстве случаев остается неизвестной. Предполагают, что доброкачественное позиционное головокружение может возникать после черепно-мозговой травмы или в результате вирусной инфекции. Связи между доброкачественным позиционным головокружением и вертебробазилярной недостаточностью нет. Женщины болеют примерно в два раза чаще мужчин. Заболевание может начаться в любом возрасте, чаще — в 50-60 лет.
Диагностика относительно проста и основывается прежде всего на характерных жалобах больного. Для подтверждения диагноза применяют позиционную пробу Hallpike.
Лечение доброкачественного позиционного головокружения заключается в проведении реабилитационного маневра. При этом осуществляются повторные движения в плоскости пораженного полукружного канала. В результате отолитовые отложения отрываются и попадают в преддверие лабиринта. Исчезновение этих отложений из канала приводит к прекращению головокружения. Медикаментозное лечение малоэффективно, поскольку имеющиеся препараты (например, меклозин) не устраняют острого приступа позиционного головокружения. В тяжелых случаях показано хирургическое лечение.
Таким образом, доброкачественное позиционное головокружение является одним из самых распространенных вариантов головокружения. Благоприятный прогноз и высокая эффективность лечения делают необходимой своевременную диагностику этого заболевания.
Литература
1. Головокружение / Под ред. М. Р. Дикса, Дж. Д. Худа. М., 1989.
2. Инсульт / Под ред. Варлоу. СПб., 1998.
3. Неврология / Под ред. Самуэльса. М.,1997.
4. Brooks J. G., Abidin M. R. Repositioning maneuver for benign peripheral paroxysmal positional vertigo (BPPV) // J. Am. Osteopath. Assoc. 1997; 97, № 5: 277-279.
5. Disorders of the vestibular system. Ed. by R. W. Baloh, G. M. Halmagyi. N.Y., 1986.
6. Lanska D. J., Remler B. Bening paroxysmal positioning vertigo: classic descriptions, origins of the provocative positioning technique, and conceptual development // Neurology.1997; 48, № 5: 1167-1177.
Калорический нистагм при шейном остеохондрозе
Калорический нистагм при шейном остеохондрозе
В целях получения однородных статистических групп по признаку ПГДР 174 больных шейным остеохондрозом мы разделили на группы: 1-ю группу составили 68 человек (ведущий признак — наличие спонтанного нистагма); 2-ю группу — 71 человек, у которых регистрировали ШПН; 3-ю группу — 35 человек без каких-либо ПГДР. Этим лицам проводили битермальную калорическую пробу; при наличии спонтанного нистагма, на который накладывался калорический, производили вычисление калорической составляющей по приведенным выше формулам.
При наличии спонтанного нистагма I степени суммация спонтанного и калорического нистагмов, как мы и предполагали, могла возникнуть только при таком положении глазных яблок (поворот взора в сторону быстрого компонента), при котором проявляется данный нистагм. Так как наша методика калорического исследования предусматривала регистрацию калорического нистагма при закрытых глазах (без движения глаз под повязкой в какую-либо сторону), то мы предположили, что при данной методике явление суммации спонтанного и калорического нистагмов станет очевидным на ЭНГ только у лиц со спонтанным нистагмом, проявляющимся при прямом направлении взора, т. е. при спонтанном нистагме II и III степени.
Поэтому для достижения максимально возможной статистической однородности результатов мы 1-ю группу обследуемых разделили на две подгруппы: в подгруппу 1 А (36 человек) были включены больные, у которых спонтанный нистагм под повязкой на ЭНГ не регистрировался, но возникал при волевом движении глаз в сторону быстрого компонента; подгруппу 1 Б (32 человека) составили больные, у которых под повязкой проявлялся спонтанный нистагм различной степени без дополнительных поворотов глаз.
Исследование калорического нистагма у больных 1-й группы. В общих чертах можно предположить, что взаимодействие спонтанного и калорического нистагмов происходит по принципу алгебраической суммации: нистагмы одного знака (направления) складываются, нистагмы разных знаков вычитаются с сохранением знака (направления) более выраженного из них.
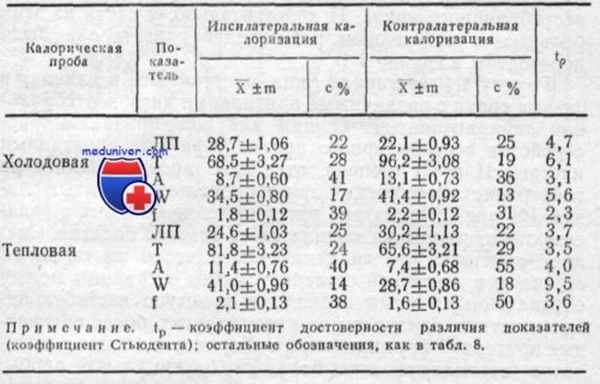
Показатели калорического нистагма у обследованных группы 1 А
Различия калорических нистагмов, а точнее, результирующих нистагмов, например при холодовой пробе, получаемых с каждого лабиринта в отдельности, позволяют предположить, что конечный глазодвигательный эффект возникает при интеграции двоякого рода афферентации — патологической, выражением которой является спонтанный нистагм, и экспериментальной (в виде калорического нистагма). В связи с этим возникает ряд вопросов: на каком уровне появляется патологическая афферентация?
Если на периферическом, то возможно ли адекватное реагирование пораженного лабиринта на калорический раздражитель? Если патологическая импульсация возникает на уровне стволовых структур, то существуют ли закономерности взаимодействия этой импульсации и экспериментально вызванной афферентации с лабиринта? Ответы на эти вопросы имеют не только теоретическое значение, поскольку они позволяют судить об уровне патологического очага, и, следовательно, правильно выбрать тактику терапевтического воздействия.
В таблице приведены показатели калорического нистагма для больных группы 1 А. В этой таблице мы вводим понятия «ипсилатеральная» и «контралатеральная калоризация» в соответствии с понятиями «ипсилатеральный» и «контралатеральный лабиринты»: первый — это лабиринт, в сторону которого направлен спонтанный нистагм, второй — противоположный лабиринт. Из данных таблицы видно, что с помощью битермальной калоризации у больных данной группы определяется асимметрия возбудимости вестибулярных аппаратов «по направлению», что делает вероятной зависимость спонтанного нистагма у этих больных не только от периферических, но и от центральных процессов.
Тот факт, что оба лабиринта реагируют на калорический раздражитель достаточно выраженным нистагмом, позволяет утверждать, что здесь мы не наблюдаем угнетения функции какого-либо одного из вестибулярных аппаратов, однако наличие достоверной асимметрии по всем показателям калорического нистагма указывает на то, что ипсилатсральная «половина» вестибулярной системы находится в состоянии латентного возбуждения. Это подтверждается преобладанием показателей калорического нистагма при коптралатеральной холодовой и ипсилатеральной тепловой калоризациях.
Международный неврологический журнал 1(17) 2008
Введение
Нарушения координации движений (атаксия) при болях шейной локализации связываются с шейным остеохондрозом, деформирующим артрозом шейных позвоночно-двигательных сегментов (ПДС). Причинами развития вертеброгенного головокружения считаются: 1) стимуляция симпатического позвоночного сплетения [17]; 2) нарушение кровообращения в вертебробазилярной системе [1, 2, 5, 11, 19]; 3) изменение состояния проприорецепторов в верхнешейном отделе позвоночника [14, 23]. Однако появление дискоординационного синдрома у лиц молодого возраста без признаков дегенеративной патологии позвоночника и поражения сосудистой системы, спонтанное его исчезновение способствовали критическому пересмотру сложившейся классической концепции. Имеется мнение, что вертеброгенное головокружение является результатом дисбаланса между вестибулярной, зрительной и цервикальной афферентацией, что проявляется при движении шеи и головы [12, 21, 22]. Это объясняется особенностями вестибулошейного взаимодействия, при котором вестибулярная система детектирует линейные и угловые ускорения головы в пространстве, а шейные проприорецепторы сигнализируют о позиции головы. Взаимодействие двух систем на уровне вестибулярных ядер обеспечивает стабилизацию позы и ориентацию в пространстве. Можно предположить, что патогенез нарушений координации движений в условиях отсутствия ветебральных, невральных, зрительных и вестибулярных расстройств может быть обусловлен наличием дополнительного фактора, способствующего формированию обсуждаемого синдрома.
С учетом изложенного нами оценена роль миофасциального болевого синдрома (МФБС) шейной локализации в происхождении и формировании клинической картины вертеброгенной цервикальной атаксии.
Материал и методика исследования
Материалы настоящего исследования получены в результате клинического и нейрофизиологического обследования 42 больных с миофасциальным болевым синдромом шеи (17 мужчин и 25 женщин) в возрасте от 18 до 35 лет. В обследование не включались больные с активным вертебральным синдромом, актуальной компрессионной корешковой, спинальной патологией и поражением позвоночных артерий. Приобретенная вестибулярная дисфункция также исключалась отоневрологическим обследованием. По классификации синдромов шейного остеохондроза (Я.Ю. Попелянский, 1997) обсуждаемый болевой синдром относится к мышечно-тоническим.
МФБС диагностировался согласно общепринятым методическим рекомендациям на основании клинических проявлений, данных тензоальгезиметрии и переменно-дискретной миотонометрии. Выраженность болезненности мышц оценивалась по 3 степеням [7].
Наряду с общеневрологическим и вертеброневрологическим обследованием нами оценивалась координация движений в пробе Бараньи, вызыванием калорического нистагма, а также стабилометрией.
При продолжительности нистагма больше 25 секунд с выраженной гармоничной или дисгармоничной девиацией рук, выраженным головокружением, вегетативной реакцией в виде побледнения, тахикардии, общей потливости возбудимость вестибулярного аппарата считалась повышенной. Наоборот, при уменьшении времени нистагма до 15 секунд без девиаций рук и остальных составляющих возбудимость вестибулярного аппарата оценивалась как пониженная. Возбудимость вестибулярного аппарата у больных исследуемой группы сравнивалась с показателями контрольной группы. В настоящем исследовании стабилограмма регистрировалась только в позе (тест) Ромберга.
Функциональное состояние центральной нервной системы исследовалось путем регистрации полисинаптического спино-бульбо-спинального (СБС), мигательного (МР) рефлексов [13, 15].
Всем больным проведена рентгенография шейного отдела позвоночника, а также транскраниальная УЗДГ.
Результаты исследования
Жалобы больных заключались в ощущениях несистемного головокружения, особенно во время смены положения лежа на вертикальное и наоборот, периодического пошатывания при ходьбе, общего дискомфорта. Ухудшение самочувствия сопровождалось нарастанием болезненности шеи, чувством тяжести в затылке. Пациенты отмечали «затвердение» мышц шеи и надплечья, уменьшение объема движений головы, в основном поворотов. Попытка преодоления ограничения движения шеи сопровождалась усилением названных жалоб. Характерна метеочувствительность. Стрессовые ситуации, как правило, ухудшали самочувствие. Часто наблюдается нарушение сна. Просмотры телепередач, езда в транспорте самочувствие больных не ухудшали. Обычно ощущение головокружения исчезало в положении лежа на спине. Улучшение самочувствия больными отмечалось при прогревании шеи (сауна), использовании анестезирующих мазей, применении нестероидных противовоспалительных препаратов. Вазоактивные средства, как правило, заметного клинического эффекта не оказывали [24].
Результаты оценки статической и динамической составляющих координации движений представлены в табл. 1.
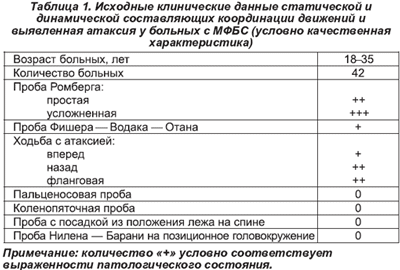
Как следует из табл. 1, атаксия у большей части больных отмечается в ситуациях, связанных с удержанием прямостояния и сменой положения. Истинное головокружение, переживаемое как вращение собственного тела и окружающих предметов, подавляющая часть пациентов не отмечала.
Качественная характеристика общей тенденции вызванного нистагма у обследованных нами больных с МФБС выявила следующие варианты возбудимости вестибулярного аппарата: нормальная — 34 больных, повышенная — 2 больных, пониженная — 6 больных.
Результаты стабилометрии у больных с МФБС выявили отчетливое нарастание фронтально-сагиттальных девиаций при проведении теста Ромберга с закрытыми глазами.
Анализ амплитудно-временных параметров мигательного рефлекса показал, что у 15 (39 %) больных с МФБС легкой степени электрическая стимуляция надглазничного нерва вызывала в круговых мышцах глаза рефлекторные разряды, аналогичные таковым в группе здоровых. Однако порог вызывания рефлекторного ответа был снижен и составлял в среднем 7,8 мА (Р < 0,05). Амплитуда R2 была отчетливо выше, а сами разряды синхронизированными.
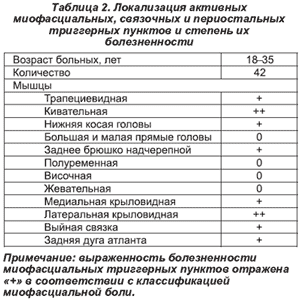
У 3 (8 %) больных с МФБС средней и 4 (12 %) — с МФБС тяжелой степени регистрировался гипорефлекторный вариант мигательного рефлекса с латентным периодом 42,0 ± 2,1 мс, длительностью R2-компонента в среднем 29,0 ± 1,7 мс. Необходимо подчеркнуть, что если в группе здоровых устойчивый R2-компонент появлялся при интенсивности стимуляции 8–12 мА, то у данных больных требовалась интенсивность стимуляции в 25–30 мА.
Таким образом, результаты проведенного исследования по изучению параметров мигательного рефлекса показали, что у больных с МФБС шейной локализации наблюдаются разнонаправленные изменения рефлекторной возбудимости ствола мозга. Это позволило выделить три клинико-нейрофизиологических варианта МФБС и разделить всех исследуемых нами больных на три группы — «низкая полисинаптическая рефлекторная возбудимость», «нормальная полисинаптическая рефлекторная возбудимость» и «высокая полисинаптическая рефлекторная возбудимость». В целом у больных с МФБС шеи с атактическим синдромом наблюдается растормаживание рефлекторной активности бульбарных отделов ретикулярной формации мозга.
Необходимо отметить, что изменения СБС-рефлекторной активности находились в тесной связи с изменениями мигательных рефлексов. Гиперрефлекторный ответ СБС соответствовал гиперрефлекторному мигательному рефлексу.
Увеличение латентности рефлекторного СБС-ответа с параллельным растормаживанием МР, возможно, объясняется перемещением активности нейронов, участвующих в реализации СБС-рефлекса, в вышележащие отделы ствола [8, 9]. Уменьшение латентности и длительности СБС-рефлекса позволяет предположить не только изменение анатомического уровня реализации ответа, но и уменьшение количества активных нейронов.
Результаты проведенного исследования показали, что дискоординация движений при шейном миофасциальном болевом синдроме имеет свои клинические особенности, не укладывающиеся в привычные клинические рамки атактических синдромов. Во-первых, отсутствие системного характера атаксии. При этом влияние зрительной коррекции на атаксию значимо, а экстрацептивный и интенционный компоненты атаксии несущественны. Возбудимость вестибулярного аппарата нормальная или несколько снижена. Статическая и динамическая составляющие атаксии в оформлении клинической картины являются равномерными (эквивалентными). Во-вторых, атактический синдром складывается в результате преобладания субъективных проявлений неустойчивости над объективными симптомами дискоординации движений. Значительную долю в структуре жалоб и клинических проявлений составляет синдром вегетативной дисфункции пароксизмального характера. В третьих, в определенной мере обсуждаемый синдром можно определить как сумму фрагментов сенсорной, вестибулярной, мозжечковой атаксии. Сенсорный (проприоцептивный) компонент атаксии является ведущим. В четвертых, МФБС шейной локализации сопровождается растормаживанием рефлекторной активности супраспинальных и спинальных механизмов рефлекторной регуляции с одновременным угнетением возбудимости вестибулярного анализатора.
Таким образом, вертеброгенная атаксия, формирующаяся при актуальном миофасциальном болевом синдроме шейной локализации, очевидно, является результатом дисбаланса и дефицита проприоцепции из зоны миогенного триггерного пункта и суставно-связочных структур. В этом контексте более адекватным считаем употребление термина «вертеброгенная цервикальная атаксия».
1. Афанасьева С.А., Горбачева Ф.Е. Изолированное системное головокружение // Неврологический журнал. — 2003. — Т. 8, № 4. — С. 36-40.
2. Болезни нервной системы / Под ред. Н.Н. Яхно, Д.Р. Штульман. — 2-е изд. — М.: Медицина, 2005. — С. 124-130.
3. Гайнутдинов А.Р. Клинико-нейрофизиологическая характеристика нейромоторного контура системы дыхания у больных хроническими обструктивными заболеваниями легких: Дис. д-ра мед. наук. — Казань, 1999.
4. Гокин А.П., Словачек М. Ретикулярные структуры и ретикулоспинальные пути, участвующие в инициации и торможении спино-бульбо-спинальной активности // Нейрофизиология. — 1976. — Т. 8, № 4. — С. 373-383.
5. Головокружение / Под ред. М.Р. Дикс, Дж.Д. Худ. — М.: Медицина, 1989. — С. 15-30.
6. Горбачева Ф.Е., Матвеева Л.А., Чучин М.Ю. О шейном головокружении // Русский медицинский журнал. — 2004. — Т. 12.
7. Иваничев Г.А. Болезненные мышечные уплотнения. — Казань, 1991. — 158 с.
8. Крыжановский Г.Н. Общая патология нервной системы. — М., 1997. — 350 с.
9. Лиманский Ю.П. Рефлексы ствола головного мозга. — К.: Наукова думка, 1987. — 240 с.
10. Никифоров А.С., Коновалов А.Н., Гусев Е.И. // Клиническая неврология. — 2002. — Т. 1. — С. 654-657.
11. Неврология / Под ред. М. Самуэльса: Пер. с англ. — М.: Практика, 1997. — С. 94-120.
12. Попелянский Я.Ю. Ортопедическая неврология (вертеброневрология). — Казань, 1997. — С.72-169.
13. Старосельцева Н.Г., Иваничев Г.А. Длинно-петлевые рефлексы в механизмах возникновения миогенных триггерных пунктов // Тез. докл. I Российского конгресса по патофизиологии. — М., 1996. — С. 168.
14. Федин А.И. Современные концепции вертеброгенного головокружения // Мат-лы науч. симпозиума. — М.: РГМУ, 2001.
15. Якупов Р.А. Клинико-электронейрофизиологическая характеристика и акупунктурная терапия синдрома хронической боли при заболеваниях периферической нервной системы: Дис… д-ра мед. наук. — Казань, 2001.
16. Ва1оh К.W., Ноnrubiа V., Jасоbsоn К. Benign positional vertigo // Neurology. — 1987. — 37. — 371.
17. Ваrrе J.А. Sur un syndrome Sympathique cervical posterseur et sa cfae frequente: l’arthrite cervicale // Revue de Neurologie. — 1926. — 45. — 1246-1253.
18. Ваrаnу К. Diagnose von Krankheitserscheinungen im Bereich des Otolithenapparates // Acta Otolaryng. — 1921. — 2. — 434-437.
19. Вrаndt Т., Dаroff R.В. The multisensory physiological and patological vertigo sindromes // Ann. Neurol. — 1980. — 7. — 195.
20. Вrаndt Т. Vertigo. Its Multisensory Sindromes. —2nd ed. — Springer, London, 2000. — P. 441-451.
21. Dix М.R, Наllрiке С.S. Тhе Раthologу, Sуmрtomatology аnd Diagnosis оf Сеrtain Соmmоn Disorders of the Vestibular System // Ann. of Otology. — 1952. — 61. — 987-1016.
22. Fisher F.Е. Vertigo in cerebrovascular desiase // Arch. of Otolaringology. — 1967. — 85. — 529-534.
23. Simons D.G. Muscle Pain Sindromes. Раrts 1 аnd II // Аm. J. Phvs Меd. — 1975. — 54. — 289-311; аnd 1976. — 55. — 15-42.
24. Zее D.S. Perspectives оn thе рhаrmасоtегару of vertigo // Arch. of Otolaringol. — 1985. — 111. — 609.
Остеохондроз и зрение
Остеохондроз – очень распространённое заболевание позвоночника, которое влечёт за собой множество осложнений. Вся гамма нарушений при остеохондрозе не смертельна, однако может существенно снизить качество жизни.
Среди многих жалоб, таких как боли в шее, нарушение подвижности, головокружения и боли в голове, нередко наблюдается и ухудшение зрения при шейном остеохондрозе.
Как нарушения зрения связаны с остеохондрозом?
В шейном отделе позвоночника проходят позвоночные артерии, питающие мозг. Вследствие дегенерации хрящевой ткани межпозвоночных дисков происходит сдавливание этих артерий и нервных волокон. То есть при нарушении мозгового кровообращения страдают различные отделы мозга, отвечающие за те или иные функции организма, а при раздражении нервных корешков снижается проводимость нервных импульсов, развивается болевой синдром.

Снижение зрения при остеохондрозе
При компрессии позвонков шейного отдела в первую очередь страдают структуры продолговатого мозга, отвечающие за дыхательный и сердечный центры. Но, как известно, в затылочной области также располагается и зрительный анализатор. Именно при гипоксии (недостатке кислорода) этого анализатора может происходить снижение зрения при шейном остеохондрозе.
Очень часто наблюдается синдром позвоночной артерии, который ведёт не только к головокружениям и слабости, но и к нарушениям зрения при шейном остеохондрозе. Больной жалуется на:
- мелькание «мушек»,
- периодические потемнения в глазах,
- появление цветных пятен,
- туман перед глазами,
- двоения и другие нарушения фокусирования,
- уменьшение поля зрения,
- снижение остроты зрения,
- чувство напряжённости, а иногда и боли в глазах.
Клинические проявления
Большинство людей не придают особого значения головокружениям и периодическим потемнениям в глазах. Тем не менее, такое, казалось бы, повседневное и банальное недомогание может скрывать серьёзные изменения в работе зрительного анализатора.
Сам пациент может заметить, а офтальмолог подтвердить, видимые изменения во внешнем виде и работе глаза:
- расширение зрачков и их вялая реакция на свет;
- небольшое выпучивание глазного яблока (экзофтальм);
- изменение формы глаза;
- ограничение движения глаз;
- внезапное горизонтальное подёргивание глазного яблока (нистагм);
- сужение поля зрения;
- двоение в глазах (диплопия);
- снижение остроты зрения.
При клинической диагностике часто обнаруживается повышение внутриглазного давления, дегенерация сетчатки вследствие сужения и склерозирования её артерий, отёк зрительного нерва.
Прогноз состояния зрения при шейном остеохондрозе

Лечение остеохондроза способно остановить ухудшение зрения
Конечно, стадии остеохондроза есть разные, и никто не может предсказать, с какой скоростью будет прогрессировать это заболевание у каждого отдельного пациента. Однако отсутствие лечения остеохондроза может привести к серьёзным нарушениям зрения и даже слепоте:
- вследствие спазма глазных мышц происходит нарушение фокусирующей способности глаза (аккомодации). То есть у больного не всегда получается сразу сфокусироваться на определённом предмете, а иногда мышцы хрусталика произвольно расслабляются, «размывая» всю окружающую картину. Без лечения этот процесс может усугубиться до атрофии мышц хрусталика, когда зрительный орган уже не в состоянии самостоятельно «наводить резкость»;
- существует угроза развития близорукости. Например, если человек всё время слишком близко наклоняется к объекту, с которым работает, формируется функциональная близорукость. Хрусталик привыкает к положению, при котором лучше всего видны ближние объекты. Со временем способность быстро стягиваться и растягиваться для фокусировки на ближних и дальних предметах теряется, и функциональная близорукость переходит в органическую;
- повышение внутриглазного давления очень часто влечёт за собой развитие глаукомы. А глаукома без лечения – это практически всегда полная потеря зрения.
Если Вы жалуетесь на нарушения зрения и осведомлены о своём остеохондрозе, на приёме у офтальмолога сообщите о своём диагнозе, так как негативное влияние шейного остеохондроза на зрение – доказанный факт. Таким образом, меньше времени будет потрачено на диагностику причин Вашего глазного недомогания, лечение начнётся раньше, и шансов на выздоровление будет больше.
Профилактика нарушений зрения при остеохондрозе
Больной, у которого диагностирован остеохондроз, всегда имеет риск зрительных нарушений. Обычно мероприятия, направленные на лечение остеохондроза, одновременно являются и профилактикой ухудшения зрения. Для улучшения мозгового кровоснабжения и регенерации хрящевой ткани назначаются:
- массаж воротниковой зоны;
- электрофорез;
- курс ЛФК;
- витаминотерапию (с акцентом на витамины группы В);
- в сложных случаях – медикаментозное лечение.
В случае уже проявившихся нарушений зрения при остеохондрозе в дополнение к лечению основного заболевания проводят и симптоматическое лечение зрительного анализатора.
Чтобы обезопасить себя от возникновения шейного остеохондроза:
- откажитесь от курения;
- наполните рацион витаминами;
- укрепляйте мышечный корсет;
- не держите голову в одном положении дольше получаса;
- разминайте шею (нерезкие наклоны, повороты, вращения) в течение 10 секунд;
- расстояние от глаз до книги или других предметов должно быть 30-35 см;
- соблюдайте зрительный режим (каждые 20 мин делайте перерыв в зрительной нагрузке).
Здоровый образ жизни снижает риск возникновения многих заболеваний, в том числе и остеохондроза.
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

Вертеброгенное головокружение: клиника, диагностика, лечение
Н. А. Дайхес, О. В. Зайцева ФГУ НКЦ оториноларингологии Росздрава (директор – д. м. н., профессор Дайхес Н. А.)
Головокружение в последние годы становится все более частым симптомом, встречающимся в медицинской практике. Головокружением страдают 3 – 4% пациентов, обращающихся к врачам-интернистам и 10% больных, посещающих оториноларингологов и невропатологов (26). Причиной головокружения могут являться более 80 патологических состояний (23).
Одной из основных причин развития вестибулярных расстройств у лиц трудоспособного возраста являются остеохондроз шейного отдела позвоночника и вертебробазилярная дисциркуляция (1, 5, 18). У 49,6% больных шейным остеохондрозом выявляются вестибулярные нарушения (обследовано 113 человек) (6). До 82% пациентов, страдающих шейным остеохондрозом, еще задолго до первого приступа головокружения жалуются на неустойчивость при ходьбе, ощущение зыбкости почвы под ногами, неопределенное покачивание тела, неясность контуров предметов.
Нередко эпизоды вертеброгенного головокружение сопровождаются головной болью, тошнотой. Возникающие зрительные расстройства (потемнение, мушки, пелена перед глазами) объясняются ангиоспазмом глазничной артерии из-за дисциркуляторных нарушений в затылочных долях мозга и симпатической ирритации (8). Следствием дисциркуляторных нарушений в вертебробазилярном бассейне является негрубая мозжечковая симптоматика и координаторные нарушения. Характерным признаком вертеброгенного вестибулярного синдрома является нарушение равновесия, усиливающееся при повороте головы (13). Проведенные стабилографические исследования показали, что снижение стабилографического индекса устойчивости при повороте головы на 17% и более свидетельствует о нарушении кровоснабжения в позвоночной артерии .
Вегетативные нарушения, включающие вестибуло-вегетативно-сосудистый синдром, встречаются у 47% больных шейным остеохондрозом (5), что во многом определяет клиническую картину: вазомоторные вегетативно-ирритативные проявления (ушной шум, головокружение, тошнота, синкопальные приступы), а также «неврологический дефицит». Вестибулярные нарушения составляют одно из наиболее ярких проявлений синдрома позвоночной артерии (задний шейный симпатический синдром или синдром Барре – Льеу), который в 30 – 42,5% случаев может быть обусловлен остеохондрозом или аномальным строением шейного отдела позвоночника, вызываться унковертебральными экзостозами (6) и разгибательным подвывихом позвонков (25), образуя блоки (полное или частичное слияние тел позвонков, дужек, суставных или остистых отростков соседних позвонков, что может быть связано с нарушением сегментации во внутриутробном периоде), чаще на уровне СII – СIII (16). При мануальном исследовании шейного отдела позвоночника 82 больных нейросенсорной тугоухостью, лечение которых по общепринятым схемам не было эффективным, у всех выявлены ротационные блоки в сторону больного уха преимущественно в нижне- и среднешейных позвоночных двигательных сегментах, у 69 человек – блоки в атланто-затылочном сочленении с больной стороны (19). Головокружение при синдроме позвоночной артерии может быть как несистемным – в виде покачивания, дурноты, так и системным – в виде вращения предметов, ощущения «ухода почвы из-под ног». Иногда встречается сочетание системного и несистемного головокружения.
Дегенеративные изменения связочно-хрящевых и костных структур шейного отдела позвоночника приводят к раздражению, а иногда и к сдавливанию, оплетающего позвоночную артерию симпатического нервного сплетения, которое оказывает влияние на сосудистую систему и метаболизм внутреннего уха. (4). Раздражение позвоночного нерва, повышая тонус позвоночной артерии, может уменьшить скорость объемного кровотока в ней на треть от исходной величины, при этом усиливается тонус и в ветвях основной артерии, в частности снижается более чем на 40% кровоснабжение внутреннего уха. Длительное патологическое воздействие на шейное симпатическое сплетение может вызвать сосудистые расстройства в лабиринте и нарушение функции рецепторного аппарата внутреннего уха (14).
Дегенеративно-дистрофические изменения, развивающихся в шейном отделе позвоночника, могут вызвать такое осложнение как стеноз позвоночного канала, проявляющийся признаками поражения нервной системы. Причиной стеноза нередко являются межпозвонковые грыжи, чаще сегментов С5 – С6 и С6 – С7, полисегментарное поражение встречается в 82% случаев (7).
При изучении состояния двигательных сегментов позвоночника (методом компьютерной томографии) на ранних стадиях процесса в 85% случаев выявляется наличие протрузий, величина которых варьирует от 4 до 7 мм. Считается, что выпячивание дисков становится клинически значимым при размерах более 3 мм. (7), однако другие авторы считают, что объем и характер, выявляемых в просвете позвоночного канала шейного отдела грыж диска, не определяет выраженность и остроту развития клинической симптоматики заболевания.
Протрузии межпозвонковых дисков представляют собой выпячивания фиброзного кольца за края тела позвонка и по всей его окружности (диффузная протрузия) или только части ее (локальная протрузия). Грыжа межпозвонкового диска является результатом смещения и выдавливания пульпозного ядра из своего ложа. Грыжевые массы образуют локальное выпячивание по краю межпозвонкового диска.
Следует дифференцировать локальные протрузии от локальных грыжевых выпячиваний. Локальная протрузия диска, как правило, больше по протяженности, чем грыжевое выпячивание. Кроме того, дифференциальное значение имеют непрямые симптомы грыж диска, к которым относятся облитерация эпидурального пространства, уменьшение плотности дорсальной части диска, асимметрия или изменение положения выходящих нервных корешков.
При наличии задних грыж диска важно отметить деформацию переднего контура дурального мешка, которая может быть обусловлена давлением от локального выпячивания диска или дополнительными структурами, облитерирующими эпидуральное пространство. Вероятно, симптом облитерации эпидурального пространства имеет решающее клиническое значение, так как в этом случае само локальное выпячивание непосредственного влияния на дуральный мешок не оказывает (7). Однако в механизме дискогенного корешкового синдрома наряду с компрессионным фактором важная роль принадлежит и вторичным изменениям в окружающей пораженный диск ткани (отек, гиперемия, реактивное воспаление, спайки и рубцы, артериальные и венозные дисциркулярные нарушения).
Одним из врожденных патологических состояний краниовертебральной области является аномалия Арнольда – Киари, проявляющаяся наличием приступов системного головокружения, тяжестью в голове, головной болью (в затылочной области), неустойчивостью в позе Ромберга, нарушением координации, ухудшением слуха, ушным шумом (как правило с одной стороны), снижением чувствительности роговицы и слизистой оболочки носа, часто – нарушением обоняния и вкуса. По некоторым данным, патология Киари выявляется у 26% больных с подозрением на различные патологические изменения ШОП и кранио-спинальные опухоли (3). Симптоматика аномалии Арнольда – Киари патогенетически обусловлена сдавлением каудальных отделов спинного мозга, позвоночной и мозжечковой артерии смещенными миндалинами мозжечка более чем на 3 мм ниже плоскости большого затылочного отверстия (линии Чемберлена). Следует отметить, что не все случаи расположения миндалин мозжечка ниже линии Чемберлена сопровождаются развитием клинических проявлений. Опускание миндалин мозжечка при патологии Киари составляет 3 – 29 мм (22, 23).
Поскольку, головокружение является симптомом многих соматических и эндокринологических заболеваний, в план обследования включается комплексное исследование соматического, отоневрологического и неврологического (в том числе вегетативного) статуса, лабораторная и рентгенологическая диагностика.
В клинической практике при обследовании больного с кохлеовестибулярными нарушениями нередко ограничиваются лишь рентгенограммой шейного отдела позвоночника, однако, этого недостаточно – 40% пациентов с изменениями на рентгенограммах не имели характерных клинических проявлений и еще 40% больных имели клиническую симптоматику без рентгенологической (7). Поэтому для постановки правильного диагноза и выбора лечебной тактики необходимо применение по крайней мере функциональной рентгенографии (боковая проекция с полным сгибанием и разгибанием головы при сидячем положении больного) (Дадашева М. Н.). Для более точного исследования шейного отдела позвоночника следует прибегать к магнитно-резонансной томографии (МРТ) и магнитно-резонансной ангиографии (3, 9, 11, 24) – самым современным неинвазивным методам нейровизуализации. Преимуществом МРТ является многоплановость изображения, визуализация мягкотканых структур, что позволяет оценить состояние дурального пространства спинного мозга (3, 11). Особенно ценно, что МРТ дает возможность оценить степень пролабирования межпозвонковых грыж, дегенеративные изменения спинного мозга, сужение вертебробазилярных сосудов или их окклюзию, еще до клинических проявлений (27) в виде головокружения, помутнения сознания, наличия патологического позиционного нистагма (24).
Следует отметить, что компьютерная томография дает одноплоскостное изображение, кроме того, ее надежность при исследованиях шейного отдела позвоночника составляет 50% (3).
Целесообразно разделять патогенетическую терапию вертеброгенного головокружения в острый период и период ремиссии, а также на терапию синдрома позвоночной артерии и терапию цервикального синдрома. Терапия синдрома позвоночной артерии включает применение вестибулолитических средств и вазоактивных препаратов, нормализующих гемодинамику. Для нормализации метаболических процессов используются ноотропные лекарственные средства, повышающие устойчивость ткани головного мозга к гипоксии, снижающие выраженность когнитивных и вегетативных расстройств. С целью регуляции обменных процессов целесообразно использование церебролизина. Терапия цервикального синдрома включает купирование болевого синдрома и мышечного напряжения нестероидными противовоспалительными препаратами. Для снижения мышечного тонуса используют миорелаксанты. Витамины группы В рекомендуются для стимуляции обменных процессов. При выраженном психоэмоциональном напряжении и для купирования вегетативного криза возможно применение малых транквилизаторов. В период ремиссии для лечения цервикального синдрома назначают хондропротекторы.
В современной клинической практике больным шейным остеохондрозом с кохлео-вестибулярным синдромом проводится, как правило, курс массажа шейно-воротниковой зоны и надплечий, лечебная гимнастика, фонофорез с новокаином, эуфиллином или гидрокортизоном, электротерапия, магнитотерапия, аэрозоль- и электроаэрозольтерапия, гидробальнеотерапия, рефлексотерапия – корпорально-аурикулярная акупунктура и массаж игольчатым молоточком шейно-воротниковой зоны, позволяющие улучшить кровообращение в вертебро-базилярной системе.
Курс классического, аппаратного, вакуумного или гидромассажа массажа шейно-воротниковой зоны, богатой рецепторами, с охватом паравертебральных областей состоит из 15-20 процедур. Наряду с миорелаксирующим действием, массаж способствует улучшению кровообращения, в частности усилению венозного оттока.
Многие авторы считают, что лечение больных с грыжами, протрузиями, вертеброгенным поражением позвоночной артерии наряду с применением вазоактивных препаратов должно и может включать мануальную терапию (МТ), эффективность которой достаточно высока. Уже после одной – двух процедур МТ (постизометрическая релаксация тонически напряженных мышц и мобилизация соответствующих позвоночно-двигательных сегментов в сочетании с медикаментозным лечением) у 25 больных купировалась субъективная и объективная симптоматика, а после 4 – 6 сеансов МТ все больные (проведено лечение 47 человек) отмечали улучшение состояния, повышалось пульсовое кровенаполнение в вертебро-базилярном бассейне, нормализовывался венозный отток (10). После курса мануальной терапии у большинства пациентов (69,2%) уменьшается частота и длительность приступов головокружения, спонтанный нистагм исчезает в 39,9% случаев, более быстрый регресс симптомов отмечается у больных с блокированием верхне-шейных сегментов (особенно С0 – С1) (6), уменьшается выраженность вегето-сосудистой дисфункции, развивающейся на фоне дегенеративных изменений позвоночника.
Отбор пациентов для проведения МТ должен быть тщательным, поскольку при некоторых формах дегенеративных заболеваний позвоночника МТ может спровоцировать ухудшение состояния больного. При проведении мануальной терапии больным шейным остеохондрозом могут возникать такие осложнения, как нарушение кровоснабжения мозга в вертебробазилярной системе; вегето-сосудистые кризы; компрессия спинного мозга на уровне шейного отдела; формирование нестабильности сегментов шейного отдела.
В связи с возможностью возникновения осложнений мануальную терапию шейного отдела позвоночника необходимо проводить с осторожностью, без каких-либо попыток глубокого массажа. Перед началом курса необходимо исключить у пациента наличие врожденных аномалий развития и системных заболеваний позвоночника, чрезмерную подвижность позвоночных сегментов, сосудистых нарушений системы кровообращения спинного мозга, спондилеза III степени, остеопороза позвоночника разной этиологии, тяжелых заболеваний внутренних органов, воспалительных процессов позвоночника, онкологических заболеваний, состояния после травматических повреждений и хирургических вмешательств на позвоночнике (12).
Уменьшению выраженности головокружения, нормализации функции равновесия способствует включение в комплекс лечебных мероприятий 10-12 сеансов вестибулярной реабилитации (гимнастики), проводимой на стабилографических (/постурографических) комплексах.
Нами проведено обследование и лечение 48 больных с головокружением на фоне остеохондроза шейного отдела позвоночника. При проведении МРТ шейного отдела позвоночника 32 больным (в возрасте от 20 до 63 лет) с трудно поддающейся лечению вестибулопатией и дегенеративными заболеваниями ШОП выявлено наличие грыж диска – у 13, протрузий – у 15, сочетание грыжи и протрузии – у 4, сочетание с аномалиями развития сосудов вертебро-базилярной системы – у 2 пациентов. Показаниями к проведению МРТ были следующие рентгенологические признаки: снижение высоты межпозвонкового диска, наличие остеофитов – костных разрастаний по краям тел позвонков, унковертебрального артроза.
Все пациенты получали медикаментозную терапию, массаж шейно-воротниковой зоны и лечебную гимнастику для больных остеохондрозом, по показаниям мануальную терапию (28 человек) и вестибулярную реабилитацию на постурографическом комплексе (21 человек). В результате проведенного лечения у всех пациентов достигнута компенсация вестибулярной функции в покое, уменьшение длительности и частоты приступов головокружения, улучшение стабилографических показателей.
Таким образом, целенаправленное и рациональное использование всех медикаментозных и немедикаментозных лечебных мероприятий способствует более успешному лечению головокружения.
Читайте также:
