Карбаматы. Антихолинэстеразные средства при миастении гравис
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Эфгартигимод разработки Argenx — сильный конкурент «Солириса».
Главное
Голландская «Ардженекс» (Argenx) выпустила «Вивгарт» (Vyvgart, эфгартигимод) — новый препарат, предназначенный для лечения взрослых пациентов с генерализованной миастенией гравис и аутоантителами к ацетилхолиновому рецептору (AChR).
«Вивгарт» одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Курс лечения «Вивгартом» предполагает внутривенное вливание препарата один раз в неделю на протяжении месяца.
Годовая стоимость «Вивгарта», который поступит в продажу в январе 2022 года, для типичного пациента в США составляет 225 тыс. долларов. Для сравнения: годовой курс лечения миастении гравис при помощи «Солириса» (Soliris, экулизумаб) — до этого момента единственного специализированного препарата против данного аутоиммунного заболевания — обходится в 470 тыс. долларов.

«Вивгарт»: механизм действия эфгартигимода
Эфгартигимод (efgartigimod, ARGX-113) представляет собой фрагмент человеческого IgG-антитела против неонатального Fc-рецептора (FcRn).
Неонатальный Fc-рецептор, также известный как рецептор Брамбелла и кодируемый геном FCGRT, представляет собой рецептор Fc-фрагмента иммуноглобулина G (IgG). Его структура подобна на таковую молекулы главного комплекса гистосовместимости (MHC) класса I и ассоциирована с бета-2-микроглобулином (B2M). На ранних этапах жизни организма FcRn обеспечивает усвоение антител IgG из крови или молока матери, во взрослом организме играет важную роль в поддержании гомеостаза антител этого изотипа и сывороточного альбумина, защищая их от преждевременной деградации.
FcRn, участвующий в процессинге и презентации антигенов, вовлечен в активацию T-лимфоцитов CD4 + and CD8 + и запуск стимулирования синтеза и высвобождения воспалительных цитокинов этими клетками. FcRn-опосредованное представление антигенов также вносит вклад в продукцию IgG B-лимфоцитами и поддержание иммунного IgG-ответа.
FcRn фактически спасает IgG от распада, связывая их с эндосомами и возвращая в кровоток, тем самым продлевая время полужизни. При аутоиммунных состояниях, когда организм ошибочно вырабатывает патогенные IgG-антитела к собственным тканям, FcRn вносит существенный вклад в хронический процесс, предотвращая лизосомальное разрушение указанных IgG-антител. Соответственно имеет смысл блокировать взаимодействие между FcRn и IgG.
Эфгартигимод, будучи Fc-фрагментом IgG1, выступает в роли естественного лиганда FcRn. Молекула сделана так, чтобы характеризоваться увеличенным сродством к FcRn по сравнению с эндогенным IgG в целях конкурирования со связыванием последнего, что приводит к снижению рециркуляции IgG и увеличению его деградации.
«Вивгарт»: эффективность и безопасность эфгартигимода в лечении миастении гравис
Клиническое исследование ADAPT (NCT03669588) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) изучило эффективность и безопасность эфгартигимода в лечении генерализованной миастении гравис у взрослых пациентов (n=167).
До скрининга участники должны были придерживаться стабильной терапии миастении гравис при помощи ингибиторов ацетилхолинэстеразы, кортикостероидов или нестероидных иммуносупрессивных препаратов.
Испытуемым назначали внутривенные инфузии эфгартигимода или плацебо.
Эффективность лечения оценивалась изменением общего балла по шкале повседневной активности при миастении гравис (MG-ADL) среди пациентов с аутоантителами к ацетилхолиновому рецептору (AChR). Ответившими на лечение считались те испытуемые, которые показали снижение балла MG-ADL на 2 пункта и более, фиксируемое на протяжении не менее чем 4 недель подряд, причем первое такое снижение должно было произойти в течении одной недели после последнего вливания препарата в очередном цикле терапии.
В первом терапевтическом цикле пропорция ответивших на лечение пациентов в группе «Вивгарта» составила 67,7% — против 29,7% в группе плацебо (p<0,0001). Отношение шансов (odds ratio, OR) получилось равным 4,95 (95% ДИ: 2,21–11,53).
Кроме того, 40% испытуемых в группе эфгартигимода вышли к общему баллу MG-ADL 0 или 1 (минимальная выраженность симптомов) — против 11% в группе контроля (p<0,0001).
Эффективность лечения также подтверждалась изменением общего балла по шкале количественной оценки тяжести клинических проявлений миастении гравис (QMG), оценивающей мышечную слабость. Ответившими на лечение считались те пациенты, которые продемонстрировали снижение балла QMG на 3 пункта и более, отмечаемое на протяжении не менее чем 4 недель подряд, при этом первое такое снижение должно было произойти в период одной недели после последней инфузии препарата в очередном цикле терапии.
В первом терапевтическом цикле пропорция ответивших на лечение пациентов в группе «Вивгарта» составила 63,1% — против 14,1% в группе плацебо (p<0,0001). Показатель OR вышел к 10,84 (95% ДИ: 4,18– 31,20).
Среди AChR-положительных пациентов усредненное максимальное снижение уровня иммуноглобулина G (IgG) составило 61,3%, AChR-антител — 57,6%.
Среди наиболее распространенных побочных реакций на назначение эфгартигимода: инфекции респираторного тракта (у 33% пациентов — против 29% в группе плацебо), головная боль (32% против 29%), инфекции мочевыводящих путей (10% против 5%), парестезия (7% против 5%), миалгия (6% против 1%).
Эфгартигимод: что дальше
«Ардженекс» продолжает осуществлять масштабную клиническую программу эфгартигимода, проверяя в том числе его более удобную подкожную рецептуру, реализованную благодаря технологии лекарственной доставки ENHANZE, придуманной «Хелозайм терапьютикс» (Halozyme Therapeutics).
Эфгартигимод проходит ряд клинических испытаний экспериментального лечения таких аутоиммунных заболеваний, как первичная иммунная тромбоцитопения, пузырчатка обыкновенная и пузырчатка эксфолиативная, хроническая воспалительная демиелинизирующая полинейропатия, буллёзная пузырчатка, идиопатическая воспалительная миопатия (миозит).
Эфгартигимод: рыночные перспективы и конкуренция
Согласно отраслевым прогнозам, реализация препарата «Вивгарт» для лечения миастении гравис выйдет на уровень 2,1 млрд долларов к 2026 году.
Если говорить о секторе лекарственных препаратов, таргетированных на FcRn и проверяемых в лечении миастении гравис, ближайшим конкурентом эфгартигимода является экспериментальный розаноликсизумаб (rozanolixizumab, UCB7665) — моноклональное антитело против FcRn, которым занимается бельгийская «ЮСиБи» (UCB). Его «фишкой» является подкожный способ введения, хотя назначение препарата осуществляется ежедневно.
Розаноликсизумаб, успешно прошедший клиническое исследование MycarinG (NCT03971422) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) в лечении генерализованной миастении гравиc, готовится к регистрации: досье в США, Европу и Японию намечено к отправке в третьем квартале 2022 года.
В клиническом испытании NCT03052751 фазы II пропорция пациентов, ответивших на лечение (изменение общих баллов на не менее чем 3 пункта), оказалась больше в группе розаноликсизумаба, чем плацебо: MG-ADL (48% против 14%), QMG (38% против 23%), композитная шкала оценки при миастении гравис (MGC) [48% против 27%].
«Янссен» (Janssen) в составе «Джонсон энд Джонсон» (Johnson & Johnson) трудится над нипокалимабом (nipocalimab, JNJ-80202135, M281) — моноклональным антителом против FcRn, разработанным «Момента фармасьютикалс» (Momenta Pharmaceuticals), которая была куплена в октябре 2020 года за 6,5 млрд долларов.
Нипокалимаб, который проходит клиническое исследование NCT04951622 фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) в лечении генерализованной миастении гравис, назначается внутривенно один раз в 2 или 4 недели.
Клиническое испытание Vivacity-MG (NCT03772587) фазы II продемонстрировало , что нипокалимаб привел к устойчивому снижению общего балла MG-ADL минимум на 2 пункта у 51,9% пациентов — против 15,4% в группе плацебо.
«Имьюновант» (Immunovant) как часть «Ройвант сайенсиз» (Roivant Sciences) занимается батоклимабом (batoclimab, IMVT-1401, RVT-1401, HL161) — моноклональным антителом против FcRn, разработанным корейской «Ханол байофарма» (HanAll Biopharma), аффилированной с «Тэвун фармасьютикал» (Daewoong Pharmaceutical). Батоклимаб назначается подкожными инъекциями один раз еженедельно или каждые 2 недели.
В клиническом испытании ASCEND MG (NCT03863080) фазы IIa в группе батоклимаба на лечение генерализованной миастении гравис ответили (снижение общего балла MG-ADL хотя бы на 2 пункта) 60% пациентов — против 20% в группе плацебо. Клиническое исследование фазы III намечено к запуску в начале 2022 года.
«Алексион фармасьютикалс» (Alexion Pharmaceuticals), ныне принадлежащая «АстраЗенека» (AstraZeneca), пробует силы с ориланолимабом (orilanolimab, ALXN1830, SYNT-001) — моноклональным антителом против FcRn, разработанным купленной «Синтимьюн» (Syntimmune). Ориланолимаб назначается подкожными инъекциями.
Клиническое исследование NCT04982289 фазы IIa, изучающее ориланолимаб в лечении генерализованной миастении гравис и временно остановленное из-за пандемии COVID-19, будет перезапущено в 2022 году.
Карбаматы. Антихолинэстеразные средства при миастении гравис
Миастения гравис. Патофизиология и лечение миастении гравис
Миастения гравис — редкое аутоиммунное заболевание, влияющее на нервно-мышечную систему. Характерные симптомы: слабость скелетных мышц и утомление после кратковременного периода повторной деятельности с восстановлением после короткого периода отдыха. Однако в случае прогрессирования болезни сила мышцы у пациентов не всегда возвращается к исходному состоянию после отдыха. Около 85% больных миастенией испытывают общую слабость, поражающую веки, глазные мышцы, мышцы туловища, диафрагмы и длинные мышцы шеи. Иногда слабость ограничивается только веками и экстраокулярными мышцами (15% пациентов), что проявляется птозом.
Миастения гравис встречается в США приблизительно в 100 случаях на 1 млн, обычно у женщин в возрасте около 50 лет и у мужчин старше 60 лет.
Патофизиологические особенности миастении гравис —результат дефицита никотиновых холинергических рецепторов в мышцах. При миастении гравис количество никотиновых холинергических рецепторов в концевых мышечных пластинах составляет только ~ 30% нормы. Дефицит рецепторов связан с иммунологическим ответом, вовлекающим тимус, т.к. сила мышц у таких пациентов обычно улучшается после тимэктомии. В сыворотке крови пациентов с миастенией присутствуют антитела к никотиновому рецептору, и антиген может быть локализован в тимусе, т.к. холинергические рецепторы обнаружены на поверхности мышечных клеток в тимусе.
При миастении гравис сокращение скелетных мышц неадекватно для поддержания физической активности. При миастении гравис мышечное сокращение не может быть поддержано, т.к. число взаимодействий нейромедиатор-рецептор меньше нормы вследствие уменьшения количества доступных для функционирования никотиновых рецепторов в концевых мышечных пластинах из-за антител. В связи с этим во многих мышечных волокнах происходит нарушение передачи, т.е. потенциалы действия могут быть сгенерированы лишь в небольшом количестве мышечных волокон. Вероятно, поэтому сокращение невозможно даже после небольшого периода мышечной активности. Однако это можно предотвратить увеличением числа холинергических взаимодействий нейромедиатор-рецептор.
Эффективная лекарственная терапия миастении гравис увеличивает число холинергических взаимодействий нейромедиатора с рецептором.
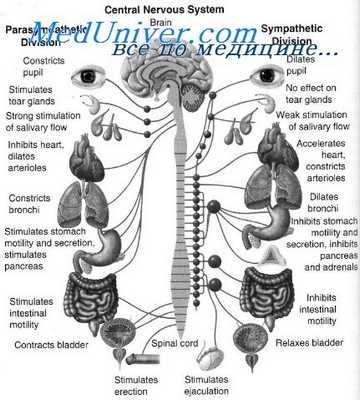
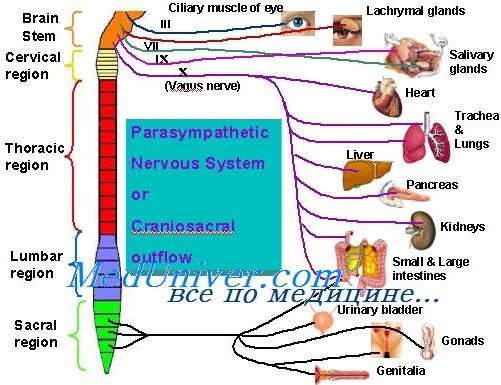
Лечение миастении гравис заключается в следующем:
• увеличение концентрации АХ в нервно-мышечном синапсе (например, антихолинэстеразными средствами);
• подавление иммунного ответа.
Лечение миастении гравис
Ацетилхолин неэффективен как лекарственный препарат, т.к. быстро метаболизируется ацетилхолинэстеразой в НМС и вызывает неблагоприятные эффекты стимуляции мускариновых рецепторов. Однако концентрация АХ в НМС может быть увеличена антихолинэстеразными средствами, которые ингибируют метаболизм АХ. Максимальные эффекты антихолинэстеразных средств обычно развиваются быстро в начале лечения, но после нескольких недель или месяцев терапии такие средства теряют эффективность. Тогда необходимо добавить другие препараты.
Фермент холинэстераза, которую ингибируют этими средствами, существует в двух структурно связанных изоэнзимах: (1) ацетилхолинэстераза (метаболизирует ацетилхолин), которая найдена преимущественно в НМС (и холинергических нейроэффекторных синапсах); (2) семейство эстераз, называемое псевдохолинэстераза или бутирилхолинэстераза (субстраты — неспецифические эфиры), которые найдены главным образом в плазме крови. Эти две разновидности фермента имеют два главных участка связывания — эстеразный и анионный, за которые антихолинэстеразные лекарства конкурируют с ацетилхолином, что ингибирует его метаболизм. Лекарства, которые ингибируют ацетилхолинэстеразу, можно объединить в две группы на основании участка связывания и стабильности взаимодействия с ферментом (например, обратимые и необратимые ингибиторы).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Карбаматы — обратимые антихолинэстеразные средства, широко используемые в лечении миастении гравис. Карбаматы, особенно неостигмин и пиридостигмин, обратимо ингибируют ацетилхолинэстеразу, связываясь в анионных и эстеразных участках. В течение периода ингибирования (3-6 час) концентрация АХ в НМС увеличивается, в результате происходят повторные взаимодействия с уменьшенным числом никотиновых холинергических рецепторов. Это ведет к улучшению сокращения мышц у пациента с миастенией. Оба средства назначают внутрь, но пиридостигмин имеет большую биодоступность и длительность действия (T1//2 = 4 час), чем неостигмин (Т1/2 = 2 час), и всасывается не полностью.
Силу дыхательных движений и жизненную емкость легких обычно используют для мониторирования увеличения мышечной силы после приема антихолинэстеразных средств. Для контроля и диагностики миастении гравис используют антихолинэстеразное средство ультракороткого действия — эдрофоний хлорид. Этот метод контроля является профилактической мерой для предотвращения передозировки, которая может уменьшить мышечную силу за счет АХ-вызванной блокады деполяризации никотиновых холинергических рецепторов в НМС у пациентов с миастенией гравис. Эдрофоний хлорид конкурирует с ацетилхолином за обратимое связывание в анионном участке ацетилхолинэстеразы. Улучшение мышечной силы с помощью эдрофония хлорида длится около 5 мин, если препарат вводят внутривенно. Однако, несмотря на непродолжительное действие эдрофония хлорида, в наличии должен быть атропин, чтобы противостоять мускариновым побочным эффектам в результате накопления ацетилхолина.
Антихолинэстеразные средства при миастении гравис
Для лечения миастении гравис также используют длительно действующие (более 3-8 час) антихолинэстеразные средства типа амбенония. Этот препарат действует подобно карбаматам. Фосфорорганические соединения редко используют в клинике, т.к. трудно контролировать дозы из-за необратимого связывания этих препаратов с эстеразным центром ацетилхолинэстеразы. Фосфорорганические антихолинэстеразные вещества используют прежде всего как инсектициды (например, паратион, малатион) и как химическое оружие (например, табун, зарин). Иногда для лечения некоторых форм глаукомы применяют эхотиофат.
Побочные эффекты антихолинэстеразных средств. Эти эффекты возникают из-за накопления ацетилхолина, ведущего к возбуждению мускариновых рецепторов во многих тканях. Побочными эффектами могут быть абдоминальные спазмы, гиперсаливация, увеличение бронхиальной секреции, миоз и брадикардия. Эти эффекты устраняют антагонисты мускариновых рецепторов типа атропина, но обычно его не назначают, поскольку лучше не маскировать появление мускариновых эффектов, которые являются показателем чрезмерной антихолинэстеразной терапии. Большинство пациентов становятся толерантными к этим неблагоприятным эффектам.
Лекарственные взаимодействия антихолинэстеразных средств. Эффективность антихолинэстеразных веществ снижается, а симптомы миастении гравис усиливаются, если пациент подвергается воздействию тубокурарина (антидеполяризующий миорелаксант) или аминогликозидного антибиотика, который нарушает нервно-мышечную передачу.
Поскольку эффективность антихолинэстеразной терапии часто уменьшается через несколько недель или месяцев, используют дополнительные терапевтические меры: назначение иммунодепрессантов типа глюкокортикостероидов, которые показаны, если мышечная сила неадекватна.
Глюкокортикостероиды и азатиоприн при миастении гравис. Циклоспорин А в лечении миастении гравис
Глюкокортикостероиды используют в лечении миастении гравис, т.к. они ингибируют синтез антител к никотиновым холинергическим рецепторам в НМС. Для этого обычно назначают преднизолон или преднизон, что ведет к увеличению числа доступных никотиновых холинергических рецепторов для взаимодействия с АХ. В результате сила мышц у пациентов с миастенией улучшается. Есть предположение, что полезные эффекты преднизолона могут быть частично обусловлены увеличенным синтезом АХ-рецепторов, которые также улучшают нервно-мышечную передачу при миастении гравис из-за подавления образования антител.
На ранних стадиях терапии преднизолоном мышечная слабость может увеличиваться, поэтому пациентов необходимо госпитализировать при использовании этого лечения впервые. Риск может быть уменьшен начальной терапией: комбинацией антихолинэстеразных средств и малой суточной дозы преднизолона (20 мг). Как только мышечная сила улучшается, дозу глюкокортикостероида можно постепенно увеличивать, а дозу антихолинэстеразного средства одновременно уменьшать до тех пор, пока на фоне одного глюкокортикостероида будет наблюдаться желаемый уровень мышечной силы. Однако лечение миастении гравис глюкокортикостероидами часто длительное, с предпочтительным дневным режимом терапии, чтобы уменьшить риск неблагоприятных эффектов. В этом режиме максимальный терапевтический эффект можно получить в пределах 6-12 мес.
Азатиоприн при миастении гравис
Азатиоприн используют в качестве альтернативы преднизолону при генерализованной миастении гравис, не отвечающей на глюкокортикостероидную терапию. Азатиоприн подавляет синтез антител к никотиновому холинергическому рецептору, ингибируя пролиферацию В-лимфоцитов. Эффективность препарата может быть обусловлена метаболитом 6-меркаптопурином, который ингибирует синтез ДНК. Однако его терапевтическая эффективность развивается медленно, вызывая удовлетворительные клинические результаты после одного года приема.
Побочные эффекты азатиоприна. Этими эффектами могут быть гриппоподобная реакция, тошнота и рвота, дерматиты, угнетение костного мозга и гепатоток-сичность. Многие из этих неблагоприятных эффектов могут развиться в серьезную токсичность, если азатиоприн используют в комбинации с 6-меркаптопурином или аллопуринолом.

Циклоспорин А при миастении гравис
Циклоспорин А — другой иммунодепрессант, используемый в лечении миастении гравис. Его эффективность связана с ингибированием синтеза антител к никотиновому холинергическому рецептору путем блокирования активации Т-клетокхелперов. Терапевтический эффект циклоспорина А развивается в пределах 1-2 мес.
Побочные эффекты циклоспорина А. Включают нефротоксичность, гепатотоксичность, гипертензию и тремор.
При попытке полностью устранить антигенную стимуляцию для производства антител к никотиновым холинергическим рецепторам в НМС иногда проводят хирургическое удаление тимуса. Эта хирургическая процедура не показана детям, не достигшим половой зрелости, из-за необходимости сохранить роль тимуса в развивающейся иммунной системе.
Для удаления антител к АХ-никотиновым рецепторам можно использовать плазмафорез, но только в качестве экстренной терапии у пациентов с миастеническим кризом (при усилении симптомов заболевания). Терапевтическая эффективность этой процедуры наступает через несколько дней и длится в течение нескольких недель.
Заболевания периферической нервной системы
Рис. 8.15 Высвобождение нейротрансмиттера и его взаимодействие с никотиновыми рецепторами в нервно-мышечном синапсе. При миастении гравис никотиновые рецепторы блокируются антителами, предотвращая взаимодействие между нейротрансмиттерами и рецепторами. АХ — ацетилхолин.
Миастения гравис — редкое аутоиммунное заболевание, влияющее на нервно-мышечную систему (рис. 8.15). Характерные симптомы: слабость скелетных мышц и утомление после кратковременного периода повторной деятельности с восстановлением после короткого периода отдыха. Однако в случае прогрессирования болезни сила мышцы у пациентов не всегда возвращается к исходному состоянию после отдыха. Около 85% больных миастенией испытывают общую слабость, поражающую веки, глазные мышцы, мышцы туловища, диафрагмы и длинные мышцы шеи. Иногда слабость ограничивается только веками и экстраокулярными мышцами (15% пациентов), что проявляется птозом.
Миастения гравис встречается в США приблизительно в 100 случаях на 1 млн, обычно у женщин в возрасте около 50 лет и у мужчин старше 60 лет.
Патофизиологические особенности миастении гравис—результат дефицита никотиновых холинергических рецепторов в мышцах
При миастении гравис количество никотиновых холинергических рецепторов в концевых мышечных пластинах составляет только « 30% нормы. Дефицит рецепторов связан с иммунологическим ответом, вовлекающим тимус, т.к. сила мышц у таких пациентов обычно улучшается после тимэктомии. В сыворотке крови пациентов с миастенией присутствуют антитела к никотиновому рецептору, и антиген может быть локализован в тимусе (рис. 8.16), т.к. холинергические рецепторы обнаружены на поверхности мышечных клеток в тимусе.
Рис. 8.16 Источник образования антигенов и антител при миастении гравис. Схематическое изображение участка тимуса, который содержит модифицированные мышечные клетки с никотиновыми рецепторами на поверхности. Предполагается, что эта железа может быть источником антигена, который служит моделью для получения никотиновых антител у больных миастенией. Эти антитела блокируют никотиновые рецепторы в нервно-мышечном соединении и предотвращают взаимодействие между нейротрансмиттером и никотиновыми рецепторами (см. рис. 8.18). АХ — ацетилхолин.
При миастении гравис сокращение скелетных мышц неадекватно для поддержания физической активности
При миастении гравис мышечное сокращение не может быть поддержано, т.к. число взаимодействий нейромедиатор-рецептор меньше нормы вследствие уменьшения количества доступных для функционирования никотиновых рецепторов в концевых мышечных пластинах из-за антител (см. рис. 8.16). В связи с этим во многих мышечных волокнах происходит нарушение передачи, т.е. потенциалы действия могут быть сгенерированы лишь в небольшом количестве мышечных волокон. Вероятно, поэтому сокращение невозможно даже после не большого периода мышечной активности. Однако это можно предотвратить увеличением числа холинергических взаимодействий нейромедиатор-рецептор.
Эффективная лекарственная терапия миастении гравис увеличивает число холинергических взаимодействий нейромедиатора с рецептором
Лечение миастении гравис заключается в следующем:
- увеличение концентрации АХ в нервно-мышечном синапсе (например, антихолинэстеразными средствами);
- подавление иммунного ответа.
АХ неэффективен как лекарственный препарат, т.к. быстро метаболизируется ацетилхолинэстеразой в НМС и вызывает неблагоприятные эффекты стимуляции мускариновых рецепторов. Однако концентрация АХ в НМС может быть увеличена антихолинэстеразными средствами, которые ингибируют метаболизм АХ. Максимальные эффекты антихолинэстеразных средств обычно развиваются быстро в начале лечения, но после нескольких недель или месяцев терапии такие средства теряют эффективность. Тогда необходимо добавить другие препараты.
Карбаматы — обратимые антихолинэстеразные средства, широко используемые в лечении миастении гравис
Карбаматы, особенно неостигмин и пиридостигмин, обратимо ингибируют ацетилхолинэстеразу, связываясь в анионных и эстеразных участках. В течение периода ингибирования (3-6 час) концентрация АХ в НМС увеличивается, в результате происходят повторные взаимодействия с уменьшенным числом никотиновых холинергических рецепторов. Это ведет к улучшению сокращения мышц у пациента с миастенией. Оба средства назначают внутрь, но пиридостигмин имеет большую биодоступность и длительность действия (T1/2 = 4 час), чем неостигмин (Т1/2 = 2 час), и всасывается не полностью.
Силу дыхательных движений и жизненную емкость легких обычно используют для мониторирования увеличения мышечной силы после приема антихолинэстеразных средств
Для контроля и диагностики миастении гравис используют антихолинэстеразное средство ультракороткого действия — эдрофоний хлорид. Этот метод контроля является профилактической мерой для предотвращения передозировки, которая может уменьшить мышечную силу за счет АХ-вызванной блокады деполяризации никотиновых холинергических рецепторов в НМС у пациентов с миастенией гравис. Эдрофоний хлорид конкурирует с ацетилхолином за обратимое связывание в анионном участке ацетилхолинэстеразы. Улучшение мышечной силы с помощью эдрофония хлорида длится около 5 мин, если препарат вводят внутривенно. Однако, несмотря на непродолжительное действие эдрофония хлорида, в наличии должен быть атропин, чтобы противостоять мускариновым побочным эффектам в результате накопления ацетилхолина.
ПОБОЧНЫЕ ЭФФЕКТЫ. Эти эффекты возникают из-за накопления ацетилхолина, ведущего к возбуждению мускариновых рецепторов во многих тканях. Побочными эффектами могут быть абдоминальные спазмы, гиперсаливация, увеличение бронхиальной секреции, миоз и брадикардия. Эти эффекты устраняют антагонисты мускариновых рецепторов типа атропина, но обычно его не назначают, поскольку лучше не маскировать появление мускариновых эффектов, которые являются показателем чрезмерной антихолинэстеразной терапии. Большинство пациентов становятся толерантными к этим неблагоприятным эффектам.
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ. Эффективность антихолинэстеразных веществ снижается, а симптомы миастении гравис усиливаются, если пациент подвергается воздействию тубокурарина (антидеполяризующий миорелаксант) или амино-гликозидного антибиотика, который нарушает нервно-мышечную передачу.
ЛЕКАРСТВА, КОТОРЫЕ ПОДАВЛЯЮТ ИММУННЫЙ ОТВЕТ ПРИ МИАСТЕНИИ ГРАВИС. Поскольку эффективность антихолинэстеразной терапии часто уменьшается через несколько недель или месяцев, используют дополнительные терапевтические меры: назначение иммунодепрессантов типа глюкокортикостероидов, которые показаны, если мышечная сила неадекватна.
Механизм действия глюкокортикостероидов обсужден подробно в Кортикостероиды. Глюкокортикостероиды используют в лечении миастении гравис, т.к. они ингибируют синтез антител к никотиновым холинергическим рецепторам в НМС (табл. 8.6). Для этого обычно назначают преднизолон или преднизон, что ведет к увеличению числа доступных никотиновых холинергических рецепторов для взаимодействия с АХ. В результате сила мышц у пациентов с миастенией улучшается. Есть предположение, что полезные эффекты преднизолона могут быть частично обусловлены увеличенным синтезом АХ-рецепторов, которые также улучшают нервно-мышечную передачу при миастении гравис из-за подавления образования антител.
Читайте также:
