Причины устойчивости опухолевых клеток к химиотерапии
Добавил пользователь Cypher Обновлено: 21.01.2026
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Медицина — не математика. То, что в ней происходит, нельзя четко разделить на «черное» и «белое». Организм человека можно сравнить со сложным уравнением, в котором тысячи неизвестных. Решая его, зачастую нельзя получить точный однозначный ответ. В медицине дважды два не равно четырем. Врач скажет, что получается примерно четыре с вероятностью 90% плюс-минус 0,051.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.

Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Но даже в рамках протоколов каждый пациент индивидуален. Например, два немелкоклеточных рака легких могут иметь очень разные молекулярно-генетические свойства, и против них будут эффективно работать разные комбинации препаратов. Нужен персонализированный подход, и современные технологии предоставляют такую возможность. В клиниках сети «Евроонко» можно провести специальный анализ и составить «молекулярный портрет» опухолевых клеток. Вместе с результатом анализа лаборатория выдает списки комбинаций химиопрепаратов, которые будут наиболее эффективны в конкретном случае.
Что такое ремиссия?
«Доктор, сможете ли вы избавить меня от рака?» Если онколог отвечает на этот вопрос однозначное «да», то он в некоторой степени кривит душой.
Что подразумевает пациент под словом «выздоровление»? Скорее всего, что в его организме не останется ни одной раковой клетки. Проблема в том, что это нельзя проверить ни одним самым современным методом диагностики. Раковые клетки крайне малы и могут находиться в организме где угодно. Они могут годами «спать», а потом начать быстро размножаться и образовать метастазы.
Вместо слова «выздоровление» в онкологии применяют специальный термин «ремиссия»: с помощью доступных на данный момент методов диагностики в организме пациента не обнаруживаются признаки злокачественной опухоли. Это не означает, что в будущем рак не может вернуться. Иногда рецидивирует прежнее онкологическое заболевание или возникает новое. Врачи применяют разные методы профилактического лечения, чтобы этого не произошло. Но полностью застраховаться нельзя, можно лишь снизить риски.
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.

В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
Химиотерапию проводят циклами. Это означает, что пациенту вводят препараты, а потом дают время на «передышку». Продолжительность цикла кратна неделе и составляет 7, 14, 21 день. Обычно для того чтобы оценить ответ на лечение, требуется 2–3 цикла. Для контроля используют те же методы, что и для диагностики рака:
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В клиниках «Евроонко» этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи «Евроонко» всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
Причины устойчивости опухолевых клеток к химиотерапии
Причины развития устойчивости к противоопухолевым препаратам. Гипотеза Голди—Гольдмана
Эффективность любой противоопухолевой терапии ограничено лекарственной устойчивостью, которая может быть врожденной и приобретенной, может развиваться к одному или нескольким препаратам (множественная резистентность). Высказывалось предложение, что в основе лекарственной резистентности лежат спонтанные мутации. Такие мутации быстро появляются в злокачественных опухолях.
Эта концепция, гипотеза Голди—Гольдмана, была применена к росту злокачественных опухолей и имеет важное клиническое значение. Данная теория наводит на мысль о том, что большинство злокачественных клеток вначале имеет врожденную чувствительность к химиопрепаратам, но затем развивается спонтанная резистентность разной степени.
Голди и Гольдман разработали математическую модель, в которой излечение соотносится со временем появления клеток, резистентных к одному или двум химиопрепаратам. Предполагая, что есть спонтанная частота мутации, модель прогнозирует различия в размере устойчивой группы клеток опухоли того же размера и типа, которые зависят от спонтанной частоты мутации и особенностей, при которых мутация развивается. Таким образом, количественное соотношение резистентных клеток в любых опухолях, не подвергавшихся лечению, вероятно, будет небольшим и начальный ответ на лечение не будет влиять на количество резистентных клеток.
В клинической практике это означает, что полная ремиссия может быть достигнута, даже если существовала линия резистентных клеток. Однако неудачи в лечении таких больных непосредственно бы зависели от присутствия этих резистентных клеток. Такая модель спонтанной лекарственной устойчивости клеток предполагает, что для уменьшения появления клонов, устойчивых к препарату, необходимо, чтобы разнообразные эффективные лекарственные средства были применены как можно раньше при злокачественном процессе.
В клеточных линиях и экспериментальных моделях на животных устойчивость к специфическим препаратам, вероятно, возникает в результате разнообразных механизмов, хотя лишь только некоторые из них имеют клиническую значимость при злокачественных новообразованиях человека. Они включают улучшение качества репарации ДНК, уменьшение поглощения лекарственного средства или увеличение оттока его из клетки, повышение или изменение активности ферментов-мишеней данного химиопрепарата, изменения в лекарственной активации/деградации, амплификацию генов и нарушение метаболизма лекарственного средства. Эти механизмы представлены в таблице ниже.

Известны также различные механизмы множественной резистентности. Некоторые экспериментальные данные на моделях мышей указывают на то, что одна форма множественной лекарственной резистентности опухолевых клеток имеет отношение к способности резистентных к лекарственным средствам клеток опухоли ограничивать накопление препаратом структурно не связанных веществ. Эта перекрестная устойчивость чаще всего наблюдается при использовании природных препаратов (например, доксорубицина, этопозида, паклитаксела и алкалоидов барвинка).
Устойчивость к одному препарату может придать перекрестную устойчивость к структурно отличающимся препаратам с различными способами воздействия. Лучше всего исследован механизм множественной резистентности; было описано вовлечение в процесс гликопротеида р-170 и его гена MDR1. Линг и соавт. первые показали образование Р-гликопротеида с молекулярной массой 170 кДа на клеточной мембране. Появление плейотропной лекарственной устойчивости связывают с проницаемостью клетки, необходимой для накопления и удержания противоопухолевых препаратов.
Было описано, что этот Р-гликопротеид непосредственно связан с выраженностью устойчивости, а клетки, которые возвращаются в состояние чувствительности к препарату, теряют этот мембранный гликопротеид. ДНК может перемещаться из резистентных клеток в чувствительные клетки, обусловливая передачу плейотропной устойчивости в неэкспонированные клетки.
Маловероятно, что ген MDR1 служит самым распространенным механизмом образования устойчивости к химиопрепаратам при злокачественных новообразованиях яичника, особенно если учесть, что ген MDR1 этими опухолями не экспрессируется. Другой механизм, обусловливающий фенотип множественной лекарственной резистентности, характерен для алкилирующих средств, цисплатина и облучения. Устойчивость в этой группе была связана с повышением внутриклеточного уровня глутатиона и не связана с общим умеренным снижением накопления препарата. Для других транспортных белков, включая ассоциированные со множественной лекарственной резистентностью, было установлено, что р-170 гликопротеидный насос не участвует в механизме развития устойчивости.
Более того, были обнаружены изменения в генах, контролирующих апоптоз и задержку пролиферации. Несмотря на то что необходимо установить относительную значимость этих отдельных механизмов развития резистентности при раке яичника (РЯ), наиболее вероятно, что в клинической практике имеют место различные комбинации механизмов.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
На эффективность препарата большое влияние оказывает скорость его превращения в активную форму и скорость выведения из организма. Различия в этих ферментативных процессах отчасти имеют конституционный характер, являясь результатом генетических особенностей индивидуума. Для опухолей, помимо конституционных факторов, существуют механизмы, свойственные самой опухоли.
К их числу относится усиление или подавление метаболических процессов в клетках опухоли, которое может происходить за счет соматических мутаций, а также различная активность процессов, ответственных за доставку препарата в клетки опухоли, которые определяются степенью ее васкуляризации.
Таким образом, некоторые механизмы устойчивости опухолей к химиотерапевтическим средствам отражают особенности метаболизма и лекарственной устойчивости организма, в то время как другие связаны с самой опухолью.
Особенности метаболизма как причина устойчивости к химиотерапии
Индивидуальная чувствительность к лекарственным средствам зависит от конституционных факторов, ответственных за поступление лекарства, распределение его в организме и метаболические изменения до момента его попадания в опухоль. Эффективность этих процессов определяется генети-чески-детерминированными различиями среди индивидуумов.
Эти различия определяют структуру белков, принимающих участие в процессах метаболизма лекарственных препаратов. В основе таких наследственных вариаций в характере метаболизма лекарств лежит фармакогенетика. Для некоторых противоопухолевых препаратов понятны причины их различной эффективности, и генетически-детерминированные различия метаболизма определяют их такие важные характеристики, как противоопухолевая активность или токсичность. Они определяются различными генетическими факторами
За счет мутаций может происходить изменение активности или полная инактивация ферментов, отвечающих за метаболизм лекарства, в результате которого оно превращается в активную форму или распадается. В качестве примера можно привести изменения в метаболизме тамоксифена, при которых полиморфизм фермента CYP2D6, участвующего в обмене цитохрома Р450 в печени, изменяет вероятность развития побочных эффектов и лекарственного взаимодействия.
Часто наблюдается полиморфизм генетических структур, например изменение какого-либо нуклеотида в ДНК, или аминокислоты в белке. Обычно при этом функция меняется незначительно, хотя иногда наступающие изменения важны для клиники.
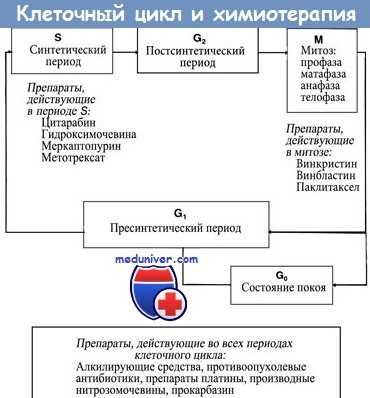
Примеры:
1. Меркаптопурин превращается в неактивную форму при участии фермента ТРМТ (тиопурин метилтрансферазы). Десять процентов населения гетерозиготны по мутантному аллелю, в то время как 0,3% гомозиготны. Мутантный аллель вызывает утрату способности клетки разрушать меркаптопурин (особенно это проявляется у гомозиготных организмов).
В результате возрастает токсичность препарата, однако усиливается его противоопухолевая эффективность.
2. Иринотекан представляет собой ингибитор топоизомеразы I. При участии СУР3А (цитохрома печени) он превращается в неактивную форму, а фермент СЕ (карбоксиэстераза) переводит его в активную форму, которая носит название SN38. Последняя инактивируется в печени под действием глюкоуронилтрансферазы (UGT1).
Полиморфизм промоторного участка UGT1 приводит к снижению метаболизма препарата и к увеличению его токсичности. Аналогичный эффект наблюдается при снижении активности СУР3А.
Приведенные примеры иллюстрируют возможности использования этого подхода в лечении рака. При помощи простых методов генотипирования можно обнаружить полиморфизм, который обусловливает такие результаты лечения цитотоксическими препаратами, как эффективность лечения, чувствительность к острой токсичности препаратов или проявление осложнений после продолжительного лечения (например, развитие вторичных опухолей).
Конечная цель состоит в разработке более индивидуального подхода к лечению больных, чем это удается делать до сих пор.

Устойчивость опухоли к лекарственным препаратам
До начала лечения клетки солидных опухолей проявляют различную чувствительность к лекарственным препаратам. Развивающаяся по мере роста опухоли генетическая нестабильность и образование соматических мутаций обусловливают проявление гетерогенности клеток по их устойчивости к действию химиотерапевтических препаратов. Это частично объясняет лекарственную устойчивость клеток больших опухолей, в которых такие процессы прогрессируют.
По мере роста опухоли частота возникновения устойчивых клеток увеличивается, и таким образом в больших опухолях их содержится много. Эта устойчивость обусловлена существованием одного или нескольких механизмов, перечисленных в таблице, которые рассматриваются ниже. Причиной является генетическая нестабильность, которая приводит к изменениям количества и функций внутриклеточных ферментов или транспортных белков.
Защитные механизмы организма и цитотоксические препараты оказывают на клетки селекционное давление, тем самым способствуя выживаемости устойчивых клеток, которые растут и делятся.
Наряду с перечисленным типом клеточной устойчивости, важную роль играют, по крайней мере, еще два других механизма. Один из них — понижение степени васкуляризации участков опухоли по мере ее роста. Это приводит к гипоксии и к снижению проникновения препарата в опухолевую ткань. Есть основания предполагать, что так же, как при радиотерапии, клеточная гипоксия может определять чувствительность опухоли к цитотоксическим препаратам.
Второй механизм связан с тем, что лишь небольшое количество клеток находится в цикле. Это дает дополнительное время для протекания репарации повреждений до момента вступления клетки в деление.
Как раковые клетки становятся устойчивыми к противоопухолевым препаратам?
Прорывное исследование, результаты которого были недавно опубликованы в научном журнале Science, показало, что раковые клетки могут активировать альтернативные пути копирования ДНК, чтобы стать устойчивыми к противоопухолевым препаратам. Этот процесс называется стресс-индуцированным мутагенезом. Бактерии также его используют, чтобы выработать устойчивость к антибиотикам.
Каждый раз, когда делится клетка в организме человека, она должна очень точно скопировать около трех миллиардов «букв» генетического кода. Высокая точность нужна для того, чтобы дочерние клетки были жизнеспособны и нормально функционировали. Для раковых клеток это не так важно.
Ученые обнаружили, что при разных типах злокачественных опухолей, включая меланому, рак поджелудочной железы, саркомы и рак молочной железы, в ДНК раковых клеток во время деления при воздействии противоопухолевых препаратов происходит множество мутаций. Благодаря этим генетическим «ошибкам» и развивается устойчивость к химиопрепаратам.
Проблема резистентности рака
Даже если поначалу те или иные противоопухолевые препараты работали в конкретном клиническом случае очень хорошо, со временем они перестают быть эффективны. С этой проблемой ежегодно сталкиваются сотни тысяч онкологических больных. Зачастую еще остается возможность назначить «запасные» схемы терапии, но они тоже работают только в течение определенного времени. Рано или поздно, возникает ситуация, когда не помогает ни одна комбинация препаратов из актуальной версии протоколов лечения.
Ученым давно известно, что раковые клетки вырабатывают резистентность (устойчивость) к терапии в результате мутаций. Но пока непонятно, какие механизмы приводят к этим мутациям, и можно ли на них повлиять.
Команда ученых из Института медицинских исследований Гарвана (Garvan Institute of Medical Research, Австралия) во главе с профессором Дэвидом Томасом (David Thomas) проанализировала образцы опухолевой ткани, полученные от пациентов до и после курса таргетной терапии.
Исследователи были удивлены, когда увидели, что в опухолевых клетках после применения таргетных препаратов резко увеличился уровень повреждения ДНК, даже в случаях, когда ее не повреждал сам препарат. Было проведено секвенирование ДНК раковых клеток, чтобы оценить, как лечение привело к ускоренной эволюции генома опухолевой ткани.
Первый автор исследования, Аркади Сиппони (Arcadi Cipponi) отмечает:
Наши исследования показали, что в раковых клетках, подвергшихся воздействию таргетных препаратов, происходит стресс-индуцированный мутагенез. Они генерируют случайные генетические вариации с гораздо большей скоростью, чем раковые клетки, не подвергшиеся воздействию таргетных препаратов. Этот же механизм используют бактерии, когда оказываются в стрессовых условиях.
Рак использует двухступенчатую стратегию
Чтобы разобраться, почему в опухолевых клетках происходит стресс-индуцированный мутагенез, ученые начали поочередно «выключать» в них разные гены.
Когда был «отключен» ген, кодирующий белок MTOR, ученые обнаружили, что раковые клетки перестали расти, но парадоксальным образом ускорилась их эволюция в присутствии противоопухолевых препаратов.
Доктор Сиппони объясняет:
MTOR является сенсорным белком, он сигнализирует нормальным клеткам о том, что они оказались в стрессовых условиях, и им нужно прекратить расти. Мы обнаружили, что во время противоопухолевой терапии сигналы MTOR способствуют тому, что в раковых клетках меняется экспрессия (активность) генов, кодирующих белки, которые копируют и восстанавливают ДНК. Например, активируются ферменты, которые копируют ДНК и при этом часто совершают ошибки. Из-за этого в генах опухолевых клеток происходит большое количество изменений, благодаря чему и развивается резистентность к противоопухолевым препаратам.
Не менее интересен и тот факт, что такие реакции со стороны опухолевой ткани носят временный характер. Как только развивается устойчивость к препаратам, копирование ДНК снова становится точным, и генетические изменения перестают накапливаться в таком большом количестве.
Новые подходы к лечению онкологических заболеваний
Авторы исследования считают, что можно повысить эффективность лечения рака, если сочетать традиционную таргетную терапию с препаратами, влияющими на репарацию ДНК. Ученые проверили свое предположение на мышах с раком поджелудочной железы. Животным вводили два препарата:
- Палбоциклиб — блокирует ферменты циклинзависимые киназы, которые активируют размножение клеток.
- Рукапариб (Рубрака) — блокирует фермент PARP, который восстанавливает поврежденную ДНК.
В течение 30 дней терапии этой комбинацией рост злокачественной опухоли удалось затормозить на 60% эффективнее, чем при использовании только палбоциклиба.
Клеточные механизмы устойчивости к цитостатикам
Образование соматических мутаций и преимущественная выживаемость клеток, устойчивых к химиотерапевтическим препаратам, свидетельствуют о том, что невозможно различить «истинную» и «приобретенную» устойчивость. Клеточные механизмы представляют собой сочетание генетических изменений и отбора клеток с механизмами устойчивости, характерными для здоровых тканей. Для некоторых клеток характерен один механизм лекарственной устойчивости.
Вместе с тем, в клетках могут сосуществовать несколько механизмов. Поэтому можно ожидать, что для разных клеток опухоли характерно существование различных механизмов устойчивости к цитотоксическим препаратам.
Один из необъяснимых феноменов, характерных для химиотерапии рака, заключается в том, что некоторые опухоли проявляют чувствительность к цитотоксическим препаратам, в то время как другие устойчивы к ним. Эта присущая опухолям чувствительность или устойчивость проявляется для препаратов, относящихся к различным химическим группам и обладающих различными механизмами действия.
Так, для лимфом и опухолей герминативных клеток характерна крайне высокая чувствительность к лекарственным средствам.
Больные с этими опухолями успешно вылечиваются. В то же время, рак поджелудочной железы и меланома относятся к числу опухолей, устойчивых к лекарственным средствам. Такие свойства опухолей трудно объяснить существованием индивидуальных механизмов устойчивости, которые рассматриваются ниже. Скорее всего, они обусловливаются более легкой индукцией клеточной гибели (апоптоза) в некоторых опухолях в ответ на повреждения ДНК.
Некоторые механизмы лекарственной устойчивости опухолей перечислены в таблице. Необходимо подчеркнуть, что эти механизмы свойственны как здоровым, так и злокачественным клеткам.
Множественная лекарственная устойчивость (MDR) как причина устойчивости к цитостатикам
Существует мембранный гликопротеин (р-гликопротеин, pgp, gpl70) с молекулярным весом 170 кДа, выполняющий функции внутриклеточного насоса и снижающий внутриклеточную концентрацию некоторых, хотя и не всех, цитотоксических агентов.
По структуре этот белок гомологичен транспортному белку оболочки бактерий и широко распространен в природе. Он присутствует в эндотелии верхнего участка желудочно-кишечного тракта, в клетках надпочечников и почки. В клетке он выполняет функцию детоксикации. Наличие этого белка обусловливает устойчивость клеток к ряду цитоток-сических агентов, таких как алкалоиды винки, антрациклины и эпиподофиллотоксин.
Гены MDR относятся к семейству генов, кодирующих белки, которые удаляют из клетки лекарственные препараты. Существуют клинические данные, свидетельствующие о том, что экспрессия pgp в опухолях коррелирует с неблагоприятным прогнозом заболевания (например, в случае сарком мягких тканей в детском возрасте). Однако неизвестно, является ли это прямым следствием неблагоприятной реакции опухоли на действие цитотоксических препаратов.
В экспериментах in vitro эффект pgp снимается блокато-рами кальциевых каналов (например, верапамилом), однако в клинических условиях трудно создать необходимую концентрацию этого препарата в плазме крови. Поэтому клинически значимого результата блокирования механизма MDR пока не достигнуто. Проводятся испытания других соединений.
Белок, связанный с развитием множественной лекарственной устойчивости
Этот белок функционирует как переносчик за пределы клетки конъюгата, состоящего из лекарственного препарата и глутатиона (GSH, см. ниже). Значение этого механизма в полной мере пока не установлено, однако в некоторых линиях опухолевых клеток обнаружена повышенная экспрессия белка-переносчика.
Глутатион как причина устойчивости к цитостатикам
Небольшой трипептид, представляющий собой восстанавливающий агент, содержащий SH-группы и выполняющий роль внутриклеточного детоксицирующего агента. Благодаря присутствию в цитоплазме клетки фермента глутатионредуктазы, глутатион находится в восстановленной SH-форме. Это предотвращает образование в белках случайных SS-связей, которые могут приводить к нарушению пространственной конфигурации белковых молекул.
В клетке находятся ферменты трансферазы, которые обеспечивают связывание глутатиона с токсинами. Специфичность трансфераз ко многим цитотоксическим агентам еще не вполне выяснена. Полиморфизм трансфераз обуславливает развитие острого миелоцитарного лейкоза у детей.
Уровень глутатиона и активность глутатионтрансфераз являются важнейшими факторами, обуславливающими чувствительность клеток к токсическим препаратам, в особенности к алкилирующим агентам. В клетках здоровых и опухолевых тканей уровень глутатиона широко варьирует и, вообще говоря, не коррелирует с их чувствительностью к лекарствам. Чувствительность клеток можно повысить при помощи средств, снижающих уровень внутриклеточного глутатиона или ингибирующих активность трансфераз, например таких как этакриновая кислота.
В клетках, которые приобрели устойчивость к азотистому иприту, увеличение трансферазной активности связано с амплификацией генов, однако неизвестно, какую роль играет этот механизм в клетках спонтанно возникающих опухолей.
Амплификация генов как причина устойчивости к цитостатикам
В культуре опухолевых клеток, устойчивых к цитотоксическим агентам, происходит амплификация генов, ответственных за развитие этой устойчивости. По-видимому, амплификация генов наследуется в поколениях делящихся клеток. В качестве примера приведем амплификацию гена, кодирующего синтез дигидрофолатредуктазы, в результате которой в клетке увеличивается количество этого фермента и развивается устойчивость к метотрексату. Другие примеры включают амплификацию изоформ глутатион S-трансферазы (которые ответственны за развитие устойчивости к алкилирующим агентам) и О6-алкилтрансферазы (обеспечивающие устойчивость клетки к нитрозомочевинам).
Усиление процессов репарации ДНК как причина устойчивости к цитостатикам
Аддукты, состоящие из оснований ДНК и алкилирующих агентов, связанных ковалентной связью, удаляются ферментативно. Протекающие при этом реакции носят сложный характер и происходят с участием ДНК-гликозилазы и полимеразы. Репаративный механизм включает этап эксцизионной репарации оснований, при котором гликозилаза расщепляет связь между основанием и сахарным остатком, и эксцизионную репарацию нуклеотидов, которая приводит к выщеплению более протяженных участков ДНК с последующим воссоединением концов цепи.
В отличие от клеток здоровых тканей о спектре ферментов и эффективности процессов репарации ДНК в раковых клетках известно мало. Также неизвестно, связана ли устойчивость этих клеток к лекарственным препаратам с повышенной способностью к репарации повреждений, возникающих в ДНК. Характер репаративных процессов различается в зависимости от типа повреждений, возникающих в определенных участках молекул оснований. Также их эффективность сильно зависит от локализации повреждения в гене и от его транскрипционной активности.
Ингибирование процессов активации лекарственных препаратов
Прежде чем проявить противоопухолевое действие, такие препараты, как цитозин арабинозид и 5-фторурацил (5-ФУ), должны превратиться в активные формы внутри клетки. Низкий уровень соответствующих ферментов или наличие конкурентных путей метаболизма лекарства может привести к снижению внутриклеточной концентрации его активной формы. Такие препараты, как циклофосфамид, превращаются в активную форму в клетках здоровых тканей (в данном случае печени).
Генетически-детерминированные различия в эффективности процессов активации лекарств обуславливают вариабельность концентрации и скорости образования активной формы. Эти различия не принадлежат к числу характерных для раковых клеток, однако могут объяснять снижение эффективности лекарственных средств. Внутриклеточный уровень DT-диафоразы, одного из ферментов восстановления, может играть роль критического фактора в превращении в активную форму таких восстанавливающих агентов, как хиноны.
Прочие механизмы устойчивости к цитостатикам
К числу многочисленных биохимических реакций, приводящих к разрушению лекарственных препаратов, относится их внутриклеточная деградация (например, дезаминирование цитозинарабинозида), нарушения процессов мембранного транспорта (метотрексат), и существование конкурентных метаболических процессов, например образование аспарагина под действием аспарагинсинтетазы, снижающее эффективность аспарагиназы.
Некоторые из этих механизмов рассматриваются в разделах, посвященных конкретным препаратам.
Читайте также:
