Кишечник при острой окклюзии верхней брыжеечной артерии. Гистология
Добавил пользователь Владимир З. Обновлено: 10.01.2026
Кишечник при острой окклюзии верхней брыжеечной артерии. Гистология
Влияние острой окклюзии верхней брыжеечной артерии на кишечник. Влияние перевязки верхней брыжеечной артерии изучается уже более ста лет. В 1975 г. Linen провел первые эксперименты. В опытах на 40 собаках Litten установил, что перевязка ВБА неминуемо приводит к смерти животных через 12—48 часов; этот период сопровождается рвотой, диареей с кровью и лихорадкой.
После перевязки верхней брыжеечной артерии полностью исчезает пульсация, кишка становится сине-белой и спастической со спавшимися артериями и набухшими венами. Вначале сокращения усиливаются, однако в последующем они исчезают, и спустя несколько часов петли кишки полностью расслабляются и растягиваются. Через 8—10 часов начинается выраженное кровотечение, и при вскрытии кишечник от двенадцатиперстно-тощекишечного изгиба до поперечной ободочной кишки имеет темно-красный цвет с тусклой геморрагической отечной поверхностью.
Серозная оболочка покрыта волдырями, отмечается кровоизлияние в мышечные слои.
Слизистая оболочка отечна, с обильным серозно-геморрагическим секретом. В лимфатических узлах брыжейки обнаруживаются кровоизлияния.
Вены наполнены кровью, но не тромбированы.
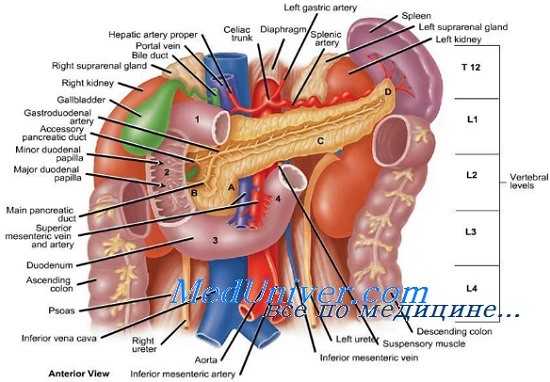
Эта картина идентична той, которая впоследствии была описана Hertzler и Boyd у больных после мезентериальной эмболии. Выявленные ими гистологические изменения заключались в некрозе, распространившемся от слизистой оболочки к наружным слоям кишки, с оттенком и кровоизлияниями; при микроскопическом исследовании брыжейки и стенки кишки отмечались ретроградный венозный кровоток и наполнение венозных сосудов различной степени.
Деструкция кишки неоднородна по той причине, что кровоток находится под действием множества факторов (механических, биохимических и гормональных).
Диаметр и расположение определенной кишечной петли, не имея никакого значения в нормальных условиях, становятся решающим фактором, если давление артериального притока резко падает; в таких случаях незначительные изменения внутрипросветного давления, связанные с зонами спазма и обструкции, могут оказывать огромное влияние на интрамуральный кровоток. Более того, было показано, что бактериальный и химический состав кишечного содержимого имеет значительное воздействие на темпы развития некроза после окклюзии ВБА.
Кроме того, после окклюзии артерии всегда отмечаются еще два характерных нарушения: появление в брюшной полости умеренного количества мутной с дурным запахом жидкости и пузырьков газа в брыжеечных венах — предположительно в результате бактериальной активности в просвете и стенке кишки.
Гистологические признаки окклюзии верхней брыжеечной артерии. Самое раннее изменение после окклюзии ВБА — приподнимание эпителия с образованием пространства между железистыми клетками и основной мембраной. Затем верхушки ворсинок слущиваются, и образуются скопления мембран некротического эпителия, фибрина, воспалительных клеток и бактерий. Позднее появляется отек с кровоизлияниями в подслизистый слой, в то время как некротические изменения неуклонно распространяются от внутреннего слоя кишки кнаружи до такой степени, что в наиболее пораженных зонах не оставляется никаких следов строения слизистой оболочки.
Наряду с изменениями, обнаруживаемыми в слизистой оболочке, отмечается нарастающее запустевание артериального дерева с одновременным застоем в венозных сосудах и тромбозом отдельных сосудов. Воспалительная реакция в стенке кишки, вначале яркая, постепенно угасает, по-видимому, вследствие уменьшения количества клеток под влиянием аноксии без соответствующего их воспаления из артериальной циркуляции. По мере отделения и слущивания слизистой оболочки в просвет кишки ее стенка истончается, и через 9—10 часов могут возникнуть перфорации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острая окклюзия мезентериальных сосудов
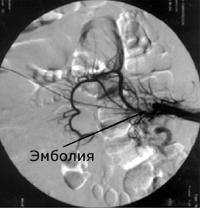
Острая окклюзия мезентериальных сосудов – острое нарушение кровообращения в брыжеечных сосудах, приводящее к ишемии кишечника. Заболевание проявляется резкой, нестерпимой болью в животе, рвотой и поносом с примесью крови, шоковым состоянием. Диагноз острой окклюзии мезентериальных сосудов определяют на основании клинической картины, данных селективной ангиографии, рентгенографии брюшной полости, лапароскопии. Острая окклюзия мезентериальных сосудов требует экстренного оперативного вмешательства (эмбол- или тромбэндартериоэктомии, резекции пораженных отделов кишечника), профилактики перитонита и повторных окклюзий.
Общие сведения
Острая окклюзия мезентериальных сосудов - неотложная патология в гастроэнтерологии, возникающая вследствие тромбоза или эмболии сосудов брыжейки. Острая окклюзия мезентериальных сосудов проявляется резким нарушением кровообращения в сосудистых участках проксимальнее и дистальнее места обструкции, сопровождается выраженным ангиоспазмом и дополнительным тромбообразованием, в результате чего возникает острое нарушение питания и ишемическое поражение стенки кишечника. В дальнейшем начинают развиваться необратимые деструктивные изменения, формируется анемический и геморрагический инфаркт (некроз) кишечника. Острая окклюзия мезентериальных сосудов характеризуется крайне тяжелым течением и высокой летальностью.
Локализация и протяженность ишемического поражения кишечника при острой окклюзии мезентериальных сосудов зависит от вида и уровня обструкции, наличия коллатеральных путей компенсации кровотока. В 90% случаев наблюдается окклюзия основного ствола или одной из ветвей верхней брыжеечной артерии, в большей степени обеспечивающей кровоснабжение пищеварительного тракта. Нижняя брыжеечная артерия имеет хорошие коллатеральные связи, поэтому при ее окклюзии редко возникают серьезные нарушения мезентериального кровообращения. Окклюзия брыжеечных вен встречается реже; возможно также смешанное поражение брыжеечных артерий и вен, при котором острой окклюзии одного из сосудов предшествует хроническая обструкция другого.
Острая окклюзия мезентериальных сосудов встречается преимущественно у лиц мужского пола в возрасте старше 50-60 лет.
Причины острой окклюзии мезентериальных сосудов
Острая окклюзия мезентериальных сосудов развивается как осложнение различных сердечно-сосудистых заболеваний (атеросклероза, пороков сердца, системных аллергических васкулитов, ревматизма, гипертонической болезни, аневризмы брюшной аорты, аритмии), предшествующих операций на сердце и аорте, злокачественных опухолей, травм.
Непосредственной причиной острой окклюзии мезентериальных сосудов являются тромбоз и эмболия. При тромбозе просвет сосудов брыжейки перекрывается тромбом, образовавшимся вследствие изменения сосудистых стенок на фоне повышенной свертываемости крови и замедленного кровотока (патогенетическая триада Вихрова). При эмболии наблюдается обструкция брыжеечных сосудов частицей тканью опухоли, инородным телом или пузырьком воздуха, мигрировавшими от первичного источника поражения с током крови.
Острая окклюзия мезентериальных сосудов может протекать с компенсацией, субкомпенсацией и декомпенсацией мезентериального кровотока. При компенсации мезентериального кровотока (спонтанно или под воздействием консервативной терапии) все функции кишечника восстанавливаются полностью. Субкомпенсация мезентериального кровотока ввиду недостаточного кровоснабжения может приводить к ряду заболеваний кишечника: брюшной жабе, язвенным энтеритам и колитам и др. Декомпенсация мезентериального кровообращения вызывает распространенный гнойный перитонит и развитие тяжелого абдоминального сепсиса.
Симптомы острой окклюзии мезентериальных сосудов
Развернутой клинической картине острой окклюзии мезентериальных сосудов могут предшествовать предвестники заболевания, сходные с предынфарктным состоянием, – так называемая «брюшная жаба».
В большинстве случаев острая окклюзия мезентериальных сосудов имеет внезапное начало и на стадии ишемии (первые 6-12 часов) характеризуется невыносимыми, схваткообразными болями в животе. Пациент испытывает беспокойство, не находит себе места, принимает вынужденную позу с приведенными к животу ногами. Возникают тошнота и рвота с примесью желчи и крови, позднее рвота с каловым запахом, неоднократный жидкий стул с примесью крови («ишемическое опорожнение кишечника»).
Наблюдается резкая бледность кожных покровов, цианоз, шоковое состояние, повышение артериального давления на 60-80 единиц (симптом Блинова), брадикардия. Для острой окклюзии мезентериальных сосудов характерно несоответствие между тяжестью состояния больного и данными его осмотра: в первые часы живот остается мягким, брюшная стенка участвует в дыхании, отмечается незначительная болезненность без симптомов раздражения брюшины.
В стадии инфаркта (через 6-12 часов от начала острой окклюзии мезентериальных сосудов) болевые ощущения немного уменьшаются, но нарастает локальная (в зоне поражения кишки) болезненность при пальпации, между пупком и лобком может прощупываться тестовидная припухлость (симптом Мондора), ухудшается состояние больного. Эвакуаторная функция кишечника сохраняется, артериальное давление нормализуется, пульс учащается.
Диагностика
Распознавание острой окклюзии мезентериальных сосудов опирается на анализ клинической картины заболевания: острый болевой абдоминальный синдром, поражение сердца и сосудов в анамнезе. Важное диагностическое значение имеет исследование коагулограммы, определение количества тромбоцитов, холестерина крови.
При обзорной рентгенографии брюшной полости определяется пневматизация кишечника, наличие горизонтальных уровней жидкости в брюшной полости. Специфическим методом диагностики острой окклюзии мезентериальных сосудов является селективная мезентерикография, которая уже на ранней стадии заболевания может выявить отсутствие кровотока в стволе и ветвях брыжеечной артерии. При наличии технической возможности выполняется магнитно-резонансная ангиография мезентериальных сосудов.
Диагностическая лапароскопия позволяет обнаружить изменения кишечника и брюшной полости, наличие признаков анемического и геморрагического инфаркта кишки. Острую окклюзию мезентериальных сосудов дифференцируют от прободной язвы желудка и двенадцатиперстной кишки, острого аппендицита, кишечной непроходимости, острого панкреатита и острого холецистита.
Лечение острой окклюзии мезентериальных сосудов
При острой окклюзии мезентериальных сосудов показано экстренное хирургическое вмешательство, целью которого служит ревизия кишечника с оценкой его жизнеспособности, ревизия основных брыжеечных сосудов, устранение причины сосудистой непроходимости и восстановление мезентериального кровотока, резекция некротизированных отделов кишечника, профилактика перитонита.
Реваскуляризация кишечника выполняется путем непрямой эмбол- или тромбэндартериоэктомии, в трудных случаях проводится реконструктивное обходное шунтирование с использованием сосудистых протезов (протезирование верхней брыжеечной артерии).
При некрозе кишечника реваскуляризация дополняется частичной или обширной резекцией пораженных участков кишечника и активным назоинтестинальным дренированием для лечения послеоперационного пареза кишечника. Через 24-48 часов возможно выполнение релапаротомии с целью контроля состояния брюшной полости или наложения отсроченного анастомоза.
Пред- и послеоперационное ведение больного с острой окклюзией мезентериальных сосудов включает назначение антитромботических препаратов для профилактики повторной эмболии и ретромбоза; мероприятия интенсивной терапии с целью восстановления ОЦК, устранения интоксикации, улучшения кровотока и тканевого метаболизма, стабилизации сердечной деятельности. Проводится антибактериальная терапия, дренирование и санация брюшной полости для предупреждения гангрены и перитонита.
Прогноз и профилактика
Восстановление кровотока в брыжеечных артериях в течение первых 4-6 часов («золотой период») может предотвратить инфаркт кишечника и восстановить его функции. Как правило, оперативное вмешательство приходится на II и III стадии острой окклюзии мезентериальных сосудов, поэтому летальность после операции достигает 80-90%. Прогноз ухудшает наличие основного заболевания, приведшего к острому нарушению мезентериального кровообращения.
Профилактика острой окклюзии мезентериальных сосудов заключается в своевременном устранении потенциального источника тромбоэмболии, т. е. первичного заболевания (атеросклероза, мерцательной аритмии, ревматического порока сердца, аневризм и др.).
Синдром верхней брыжеечной артерии ( Артериомезентериальная компрессия двенадцатиперстной кишки , Синдром Уилки )
Синдром верхней брыжеечной артерии (СВБА) — это разновидность дуоденальной непроходимости, вызванной сдавлением 12-перстной кишки между верхней брыжеечной артерией и абдоминальным отделом аорты. Болезнь проявляется болями в животе после еды, тошнотой, рвотой, ощущением переполнения желудка. Для диагностики применяют инструментальные методики: рентгенографию ЖКТ с пероральным контрастированием, ЭФГДС, УЗИ и комбинированную компьютерную томографию. Лечение в основном консервативное: назначается щадящая диета и лекарственные средства (прокинетики, спазмолитики, ферменты). При декомпенсированном варианте синдрома показано хирургическое вмешательство.
МКБ-10

В медицинской литературе у СВБА есть несколько синонимов: артериомезентериальная или сосудистая компрессия двенадцатиперстной кишки, синдром Уилки. Заболевание встречается редко. Истинная распространенность неизвестна, что связано со сложностями диагностического поиска. Частота синдрома верхней брыжеечной артерии, по данным рентгенографии пассажа бария, составляет 0,013-0,3%. У женщин болезнь выявляется в 2 раза чаще. В 75% случаев сосудистая компрессия наблюдается у детей старше 10 лет, подростков и молодых людей до 30 лет.

Причины
Основным этиологическим фактором синдрома являются индивидуальные особенности анатомии гастродуоденальной зоны. Характерен угол около 20-25° (по сравнению с 30-60° в норме) между брюшной аортой и верхней брыжеечной артерией, из-за чего пространство между двумя сосудами сокращается до 10 мм и менее. Также отмечается высокое расположение связки Трейца, которая подтягивает горизонтальную часть 12-перстной кишки (ДПК) к вершине аортомезентериального угла.
Способствующие факторы
Дуоденальная компрессия происходит только при наличии провоцирующих факторов. Распространенные причины синдрома:
- резкое снижение веса, которое сопровождается сокращением объема висцерального жира − при этом расстояние между аортой и брыжеечной артерией уменьшается;
- поясничный лордоз, сколиоз;
- слабость мышц живота;
- строгий постельный режим после травм и операций.
Наиболее подвержены развитию синдрома верхней брыжеечной артерии подростки, у которых происходит быстрый скачкообразный рост без компенсаторного увеличения веса.
Патогенез
Хроническая дуоденальная непроходимость, связанная со сдавлением кишечника верхней брыжеечной артерией, развивается в 3 этапа. Для стадии компенсации характерно неполное перекрытие просвета органа и повышение внутрипросветного давления, что способствует прохождению пищи в нижележащие отделы ЖКТ. В этот период появляются стойкие нарушения трофики и микроциркуляции кишечной стенки, снижается поступление желчи и ферментов поджелудочной железы.
На этапе субкомпенсации дуоденальная перистальтика снижается. Обычно происходит обратный заброс содержимого в желудок, панкреатический проток или желчевыводящие ходы. Наиболее тяжело протекает стадия декомпенсации, которая проявляется дуоденостазом. Характерно патологическое расширение желудка и начальных отделов кишечника наряду с тотальной обструкцией артерией горизонтального участка двенадцатиперстной кишки.
Симптомы СВБА
В большинстве ситуаций синдром верхней брыжеечной артерии имеет хроническое течение, а его симптоматика нарастает постепенно. Острое начало заболевания возможно у больных с травмами позвоночника, ортопедическими проблемами или ожогами — состояниями, которые требуют длительной иммобилизации. Острый вариант синдрома манифестирует сильнейшими болевыми ощущениями в полости живота и кишечной непроходимостью.
Основной признак хронического сдавления ДПК верхней брыжеечной артерией — боли в эпигастрии, которые возникают спустя 20-40 минут после еды (постпрандиальный болевой синдром). Иногда боли появляются сразу после приема пищи. Болезненность достаточно ощутима, что вынуждает пациентов есть небольшими порциями или вовсе голодать. Для уменьшения дискомфорта человек принимает вынужденное положение: лежа на левом боку или на животе, стоя в коленно-локтевой позе.
Боли сопровождаются тошнотой и рвотой, чувством переполненного желудка. В рвотных массах содержится частично переваренная пища с включениями желчи. После рвоты больные чувствуют облегчение. Зачастую беспокоит горькая отрыжка, изжога. Характерно чувство раннего насыщения. Для декомпенсированной стадии характерно резкое похудение вплоть до истощения. При хроническом течении синдрома развивается апатия, снижается физическая и умственная трудоспособность.
Осложнения
При хроническом нарушении дуоденальной проходимости присоединяется желудочная патология. У 50% пациентов определяются гиперхлоргидрия и гиперацидный гастрит, который в 25-45% случаев переходит в язвенную болезнь. В субкомпенсированной стадии наблюдается дисфункция пилорического сфинктера, в результате чего формируется дуодено-гастральный рефлюкс. Повреждение желудочной стенки желчными кислотами проявляется в виде рефлюкс-гастрита.
Декомпенсированная стадия компрессии ДПК верхней мезентериальной артерией осложняется хроническим дуоденитом. Воспалительный процесс вызван свободным перемещением инфицированного желудочного содержимого в двенадцатиперстную кишку и обратно. В запущенных случаях синдрома снижается тонус сфинктера Одди, и застойное дуоденальное содержимое попадает в протоки. Как следствие, развивается хронический холецистопанкреатит, усугубляющий состояние больных.
На основании физикального обследования врачу-гастроэнтерологу трудно заподозрить артериомезентериальную компрессию ввиду отсутствия патогномоничных симптомов. Предположить сосудистый характер непроходимости можно у людей с астеничным телосложением, истощенных соматических или онкологических пациентов. Постановка диагноза синдрома верхней брыжеечной артерии основывается на применении ряда методов инструментальной диагностики:
- Рентгенологическое исследование.Рентгенография с контрастным веществом выявляет застой бария в сдавленной артерией горизонтальной части двенадцатиперстной кишки и замедленное опорожнение желудка (до 4-6 часов). Также визуализируется расширенная верхняя часть ДПК и стойкий дуоденогастральный рефлюкс. Еще один типичный признак — снижение перистальтики.
- ЭФГДС. При СВБА обнаруживают расширение желудка, а также начального отдела двенадцатиперстной кишки с патологическим сужением ее дистального отдела. При эндоскопическом исследовании визуализируется гиперемированная и отечная слизистая гастродуоденальной зоны. На декомпенсацию процесса указывает зияние сфинктера привратника.
- УЗИ гастродуоденальной зоны. Ультразвуковое исследование необходимо для наблюдения за сократительной функцией желудка и ДПК в режиме реального времени. Допплерография выполняется, чтобы оценить состояние брюшного отдела аорты, брыжеечных артерий, измерить сосудистый угол.
- КТ брюшной полости. Контрастирование пищеварительного канала с одновременной ангиографией абдоминальной части аорты назначается для верификации диагноза в сомнительных случаях. Исследование проводится для оценки стадии патологического процесса, измерения дуоденального просвета, величины угла, который образуют аорта и верхняя брыжеечная артерия.

Лечение синдрома верхней брыжеечной артерии
Консервативная терапия
В компенсированной и субкомпенсированной стадиях сосудистой компрессии проводится диетотерапия и медикаментозное лечение. Основные задачи консервативных мероприятий — усиление питания и уменьшение степени дуоденальной непроходимости. Лечебная диета предполагает прием жидкой, полужидкой и протертой пищи малыми порциями. Для коррекции состояния применяется ряд препаратов:
- Прокинетики. Лекарства стимулируют перистальтику ЖКТ, способствуя более быстрому продвижению химуса по пищеварительному каналу. Прокинетики нормализуют тонус мышечных сфинктеров, предотвращают дуоденальный рефлюкс.
- Спазмолитики. Назначаются короткими курсами перед приемом прокинетиков для снижения внутриполостного давления в 12-перстной кишке, которая сдавлена мезентериальной артерией. Препараты быстро устраняют боли и дискомфорт в эпигастральной зоне.
- Ферментные препараты. Для улучшения пищеварительной функции используют средства заместительной терапии с панкреатическими ферментами. Лекарства способствуют нормализации стула, уменьшают вздутие живота и диспепсические симптомы.
- Антибактериальные средства. Чтобы уменьшить риск гастродуоденитов, при дуоденальном рефлюксе рекомендуют кишечные антисептики, которые не оказывают системного действия. С целью подавления бактериальной инфекции показаны фторхинолоны, макролиды.
Хирургическое лечение
Критериями отбора больных для проведения оперативного вмешательства являются прогрессирующая потеря массы тела, выраженный дуоденостаз, развитие осложнений СВБА. Наиболее часто проводят дуоденоеюностомию, которая позволяет полностью устранить симптомы у 90% пациентов. В современной абдоминальной хирургии используют лапароскопическую операцию по разделению связки Трейца и уменьшению дуоденальной компрессии.
Сочетание медикаментозного лечения со специальной диетой показывает хорошие отдаленные результаты у пациентов с начальными стадиями синдрома. С учетом современных хирургических методов лечения прогноз благоприятен даже при декомпенсации заболевания. Меры профилактики включают своевременную коррекцию искривлений позвоночного столба, соблюдение рациональной диеты с адекватной калорийностью.
1. Синдром верхней брыжеечной артерии. Клинический случай в педиатрической практике/ Н.М. Тихон, М.П. Волкова, А.В. Хмеленко, А.И. Гринь // Вестник Витебского государственного медицинского университета. — 2016.
2. Синдром верхней мезентериальной артерии/ М.Б. Щербинина, В.Н. Гладун, С.И. Кожан, А.В. Семашко, С.И. Фещенко// Современная гастроэнтерология. — 2012.
3. Синдрома верхней мезентериальной артерии (синдром Уилки): клиническое наблюдение/ А.К. Графов, М.А. Халилов, Н.Н. Шевердин, А.Г. Алексеев // Российский вестник детской хирургии, анестезиологии и реаниматологии. — 2015.
4. Хроническая дуоденальная непроходимость. Т.Д. Звягинцева, И.И. Шаргород// Восточноевропейский журнал внутренней и семейной медицины. - №2 — 2016.
Влияние окклюзии верхней брыжеечной артерии на организм. Патогенез
До внедрения эффективного парентерального питания гангрена кишечника была несовместима с жизнью.
Полное прекращение артериального кровотока в кишечнике вызывает комплекс патофизиологических сдвигов, в которых можно выделить ряд основных звеньев.
Потеря жидкости при окклюзии верхней брыжеечной артерии. Окклюзия ВБА — вариант странгуляционной непроходимости кишечника. Достоверно установлено, что при этом состоянии потеря циркулирующего объема крови может составлять от 15 до 65% в зависимости от длины ущемленной петли.
В то время как при ущемлении короткой петли основной причиной смерти служат перфорация кишки и перитонит, ущемление длинной петли приводит к летальному исходу из-за потери жидкости. В классических экспериментах по воспроизведению такого типа кишечной непроходимости, которая в клинических условиях наблюдается при ущемленной грыже, в большинстве случаев вызывают поражение короткой петли кишки с окклюзией ее просвета, венозных и артериальных сосудов. Эта ситуация значительно отличается от полной ишемии средней части кишечника, при которой сохраняется проходимость венозных сосудов.
Однако и изолированное поражение артерий может приводить к большой потере внеклеточной жидкости. Объем крови у животных снижается в среднем на 34%. Объем циркулирующих эритроцитов уменьшается за то же время на 10%, тогда как объем плазмы — в среднем на 54%. Гематокрит непосредственно перед смертью животных достигает 65—70%. Такая массивная степень гемоконцентрации и потеря жидкости отмечаются в отсутствие сколько-нибудь выраженной портальной гипертензии, поэтому важно исключить в качестве причины указанных сдвигов хорошо известный синдром «обструкции печеночного оттока», который часто наблюдается у собак в ответ на стресс. На основании проведенных исследований можно прийти к выводу, что «утечка» плазмы в стенку и просвет кишки происходит из венозной части сосудистого русла через поврежденные кишечные капилляры.
Всасывание вазоактивных веществ из кишечника при окклюзии верхней брыжеечной артерии. В ишемизированном кишечнике образуются вазоактивные вещества, которые всасываются через брюшину, венозные и лимфатические сосуды. Эти вещества включают катехоламины, гистамин, 5-гидрокситриптамин (5-ГТ, серотонин), ферритин и такие ферменты, как бета-глюкуронидаза, трансаминазы, щелочная фосфатаза, диаминоксидаза и бета-N-ацетилгексозаминидаза. Кроме того, в крови воротной вены повышается содержание калия, фосфатов, гистамина и бактериального эндотоксина.
Ишемия кишечника служит причиной системных нарушений, которые могут проявиться задолго до гангрены, и даже массивного повреждения тканей.

Williams и его группа изучали ранние изменения миокарда при кратковременной ишемии тонкой кишки. Подтверждая и дополняя предшествующие исследования Bounous и соавт., Dogru и Atasoy, они показали, что через час окклюзии ВБА у собак отмечается значительное снижение сердечного выброса, сопровождаемое электрокардиографическими изменениями. При исследовании периферической крови был обнаружен миокардиальный депрессантный фактор (МДФ), идентифицированный по его действию на изолированные волокна миокарда крыс.
Аналогичные результаты получены Vyden, Nagasawa и Corday, изучавшими у собак изменения сердечно-сосудистой системы в ответ на острую окклюзию ВБА. Они установили, что вначале возникает транзиторное увеличение артериального давления, а также коронарного, почечного и мозгового кровотока, затем происходит нарастающее повышение системного сосудистого сопротивления в сочетании с падением кровотока во всех жизненно важных органах. Указанные изменения возникали рано, еще до значительного снижения объема плазмы, и не соответствовали тому, что можно было ожидать при выбросе серотонина из поврежденной кишки. Авторы поддерживают концепцию Lifer и Williams и полагают, что причиной этих расстройств служит миокардиальный депрессантный фактор, выделяющийся, вероятно, из ишемической поджелудочной железы.
Реваскуляризация кишки при окклюзии верхней брыжеечной артерии. Как уже отмечалось, если окклюзия ВБА сохраняется несколько часов, восстановление кровотока приводит к периферическому циркуляторному коллапсу и смерти животного.
Nelson и Kremen, определяя максимальное время толерантности собак к ишемии средней части кишечника, установили, что безопасная продолжительность окклюзии ВБА составляет 2 часа; снятие лигатуры с артерии через 3 часа окклюзии у 60% собак вызывает смерть, а через 4 часа погибают 80% животных.
При реваскуляризации ишемической кишки возникали кровоизлияния в ее просвет, сопровождавшиеся снижением объема плазмы и повышением гематокрита.
Несомненно, что реваскуляризация ишемической кишки небезопасна, и приведенные данные позволяют объяснить высокую летальность при мезентериальной эмболэктомии в клинической практике.
Zuidema и соавт. установили, что двухчасовая окклюзия ВБА у собак вызывает «утечку» в просвет кишечника поливинилпирролидона (ПВП), меченного 131I, а также сокращение содержание альбумина в сыворотке крови, уменьшение всасывания и транзиторное (в течение нескольких дней) снижение в крови концентрации азота мочевины. Содержание натрия и калия в сыворотке крови не изменяется.
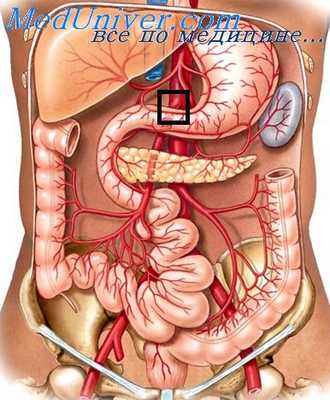
В наших исследованиях были подтверждены данные о резком падении артериального давления, периферического сопротивления и объема крови, которые возникают после устранения окклюзии ВБА. При этом было показано, что если до устранения окклюзии наблюдается в основном снижение объема плазмы, то реваскуляризация приводит к массивному кровотечению в стенку и просвет кишки, что само по себе вполне достаточно для объяснения причины смерти животных.
В последующих работах было показано, что подключение к циркуляции через ишемическую кишку здоровых собак доноров также ведет к гибели животных, причем летальный исход не предотвращается с помощью замещения крови. Это дает возможность предположить, что в таких условиях всасывание токсических веществ — менее значимый фактор летальности, чем кровотечение.
Эти давние исследования могли вызывать сомнения: во-первых, в них не придавалось значения роли селезенки в регуляции объема крови; во-вторых, для измерения общего объема крови использовался меченный йодом сывороточный альбумин, что, как установлено в настоящее время, может давать ошибочные результаты; в-третьих, выводы делались на основании экспериментов с перекрестным кровообращением без подбора животных по группе крови.
Однако последующие исследования с применением более совершенных методов подтвердили полученные данные.
Так, Chiu, Scott и Gurd, признавая значение всасывания таких токсических факторов, как гистамин и бета-глюкуронидаза, установили, что летальность собак после трехчасовой окклюзии верхней брыжеечной артерии может быть снижена с 89 до 36% с помощью адекватной инфузионной терапии. При этом восстановление мезентериального кровообращения после такого же периода окклюзии не вызвало циркуляторной недостаточности. Kangwalklai и соавт. провели тщательные и широкие исследования нарушений, возникающих во время трехчасовой окклюзии верхней брыжеечной артерии и после нее. Они подтвердили наши данные о нарастающей потере плазмы (по их данным — 3,9% в час в отличие от установленных нами 5%, что, впрочем, может быть обусловлено различиями в деталях эксперимента).
Однако после снятия зажима с артерии они обнаружили значительно меньшее снижение объемов крови и плазмы, хотя и установили сокращение объема общей и особенно внутриклеточной воды в организме. Позднее данные о большем снижении всего объема циркулирующей крови были получены Tjiong и соавт., работающими в той же группе, что и предыдущие исследователи.
Тем не менее этот вопрос нельзя считать окончательно решенным. В частности, имеются убедительные данные о том, что смертельный исход, связанный с реваскуляризациеи ишемического кишечника задолго до развития его полного некроза, часто не предотвращается поддержанием объема крови на нормальном уровне, в то время как обработка кишки с помощью различных мер, направленных на уменьшение образования эндотоксина и профилактику вазоконстрикции в кишечной стенке, способствует снижению летальности.
Оценка жизнеспособности кишки при окклюзии верхней брыжеечной артерии. Выяснение возможности восстановления сегмента кишки, поврежденного при ишемии, в клинических условиях представляется важным вопросом. Хорошо известна ненадежность такой оценки по цвету кишки, наличию артериальной пульсации и перистальтики.
Более совершенные методы включают тест восстановления бромида тетразолия и использование меченных альбумином микросфер, однако эти (в основном экспериментальные) методы не получили распространения в клинической практике, поскольку требуют сложного оборудования, наличие которого маловероятно в экстренной ситуации.
В настоящее время используются два метода — допплеровская ультразвуковая диагностика и внутривенное введение флюоресцеина.
Инфаркт кишечника
Инфаркт кишечника – это некроз кишечной стенки, связанный с острым прекращением кровотока по мезентериальным сосудам вследствие их эмболии или тромбоза. Характерным признаком является интенсивная боль в животе при полном отсутствии каких-либо объективных данных во время обследования пациента (живот мягкий, малоболезненный). Для уточнения диагноза проводится УЗИ и обзорная рентгенография ОБП, дуплексное сканирование и ангиография мезентериальных сосудов, лапароскопия. Консервативная терапия неокклюзионных форм патологии возможна только в первые часы заболевания, поздние стадии и остальные формы требуют хирургического лечения.
Инфаркт кишечника – острое нарушение мезентериального кровообращения с последующим некрозом кишки и развитием перитонита. Данная патология является одной из серьезных проблем абдоминальной хирургии. Чаще всего эмболия, тромбоз, атеросклероз и неокклюзионная ишемия сосудов кишечника возникают на фоне тяжелой патологии сердца. В связи с увеличением процента пожилого населения и омоложением сердечно-сосудистой патологии инфаркт кишечника встречается все чаще (0,63% сравнительно с единичными случаями в конце прошлого века). Средний возраст пациентов – 70 лет, преобладают женщины (более 60%). Учитывая солидный возраст больных и массу фоновых заболеваний, решить вопрос о хирургической тактике лечения бывает достаточно сложно.
Еще одной проблемой является то, что поставить диагноз достаточно сложно, а подтвердить его без проведения ангиографии до операции практически невозможно. Вследствие ошибочной диагностики затягивается предоперационная подготовка; за это время происходят необратимые изменения в кишке, приводящие к смерти пациента. Ситуация усугубляется тем, что в последние годы инфаркт кишечника значительно омолодился (каждый десятый пациент моложе 30 лет), а радикальная резекция кишечника в поздней стадии заболевания приводит стойкой инвалидизации.
Все причинные факторы, приводящие к инфаркту кишечника, можно разделить на три группы: тромботические, эмболические и неокклюзионные. Тромботический вариант патологии характеризуется тромбозом мезентериальных артерий (реже вен) в их проксимальных отделах. Чаще всего тромб локализуется в устье верхней брыжеечной артерии. К тромбозу висцеральных ветвей аорты может приводить повышенная свертываемость крови, полицитемия, сердечная недостаточность, панкреатит, травмы, опухоли, прием гормональных контрацептивов.
Эмболический вариант заболевания развивается при закупорке брыжеечных сосудов тромбоэмболами, мигрировавшими из проксимальных отделов сосудистого русла. Причиной этого чаще всего служат мерцательная аритмия, формирование пристеночных тромбов на фоне инфаркта миокарда, аневризмы аорты, выраженные нарушения коагуляции. После обтурации сосуда эмбол может смещаться в дистальные отделы и ветви сосуда, вызывая прерывистую, мигрирующую ишемию.
Неокклюзионный вид инфаркта кишки связан не с обтурацией висцеральных сосудов, а со снижением притока крови по ним. Причинами ограничения висцерального кровотока могут быть мезентериальный тромбоз, снижение фракции сердечного выброса, выраженная аритмия, спазм сосудов брыжейки, гиповолемия при шоке, сепсисе, обезвоживании. Факторы из перечисленных трех групп нередко комбинируются.
Классификация
Заболевание может протекать с компенсацией, субкомпенсацией и декомпенсацией кровотока. Кроме того, выделяют три последовательные стадии инфаркта кишечника: ишемии, инфаркта и перитонита. В первой стадии изменения в кишечнике еще обратимы, а клинические проявления в основном связаны с рефлекторными реакциями организма.
В инфарктной стадии происходит некроз кишечника, деструктивные изменения продолжаются даже после восстановления кровотока. Защитные свойства кишечной стенки постепенно ослабевают, бактерии начинают проникать сквозь все ее слои в брюшную полость. В стадии перитонита происходит распад тканей кишечной стенки, геморрагическое пропотевание с развитием тяжелейшего воспаления брюшины.
Симптомы инфаркта кишечника
Первая стадия патологии (ишемическая) обычно длится не более шести часов. В этот период пациента беспокоят сильные боли в животе, вначале схваткообразные, затем постоянные. Локализация боли зависит от того, какой отдел кишечника поражен: при ишемии тонкой кишки беспокоит боль в околопупочной области, восходящей и слепой кишки – в правой половине живота, поперечно-ободочной и нисходящей – в левой половине.
Боль очень сильная, однако не соответствует полученным при осмотре пациента объективным данным. При пальпации живот мягкий, малоболезненный. Для данного заболевания характерно острое появление болевого синдрома, однако возможно и постепенное, иногда двухэтапное начало заболевания. Кроме болей в животе, больной может жаловаться на тошноту, рвоту, диарею. Аускультация живота в начальной стадии выявляет повышенную перистальтику, которая постепенно ослабевает в течение нескольких часов.
В стадиях инфаркта и перитонита состояние больного прогрессивно ухудшается. Кожные покровы бледные, сухие. Боль постепенно ослабевает, а при полном некрозе стенки кишечника полностью исчезает, что является плохим прогностическим признаком. Язык сухой, с налетом. Живот вздутый, но поскольку для патологии характерно позднее появление симптомов раздражения брюшины, живот долгое время остается мягким.
Патогномоничен симптом Кадьяна-Мондора: при пальпации в брюшной полости определяется цилиндрическое плотно-эластичное образование, малосмещаемое и болезненное - отекший участок кишки и брыжейки. При аускультации брюшной полости участки тимпанита (звонкого звука над перераздутыми петлями кишечника) чередуются с участками притупления звука (над некротизированными петлями). Выпот в брюшной полости (асцит) может формироваться уже через несколько часов от начала заболевания.
Если заболевание прогрессирует, явления интоксикации и обезвоживания нарастают, больной становится безучастным, апатичным. Даже если начать оказание помощи пациенту на этой стадии, состояние может прогрессивно ухудшаться, наступает кома, начинаются судороги. На заключительном этапе болезни смертность достигает практически 100%.
Низкая информированность врачей догоспитального этапа об инфаркте кишечника значительно затрудняет своевременную диагностику. Позднему выявлению данной патологии способствует недостаточная оснащенность стационаров диагностическим оборудованием (ангиограф, компьютерный томограф). Однако заподозрить инфаркт кишечника можно и с помощью другим методов исследования. На УЗИ органов брюшной полости выявляется утолщенная стенка кишечника, наличие свободной жидкости в брюшной полости. Дуплексное цветное ультразвуковое сканирование является единственным достоверным УЗ-методом диагностики тромбоза мезентериальных сосудов.
Обзорная рентгенография органов брюшной полости информативна на более поздних стадиях, когда становятся видны чаши Клойбера, кишечные арки. Проведение контрастной рентгенографии не рекомендуется, так как она не предоставляет каких-либо ценных для постановки диагноза данных, но значительно затягивает этап диагностики. МСКТ органов брюшной полости позволяет провести более точное исследование петель кишечника (дает возможность обнаружить газ в брыжейке и стенке кишки), а МРТ мезентериальных сосудов – оценить состояние сосудистого русла, обнаружить тромбы и эмболы.
Наиболее точным методом исследования является ангиография мезентериальных сосудов. Данное исследование рекомендуют проводить в двух проекциях – прямой и боковой. Такая методика позволяет вычислить точную локализацию патологического процесса, выявить пораженные ветви висцеральных сосудов, определить тактику и объем оперативного вмешательства. Помогает в диагностике и определении лечебной тактики и консультация врача-эндоскописта.
Диагностическая лапароскопия дает возможность визуально оценить состояние петель кишечника, выявить некоторые патогномоничные для инфаркта кишечника признаки. К ним относят изменение цвета кишечной стенки, отсутствие пульсации краевых сосудов, изменение сосудистого рисунка (продольный вместо поперечного). Выявление данных признаков позволяет выставить показания к ургентной операции даже при невозможности проведения ангиографии. Противопоказаниями к лапароскопии являются выраженное вздутие кишечника, наличие обширных лапаротомий в анамнезе, крайне тяжелое состояние пациента.
Специфических лабораторных признаков патологии, особенно в начальных стадиях заболевания, не существует. В общем анализе крови по мере развития заболевания нарастает лейкоцитоз, сдвиг лейкоформулы влево. Анализ кала на скрытую кровь также становится положительным на стадии некроза кишечника. Некоторые авторы указывают на повышение уровня лактата в крови как на специфичный признак инфаркта кишечника.
Лечение инфаркта кишечника
Цель лечения – устранение всех патогенетических звеньев заболевания. Один из основополагающих принципов терапии тромбоза мезентериальных сосудов – раннее начало фибринолиза. Однако начало патогенетического лечения на догоспитальном этапе возможно только теоретически, потому что этот диагноз практически никогда не ставится до госпитализации пациента и обследования с участием абдоминального хирурга.
Сразу после госпитализации начинают коррекцию патологии, которая привела к развитию инфаркта кишечника, одновременно с инфузионной терапией. Инфузия кристаллоидных и коллоидных растворов призвана возместить недостающий объем циркулирующей крови, восстановить перфузию ишемизированных участков кишки. Начиная кардиотропную терапию, следует отказаться от использования вазопрессоров, так как они вызывают спазм сосудов брыжейки и усугубляют ишемию. При неокклюзионной ишемии показано введение спазмолитиков для улучшения висцерального кровотока.
Консервативная терапия оправдана только при отсутствии у пациента признаков перитонита. Наибольшая эффективность достигается при терапии, начатой в первые два-три часа от появления симптоматики. Чем дольше будет длиться этап консервативного лечения, тем меньше шансов на благоприятный исход, поэтому этап нехирургической терапии должен быть максимально кратким. При отсутствии быстрого эффекта проводится ургентная операция. То же касается и предоперационной подготовки – чем она короче, тем выше шансы на выздоровление.
Радикальными считаются лишь оперативные вмешательства на сосудистом русле (при наличии показаний - в сочетании с резекцией кишечника). Изолированная резекция некротизированной кишечной петли без удаления тромба из сосуда не устраняет основной патогенетический механизм возникновения инфаркта кишечника, а значит – не приводит к улучшению состояния пациента. Если оперативное вмешательство произведено в сроки более 24 часов от начала заболевания, лапаротомия в 95% случаев лишь констатирует необратимые изменения в большей части кишечника. Радикальная резекция пораженной кишки в такой ситуации не предотвращает смерти больного.
Если была произведена обширная резекция кишечника, в послеоперационном периоде пациенту может потребоваться консультация гастроэнтеролога для определения тактики энтерального и парентерального питания. Иногда такие пациенты требуют пожизненного частичного или полного парентерального питания с помощью внутривенного введения углеводов, белковых и жировых фракций.
Прогноз неблагоприятный, так как заболевание редко своевременно диагностируется, а на поздних стадиях оперативное лечение часто бывает неэффективным. Несмотря на усовершенствование диагностических и лечебных мероприятий, смертность при различных формах патологии достигает 50-100%. Профилактика инфаркта кишечника заключается в своевременном лечении приводящих к нему заболеваний (аортальные и митральные пороки сердца, аритмии, атеросклероз, тромбофилии).
Читайте также:
