Классификация лейкодистрофий по поражению клеток, нарушению метаболизма
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Глобоидно-клеточная лейкодистрофия (GLD, болезнь Краббе) - причины, диагностика, лечение
Глобоидно-клеточная лейкодистрофия (GLD, болезнь Краббе) является аутосомно-рецессивным заболеванием, вызванным дефицитом галактоцереброзид-бета-галактозидазы (галактоцереброзидазы) (Suzuki et al., 1971). Ген находится на хромосоме 14q24—32.1. Галактоцереброзиды являются наиболее специфичными липидами миелина головного мозга; их концентрация отражает созревание. Выделяют три подтипа GLD: наиболее распространенную младенческую форму и редкие формы (ювенильную и взрослую).
Нейропатология болезни Краббе характеризуется недостаточностью олигодендроцитов, отсутствием миелина и пролиферацией глиальных клеток в пораженных участках в сочетании с мононуклеарными эпителиоидными клетками и скоплениями крупных многоядерных глобоидных клеток. Поражение периферической нервной системы встречается часто, но может быть выражено не так сильно, как при MLD. Дефицит галактоцереброзид-бета-галактозидазы приводит к накоплению цереброзидов и психозина (галактозил сфингозина). Многие симптомы, отмечаемые при GLD, связаны с повышением уровня психозина, которые оказывает токсическое действие (Suzuki, 2003).
Наиболее распространенная младенческая форма манифестирует обычно в виде гипотонии, развивающейся до шестимесячного возраста. Кроме того, характерными симптомами являются чрезвычайная возбудимость, особенно заметны вздрагивание при громких звуках и прогрессирующая ригидность. При осмотре выявляется повышение мышечного тонуса и пирамидные знаки, а также опистотонусные судороги с ретракцией головы, часто вызываемые внешним воздействием.
Часто отмечаются судороги, которые могут представлять собой инфантильные спазмы с атипичным гипсаритмическим ЭЭГ-паттерном. Отсутствие глубоких сухожильных рефлексов часто контрастирует со спастичностью. Развивается атрофия зрительного нерва и слепота. Болезнь прогрессирует стремительно и смерть обычно наступает в возрасте до двух лет. Выделены клинические стадии болезни Краббе (Hagberg et al., 1969).
Во всех случаях инфантильной формы заболевания отмечается высокий уровень белка (более 70 мг/дл) в спинномозговой жидкости, а скорость проводимости нервов снижена. При формах с поздним началом уровень белка в спинномозговой жидкости может не отличаться от нормы. На МРТ в области белого вещества мозжечка выявляется снижение плотности в режиме Т1 и повышение плотности в режиме Т2. При МР-спектроскопии в пораженном белом веществе выявляется заметное повышение уровня инозит и холин-содержащих веществ, что отражает демиелинизацию и глиальную пролиферацию, сопровождающуюся снижением N-аспартил ацетата, что является признаком утраты нейронов (Brockmann et al., 2003а).
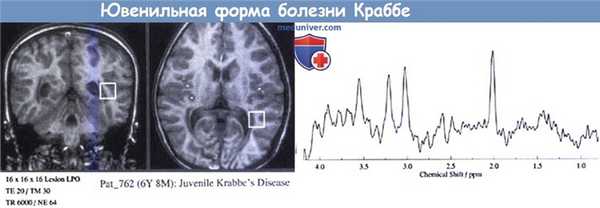
Ювенильная форма болезни Краббе.
На МРТ (вверху) видны только небольшие аномалии сигнала белого вещества.
Заметен низкий сигнал в области таламуса.
На МР-спектроскопии (внизу) видны высокие пики холина и миоинозитола и низкие лики N-ацетиласпартовой кислоты.
Диагностика GLD основана на характерных клинических симптомах, повышении уровня белка в спинномозговой жидкости и изменениях на МРТ. При позднем начале заболевания ключевые симптомы менее характерны и включают трудности при ходьбе, снижение зрения и трудности в обучении. При любой лейкодистрофии в сочетании с легкой периферической нейропатией следует подозревать GLD. Диагноз подтверждается путем оценки уровня галактоцероброзид-бета-галактозидазы в лейкоцитах и фибробластах.
Молекулярный анализ может выявить одну из более 60 мутаций, описанных при болезни Краббе (Kleiyer et al., 1997; Wenger et al., 1997).
Лечение имеет симптоматический характер. Бензодиазепины в высоких дозах могут быть эффективны для устранения чрезвычайной возбудимости и опистотонуса у некоторых пациентов. Предпринимались попытки трансплантации стволовых гемопоэтических клеток, но полученные результаты неоднозначны (Krivit et al., 1998). В последнее время восстановление нормального уровня галактоцереброзида в крови было достигнуто у 11 новорожденных с бессимптомным течением заболевания и 14 младенцев с симптомами болезни Краббе; результаты были достигнуты благодаря трансплантации пуповинной крови неродственных доноров (Escolar et al, 2005).
У младенцев, которым трансплантация была проведена до появления симптомов, в течение всего периода наблюдения (до трех лет) отмечалось прогрессирование центральной миелинизации, развитие и приобретение навыков в соответствии с возрастом. Трансплантация, проведенная после появления симптомов, не приводила к стойкому улучшению.
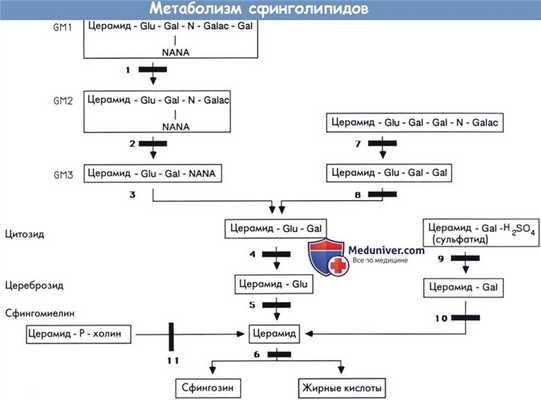
Метаболизм сфинголипидов.
Gal—галактоза. Glu—глюкоза. N-Galac—N-ацетилгалактозамин. NANA—нейраминовая кислота (N-ацетилнейраминовая кислота).
1 — β-галактозидаза. 2 — β-гексозаминидаза А (болезнь Тея-Сакса) и другие ганглиозидозы типа II GМ2.
3 — GM3 сиалидаза. 4 — лактозилцекамидаза (лактозилцерамидоз). 5 — β-глюкозидаза (глюкоцереброзидаза) (болезнь Гоше).
6 — церамидаза (болезнь Фарбера). 7 — β-гексозаминидаза В (болезнь Сандгоффа и другие О варианты GM2 ганглиозидозов).
8 — церамид-тригексозидаза/α-галактозидаза (болезнь Фабри). 9 — цереброзидсульфатаза/арилсульфатаза* (метахроматическая лейкодистрофия).
10 — β-галактозидаза/β-галактоцереброзидаза (болезнь Краббе). 11 — сфингомиелиназа (болезнь Ниманна-Пика А и В).
*Активность, оцененная на искусственных субстратах, не всегда соответствовала активности цереброзиодсульфатазы.
Классификация лейкодистрофий по поражению клеток, нарушению метаболизма
Лейкодистрофии представляют собой группу генетических заболеваний, поражающих белое вещество головного мозга и при некоторых заболеваниях также периферический миелин. В настоящее время отсутствует классификация, учитывающая все клинические проявления, морфологические нарушения или метаболические или генетические изменения. В широком смысле лейкодистрофии определяются как генетические поражения белого вещества головного мозга.
Лейкодистрофии также относятся к большой группе состояний, преимущественно поражающих белое вещество, называемых лейкоэнцефалопатиями, которые включают многие заболевания, поражающие белое вещество, но имеют скорее негенетическое происхождение. Лейкоэнцефалопатии приводят к формированию выявляемых с помощью визуализации проявлений, напоминающих проявления лейкодистрофий, что является основанием для дифференциальной диагностики.
Первоначально классификация основывалась на морфологических характеристиках; примером являются глобоидно-клеточная лейкодистрофия (болезнь Краббе), метахроматическая лейкодистрофия и суданофильная лейкодистрофия. Последний термин в последнее время употребляется все реже в связи с улучшением понимания генетической этиологии большинства лейкодистрофий. Понятия демиелинизация, дисмиелинизация и гипомиелинизация описывают возможные патофизиологические изменения.
Демиелинизация представляет собой деградацию структурно и биохимически нормального миелина (например, при рассеянном склерозе), дисмиелинизация характеризуется структурно и биохимически аномальным или нестабильным миелином (например, при адренолейкодистрофии), в то время как гипомиелинизация указывает на нарушение и отсрочку формирования миелина (например при болезни Пелицеуса-Мерцбахера). Демиелинизация может встречаться при всех трех состояниях, поражая обычно олигодендроциты и макрофаги как основные клеточные компоненты.
Результаты исследований последних лет свидетельствуют о признаках поражения белков внеклеточного матрикса при стабилизации мембраны миелина (например, при альфа-саркогликанопатиях). Аксонопатии и нарушения нейрофиламентов также могут играть важную роль в поддержании стабильности миелина. Недавно обсуждалась роль дисфункции астроцитов в качестве фактора демиелинизации (Seifert et al., 2006). Несмотря на все диагностические усилия и прогресс современной неврологии, радиологии, биохимии и генетических методик, существенная доля лейкодистрофий детского возраста остается неклассифицированной, а патогенез многих заболеваний белого вещества головного мозга неустановлен.
Несмотря на то, что обычно лейкодистрофия проявляется в раннем детском возрасте, возрастной диапазон начала заболевания варьирует от пренатального периода (врожденное заболевание) до взрослого возраста. Лейкодистрофии представляют собой классический вариант поражения белого вещества. Тем не менее, поражение серого вещества с возрастающей частотой выявляется в качестве проявления многих заболеваний, начинающихся в раннем возрасте.
Классификация лейкодистрофий преимущественно основана на изменениях клеточных органелл (лизосом, пероксисом, митохондрий), структурных элементов (нейрофиламентов, альфа-саркогликана) и метаболических процессов. В таблице ниже приведена классификация лейкодистрофий в соответствии с наличием или отсутствием известных метаболических или генетических дефектов. Большая группа недавно идентифицированных заболеваний белого вещества описана отдельно как «прочие заболевания». Будущая классификация, вероятно, будет основана на индивидуальных генетических дефектах.
С клинической точки зрения лейкодистрофии характеризуются преобладанием моторных нарушений, особенно пирамидных и мозжечковых симптомов, медленной умственной деградацией, низкой частотой припадков, миоклонуса и пароксизмальных ЭЭГ аномалий. При визуализации при всех лейкодистрофиях отмечается поражение белого вещества, лучше всего выявляемое при МРТ, выраженность поражения может быть различной, и в некоторых случаях требуется применение новейших методик визуализации. МРТ признаки поражения белого вещества описаны van der Knaap и Valk (2005), а аномалии, выявляемые при МР-спектроскопии — Hanefeld et al. (2004).
Метахроматическая лейкодистрофия (MLD) - причины, диагностика, лечение
Метахроматическая лейкодистрофия (MLD) впервые была описана Scholz и Greenfield. Scholz выявил генетическое происхождение заболевания и выделил его из группы болезней, описываемых как диффузный склероз. Типичные признаки в виде метахромазии при окрашивании крезил-фиолетом или толуидиновым синим в кислом растворе отделяют заболевание от так называемых ортохроматических или суданофильных лейкодистрофий. Окрашивание специфично выявляет сульфатиды, присутствующие не только в тканях головного мозга, но и в нервах и множестве соматических тканей, таких как почки, печень и яичники, а также в моче. Кроме метахромазии в периферических нервах также отмечается сегментарная демиелинизация.
Выявление метахроматического материала в эпителиальных клетках в моче до сих пор является полезным диагностическим тестом.
Метахроматическая лейкодистрофия (MLD) является аутосомно-рецессивным заболеванием, по оценкам с частотой 1 на 40000. Причиной заболевания является дефицит арилсульфатазы A (ARSA). Дефицит ARSA приводит к накоплению цереброзид сульфата (сульфатида). Генетический дефект локализован на 22 хромосоме (Polten et al., 1991). Накопление сульфатидов приводит к повреждению центрального и периферического миелина. Концентрация сульфатидов в пораженных тканях повышается, а концентрация цереброзида снижается.
Кроме аллелей ARSA (частота 0,5%), являющихся причиной MLD, существуют другие ARSA-аллели (частота 7-15%), называемые псевдодефицитным ARSA-геном (ARSA-PD) (Gieselmann et al., 1991). У 10-20% гомозигот по данному аллелю отмечается сниженная активность ARSA, но клинические симптомы и сульфатидурия не развиваются. Гомозиготность по ARSA-PD часто встречается в общей популяции; пациентам, у которых причиной неврологических симптомов является не ARSA-PD, может быть ошибочно установлен диагноз MLD. Псевдодефицитный аллель может быть выявлен непосредственно при исследовании ДНК. Кроме того, в редких случаях MLD может быть вызван мутациями, затрагивающими активатор белка (сапонин В), кодируемый геном на участке 10q21—22. Активатор белка активирует не только гидролиз сульфатидов под действием ARSA, но и гидролиз GM1-ганглиозидов.
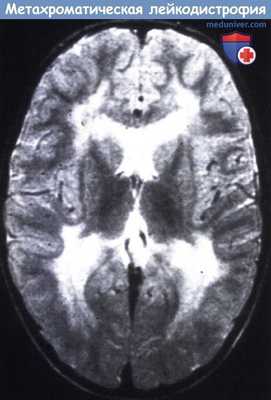
Дефицит сапонина В может приводить к ювенильной или (в редких случаях) поздней младенческой форме MLD, но гистологически также отмечается накопление ганглиозидов. Диагностика проводился в культуре фибробластов: патологический метаболизм может быть восстановлен активатором белка (Gieselmann, 2003).
В соответствии с возрастом начала заболевания можно выделить три клинических типа MLD: поздний младенческий (40%), ювенильный (40%) и взрослый (20%). Поздняя младенческая форма является наиболее гомогенной и возникает в возрасте от шести месяцев до двух лет. У детей отмечается задержка развития или утрата способности к ходьбе: некоторые дети не способны ходить самостоятельно. Походка характеризуется спастичностью и атаксией. Может отсутствовать ахиллов рефлекс в сочетании с наличием двустороннего рефлекса Бабинского. В дальнейшем течении заболевания в клинической картине преобладают атрофия зрительного нерва и более генерализованная спастичность (MacFaul et al., 1982). Прогноз неблагоприятный, смерть наступает до 10 лет.
Время появления симптомов при ювенильной форме варьирует, заболевание может начинаться в возрасте 4-6 лет. Наблюдается нарушение походки в сочетании с трудностями обучения и поведенческими проблемами. Двигательные симптомы включают мозжечковые и пирамидные нарушения, а также признаки периферической нейропатии. Припадки и деменция являются поздними проявлениями. В случае начала заболевания во взрослом возрасте в клинической картине преобладают нарушения походки, экстрапирамидные симптомы и психиатрические отклонения.
Метахроматическую лейкодистрофию (MLD) следует подозревать у всех детей с прогрессирующими спастическо-атаксическими симптомами и парадоксальным отсутствием ахиллова рефлекса при наличии рефлекса Бабинского. При осмотре глазного дна может выявляться атрофия зрительного нерва. Показатели ЭЭГ обычно не отличаются от нормы или позволяют выявить некоторую медленную активность и эпилептиформные разряды на поздних стадиях заболевания. Электроретинограмма сохраняется неизмененной. Скорость проводимости чувствительных и двигательных нервов снижена. Практически всегда выявляется повышенное содержание белка в спинномозговой жидкости.
При всех трех типах заболевания на КТ и МРТ отмечаются изменения перивентрикулярного белого вещества с преобладанием поражения в лобной области. При ювенильной и взрослой формах заболевания U-волокна сохраняются, отмечается раннее поражение мозолистого тела, в пирамидном тракте могут выявляться признаки демиелинизации. Диагноз подтверждается на основании определения уровня ARSA и метахроматического материала в моче.
В настоящее время эффективные методы лечения отсутствуют. Предпринимались попытки трансплантации костного мозга или стволовых клеток гемопоэза, но полученные результаты имели противоречивый характер. В последнее время поднят вопрос о поддерживающей терапии арилсульфатазой-А (Matzner и Gieselmann, 2005).
Метахроматическая лейкодистрофия
Метахроматическая лейкодистрофия — аутосомно-рецессивно наследуемая демиелинизирующая патология ЦНС, отличительной особенностью которой является метахроматическое окрашивание зон демиелинизации. В клинике преобладает задержка развития, парезы, судорожные приступы, экстрапирамидные и мозжечковые расстройства, нарушение зрения. В ходе диагностики проводится исследование цереброспинальной жидкости, уровня сульфатидов, активности арилсульфатазы А, КТ/МРТ головного мозга, генетические обследования. Возможна пренатальная диагностика. Лечение симптоматическое, в отдельных случаях проводится трансплантация пуповинной крови или стволовых клеток.
Общие сведения
Метахроматическая лейкодистрофия — один из основных видов лейкодистрофии, характеризующийся, как и другие ее типы, задержкой психомоторного развития, расстройством психики, спастическими парезами, мозжечковым синдромом, экстрапирамидными нарушениями, судорожным синдромом и атрофией зрительных нервов. Встречается в популяции с частотой 1 случай на 40 тыс. Наследуется аутосомно-рецессивно. Впервые выделена как нозологическая форма в 1910 г. Альцгеймером, подробно описана в 1925 г. Шольцем. Время манифестации заболевания существенно варьирует и обуславливает его клиническое течение. В соответствии с этими особенностями выделяют несколько вариантов патологии: врожденную (раннедетскую) форму, позднедетскую форму Гринфилда, ювенильную форму Шольца и взрослую форму. Наиболее часто наблюдается познедетская форма. В виду отсутствия эффективных способов лечения метахроматическая лейкодистрофия является проблемной патологией для современной педиатрии, неврологии и генетики.
Причины
Основным субстратом заболевания выступает дефект расположенного на 22-й хромосоме гена, ответственного за синтез арилсульфатазы А. Результатом дефицита указанного энзима является блокировка метаболизма сульфатида в галактоцереброзид. Сульфатиды откладываются в белом веществе головного и спинного мозга, коже, соматических органах (печени, легких, сердце, почках) и в костях. Однако при этом функция внутренних органов не страдает (исключением является желчный пузырь), а в мозговом веществе происходят прогрессирующие дегенеративные изменения, ведущие к гибели заболевшего.
Отложение сульфатидов в нервной ткани приводит к разрушению миелина и накоплению продуктов его распада. В процесс демиелинизации вовлекаются не только структуры ЦНС, но и периферические нервные стволы. В головном мозге формируются диффузные очаги демиелинизации, дающие при их гистохимическом исследовании метахроматическое окрашивание.
Симптомы метахроматической лейкодистрофии
Врожденная метахроматическая лейкодистрофия дебютирует до 3-месячного возраста задержкой развития и эписиндромом. Быстро присоединяется спастический парез, расстройства глотания. Дети погибают на 1-ом году жизни.
Позднедетская метахроматическая лейкодистрофия (поздняя инфантильная форма) обычно манифестирует на 2-ом году жизни ухудшением моторики и задержкой психического развития. Отмечается неустойчивая походка, понижение мышечного тонуса. В течении позднедетской формы различают 4 периода. Первый характеризуется мышечной гипотонией и слабостью, угасанием сухожильных рефлексов, затруднением ходьбы. Длится от 1-3 мес. до 1 года, иногда и дольше. Второй период знаменуется выраженным отставанием в интеллектуальной сфере, сменой гипотонии на гипертонию мышц. Ребенок утрачивает способность стоять. Наблюдается дизартрия, атрофия зрительных нервов. Период занимает несколько месяцев. В третьем периоде отмечается тетраплегия, тяжелая олигофрения, бульбарный и псевдобульбарный паралич. Четвертый период сопровождается утратой реакций на окружающие события. Ребенок не говорит, не может принимать пищу, развивается полная слепота. При хорошем уходе и кормлении через гастростому или желудочный зонд данный период может продолжаться 1-2 года.
Ювенильная метахроматическая лейкодистрофия начинается после 3-летнего возраста в периоде до 10 лет (чаще в возрасте около 6 лет). Дебютирует эмоциональной лабильностью, изменениями в поведении, снижением когнитивных функций (у школьников происходит резкое ухудшение успеваемости), атаксией, затруднениями при ходьбе. Зачастую отмечаются эпиприступы. Заболевание неуклонно прогрессирует и, в зависимости от начала симптоматики, к 10-15 годам жизни приводит к летальному исходу.
Взрослая метахроматическая лейкодистрофия манифестирует после пубертата, может возникать до 60-летнего возраста. Как правило, имеет начало с психических расстройств шизофреноподобного или психопатического характера, отчего заболевшие первоначально становятся пациентами психиатра. В отдельных случаях дебют происходит с симптомов полиневропатии. Развитие патологических изменений происходит медленнее, чем при других возрастных вариантах заболевания. В позднем периоде развиваются тетрапарез, бульбарные нарушения, деменция. Летальный исход наблюдается спустя 10-20 лет от начала симптоматики.
Диагностика метахроматической лейкодистрофии
Диагностические мероприятия имеют комплексный характер и позволяют отдифференцировать метахроматическую лейкодистрофию от других нейродегенеративных заболеваний и других форм лейкодистрофии. Проводится люмбальная пункция, при исследовании цереброспинальной жидкости определяется повышенная концентрация белка, дефицит арилсульфатазы, белково-клеточная диссоциация. Электромиография выявляет увеличение длительности проведения нервных импульсов. КТ головного мозга визуализирует расширенные желудочки и определяет пониженную плотность белого церебрального вещества. МРТ головного мозга выявляет очаги демиелинизации.
Важное диагностическое значение имеют биохимические исследования: определение сульфатидов в крови и моче, оценка активности арилсульфатазы А в лейкоцитах взятой на анализ крови. Пациентам показана консультация генетика с проведением генеалогического исследования; возможна ДНК-диагностика. Разработан также метод пренатальной диагностики патологии — определение активности арилсульфатазы А в клетках полученной при амниоцентезе амниотической жидкости. Исследования показали, что у носителей патогенного гена также отмечается сниженный уровень арилсульфатазы А. В связи с этим вместо пренатальной диагностики плода предлагается обследовать родителей будущего ребенка, чтобы избежать медаборта плода, являющегося лишь носителем дефектного гена.
Лечение метахроматической лейкодистрофии
Терапия, способная предотвратить летальный исход заболевания, пока не найдена. Осуществляется лечение, направленное на купирование его отдельных симптомов: противосудорожная терапия, борьба с контрактурами суставов; на поздних стадиях — профилактика пролежней, парентеральное питание. Проводится поиск более эффективных способов лечения, особенно в области генной терапии.
Предпринимаются попытки лечения путем трансплантации костного мозга и пуповинной крови. У ряда пациентов пересадка стволовых клеток позволяет добиться временной стабилизации состояния и замедления прогрессирования патологических изменений. Донором стволовых клеток обычно выступает родственник больного, не имеющий лейкодистрофии и тщательно обследованный. Однако следует помнить, что сама трансплантация может повлечь за собой целый ряд осложнений: отторжение, интеркурентные инфекции, реакцию «трансплантат против хозяина». Кроме того, при быстром прогрессировании симптомов летальный исход опережает наступление эффекта трансплантации.
Прогноз
Пока не найдена эффективная терапия лейкодистрофий, она имеет крайне неблагоприятный прогноз. При врожденной форме дети не доживают до 1 года. При позднедетском варианте продолжительность болезни, как правило, не превышает 4 года, при ювенильном — 6 лет. Среди пациентов со взрослой формой известны отдельные случаи, когда продолжительность жизни составила около 50 лет. Пока единственным способом предупреждения лейкодистрофии является недопущение рождения ребенка, имеющего соответствующую генную мутацию. В этом плане основное значение имеет генетическое консультирование пар, планирующих деторождение, а также обследование будущих родителей из группы риска на степень активности арилсульфатазы А.
Лейкодистрофия
Лейкодистрофия — нейродегенеративное заболевание, обусловленное наследственным нарушением обмена веществ с накоплением в головном и спинном мозге метаболитов, провоцирующих разрушение миелина. Манифестирует в основном в детском возрасте задержкой психомоторного развития, двигательными расстройствами, поражением зрительных и слуховых нервов, гидроцефалией, эпилептическими приступами. Диагностируется лейкодистрофия по данным неврологического статуса, анамнеза, генетических исследований, МРТ или КТ картины головного мозга, биохимических анализов. Лечение симптоматическое. При раннем выявлении и медленном прогрессировании возможна трансплантация пуповинной крови или костного мозга.
МКБ-10
Лейкодистрофия получила свое название в связи с поражением белого вещества мозга (с греческого leukos — белый). Различают около 60 разновидностей лейкодистрофии, определяющихся видом генной аномалии и возрастом манифестации клинических проявлений. Наряду с отдельными воспалительными поражениями ЦНС (например, лейкоэнцефалитом Шильдера) лейкодистрофия относится к синдрому диффузного склероза мозга. При этом доминирующее поражение миелина сближает ее с демиелинизирующими заболеваниями (рассеянным склерозом, РЭМ и пр.), а отдельные формы можно отнести к липидозам.
К основным формам лейкодистрофии относятся метахроматическая, суданофильная, глобоидно-клеточная, дегенерация Ван-Богарта-Бертрана, болезнь Александера, вариант Галлервордена-Шпатца. Наиболее распространены первые 3 вида лейкодистрофии. Их встречаемость колеблется от 0,4 до 1 случая на 100 тыс. новорожденных. Ряд форм лейкодистрофии являются настолько редкими, что в мировой литературе по неврологии описано всего несколько сотен их клинических наблюдений. В зависимости от возрастного периода, в котором дебютирует лейкодистрофия, каждая ее форма может подразделяться на инфантильный, поздний инфантильный, ювенильный и взрослый вариант.
Причины возникновения лейкодистрофии
В своей основе каждая лейкодистрофия имеет генетическую аномалию определенного фермента. Вид аномалии и локализация генной мутации пока установлены лишь для наиболее встречающихся форм патологии. В большинстве случаев лейкодистрофия имеет аутосомно-рецессивный путь наследственной передачи, однако отдельные ее формы могут наследоваться сцеплено с полом. Кроме того, не одиноки случаи спонтанных мутаций. Генетически детерминированный энзимный дефект ведет к обменным нарушениям (чаще в метаболизме липидов) с отложением определенного метаболита в нервных структурах и отдельных соматических органах, в первую очередь в печени и почках.
Следствием метаболической аномалии является разрушение миелина оболочек нервных стволов и проводящих путей, гибель нейронов с замещением их разрастающейся глиальной тканью. Морфологически лейкодистрофия характеризуется диффузными и симметрично расположенными в полушариях головного мозга зонами гибели миелина, скоплением продуктов миелинового распада, усиленной пролиферацией глии. В отдельных нозологических вариантах лейкодистрофия имеет специфическую морфологическую картину — метахроматическое или суданофильное окрашивание продуктов миелинового распада, скопление в зонах демиелинизации глобоидных клеток и т. п.
Симптомы лейкодистрофии
В большинстве случаев лейкодистрофия дебютирует в раннем детском возрасте. Новорожденные, как правило, выглядят здоровыми. Определенный период они нормально развиваются, а затем постепенно возникают различные неврологические симптомы, отличающиеся неуклонным прогрессированием. Скорость нарастания симптомов тем выше, чем раньше манифестировала лейкодистрофия. Ведущими проявлениями выступают прогрессирующая олигофрения, ухудшение зрения, тугоухость, эписиндром, спастические парезы. Первыми симптомами лейкодистрофии могут быть атаксия, мышечно-тонические расстройства (гипо- или гипертонус, мышечные подергивания), экстрапирамидные проявления, изменения поведения. Затем возникают эпиприступы, бульбарные проявления, снижается слух и зрение, отмечается интеллектуальное снижение с постепенной утратой ранее приобретенных навыков. Сенсорные расстройства не характерны. На поздних этапах развития болезни наблюдаются параличи, выраженная олигофрения, грубое расстройство глотания, амавроз, глухота. В терминальной фазе обычно отмечается децеребрационная ригидность.
Виды лейкодистрофии
Метахроматическая лейкодистрофия в зависимости от манифестации имеет 4 варианта. Врожденный вариант дебютирует в первые 1-3 мес. жизни задержкой развития и судорожным синдромом; дети не достигают возраста 1 года. Позднедетский вариант метахроматической лейкодистрофии начинается в период от 1 до 3 лет с мышечной гипотонии и слабости, атаксии, задержки психического развития (ЗПР). Затем формируется спастическая тетраплегия, афазия, псевдобульбарный синдром. В редких случаях пациенты доживают до 10-летнего возраста. Ювенильный вариант манифестирует в 4-6 лет и длится в среднем 7 лет. Взрослый вариант дебютирует в третьей декаде жизни, иногда позднее, продолжительность жизни пациентов от начала клиники варьирует в пределах 10-20 лет.
Суданофильная лейкодистрофия наследуется сцеплено с Х-хромосомой и имеет несколько разновидностей. Лейкодистрофия Пелицеуса-Мерцбахера может стартовать на 1-ом году жизни или в 3-4 года. Первым признаком является крупноразмашистый нистагм, позже возникает ЗПР, мозжечковая атаксия, гиперкинезы, парезы. Наибольшее прогрессирование происходит в возрасте до 10 лет, затем заболевание принимает замедленное течение с длительными ремиссиями. Пациенты могут жить до зрелого возраста. Адренолейкодистрофия — вариант, при котором лейкодистрофия сочетается с надпочечниковой недостаточностью. Характеризуется прогрессирующим течением с летальным исходом спустя 6-8 лет от начала клиники.
Глобоидно-клеточная лейкодистрофия (болезнь Краббе) — липоидоз с накоплением в очагах демиелинизации галактоцереброзида и образованием больших округлых глобоидных клеток. Раннедетский вариант развивается в первом полугодии жизни с гипервозбудимости и периодической гипертермии, задерживается психомоторное развитие, нарастает тонус мышц, затем развивается спастический тетрапарез, олигофрения, эписиндром, возможен опистотонус. В годовалом возрасте наступает летальный исход. Позднедетский вариант более редкий, манифестирует ухудшением зрения.
Спонгиозная дегенерация Ван-Богарта-Бертрана характеризуется эписиндромом, гиперсомнией, выраженной гидроцефалией с увеличением размеров головы, вызывающей амавроз атрофией зрительных нервов. Резкая внутричерепная гипертензия приводит к расхождению черепных швов, регистрируемому при рентгенографии черепа. Пациенты с этой формой лейкодистрофии погибают до 3-летнего возраста.
Болезнь Александера (лейкодистрофия с волокнистой формацией) обусловлена мутацией гена, ответственного за синтез GFAP белка. В результате происходит накопление в клетках глии аномального GFAP белка, содержащего волокна Розенталя. Неонатальный вариант имеет тяжелое течение с летальным исходом к концу 1-го года. Инфантильный вариант встречается примерно в половине случаев, проявляется в первые 1-2 года жизни ЗПР, затем присоединяются спастические парезы, атаксия, гидроцефалия. Дети погибают спустя несколько лет. Ювенильная лейкодистрофия Александера дебютирует в период от 4-х до 10-летнего возраста, протекает с преимущественно стволовой симптоматикой. Продолжительность жизни колеблется в пределах 10-30 лет. Взрослый вариант отличается поздней манифестацией и относительно медленным течением в пределах 10 и более лет.
Лейкодистрофия Галлервордена-Шпатца чаще всего стартует в 10-летнем возрасте. Проявляется дисфункцией стриопаллидарной системы, затем на фоне гиперкинезов прогрессирует тетрапарез, развивается гемералопия и пигментный ретинит, наблюдается снижение интеллекта, возникают эпиприступы.
Диагностика лейкодистрофии
Диагностический поиск требует привлечения ряда специалистов: невролога, педиатра, медицинского генетика, для диагностики расстройств зрения и слуха — отоларинголога и офтальмолога. Важное значение имеет изучение анамнеза болезни (возраст и симптомы дебюта, последовательность развития клиники) и семейного анамнеза (наличие лейкодистрофии у родственников). Нейросонография через родничок и эхо-энцефалография у пациентов более старшего возраста, как правило, выявляет повышение интракраниального давления. Лейкодистрофия сопровождается существенным увеличением концентрации белка, обусловленным разрушением церебральных клеток, что определяется при исследовании цереброспинальной жидкости.
С целью диагностики вида метаболической аномалии проводится целый ряд биохимических тестов с определением уровня ферментов и накапливающихся метаболитов. Очаги демиелинизации хорошо визуализируются при помощи МРТ, могут быть обнаружены и на КТ головного мозга. Обычно демиелинизация видна на МРТ головного мозга еще до клинической манифестации лейкодистрофии. Благодаря развитию генетики, лейкодистрофия имеет разработанную ДНК-диагностику, а отдельные ее формы (метахроматическая, адренолейкодистрофия, глобоидно-клеточная) — возможность пренатального диагностирования.
Лечение лейкодистрофии
На сегодняшний день лейкодистрофия не имеет эффективных способов терапии, позволяющих купировать прогрессирование симптомов. Проводится симптоматическое лечение — в основном дегидратационная и антиконвульсантная терапия. Единственным методом, способным увеличить продолжительность жизни пациентов с лейкодистрофией и улучшить качество их жизни, является трансплантация пуповинной крови или пересадка костного мозга. Трансплантация приводит к нормализации метаболизма. Однако этот процесс занимает длительное время (от 12 до 24 мес.), в течение которого продолжается прогрессирование лейкодистрофии. Поэтому зачастую тяжелая инвалидизация или гибель пациента наступает даже после успешной трансплантации.
Следует подчеркнуть, что трансплантация никак не влияет на уже развившийся неврологический дефицит, она лишь позволяет приостановить его дальнейшее прогрессирование. В связи с тем, что эффект такого лечения наступает спустя 1-2 года, оно целесообразно в случае ранней доклинической диагностики лейкодистрофии (при соответствующей настороженности родителей рожденного ребенка в связи с наличием подобной патологии в семье) или при медленно прогрессирующем варианте течения. Кроме того, необходимо учитывать, что трансплантация связана с риском ряда серьезных осложнений, таких как отторжение, реакция «трансплантат против хозяина», развитие инфекций.
Читайте также:
