Клиника болезни Аддисона-Бирмера (злокачественной анемии) - признаки
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Лабораторная диагностика болезни Аддисона-Бирмера (злокачественной анемии) - анализы
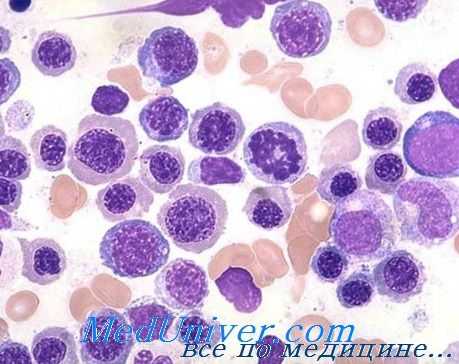
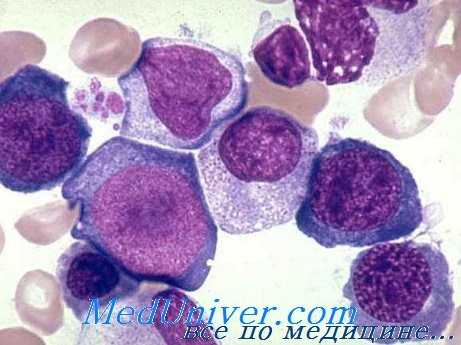
В периферической крови макроцитоз наиболее показательный элемент. Большинство эритроцитов крупных размеров (до 12 u и более), немного овальной формы, хорошо загруженные гемоглобином (без светлой центральной зоны); тем не менее существуют эритроциты и меньших размеров (менее 5 u), некоторые из них нерегулярной формы (пойкилоциты); также встречаются точечнобазофильные эритроциты, кольца Cabot.
Наличие анизоцитоза отмечает широкая кривая Price-Jones, верхушка которой сдвинута вправо; в принципе DEM (СДЭ) укладывается в пределы от 8 до 9 u, а иногда и более.
Соответственно повышаются показатели VEM (СОЭ) (95—110 u3, иногда более 140 u3) и НЕМ (33—38 пг, в отдельных случаях 50 пг.) В связи с макроцитозом число эритроцитов меньше соответственных показателей гемоглобина и гематокрита, при этом больные переносят относительно хорошо анемию, показатель которой равняется 1,5 мл Э/мм3. Число ретикулоцитов меньше нормы. Важным но не постоянным признаком для постановки диагноза составляет наличие в крови единичных мегалобластов.
Лейкоцитная картина характеризуется, вообще, умеренной лейкопенией (от 3000 до 5000 на мм3), сокращением численности гранулоцитов, которые крупные и проявляют тенденцию к гиперсегментированию (одновременно появляются молодые элементы — метамиэлоциты и миэлоциты). Численность тромбоцитов умеренно уменьшается (редко менее 50 тыс.), при этом отмечается анизоцитоз, в отдельных случаях с некоторым функциональным дефицитом.
В костном мозге обнаруживается (выраженная) гиперплазия предшественников эритроцитов и мегалобластические изменения во всех костномозговых рядах, морфологический характер, генез и последствия которых уже рассматривались при описании мегалобластоза. В некоторых тяжелых случаях обнаруживается наличие эктопических очагов кроветворения в печени и селезенке.
Среди прочих биологических постоянных бирмеровской болезни следует отметить: гипербилирубинемию (в основном костномозговой природы) — с увеличенным выделением с фекалиями билирубиновых телец (до 800 мг в сутки); рост показателя сывороточных ферментов — таких как лактикодегидрогеназа (изофермент эритроидной природы), малико-6-фосфоглюконат и 2-гидроксибутиратдегидрогеназа (за счет неэффективности эритропоэза и повышения их активности в мегалобластах); некоторые сдвиги в белковом обмене (увеличивается выделение с мочой аминокислот, растет РОЭ, уменьшается гаптоглобин (в связи с расплавлением крови), также в жировом обмене (при этом уменьшаются альфа- и растут бета-липопротеиды, сокращается поглощение кишечником жирных кислот); нарушение гемостаза (в принципе легкое, за счет тромбоцитопении и понижения активности протромбина).
Что касается обмена железа нередко обнаруживается наличие завышенного количества железа в крови с общей невысокой способностью связывания, одновременно понижение поглощения железа кишечником.
В процессе диагностирования представляют значение определения метаболизма витамина В12.
В сыворотке уровень витамина В12 (определяемый микробиологическом путем или способом радиоактивных изотопов) в отдельных случаях значительно меньше критического — 100 пг/мл.
Поглощаемость кишечником витамина В12 определяется реакцией Шиллинга, которая, судя по леченным нами больным, предоставляет существенную информацию. Эта реакция заключается в назначении внурть небольшого количества радиоактивного витамина (0,5 uCi), а спустя 2 ч с помощью внутримышечного инъецирования еще 1000 мкг витамина В12 (чтобы воспрепятствовать связыванию поглощаемого 60СоВ12 и одновременно способствовать его удалению). В подобных условиях за сутки у человека в норме выделяются с мочой 10% введенной в организм радиоактивности, в то время как у страдающих бирмеровской болезнью — менее 2%.
Однако заключение, по которому неполноценность поглощения обусловлена отсутствием внутреннего фактора требует подтверждения повторным испытанием (спустя 2 недели) при одновременном введении ВФ для поправки результата (при бирмеровской болезни). К ведущим факторам погрешности относятся почечная и сердечная недостаточность, инфекционные заболевания и пр.
На практике лишь в редких случаях оказывается необходимым определение активности внутреннего фактора в желудочном соке или исследование в сыворотке антител против внутреннего фактора (серологическим методом или путем радиоактивных изтотопов).
Косвенным методом выявления недостатка В12 является определение выделения с мочой метилмалоновой кислоты (норма 1—7 мг в сутки); при бирмеровской болезни этот показатель растет до нескольких десятков или даже сотен мг/сутки (в частности при формах болезни с невропатией).
Реакция на суппрессию включения дезоксиуридина (дУ), при дефиците В12 или фолиевой кислоты, основывается на факте включения меченного тимидина в эритробласты (или стимулированные лимфоциты), преимущественно по сравнению с дезоксиуридином (которого метилирование не преобразовывает в тимидин); откорригировать это положение возможно добавлением недостающего витамина (Killman).
В текущей клинической практике диагноз болезни Бирмера можно заподозрить по данным анамнеза и клинического обследования. Выявление признаков мегалобластической анемии и неподдающейся гистамину ахилии желудка по существу обеспечивают диагностирование, при этом подтверждение правильности определения дает наступление межприступного периода после назначения специфической терапии.
Реакция Шиллинга применяется для подтверждения отсутствия внутреннего фактора, в частности у леченных лиц или в случаях неполной симптоматологии. Определение витамина в крови (равно как и выделения АММ) можно применять лишь в сложных случаях (например при подозрительной нервной симптоматологии, без анемии), при этом сыворотку отбирать до начала лечения и сохранить в замороженном состоянии.
Дифференциальная диагностика рассматривается в общих сведениях о мегалобластической анемии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника болезни Аддисона-Бирмера (злокачественной анемии) - признаки
Болезнь Бирмера (Аддисона-Бирмера, злокачественная анемия) - история изучения, причины
Болезнь Бирмера (Аддиссона-Бирмера) или «злокачественная анемия» наиболее частая и лучше изученная форма дефицита витамина В12.
История болезни начинается описанием Аддиссоном (1885) «генуинной» анемии у хорошо питающихся лиц; о желудочных дегенеративных поражениях высказывал предположение Флинт (1860), что, в дальнейшем было подтверждено Fenwick (1870) на секционном материале, в то время как бескислотность, доказанная Cohn и Mehring уже в 1886 г. лишь спустя несколько десятков лет была признана в качестве обязательного симптома болезни.
Бирмеру мы обязаны анатомоклиническим описанием «злокачественной анемии» (1868—1872), хотя большинство рассмотренных им случаев видимо в действительности, составляли виды анемии за счет недостатка фолиевой кислоты (Castle, 1970).
Описание мегалобласта Эрлихом в 1908 г. заложило основу морфологического диагноза, увенчавшегося в дальнейшем практикой костномозговых пункций.
Начало патофизиологического этапа отмечено успешным применением пероральной гепатотерапии (Minot и Murphy), после чего, постепенно, путем очистки печеночных экстрактов, удалось выделить витамин В12 и синтезировать его. В 1938 г. Castle доказал роль внутреннего фактора в патогенезе этого заболевания. На последующих этапах были достигнуты большие успехи в изучении метаболизма витамина В12 и его взаимосвязь с другими метаболическими процессами, к тому же был приведен ряд аргументов, в пользу высказывания об аутоиммунном патогенезе с описанием нескольких генетических болезней, касающихся ферментов, которые зависят от витамина В12.
На основе современных знаний болезнь Бирмера можно определить как болезненное состояние, характеризующееся изменениями мегалобластического вида клеток периферической крови и костного мозга и дегенеративными поражениями слизистых оболочек пищеварительного тракта и нервной системы в связи с недостаточным поглощением витамина В12 по причине отсутствия внутреннего фактора, что, видимо создается каким-то аутоиммунным механизмом на наследственном фоне.
Частота заболевания значительно колеблется в зависимости от географической области при этом болезнь чаще в странах, населенных «северными расами» (Голландия, Скандинавский полуостров, Англия, США, Канада), чем на востоке и юге Европы и совсем редко встречается на Дальнем Востоке и среди негроз (Gummert). Более высокий показатель частоты у женского пола (5:2) не подтвержден всеми авторами.
По возрастным группам наиболее высокий показатель приходится на группу 45—55 лет, однако процент заболевших растет неуклонно в последующих группах.
Экономические и трудовые (профессиональные) условия не оказывают существенного влияния на показатель частоты этого заболевания «эндогенного детерминизма» (в отличие от мегалобластической анемии за счет недостатка фолиевой кислоты).
В болезни Бирмера роль строения и наследственности была выявлена при описании первых случаев (Аддисон). В дальнейшем высказывалось предположение о взаимосвязи с определенными соматическими, нервными или эндокринными строениями, была отмечена частота отдельных соматических черт (широкое лицо, отдаленные глаза, белесный цвет волос, раннее появление седины и пр.), которые, в, настоящее время, не считаются показательными.
Более важным представляется рост частоты полностью развившегося заболевания или его частичного проявления в семье больного.
По материалам Вернера (цит. Бегеманном), проводившего исследования в ряде семей страдающих, у 9% обследованных были отмечены иные явные случаи заболевания, а в 15% — частичные проявления [скрытые или исходные признаки болезни]. Среди близких родственников больного наиболее часто наблюдались заниженность или отсутствие кислотности (19%), желудочно-кишечные расстройства (33%), холе-цистопатия (15%) (реже — 8%—изменения языка), парестезия (25%) (в некоторых семьях наблюдалось развитие заболевания в сопровождении невропатии); из числа гематологических сдвигов отмечены мокроцитоз, овалицотоз, гиперсегментирование (примерно в 23% случаев).
Болезнь Бирмера описана и у одножелточных близнецов (Arbo и Mohr).
Другими аргументами, выступающими за генетический детерминизм болезни являются значительная частота антител против пристеночных клеток и сокращение ВФ у родственников больного (Ардеман и сотр.), также возможно, существенно увеличенная частота кровяной группы А (II) у страдающих бирмеровской анемией. К тому же выявлены (Асталди и сотр.,) количественные и качественныз изменения хромосом (непостоянные, нехарактерные).
По одному из предложенных генетических объяснений болезнь передается посредством гена, вовлеченного в процесс образования внутреннего фактора, при этом дефицит передается доминантным способом, но с небольшой проницаемостью; гомозитотное состояние видимо обусловливает ювенильную форму заболевания (при врожденном отсутствии внутреннего фактора), в то время как для проявления болезни в гетерозиготных условиях (обычной у взрослых) предполагается необходимым образование, во времени, атрофических поражений слизистой оболочки желудка (под воздействием каких-то эпигенетических факторов).
Вероятность наличия полигенетического механизма подсказывается относительно большой частотой случаев «конституционной гипохромной анемии» (с заниженным выделением желудочного сока, воспалением слизистой оболочки языка и пр.) среди родственников больного.
Второй основной вопрос патогенеза болезни Бирмера связан с нали чием аутоиммунных антител у большинства больных.
В сыворотке примерно 40% страдающих имеются антитела против ВФ, в то время как у примерно 90% — антитела против пристеночных клеток. Последние (примерно в размере 30% случаев) выявляются и при других заболеваниях аутоиммунного патогенеза, таких как тиреоз Хашимото, тиреотоксикоз, генуинная недостаточность надпочечной железы (Ирвине и сотр.). С другой стороны у 40—50% страдающих отмечается наличие противощитовидных антител.
Однако антитела против пристеночных клеток встречаются и при простом атрофическом гастрите (60%) или даже у лиц, страдающих невыявимыми заболеваниями (5—8%), особенно у женщин старше 60 лет (Ирвине и сотр.). Поставлен вопрос о том, не составляет ли развитие этих аутоантител вторичное явление изменению антител клеточных структур.
Антитела против внутреннего фактора находятся в разной пропорции в слюне и желудочном соке страдающих бирмеровской болезнью; их роль в сокращении поглощения витамина В1а доказана. Что касается роли антител против пристеночных клеток в патогенезе поражения слизистой оболочки желудка вопрос остается еще невыясненным (участвуют иммунологические механизмы гуморального и клеточного видов в обстановке разных эндо- и экзогенных факторов).
С диагностической точки зрения в случае мегалобластической анемии присутствие антител против пристеночных клеток указывает, с большой вероятностью, на наличие болезни Бирмера, в то время как выявление антител против внутреннего фактора свидетельствует о развитии этого заболевания почти с достоверностью (Williams).
Другим аргументом в пользу аутоиммунного патогенеза болезни Бирмера служит способность глюкокортикостероидов обусловливать (временно) регрессию поражений слизистой желудка и понижение коэффициента антител против внутреннего фактора (Robro и сотр.).
На сонове этих аргументов, выступающих, с одной стороны, за наследственный характер болезни, а с другой, за аутоиммунный фактор патогенеза в настоящее время многие авторы склонны рассматривать болезнь Бирмера как результат генетического недостатка, вызывающего иммунологическое нарушение, которое заключается в низкой иммуной переносимости в отношении клеток желудочного эпителия (и других клеток одинакового эмбриологического происхождения), в связи с чем проявляются аутоантитела (под воздействием добавочных факторов).
Гемолитическая анемия
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10
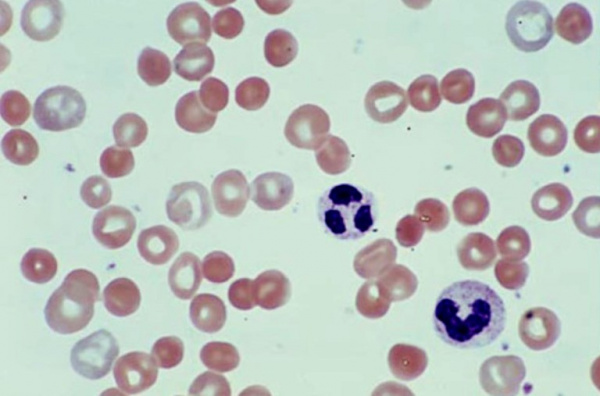
Общие сведения
Гемолитическая анемия (ГА) - малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
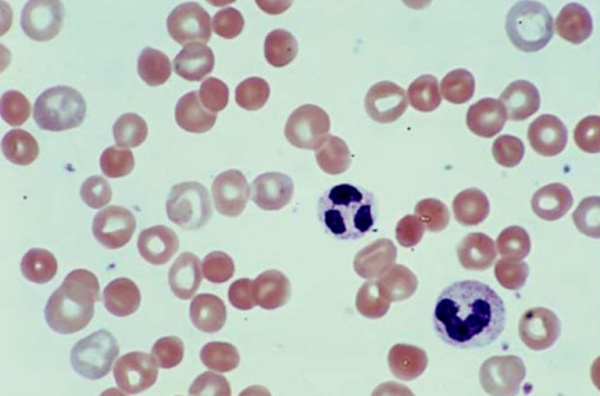
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии- анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические - анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом - обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще - Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий - талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
4. Клинические рекомендации по диагностике и лечению аутоиммунных гемолитический анемий/ Цветаева Н.В., Никулина О.Ф. - 2014.
Анамнез вскрывает признаки, соответствующие трем, первостепенно поражаемым системам — пищеварительной, кровяной и нервной. Пищеварительные симптомы появляются на ранних сроках, к ним относятся отсутствие аппетита, отвращение к мясу, ощущение насыщенности, нередко пресная рвота; иногда наблюдаются расстройство желудка или запор, жжение языка — явление не постоянное.
Признаки анемии развиваются позже в виде утомленности, головокружения, сердцебиения, наряду с появлением бледности желтоватого оттенка. Нервные симптомы (развивающиеся даже за отсутствием объективных признаков миелоза, в отдельных случаях в качестве первого симптома) в основном касаются чувствительности конечностей: мурашки, онемение, разного вида парестезии, слабость, часто молниеносная или стойкая боль; расстройства психотического характера значительно реже.
Объективное обледование при болезни Аддисона-Бирмера. Общий вид больного нередко характерен: опухший, бледножелтый оттенок в связи с поджелтушным состоянием (разной интенсивности); в отдельных случаях наблюдается гиперпигментация (невыясненной причины), возможно с участками витилиго; появляются и расстройства трофики — сухость кожи, ломкость ногтей и волос, тенденция к депигментации, иногда отеки, редко элементы пурпуры на конечностях.
Исследование внутренних органов не выявляет характерных признаков. Так, печень немного увеличена, селезенка, в принципе, прощупывается при вдохе (в редких случаях, больше). Явления сердечной недостаточности, отмечающиеся в более тяжелых случаях заболевания, не отличаются от таковых при других видах анемии; они относятся за счет недостатка кислорода и увеличенной объемной скорости сердца (однако не исключается непосредственное влияние недостатка витамина В12 на обмен сердечной мышцы).
Что касается мочевой системы следует отметить плейохромный аспект мочи (содержащей уробилиноген и прочие пигменты), равно как и тенденцию к мочевой инфекции кишечной бактерией.
Особое значение для диагностирования представляют изменения, происходящие в пищеварительной системе. Воспаление слизистой оболочки языка (описанное Гунтером) проявляется, обычно, по краям и на кончике языка в виде болезненной красноты (в отдельных случаях с небольшими изъязвлениями), в дальнейшем наблюдается атрофия сосочков, язык становится красным, гладким и блестящим («лакированным»). В случае глоточно-пищеводных поражений развивается расстройство глотания (синдром Plummber-Vinson), как при тяжелой железодефицитной анемии.
Что касается желудка, исследованием выявляются выраженная выделительная недостаточность, даже после предельного стимулирования гистамином (0,5 мг и более), значительное сокращение желудочного сока и исчезновение пептической активности, соляной кислоты и внутреннего фактора (случаи бирмеровской анемии без ахилии желудка чрезвычайно редкие), при этом весьма часто наблюдается заселение бактериями полости желудка. Слизистая оболочка желудка резко атрофирована в верхних 2/3, исчезают канальцы; клетки эпителиев желудка и рта крупнее, содержат скудный хроматин и вакуолизированную цитоплазму.

При этом наблюдается недостаточное поглощение кишечником железа и прочих веществ (жиров, даже фолиевой кислоты). В отдельных случаях появляются признаки легкой недостаточности поджелудочной железы или печени.
Признаки нервного характера весьма разнообразны с точки зрения момента появления, формы и тяжести. К ним относятся парастезии, расстройства глубокой чувствительности и дефицит моторики.
В легких случаях заболевания больной жалуется на парестезию различного вида, однако, при объективном обследовании, в принципе выявляются расстройства глубокой чувствительности, иногда изменение рефлексов. Тяжелые формы делятся (по Гейльмайеру) на: тип заднего канатика (ложнотабетический) с атаксией, выпадением рефлексов; тип бокового канатика с преобладанием пирамидных признаков (ригидность, гиперрефлекторность, клонус и пр.), причем этот вид нередко сочетается с предыдущим; тип поперечного сечения с нарушениями поверхностной чувствительности под соответствующим уровнем, парезом нижних конечностей, мочевого пузыря и пр.
К тому же известен ряд более редких форм, при которых поражаются отдельные черепно-мозговые или периферические нервы, полиневритные, психопатические чрезвычайно редкие по проявлению и тяжести формы. Характерный субстрат этих проявлений составляют поражения спинного мозга, в основном задних (и боковых) канатиков, заключающиеся в разрушающих миелиновую оболочку процессах с дальнейшим перерождением аксонов.
Течение болезни Аддисона-Бирмера - прогноз
Зловещий прогноз болезни Аддисона-Бирмера до наступления эры специфической терапии, в настоящее время несравненно улучшился. Тем не менее даже если картины, описанные прежними клиницистами ныне редкое явление, для отдельных старых людей, умирающих по существу от злокачественной анемии, выставляется посмертный диагноз, «старческого истощения» или подозрения на рак желудка и пр., при этом формы заболевания, которым предшествуют или в которых преобладают нервные симптомы долгое время пренебрегаются, что приводит к тяжелым необратимым неврологическим поражениям.
При начальных формах болезни Аддисона-Бирмера (со скрытой гематологической симптоматологией, астенией, парестезией, ахилией) нередко отмечается ошибочное диагностирование, в частности при предварительном лечении данных лиц поливитаминами, содержащими фолиевую кислоту (которая устраняет гематологические признаки, а иногда усугубляет неврологический синдром). Описаны также скрытые формы с прогрессивным понижением витамина в крови, причем протекающие долгое время без иных выраженных симптомов. Отмечены и случаи наступления самопроизвольной ремиссии (подобно посттерапевтической), по еще невыясненной причине.
Сопутствующие болезни болезни Аддисона-Бирмера
Совмещение болезни Бирмера и раком желудка наблюдается в 7—12% случаев (коэффициент частоты примерно в три раза больше, чем у контрольной популяции); изменение симптоматологии пищеварительного тракта, устойчивость анемии к проводимой терапии, гипохромный характер и пр. — признаки злокачественного течения болезни. Полипоз желудка также отмечается довольно часто (примерно в 6% случаев).
Совмещение с заболеваниями щитовидной железы, «эссенциальной гипохромной анемией», болезнями желчного пузыря и пр. рассматривались при описании этиопатогенеза. Другие сопутствующие заболевания (лейкемия, гемолитическая желтуха и пр.) встречаются редко и не существенны.
Болезнь Аддисона ( Бронзовая болезнь )
Болезнь Аддисона – это первичная надпочечниковая недостаточность (ПНН), которая вызвана разрушением железистой ткани надпочечников и снижением синтеза гормонов. Заболевание возникает на фоне аутоиммунных патологий, поражения эндокринных желез туберкулезным процессом. Классические симптомы включают гиперпигментацию кожных покровов, общую и мышечную слабость, диспепсические расстройства. Для диагностики применяются иммунологические и гормональные исследования крови, методы лучевой диагностики. Лечение Аддисоновой болезни включает заместительную гормонотерапию, диетотерапию, коррекцию первопричины патологии.
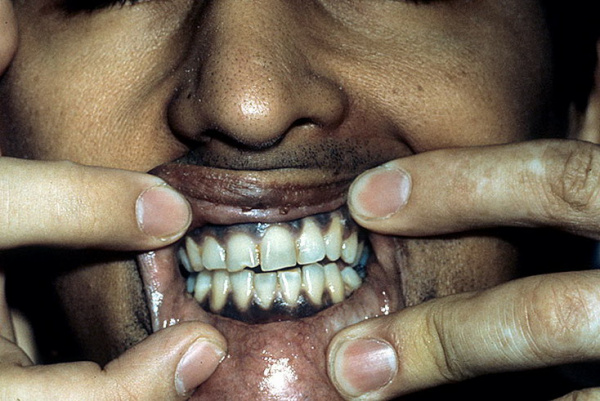
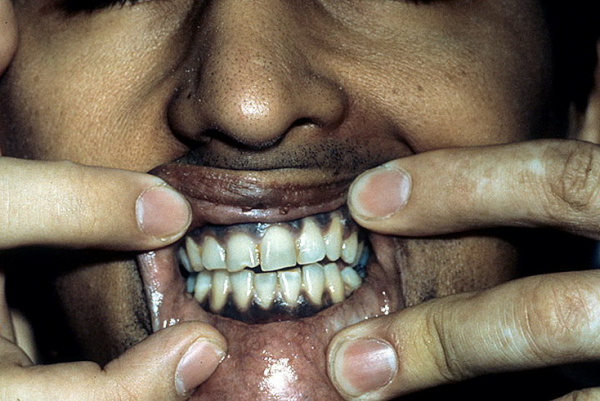
Клинический синдром, связанный с поражением надпочечников, был впервые описан английским терапевтом Томасом Аддисоном в 1855 г. Позже связь между характерным симптомокомплексом и надпочечниковой недостаточностью подтвердил французский врач А. Труссо, который назвал ее «Аддисоновой болезнью». В практической эндокринологии заболевание встречается с частотой от 35 до 140 случаев на 1 млн. населения. Пик диагностики приходится на возраст 20-50 лет, патология чаще развивается у женщин.
Основным пусковым фактором болезни Аддисона признано аутоиммунное повреждение надпочечников, которое составляет до 90% всех причин заболевания. Надпочечниковая недостаточность зачастую сопровождается другими аутоиммунными процессами: витилиго, сахарным диабетом 1-го типа, гипотиреозом и тиреоидитом. При сочетании таких патологий диагностируется полигландулярный синдром. Другие причины недостаточности надпочечников:
- Туберкулез. У инфицированных палочкой Коха пациентов наблюдается гематогенное распространение инфекции в корковый и мозговой слой надпочечников, что результирует развитием специфического воспаления. Туберкулезное поражение становится причиной около 10% случаев Аддисоновой болезни.
- Повреждение надпочечников. Помимо туберкулеза, существует вероятность развития неспецифического инфекционного процесса в корковом слое органа. Реже в клинической практике встречается адренолейкодистрофия, двустороннее кровоизлияние в надпочечники при синдроме Уотерхауса-Фридериксена.
- Заболевания гипофиза. Снижение функции надпочечников наблюдается при угнетении регулирующего влияния кортикотропного гормона (АКТГ). Такая проблема встречается при опухолях гипофиза, послеродовом некрозе железы (синдром Шихана), краниофарингиоме.
- Ятрогенные причины. Болезнь возникает как результат двусторонней тотальной адреналэктомии при отсутствии соответствующей заместительной терапии. Реже причиной становится гипофизэктомия или лучевое поражение гипофиза. Надпочечниковую недостаточность провоцируют блокаторы стероидогенеза, некоторые антикоагулянты.
На современном этапе установлена вероятность генетической предрасположенности к появлению заболевания. Ученым удалось выяснить ассоциацию болезни Аддисона с HLA монотипами DQ2/DR4–DQ8. Другие исследования доказали роль полиморфизма единичного нуклеотида в области гена CTLA-4. Развитие патологии связывают с нарушением отрицательного отбора лимфоцитов в тимусе, в результате чего формируются аутоиммунные реакции.
Все вышеописанные причины вызывают первичную недостаточность надпочечников, имеющую сходный патогенез и клиническую картину. Во избежание путаницы в терминологии в настоящее время эндокринологи используют название «болезнь Аддисона» только для обозначения ПНН аутоиммунного и туберкулезного генеза. Именно эти варианты заболевания описывал в своих работах Томас Аддисон.
Надпочечниковые железы – парный эндокринный орган, который состоит из коркового и мозгового вещества. В корковом слое вырабатывается ряд гормонов: минералокортикоиды (альдостерон), глюкокортикоиды (кортизол), половые стероиды (андрогены и эстрогены). Механизм развития Аддисоновой болезни связан с недостаточным количеством альдостерона и кортизола, которые участвуют процессах обмена веществ и воздействуют практически на все внутренние органы.
При дефиците кортизола – основного адаптогенного гормона – наблюдается снижение сопротивляемости к эндо- и экзогенным стрессовым факторам, при которых в норме концентрация глюкокортикоидов повышается в десятки раз. К тому же у пациентов развивается циркуляторная недостаточность, дегидратация, угнетение глюконеогенеза и уменьшение запасов гликогена в печени.
Недостаток альдостерона обуславливает повышение уровня калия и снижение количества натрия в крови. При нехватке этого гормона происходят усиленные потери воды через почки и желудочно-кишечный тракт, в результате чего снижается объем циркулирующей крови и развивается артериальная гипотензия. Избыток калия нарушает работу сердца, ухудшает внутрижелудочковую проводимость.

Симптомы болезни Аддисона
Клиническая картина развивается постепенно, зачастую пациенты не могут вспомнить точное время манифестации заболевания. К первым признакам болезни Аддисона относят необъяснимую слабость, снижение работоспособности, уменьшение мышечной силы. Больному становится трудно выполнять привычные бытовые действия, в тяжелых случаях человек не покидает постели, отказывается есть и разговаривать. На фоне артериальной гипотонии возникают обмороки.
Большинство пациентов имеют диспепсические расстройства: разлитые боли в животе, тошноту и рвоту, неустойчивость стула. Симптомы не имеют четкой связи с характером питания, их интенсивность варьирует от легкого недомогания до серьезных нарушений пищеварительной функции. Вследствие массивных потерь натрия развивается пристрастие к соленой пище. На фоне общей слабости, снижения аппетита и угнетения анаболических процессов наблюдается потеря веса.
У пациентов с болезнью Аддисона кожа со временем темнеет и приобретает характерный бронзовый оттенок. Такой симптом стал причиной неофициального названия патологии «бронзовая болезнь». Сначала гиперпигментация возникает на открытых участках тела, которые подвержены действию солнечных лучей, а также в области наружных половых органов и сосков. Затем потемнение кожи наблюдается в местах постоянного трения одеждой, естественных складках тела.
Наиболее опасное последствие болезни Аддисона – развитие острой надпочечниковой недостаточности (аддисонического криза). Такое состояние возникает на фоне травмы, хирургического вмешательства, тяжелой инфекции. У пациентов в течение считанных часов развивается гипотензивный шок, тяжелая дегидратация, гипогликемия. При отсутствии своевременной интенсивной терапии аддисонический криз приводит к летальному исходу.
Более 50% больных со временем сталкиваются с психическими расстройствами и неврозоподобными состояниями. Это особенно характерно для пациентов с недиагностированным заболеванием на фоне повышенной тревоги за здоровье, канцерофобии. При прогрессирующей форме болезни Аддисона возможно появление галлюцинаций. Гиперкалиемия чревата развитием миокардиодистрофии, внутрижелудочковых блокад.
Обследование пациента у врача-эндокринолога начинается с оценки клинических проявлений. Для постановки диагноза обязательно проводится комплекс лабораторных анализов, объем которых определяется с учетом клинической ситуации, общего состояния пациента, наличия признаков других аутоиммунных синдромов. Диагностика болезни Аддисона требует проведения следующих видов исследований:
- Гормональные исследования. Базовые методы включают оценку уровня кортизола в крови и моче, при стертой клинической картине целесообразно проводить тест с 1-24-АКТГ. Если по результатам фармакологической пробы уровень кортизола остается менее 500 нмоль/л, удается заподозрить наличие первичного гипокортицизма.
- Иммунологические анализы. В крови обнаруживаются специфические антитела к антигенам надпочечников (21-гидроксилазе, десмолазе, 17-гидроксилазе). При полигландулярном синдроме определяются антитела к антигенам щитовидной железы и других органов.
- Клинические и биохимические анализы. При оценке показателей гемограммы определяется нормохромная или гипохромная анемия, умеренная лейкопения, относительный лимфоцитоз и эозинофилия. По данным биохимического исследования крови диагностируется гиперкалиемия, гипонатриемия.
- Лучевая диагностика. При подозрении на туберкулезную этиологию болезни Аддисона проводится рентгенография органов грудной клетки. Ограниченную информативность в диагностике имеет рентгенография и КТ надпочечников, которые могут выявлять увеличение органа в размерах, отдельные кальцинаты.
Дифференциальная диагнгстика
При развернутой клинической картине гипокортицизма и наличии бронзовой пигментации постановка диагноза не затруднена. У пациентов со стертыми проявлениями болезни Аддисона необходимо проводить дифференциальную диагностику с пернициозной анемией, онкопатологией, заболеваниями ЦНС. Желудочно-кишечные симптомы следует отличать от клиники «острого живота», хронического холецистита, энтероколита.

Лечение болезни Аддисона
Диета
Для коррекции электролитных нарушений важное значение имеет диетотерапия. Рацион питания обогащают поваренной солью в количестве 5-10 г в сутки. Поскольку аскорбиновая кислота активизирует синтез кортикостероидов, рекомендуется дополнительный прием витамина С в высоких дозах. Для восполнения дефицита массы тела диета должна содержать высокий уровень белка, достаточное количество растительных и животных жиров в правильном соотношении.
Фармакотерапия
По возможности при болезни Аддисона назначается этиотропная терапия. При туберкулезном поражении надпочечниковых желез лечение проводится под контролем фтизиатра с применением индивидуальной комбинации препаратов. Для контроля аутоиммунных заболеваний рекомендовано патогенетическое лечение: назначение левотироксина, инсулинотерапии.
Основу лечения составляет заместительная гормональная терапия, которая предполагает применение глюкокортикоидов и минералокортикоидов. Коррекция минералокортикоидного обмена не представляет особых сложностей, с этой целью применяется один препарат в стандартных дозах, который показывает высокую эффективность. Применение кортикостероидов имеет ряд правил и нюансов:
- стандартный режим предполагает назначение гормональных препаратов короткой или средней продолжительности действия с кратностью приема 2 или 3 раза в день в невысоких дозировках;
- при легких простудных и других острых заболеваниях доза глюкокортикоидов повышается в 2-3 раза для коррекции возросших потребностей организма в гормонах;
- при тяжелых болезнях, высокой лихорадке, подготовке к оперативным вмешательствам целесообразно переходить на внутривенное введение гормонов до нормализации состояния.
Применение гормонотерапии предполагает строгий клинико-лабораторный контроль, чтобы предупредить развитие ятрогенных осложнений. Критериями успешности терапии являются исчезновение субъективной симптоматики, постепенный регресс пигментации, поддержание нормальной массы тела. Пациентам с болезнью Аддисона рекомендуется избегать приема диуретиков, которые усугубляют электролитные нарушения.
При правильно подобранной заместительной терапии заболевание не оказывает существенного влияния на качество и продолжительность жизни пациентов. Прогноз определяется комплаенсом больного, причинами и степенью тяжести проявлений гипокортицизма. Профилактика болезни заключается в своевременном выявлении и лечении больных туберкулезом, динамическом наблюдении за пациентами с другими аутоиммунными патологиями.
1. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению первичной надпочечниковой недостаточности у взрослых пациентов (проект)/ Г.А. Мельниченко// Consilium Medicum. – 2017.
3. Первичная недостаточность коры надпочечников/ И.И. Панькив// Международный эндокринологический журнал. – 2013. – №3.
4. Заболевания надпочечников. Этиология, патогенез, клиника, диагностика и принципы лечения/ Е.А. Якименко. – 2019.
Читайте также:
