Комплексная терапия манифестных проявлений папилломавирусной инфекции урогенитального тракта
Добавил пользователь Евгений Кузнецов Обновлено: 23.01.2026
Для цитирования: Соловьев А.М., Чернова Н.И. Фармакотерапия рецидивирующих клинических проявлений генитальной папилломавирусной инфекции. РМЖ. 2015;11:621.
Проблема лечения генитальных вирусных инфекций является наиболее острой в настоящее время. С учетом биологии вирусов эти инфекции наиболее трудно поддаются эпидемиологическому контролю и лечению. Среди вирусных инфекций, поражающих аногенитальную область, наиболее распространена папилломавирусная инфекция (ПВИ). Частота встречаемости одного из проявлений ПВИ – аногенитальных бородавок (остроконечных кондилом) составляет 19,1% [1], а инфицированность урогенитального тракта вирусом папилломы человека (ВПЧ) среди лиц молодого и среднего возраста в некоторых популяциях достигает 34,4–44,9% [2, 3]. По распространенности ВПЧ в 3 раза превосходит генитальный герпес и не уступает гонорее [4]. В России уровень заболеваемости аногенитальными бородавками в 2011 г. составил 29,4 на 100 тыс. населения [5]. Считается, что к 50-ти годам 80% женщин инфицированы ВПЧ [6]. В результате проведенных эпидемиологических и молекулярно-биологических исследований установлено, что инфицирование женщин ВПЧ является важнейшим фактором канцерогенеза шейки матки – различные типы ВПЧ были выявлены в 99,7% биоптатов, взятых у больных раком шейки матки по всему миру [7].
Согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, лечение должно быть направлено либо на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов [8].
В Европейском руководстве по лечению дерматологических заболеваний (под ред. А. Кацамбаса) представлена следующая классификация методов лечения аногенитальных бородавок [9]:
I. Местные препараты.
1. Кератолитики и прижигающие средства: салициловая и молочная кислоты, уксусная кислота и трихлоруксусная кислота.
2. Цитотоксические препараты: подофиллин, подофиллотоксин.
3. Ингибиторы ДНК: фторурацил, блеомицин, цидофовир.
4. Местные ретиноиды.
II. Деструктивные методы.
1. Электрохирургические методы.
2. Криотерапия.
3. Лазеротерапия.
4. Хирургическое иссечение.
5. Лазерный фототермолиз.
III. Препараты – модификаторы клеток.
1. Системные ретиноиды.
IV. Противовирусные препараты и модуляторы иммунного ответа.
1. Интерфероны (ИФ).
2. Имихимод.
3. Инозин пранобекс (Изопринозин).
Частота рецидивов достаточно высока при любом способе лечения [10]. Уровень рецидивирования составляет в среднем 25–30% в течение 3 мес. после лечения [11, 12]. Рецидивы аногенитальных бородавок чаще всего связаны с реактивацией инфекции, а не с реинфекцией от полового партнера.
Лечение больных с рецидивирующими остроконечными кондиломами представляет для врача наиболее сложную задачу, т. к. в этих случаях неоднократное применение деструктивных методов (иногда даже нескольких) не дает хорошего терапевтического результата. Создается тупиковая ситуация: понятно, что лечить больного необходимо, но подобрать адекватную терапию непросто.
Цель настоящей статьи – дать представление о современных методах фармакотерапии рецидивирующих клинических проявлений ПВИ.
Патогенез вирусных инфекций – иммунозависимый; их клиническая манифестация обычно связана с дефектами различных звеньев иммунитета. Важнейшей причиной клинической манифестации ПВИ и ее рецидивирующего течения являются нарушения в иммунной системе [13, 60]. Известно, что ВПЧ имеет специальные механизмы, подавляющие как клеточный, так и гуморальный иммунитет, в частности интерфероновое звено иммунной системы [14].
О влиянии состояния иммунной системы на рецидивирование клинических проявлений ПВИ говорит тот факт, что у ВИЧ-инфицированных пациентов рецидивы возникают гораздо чаще, с большей площадью поражений, чем у иммуннокомпетентных больных [15, 16].
Комбинированное лечение таких больных намного результативнее, чем только деструкция очагов. При лечении рецидивирующей ПВИ эффективность монотерапии деструктивными методами невысока. Даже после многократных курсов лечения рецидивирование прекращается лишь у 40% больных [18]. Тщательные исследования показали, что столь невысокий показатель связан с тем, что не происходит устранения генома ВПЧ из поражений, устойчивых к лечению (по данным диагностики методом полимеразной цепной реакции (ПЦР), молекулярно-биологическое излечение наступает у 26% больных), а также из соседних участков кожи [18, 19].
Наибольший интерес вызывает применение в терапии рецидивирующей ПВИ препаратов III и IV групп по вышеуказанной классификации Кацамбаса – модификаторов клеток и модуляторов иммунного ответа.
К препаратам, воздействующим на инфицированные эпителиальные клетки, можно отнести индолкарбинол. Он блокирует эстрадиол-зависимую индукцию онкобелка Е7 и препятствует гормон-зависимой пролиферации инфицированных клеток; нормализует метаболизм эстрадиола в клетках; индуцирует апоптотические процессы ВПЧ-инфицированных клеток, вызывая избирательную гибель клеток с опухолевыми свойствами. Индолкарбинол назначают внутрь по 200 мг 2 р./сут, длительность лечения – 3–6 мес. Исследования показывают высокую эффективность комбинированной терапии рецидивирующих аногенитальных бородавок – рецидивы ПВИ в группе традиционной терапии регистрировались в 46% случаев, в группе комбинированной терапии с применением индолкарбинола – в 12% [20].
Повысить эффективность лечения и снизить частоту рецидивов позволяют модуляторы иммунного ответа. Так как ВПЧ сохраняется в эпителиальных клетках, а использование деструктивных и цитотоксических методов не дает абсолютной гарантии против развития рецидивов, для их предотвращения более предпочтительно применение ИФ или его индукторов, а также других активаторов противовирусного иммунитета в качестве адъювантной терапии в комбинации с различными деструктивными методами [14, 21]. Комбинированная иммунотерапия может применяться при лечении упорных, плохо поддающихся лечению бородавок и кондилом [22]. Такое лечение может позволить с наибольшей эффективностью преодолеть основную проблему ПВИ – рецидивы клинических проявлений.
1. Интерфероны
С учетом вирусного характера заболевания основными иммунными препаратами, которые использовали для терапии остроконечных кондилом, всегда были ИФ. Их можно применять местно, внутриочагово и системно (подкожно, в/м или в/в). Установлено, что при применении ИФ в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражений [23].
По данным различных авторов, внутриочаговое применение α- и β-ИФ приводит к исчезновению 35–62,5% бородавок, причем как уже леченных, так и не леченных ранее [24–29].
На российском рынке представлен широкий выбор ИФ различных производителей, как отечественных, так и зарубежных. Предпочтительнее использовать рекомбинантные, а не человеческие ИФ: рекомбинантный ИФ α-2b, рекомбинантный ИФ α-2а, очищенный ИФ α-n1.
Сочетание ИФ с лазеротерапией более эффективно, чем только лазеротерапия: полное исчезновение бородавок наблюдалось у 52–81,5% и 19–61% пациентов соответственно [30–34].
2. Иммунотропные препараты
Воздействовать на противовирусный иммунитет можно назначением индукторов эндогенного ИФ и других активаторов иммунитета, которые могут применяться местно или системно. На российском фармацевтическом рынке представлено много иммуноактивных препаратов, которые согласно инструкции производителя или рекомендациям исследователей используются в комбинированном лечении рецидивирующих клинических проявлений ПВИ в сочетании с различными деструктивными методами или в виде монотерапии. Обязательными условиями при системном применении иммуномодуляторов являются контроль иммунограммы до, во время и после лечения, а также консультация иммунолога.
С точки зрения преодоления и профилактики рецидивов представляет интерес местное применение низкомолекулярного производного имиквидазохинолинамина – имихимода, который является индуктором цитокинов – α-ИФ, интерлейкинов (ИЛ) -1, -6 и -8, фактора некроза опухоли-α [35, 36]. Препарат выпускается в пакетиках для одноразового применения и наносится на места поражений 3 р./нед. (через 1 день) до полного исчезновения высыпаний (но не более 16 нед.). Эффективность монотерапии имихимодом достигает 70% [35–42], а уровень рецидивов – в 2–5 раз ниже, чем при использовании только деструкций. Комбинированное лечение, при котором сочетают деструктивные методы с обработкой поражений имихимодом, дает результат намного лучше, чем просто деструкция очагов [15–17]. Российский опыт использования крема имихимод свидетельствует о его высокой эффективности в терапии аногенитальных бородавок – полное исчезновение поражений у 89% пациентов (в группе плацебо – у 9%) [43].
Перспективным является применение активатора противовирусного иммунитета – кислого пептидогликана с молекулярной массой 1000–40000 кДа. Препарат выделен из растений с помощью биохимических методов, включающих ультрафильтрацию и хроматографию. Выпускается в виде лиофилизированного порошка по 200 Ед. во флаконах для инъекций.
Мы имеем собственные данные об использовании препарата при рецидивирующем течении ПВИ в комбинации с любым из деструктивных методов. Больным удаляли остроконечные кондиломы и одновременно назначали в/м инъекции кислого пептидогликана по 200 Ед. 1 р./сут на 1, 2, 3, 8, 9 и 10-й дни лечения [44]. У 68% больных сразу по окончании лечения наблюдали отсутствие рецидивирования кондилом, а после проведения дополнительных сеансов деструкции эффективность комбинированной терапии достигала 98% (при контрольном наблюдении не менее 3 мес.).
Одним из показаний к применению препарата являются инфекции, вызванные ВПЧ: остроконечные кондиломы, ПВИ вульвы, вагины и шейки матки (в составе комплексной терапии).
В Европейском руководстве по лечению дерматологических болезней Изопринозин входит в список рекомендованных препаратов для терапии остроконечных кондилом и бородавок. Он также присутствует в Российском протоколе ведения больных с инфекциями, передаваемыми половым путем [51].
В инструкции по применению указано, что при рецидивирующей ПВИ Изопринозин назначают по 3 г/сут (2 таблетки 3 р./сут) как дополнение к местной терапии или деструктивным методам в течение 14–28 дней, далее с 3-кратным повторением указанного курса с интервалом в 1 мес. В литературе описаны и другие схемы его применения.
Известно о зарубежном опыте применения инозин пранобекса в качестве терапии, дополняющей деструкцию аногенитальных бородавок [52]. Препарат применяли по 1 г 3 р./сут в течение 28 дней. Количество рецидивов снижалось с 41% после криодеструкции до 6% при использовании комбинации Изопринозина и подофиллотоксина.
Близкие результаты влияния Изопринозина на частоту рецидивов получены в работе Г.Э. Баграмовой и соавт. [53]: 43,4% – при деструкции, 17,4% – при сочетании деструкций с Изопринозином.
Похожие результаты показаны в работах В.Н. Прилепской и соавт. [54]. Добавление к стандартному лечению Изопринозина в дозе 1 г 3 р./сут в течение 5 дней до проведения деструкции повышало эффективность терапии с 65,6 до 87,5% и в 3 раза снижало частоту рецидивов – с 28,1% при деструкции до 9,4% в случае комбинации с Изопринозином. Важно, что контроль за возникновением рецидивов осуществлялся в течение длительного времени – 6 мес. Также отмечалась высокая частота элиминации ВПЧ из очагов поражения – 65,6%.
Был проведен метаанализ результатов применения Изопринозина [58]. Данные из 15 источников, в которых описаны 2369 случаев применения Изопринозина в качестве монотерапии, 3369 – в комбинации с другими методами, в сравнении с 71 наблюдением плацебо-контроля и 575 наблюдениями за традиционным лечением, свидетельствуют об эффективности вспомогательной иммунотерапии Изопринозином на фоне применения традиционных методов при лечении генитальных поражений, ассоциированных с ВПЧ.
Заключение
Основным показателем эффективности любого метода удаления аногенитальных бородавок является отсутствие рецидивов (рис. 3). В данной работе мы постарались сделать акцент на методиках, позволяющих быстро и эффективно бороться с рецидивирующими проявлениями ПВИ. Для этого рекомендуется комбинированная фармакотерапия с использованием иммунотропной терапии. Такой подход обеспечивает эффективное лечение клинических проявлений ПВИ, что должно существенно улучшить ее контроль в популяции.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Комплексная терапия манифестных проявлений папилломавирусной инфекции урогенитального тракта
Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии, Екатеринбург
Эффективность комплексной терапии манифестных проявлений папилломавирусной инфекции урогенитального тракта
Клинические проявления ПВИ сопряжены с физическим и психологическим дискомфортом для пациентов, поэтому целью терапии являются: деструкция разрастаний, предупреждение развития осложнений, уменьшение числа рецидивов, улучшение качества жизни пациентов [3—11]. Выбор метода лечения при ассоциированных с вирусом папилломы человека (ВПЧ) заболеваниях аногенитальной области зависит от морфологии, размеров, количества и локализации высыпаний, возраста пациентов, наличия беременности и опыта врача.
Традиционные методы лечения аногенитальных бородавок включают крио-, электро-, радио- и лазерную деструкцию, обработку очагов поражения цитотоксическими лекарственными препаратами, вызывающими цитолиз и некроз ткани или механическое удаление кондилом и бородавок. Ввиду отсутствия патогенетического механизма воздействия на ПВИ, основными недостатками этих методов являются местные кожные реакции, такие как зуд, жжение, эрозии и боль, высокая частота рецидивов заболевания, необходимость многократного повторения процедур, вариабельность терапевтического эффекта, наличие осложнений и побочных реакций, негативно влияющих на качество жизни больных [12]. Эффективность комплексной терапии манифестных проявлений ПВИ аногенитальной области с включением иммунотропных препаратов была показана рядом отечественных и зарубежных исследований [8—11, 13—28]. Так как активация клеточного звена иммунитета сопровождается регрессом кондилом, в 80-е годы прошлого столетия было предложено использование в качестве иммуностимулятора аналога натуральных пуринов — инозинапранобекса (ИП). ИП по своей природе являясь производным пуринов и жизненно важным компонентом клеточного ядра, не обладает выраженным токсическим эффектом даже при назначении в больших дозах. Обычно природные аналоги ИП поступают в организм из разнообразных пищевых продуктов. Поэтому при правильном назначении ИП с учетом его противопоказаний в качестве иммуностимулятора частота побочных эффектов минимальна. Об этом свидетельствуют данные более 35-летнего использования ИП в медицинской практике [29]. ИП воздействует на иммунную систему, активируя ее клеточное звено, с одной стороны, усиливает секрецию интерферонов и ряда цитокинов, с другой — подавляет продукцию других провоспалительных цитокинов. Это приводит к «уравновешиванию» клеточного и гуморального звеньев иммунной системы, что сопровождается восстановлением адекватной противовирусной защиты организма [30].
Целью исследования была оценка клинической эффективности, переносимости и безопасности препарата гроприносин (инозин пранобекс) в комплексной терапии пациентов с манифестными проявлениями папилломавирусной инфекции аногенитальной области.
1. Определить клиническую эффективность комбинированной терапии: деструкция в сочетании с применением гроприносина.
2. Оценить безопасность терапии препаратом гроприносин.
Материалы и методы
Исследование клинической эффективности комбинированной терапии путем деструкции в сочетании с назначением гроприносина у пациентов с манифестными проявлениями папилломавирусной инфекции аногенитальной области было проведено на базе Уральского НИИ дерматовенерологии и иммунопатологии Минздравсоцразвития. В исследование вошли 25 женщин и 15 мужчин в возрасте от 19 до 42 лет с учетом критериев включения и исключения, после получения письменного согласия.
1-я группа — 20 пациентов, получавших комбинированную терапию, включающую деструкцию и назначение гроприносина.
2-я группа — 20 пациентов, которым была проведена только деструкция.
Деструкция кожных разрастаний проводилась факелом аргоновой плазмы и иссечения высокочастотным электрическим током в режиме радиоволны аппаратом ФОТЕК ЕА141.
Обследование пациентов проводилось по следующей схеме: сбор анамнеза в соответствии со стандартизованной анкетой; общеклинический осмотр и бимануальное исследование у женщин; общеклиническое исследование, включающее общий анализ крови и общий анализ мочи; кольпоскопическое и цитологическое обследование (у женщин) при наличии показаний.
Критерии включения
1. Пациенты: мужчины и женщины в возрасте от 18 до 50 лет.
2. Подтвержденный при клиническом осмотре и верифицированный диагноз — заболевания, вызванные ВПЧ.
3. Отсутствие на момент начала терапии каких-либо других ИППП.
4. Подписанная форма информированного согласия.
5. Для женщин — согласие применять барьерные методы контрацепции в течение всего исследования.
Критерии исключения
1. Реакции гиперчувствительности к препарату или его компонентам в анамнезе.
2. Наличие хотя бы одного тяжелого сопутствующего заболевания: хронические заболевания печени и почек, выраженные нарушения функции печени, почек и системы кроветворения, острая почечная недостаточность, сахарный диабет, эпилепсия и другие заболевания ЦНС.
3. Беременность, период лактации.
4. Сопутствующая антивирусная терапия.
5. Иммуносупрессивные состояния.
6. Прием в течение последнего месяца иммунотропных препаратов.
7. Лица, которым проводилось лечение в пределах 30 дней до начала настоящего исследования.
8. Наличие других ИППП.
Результаты исследования
Препарат применялся по 1000 мг перорально через равные промежутки времени 4 раза в сутки после еды в течение 10 дней в сочетании с деструктивными методами удаления аногенитальных бородавок. Гроприносин — иммуностимулирующий препарат с противовирусным действием. Представляет собой комплекс, содержащий инозин и N,N-диметиламино-2-пропанол в молярном соотношении 1:3.
Эффективность комплекса определяется присутствием инозина, второй компонент повышает его доступность для лимфоцитов. Гроприносин стимулирует биохимические процессы в макрофагах, повышает продукцию интерлейкинов. Усиливает синтез антител и пролиферацию Т-лимфоцитов, Т-хелперов, естественных клеток-киллеров. Стимулирует хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток. Гроприносин подавляет репликацию ДНК и РНК вирусов посредством связывания с рибосомами клетки, изменяя стереохимическое строение последних. Препарат хорошо переносится, так как имеет низкую токсичность. Его можно назначать больным в пожилом возрасте, страдающим, в частности, стенокардией или хронической недостаточностью кровообращения.
При назначении гроприносина в качестве вспомогательного лекарственного средства при инфекционном поражении слизистых оболочек и кожи, вызванном вирусом Herpes simplex, происходит более быстрое заживление пораженной поверхности.
Фармакокинетика
После приема внутрь препарат хорошо всасывается из ЖКТ и характеризуется хорошей биодоступностью. Инозин подвергается метаболизму по циклу, типичному для пуриновых нуклеотидов с образованием мочевой кислоты, уровень которой в сыворотке крови иногда может повыситься. В результате возможно образование кристаллов мочевой кислоты в мочевых путях. Кумуляции препарата в организме не обнаружено.
Полная элиминация препарата и его метаболитов из организма происходит в течение 48 ч.
— иммунодефицитные состояния, вызванные вирусными инфекциями, в том числе заболевания, вызванные вирусами Herpes simplex типов 1 и 2 (включая генитальный герпес и герпес другой локализации);
— подострый склерозирующий панэнцефалит (энцефалит Давсона).
Все изменения в лечении, касающиеся частоты применения препарата, а также побочные эффекты и нежелательные явления были отражены в амбулаторной карте больного.
Исследование включало шесть визитов: скрининг (визит 0), на котором оценивались критерии включения пациентов, проводился сбор анамнеза, через 3±2 дня после скрининга (визит 1) — назначение препарата, на 10±2-й день исследования (визит 2), на 30±2-й день исследования (визит 3), 60±2-й день исследования (визит 4), 90±2-й день исследования (визит 5). В течение визитов оценивали жалобы, проводили клинический осмотр и физикальное обследование, динамику клинических проявлений, оценку эффективности терапии и выраженность нежелательных явлений. Общеклиническое обследование, включающее ОАК и ОАМ, проводилось на 0 и 3-м визитах.
При оценке эффективности лечения проводилась как субъективная (самим больным), так и объективная (врачом-исследователем) оценка эффективности терапии.
Критерии эффективности: локализация и общее количество высыпаний в сравнении с начальным их количеством и размерами; наличие рецидивов; степень выраженности побочных явлений и их перечень; влияние на общеклинические параметры (ОАК, ОАМ).
Безопасность и переносимость лечения оценивалась на основе регистрации нежелательных явлений, сопутствующих заболеваний и лабораторных показателей.
В 1-ю группу вошли 20 пациентов (12 женщин и 8 мужчин) в возрасте от 19 до 42 лет, которым было проведено комплексное лечение аногенитальных бородавок путем деструкции разрастаний факелом аргоновой плазмы и иссечения высокочастотным электрическим током в режиме радиоволны аппаратом ФОТЕК ЕА141 в сочетании с системной противовирусной и иммуномодулирующей терапией препаратом гроприносин по 1000 мг 4 раза в сутки в течение 10 дней. Во 2-ю группу вошли 20 пациентов (13 женщин и 7 мужчин), получавших только деструктивную терапию разрастаний факелом аргоновой плазмы и иссечения высокочастотным электрическим током в режиме радиоволны аппаратом ФОТЕК ЕА141. Пациенты обеих групп были сопоставимы по возрасту, полу, соматическому статусу, данным анамнеза и клиническим проявлениям заболевания (р>0,05).
На наличие аногенитальных бородавок в анамнезе указали 18 (45,0%) пациентов обеих групп. Все они ранее получали различные виды деструктивной терапии.
Локализация высыпаний у 23 (92,0%) женщин — на половых губах, у 17 (68,0%) — преддверии влагалища, у 3 (12,0%) — в перианальной области, у 2 (8,0%) — на слизистой оболочке шейки матки и у 2 (8,0%) — на стенках влагалища. Локализация высыпаний в перианальной области у 2 (13,3%) мужчин, в области венечной борозды — у 9 (60,0%), на головке полового члена — у 6 (40,0%), на коже мошонки — у 5 (33,3 %) (поливариантный признак — сумма не имеет значения, так как у одного пациента возможно наличие более одного признака). Площадь поражения от 1 до 5 см 2 была у 5 (12,5%) пациентов, от 5 до 10 см 2 — у 29 (72,5%) и более 10 см 2 — у 6 (15,0%) пациентов. Высыпания в виде отдельных папул определялись у всех пациентов, а в виде «цветной капусты» — у 34 (85,0%). Кроме того, у 5 (12,5%) пациентов имелись трещины и кровоточивость.
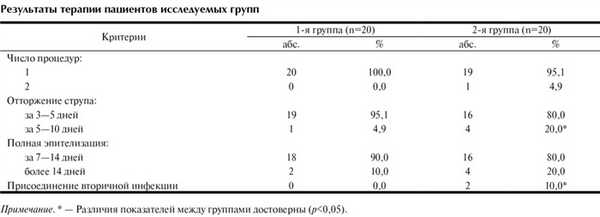
При назначении комплексного лечения остроконечных кондилом урогенитального тракта и аногенитальной области, включающего деструкцию и применение системной противовирусной и иммуномодулирующей терапии у пациентов 1-й группы, отторжение струпа произошло в течение 3—5 дней — у 19 (95,1%), а через 5—10 дней — у 1 (4,9%) (см. таблицу). Полная эпителизация наступила в течение 7—14 дней у большинства пациентов 1-й группы — 18 (90,0%). У 2 (10,0%) пациентов 2-й группы, получавших только деструктивную терапию, наблюдалось присоединение вторичной бактериальной инфекции, что приводило к увеличению сроков эпителизации по сравнению с результатами пациентов 1-й группы.
При оценке эффективности терапии самими пациентами все пациенты 1-й группы (100%) и 17 (85,0%) 2-й группы отметили высокую удовлетворенность методом лечения, хорошую переносимость, отсутствие необходимости частого посещения врача, возможность проведения процедуры в амбулаторных условиях. При динамическом наблюдении в течение 3 мес после окончания терапии у всех пациентов 1-й (100%) и у 16 (80,0%) 2-й группы отсутствовали рецидивы заболевания. Ни у одного из 40 пациентов не было выявлено отрицательного влияния терапии на общеклинические показатели (общий анализ крови и общий анализ мочи). Среди нежелательных явлений у 4 (20,0%) пациентов, получавших гроприносин, были отмечены умеренно выраженные диспепсические расстройства, связанные с нарушением режима приема (до еды или между приемами пищи), не потребовавшие отмены препарата.
Таким образом, применение ИП в комплексной терапии ПВИ аногенитальной области совместно с использованием деструктивных методов является целесообразным, позволяет добиться полного регресса высыпаний, а также предотвратить развитие рецидивов заболевания.
Этиопатогенетическая терапия папилломавирусной инфекции, ассоциированной с бактериальным вагинозом
Обоснована этиопатогенетическая терапия больных женщин с папилломавирусной инфекцией (ПВИ), ассоциированной с бактериальным вагинозом (БВ). Использование предложенной схемы лечения обеспечивает у большинства пациенток достижение стойкого клинического эффе
Etio-pathogenic therapy of women patients with papilloma viral infection (HPV) associated with bacterial vaginosis (BV) was grounded. Use of the proposed therapeutic scheme provides achievement of stable clinical effect in most of patients, as well as HPV elimination and prevention of HPV and BV recurrence.
Среди вирусных инфекций, поражающих аногенитальную область, наиболее распространена папилломавирусная инфекция (ПВИ), вызываемая вирусом папилломы человека (ВПЧ). Частота встречаемости одного из проявлений ПВИ — аногенитальных бородавок (остроконечных кондилом) — составляет 19,1%, а инфицированность урогенитального тракта ВПЧ среди лиц молодого и среднего возраста в некоторых популяциях достигает 34,4–44,9% [10]. ВПЧ — ДНК-содержащий вирус, персистирующий только в эпителиальных тканях. Патологические состояния, ассоциированные с ВПЧ, можно условно разделить на две основные группы: клинические формы, характеризующиеся экзофитными разрастаниями кожи и слизистых оболочек (остроконечные кондиломы), и субклинические формы, которые повреждают эпителиальные ткани, не вызывая экзофитного роста, но являющиеся чрезвычайно трудными для диагностики (плоские, инвертирующие кондиломы, цервикальные интраэпителиальные неоплазии всех степеней тяжести). ПВИ часто свойственно длительное течение без выраженной клинической симптоматики, высокая вероятность рецидивирования после лечения, а также возможность обратного развития без лечения [8].
ВПЧ имеет специальные механизмы, подавляющие как клеточный, так и гуморальный иммунитет, в частности интерфероновое звено иммунной системы [15]. Поэтому при ПВИ закономерно развиваются вторичные иммунодефициты, обусловленные недостаточностью разных звеньев иммунной системы. ВПЧ не инфицируют антиген-представляющие клетки, что является причиной отсутствия прямого пути активации системы иммунитета при ПВИ. Длительной персистенции ВПЧ способствует способность вируса «ускользать» от системного иммунного надзора. Хотя ВПЧ инфицирует преимущественно базальные клетки, репликация вируса и сборка вирусных частиц происходит в дифференцированных клетках поверхностного слоя эпителия, которые подвергаются последующему апоптозу, поэтому вышеуказанный процесс не сопровождается признаками воспаления, а иммунная система его практически игнорирует (эписомальная форма) [17]. Интегративная форма папилломавирусной инфекции обнаруживает снижение концентрации интерферонов альфа (ИФН-α), интерферонов гамма (ИФН-γ), интерлейкина-18 (ИЛ-18), а также локальную иммуносупрессию — повышение значений интерлейкина-10 (ИЛ-10) [1]. Ключевую роль в рецидивировании ПВИ играют локальные иммунные процессы, а именно цитокиновая регуляция локального иммунного ответа на ВПЧ. У женщин с ПВИ, имеющих морфологические изменения эпителия шейки матки или другую гинекологическую патологию, обнаружено выраженное снижение уровней ИНФ-α и фактора некроза опухолей альфа (ФНО-α), повышение концентраций ИНФ-γ, ИЛ-10 и повышение уровня секреторного иммуноглобулина А (sIgА) в цервикальной слизи. Избыток ИЛ-10 ведет к снижению противоинфекционной защиты и развитию хронических инфекций. ИЛ-10 также способствует стимуляции опухолевого роста в результате ингибирования T-клеточного иммунного ответа [7].
Cвоевременное выявление, лечение и профилактика данной инфекции продолжают оставаться чрезвычайно сложной задачей для практических врачей. Одной из причин этого является частое сочетание ПВИ с другими инфекциями, передающимися половым путем (ИППП), требующими терапии, а также возможные нарушения вагинальной микрофлоры, которые снижают эффективность лечения вирусной инфекции, а поэтому требуют своевременного их выявления и коррекции [9].
ПВИ может манифестировать как моноинфекция, однако многочисленные данные литературы свидетельствуют о том, что в наиболее тяжелой форме она протекает у женщин, инфицированных другими возбудителями, ввиду еще большего повышения пролиферативной активности эпителия. Большинство случаев рецидивов ПВИ связывают с провоцированием их другими ИППП, и как микст-инфекция выявляется в 71% случаев. При этом с генитальным кандидозом ПВИ сочетается в 33,3%, генитальным герпесом и цитомегаловирусной инфекцией — в 37%, хламидийной и микоплазменной инфекцией — в 46,3% и наиболее часто с бактериальным вагинозом (БВ) — в 66,7% случаев [6, 9].
Бактериальный вагиноз остается одной из самых распространенных патологий в акушерско-гинекологической практике и занимает 30–50% от общей заболеваемости вульвовагинальными инфекциями. БВ сопровождается усиленным ростом преимущественно облигатно анаэробных бактерий и резким снижением концентрации лактобактерий. Основную роль в возникновении БВ отводят нарушениям биоценоза влагалища, и к одному из эндогенных факторов относят нарушения общего и местного иммунитета. При БВ имеются нарушения в системе местного иммунитета (уменьшение концентрации IgA, sIgA, IgG и увеличение концентрации IgM, дисфункция нейтрофилов вагинального содержимого). Нарушения в системе общего иммунитета заметны лишь при длительно текущем заболевании (более 5 лет) [5].
При влагалищном дисбиозе на эпителий шейки матки воздействуют нитрозамины, выделяющиеся в процессе жизнедеятельности анаэробных бактерий, вызывающие патологические изменения в тканях. Кроме того, влагалищный дисбиоз и ВПЧ ведут к снижению выработки sIgA, что также способствует персистенции ВПЧ, увеличению площади атипичного со сниженной концентрацией гликогена эпителия шейки. Это еще больше снижает секрецию sIgA и усугубляет влагалищный дисбиоз. При хроническом цервикальном воспалении происходит миграция натуральных киллеров и фагоцитов, которые высвобождают медиаторы воспаления, ассоциированные с дисплазией и раком шейки матки, а также происходит повышенная продукция антимикробных оксидантов, которые могут вызвать окислительные повреждения ДНК хозяина [4].
Развитию БВ способствуют изменения уровня гормонов, нарушение микробиоценоза кишечника и иммунного статуса, предшествующая терапия антибиотиками, перенесенные в прошлом другие инфекции мочеполового тракта, применение иммунодепрессантов или гормональных средств, частая смена половых партнеров. Схожие факторы обнаруживаются при анализе анамнеза пациенток с ПВИ [9].
Согласно существующим принципам ведения больных с клиническими проявлениями, связанными с ВПЧ, лечение должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, на стимуляцию противовирусного иммунного ответа, а также на сочетание этих подходов [2, 11].
С учетом вирусного характера заболевания основными иммунными препаратами, которые используют для терапии остроконечных кондилом, являются препараты интерферона (ИФН). Применение ИФН в очагах поражения снижает количество вирусной ДНК, что коррелирует с клиническим улучшением или исчезновением поражений [13, 14].
Внутриочаговое применение препаратов ИФН-α и ИФН-β приводит к исчезновению 35–63% бородавок, причем как уже леченных, так и не леченных ранее [16].
На российском рынке представлен широкий выбор препаратов ИФН отечественных и зарубежных производителей. В связи с большей, по сравнению с человеческими ИФН, стойкостью рекомбинантных ИФН (рекомбинантный ИФН-α-2b, рекомбинантный ИФН-α-2а, очищенный ИФН-α-n1), им отдается предпочтение в практическом применении [10].
Терапия БВ также остается нелегкой задачей ввиду частого рецидивирования или низкой эффективности препаратов.
Сочетание ПВИ с БВ и, как следствие, нарушение вагинальной микрофлоры, снижающее эффективность лечения ПВИ, требуют своевременной терапии и коррекции. Своевременная коррекция микробиоценоза влагалища при ПВИ с дополнительным применением препаратов иммуномодулирующего действия положительно влияет на течение папилломавирусной инфекции у женщин.
Для лечения БВ применяются методы местной и системной терапии. Основными препаратами для лечения БВ являются метронидазол, клиндамицин и тинидазол, которые применяют как в таблетированной форме для приема внутрь, так и в виде местных форм. Метронидазол назначают в дозе 500 мг 3 раза в день в течение 7 дней или однократно в дозе 2 г [12].
Учитывая наличие местного иммунодефицита у больных ПВИ, ассоциированной с БВ, перспективно системное лечение с использованием иммуномодуляторов для интравагинального применения. Существенное увеличение уровня ИФН-α — важный элемент снижения вероятности рецидивов и восстановления противовирусного иммунитета [3].
Учитывая важность иммунитета как фактора риска возникновения БВ и персистенции ПВИ, целью настоящего исследования служила оптимизация терапии ПВИ, ассоциированной с БВ, за счет местной иммуномодулирующей терапии в комплексе с системной коррекцией влагалищного микробиоценоза.
Материал и методы исследования
Всем пациенткам было назначено лечение: интравагинальное введение суппозиториев Генферон® по 1 млн МЕ 2 раза в день в течение 10 дней (для лечения ПВИ) и метронидазол по 500 мг внутрь 3 раза в день в течение 7 дней (для лечения БВ). Деструктивные методы лечения ПВИ не применялись.
Эффективность лечения оценивали по результатам исследования влагалищного микробиоценоза до лечения, через 2 недели, 6 и 12 месяцев после окончания лечения и дополнительно — по результатам РАР-мазков (тест Папаниколау) и ВПЧ-тестирования (полимеразная цепная реакция) (через 6 и 12 месяцев). Кроме того, определяли концентрацию ИЛ-10 и ФНО-α в вагинально-цервикальном смыве через 6 месяцев после лечения.
Результаты обрабатывали статистически с использованием непараметрических критериев: U-критерия Манна–Уитни. Различия принимались достоверными при р < 0,05.
Результаты исследования и обсуждение
Результаты исследования показали, что нормализация влагалищного микробиоценоза произошла у всех женщин через 2 недели после лечения. Через 6 и 12 месяцев в шейке матки ДНК ВПЧ не определялась у 36 пациенток (81,8%) и у 4 пациенток (9,1%). При наблюдении в течение 12 месяцев у пациенток элиминация ВПЧ произошла у 40 пациенток (90,9% случаев), рецидивов БВ не было. Применение Генферон® и метронидазола позволило нормализовать концентрацию цитокинов в вагинально-цервикальном смыве (табл.).
Лечение БВ метронидазолом обосновано стандартами с учетом международных рекомендаций Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC). Метронидазол — антибактериальный препарат, широко применяется в практике лечения БВ, обладает быстрореализующимся противовоспалительным действием при отсутствии побочных эффектов на местный и общий иммунитет. Это является важным положительным свойством препарата при лечении генитальной вирусной инфекции.
Генферон® обладает иммуномодулирующим, противовирусным, опосредованным антибактериальным, местноанестезирующим, регенерирующим действием. Комбинированное действие Генферона® обусловлено компонентами в его составе, которые оказывают местное и системное действие. В состав Генферона® входит человеческий рекомбинантный интерферон альфа-2b. Он синтезируется генно-инженерно-модифицированным штаммом микроорганизма Escherichia coli. Интерферон альфа-2b является иммуномодулятором, а также оказывает антипролиферативное, антивирусное и антибактериальное действие. Эти эффекты вызваны стимулирующим действием препарата на внутриклеточные ферменты, которые ингибируют воспроизводство вируса. Интерферон усиливает клеточный иммунитет посредством активации ряда маркеров клеток-киллеров, ускорения деления B-лимфоцитов и синтеза ими антител, увеличения активности моноцитарно-макрофагальной системы и повышения распознаваемости зараженных и опухолевых клеток. В результате этого повышается эффективность борьбы организма с вирусами, бактериями, паразитами и раковыми клетками. Также под воздействием интерферона происходит активация лейкоцитов слизистой оболочки, которые участвуют в подавлении патологических очагов. Таурин нормализует метаболические процессы в тканях, способствует их регенерации, взаимодействует со свободными радикалами кислорода, нейтрализуя их и предохраняя ткани от повреждения. Интерферон менее подвержен распаду и дольше сохраняет свое действие благодаря присутствию таурина. Бензокаин (Анестезин) — местное обезболивающее средство. Он изменяет проницаемость цитоплазмы нейронов для ионов натрия и кальция, в результате чего не только блокируется проведение нервных импульсов по аксонам, но и ингибируется сам процесс возникновения нервных импульсов. Бензокаин обладает только местным эффектом и не всасывается в системный кровоток.
При вагинальном применении, благодаря большой концентрации препарата в очаге инфекции и его закреплении на клетках слизистых, достигается заметный местный терапевтический эффект. Препарат разрешен к применению у взрослых людей в соответствии с инструкцией в составе комплексной терапии при инфекционно-воспалительных заболеваниях урогенитального тракта (генитальный герпес, хламидиоз, уреаплазмоз, микоплазмоз, рецидивирующий вагинальный кандидоз, гарднереллез, трихомониаз, папилломавирусная инфекция, бактериальный вагиноз, эрозия шейки матки, цервицит, вульвовагинит, бартолинит, аднексит, простатит, уретрит, баланит, баланопостит).
Заключение
Результаты проведенного исследования обосновали этиопатогенетическую терапию больных с папилломавирусной инфекцией, ассоциированной с бактериальным вагинозом, местным использованием препарата Генферон® в комплексе с системным препаратом метронидазол. Практическое использование данной схемы лечения обеспечивает у большинства пациенток достижение стойкого клинического эффекта, элиминацию ВПЧ и профилактику рецидивов ПВИ и БВ. Иммунопатологические механизмы развития ПВИ и БВ объясняют высокую эффективность комплексного применения местной и системной терапии больных с ПВИ, ассоциированной с БВ.
Литература
- Андосова Л. Д. Состояние локального иммунитета в зависимости от тяжести плоскоклеточного интраэпителиального поражения шейки матки // Медицинский альманах. 2013. № 6 (30). С. 66–69.
- Ведение больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями: Клинические рекомендации РОДВ. Издательский дом «Деловой экспресс», 2012. 112 с.
- Летяева О. И., Абрамовских О. С., Гизингер О. А. Оппортунистические инфекции гениталий и папилломавирусная инфекция: новые возможности иммуномодулирующей терапии // Акушерство и гинекология. 2011. № 6. С. 108–112.
- Манухин И. Б., Крапошина Т. П., Григорян С. Н. Показатели эндотоксинемии, антиэндотоксинового иммунитета и вирусной нагрузки у пациенток с вульварной интра-эпителиальной неоплазией I степени, ассоциированной с вирусом папилломы человека // Врач скорой помощи. 2012. № 2. С. 51–55.
- Олина А. А., Падруль В. М. Папилломавирусная инфекция гениталий и бактериальный вагиноз // Фарматека. 2007. № 1. С. 49–54.
- Прилепская В. Н., Роговская С. И. Возможности Изопринозина в лечении хронических цервицитов и вагинитов // Российский медицинских журнал. 2007. Т. 16, № 3. С. 5–9.
- Прилепская В. Н., Довлетханова Э. Р. Папилломавирусная инфекция — от ранней диагностики к рациональной терапии // Акушерство и гинекология. 2013. № 2. С. 101–107.
- Роговская С. И., Теребнева Л. А. Клинические аспекты плоскоклеточных интраэпителиальных поражений низкой степени // Акушерство и гинекология. 2013. № 2. С. 139–143.
- Роговская С. И. Папилломавирусная инфекция у женщин и патология шейки матки: в помощь практикующему врачу. М.: ГЭОТАР-Медиа, 2008. 192 с.
- Соловьев А. М., Чернова Н. И. Фармакотерапия рецидивирующих клинических проявлений генитальной папилломавирусной инфекции // Российский медицинский журнал. 2015. № 11. С. 621–625.
- Федеральные клинические рекомендации по ведению больных аногенитальными (венерическими) бородавками. М.: РОДВ, 2015. 14 с.
- Шперлинг Н. В., Венгеровский А. И., Шперлинг И. А. Оптимизация системной терапии больных с бактериальным вагинозом // Российский вестник акушера-гинеколога. 2014. Т. 14. № 6. С. 103–107.
- Arany I., Nagamani K., Tyring S. K. Interferon resistance is independent from copy numbers in benign HPV-induced lesions // Anticancer. Res. 1995. Vol. 15, № 3. P. 1003–1006.
- Arany I., Goel A., Tyring S. K. Interferon response depends on viral transcription in human papillomavinus-contaning lesions // Anticancer Res. 1995. Vol. 15. P. 2865–2869.
- Cusini M., Salmaso F., Zerboni R., Carminati G., Vernaci C., Franchi C., Locatelli A., Alessi E. 5% imiquimod cream for external anogenital warts in HIV-infected patients under HAART therapy // Int. J. Std. Aids. 2004. Vol. 15. Р. 17–20.
- Dinsmore W., Jordan J., O’Mahony C., Harris J. R., McMillan A., Radcliffe K. W., Engrand P., Jackson B. W., Galazka A. R., Abdul-Ahad A. K., Illingworth J. M. Recombinant human interferon-beta in the treatment of condylomata acuminate // Int. J. STD. AIDS. 1997. Vol. 8 (10). Р. 622–629.
- Ocnishi H., Kosuzume H., Inaba H. et al. Mehanizm of host defens suppression induced by viral infection: mode of action of Inosimplex as an antiviral agent // Infect. Immun. 1982. Vol. 38 (1). P. 245–250.
Н. В. Шперлинг, доктор медицинских наук, профессор
Дифференцированный подход к выбору тактики ведения пациентов с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией
Проведен анализ частоты встречаемости папилломавирусной инфекции урогенитального тракта среди пациентов урологического приема у 360 мужчин репродуктивного возраста. Представлены данные о клинических особенностях течения папилломавирусной инфекции в ассоци
Differentiated approach to selection of strategy of observing patients with viral and bacterial urethritis associated with HPV infection
The analysis of frequency of occurrence papillomaviral infection by an infection papillomaviral infection a path at 360 men of reproductive age is carried out. The data about frequency of occurrence papillomaviral infection an infection and clinical features of its current in associations with is conditional-pathogenic microorganisms is presented.
В последние годы большое внимание исследователей и практикующих специалистов привлекают вопросы своевременной диагностики и эффективного лечения папилломавирусной инфекции (ПВИ) человека, что связано с неуклонным ростом ее распространенности, высокой контагиозностью и доказанной онкогенностью [1–3]. Вирус папилломы человека (ВПЧ) обусловливает многообразие поражений кожи и слизистых оболочек. Полагают, что папилломавирусная инфекция носит оппортунистический характер, и манифестация болезни происходит на фоне изменений в иммунной системе, которая становится несостоятельной в распознавании и элиминации трансформированных вирусом клеток [1, 4–6]. В то же время, несмотря на широкое распространение инфекции и большое количество посвященных ей исследований, до настоящего времени мало изучены факторы, лежащие в основе рецидивирования ПВИ, изменений специфической и неспецифической реактивности организма [7, 8].
Доминирующим кофактором, способствующим развитию ВПЧ-инфекции, является сексуальная активность. В целом рак гениталий, как и выявление ВПЧ, регистрируется чаще среди пациентов, рано начавших половую жизнь и имеющих большое количество половых партнеров [5, 9, 10]. Так, высок процент обнаружения этого вируса у сексуально активных подростков и молодых людей, не использующих барьерные методы контрацепции. Вторым важнейшим кофактором инфицирования, снижающим местный иммунитет, является наличие урогенитальных инфекций: хламидии, уреаплазмы, микоплазмы и условно-патогенная микрофлора [11].
Данные о частоте ПВИ урогенитального тракта в России недостаточно полны и основаны на статистике отдельных медицинских учреждений или врачей, занимающихся этой патологией [12].
Диагностика ПВИ представляет определенные трудности, особенно ее латентной формы, при которой, несмотря на наличие вируса папилломы человека, морфологических изменений в ткани не наблюдается [13].
Отягчающим фактором является длительная персистенция ВПЧ, на фоне которой развивается интраэпителиальная неоплазия, в 15,0–20,0% случаев приводящая к carcinoma in situ и инвазивному раку [2, 6, 11, 14]. Потенциальный риск озлокачествления эпителия при длительно существующей (персистирующей) папилломавирусной инфекции диктует необходимость обязательной санации при выявлении ВПЧ.
Материалы и методы исследования
На базе ФГБУ УрНИИДВиИ МЗ РФ было проведено комплексное клинико-лабораторное обследование 360 мужчин в возрасте от 21 до 46 лет (средний возраст составил 33,2 ± 2,2), обратившихся с различными жалобами со стороны органов мочеполового тракта. Из всех обследованных пациентов 54,0% имели половые контакты с одной половой партнершей, 32,0% имели половые контакты с двумя и 14,0% мужчин — с тремя и более. Клиническое обследование включало осмотр наружных половых органов, ректальное пальцевое исследование предстательной железы. По показаниям проводилось ультразвуковое исследование предстательной железы. Материалом для бактериоскопического и бактериологического исследования служило отделяемое уретры. Исследование проводилось в нативных препаратах и при микроскопии препаратов, окрашенных метиленовым синим и по Граму.
Результаты и обсуждение
При первичном обращении основными жалобами пациентов были дискомфорт в мочеиспускательном канале (61,0%), дискомфорт в области промежности (18,0%), выделения из уретры слизистого или слизисто-гнойного характера (30,0%), жжение в уретре (43,0%), гиперемия и отечность губок уретры (54,0%), гиперемия кожи головки полового члена (36,0%), налет на головке полового члена (22,0%). Высыпания на половом члене в виде остроконечных кондилом наблюдались у 50 (14,0%) пациентов (табл. 1).
При проведении диагностики методом полимеразной цепной реакции (ПЦР) у 86 пациентов было выявлено сочетание ВПЧ с другими инфекциями, передающимися половым путем. Так, у 6 (7,1%) пациентов было обнаружено наличие Ch. trachomatis, у 25 (29,2%) — U. urealyticum, у 9 (10,0%) — M. genitalium (табл. 3). Сопутствующие инфекции, передаваемые половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов. При смешанной инфекции не исключается возможность синергического действия возбудителей на развитие и течение воспалительного процесса.
При бактериологическом исследовании отделяемого уретры больных с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией, наиболее часто обнаруживался Enterococcus faecalis (22,0%), у 15,0% больных был выделен Streptococcus agalactiae, у 11,0% — E. coli, у 4,0% — Staphilococcus aureus, у 4,0% — Haemophilus parainfluenzae, у 3,0% — Candida albicans, у 3,0% — Gardnerella vaginalis (рис. 1).
Таким образом, с учетом обозначенной проблемы и негативной роли папилломавирусной инфекции на органы репродуктивной системы приводим дифференцированный подход к выбору тактики ведения пациентов с урогенитальной ПВИ в зависимости от варианта течения (рис. 2).
Обследование на онкогенные типы ВПЧ показано пациентам с инфекциями, передаваемыми половым путем (ИППП), нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. По эпидемиологическим показаниям обследованию на онкогенные типы ВПЧ подлежат половые партнеры женщин с ИППП, в том числе вирусной этиологии, пациенты с ранним возрастом начала половой жизни, лица промискуитетного поведения.
Латентная форма ПВИ диагностируется только с помощью молекулярно-биологических методов исследования — выявление ВПЧ высокого онкогенного риска методом ПЦР при отсутствии клинических проявлений. Производится комплексное бактериологическое, бактериоскопическое, молекулярно-биологическое (ПЦР) исследование отделяемого уретры на N. gonorrhoeae, T. vaginalis, C. trachomatis, U. urealyticum, M. hominis, M. genitalium, G. vaginalis, дрожжеподобные грибы рода Candida, Herpes simplex virus I, II типов, Cytomegalovirus, определение микрофлоры урогенитального тракта с учетом количества, вида микроорганизмов и чувствительности микрофлоры к антибиотикам, выявление микст-инфицирования ИППП. При верификации сопутствующих ИППП и условно-патогенной микрофлоры в диагностически значимых титрах лечение пациенту назначается в соответствии с чувствительностью к антибактериальным препаратам.
При транзиторном варианте течения папилломавирусной инфекции урогенитального тракта, при отсутствии манифестных проявлений, необходимо диспансерное наблюдение в кожно-венерологическом учреждении с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной ПВИ рекомендовано назначение противовирусной и/или иммунотропной терапии, способствующее уменьшению степени риска развития неопластических процессов. При латентном течении ПВИ необходимо наблюдение и регулярное обследование в кожно-венерологических учреждениях.
Выводы
Таким образом, проведя анализ полученных данных, можно сделать вывод о высоком уровне инфицированности мужчин репродуктивного возраста ВПЧ высокого онкогенного риска (24,0%), при этом сопутствующие инфекции, передаваемые половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов, так как микст-инфицирование различными генотипами ВПЧ снижает скорость элиминации вируса из организма при терапии и является неблагоприятным прогностическим признаком.
Клиническими показаниями для обследования на онкогенные типы ВПЧ являются пациенты с инфекциями, передающимися половым путем, нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. При транзиторном варианте течения ВПЧ, при отсутствии манифестных проявлений необходимо диспансерное наблюдение в кожно-венерологических учреждениях с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной папилломавирусной инфекции рекомендовано назначение противовирусной и/или иммунотропной терапии.
- Евстигнеева Н. П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза: автореф. дис. … д-ра мед. наук. М., 2007. 46 с.
- Евстигнеева Н. П., Кузнецова Ю. Н., Герасимова Н. М. Критерии диагностики урогенитальной персистирующей папилломавирусной инфекции // Инфекции, передаваемые половым путем. 2009. № 3–4. С. 25–31.
- Козлова В. И., Пухнер А. Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. Рук-во для врачей. М.: Изд-во «Триада-Х», 2003. 439 с.
- Akgül B., Cooke J. C., Storey A. HPV-associated skin disease // J. Pathol. 2006. Vol. 208. № 2. P. 165–175.
- Bosch F. X., Lorinez A., Munos N., Meijer С. J. L. M., Shacn K. V. The causal relation between papillomavirus and cervical cancer // Journal of clinical partology. 2002. Vol. 55, 4, P. 244–265.
- Sedlacek T. V. Advances in the diagnosis and treatment of human papillomavirus infection // Clin. Obstet. Gynnecol. 1999. V. 42, № 2. Р. 206–220.
- Bosch F. X., Lorincz A., Munos M., Meijer C. J., Shah K. V. The causal relation between human papillomavirus and cervical cancer // J Clin Pathol. 2002. 55. P. 244–265.
- Uschieri K., Whitley M., Cubie H. Human papillomavirus type specific DNA and RNA persistenceimplications for cervical disease progression and monitoring // J Med Virol. 2004 May. 73 (1) H. Р. 65–70.
- Giuliano A. R., Tortolero-Luna G. Epidemiology of Human Papillomavirus infection in men, cancers other than cervical and benign conditions // Vaccine. 2008. V. 26. Р. 17–27.
- Schlecht N. F., Kulaga S., Robitaille J. et al. Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia // JAMA. 2001; 286. P. 3106–3114.
- Wu R., Sun S., Steinberg B. M. Requirement of STAT3 activation for differentiation of mucosal stratified squamous epithelium // Mol. Med. 2003. Vol. 9 (3–4). Р. 77–84.
- Тихонова Л. И. Обзор ситуации с ИППП // Заболевания, передаваемые половым путем. 1999. № 1. С. 15–17.
- Минкина Г. Н., Манухин И. Б., Франк Г. А. Предрак шейки матки. М.: Аэрографмедиа, 2001.
- Молочков В. А., Киселев В. И., Рудых И. В. и др. Папилломавирусная инфекция, клиника, диагностика, лечение. М.: Изд-во РГМУ, 2004. 43 с.
Н. И. Скидан, кандидат медицинских наук
Д. В. Орехов 1
А. П. Горбунов, кандидат медицинских наук
Н. П. Евстигнеева, доктор медицинских наук, профессор
Ю. Н. Кузнецова, кандидат медицинских наук
Читайте также:
- Дыхание Куссмауля. Нарушения ритма. Тахикардии.
- Признаки хрящевых и костно-хрящевых повреждений голеностопного сустава на артрограмме
- Нейрохирургия менингиомы - симптомы, диагностика, лечение
- Ведение пациентов с почечной недостаточностью. Ведение пациента с острым тубулярным некрозом.
- Диагностика субэпендимомы по КТ, МРТ
