Костный мозг. Функции костного мозга. Миеломоноцитопоэз.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Происхождение ( образование ) клеток иммунной системы. Функции клеток иммунной системы. Лимфопоэз. Бурса Фабрициуса.
Лимфоциты, как и другие клетки крови, ведут свое происхождение из единой стволовой гемопоэтической клетки. Лимфопоэз имеет черты сходства с общим гемопоэзом: зависит от контактов клеток-предшественниц со стро-мальными клетками и от влияния цитокинов. Вместе с тем лимфопоэзу присущи некоторые особенности: возникновение в процессе пролиферации клеток-предшественниц широкого разнообразия Т- и В-лимфоцитов с разными антигенраспознающими рецепторами; гибель путем апоптоза значительной части пролиферирующих клеток-предшественниц; избирательное накопление в результате пролиферации клеток — потомков одной клетки, первоначально активированной при контакте с соответствующим антигеном, «клона» клеток, все клетки которого несут одинаковые по специфичности антигенраспознающие рецепторы.
Лимфоциты — это единственные клетки организма, способные специфически распознавать собственные и чужеродные антигены и отвечать активацией на контакт с конкретным антигеном. При весьма сходной морфологии малые лимфоциты делятся на две популяции, имеющие различные функции и продуцирующие разные белки (табл. 8.1).
Одна из популяций получила название В-лимфоциты, от названия органа «бурса Фабрициуса», где было впервые обнаружено созревание этих клеток у птиц. У человека В-лимфоциты созревают в костном мозге. В-лимфоциты распознают антигены специфическими рецепторами иммуно-глобулиновой природы, которые по мере созревания В-лимфоцитов появляются на их мембранах. Взаимодействие антигена с такими рецепторами является сигналом активации В-лимфоцитов и их дифференцировки в плазматические клетки, продуцирующие и секретирующие специфические для данного антигена антитела — иммуноглобулины.
Таблица 8.1. Классификация лимфоцитов человека
Другая популяция получила название Т-лимфоциты в связи с дифференцировкой их предшественников в тимусе. Эта популяция включает разные субпопуляции, среди которых наиболее отчетливо различаются Т-хелперы (CD4+) и цитотоксические Т-лимфоциты (CD8+). В отличие от В-лимфоцитов, способных распознавать и связывать белковые, полисахаридные и липопротеидные растворимые антигены, Т-лимфоциты могут распознавать только короткие пептидные фрагменты белковых антигенов на поверхности вспомогательных антигенпредставляющих клеток (дендритных, макрофагов или В-лимфоцитов) в комплексах с собственными молекулами главного комплекса гистосовместимости. Связывание антигена с антиген-распознающим рецептором на клеточной мембране индуцирует активацию Т-лимфоцита, которая проявляется продукцией и секрецией цитокинов, усиливающих процессы пролиферации и дифференцировки самих Т-лимфоцитов, В-лимфоцитов и макрофагов.
Т-лимфоциты выполняют важнейшую функцию специфического распознавания и связывания антигена, что ведет к их активации, пролиферации и дифференцировке разных субпопуляций Т-лимфоцитов, участвующих далее во всех формах иммунного ответа.
Главной функцией В-лимфоцитов также является специфическое распознавание антигена, которое ведет к их активации, пролиферации и дифференцировке в плазматические клетки — продуценты специфических антител — иммуноглобулинов, т. е. к гуморальному иммунному ответу. Чаще всего В-лимфоциты для развития гуморального иммунного ответа нуждаются в помощи Т-лимфоцитов в виде продукции активирующих цитокинов.
Имеется еще один тип лимфоцитов — большие гранулярные лимфоциты, отличающиеся от меньших по величине Т- и В-лимфоцитов не только особенностями структуры, но и отсутствием антигенраспознающего рецептора. Эти клетки получили название «естественные киллеры»: они способны убивать инфицированные разными вирусами клетки-мишени или опухолевые клетки (см. табл. 8.1).
Все процессы транспортировки лимфоцитов из первичных во вторичные органы иммунной системы, из вторичных органов иммунной системы в ткани зависят от взаимодействия особого типа цитокинов — хемокинов с соответствующими рецепторами на поверхности клеток. Кроме хемокинов миграция лимфоцитов зависит от присутствия на их поверхности адгезионных молекул, которым соответствуют молекулы-лиганды на поверхности эндотелиальных клеток сосудов, на поверхности макрофагов и дендритных клеток, на элементах внеклеточного матрикса.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Костный мозг. Функции костного мозга. Миеломоноцитопоэз.
Тимус в качестве одного из центральных органов иммунной системы является местом созревания Т-лимфоцитов из клеток-предшественниц и формирования огромного разнообразия зрелых Т-лимфоциов, способных распознать своими рецепторами любой антиген.
Лимфоциты, находящиеся в тимусе, называют тимоцитами. В тимусе идут параллельно несколько процессов:
• пролиферация Т-лимфоцитов,
• их созревание (дифференцировка),
• отбор пригодных для данного организма клеток, которому сопутствует гибель значительной части непригодных клеток.
Ранние клетки-предшественницы Т-лимфоцитов из костного мозга поступают в корковый слой тимуса. Постепенно они мигрируют из коркового слоя тимуса в мозговой, контактируя с тимическими эпителиальными клетками, макрофагами и дендритными клетками. На тимоциты влияют продуцируемые тимическими эпителиальными клетками гормоны: тимулин, al- и (34-тимозины, тимопоэтин, контролирующие их дифференцировку. В процессе продвижения в мозговой слой тимоциты созревают (дифференцируются), поэтапно приобретая характерные для зрелых Т-лимфоцитов поверхностные рецепторы и антигены.
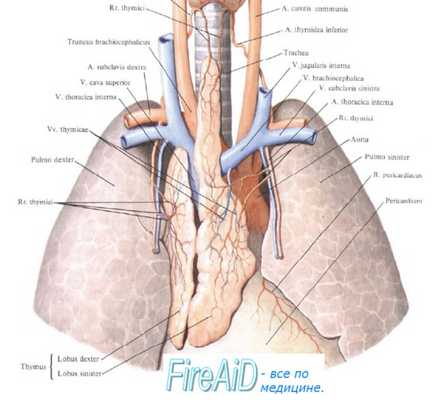
От стромальных клеток тимуса и продуцируемых ими молекул каждый тимоцит получает сигналы: усиления пролиферации, изменений поверхностного фенотипа (сочетания молекул, присутствующих на поверхности клеток), перестройки («реаранжировки») генов, ответственных за широкое разнообразие специфических антигенраспознающих рецепторов.
Основная функция зрелых Т-лимфоцитов — это распознавание чужеродных антигенных пептидов в комплексе с собственными молекулами главного комплекса гистосовместимости на поверхности антигенпредстав-ляющих клеток. Для выполнения этой функции Т-лимфоциты располагают специфическими антигенраспознающими рецепторами.
Отбор тимоцитов идет в два этапа (рис. 8.4). После того как на тимоците формируется Т-клеточный рецептор определенной специфичности, в следующие этапы развития вступают только те тимоциты, которые проявили способность распознавать собственные молекулы главного комплекса гистосовместимости, присутствующие на эпителиальных клетках коры тимуса данного организма. В отличие от зрелого Т-лимфоцита, который при встрече с антигенным пептидом, специфичным для его Т-клеточного рецептора, получает сигнал активации, незрелые тимоциты в тимусе при распознавании специфичных для их Т-клеточных рецепторов аутоантигенных пептидов получают сигнал генетически программированной гибели — апоптоза. Таким образом, идет «выбраковка» аутореактивных Т-лимфоци-тов, 95—98 % тимоцитов ежедневно погибают в тимусе этим путем. Только 2—5 % тимоцитов (1 • 10б) в виде зрелых Т-лимфоцитов ежедневно покидают тимус, поступая в кровь и расселяясь в лимфоидных органах.
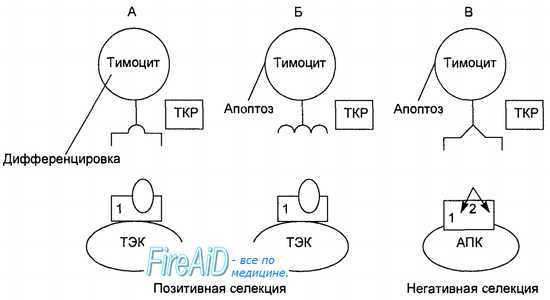
Рис. 8.4. Этапы отбора тимоцитов.
A. Тимоцит, способный распознать своим рецептором (ТКР) собственные антигены главного комплекса гистосовместимости (1) на поверхности тимических эпителиальных клеток (ТЭК), вступает в дальнейшую дифференцировку.
Б. Тимоцит, не способный распознать своим ТКР собственные антигены главного комплекса гистосовместимости (1) на поверхности ТЭК, получает сигнал апоптоза.
B. Тимоцит, способный распознать своим ТКР пептидный фрагмент аутоантигена (2) на поверхности антигенпредставляющеи клетки в комплексе с собственными молекулами главного комплекса гистосовместимости (1), получает сигнал апоптоза.
В результате в кровоток и в лимфоидные органы поступают только те Т-лимфоциты, которые несут рецепторы, распознающие чужеродные пептиды в сочетании с собственными молекулами главного комплекса гисто-совместимости.
Тимус представляет собой единственный орган иммунной системы, подвергающийся быстрой возрастной инволюции, которая у людей начинается после первого года жизни. Человек ежегодно теряет до 3 % истинно тимической ткани, которая постепенно замещается жировой и соединительной тканью. Соответственно снижается и продукция Т-лимфоцитов. Высокая продукция Т-лимфоцитов сохраняется до двух лет, а затем быстро снижается. Однако количество Т-лимфоцитов в организме сохраняется на достигнутом уровне благодаря тому, что значительную часть популяции Т-лимфоцитов составляют долгоживущие клетки, которые не нуждаются в постоянном обновлении. Более того, зрелые Т-лимфоциты, распознавшие «свой» антиген в периферических органах иммунной системы, получают сигналы активации и избирательной пролиферации, за счет чего их численность возрастает. Перенесенная взрослым человеком тимэктомия не приводит к катастрофическому снижению количества циркулирующих Т-лимфоцитов.
В качестве одного из центральных органов иммунной системы тимус выполняет следующие функции: а) контролирует пролиферацию, диффе-ренцировку, отбор и окончательное созревание Т-лимфоцитов, б) продуцирует тимические гормоны, влияющие на функции Т-лимфоцитов.
- Вернуться в оглавление раздела "Физиология человека."
Продолжая функцию эмбриональной печени, костный мозг является местом гемопоэза, в том числе лимфопоэза (рис. 8.3). Единая гемопоэтическая стволовая клетка может дифференцироваться в сторону общей клетки-предшественницы лимфоцитов. Эта клетка дает начало клеткам-предшественницам В-лимфоцитов, Т-лимфоцитов и естественных киллеров. Дальнейшая дифференцировка лимфоцитов зависит от влияния колониестимулирующих факторов, продуцируемых стромальными клетками костного мозга. Созревающие активированные лимфоциты начинают продуцировать цитокины, аутокринно влияющие на их пролиферацию и дифференцировку. Так, интерлейкин-1 и интерлейкин-6 служат синергиста-ми колониестимулирующих факторов в стимуляции пролиферации клеток-предшественниц; интерлейкин-2 является ростовым фактором Т-лимфоцитов; интерлейкины-4, -6, -7 способствуют выживанию, пролиферации и дифференцировке ранних предшественниц лимфоцитов; туморнекротизи-рующий фактор (ТНФ), гамма-интерферон, трансформирующий ростовой фактор-бета (ТРФ-бета), напротив, ингибируют процессы пролиферации и дифференцировки клеток-предшественниц.
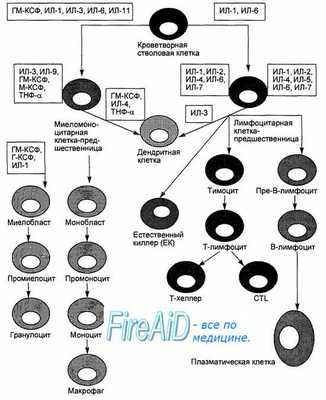
Рис. 8.3. Миеломоноцитопоэз и лимфопоэз в общей системе гемопоэза. Единая стволовая гемопоэтическая клетка является общей клеткой-предшественницей всех ростков кроветворения. Миеломоноцитарные клетки-предшественницы под контролем указанных групп цитокинов созревают и дифференцируются в гранулоциты и моноциты/макрофаги. Клетки-предшественницы лимфоцитов под влиянием указанных групп цитокинов созревают и дифференцируются в Т- и В-лимфоциты, или в естественные киллеры. Миелоид-ные и лимфоидные клетки-предшественницы могут дифференцироваться в дендритные клетки в присутствии указанных цитокинов.
Созревшие в костном мозге клетки-предшественницы Т-лимфоцитов через кровоток попадают в тимус для дальнейшей дифференцировки. В отличие от Т-лимфоцитов, местом дальнейшего созревания В-лимфоцитов у млекопитающих является костный мозг. Один из продуктов стромальных клеток костного мозга — интерлейкин- 7 преимущественно стимулирует процесс созревания В-лимфоцитов из костномозговых предшественников. Созревшие В-лимфоциты выходят в кровь, заселяют лимфоидные органы, участвуют в рециркуляции, проявляя способность к распознаванию конкретного антигена. Распознавание антигена служит одним из сигналов активации В-лимфоцитов и их дальнейшей дифференцировки в плазматические клетки, продуцирующие и секретирующие антитела (иммуноглобулины). Иммуноглобулины продуцируются в костном мозге и в периферических органах иммунной системы, откуда поступают в кровоток.
Таким образом, костный мозг в качестве одного из центральных органов иммунной системы выполняет следующие функции: является местом начальной дифференцировки и пролиферации ранних клеток-предшественниц лимфоцитов; является местом дальнейшей дифференцировки В-лимфоцитов вплоть до их выхода в кровоток и заселения периферических органов иммунной системы; является местом продукции и секреции колониестимулирующих факторов и цитокинов, влияющих на процессы пролиферации, дифференцировки и транспортировки Т- и В-лимфоцитов; является одним из мест продукции и секреции антител (иммуноглоблинов).
Миелограмма костного мозга

Костный мозг (КМ) — это важнейшая кроветворная (миелоидная) ткань человеческого организма. В ней размножаются и созревают стволовые клетки — клетки-предшественницы всех кровяных клеток: эритроцитов, лейкоцитов, тромбоцитов. Они являются основным компонентом костного мозга. Костный мозг есть внутри всех костей человеческого организма. Кости имеют пористую структуру, густо пронизаную проницаемыми сосудами, в которые легко попадают молодые кровяные клетки.
Различают два типа КМ: красный и желтый. Масса КМ составляет около 4,6% от общего веса человека. При этом вес красного и желтого его типов в костях приблизительно одинаков. Красный костный мозг дислоцируется в костях таза, плоских костях, концах трубчатых костей и позвонках. Именно в нем происходят процессы кроветворения.
Желтый тип локализуется в полостях трубчатых костей и представляет собой жировую ткань, которая служит резервом для красного типа КМ. В условиях острой нехватки молодых клеток крови желтый мозг трансформируется в красный и в нем начинается гемопоэз.
Миелограммой называется результат прижизненного качественного и количественного исследования тканевого и клеточного состава костного мозга. Термин происходит от слов греческого происхождения и буквально переводится как «запись костного мозга». Расшифровка результатов исследования мазка или пунктата КМ оформляется в виде таблицы, в которой представлено процентное соотношение разных клеток.
В отличие от крови, порцию которой можно легко взять для проведения анализа из периферических сосудов, КМ недоступен для простого отбора образцов. Чтобы выполнить его исследование, необходимо провести пункцию или биопсию кости. Эта манипуляция для гематолога не является сложной, но требует специальных инструментов и соответствующей квалификации врача, поэтому ее не проводят в обычных клинических лабораториях.
Взятие биоматериала
Для проведения миелограммы необходим красный КМ. Получить его образец можно путем пункции грудины (стернальная пункция), биопсии подвздошной (трепанобиопсия), пяточной, бедренной или большеберцовой костей.
Первые две процедуры для взятия образца биоматериала в гематологии используются чаще всего. Трепанобиопсия позволяет получить большой объем биоматериала для исследования. Взятие образцов КМ из пяточной и других костей ног применяют у новорожденных и маленьких детей.
Показания и противопоказания
Целью исследования КМ является выявление нарушений гемопоэза. Исследование миелограммы показано при:
- анемиях (кроме железодефицитной) и цитопениях;
- беспричинном увеличении СОЭ в общем анализе крови;
- острых и хронических лейкозах;
- эритремии;
- миеломе;
- лимфогранулематозе и неходжкинских лимфомах;
- метастазировании злокачественных опухолей в кости;
- наследственных заболеваниях (болезнях Ниммана-Пика, Гоше, Урбаха-Вите);
- спленомегалии неясного происхождения.
Пункцию костного мозга проводят для установления стадии и фазы лейкозов, их дифференциальной диагностики с лейкемоидными реакциями. Исследование миелограммы показано для определения гистосовместимости костного мозга донора и реципиента.
Стернальная пункция или трепанобиопсия противопоказаны больным с острым инфарктом миокарда, инсультом, в момент приступа стенокардии, удушья, при гипертоническом кризе.
Подготовка к процедуре
Процедура взятия КМ является обычной для гематологии. Какой-либо специальной подготовки пациента к стернальной пункции или трепанобиопсии не требуется.
Подготовка к манипуляции мало отличается от подготовки к другим малоинвазивным процедурам:
- больной перед манипуляцией должен быть обследован (общий анализ крови, коагулограмма);
- за несколько дней отменяют антикоагулянты и антиагреганты, а также все другие лекарства, кроме жизненно необходимых;
- за несколько часов пациенту нельзя кушать и пить (если процедура назначена на вторую половину дня, пациенту с утра необходим легкий завтрак);
- за 2 часа до манипуляции нужно опорожнить кишечник, а непосредственно перед ней — мочевой пузырь;
- если в месте будущего прокола кожи имеются волосы, их сбривают.
О наличии у обследуемого какой-либо аллергии необходимо уведомить врача, особенно если это аллергическая реакция на местные анестетики.
В день забора биоматериала больному нельзя назначать другие процедуры и оперативные вмешательства. При сильном чувстве страха больному следует принять седативные препараты за полчаса до процедуры, о чем нужно сообщить врачу. Стернальная пункция и трепанобиопсия не являются приятными манипуляциями, но и к болезненным их отнести сложно.
Место прокола кожи и надкостницы обрабатывается местным анестетиком, поэтому боль в этом месте не ощущается.
Непосредственно перед процедурой у пациента берут информированное согласие на манипуляцию: ему объясняют ход ее проведения, а также возможные осложнения после нее. Если пункция предстоит несовершеннолетним детям, информированное согласие берут у их родителей или других законных представителей.
Проведение костномозговой пункции
Больного укладывают на кушетку: при стернальной пункции — на спину (между лопатками укладывают валик), при трепанобиопсии — на правый бок или живот. Место пункции обрабатывают спиртовым раствором йода и проводят обезболивание с помощью местноанестезирующих препаратов.
Для проведения манипуляции нужен специальный инструментарий: игла Кассирского (для стернальной пункции) или игла-троакар с мандреном (для трепанобиопсии). На свободном конце троакара имеются насечки, играющие роль своеобразной «фрезы». С помощью этой «фрезы» вкручивающими движениями «просверливают» наружный слой кости.

Игла при стернальной пункции вводится между третьим и четвертым ребрами по срединной линии. Прокол кожи и подвздошной кости при проведении трепанобиопсии делают в районе локализации гребня кости, чаще слева от позвоночника: так врачу легче проводить манипуляцию.
У маленьких детей грудина слишком тонкая и мягкая, поэтому имеется вероятность ее сквозного прокола, что является неблагоприятным осложнением. По этой причине взятие образца костного мозга у детей проводят из бедренной или большеберцовой кости, а у новорожденных — из пяточной. Другие кости вместо грудины выбирают также для взятия биоптата у пожилых людей с выраженным остеопорозом и у лиц, длительно принимающих кортикостероиды (из-за риска перелома грудины).
Взятый пунктат (биоптат) извлекают из иглы и помещают на предметное стекло (для цитологического исследования) или во флакон с формалином (для гистологического обследования). Чтобы не произошло свертывания жидкой части костного мозга на предметном стекле, в пунктат добавляют фиксаторы.
Размеры взятого биоптата должны позволять получить срезы для исследования площадью не менее 2×20 мм или 3×15. Очень важно при проведении пункции (биопсии) взять костный мозг из костномозговой полости. Если в препарате большая часть будет занята надкостницей или субкортикальными костномозговыми ячейками, полноценное гистологическое исследование проведено не будет: для заключения необходим просмотр 5 и более костномозговых ячеек.
После взятия биоматериала иглу извлекают из кости, место прокола обрабатывают антисептиком, накладывают стерильную салфетку и заклеивают пластырем.
Возможные осложнения
Взятие пунктата (биоптата) костного мозга считается безопасной процедурой. Если она выполняется опытным врачом и с соблюдением всех правил, осложнения после нее возникают очень редко. К таким редким последствиям относятся:
- инфицирование места прокола;
- кровотечения;
- сквозной прокол или перелом грудины;
- обморочные и шоковые состояния у истероидных пациентов.
Чтобы избежать возможных последствий, врачу необходимо строго соблюдать все этапы процедуры, а перед ней — провести доверительную беседу с пациентом.
Восстановление после манипуляции
Сама процедура длится не более 15 минут. После взятия образцов, больной в течение часа находится под медицинским наблюдением: контролируют пульс, артериальное давление, температуру. Если никаких осложнений в течение часа не обнаружилось, пациента отпускают домой. При болевых ощущениях больные могут принимать обезболивающие препараты.
Поскольку после процедуры возможны головокружения и обмороки, обследованным пациентам запрещено в этот день вести автомобиль. Риск возникновения кровотечения из места прокола кожи является причиной запрета выполнять тяжелые работы, заниматься спортом или употреблять алкогольные напитки в течение нескольких дней после процедуры.
Чтобы недопустить инфицирования места прокола кожи, необходимо своевременно менять салфетки и обрабатывать ранку антисептиками. До заживления раны запрещается посещать общественные бассейны, сауны, купаться в реке.
Цитологическое и гистологическое исследование
Мазки костного мозга готовят сразу после взятия пункции. Биоптат для гистологического исследования консервируют в специальных растворах. В лаборатории из биоптата готовят гистологические срезы, окрашивают их и оценивают. При этом стараются приготовить как можно больше микропрепаратов КМ, особенно при гипопластических процессах, когда взятые образцы очень бедны клеточными элементами. Цитологическое исследование проводится в день отбора образцов, на гистологию требуется до 10 дней.
При цитологическом исследовании миелограммы оценивают:
- количество и соотношение разных видов клеток;
- патологические изменения формы, размеров и структуры клеточных элементов;
- тип кроветворения;
- цитоз;
- костномозговые индексы;
- наличие специфических клеток.
Результат цитологического исследования имеет вид таблицы из трех колонок: в первой указаны названия клеточных элементов, во второй — показатели, определенные в образцах КМ, в третьей — референсные (нормальные) количественные или процентные показатели.
Нормальная миелограмма
В образце костного мозга здорового человека присутствует не более 2% клеток стромы: фибро- и остеобластов, адипоцитов, эндотелиальных клеток. Среди клеточных элементов паренхимы обнаруживаются недифференцируемые стволовые, бластные (молодые) и зрелые клетки. Количество бластов не превышает 1,7%.
В КМ обнаруживаются пять клеточных ростков:
- Эритроидный (представлен эритробластами, пронормоцитами, нормоцитами, ретикулоцитами и эритроцитами).
- Тромбоцитарный (к нему относятся мегакариобласты, промегакариоциты, мегакариоциты и тромбициты).
- Гранулоцитарный (представлен миелобластами, промиелоцитами, миелоцитами, метамиелоцитами, палочкоядерными и сегментоядерными нейтрофилами, базофилами и эозинофилами).
- Лимфоидный (к нему относятся лимфобласты, пролимфоциты и лимфоциты).
- Моноцитарный (состоит из монобластов, пронормоцитов и моноцитов).
Клетки разных ростков имеет свои особенности строения и свойства, например, чувствительность к кислотам, щелочам или другим химическим соединениям. Эти отличительные особенности используют при исследовании образцов КМ, применяя различные красители для обработки мазков и срезов.
Кроме цитологического состава КМ важен также темп их созревания. Он определяется путем определения соотношений (индексов) между созревающими и зрелыми клетками:
При исследовании трепанобиоптата определяют также соотношение между паренхимой КМ, жировой и костной тканью в срезах. Нормальным считается их соотношение 1:0,75:0,45. Нарушение этих соотношений свидетельствует о патологии костного мозга. Гистологическое исследование диагностически более значимо, чем цитологическое, при гипоплазиях КМ, лейкозах и раковых метастазах в кости.
Патологическая миелограмма
Увеличение, уменьшение пула отдельных ростков клеток костного мозга и нарушение их соотношений указывает на патологию. Увеличение количества мегакариоцитов в КМ говорит о наличии ракового метастазирования в кости. Повышение количества бластных клеток на 20% и более наблюдается при остром лейкозе. Увеличение соотношения белого ростка к красному может свидетельствовать о хроническом миелолейкозе, сублейкемическом миелозе или лейкемоидных реакциях. При бластном кризе или хроническом миелолейкозе возрастает индекс созревания нейтрофилов.
Повышение количества эозинофилов указывает на аллергические реакции, глистные инвазии, онкологические заболевания, острый лейкоз, лимфогранулематоз. Базофилы растут при эритремии, базофильном лейкозе, хроническом миелолейкозе. Увеличение концентрации лимфоцитов характерно для апластической анемии или хронического лимфолейкоза.
Эритробласты увеличиваются при анемиях и остром эритромиелозе, моноциты — при сепсисе, туберкулезе, лейкозе, хроническом миелолейкозе, плазматические клетки — при миеломной болезни, агранулоцитозе, апластической анемии.
Понижение количества мегакариоцитов свидетельствует о гипо- и апластических аутоиммунных процессах, угнетении КМ после лучевой терапии и приема цитостатиков. Соотношение белого и красного ростков падает после обильных кровотечений, гемолиза, при остром эритромиелозе и эритремии. Снижение индекса созревания эритробластов характерно для В12-дефицитной анемии. Количество эритробластов снижается при апластической анемии, красноклеточной аплазии КМ, после лучевой и химиотерапии.
Стоимость проведения процедуры взятия образцов костного мозга путем стернальной пункции или трепанобиопсии с последующей миелограммой колеблется от 1 до 3 тысяч рублей. Цена зависит от формы собственности специализированной лаборатории, метода отбора образцов и объема исследований КМ (цитология, гистология).
Костный мозг трубчатых костей выполняет важную функцию в иммуногенезе. Желтый костный мозг дает нам все больше информации о своей значимости. Проведенные исследования показывают, что миелограмма костного мозга трубчатых костей имеет свои особенности и это следует считать нормой для желтого костного мозга. Можно предположить, что желтый и красный костный мозг имеют некоторое разделение функций. Функции желтого костного мозга незаслуженно отодвигались на задний план. Получая новые факты о функциях костного мозга мы все больше продвигаемся по пути возможного управления стволовой клеткой. В настоящее время мы стоим на пороге активного применения клеточных технологий в клинической практике.
1. Егоров Е.Е., Чернов Д.Н., Акимов С.С. и др. Подавление функции теламеразы аналогами нуклеозидов // Биохимия.-1997.-Т.62.-С.1516-1527.]
2. Руководство по лабораторной гематологии /.Б. Сисла; пер. с англ. под общ. ред. А.И. Воробьева – М.: Практическая медицина, 2011. – 352 с.
5. Singer S.J., Nicholson L. The fluid mosaic of the structure of cell membranes. Annu Rev Biochem 43:805, 1974
7. Wallace M.S. Hematopoietic theory. In:Rodak B., ed. Hematology: Clinical Procedure and Applications,2nd ed. Philadelphia: WB Saunders, 2002; 73
8. Wang X, Ge S, Conzales I et all (2006). Formation of pancreatic duct epithelium from bone marrou during neonatal development. Stem Cells 24: 307-314.
Уникальной особенностью микроокружения костного мозга является присутствие там полипотентных стволовых клеток [7]. Изучение биологии стволовых клеток открывает огромные перспективы для развития медицины [1] Количество костного мозга равно в среднем 4,6% веса тела, причем в норме у человека имеется приблизительно равное количество красного и желтого мозга. Так, у взрослого здорового человека весом 60 кг на костный мозг приходится около 2600 г. Таким образом, активного - красного костного мозга у него имеется около 1300 г, по данным некоторых авторов 1500г [5]. Использование мультипотентных стволовых клеток костного мозга для лечения многих заболеваний , и в первую очередь сахарного диабета, стало реальным [6,8]. Доминантное положение красного костного мозга над желтым является преувеличением. Желтый костный мозг имеет не меньшее значение для организма, чем красный костный мозг и в свете новых тенденций в изучении стволовых клеток, возможно, и большее.
Цель исследования: оценка особенностей миелограммы из костного мозга трубчатых костей
Материалы и методы: В ходе микроскопического исследования производили дифференцированный подсчет клеток желтого костного мозга в предварительно окрашенных и зафиксированных мазках. У взрослого человека красный костный мозг содержится только в ячейках губчатого вещества плоских костей (грудина, крылья подвздошных костей), в губчатых костях и эпифизах трубчатых костей. В диафизах, т. е. в костно - мозговых полостях, находится желтый костный мозг. В обычной медицинской практике необходимость в миелограмме появляется, как правило, в случае диагностики заболеваний крови и при лучевой терапии по разным показаниям. Клеточный состав костного мозга оценивается по результатам исследования пунктата грудины или подвздошной кости [2], полученного с помощью иглы И. А. Кассирского. Для диагностики гипопластических состояний, выявления лейкозных инфильтратов и раковых метастазов, а также миелодиспластического синдрома и некоторых видов костной патологии используют трепанобиопсию подвздошной кости, которую проводят с помощью специального троакара [4]. Потребности в получении костного мозга из трубчатых костей нет, тем более, что пункция трубчатых костей невозможна из-за высокой прочности кортикального слоя. В процессе хирургической практики создаются ситуации, когда костный мозг трубчатых костей доступен, без каких-либо специальных манипуляций. Например, ампутация нижних конечностей при критических ишемиях, травматические повреждения, сопровождающие необходимостью ампутации конечности. При оперативном вмешательстве на трубчатой кости во время ампутации забор костного мозга из конечности, которая подлежит удалению, становится процедурой доступной и легкой. Костный мозг, полученный из трубчатой кости, во время операции может быть использован для подсчета миелограмм.
Результаты исследования: Было исследовано 15 образцов костного мозга трубчатых костей, полученного при ампутации конечности. Высохшие на воздухе мазки фиксировались с использованием фиксатора Майн-Грюнвальда, далее фиксированные мазки окрашивались азур-эозином по Романовскому. Окрашенные препараты микроскопировали с иммерсией при увеличении х 1000 используя микроскоп Olympus CX 41 (окуляр на 10, объектив на 100). Следует отметить, что состояние костного мозга во всех случаях разное. Консистенция костного мозга варьирует от жидкого, как вода до густого типа желе, но это состояние не связано с клеточным составом и не влияет на результаты миелограмм. Также характерен цвет костного мозга трубчатых костей, чаще он желтоватый из-за жирового компонента, который является необходимым составляющим компонентом для жизнеобеспечения костного мозга. Утверждение, что костный мозг трубчатых костей перерождается в жировую ткань, является сомнительным, так как в процессе исследования костного мозга пациентов различного возраста, выявлено, что даже у 25-летнего больного, которому произведена ампутация конечности в связи с отморожением стопы, костный мозг имеет такой же процент жировой ткани, как и пожилые пациенты старше 70 лет. При исследовании костного мозга определяется неоднородность по наличию «островков кроветворения». В одних случаях их нет вообще, у других присутствуют единичные. Костный мозг трубчатых костей крайне редко бывает красноватого цвета, что позволяет предположить низкий уровень кроветворной функции. При подсчете миелограммы желтого костного мозга следует отметить следующее: недифференцированные бласты, миелобласты и промиелоциты в пределах от 0,1% до 1,4%. Содержание миелоцитов возрастает от 8,0% до 31,4%. Количество метамиелоцитов, палочкоядерных и сегментоядерных нейтрофилов в пределах нормы. В целом клетки нейтрофильного ряда количественно составляют от 64,0% до 78,6%. Крайне низкое число клеток эозинофильного ряда от 0,1% до 3,0%. Содержание клеток эритроидного ряда незначительно снижено от 7,0% до 18,0%. Лейко-эритробластное соотношение имеет свои особенности и равно от 5:1 до 10:1. Индекс созревания эритробластов равен 1,0. Отмечается полное отсутствие тромбоцитов и мегакариоцитов. Во всех исследованных образцах (10) отмечалась нормальная клеточность костномозгового материала и в 2 случаях клеточность была снижена. Состав костного мозга полиморфный. Тип эритропоэза нормобластический. Гранулоцитарный росток в норме или расширен. Созревание нейтрофилов не нарушено. Эритроидный росток во всех случаях угнетен. Белый росток гиперплазирован.
При проведении гистохимического анализа костного мозга трубчатых костей получены следующие характеристики: костный мозг клеточный, гистоархитектоника сохранена. В костно-мозговых ячейках костной ткани губчатого строения, костный мозг гиперцеллюлярный. В среднем клеточность костного мозга составляет в различных участках от 50% до 80%. В участках клеточного строения костного мозга определяются клетки реактивного окружения, представленные расположенными вблизи капилляров гистиоцитами, эозинофилами, плазматическими клетками, единичными тучными клетками. Иммуногистоархитектоника костного мозга сохранена. В большом количестве определяются клетки гранулопоэза различной степени зрелости со смещением в сторону незрелых промежуточных форм. Клетки эритропоэза представлены небольшими скоплениями эритробластов, формирующих эритропоэтические островки, состоящие из различных клеточных форм; в составе части скоплений определяются клетки макрофагального ряда. Мегакариоциты имеют морфологию зрелых клеток, распределены в центральных отделах костномозговых ячеек, часто вблизи сосудов синусоидного типа без формирования кластеров. Лимфоидные элементы распределены диффузно, не формируя скоплений и агрегатов, имеют морфологию типа малого лимфоцита. Сосуды синусоидного типа, содержат дифференцированные клеточные формы. При иммуногистохимическом исследовании в оразцах определяются CD34-экспрессирующие клетки с мононуклеарной морфологией, распределенные дискретно без кластерообразования. В среднем число CD34+ клеток при х 400 составляет - 6-8/
Заключение: Полученные данные следует считать нормой для желтого костного мозга. Исследование особенностей желтого костного мозга, взятого из бедренной кости (в случае ампутации конечности) может быть использовано для более полного понимания процессов иммуногенеза, происходящих в организме. В последнее десятилетие резко повысился интерес к изучению стволовых клеток, что невозможно без тонкого изучения костного мозга, как красного, так и желтого в целом. Понимание процессов происходящих в микроокружении стволовых клеток, находящихся в костном мозге, даст нам возможность влиять на функциональное состояние этих клеток и управлять ими.
Данная работа выполнена при поддержке Красноярского краевого фонда поддержки научной и научно-технической деятельности.
Рецензенты:
Сухоруков А.М., д.м.н., проф. ФГБНУ «НИИ МПС» г. Красноярск;
Черданцев Д.В., д.м.н., проф., заведующий кафедрой и клиникой хирургических болезней им. проф. А.М. Дыхно с курсом эндоскопии и эндохирургии КрасГМУ, г. Красноярск.
Читайте также:
- Синдром вегетативно-сосудисто-трофических нарушений. Признаки вегетативно-сосудисто-трофических нарушений.
- Поражение глаз вирусом герпеса. Офтальмогерпес
- Герпетический энцефалит на КТ, МРТ
- Назофарингит (ринофарингит): причины, симптомы и лечение
- Скелетные и мышечные осложнения параплегии - лучевая диагностика
