Криоконсервирование и хранение гемопоэтических стволовых клеток
Добавил пользователь Alex Обновлено: 28.01.2026
В связи с увеличением количества трансплантаций гемопоэтических стволовых клеток (ГСК) пуповинной крови (ПК) и расширением показаний к их клиническому применению проблема создания банков длительного хранения стволовых клеток является весьма актуальной [1, 2]. Успех трансплантаций аллогенных ГСК ПК во многом зависит от качества и безопасности заготовленного клеточного материала [3, 4, 5].
Криоконсервирование является неотъемлемой частью процедуры длительного хранения клеточных биоматериалов. В большинстве случаев клетки сохраняют свою морфологию после замораживания-размораживания, но может наблюдаться снижение их жизнеспособности и нарушение клеточных функций, приводящее к снижению пролиферативных свойств и нарушению биологической активности.
Вопросы сохранности ГСК ПК на этапе их криоконсервирования и хранения, а также оценка их пролиферативного потенциала и способности к дифференцировке in vitro и in vivo требуют постоянного изучения и совершенствования.
В исследовании использовалось 40 образцов пуповинной крови, полученных во время физиологических срочных родов. Информированное согласие рожениц на сбор пуповинной крови и проведение эксперимента было получено.
Сбор образцов пуповинной крови проводился в родильных домах г. Тюмени. Для исследований отбирались образцы, объем которых превышал 80 мл. ПК собирали в систему для сбора крови (Green Cross, Корея), содержащую стандартное количество гемоконсерванта CPDA (цитратно-фосфатно-декстрозно-адениновый раствор).
Выделение ГСК ПК проводили методом ав- томатического выделения клеток с помощью клеточного сепаратора «SepaxS1000» (Biosafe, Швейцария).
В качестве криопротектора к концентрату ядросодержащих клеток ПК добавляли высокоочищенный диметилсульфоксид (ДМСО) в сочетании с полиглюкином. Конечная концентрация ДМСО в криоконсервируемой среде составляла 5%. Для криоконсервирования концентрата клеток пуповинной крови использовались два способа замораживания: спонтанное замораживание в парах жидкого азота и криоконсервирование в программном замораживателе PLANER Krio 560-16 (ENGLAND) автоматическим контролем про- цесса охлаждения каждого образца клеток. Количество и жизнеспособность ГСК ПК оценивали), методом проточной цитометрии на проточном цитофлуориметре Beckman Coulter FS-500 Cytomics (Beckman Coulter, США) с помощью набора Stem-Kit TM Reagents (Beckman Coulter, США).
С целью изучения пролиферативного потенциала ГСК ПК определяли длину их теломер и колониеобразующую способность (КОЕ). КОЕ ГСК пуповинной крови определяли с помощью культивирования клеточной суспензии в метилцеллюлозе в течение 14 сут. при температуре 37 °С в СО2 инкубаторе с подсчетом количества колониеобразующих единиц (КОЕ) на 1 × 105: КОЕ-ГМ – гранулоцитарных-макрофагальных, КОЕ-Г – гранулоцитарных, КОЕ-М – макрофагальных, КОЕ-Эр –эритроцитарных, КОЕ-mix – смешанных. Для определения абсолютного количества гемопоэтических предшественников в 1 мл пуповинной крови, полученные величины КОЕ умножали на число мононуклеарных клеток в 1 мл крови.
Для определения длины теломер использовался набор PNA Kit/FITC (DAKO, Дания). Гибридизация клеток с теломерным зондом проводилась в соответствии с рекомендациями фирмы DAKO. В образцах, гибридизиро- ванных с теломерным зондом, производилось определение длины теломер на проточном цитофлуориметре Beckman Coulter FS-500 Cytomics (Beckman Coulter, Швейцария). Для исследования использовался световой фильтр с длиной волны 488 нм. Интенсивность флуоресценции выставляли при флуоресцентном сигнале в FL-1. Гейтировали клетки в G0/1 фазе клеточного цикла, где клетка имеет только одну копию своего генома. Оценка количества жизнеспособности и пролиферативной активности проводилась до и после криоконсервации.
Математическую обработку данных проводили при помощи программы Kaluzav. 1.2 (Beckman Coulter, США). Статистическую обработку данных проводили при помощи программного обеспечения Statistica 6.1 (StatSoft).
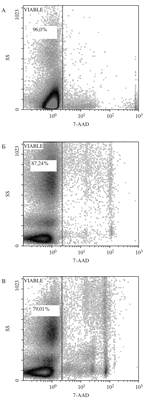
Рис. 1. Гистограмма жизнеспособности ядросодержащих клеток CD45+ пуповинной крови негативных по реакции с 7-ADD (А), нативный образец (Б) клетки криоконсервированные в программном замораживателе, (В) клетки криоконсервированные в парах азота.
КОЕ ГСК является достоверным показате- лем их пролиферативного потенциала. При исследовании КОС ГСК до замораживания среднее количество колоний на 1 × 105 ГСК ПК составило 40,28±2,45, КОЕ ГСК ПК, криоконсервированных в программном замораживателе в среднем составила 39,66±1,09 при криоконсервировании в парах жидкого азота – 21,86±2,71 соответственно. При оценке КОЕ клеток ПК было показано, что количество колоний после криоконсервации в автоматизированной системе снижается не значительно в сравнении с замораживанием в парах азота (табл. 1, рис. 2).
Таблица 1. Влияние различных способов криоконсервирования на КОЕ ГСК ПК

Примечание: *р < 0,01по сравнению с образцом до криоконсервации; + р < 0,01по сравнению с образцом после криоконсервации в программном замораживателе. КОЕ-ГМ – гранулоцитарно-макрофагальные, КОЕ-Г – гранулоцитарные, КОЕ-М – макрофагальные, КОЕ-Эр – эритроцитарные, КОЕ-mix – смешанные колониеобразующие единицы.
Рис. 2. ГСК ПК. КОЕ А – до и после криоконсер- вации, Б – в программном замораживателе, В – парах азота.
Исследования зарубежных ученых сопо- ставимо с полученными результатами. В Японии при оценке качества 54 криоконсервированных образцов ПК из 9 различных банков ПК. Было показано, что процент сохранения ядросодержащих клеток, CD34+-клеток и КОЕ-ГМ составил 96,0±11,3%, 83,0±17,0% и 88,6±41,2%, соответственно [6].
Определение длины теломер ГСК ПК проводили с использованием новейшей методики сочетания флуоресцентной гибридизации in situ и проточной цитометрии. Для изучения влияния криоконсервирования на репликативный потенциал ГСК, зависящий от длины их теломер, нами было исследовано 40 образцов пуповинной крови. Выявлено достоверное уменьшение длины теломер в клетках после криоконсервирования (рис. 3, табл. 2).
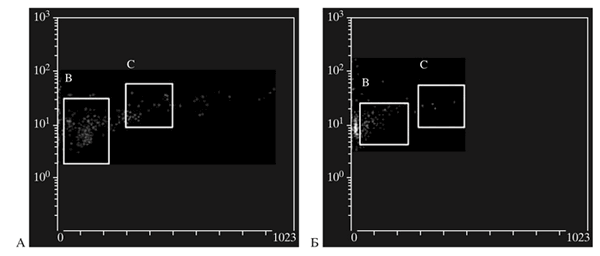
Рис. 3. Гистограммы идентификации клеток культуры, находящихся в G0/1-фазе клеточного цикла. Прямое светорассеяние, гейтирование области, в которой находятся клетки в фазе G 0/1 клеточного цикла. A– клетки перед криоконсервированием; Б – клетки после криоконсервирования
Таблица 2. Длина теломер ГСК ПК
При криоконсервировании клеток в программном замораживателе изменение пролиферативного потенциала ГСК ПК менее выражено, чем при замораживании в парах жидкого азота. Как известно, охлаждение биологического объекта с любой скоростью всегда сопровождается образованием разнообразных кристаллов льда. В момент перехода растворенной в клетке воды в кристаллическую форму – достижении точки эвтектики – происходит выделение дополнительного тепла за счет образования кристаллической решетки при переходе воды из жидкого состояния в твердое. Основные повреждения клетки наступают в точке перекристаллизации, так как в этот период образуются концентрированные растворы солей, которые повреждают клеточные структуры. Этот период не должен длиться более 1,5 мин [7, 8, 9]. В проведенных нами исследованиях при замораживании в программном замораживателе время от наступления точки эвтектики и кристаллизации сокращено до 1,5 мин, а при замораживании в парах жидкого азота это время длилось более 5 мин.
Укорочение длины теломер при замораживании клеток ПК может быть связано с процессами повреждения ядерной мембраны [4, 10], так, как именно она повреждается при криоконсервировании в первую очередь [7]. Процессы криоконсервирования клеток могут приводить к транзиторным или органическим поражениям этих структур, и таким образом вызывать апоптоз клеток, что, безусловно, сказывается на их восстановлении после размораживания [8]. Уменьшение длины теломер возможно, приводит к изменению экспрессии генов, что также может сказаться на функции клетки [4, 10].

Таким образом, при оценке жизнеспособности и пролиферативного потенциала ГСК ПК установлено, что замораживание в парах жидкого азота приводит к потерям клетками их пролиферативных свойств. Использовать такие клетки для трансплантации следует с большой осторожностью, так как при восстановлении гемопоэза из относительно малого количества ГСК ПК с низким пролиферативным потенциалом восстановление объема ниши стволовой клетки произойдет не полностью. При криоконсервировании в программном замораживателе наблюдается лучшая сохранность пролиферативных свойств ГСК ПК, поэтому использование данного метода сохранения образцов клеток ПК для дальнейшего клинического применения предпочтительнее, так как позволяет сохранить клетки в жизнеспособном и функ- ционально полноценном состоянии. Длина теломер и КОЕ может служить важным маркером сохранности пролиферативного потенциала ГСК ПК.
Криоконсервирование индуцирует физиологическое старение клеток. Представленные данные позволяют сделать вывод о том, что не подходящие условия криоконсервирования могут не только снижать жизнеспособность клеток, но и также индуцировать апоптоз. Полученные нами данные являются важными для областей медицины, которые используют замороженные клетки.
Криоконсервирование и хранение гемопоэтических стволовых клеток
Режимы кондиционирования при алло-трансплантации гемопоэтических стволовых клеток (алло-ТГСК) - схемы
Миелоаблативные режимы кондиционирования. Наиболее распространенные миелоаблативные режимы кондиционирования при проведении алло-трансплантации гемопоэтических стволовых клеток (алло-ТГСК) у больных со злокачественными заболеваниями системы крови представлены в таблице.
При гаплоидентичной трансплантации гемопоэтических стволовых клеток используют режимы кондиционирования с включением комбинации препаратов, оказывающих выраженное иммуносупрессивное действие.
Различия в дозах АТГ фирм «Sangstat», «Fresenius» и «Pfizer» связаны с особенностями производства препарата (АТГ фирм «»Sangstat» и «Fresenius» кроличий, АТГ фирмы «Pfizer» лошадиный) и их фармакокинетикой. Так, АТГ фирмы «Fresenius» может персистировать на поверхности Т-лимфоцитов до 30 дней после введения, в то время как АТГ фирмы «Sangstat» обнаруживается до 150 дней.
Миелоаблативные режимы кондиционирования
| Тип ТГСК и показания | Препараты | Дневная доза | Способ введения | Дни введения |
| Алло-ТГСК при ОЛ, НХЛ, ММ Ауто-ТГСК при ОЛ | ТОТ Циклофосфан ±АТГ | 2-2,5 Гр 60 мг/кг 20-30 мг/кг | Внутривенно Внутривенно | -8, -7, -6, -5 -4, -3 -3, -2, -1 |
| Алло-ТГСК при ОЛ, НХЛ, ММ Ауто-ТГСК при ОЛ | Бусульфан Циклофосфан +АТГ | 4 мг/кг 60 мг/кг 20-30 мг/кг | Внутрь Внутривенно Внутривенно | -7, -6, -5, -4 -3, -2 -3, -2, -1 |
| Алло-ТГСК при ОЛ, НХЛ Ауто-ТГСК при ОЛ | Бусульфан Циклофосфан Вепезид ±АТГ | 4 мг/кг 60 мг/кг 30-60 мг/кг 20-30 мг/кг | Внутрь Внутривенно Внутривенно Внутривенно | -7, -6, -5, -4 -3, -2 -3 -3, -2, -1 |
| Алло-ТГСК при ОЛ, НХЛ | ТОТ Циклофосфан Мабкампат | 2-2,5 Гр 60 мг/кг 10 мг | Внутривенно Внутривенно | -4, -3, -2 -6,-5 -1, +1, +2, +3, +4 |
| Алло-ТГСК при ОЛ, НХЛ | Тиотепа Циклофосфан | 150 мг/м2 1,5 г/м2 | Внутривенно Внутривенно | -6, -5, -4, -3 -6,-5,-4,-3 |
| Алло-ТГСК при ОЛ, НХЛ | Бусульфан Циклофосфан Мелфалан +/-АТГ | 4 мг/кг 60 мг/кг 140 мг/м2 20-30 мг/кг | Внутрь Внутривенно Внутривенно Внутривенно | -7, -6, -5, -4 -3, -2 -3 -3, -2, -1 |
ОЛ — острые лейкозы; НХЛ — неходжкинская злокачественная лимфома; ММ — множественная миелома.
Режимы кондиционирования с уменьшенной интенсивностью дозы. Предложено большое количество «немиелоаблативных» режимов кондиционирования, которые используются при алло-трансплантации гемопоэтических стволовых клеток от родственного и неродственного донора с различной степенью совместимости по HLA-системе (совместимые, частично совместимые, гаплоидентичные).
При проведении алло-трансплантации гемопоэтических стволовых клеток с «немиелоаблативным» режимом кондиционирования от частично совместимого по HLA-системе родственного донора или неродственного донора для дополнительной иммуносупрессии в режим кондиционирования необходимо включение АЛГ/АТГ.
Миелоаблативные режимы кондиционирования при гаплоидентичной алло-ТГСК при ОЛ, НХЛ
| Режим | Препарат | Дневная доза | Способ введения | Дни введения |
| I | ТОТ Тиотепа Флударабин АТГ | 8 Гр 5 мг/кг 40 мг/м2 1,2 мг/кг | Внутривенно Внутривенно Внутривенно | -9 -8,-7 -6, -5, -4, -3 -6, -5, -4, -3 |
| II | Бусульфан Тиотепа Флударабин АТГ | 4—5 мг/кг 5 мг/кг 40 мг/м2 5 мг/кг | Внутрь Внутривенно Внутривенно Внутривенно | -10, -9, -8, -7 -6, -5 -5, -4, -3, -2 -3, -2, -1 |
** Доза АТГ рассчитана для препарата фирмы «Fresenius»
Наиболее известными «немиелоаблативными» режимами кондиционирования являются комбинации цитостатических препаратов, используемые в следующих суммарных дозах:
флударабина 90—150 мг/м2 + циклофосфана 20—120 мг/кг;
флударабина 150—300 мг/ м2 + бусульфана 4—10 мг/кг;
флударабина 180 мг/м2 + бусульфана 8 мг/кг + АТГ 40 мг/кг;
флударабина 90—150 мг/м2 + мелфалана 100—140 мг/м2 + АТГ 30-60 мг/кг;
флударабина 90—150 мг/м2 + мелфалана 140 мг/м2 ± Campath-1H 100 мг/м2;
флударабина 120—150 мг/м2 + цитозара 800 мг/м2 + идарубицина 12—15 мг/м2;
флударабина 90—150 мг/м2 + тиотепа 300 мг/м2;
флударабина 100 мг/м2 + циклофосфана 60 мг/кг + тиотепа 300 мг/м2;
флударабина 150 мг/м2 + BCNU 300 мг/кг + мелфалана 140 мг/м2;
флударабина 150 мг/м2 + треосульфана 30 мг/м2; циклофосфана 60—120 мг/кг + тиотепа 300—600 мг/м2.
При гаплоидентичной алло-трансплантации гемопоэтических стволовых клеток в качестве «немиелоаблативного» режима кондиционирования могут быть использованы (суммарные дозы) флударбин 150—180 мг/м2 + бусульфан 8 мг/кг + + АТГ 60 мг/кг (фирма «Fresenius»).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Режимы кондиционирования перед переливанием гемопоэтических стволовых клеток - схемы
Режимом кондиционирования называется подготовка больного с помощью цитостатической и лучевой терапии к инфузии аутологичных или аллогенных гемопоэтических стволовых клеток.
Существует два принципиальных подхода при назначении режима кондиционирования перед трансплантацией гемопоэтических стволовых клеток: миелоаблативное и немиелоаблативное воздействие. При этом все известные режимы кондиционирования обладают этими свойствами в разной степени и находятся в диапазоне от немиелоаблативного до миелоаблативного эффекта. Примеры воздействия различных комбинаций цитостатических препаратов, используемые в качестве режимов кондиционирования, представлены в таблице.
Дозы цитостатических препаратов и лучевой терапии, используемые в качестве режимов кондиционирования, приведены в таблицах.
При ауто-трансплантации гемопоэтических стволовых клеток режим кондиционирования включает, как правило, миелоаблативные или близкие к ним дозы цитостатических препаратов либо лучевой терапии для полной эрадикации кроветворения (нормального и злокачественного клонов) пациента перед инфузией аутологичных гемопоэтических стволовых клеток.
Обозначения: FL — флударабин; А — цитозар; Ida — идарубицин; CY — циклофосфан; М — мелфалан; B(BCNU) — нитрозомочевина; BU — бусульфан; TBI — ТОТ (тотальное облучение тела); ALG — антилимфоцитарный глобулин (АЛГ); G — К.СФ-Г (комбинации цитостатических препаратов подразумевают их использование в классических дозах).
Полная замена кроветворения реципиента на гемопоэз донора при алло-трансплантации гемопоэтических стволовых клеток осуществляется с помощью цитостатического и иммунологического воздействия, баланс внутри которых определяется дозой цитостатических препаратов, степенью иммуносупрессии и клеточным составом трансплантата. От уровня иммуносупрессии реципиента зависят скорость приживления гемопоэтических стволовых клеток донора и вероятность развития первичной «реакции отторжения» трансплантата.
До сих пор не разработано идеального режима кондиционирования, в основе которого находилась бы комбинация лучевой терапии и цитостатических препаратов, обладающих максимально высокими противоопухолевым и иммуносупрессивным эффектами у реципиента, без каких-либо проявлений органотоксичности. Наиболее часто встречающиеся токсические осложнения существующих режимов кондиционирования хорошо изучены, их тяжесть зависит от возраста реципиента (менее выражены у детей и подростков), генетической предрасположенности, общего состояния (индекс Карновского), стадии заболевания в момент трансплантации (рецидив, ремиссия).
При алло-трансплантациии гемопоэтических стволовых клеток используют миелоаблативные режимы кондиционирования и достаточно часто режимы кондиционирования с уменьшенной интенсивностью дозы (R1 — HSCT — reduce intensity — hematopoietic stem cell transplantation, «мини-трансплантат», «немиелоаблативные»), особенности которых учитывают при назначении определенной схемы подготовки пациента перед трансплантацией.
До последнего времени миелоаблативные режимы кондиционирования были основой успеха при проведении алло-трансплантации гемопоэтических стволовых клеток. Миелоаблативным режимом кондиционирования называется использование комбинации доз цитостатических препаратов или лучевой терапии для достижения полной эрадикации кроветворения (нормального и злокачественного клонов) и иммуноаблативного эффекта у реципиента перед введением аллогенных гемопоэтических стволовых клеток.
Режимом кондиционирования с уменьшенной интенсивностью дозы («немиелоаблативные») называется назначение комбинации немиелоаблативных, но иммуноаблативных доз цитостатических препаратов или лучевой терапии для достижения высокой степени иммуносупрессии при неполной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением донорских гемопоэтических стволовых клеток.
Внедрение «немиелоаблативных» режимов кондиционирования приобрело актуальность по следующим причинам:
— наличие большого количества тяжелых осложнений, связанных с органотоксичностью при назначении цитостатических препаратов в миелоаблативных дозах;
— сложность применения миелоаблативных режимов кондиционирования у пациентов старше 50 лет и низким индексом Карновского;
— относительно высокая частота развития рецидивов основного заболевания после алло-трансплантации гемопоэтических стволовых клеток, несмотря на использование цитостатических препаратов в максимальных дозах, и, следовательно, невозможность преодоления резистентности злокачественного клона клеток путем наращивания доз;
— появление экспериментальных и клинических данных, свидетельствующих о наличии иммунологической реакции «трансплантат против опухоли (лейкоза/лимфомы/миеломы/солидной опухоли)».
Внедрение «немиелоаблативных» режимов кондиционирования стало возможным в связи с появлением новых цитостатических препаратов — аналогов пуриновых оснований (флударабин, 2-CDA), оказывающих выраженное иммуносупрессивное действие. Эти препараты создают условия для развития абсолютной иммунологической толерантности в организме реципиента, что позволяет использовать гемопоэтические стволовые клетки, полученные из различных источников (родственные, неродственные доноры, ПК) и с различной степенью совместимости по HLA-системе (полностью, частично совместимые, гаплоидентичные).
Достижение полного «химеризма» (100 % приживления гемопоэтических стволовых клеток донора) у реципиента после режимов кондиционирования с уменьшенной интенсивностью дозы происходит медленнее по сравнению с миелобластными дозами с минимальными проявлениями органотоксичности, что расширяет возрастной диапазон для применения алло-трансплантациии гемопоэтических стволовых клеток. Другим преимуществом режимов кондиционирования с уменьшенной интенсивностью дозы является то, что комбинация цитостатического и в большей степени иммунологического воздействия на лейкозный клон клеток может быть высокоэффективной при резистентных формах заболевания. Создание этих схем подготовки реципиента и первые данные, свидетельствующие в пользу возможности достижения успеха, ведут к ежегодному росту количества алло-трансплантации гемопоэтических стволовых клеток с использованием режимов кондиционирования с уменьшенной интенсивностью дозы.
Выбор комбинации различных цитостатических препаратов и лучевой терапии перед трансплантацией гемопоэтических стволовых клеток зависит от возраста реципиента, индекса Карновского, источника трансплантируемых клеток (аллогенный, аутологичный), степени совместимости по HLA-системе между донором и реципиентом, типа и стадии болезни (злокачественные заболевания системы крови, солидные опухоли, апластическая анемия, генетические заболевания или рецидив, ремиссия), а также собственного опыта работы центра трансплантации.
Применение лучевой терапии в режиме кондиционирования обусловлено способностью тотального облучения тела (ТОТ) вызывать выраженный миело- и иммуноаблативный эффект. Включение тотального облучения тела (ТОТ) в режим кондиционирования обсуждается при проведении трансплантации гемопоэтических стволовых клеток у больных ОЛЛ, лимфомами, множественной миеломой, а также при выполнении неродственной алло-трансплантации гемопоэтических стволовых клеток и трансплантации от частично совместимого или гап-лоидентичного донора. Манипулирование дозой ТОТ также позволяет достигнуть состояния иммуно-аблативного воздействия без миелоаблативного эффекта, что создает условия для создания «немиелоаблативных» режимов кондиционирования на его основе.
Однако, несмотря на преимущества тотального облучения тела (ТОТ), связанные с высокими проявлениями иммуносупрессии и профилактикой развития рецидивов заболевания (в первую очередь нейролейкемии), невозможность проведения тотального облучения тела (ТОТ) у больных с гемобластозами по тем или иным причинам не исключает применения режимов кондиционирования, полностью основанных на цитостатических препаратах с той же степенью эффективности.
Для достижения максимального иммуносупрессивного воздействия возможно дополнительное включение в режим кондиционирования антилимфоцитарного (антитимоцитарного) глобулина (АЛГ/ АТГ). Введение АЛГ/АТГ в режим кондиционирования служит мерой для профилактики первичного «отторжения» трансплантата и развития острой РТПХ при проведении родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток, а также при алло-трансплантации гемопоэтических стволовых клеток от частично совместимого или гаплоидентичного донора. Этот эффект связан с длительной персистенцией препарата в плазме крови (до 7 дней) и двусторонним повреждающим эффектом АЛГ/АТГ (до 120 дней) на лимфоидную популяцию клеток реципиента и лимфоциты, присутствующие во введенном трансплантате (Т-клеточное «истощение» in vivo).
Способы хранения стволовых клеток

«Транс-Технологии» — первый банк пуповинной крови в Санкт-Петербурге, который гарантирует использование высококачественных материалов и проведение контроля на всех этапах процесса при выделении стволовых клеток. В криохранилищах установлено оборудование, соответствующе стандартам, а работа выполняется квалифицированными сотрудниками компании. Поэтому наши клиенты могут не беспокоиться о качестве заготовки и хранения гемопоэтических стволовых клеток пуповинной крови.
Особенности криоконсервации стволовых клеток пуповинной крови
После проведения обработки концентрат гемопоэтических (кроветворных) стволовых клеток помещается в специальный криомешок, устойчивый к влиянию ультранизких температур. Для проведения дополнительных анализов, в комплект с криомешком прилагают 3 пробирки-спутника.
Система хранения концентрата гемопоэтических стволовых клеток в криопробирках не предусмотрена в нашем Банке, поскольку в случае необходимости используется весь объем сохраненных стволовых клеток. Другой причиной сохранения стволовых клеток в только в криомешке является соответствие требованиям Европейского союза. При необходимости трансплантации в европейском центре клиенту может быть отказано по причине хранения материала в несоответствующих условиях (криопробирки).
После присваивания идентификационного номера образцу, производят его криоконсервацию. Это медленное замораживание длится около двух часов. За это время происходит постепенное снижение температуры биологического материала. После этого биоматериал помещается в контейнер с жидким азотом, температура в котором колеблется от -170 до -196 оС, на карантин. После подтверждения инфекционной безопасности образца, емкость с клетками переводится в банк на постоянное хранение.
Особенности криоконсервации мезенхимальных стволовых клеток пупочного канатика.
В пупочном канатике содержится высокая концентрация мезенхимальных стволовых клеток (МСК), которые после дифференцировки могут стать клетками костной, хрящевой и жировой ткани. В экспериментальных условиях из МСК получены линии нейронов и миоцитов (клеток мышечной ткани). Совершенствование возможностей криоконсервации позволяет более детально изучать и использовать функционал клеток пупочного канатика.
Материал хранится в 2 криопробирках. В каждой содержится приблизительно 10 млн клеток.
На протяжении 20-30 дней происходит культивирование образца и последующая заморозка 2 порций мезенхимальных стволовых клеток, которые в дальнейшем можно размораживать, культивировать (размножать) и использовать в программах регенеративной медицины. Жизнеспособность и биологическая активность клеток может поддерживаться на протяжении длительного срока.
Особенности длительного хранения
Криохранилища Taylor-Wharton, используемые компанией «Транс-Технологии», — емкости, содержащие жидкий азот. Криохранилища соответствуют европейским стандартам и СанПиН. Сохранность биоматериалов контролируется системой безопасности с видеонаблюдением и ограниченным доступом сотрудников в помещения.
Компания «Транс-Технологии» гарантирует высокое качество материалов, которые используются при выделении стволовых клеток, и проведение контроля за точностью выполнения процессов на всех этапах. Использование современного оборудования от мировых производителей и выполнение работы квалифицированным персоналом позволяет гарантировать нашим клиентам качество и безопасность.
Какую емкость использовать для хранения пуповинной крови?
Согласно с международными стандартами, правильно использовать мешки. Поэтому если в будущем планируется применение биологического материала для лечения патологий иммунной или кровяной систем, то хранить его нужно в мешке. Такой порядок проведения процедуры утвержден и за границей.
С одной стороны, криопробирки в будущем могут стать более рациональной емкостью для хранения пуповинной крови, но с другой стороны, существуют определенные особенности, касающиеся невозможности использовать пробирки в клиниках из-за нестандартного способа их хранения.
Криомешки являются универсальным вариантом, который будет актуален и в данный момент, и в будущем. Однако при хранении гемопоэтических стволовых клеток в таком контейнере они могут использоваться лишь однократно. Обращайтесь и наши специалисты объяснят все тонкости процесса, ответив на интересующие вопросы.
Криоконсервирование клеток человека. Усс А.Л., Мицкевич П.Б., Завгородняя И.Л. Республиканский центр гематологии и трансплантации костного мозга на базе 9-й клинической больницы г. Минска. Опубликована в журнале «Медицинская панорама» №2(27)2003,стр.38
Проблема сохранения живых клеток вне организма человека, in vitro или ex vivo, является весьма актуальной для практической медицины. Так, например, в связи с расширением показаний к применению хирургических методов возросла потребность в постоянном наличии запасов полноценной крови и ее компонентов (эритро-, тромбо-, лейкоцитов). В результате широкого использования лучевой терапии и цитостатиков для лечения злокачественных опухолей и лейкозов возникла проблема купирования таких осложнений, как иммуно- и гемодепрессии путем трансплантации клеток крови или костного мозга. В последнее время интенсивно развивается и совсем новое направление - репродуктивная медицина, которая занимается искусственным оплодотворением на основе использования заранее выделенных из организма человека яйцеклеток и сперматозоидов, а также целых эмбрионов.
Однако необходимые для лечения индивидуума клетки не всегда можно быстро получить в «свежем» виде у подходящего донора. С другой стороны, клетки, выделенные заранее, быстро погибают вне организма при обычной температуре. Вот почему возникла проблема длительного хранения отдельных типов клеток человека, или их консервации.
Под консервацией в данном случае следует понимать сохранение биообъекта или его определенных свойств в искусственных условиях в течение определенного промежутка времени. Наиболее подходящим для этих целей оказался метод криоконсервации. Это комплекс мероприятий, обеспечивающих хранение биологических объектов при низких температурах в жизнеспособном состоянии. Изучением состояния биологических объектов в диапазонах температур ниже тех, к которым они адаптированы, занимается криобиология.
Для длительной криоконсервации клетки замораживают до температуры -80 °С или ниже. Необходимость использования сверхнизких температур связана с тем, что только при таких условиях в клетках практически полностью прекращаются все биохимические процессы. Так, при температуре 0 °С время жизни клеток весьма ограничено. При этом происходят следующие патофизиологические процессы:
1. «Выключение Na-насоса» и как следствие - набухание клеток.
2. Изменение фазового состояния липидов клеточных мембран и нарушение активности мембрансвязанных ферментов.
3. Преципитация спаборастворимых компонентов, изменение констант диссоциации некоторых веществ и, следовательно, рН растворов.
4. И наконец, по неустановленным еще причинам, быстрое охлаждение может привести к гибели клетки как таковой. Этот феномен назван термическим, или холодовым, шоком.
На практике установлено, что длительно сохранить клетки человека пока удается только в виде замороженной суспензии при температуре -80 °С или ниже. Сам процесс замораживания и последующего размораживания может оказать на клетку еще более губительное воздействие, чем просто охлаждение до 0 °С. Чтобы разрешить эту проблему, были изучены механизмы отрицательного влияния замораживания-размораживания и разработаны способы, позволяющие свести к минимуму повреждающие эффекты.
Физиологические основы криоконсервирования клеток
В процессе замораживания клеток необходимо выделить следующие методические этапы:
1. Приготовление клеточных суспензий (например, выделение необходимых клеток крови, сперматозоидов, яйцеклеток).
2. Подготовка клеточных суспензий к консервации (например, добавление криопротекторов).
3. Собственно замораживание.
4. Хранение криоконсервированных клеток в специальных емкостях при определенных температурах. По диапазонам температур выделяют следующие этапы криоконсервации клеток.
1. От -37 до -25 °С - зона температурного оптимума биологической активности.
2. От -25 до -10 °С - зона перехода клеток в состояние неполного анабиоза (временное прекращение или торможение метаболических процессов, «переохлаждение» клеточных суспензий без кристаллизации воды).
3. От -10 до -80 °С - зона кристаллизации охлажденной и переохлажденной окружающей клетку и внутриклеточной воды и перехода клетки в состояние полного анабиоза.
4. От -80 до -130 °С - зона кристаллизации связанной и адсорбированной воды и рекристаллизации.
5. От -130 до -273 °С - зона отсутствия кристаллизации и рекристаллизации.
Итак, суспензия клеток в изотоническом растворе солей (например, физиологическом) должна начать замерзать при -0,6 °С - температуре замерзания данного раствора. Однако замерзание суспензии обычно начинается с кристаллизации т.н. внеклеточной (расположенной между клетками) воды только при понижении температуры до -10 °С, при которой и происходит формирование «очагов» кристаллизации воды. При этом клеточная суспензия в диапазоне температур от 0 до -10 °С является переохлажденной, т.е. находящейся в метастабильном, жидком состоянии. Замерзание внутриклеточной жидкости обычно начинается при температуре около -40 °С.На этапах замораживания клеточных суспензий повреждение клеток могут вызвать следующие факторы:
1. Скорость замораживания. Следует отметить, что для каждого типа клеток существует своя, оптимальная скорость замораживания, которая определяется экспериментальным путем. Если суспензия клеток замораживается слишком быстро, то сначала образуются внутриклеточные кристаллы льда, которые разрывают клеточные органеллы и мембрану, приводя к лизису и гибели клеток после их размораживания. Наоборот, если клетки замораживать слишком медленно, сначала происходит замораживание внеклеточной воды, что приводит к образованию гиперконцентрированных растворов солей и изменению рН среды. Все это вызывает т.н. обезвоживание клеток и впоследствии их гибель.
2. Перегрев клеток при замораживании наблюдается в результате выделения тепла в момент фазового перехода жидкой внеклеточной воды в лед. Такой перегрев также может привести к необратимому повреждению клеток. Для его предотвращения в ряде случаев применяют программное, или контролируемое замораживание, когда в момент фазового перехода вода/лед суспензию клеток стараются кратковременно охлаждать очень быстро, что нейтрализует перегрев клеток.
3. Холодовой шок, о котором упоминалось выше.
Несмотря на перечисленные выше проблемы, в настоящее время удается заморозить и затем разморозить суспензии клеток, сохранив при этом их жизнеспособность. Этого можно добиться благодаря одновременному использованию двух подходов:
1. Применение т.н. криопротекторов - веществ, которые обладают способностью предупреждать развитие криоповреждений и обеспечивать сохранность клеток в жизнеспособном состоянии после замораживания и размораживания.
2. Охлаждение с определенной, оптимальной для данного типа клеток скоростью.
Криопротекторы разделяют на быстро проникающие в клетку низкомолекулярные вещества (диметилсульфоксид), медленно проникающие (глицерин) и непроникающие высокомолекулярные вещества (полиэтиленоксид). Общим механизмом действия криопротекторов является их способность связывать молекулы воды, что замедляет рост кристаллов льда. Это предупреждает быстрое нарастание концентрации солей во внеклеточной среде и повреждение клеток в результате осмотического шока.
Методы замораживания клеток и их хранение
Применяют два основных метода замораживания:
1. Неконтролируемое, или ручное замораживание, когда сосуд с суспензией клеток в смеси с криопротектором помещают в морозильную камеру (-80 °С) или в пары жидкого азота (-130°С) - замораживание происходит со скоростью примерно 1-3 °С в мин;
2. Контролируемое, или программное замораживание, при котором клеточные суспензии охлаждают с помощью специальных приборов - программных замораживателей.
Такой способ позволяет достичь наилучших результатов. Замороженные клетки хранят в электрических морозильных камерах при температуре от -80 до -130 °С или в сосудах Дьюара : жидким азотом при температуре -196 °С. Чем ниже температура в хранилище, тем дольше можно сохранить жизнеспособные клетки. Хотя при температуре ниже -150 °С существенной разницы уже не наблюдается, так как метаболические и кристаллизационные процессы в клетках не происходят.
Необходимо для восстановления функциональной активности клеток после хранения. В физическом смысле под размораживанием понимают повышение температуры биологических объектов, сопровождающееся фазовым переходом льда в жидкое состояние. На этом этапе клетки могут быть необратимо повреждены в результате двух процессов:
1. Рекристаллизации льда - образования больших кристаллов из мелких и повреждения последними клеточных структур.
2. Гипотонического шока - резкого снижения осмолярности внеклеточной жидкости в результате быстрого плавления внеклеточного льда.
Для предотвращения этих феноменов на практике применяют несколько методов размораживания:
1. Нагрев теплопередачей - путем быстрого погружения сосудов с замороженными клетками в воду температурой около +40 °С.
2. Нагрев в сверхвысокочастотном (СВЧ) электромагнитном поле.
3. Размораживание теплопередачей с воздействием давления. В клинической медицине, как правило, ограничиваются наиболее простым способом - размораживанием в водяной бане.
Однако существенным моментом является предотвращение токсического действия криопротекторов после размораживания (особенно токсичен для клеток диметилсульфоксид). Для этого обычно применяют два способа:
1. Размороженные клетки отмывают от криопротекторов in vitro путем постепенного добавления изотонического раствора, содержащего 10-20% сыворотки или альбумина, что смягчает эффекты изменения осмотического давления.
2. Свежеразмороженную клеточную суспензию быстро вводят внутривенно пациенту вместе с криопротектором, при этом плазма крови нейтрализует осмотическое и токсическое повреждение размороженных клеток (например, при трансплантации размороженного костного мозга). Важным моментом является контроль жизнеспособности замороженных и размороженных клеток.
С этой целью используют два основных подхода:
1. Морфологическая оценка жизнеспособности, например, по исключению красителя трипанового синего (не проникает через неповрежденную мембрану и не окрашивает клетки).
2. Исследование функциональной активности размороженных клеток (выбор теста зависит от их типа - в случае кроветворных клеток это может быть изучение способности образования ими колоний в агаре под действием колониестимулирующих факторов; в случае сперматозоидов - оценка их подвижности и т.п.).
Криоконсервирование кроветворных клеток
Трансплантацию кроветворных клеток человека используют для восстановления гемопоэза у больных после воздействия цитостатических противоопухолевых препаратов или тотального облучения тела. У таких пациентов наблюдается полное исчезновение собственных клеток крови, и без пересадки кроветворных клеток они умирают от инфекций. Забор костного мозга или периферических стволовых клеток крови производят до начала интенсивной химиотерапии или облучения (курс продолжается до 1-й недели или более), а затем клетки переливают (трансплантируют) для восстановления гемопоэза. Для лечения некоторых заболеваний используют также аллогенные кроветворные клетки от HLA-совместимого здорового донора. Однако до трансплантации гемопоэтические клетки необходимо сохранять в жизнеспособном состоянии. Это можно сделать путем их замораживания с последующим размораживанием. В настоящее время для восстановления кроветворения используют клетки костного мозга, стволовые клетки периферической крови, клетки крови пупочного канатика новорожденных; разрабатываются подходы к трансплантации клеток эмбриональной печени.
Все типы кроветворных клеток могут быть подвергнуты криоконсервированию с последующим успешным размораживанием и восстановлением функциональной активности. Как правило, замораживают суспензию клеток в аутологичной плазме или сыворотке в присутствии криопротектора (обычно используют 10%-й диметилсульфоксид). Замороженные таким образом кроветворные клетки сохраняют жизнеспособность после хранения в течение 1-го года и более. Перед трансплантацией клетки быстро размораживают, и вводят суспензию внутривенно без отмывки от криопротектора.
Криоконсервирование зрелых клеток крови
Криоконсервирование эритро-, лейко-, тромбоцитов в последнее время применяется все реже. Это связано с большей терапевтической эффективностью свежевыделенных клеток (особенно тромбоцитов), сужением показаний к переливанию лейкоцитов в целом, а также с внедрением автоматических сепараторов клеток крови, которые позволяют получать большое количество свежих донорских клеток в необходимое время.
Однако на данном примере можно отметить различие в подходах к криоконсервации тех или иных типов клеток. Так, для эритроцитов в отличие от кроветворных клеток наиболее подходящими криопротекторами являются глицерин или полиэтиленоксид.
При этом оптимальная скорость замораживания эритроцитов составляет примерно 1000 °С в мин. Поэтому эритроциты помещают в т. н. замораживающий или ограждающий раствор с 30%-м глицерином и после инкубации при комнатной температуре в течение 20 мин для полной «глицеринизации» (проникновения криопротектора в клетки) погружают в специальных контейнерах непосредственно в жидкий азот. Такой подход неприемлем для замораживания ядросодержащих лейкоцитов или тромбоцитов, которые требуют постепенного, медленного охлаждения. В целом методики замораживания этих клеток сходны с технологией криоконсервации кроветворных клеток.
Криоконсервирование половых клеток
Относительно новым и весьма актуальным направлением в репродуктивной медицине является криоконсервирование сперматозоидов и яйцеклеток человека. Замораживание сперматозоидов уже практически стало рутинной процедурой в ряде зарубежных центров. Созданы специальные «банки» половых клеток, которые содержат материал, применяемый для искусственного оплодотворения. Важным аспектом является криоконсервирование спермы онкологических больных. Это дает им шанс иметь нормальное потомство после курса химиотерапии или облучения, в результате которых пациенты часто становятся бесплодными. Замораживание сперматозоидов производят с использованием режима, сходного с криоконсервацией кроветворных клеток. Однако в качестве криопротектора обычно применяют специфическую смесь на основе глицерина и желтка куриных яиц.
Что касается замораживания яйцеклеток, то эта процедура, практически вполне осуществимая, пока не вошла в обычную клиническую практику и находится на стадии разработки. Однако особенно перспективным представляется успешное замораживание и размораживание жизнеспособных эмбрионов человека (полученных, правда, на очень ранней стадии).
В настоящее время проводятся экспериментальные испытания по трансплантации замороженных и размороженных живых тканей, таких как эндокринные железы, легочная ткань, ткани сердечной мышцы и др. В ряде центров интенсивно разрабатываются новые криопротекторы, которые в отличие от существующих не обладали бы токсическим действием на клетки. Теоретическая возможность создания таких веществ, а также постоянное совершенствование технологии замораживания позволяют надеяться, что в недалеком будущем медицина вплотную подойдет к решению проблемы криоконсервации отдельных органов.
Читайте также:
- Дифференциальная диагностика туберкулеза пожилых. Лечение туберкулеза пожилых.
- Избыточная продукция тиреоидных гормонов. Гипертиреоза. Кретинизм. Гипотиреоз. Микседема. Тиреоидная недостаточность.
- Раннее выявление гемоглобинопатий. Скрининг населения на гемоглобинопатию.
- Гастрошизис: причины, симптомы и лечение
- Лучевая диагностика травматической грыжи брюшной стенки
