Криптококкоз. Возбудитель и распространенность криптококкоза
Добавил пользователь Alex Обновлено: 29.01.2026
Описаны клинические формы криптококковой инфекции и подходы к диагностике и лечению пациентов. Приведены схемы комбинированной терапии с применением антимикотических препаратов.
Clinical forms of cryptococcal infection and approaches to diagnosis and treatment of patients were described. The schemes of combined therapy with antimycotics were given.
На протяжении последних десятилетий грибковые заболевания не теряют своей актуальности. Среди всех инвазивных микозов криптококковая инфекция занимает одно из наиболее значимых мест, так как является жизнеугрожающим заболеванием. Даже при своевременном лечении летальность составляет от 10% до 25%, а в развивающихся странах достигает 90%. Ежегодно в мире регистрируют около 1 млн случаев криптококкоза. В России, на данном этапе, обязательная регистрация глубоких микозов отсутствует. Истинная заболеваемость не известна, но по данным Северо-Западного государственного медицинского университета им. И. И. Мечникова в Санкт-Петербурге отмечается значительный рост криптококкоза с летальным исходом в период с 2002 по 2010 г. [1–5].
Род Cryptococcus насчитывает более 70 видов базидиомицетовых капсулированных дрожжей, из них медицинское значение имеет Cryptococcus neoformans и Cryptococcus Gatti. Cryptococcus Gatti наиболее распространен в странах с тропическим климатом, на территории Европы и России доминирует Cryptococcus neoformans. К факторам патогенности криптококка относят его способность расти при температуре 37 °C (т. е. при температуре тела теплокровных животных), а также возможность образовывать полисахаридную капсулу, которая является защитой от фагоцитоза и гуморальных факторов иммунитета. Криптококки синтезируют ряд ферментов, в том числе уреазу и фосфолипазу. Уреаза способствует адгезии дрожжей к эндотелиальным клеткам и формирует слизистые «кисты», не инициируя воспалительного ответа. Фосфолипаза разрушает клеточные мембраны человека, облегчает прикрепление к легочному эпителию. Способность грибов к меланинообразованию служит защитой от антитело-опосредованного фагоцитоза [6–10].
Заболеванию клинически выраженными формами криптококкоза подвержены люди с нарушениями в иммунной системе. Чаще всего это пациенты с синдромом приобретенного иммунодефицита (СПИД), лейкозом, саркоидозом, лимфомой, а также пациенты после трансплантации органов и больные, получающие большие дозы цитостатиков или кортикостероидов. Заражение происходит ингаляционно, легкие являются органом первичной локализации возбудителя, где он может долгое время находиться в латентном состоянии. При нарушении функционирования иммунной системы происходит активация инфекции [11, 12].
Клиника криптококкоза зависит от локализации и распространенности процесса. По МКБ-10 выделяют легочный криптококкоз, церебральный криптоккоз, криптококкоз кожи, криптококкоз костей. Криптококкоз легких может протекать бессимптомно или сопровождаться кашлем со слизистой мокротой, слабовыраженной лихорадкой, недомоганием, редко одышкой. Рентгенологически визуализируются узелковые инфильтраты и сливные очаги, расположенные субплеврально. У больных СПИДом в 1/3 выявляется криптококковая пневмония. Заболевание характеризуется быстрым прогрессированием с развитием респираторного дистресс-синдрома и острой дыхательной недостаточностью. Криптококкоз кожи встречается в 10–15% случаев. Характеризуется появлением папул, которые трансформируются в бляшку с уплотнением и последующим изъязвлением в центре элемента. Локализуются чаще на волосистой части головы и лице. Криптококкоз костей характеризуется остеолизисом, частота встречаемости 5%. Поражаются кости таза, позвоночника, черепа, ребра [13].
Наиболее частой клинической формой является церебральный криптококкоз, который в 80–90% протекает в форме менингоэнцефалита. В центральной нервной системе (ЦНС) возбудитель диссеминирует гематогенным путем. Мишенью для патогенного воздействия криптококков является эндотелий сосудов микроциркуляторного русла. Основной способ проникновения возбудителя в вещество головного мозга это разрушение стенки сосуда. В результате этого возникает нарушение микроциркуляции, что влечет за собой дистрофию нейронов и развитие очагов некроза. Вследствие резко повышенной проницаемости сосудов происходит скопление жидкости в веществе мозга. Гистологически отмечается пролиферация дрожжеподобных грибов с инфильтрацией, представленной преимущественно лимфоцитами, гистиоцитами, небольшим числом плазмоцитов, единичными нейтрофилами. На аутопсии поражение оболочек мозга характеризуется как серозно-продуктивный менингит с точечными кровоизлияниями в мягкую и твердую мозговые оболочки. Оболочки утолщены, мутные, на поверхности множественные мелкие бугорки (скопление грибов). Патологический процесс также может охватывать базальную поверхность мозга. Причиной смерти является отек головного мозга с дислокацией стволовых структур [13, 14].
Доминирующая жалоба — постоянная головная боль диффузного характера, интенсивность которой постепенно нарастает. Тошнота, рвота отмечается у 40% пациентов. Лихорадочная реакция не постоянна, температура тела колеблется в широких пределах от 37,2 до 39,5 °С. Менингеальные симптомы (ригидность мышц затылка, симптом Кернига, симптом Брудзинского) чаще отсутствуют или бывают сомнительными. Судороги, нарушение сознания встречаются в единичных случаях и, как правило, в поздних стадиях заболевания. У некоторых больных могут выявляться застойные диски зрительных нервов, нарушение зрения, очаговая неврологическая симптоматика. При исследовании спинномозговой жидкости (СМЖ) воспалительные изменения слабо выражены. Обычно отмечается повышенное содержание белка и лимфоцитарный двух-трехзначный плеоцитоз. Характерно прогрессирующее снижение уровня глюкозы [7, 12, 13, 15, 16].
Для диагностики криптококкового поражения ЦНС основным методом является микробиологическое исследование СМЖ. Для микроскопии мазки заливают 1–2 каплями туши. Капсула Cryptococcus neoformans окрашивается не полностью и образует специфические ободки. Клетки криптококка имеют шаровидную или эллипсовидную форму. Диаметр варьирует от 5 до 7 мкм, редко от 2 до 15 мкм. Капсула хорошо окрашивается, по методу Моури альциановым синим в сине-зеленый цвет. Этот метод окрашивания позволяет визуализировать фагоцитированные криптококки. Эффективность данного метода достигает 97% [5, 17].
Для подтверждения диагноза решающее значение имеет культуральный метод. Растет Cryptococcus neoformans от 48 до 72 часов, на сусло-агаре или среде Сабуро, при температуре 37 °С. Внешне это белые, гладкие, блестящие слизисто-тягучие колонии. Получение культуры криптококка позволяет определить чувствительность выделенного штамма к антимикотическим препаратам. Микробиологическая диагностика применяется и при других формах криптококковой инфекции. Субстратами для исследования являются кровь, мокрота, отделяемое кожных элементов. Из дополнительных методов используется латекс-агглютинация. Показатели специфичности и чувствительности стандартных тестов превышают 90%. В последние годы все шире в диагностических целях применяется полимеразная цепная реакция (ПЦР), ценность этого метода заключается в том, что он позволяет в кротчайшие сроки установить диагноз [14, 16, 17].
Методы нейровизуализации (компьютерная томография и магнитно-резонансная томография) в части случаев позволяют получить дополнительные данные о характере процесса. У 34% отмечается атрофия коры головного мозга, у 11% поражение вещества головного мозга как диффузного, так и очагового характера (криптококкома). Гидроцефалия выявляется у 9%, в 50% патологические изменения не обнаруживаются [13, 17].
Для лечения менингоэнцефалита криптококковой этиологии необходимо использовать антимикотические препараты, проникающие через гематоэнцефалический барьер (ГЭБ) в терапевтических концентрациях. К ним относят флуцитозин, амфотерицин В, флуконазол. Флуцитозин обладает как фунгистатическим, так и фунгицидным действием. Встраиваясь в рибонуклеиновую кислоту (РНК) возбудителя, нарушает образование белков, а также подавляя активность тимидилатсинтетазы, препятствует синтезу грибковой дезоксирибонуклеиновой кислоты (ДНК). Его концентрация в СМЖ составляет 75% от концентрации в плазме. Амфотерицин В обладает в большей степени фунгистатическим действием. Механизм действия заключается в способности связываться с эргостерином клеточной мембраны возбудителя. В мембране образуются поры, нарушается барьерная функция, что влечет за собой потерю клеточных структур и гибель гриба. Его концентрация в СМЖ при внутривенном введении составляет 5%, поэтому предпочтительно эндолюмбальное введение. Комбинация этих двух препаратов дает лучший терапевтический эффект, в отличие от монотерапии. Кроме того, это позволяет уменьшить дозу амфотерицина В и, тем самым, снизить его токсический эффект и сократить продолжительность курса лечения. Применение комбинированной терапии позволяет предотвратить или отсрочить развитие резистентности возбудителя. Чувствительность Cryptococcus neoformas к амфотерицину В составляет 68%, флуцитозину 54%. Столь же хорошо проникает в биологические среды организма флуконазол, его концентрация в СМЖ составляет около 85%. Фунгистатический эффект данного препарата заключается в способности угнетать синтез эргостерина мембраны грибов. Чувствительность к нему составляет 74% [16, 22, 23].
В настоящее время используется следующая схема лечения: амфотерицин В 0,7–1,0 мг/кг/сут в сочетании с флуцитозином 100 мг/кг/сут в течение двух недель, а затем флуконазол 800–400 мг/сут не менее 10 недель. Если состояние пациента не улучшается в первые две недели лечения, то лечение амфотерицином В продлевают. Для лиц с сохраняющимся фактором риска повторного развития инфекции (больные СПИДом) рекомендуется поддерживающая терапия флуконазолом 200–400 мг/сут от 6 месяцев до года. Основной побочный эффект данного лечения это токсическое воздействие на почки, которое может отмечаться у 80% пациентов. Поэтому целесообразно применение липосомального препарата амфотерицина B (Амбизом), обладающего меньшей токсичностью. Возможно также эндолюмбальное введение амфотерицина В в дозе 0,25–1,0 мг 2–4 раза в сутки. При возникновении рецидива заболевания рекомендуется использовать амфотерицин В или липосомальный амфотерицин В в дозе 1 мг/кг/сут в течение 4–10 недель. В качестве поддерживающей терапии флуконазол 800–1200 мг/сут не менее 10–12 недель. В процессе лечения необходим регулярный контроль чувствительности штаммов криптококка к антимикотическим препаратам для корректировки терапии в случае резистентности возбудителя [5, 16, 24].
Помимо этиотропной терапии необходима коррекция внутричерепного давления, так как его стойкое повышение свидетельствует о возможности развития отека и набухания головного мозга (ОНГМ) с дислокацией, являющейся главной причиной летальности. Это осложнение возможно и на фоне специфической терапии, т. к. лизис криптококка приводит к освобождению токсических компонентов клетки, способствующих повышению проницаемости сосудов. Поэтому необходимо систематическое проведение дегидратационной терапии с использованием петлевых и осмотических диуретиков. При давлении СМЖ выше 250 мм в. ст. рекомендуются ежедневные пункции до снижения показателей. Стойкое повышение давления СМЖ требует постоянного дренажа (вентрикулоперитонеальный шунт) [5].
Об эффективности лечения судят по клиническому состоянию больного и улучшению состава СМЖ. Прежде всего, нормализации уровня глюкозы, отрицательному результату микроскопического и бактериологического исследовании ликвора, а также по результатам ПЦР. Снижение микробной нагрузки на 2–3 порядка в течение двух недель является хорошим прогностическим признаком и критерием адекватности терапии [2, 16].
Летальность при криптококкозе без применения антимикотической терапии достигает 100%. Она обусловлена: поздней диагностикой, резистентностью возбудителя, возможностью развития ОНГМ на фоне антимикотической терапии, низкой приверженностью больных к лечению или отказом от нее (в первую очередь ВИЧ-инфицированных) [16, 25].
Таким образом, проблема криптококкового поражения ЦНС приобретает все большую актуальность. Малая информативность клинической картины болезни требует от врачей при появлении неврологической симптоматики, прежде всего длительной головной боли у больных из группы риска раннего исследования СМЖ, даже при отсутствии менингиальных симптомов. В процессе лечения необходимо повышенное внимание к состоянию больного (возможность внезапного развития ОНГМ), микробиологический контроль СМЖ с определением чувствительности возбудителя (возможность формирования резистентности) и определения микробной нагрузки методом ПЦР как самого достоверного метода оценки эффективности лечения.
Литература
- Елинов Н. П., Босак И. А. Прошлое и настоящее Cryptococcus neoformans (Sanfelice) Vuillemin (1901) как объекта изучения потенциально грозного патогена для человека // Проблемы мед. микологии. 2006. Т. 8, № 2. С. 47–51.
- Климко Н. Н. Микозы: диагностика и лечение. Рук-во для врачей. М., 2007. 336 с.
- Васильева Н. В. Криптококки и криптококкоз на современном этапе // Проблемы. мед. микологии. 2002. Т. 4, № 2. С. 45–46.
- Лесовой В. С., Липницкий А. В. Микозы центральной нервной системы (обзор) // Проблемы мед. микологии. 2008. Т. 10, № 1. С. 3–6.
- Климко Н. Н. Микозы центральной нервной системы. СПб: Инфекционные болезни: проблемы, достижения и перспективы, 2011.
- Voelz K. Macrophage-Cryptococcus interactions during cryptococcosis // PhD Thesis. 2010.
- Васильева Н. В. Факторы патогенности Cryptococcus neoformans и их роль в патогенезе криптококкоза. Дисс. … докт. биол. наук. СПб, 2005.
- Васильева Н. В., A. A. Степанова, И. А. Синицкая. Ультраструктура капсул зрелых клеток штаммов Cryptococcus neoformans in vitro и in vivo // Проблемы медицинской микологии. 2006. Т. 8, № 2. С. 25.
- Charlicr C. Capsule structure changes associated with Cryptococcus neoformans crossing of the blood-brain barrier/C. Charlier, F. Chretien, M. Baudrimont, E. Mordelet, O. Lortholary, F. Dromer // Am. J. Pathol. 2005. V. 166, № 2. P. 421–432.
- Romani L. Immunity to fungal infection // Nat. Rev. Immunol. 2004. Vol. 4. P. 1–23.
- Del Poeta M. Role of phagocytosis in the virulence of Cryptococcus neoformans // Eukaryotic cell. 2004. Vol. 3. P. 1067–1075.
- Baddley J. W., Perfect J. R., Oster R. A. Pulmonary cryptococcosis in patients without HIV infection: factors associated with disseminated disease // Eur. J. Clin. Microbiol. Infect. Dis. 2008. Vol. 27, № 10. P. 937–943.
- Сергеев А. Ю., Сергеев Ю. В Грибковые инфекции. Рук-во для врачей. М.: ООО «Бином-пресс», 2003. 440 с.: ил.
- Хмельницкий O. K., Хмельницкая Н. М. Патоморфология микозов человека СПб: Издательский дом СПбМАПО, 2005. 432 с.
- Бартлетт Дж., Галлант Дж., Фам П. Клинические аспекты ВИЧ-инфекции. 2009–2010. М., 2010. 459 с.
- Венгеров Ю. Я., Волкова О. Е., Сафонова А. П., Свистунова Т. С., Воробьев А. С., Маринченко М. Н., Мартынова Н. Н. Клиника и диагностика криптококкового менингоэнцефалита у больных ВИЧ-инфекцией. Материалы V Ежегодного Всероссийского Конгресса по инфекционным болезням. 2013. С. 85.
- Аравийский Р. А., Климко Н. Н., Васильева Н. В. Диагностика микозов. СПб: Издательский дом СПбМАПО, 2004. 186 с.
- Larsen R. A., Bauer R., Thomas A. M. et al. Amphotericin B and fluconazole. A potent combination therapy for cryptococcal meningitis // Antimicrob. Agents. Chemother. 2004. Vol. 48, № 3. P. 985–987.
- Barchiesi F., Spreghini E., Schmizzi A. Posaconazole and amphotericin B combination therapy against Cryptococcus neoformans infection // Antimicrob. Agents. Chemother. 2004. Vol. 48, № 9. P. 3312–3316.
- Saag M. S., Graybill R. J., Larsen R. A. et al. Practice guidelines for the management of cryptococcal disease // Clin. Infec. Dis. 2000. Vol. 30, № 3. P. 710–718.
- Berard H., Astoul P., Frenay C. et al. Disseminated histplasmosis caused by Histoplasma capsulatum with cerebral involvement occurring 13 years after the primary infection // Rev. Mal. Respir. 1999. Vol. 16, № 5. P. 829–831.
- Haynes R. R., Connolly P. A., Durkin M. M. et al. Antifungal therapy for central nervous system histoplasmosis, using a newly developed intracranial model of infection // J. Infec. Dis. 2002. Vol. 185, № 9. P. 1830–1832.
- Saccente M., McDonnell R. W., Baddour L. M. et al. Cerebral histoplasmosis in the azole era: report of four cases and review // South J. Med. 2003. Vol. 96, № 4. P. 410–416.
- Сергеев А. Ю. Эволюция антимикотиков и революции в терапии микозов // Успехи медицинской микологии. 2002; 1: 111–112.
О. Е. Волкова 1
Ю. Я. Венгеров, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Криптококкоз
Криптококкоз (ранее: торулез, европейский бластомикоз, болезнь Буссе–Бушке) – инфекционное заболевание, вызываемое дрожжевым грибом Cryptococcus neoformans отдела Basidiomycota, относится к глубоким микозам. Криптококк не является представителем нормальной микрофлоры человека; его выделение всегда указывает на клинически выраженную или субклиническую инфекцию (в том числе у людей без нарушений иммунитета). C.neoformans является одной из основных причин поражений ЦНС у пациентов с иммунодефицитами. Выделяют четыре серотипа возбудителя – A, В, С и D. Серотипы A и D обозначают как C.neoformans var. neoformans, ceротипы В и С – C.neoformans var.gattii. У больных ВИЧ-инфекцией, особенно в Европе и Америке, выделяют преимущественно C. neoformans var. neoformans.
Природный источник C.neoformans var. neoformans – почва, содержащая помет голубей, реже – гниющие овощи, фрукты, растения. Инфицирование человека от животных, также как передача возбудителя от человека человеку (за исключением случаев пересадки зараженных органов) не доказаны. Основной путь передачи – воздушно- пылевой, возможно заражение через поврежденную кожу или слизистые оболочки. Чаще всего входные ворота инфекции — легкие. Проникшие в легкие криптококки (обычно мелкие бескапсульные формы, достигающие альвеол) создают первичный очаг инфекции, откуда возбудители разносятся гематогенным путем в различные органы и ткани. Имеются данные, что у людей без нарушений иммунитета криптококки могут находиться в неактивной форме в легких неопределенно долго, а активация латентной инфекции происходит только при неблагоприятных условиях.
Инкубационный период заболевания составляет от нескольких дней до нескольких месяцев. Клинические проявления заболевания зависят от локализации поражений и выраженности иммунодефицита. Самая частая клиническая форма криптококкоза — менингит (до 90% всех случаев криптококкоза), который развивается у 2,0–7,5% больных СПИДом. Заболевание обычно носит генерализованный характер, кроме ЦНС, возбудитель часто поражает легкие и кожу, реже — другие органы (костный мозг, лимфатические узлы, печень, почки, надпочечники, суставы, миокард, перикард, селезенку). Криптококковый менингит — самое частое грибковое поражение ЦНС при ВИЧ-инфекции. Приблизительно у 50% больных ВИЧинфекцией, страдающих криптококковым менингитом, развивается криптококковая пневмония. Описаны случаи бессимптомного течения болезни.
Криптококковая инфекция у лиц с нормальным иммунным статусом протекает доброкачественно и во многих случаях самоэлиминируется, выявляясь в основном при профилактическом рентгенологическом исследовании в виде остаточных явлений в легких. Исключение составляет криптококковый менингит, который при несвоевременных диагностике и лечении заканчивается летальным исходом, либо оставляет резидуальные изменения.
Факторы риска развития криптококкоза: иммунодефицитные состояния, связанные с ВИЧ-инфекцией, длительным применением глюкокортикоидов и иммуносупрессоров, трансплантацией органов и тканей, некоторыми гемобластозами (острый лимфобластный лейкоз, лимфома). Риску заболевания подвержены также люди с декомпенсированным сахарным диабетом, печеночной и почечной недостаточностью, саркоидозом, коллагенозами.
Показания к обследованию
Больные ВИЧ-инфекцией на поздних стадиях болезни (количеством CD4+ лимфоцитов менее 200 клеток/мл); лица с иммунодефицитными состояниями другой природы с признаками поражения ЦНС или пневмонией.
Дифференциальная диагностика
Токсоплазмоз, лимфома, прогрессирующая многоочаговая лейкоэнцефалопатия, ЦМВИ, туберкулез, пневмоцистоз, саркоидоз и др.
Материал для исследования
- СМЖ, биоптаты костного мозга, мокрота, моча, сыворотка/плазма крови, материал из очагов поражения кожи и др – микроскопические исследования, выявление АГ, выявление ДНК;
- сыворотка крови – определение АТ.
Этиологическая лабораторная диагностика включает визуальное выявление микроорганизма с использованием микроскопии, посев биологического материала с дальнейшей культуральной и биохимической идентификацией патогена, выявление АГ или ДНК C.neoformans, обнаружение АТ к C.neoformans.
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований и особенности интерпретации их результатов
Для окраски препаратов с целью визуального выявления C.neoformans используют разные методы: окраска по Граму, нигроззином или тушью по Бурри, муцикармином или конго красным. Клетки криптококков диаметром 4–12 мкм располагаются преимущественно в макрофагах. Диагностическая чувствительность микроскопического исследования СМЖ с окраской тушью по Бурри составляет 40–70%. При использовании названного метода для истинной идентификации C.neoformans необходимы высококвалифицированные специалисты лабораторной диагностики.
Для выявления C.neoformans используют посев с дальнейшей культуральной и биохимической идентификацией возбудителя, исследованием чувствительности штаммов к антимикотическим препаратам. На стандартных средах колонии C.neoformans обычно выявляют через 3–10 дней. Чтобы отличить C.neoformans от других видов этого рода при выделении культуры, а также в целях быстрой идентификации, определяют фенолоксидазную активность на средах с птичьим кормом или кофеиновой кислотой. Диагностическая чувствительность при выявлении возбудителя из СМЖ составляет 50–70%.
В целях экспресс-диагностики криптококкоза используют определение АТ и АГ. Антиген C.neoformans в СМЖ удается выявить в 95% случаев при менингите; столь же демонстративные результаты могут быть получены при сочетании менингита с пневмонией. Для выявления АГ применяют метод РА. Ложноположительные результаты определения возможны при развитии злокачественных новообразований, высоком уровне ревматоидного фактора в крови, а также при инфекциях, обусловленных Trichosporon spp., Capnocytophaga canimorsus и Stomatococcus mucilaginosis. Для определения специфических АТ к C.neoformans (суммарных или отдельных классов) применяют методы ИФА и РНИФ. Титры АТ при криптококкозе бывают достаточно высокими — 1:1000 и выше. У больных на поздних стадиях ВИЧ-инфекции с выраженным иммунодефицитом (СПИД) определение АТ не всегда бывает эффективным.
Высокую диагностическую значимость имеет обнаружение ДНК криптококка методом ПЦР в СМЖ и других биологических жидкостях. Выявление специфического фрагмента ДНК C.neoformans позволяет при однократном тестировании подтвердить клинический диагноз криптококкоза. Метод ПЦР позволяет выявлять ДНК C.neoformans var. neoformans и ДНК C.neoformans var.gattii, идентифицировать штаммы с одинаковой диагностической чувствительностью. Для мониторинга эффективности проводимой этиотропной терапии возможно применение ПЦР для определения концентрации ДНК возбудителя в динамике болезни.
Криптококкоз. Возбудитель и распространенность криптококкоза
Криптококкоз. Возбудитель и распространенность криптококкоза
В настоящее время выделяют две группы бластомикозов: 1) истинный бластомикоз (или криптококкоз), или европейский бластомикоз Busse—Buschke; 2) парабластомикозы — североамериканский бластомикоз Gilchrist-Stokes и паракокцидиодоз, или южно-американский бластомикоз Lutz (в который включается и гистоплазмоз). Этим группам противопоставляются псевдобластомикозы: кокцидиоидомикоз, хромобластомикоз.
Возбудитель — Cryptococcus neoformans (Sanfelice, 1894) VuiUemin, 1901 — одноклеточный дрожжеподобный гриб, размножающийся почкованием. Почки одиночные, непрочно связяны с материнской клеткой, наблюдаются редко, так как довольно скоро отделяются и существуют самостоятельно. При быстром росте криптококков размеры клеток в культурах широко варьируют — от 4 до 21 мкм, стенки их довольно тонкие, легко разрушаются при неблагоприятных физико-химических условиях.
Заражение человека может происходить от больных людей и животных, особенно при условии их тесного контакта, через дыхательные пути, кожу и желудочно-кишечный тракт. Наиболее эффективным является аэрозольный механизм заражения, обычно реализуемый воздушно-пылевым путем.
Болеют, как правило, лица с иммунодефицитами различного генеза (пациенты с ВИЧ/СПИД, сахарным диабетом, заболеваниями системы крови и др.).
Криптококкоз имеет убиквитарное распространение.
Патогенез криптококкоза не выяснен. Развитию манифестных, в особенности диссеминиррованных форм микоза способствуют иммунодефицитные состояния макроорганизма.
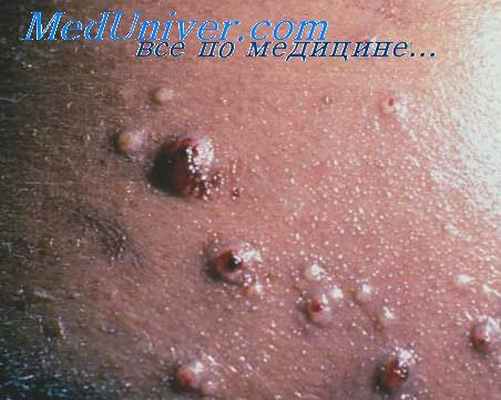
В большинстве случаев входными воротами криптококков являются легкие, где возникают очаги поражения в виде первичной криптококковой грануломы, диаметром 1-7 см, Расположенные субплеврально. Гистологическое исследование выявляет скопления одно-и многоядерных гистиоцитов, окруженные стромой, в которой видны овальные тельца с четким гало (halo) толщиной 3-5 мкм, отделяющим стенку гриба от цитоплазмы гистиоцитов.
Часто развиваются милиарные очаги, напоминающие туберкулезные, но без их кальциноза. В очагах с маловыраженной грануломатозной реакцией наблюдается расплавление легочной ткани с образованием слизистой массы, содержащей множество криптококков, что делает эти поражения похожими на гуммы.
Почти в половине случаев криптококоза возникает гематогенное поражение головного мозга, при этом преимущественно в сером веществе образуются множественные очаги деструкции с желеобразным или слизеподобным содержимым, включающем скопления заключенных в толстую капсулу криптококков, на фоне слабой воспалительной реакции.
Иногда весь очаг состоит из огромного количества почкующихся клеток («Hefetumor») Вокруг скоплений элементов гриба мозговая ткань часто расплавлена и отечна, реже обнаруживается сформированная гранулема, богатая гигантскими многоядерными клетками с заключенными в них криптококками. Аналогичные изменения обнаруживаются в мозговых оболочках. Вследствие гематогенной диссеминации криптококков возможны полиорганные поражения. Иммунитет к повторному заражению не развивается.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Криптококкоз. Возбудитель и распространенность криптококкоза
КТ — компьютерная томография
СМЖ — спинномозговая жидкость
ЦНС — центральная нервная система
Криптококкоз — инвазивный микоз, вызываемый дрожжевыми грибами Cryptococcus spp. Инфекция возникает преимущественно у больных с Т-клеточным иммунодефицитом и характеризуется частым поражением центральной нервной системы (ЦНС). Основным возбудителем криптококкоза является Cryptococcus neoformans, реже заболевание вызывают C. laurentii и С. albidus. К факторам риска, индуцирующим развитие инфекции, относят применение глюкокортикоидных и иммуносупрессивных препаратов, таких как алемтузумаб, флударабин, циклоспорин А, такралимус и др. [1—3]. Криптококкоз преобладает у ВИЧ-инфицированных больных и наиболее высокая частота этой инфекции была до внедрения высокоактивной антиретровирусной терапии СПИДа. Так, по данным многоцентрового исследования, проведенного в США с 1992 по 1994 г., заболеваемость криптококкозом при ВИЧ-инфекции составляла 1700—6600 случаев на 100 тыс. населения, в то время как у ВИЧ-неинфицированных больных этот показатель был 0,2—0,9 случая на 100 тыс. населения [1]. По данным другого многоцентрового исследования (США, 1990—1996 гг.), в структуре ВИЧ-негативных с криптококкозом основную долю составили больные, длительно принимающие глюкокортикоидные препараты (28%), реципиенты органов и тканей (18%), пациенты с ревматологическими заболеваниями (13%), гемобластозами (9%) и солидными опухолями (9%) [4].
Инфицирование криптококками обычно происходит ингаляционным путем. Споры гриба, попадая в легкие, вызывают развитие бронхопневмонии. На фоне Т-клеточного дефицита иммунитета происходит гематогенная диссеминация криптококков с поражением ЦНС. У 25—50% больных при диссеминированном процессе возможно поражение других органов, таких как простата, кожа, печень, почки, селезенка и кости. Инфицирование простаты может в дальнейшем являться источником реактивации криптококкоза после прекращения лечения. Инфицирование криптококками возможно контактным путем при травме кожных покровов [4—6].
Клинические проявления криптококкоза неспецифичны и зависят от локализации процесса. Наиболее часто возникают фебрильная температура тела, головная боль, головокружение, нарушение сознания, реже такие симптомы, как кашель, одышка, высыпания на коже.
У ВИЧ-инфицированных больных при криптококковом менингите или менингоэнцефалите примерно в 75% случаев отмечается высокое внутричерепное давление, вызванное быстрым ростом грибов в спинномозговой жидкости (СМЖ) [3].
До недавнего времени основным методом диагностики криптококковой инфекции было выявление криптококков при микроскопии с помощью окраски мазка индийской тушью и/или в культуре при исследовании СМЖ, крови и других субстратов. Этот метод наиболее информативен у ВИЧ-инфицированных больных в связи с быстрым ростом криптококка, особенно в СМЖ [7]. В настоящее время доступна экспресс-диагностика криптококковой инфекции, которая основана на определении антигена криптококка (глюкуроноксиломаннан) в крови, СМЖ, жидкости бронхоальвеолярного лаважа (БАЛ) и моче. Следует отметить высокую чувствительность (92%) и специфичность (>93%) этого теста даже при проведении исследования латекс-методом. Ложноположительные результаты при определении антигена криптококка встречаются редко, они возможны при злокачественном новообразовании, высоком титре ревматоидного фактора в сыворотке крови, а также при инфекциях, обусловленных Trichosporon spp., Capnocytophaga canimorsus и Stomatococcus mucilaginosis [8, 9].
В проведенном нами исследовании представлены клинические проявления, особенности диагностики и результаты лечения криптококкоза у больных гемобластозами.
Материалы и методы
Проведен ретроспективный анализ клинических проявлений, особенностей диагностики и результатов терапии криптококкоза у находящихся на лечении в ГНЦ МЗ РФ с 2005 по 2011 г. больных с опухолями системы крови.
Диагноз криптококкоза устанавливали согласно критериям EORTC/MSG (European Organization for Research and Treatment of Cancer/Mycoses Study Group) на основании получения культуры грибов из крови, СМЖ и других стерильных образцов и (или) определения положительного антигена криптококка в крови и (или) ликворе у больных, имеющих симптомы инфекции [10].
Определение антигена криптококка (глюкуроноксиломаннан) проводили латекс-тестом Pastorex Crypto Plus («BIO-RAD», Франция).
При повышении температуры тела более 38 °С кровь для микробиологического исследования брали из периферической вены и/или из центрального венозного катетера в коммерческие флаконы, предназначенные для автоматического анализатора гемокультур Becton-Dickinson (США). Для идентификации грибов использовали тест-системы API 20AUX («bioMerieux», Франция).
Результаты
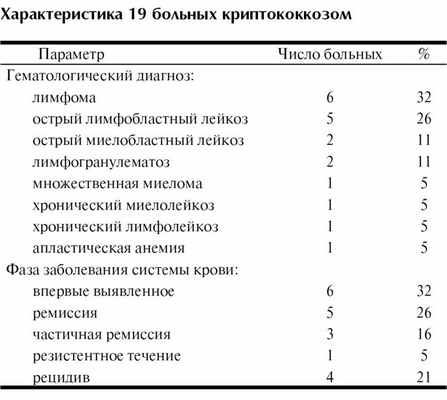
В течение 7 лет (2005—2011 гг.) криптококкоз диагностирован у 19 больных с заболеваниями системы крови (12 мужчин, 7 женщин) в возрасте от 19 до 68 лет (медиана 47 лет). В структуре криптококкоза преобладали больные лимфомой (31%) и острым лимфобластным лейкозом (26%) на этапах индукции (32%) и консолидации (26%) ремиссии гемобластоза (см. таблицу). У 13 (68%) из 19 больных криптококкоз диагностирован после курса полихимиотерапии (ПХТ), у 4 (21%) — при рецидиве или резистентном течением гемобластоза (давность введения цитостатических препаратов составила более 3 мес), у 1 — после трансплантации аллогенных стволовых гемопоэтических клеток при лечении преднизолоном хронической реакции трансплантат против хозяина, у одного — при использовании более 3 мес циклоспорина А в лечении апластической анемии. Медиана от окончания курса ПХТ и развития криптококкоза составила 9 дней (от 0 до 49 дней), при этом у 5 (38%) больных инфекция возникла после курсов высокодозной ПХТ, а у 8 (62%) — после стандартных курсов ПХТ. Глюкокортикоидные препараты применяли у 12 (63%) больных. На момент диагностики инфекции у 8 (42%) больных была гранулоцитопения (гранулоциты
Как уже отмечалось, у всех пациентов криптококкоз диагностирован в соответствии с критериями EORTC/MSG [10]. У 17 (89%) больных с симптомами поражения ЦНС выявлен положительный антиген криптококка в СМЖ, у одного пациента с сепсисом получена гемокультура Cr. neoformans, у одного больного с пневмонией и лихорадкой выявлен положительный антиген в 2 повторных анализах крови (расценен как возможная криптококковая пневмония). Проведено повторное определение антигена в СМЖ у 13 больных, из них у 8 (61%) повторно выявлен положительный антиген криптококка.
Таким образом, учитывая клинические проявления инфекции и результаты исследований, у 17 (78%) больных установлен диагноз криптококкового менингита или менингоэнцефалита, у одного — криптококкового сепсиса (лимфогранулематоз, 6-й курс химиотерапии с преднизолоном), у одного — возможной криптококковой пневмонии при лечении преднизолоном реакции трансплантат против хозяина, возникшей после трансплантации аллогенных гемопоэтических клеток.
Основным проявлением (78%) было поражение ЦНС в виде менингита или менингоэнцефалита. Ведущими симптомами при такой локализации инфекции служили головная боль (69%) и нарушение сознания до сопора (56%), реже — головокружение (25%) и тошнота (19%), кома развилась у 1 больного. При этом у 5 больных выявляли ригидность затылочных мышц, а у 4 имелись очаговые неврологические нарушения. Необходимо отметить, что 9 (47%) больным с криптококковым поражением ЦНС диагноз установлен в отделении интенсивной терапии, в которое они были переведены по причине развития тяжелых неврологических нарушений.
У 2 больных криптококкоз протекал без поражения ЦНС. У больного с криптококковым сепсисом основным симптомом была длительная фебрильная лихорадка на фоне применения антибиотиков широкого спектра действия. У больного с предполагаемым криптококковым поражением легких основными клиническими симптомами были температура тела более 38,5 °С и пневмония с дыхательной недостаточностью.
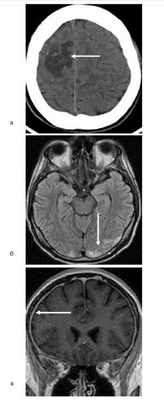
На момент диагностики криптококкоза 17 больным выполнили компьютерную томографию (КТ) органов грудной клетки и у 57% выявлены неспецифические изменения в легочной ткани. Во всех случаях при менингите/менингоэнцефалите выполнена КТ или магнитно-резонансная томография головного мозга. У 12 (71%) больных обнаружили изменения, из них гидроцефалию у 47%, очаги у 32%, утолщение оболочек головного мозга у 8% (см. рисунок). Рисунок 1. Криптококковый менингоэнцефалит у больных апластической анемией (а; КТ головного мозга: очаг пониженной плотности, неправильной формы с четкими контурами, размером 42,4×27,8×20 мм), лимфосаркомой (б; магнитно-резонансная томограмма — МРТ головного мозга: очаги неправильной округлой формы размером от 5 до 9 мм в затылочных областях обоих полушарий головного мозга) и острым лимфобластным лейкозом (в; МРТ головного мозга: равномерное утолщение твердых мозговых оболочек до 2—3 мм с интенсивным накоплением контрастного препарата).
Всем больным назначали противогрибковые препараты. На этапе индукции при симптомах менингита/менингоэнцефалита лечение проводили одним препаратом 15 больным (одному больному флуконазолом в дозе 800 мг/сут внутривенно, остальным — амфотерицином В в дозе 0,7—1,0 мг/кг/сут внутривенно) и 2 — сочетание амфотерицина В с флуцитозином (100 мг/кг/сут) или с флуконазолом (800 мг/сут). Медиана длительности индукционной терапии составила 17 дней (7—42 дня). Консолидирующую терапию проводили 8 больным, из них в 50% случаев вориконазолом в таблетках (400 мг/сут) и в 50% флуконазолом (400 мг/сут). Медиана длительности этапа консолидации составила 38 дней (8—60 дней). При криптококковом сепсисе на первом этапе назначали амфотерицин В в течение 21 дня, а затем флуконазол (400 мг/сут) — 30 дней. Больному с криптококковой пневмонией проводили лечение амфотерицином В в течение 2 нед, затем — флуконазолом 55 дней.
Излечение достигнуто у 12 (64%) больных. В течение 30 дней от момента диагностики криптококкоза умерли 5 (26%) пациентов. Причиной летального исхода в 1 (5%) случае был криптококковый менингоэнцефалит, в 2 (10,5%) — смешанная инфекция (криптококкоз и другая инфекция), в 2 (10,5%) — прогрессирование основного заболевания в сочетании с инфекционными осложнениями.
В настоящее время у ВИЧ-инфицированных больных криптококкоз занимает 4-е место среди инфекций, вызываемых условно-патогенными возбудителями, и является одной из основных причин менингита [1, 8]. Существенно реже это осложнение возникает при других заболеваниях, включая те, которые протекают с Т-клеточным иммунодефицитом. Так, в течение 10 лет криптококкоз диагностирован у 20 онкогематологических больных в центре M. Anderson (США) и у 17 пациентов в 21 центре Италии (данные исследования GIMEMA) [11, 12]. В связи с невысокой распространенностью криптококкоза у больных с опухолями системы крови, отчасти обусловленной и недостатками в диагностике, имеется немного публикаций по эпидемиологии, клиническому течению и результатам терапии.
Криптококкоз в онкогематологии возникает прежде всего у больных с лимфатическими опухолями [11—13]. Так, в исследовании D. Kontoyiannis и соавт. [11], у 17 (85%) из 20 больных криптококкозом были лимфома и хронический лимфолейкоз. В то же время, по данным многоцентрового исследования в Италии, в группу 17 больных криптококкозом вошли 47% пациентов острым миелоидным лейкозом и 41% — с лимфатическими опухолями. Авторы объясняют это преобладанием больных острым лейкозом из числа госпитализированных в гематологические стационары Италии [12]. В нашем исследовании криптококковая инфекция отмечалась преимущественно у больных с лимфатическими опухолями (74%), однако, кроме преобладания при лимфомах (31%), был выявлен немалый процент и при остром лимфобластном лейкозе (26).
Основными факторами риска развития криптококкоза у больных с опухолями системы крови были предшествующее цитостатическое воздействие, применение глюкокортикоидных и иммуносупрессивных препаратов. Необходимо отметить, что при инвазивном микозе в отличие от инвазивного аспергиллеза гранулоцитопения определяется реже (16—35%) и медиана ее продолжительности составляет около 5 дней [11—14]. В нашем исследовании число больных с гранулоцитопенией было несколько больше (42%) и, вероятно, этот показатель определяется интенсивностью цитостатического воздействия в стационаре при разных гемобластозах.
Как у ВИЧ-инфицированных пациентов, так и у больных с опухолями системы крови преобладает вовлечение в инфекционный процесс ЦНС при криптококкозе, однако клинические проявления неидентичные. Так, у больных гемобластозами симптомы криптококкового менингита и менингоэнцефалита не столь выражены, чаще всего беспокоят повышение температуры тела, головная боль, нарушение сознания, а при запоздалом лечении развивается сопор. В диагностическом плане также необходимо отметить низкий процент получения культуры криптококка из СМЖ у больных гемобластозами по сравнению с ВИЧ-инфицированными пациентами [4, 6, 13], поэтому диагноз криптококкоза в большинстве случаев устанавливают на основании определения положительного антигена криптококка в СМЖ или выделения культуры грибов из крови [11—14]. В многоцентровом исследовании L. Pagano и соавт. [12] диагноз криптококкоза был установлен у 8 (47%) из 17 больных при определении положительного антигена криптококка, а у 9 (53%) — при выделении культуры C. neoformans в основном из крови.
При лечении больных криптококкозом существуют особенности: во-первых, оно длительное и включает такие этапы, как индукция, консолидация и поддерживающая терапия; во-вторых, выбор противогрибкового препарата на первом этапе лечения (индукция) определяется локализацией инфекции [15]. При церебральной форме лечение начинают амфотерицином В (0,7—1 мг/кг/сут) в качестве монотерапии или в сочетании с флуцитозином (100 мг/кг/сут, эту дозу разделяют на 4 приема). Длительность этого этапа (индукция) составляет от 2 до 6 нед. Липидную форму амфотерицина В (липосомальный амфотерицин В в дозе 3—4 мг/кг или липидный комплекс амфотерицина В в дозе 5 мг/кг) следует назначать при непереносимости или токсичности, наблюдаемой при использовании обычного амфотерицина В. Не выявлено преимуществ по излечению при использовании липидных форм амфотерицина В в качестве начального режима лечения инфекции. При использовании флуцитозина возможно подавление костномозгового кроветворения [16]. В дальнейшем при улучшении проводят консолидирующую (8 нед) и поддерживающую (6—12 мес) терапию флуконазолом.
При изолированной нетяжелой легочной форме криптококкоза лечение проводят флуконазолом (400 мг/сут) в течение 6—12 мес [15]. В случае тяжелого течения криптококковой пневмонии или при диссеминации в ЦНС используют подход, аналогичный таковому при церебральной форме.
Альтернативным препаратом для лечения криптококкоза является вориконазол, который обладает высокой активностью in vitro, проникает через гематоэнцефалический барьер, имеет две формы применения и менее токсичен, чем амфотерицин В или флуцитозин [17—19]. Так, в глобальном многоцентровом исследовании, включающем изучение активности in vitro 1800 штаммов Cryptococcus spp., отмечено подавление роста у 99% грибов при низкой концентрации вориконазола, равной 0,5 мкг/мл и менее [17]. Для лечения больных криптококкозом вориконазол может быть назначен как на первом этапе заболевания, так и при резистентном течении. Отмечена эффективность сочетанного применения вориконазола и амфотерицина В в качестве препаратов второй линии при криптококковом менингите у ВИЧ-инфицированных больных [19].
По данным литературы, при адекватной противогрибковой терапии смертность от криптококкоза у больных с опухолями системы крови не превышает 40%. Чаще всего при криптококкозе умирают больные c неконтролируемым опухолевым процессом и поражением ЦНС [11—14]. В нашем исследовании летальность при криптококкозе в течение 30 дней составила 26%, причем в 40% случаев летальные исходы отмечались при неконтролируемом опухолевом процессе.
Заключение
Таким образом, в эру современной терапии опухолей системы крови, когда, с одной стороны, происходит интенсификация программ химиотерапии, а с другой — использование препаратов, подавляющих преимущественно Т-клеточное звено иммунитета, наблюдается расширение потенциальных возбудителей инвазивных микозов. При этом инфекционный процесс может быть обусловлен не только грибами Candida spp. или Aspergillus, но и другими возбудителями, такими как Cryptoccocus spp. При криптококкозе преобладает вовлечение в инфекционный процесс ЦНС, поэтому определение антигена криптококка в СМЖ при симптомах менингита или менингоэнцефалита у больных с опухолями системы крови, особенно лимфатическими, следует проводить во всех случаях. В случае своевременной диагностики и адекватной терапии смертность от криптококкоза при контролируемой ситуации по опухоли намного ниже, чем при других инвазивных микозах.
Криптококкоз собак и кошек
Криптококкоз – системная грибковая инфекция, встречающаяся во всем мире. Обычно поражает носовую полость, ткани вокруг носа или легкие. Она может распространяться на другие органы, чаще всего на кожу, глаза или центральную нервную систему.
Этой болезнью страдают самые разнообразные виды млекопитающих. Среди домашних животных чаще всего заболевают кошки, у которых это самая распространенная системная грибковая инфекция.
Заболевание распространено на юго-востоке и юго-западе США, в южной Калифорнии, западной части Британской Колумбии и на восточном побережье Австралии. По России, в виду отсутствия ветеринарных ученых, оценивающих данное заболевание, объективных данных нет. Однако в России такие пациенты тоже наблюдаются.
Криптококкоз вызывается преимущественно Cryptococcus neoformans и Cryptococcus gattii - сапрофитными круглыми дрожжеподобными микроорганизмами. Источниками инфицирования этими дрожжами могут стать выделения птиц, почва и фрукты. Виды рода Cryptococcus сохраняют жизнеспособность в фекалиях до двух лет.
Инфекция не передается при прямом контакте, а только при вдыхании микроорганизма из почвы или фекалий. Cryptococcus neoformans var. gattii обнаруживается преимущественно в тропических и субтропических областях из-за очень специфического местообитания на эвкалиптовых деревьях.
Болезнь поражает четыре группы органов: дыхательный тракт, центральную нервную систему, глаза и кожу. Следовательно, клинические признаки зависят от пораженных систем.
Инфекции органов дыхания (более чем в 80% случаев) характеризуются чиханием, истечениями из носа (гнойными, кровянистыми или прозрачными), припухлостью под кожей в области носа, поражениями ротовой полости и увеличением лимфатических узлов.
Неврологические симптомы варьируют в зависимости от локализации поражения и могут включать угнетение, плохую координацию движений, судороги, частичный паралич и слепоту.
При поражении глаз страдают преимущественно сетчатка, сосудистая оболочка и зрительный нерв. Клинические признаки варьируют от расширенных не реагирующих на свет зрачков и слепоты до хориоретинита, переднего увеита и повреждения сетчатки. Прогноз выживания при глазной форме криптококкоза при лечении триазоловыми противогрибковыми препаратами от удовлетворительного до хорошего. Однако прогноз восстановления зрения (из-за повреждения сетчатки) может варьировать от осторожного до неблагоприятного.
Повреждения кожи отмечаются приблизительно у 45% инфицированных животных и часто возникают одновременно с инфицированием других органов. Более вероятно, что поражения кожи обусловлены распространением инфекции на кожу. К более редким симптомам криптококкоза относятся разрушение костей, хронический кашель и почечная недостаточность.
Породы, входящие в группу риска
Собаки инфицируются C. neoformans гораздо реже кошек (вероятность инфицирования ниже в 7 – 10 раз). Средний возраст инфицированных собак составляет 3,5 года и, в отличие от кошек, у них нет половой предрасположенности. Чаще всего заболевают такие породы, как американский кокер-спаниель и лабрадор-ретривер (в Северной Америке), доберман-пинчер и дог (в Австралии). У собак криптококкозом поражаются те же четыре системы органов, что и у кошек, однако у собак чаще страдает ЦНС и глаза. Клинические признаки сходны с таковыми у кошек, кроме лихорадки (39,4 – 40,5°С), которая у собак встречается чаще (25% случаев). В нашей практике встречаются собаки и кошки различных пород, но статистики по России нет.
Диагноз и лечение
Криптококкоз – заболевание, сложно поддающееся лечению как у собак, так и у кошек. Обычно оно требует длительной терапии и последующего наблюдения.
Самым быстрым и практичным способом диагностики инфекции Cryptococcus neoformans являюятся лабораторные исследовани (истечений из носа и мочи).
Ранее для лечения криптококкоза применяли амфотерцин В (АмБ), отдельно или в сочетании с другими антигрибковыми препаратами. Однако по причине токсичности этого препарата его обычно резервируют для случаев, угрожающих жизни, и в ситуациях, когда предыдущее лечение инфекции не дало необходимых результатов. Из-за определенных недостатков АмБ, его применение менее желательно в сравнении с другими препаратами. Этот препарат сложно вводить внутривенно, а также АмВ вызывает много побочных реакций, включающих нефротоксичность и тяжелую азотемию. Препарат малоэффективен для собак и неэффективен при криптококковом менингите, так как не проникает через гематоэнцефалический барьер.
Кетоконазол (КТЗ) – еще один возможный препарат для лечения криптококкоза. Итраконазол (ИТЗ) – триазоловый противогрибковый препарат, сходный с КТЗ, но с меньшим количеством побочных нежелательных явлений.
Флуконазол (ФКЗ) – еще один триазоловый препарат, неспособный проникать через гематоэнцефалический барьер и дающий меньше побочных эффектов, чем вышеупомянутые противогрибковые соединения. Сообщается, что при лечении кошек ФКЗ частота случаев успешного излечения наибольшая, включая случаи с запущенным, длительным или диссеминированным заболеванием.
Прогноз
Исходы лечения криптококкоза сильно варьируют. Лекарственная терапия длительная (в среднем 8,5 месяцев) и часто возможно возникновение рецидивов.
При форме криптококкоза с поражением ЦНС требуется пожизненное поддерживающее лечение.
При неврологической форме болезни или иммунодефиците, вызванном вирусным лейкозом или вирусным иммунодефицитом кошек, прогноз гораздо хуже.
Поскольку Cryptococcus neoformans распространен повсеместно, лучшим способом профилактики является предотвращение контакта со средой, в которой может содержаться высокая концентрация микроорганизмов (голубиный помет, сырые здания или подвалы).
Криптококкоз у кошек
Кошки поражаются криптококкозом чаще, чем собаки. Очевидной половой, породной или возрастной предрасположенности у кошек не существует.
Клинические признаки обычно связаны с поражением органов дыхания, ротоглотки, кожи, глаз или ЦНС. В отличие от других системных микозов, клиническое поражение легких наблюдается не так часто.
В хронических случаях часты такие неспецифичные признаки, как угнетение или потеря аппетита, однако лихорадка встречается редко.
Симптомы поражения верхних дыхательных путей, связанные с инфекцией носовой полости, отмечаются у 50 – 80% инфицированных кошек и проявляются чиханием и сопением; типичны одно- или двухсторонние истечения из носа с кровью или без. Возраст инфицированных кошек широко варьирует (от 1 до 13 лет), средний возраст 5 лет. Отмечена предрасположенность у котов, вероятнее всего, из-за большей склонности гулять без присмотра. В большинстве исследований отмечается, что чаще всего криптококкоз встречается у сиамских кошек.
Свободно гуляющие кошки чаще заболевают криптококкозом, чем содержащиеся в доме, однако и у них не исключена вероятность контакта с возбудителем заболевания. Источниками инфекции домашних кошек могут стать земля в горшках с комнатными растениями и заплесневелые подвалы без отделки.
Читайте также:
