Культуральные свойства серраций. Биохимические свойства серраций. Патогенез поражений серрациями. Токсины серраций.
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Serratia species (серрации) – это имеющие форму палочек грамотрицательные условно-патогенные бактерии семейства Enterobacteriaceae. Они являются факультативными анаэробами*, отличаются подвижностью и широким распространением в окружающей среде. Значительное количество серраций содержится в человеческом кале. Наиболее распространенным и изученным видом Serratia species является Serratia marcescens. Виды S. plymuthica, S. liquefaciens, S. rubidaea и S. odoriferae более редкие.
Проведенные исследования показали, что все перечисленные виды Serratia species являются возбудителями различных инфекций в организме человека. Заражению серрациями чаще всего подвержены лица с ослабленным иммунитетом, наркоманы. Однако особую группу риска составляют пациенты стационаров, особенно перенесшие хирургические операции (90% случаев инфицирования урогенитального тракта Serratia species приходится именно на послеоперационных больных). По статистике в 10% случаев заражения внутрибольничными инфекциями именно серрация становится причиной развития воспаления легких, 5% - инфицирования уретры и хирургических ран.
Заражение Serratia species происходит:
- передачей через руки от инфицированного лица здоровому (в т. ч. от медперсонала к пациентам);
- при использовании постоянных катетеров и интубационных трубок (как правило, они применяются для осуществления искусственной вентиляции легких, реанимационных мероприятий);
- при введении в вену лекарственных препаратов и растворов.
Serratia species являются возбудителем:
- заболеваний дыхательных путей (особенно после процедур вентиляции бронхов и легких);
- менингита (воспаления оболочек головного и спинного мозга) и абсцесса мозга (скопления гноя) – у недоношенных детей, взрослых после нейрохирургических операций и эпидуральных инъекций (местного обезболивания путем введения через катетер лекарственных средств в пространство между твердой оболочкой спинного мозга и надкостницей позвонков);
- остеомиелита (поражения костной ткани);
- артрита (воспаления суставов);
- эндокардита (воспаления внутренней оболочки сердца);
- паротита (воспаления околоушной железы);
- бактериального кератита (воспаления роговицы глаза).
У взрослых пациентов серрации обычно поражают мочевыводящие пути и органы дыхательной системы. У детей бактерия является возбудителем желудочно-кишечных инфекций. У наркозависимых лиц результатом инфицирования чаще всего становится развитие септических артритов (при данном заболевании суставы опухают и болят, становятся горячими и малоподвижными), эндокардита, остеомиелита.
Поскольку Serratia species проявляют резистентность (устойчивость) ко многим антибактериальным препаратам, то в случае их выявления и перед определением тактики лечения пациенту рекомендуется пройти обследование на индивидуальную чувствительность к антибиотикам.
Данное обследование проводится методом полимеразной цепной реакции, позволяющим выявить в исследуемом биоматериале (соскобе урогенитальном, соскобе с задней стенки глотки, сперме, моче) специфические фрагменты генетического материала – ДНК Serratia species.
*Факультативные анаэробы – это микроорганизмы, процесс жизнедеятельности которых проходит без доступа кислорода, но его присутствие не является для них смертельным.
Подготовка к исследованию
Соскоб урогенитальный (цервикальный канал, влагалище, уретра)
Цервикальный канал, влагалище
Соскобы у женщин отбираются не ранее пятого дня от начала менструального цикла и не позже пятого дня до предполагаемой даты следующей менструации. Если наблюдаются явные признаки заболевания, отбор пробы проводится непосредственно в день обращения.
Требования по подготовке к тестированию:
- за день до и непосредственно в день отбора материала запрещено спринцевание влагалища;
- накануне исследования запрещено применение вагинальных препаратов – мазей, свечей и т.п.
Проба не отбирается:
- параллельно с приемом внутрь или местным применением антибиотиков – после окончания курса лечения должно пройти не менее двух недель при местной терапии и 30 дней после внутреннего приема антибактериальных препаратов;
- во время менструации;
- ранее, чем через 24-48 часов после полового контакта;
- после внутривлагалищного УЗИ;
- после колькоскопии (диагностического осмотра входа во влагалище, его стенок и шейки матки при помощи специального прибора – кольпоскопа);
- после мануального исследования и прочих манипуляций.
Мочеиспускательный канал (уретра)
У лиц обоего пола проба отбирается не ранее чем через 14 дней после применения антибиотиков местного действия и 30 дней после перорального приема противобактериальных средств.
За неделю до манипуляции рекомендуется прекратить прием всех медицинских препаратов. Если отказ от лечения невозможен, то пациенту необходимо поставить об этом в известность специалиста, направляющего его на обследование.
За 48 часов не вступать в половые контакты и не мастурбировать.
При отборе эпителиальных клеток из мочеиспускательного канала, манипуляция проводится перед мочеиспусканием или через 1,5-2 часа после него (при обильных выделениях из уретры у мужчин – через 1 час).
Соскоб клеток эпителия с задней стенки глотки
Перед отбором биологического материала необходимо учесть следующее:
- соскоб клеток, отбираемый с целью диагностики, проводится перед началом применения противобактериальных, антивирусных и противопаразитарных лекарственных средств, а также до проведения любых лечебных или диагностических мероприятий;
- отбор пробы для наблюдения за эффективностью проводимой терапии осуществляется минимум через полторы-две недели после окончания использования лекарственных средств местного действия и минимум через месяц после общего лечения.
При подготовке к взятию соскоба:
- запрещено применение препаратов для рассасывания и/или аэрозолей для орошения ротоглотки в течение 6 часов, предшествующих отбору пробы;
- запрещено использование для освежения дыхания жевательной резинки или пастилки;
- запрещено чистить зубы.
Перед проведением соскоба необходимо прополоскать рот, используя для этого воду комнатной температуры.
Для получения корректного результата тестирования все эти условия необходимо соблюсти в точности. Лечащий врач может рекомендовать иные условия проведения обследования.
Сперма
Отбор материала с целью диагностики проводится до начала противобактериального, антивирусного и противопаразитарного лечения, химиотерапии, а также до лечебных или диагностических мероприятий в месте предполагаемой локализации агента инфекции. После курса лечения проба отбирается не ранее, чем через 10-14 дней при проведении локальной терапии и через 30 дней после перорального приема антибиотиков.
Сбор спермы (эякулята) проводится посредством мастурбации в стерильный медицинский контейнер, плотно закрывающийся крышкой. Проба не отбирается в ранее использовавшиеся и вымытые или обработанные средствами дезинфекции емкости. Не рекомендуется сдавать анализ при наличии обильных гнойных выделений из мочеиспускательного канала.
После сбора материал может храниться в холодильнике при температуре +2 - +8⁰С, но не более 10-12 часов.
На анализ собирается порция первой утренней мочи, выделенной не ранее, чем через 2-3 часа после предыдущего (ночного) мочеиспускания. Ее объем должен составлять порядка 20-30 мл. Емкость, используемая для сбора биоматериала – стерильный медицинский контейнер.
Моча собирается либо до проведения химиотерапии или лечения антибиотиками, либо через месяц после окончания курса лечения.
Перед началом манипуляции необходимо тщательно обмыть гениталии. Женщинам желательно воспользоваться гигиеническим тампоном во избежание попадания в пробу слизи из влагалища. Во время менструации материал не собирается.
После наполнения контейнера на треть-половину объема, емкость с мочой плотно закрывается крышкой, дабы избежать ее вытекания.
Доставка биоматериала должна быть организована в течение максимум 6 часов. До отправки в лабораторию моча может храниться как в холодильнике (при t⁰ от +2⁰С – замораживать ее нельзя), так и в комнате, но при этом температура не должна быть выше +25⁰С.
Показания к исследованию
Тестирование предназначено для выявления в образцах биоматериала специфических фрагментов ДНК Serratia species и проводится с целью:
- определения причин развития хронического инфекционного процесса урогенитального тракта;
- диагностики заболеваний при отсутствии явных симптомов воспаления мочеполовой системы;
- диагностики бактериемии (заражения кровотока живыми бактериями);
- выявления причин образования гнойничковых поражений кожи;
- дифференцированной диагностики внутрибольничных инфекций;
- обследования лиц с ослабленным иммунитетом, наркоманов;
- оценки эффективности действия проведенного антибактериального лечения.
Интерпретация исследования
Данный тест – качественный, результат выдается в формулировках «обнаружено» или «не обнаружено».
Нормой является отсутствие в исследуемой пробе специфических фрагментов ДНК Serratia spp.
- в исследуемых образцах обнаружены специфические фрагменты ДНК Serratia spp.
- специфические фрагменты ДНК Serratia spp. не обнаружены;
- количество агента инфекции ниже порога обнаружения.
Результат анализа выдается на бланке лаборатории медицинской компании «Наука». Пример результата по данному анализу представлен ниже:
Ф.И.О.: Иванов Иван Иванович Пол: м Год рождения: 01.01.0000
Культуральные свойства серраций. Биохимические свойства серраций. Патогенез поражений серрациями. Токсины серраций.
Серрации являются условно-патогенными микробами, вызывающими у человека гнойно-воспалительные заболевания различной локализации. Частота выделения серраций и их этиологическая роль возрастают при госпитальных инфекциях. Наличие патогенных свойств у бактерий рода Serratia обусловливает их способность вызывать инфекционный процесс. Патогенные свойства придают бактериям способность преодолевать защитные барьеры организма человека, распространяться в его тканях, подавлять неспецифическую и специфическую реактивность организма. Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia. В данной работе было исследовано 58 клинических штаммов бактерий рода Serratia, выделенных из различного патологического материала: испражнений, мочи и гнойного отделяемого. Определяли индекс адгезивности исследованных бактерий, гемагглютинирующую способность, адсорбцию бактериями красителя конго красного. Исследовали антилизоцимную активность и гемолитическую способность. Все изученные штаммы характеризовались высоким персистентным потенциалом. Большинство изученных клинических штаммов бактерий рода Serratia обладали следующими патогенными свойствами: адгезивной, гемагглютинирующей, антилизоцимной и гемолитической активностью. Особенно сильно была выражена адгезивная активность у бактериальных культур серраций, выделенных из испражнений и гнойного отделяемого. Подавляющее большинство исследованных клинических штаммов обладало способностью агглютинировать эритроциты человека и эритроциты барана. Уровень антилизоцимной активности клинических штаммов серраций, выделенных из мочи и гнойного отделяемого, был несколько выше, чем у штаммов, выделенных из испражнений. Наиболее выраженно гемолитическая активность проявилась у штаммов серраций, выделенных из гнойного отделяемого.
1. Mahlen S.D. Serratia infections: from military experiments to current practice. Clin. Microbiol. Rev. 2011. vol. 24. no. 4. P. 755-791.
2. Bertrand X., Dowzicky M.J. Antimicrobial susceptibility among gram-negative isolates collected from intensive care units in North America, Europe, the Asia-Pacific Rim, Latin America, the Middle East, and Africa between 2004 and 2009 as part of the Tigecycline Evaluation and Surveillance Trial. Clin.Ther. 2012. vol. 34. no. 1. P. 124-137.
3. Sader H.S., Farrell D.J., Flamm R.K., Jones R.N. Antimicrobial susceptibility of Gram-negative organisms isolated from patients hospitalized in intensive care units in United States and European hospitals (2009-2011). Diagn.Microbiol Infect Dis. 2014. vol. 78. no. 4. P. 443-448.
4. Sader H.S., Castanheira M., Farrell D.J., Flamm R.K., Jones R.N. Ceftazidime-avibactam activity when tested against ceftazidime-nonsusceptible Citrobacter spp., Enterobacter spp., Serratia marcescens, and Pseudomonas aeruginosa from Unites States medical centers (2011-2014). Diagn Microbiol Infect Dis. 2015.vol.83. no. 4. P. 389-394.
6. Samonis G., Vouloumanou E.K., Christofaki M., Dimopoulou D., Maraki S., Triantafyllou E. Serratia infections in a general hospital: characteristics and outcomes. Eur. J. Clin.Microbiol. Infect Dis. 2011.vol.30. no. 5. P. 653-660.
7. Wu Y.M., Hsu P.C., Yang C.C., Chang H.J., Ye J.J., Huang C.T. Serratia marcescens meningitis: Epidemiology, prognostic factors and treatment outcomes. J. Microbiol. Immunol. Infect. 2013. vol. 46. no. 4. P. 259-265.
8. Габидуллин З.Г., Савченко Т.А., Габидуллин Ю.З., Туйгунов М.М., Булгаков А.К., Давлетшина Г.К., Суфияров Р.С., Усманова И.Н., Хуснаризанова Р.Ф. Условно-патогенные грамотрицательные и грамположительные бактерии: учебное пособие для студентов. Уфа: Издательство ГБОУ ВПО БГМУ Минздрава России. 2014. С.7-11.
9. Брилис В.И., Брилене Т.А., Ленцнер Х.П., Ленцнер А.А. Методика изучения адгезивного процесса микроорганизмов // Лабораторное дело. 1986. №4. С.210-212.
Особую значимость среди бактериальных инфекций имеют нозокомиальные заболевания [1]. С каждым годом число возбудителей внутрибольничных инфекций (ВБИ) увеличивается в основном за счет условно-патогенных микроорганизмов. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), представители грамотрицательной микрофлоры, аскомицеты рода Candida [2, 3]. Главной особенностью возбудителей внутрибольничных инфекций является их выраженная вирулентность и устойчивость к антибактериальным препаратам и дезинфектантам [4, 5]. В последние годы наряду с вышеперечисленными возбудителями ВБИ все чаще выделяются представители рода Serratia [6, 7].
Серрации – условно-патогенные микробы, вызывающие у человека гнойно-воспалительные заболевания различной локализации. Наиболее изученным видом является Serratia marcescens. В настоящее время бактерии рода Serratia marcesens описаны как возбудители диарейных заболеваний у человека, инфекций мочевыводящих путей, менингита, артрита, сепсиса [8]. Постоянный мониторинг изменяющихся биологических свойств выделенных клинических изолятов является одним из важнейших этапов эпидемиологической работы, в связи с чем актуально исследование постоянно меняющихся свойств бактерий этой группы.
Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia.
Материал и методы исследования. В работе использовано 58 клинических штаммов, отнесенных на основании биологических свойств к роду Serratia. Штаммы Serratia были выделены из различного патологического материала: из испражнений (15 штаммов) от пациентов с кишечными инфекциями, мочи (20 штаммов) от больных с уретритами и гнойного (раневого) отделяемого (23 штамма) от пациентов с абсцессами и флегмонами мягких тканей.
Способность к адгезии у бактерий изучали с помощью формалинизированных эритроцитов человека. Определяли основные показатели адгезии. Вычислили индекс адгезивности микроорганизмов. По данному показателю все бактерии разделили на 4 группы: 1 – неадгезивные (индекс адгезивности <1,75), низкоадгезивные (индекс адгезивности 1,76–2,5), среднеадгезивные (индекс адгезивности 2,51–4,0) и высокоадгезивные (индекс адгезивности >4,0).
Адсорбцию бактериями красителя конго красного выявляли на 1,5%-ном мясопептонном агаре с добавлением 0,02% казаминовых кислот и 0,01% конго красного.
Способность к гемагглютинации у бактерий определяли в реакции гемагглютинации с 3%-ной взвесью свежих эритроцитов человека и барана, которую проводили на панелях из органического стекла.
Для выявления D-маннозорезистентной гемагглютинации во взвесь эритроцитов добавляли 1,5% D-маннозы [9].
Антилизоцимную активность изучали по методике О.В. Бухарина. Исследования антилизоцимной активности проводили в диапазоне концентраций от 1 до 6 мкг/мл. В качестве тест-культуры использовался штамм Micrococcus luteus var. Lysodeikticus № 2665. Гемолитическую способность бактерий определяли на мясопептонном агаре с 3–5% отмытых в растворе Хенкса эритроцитов кролика. Для выявления тиолзависимых гемолизинов использовался мясопептонный агар с 0,002% L-цистеина.
Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
Исследование адгезивных свойств бактерий рода Serratia выявило, что адгезивные штаммы с индексом адгезивности выше 2,5 составили 70,6% (41 штамм) из общего количества изученных штаммов, из которых 13 штаммов серраций (86,7%) были выделены из испражнений, 18 штаммов серраций (78,3%) были выделены из гнойного отделяемого, 10 штаммов серраций (50%) были выделены из мочи.
Все адгезивные штаммы разделили на две группы: высокоадгезивные и со средней степенью адгезивности. К штаммам, обладающим высоким индексом адгезивности (более 4), отнесли 3 штамма серраций (20%), выделенных из испражнений, 5 штаммов серраций (21,7%), выделенных из гнойного отделяемого, все адгезивные штаммы (10 бактериальных культур), выделенные из мочи.
Сренеадгезивными оказались 23 штамма (39,7%). Индекс адгезивности у них составил от 2,5 до 4. Среди выделенных из испражнений штаммов со средним показателем ИАМ было 10 штаммов (66,7%), а выделенные из гнойного отделяемого составили 13 штаммов (56,5%). Все остальные штаммы были отнесены к низкоадгезивным с индексом адгезивности микроорганизмов от 1,76 до 2,5. 40 штаммов (68,9%) из всех изученных клинических культур серраций обладали способностью адсорбировать конго красный. Из выделенных из испражнений такой способностью обладало 14 штаммов (93,3%), 10 культур серраций, выделенных из мочи (50%), а среди выделенных из гнойного отделяемого это свойство было выявлено у 16 штаммов (69,6%) (табл. 1).
СЕРРАЦИИ
СЕРРАЦИИ — бактерии рода Serratia Bizio 1823, трибы Klebsiel-leae, сем. Enterobacteriaceae. Названы по имени итальянского врача 18 в. Серрати (S. Serrati).
Серрации— условно-патогенные микробы (см.), вызывающие у человека гнойно-восиалптельные заболевания различной локализации. Они представляют собой подвижные (перитрихи) грамотрицательные палочки, неспороносные, часто образующие капсулу, оксидазоотрицательные, обладающие каталазой, дезоксирибонуклеазой, орнитиндекарбоксилазой, бета-галактозидазой, но не разлагающие аргинин, фенилаланин и сорбит. Наиболее изученным видом является Serratia marcescens, именовавшийся ранее Bacterium prodigiosum.
Первоначально бактерии вида S. marcescens рассматривали как непатогенные микробы. В 60 гг. 20 в. S. marcescens признана условно-патогенным микробом, способным вызывать гнойную инфекцию ран, бронхов, мочевого тракта, среднего уха, глаза, кожи, а также быть причиной генерализованной инфекции, проявляющейся в виде эндокардита, артрита, остеомиелита, менингита у лиц с пониженной резистентностью. Общепризнано значение S. marcescens как одного из возбудителей внутрибольничной инфекции (см.), особенно в палатах интенсивной терапии и неонатальных отделениях.
Бактерии вида S. marcescens используют как источник получения продигиозана (см.). Пигментные штаммы рекомендованы в качестве тест-объектов при испытании очистительных систем, предназначенных для обеззараживания бактериального аэрозоля.
Отличительными признаками S. marcescens являются ферментация глюкозы с образованием газа, мальтозы, маннита, сахарозы, желатины, утилизация цитрата; декарбокси-лирование лизина, их неспособность к образованию сероводорода, индола, разложению рамнозы, арабинозы, дульцита и адонита. Известны 21 соматический О-антиген и 25 жгутиковых Н-антигенов, сочетания к-рых образуют 173 серотипа (серовара). S. marcescens неприхотлива к условиям культивирования, способна размножаться в окружающей среде при комнатной температуре; представляет собой факультативный анаэроб (см. Анаэробы). На плотных средах образует колонии диаметром 1— 2 мм, круглые, выпуклые, беловатые или окрашенные в красный цвет. Благодаря пигментообразованию S. marcescens называли «чудесной палочкой». Ее колонии, выраставшие в виде кроваво-красных пятнышек на отсыревших церковных тканях и хлебах, в средневековой Италии расценивали как «капли крови господа». Местом обитания S. marcescens являются увлажненные места жилых помещений, разнообразные жидкости в сосудах, мелкие водоемы, влажные ткани. Иногда бактерии обнаруживают в кале здоровых детей. Возбудителей выделяют из увлажнительных камер реанимационной аппаратуры , р-ров для парентерального введения, с поверхности катетеров, детских сосок, бронхоскопов, кисточек для бритья, влажных участков полов и раковин, и даже из слабых р-ров дезинфектантов. Передача возбудителя с предмета на предмет и с предметов к больному происходит через руки. S. marcescens резистентна к большинству антибиотиков — пенициллину, ампициллину, карбенициллину, тетрациклину, колимицину, цефалотину, а также ко многим дезинфектантам. К левомицетину, аминогликозидам, нали-диксовой к-те и триметоприму чувствительность разных штаммов различна. При бактериол. исследовании материал (гной, кал, смывы с рук и аппаратуры) засевают на обычные для энтеробактерий плотные среды в чашках Петри, кровь и цереброспинальную жидкость — во флаконы с мясопептонным бульоном. Выделенные культуры идентифицируют по морфологическим и культурально-биохимическим свойствам.
Для лечения заболеваний, вызванных S. marcescens, рекомендуют (на основании антибиотикограммы возбудителя) ампкацин, сочетание рифампицина. с полимиксином, препараты аминогликозидов. Для обеззараживания инструментов и аппаратуры применяют кипячение и ав-токлавирование; инструменты и детали, не выдерживающие термической обработки, погружают в смесь 0,5% р-ра хлорамина или 3% р-ра перекиси водорода с 0,5% р-ром моющего средства. Для предотвращения передачи S. marcescens через руки используют стерильные перчатки или обрабатывают кожу рук 0,5% р-ром хлоргексидина (гибитона).
Библиография: Краткий определитель бактерий Берге, под ред. Дж. Хоулта, пер. с англ., с. 187, М., 1980; Рагинская В. П. и Батуро А. П. Новые группы семейства Enterobacteriaceae, Журн. микр., эпид. и иммун., № з, с. 10, 1975; Yu V. L. Serratia marcescens, historical perspective and clinical review, New Engl. J. Med., v. 300, p. 887, 1979, bibliogr.
Медицинская микробиология:
Род условно-патогенных энтеробактер (Enterobacter): морфология, культуральные, биохимические свойства
а) Таксономия. Грамотрицательные палочки, соответствующие основной характеристике семейства Enterobacteriaceae, подвижные, образующие ацетилметилкарбинол и дающие отрицательную реакцию с метиловым красным, объединены в самостоятельный род семейства Enterobacteriaceae. Ранее их описывали под разными названиями: Paracolon aerobacter, Aerobacter aerogenes, Cloaca cloacae и др. Название Enterobacter предложено E. Hormaeche и P. R. Edwards в 1960 г. В настоящее время род Enterobacter включает 14 видов, 10 из которых могут вызывать различные поражения у человека. Для обозначения последних используется прилагательное human. Четыре вида относят к окружающей среде (environmental species, англ.). Enterobacter agglomerans в 1989 г. были отнесены к новому роду Pantoea.
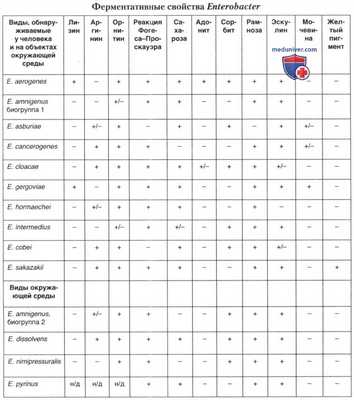
Потенциально патогенные виды — Е. aerogenes, Е. amnigenus (биогруппа 1), Е. asburiae, Е. cancerogenes, Е. cloacae, Е. gergoviae, Е. hormaechei, Е. intermedius, Е. cobei, и Е. sakazakii. В окружающей среде обнаруживаются следующие 4 вида: Е. amnigenus (биогруппа 2), Е. dissolvens, Е. nimipressuralis и Е. pyrinus. Бактерии рода Enterobacter хорошо растут на обычных питательных средах, используемых для выращивания энтеробактерий. Морфология клеток типичная для энтеробактерий.
Ферментативные свойства значительно разнятся у разных видов и биогрупп. Энтеробактеры не образуют индола и сероводорода, не обладают дезаминазами аминокислот, утилизируют цитрат, слабо гидролизуют мочевину, ферментируют сорбит, рамнозу, ксилозу, мальтозу, раффинозу, вариабельно относятся к инозиту, адониту, дульциту, салицину. Характеристика ферментативных свойств видов рода Enterobacter представлена в таблице ниже.
Бактерии рода Enterobacter — признанные нозокомиальные патогены. Могут вызывать инфекцию мочевого тракта, бактериемию, госпитальную пневмонию, нередко с летальным исходом. Внутрибольничная колонизация часто связана с контаминацией медицинских аппаратов и инструментов. Описаны случаи менингита, обусловленного Е. sakazakii.
б) Факторы патогенности. Как все энтеробактерии, бактерии рода Enterobacter обладают эндотоксином. Некоторые штаммы, особенно Е. cloacae, облают факторами патогенности, то есть способны синтезировать полисахаридную капсулу, фимбриальные адгезины (пили), различного типа энтеротоксины, протеолитические ферменты, ДНК-азы, РНК-азы и др.
в) Лабораторная диагностика. Материалом для исследования может быть моча, фекалии, ликвор, кровь, мокрота, рвотные массы, вода, пищевые продукты и др. Исследуемый материал, за исключением жидкостей организма, в норме стерильных, засевается количественным методом. Плотные пробы гомогенизируют с использованием стерильного буферного раствора, стерильных стеклянных бус или других известных приемов, а затем готовят десятикратные разведения. Для посева берут разведения 10 3 и 10 5 , а при массивной контаминации — также 10 7 . Выделение предполагаемого возбудителя при подозрении на Enterobacter проводят следующим образом.
Второй день. Просматривают чашки, засеянные накануне. Подсчитывают число выросших колоний каждого вида. Подозрительные колонии отбирают для дальнейшего исследования. На указанных средах энтеробактеры образуют довольно крупные колонии, напоминающие колонии эшерихий или клебсиелл, с металлическим блеском или без него, розовые или малиновые. Отобранные колонии (2-3 колонии) засевают на короткий «пестрый» ряд, состоящий из пробирки с полужидким агаром, среды Клиглера, среды с мочевиной по Преусу, цитратного агара Симмонса и среды Кларка.
Третий день. Учитывают результаты посева на «пестрый» ряд. Подвижные культуры, ферментирующие или не ферментирующие лактозу, не образующие индола и сероводорода, не гидролизующие, как правило, мочевину, утилизирующие цитрат, образующие ацетилметилкарбинол и дающие отрицательную реакцию с метиловым красным, могут быть отнесены к роду Enterobacter. Для установления видовой принадлежности необходимо проведение дополнительных тестов в соответствии с характеристикой вида. Если в исследуемом материале обнаружено 10 5 и более КОЕ/мл, (или КОЕ/г,) выделенный микроорганизм может быть заподозрен в качестве этиологического агента.
г) Чувствительность к антибиотикам. Энтеробактеры обладают природной устойчивостью к цефалотину. Клинические штаммы характеризуются высокой устойчивостью ко многим антибиотикам, обычно применяемым в медицинской практике. Как и клебсиеллы, чувствительны к амикацину, аминогликозидам, менее чувствительны к цефалоспоринам. Приобретенная резистентность определяется диско-диффузионным методом с использованием сред АГВ или агара Мюллера-Хинтона и отечественных или импортных дисков с антибиотиками. При необходимости можно использовать метод серийных разведений. Спектр резистентности зависит от тактики назначения антибактериальных препаратов.
Род условно-патогенных серраций (Serratia): морфология, культуральные, биохимические свойства
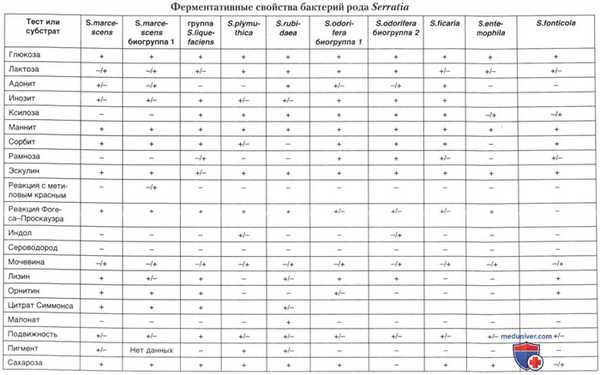
а) Таксономия. К роду Serratia относят грамотрицательные бактерии, которые но своей характеристике соответствуют определению семейства Enterobacteriaceae. Название рода связывают с именем итальянского исследователя Serafino Serrati. В настоящее время в род Serratia включено 8 видов: Serratia marcescens, S. liquefaciens, S. rubidaea, S.plymuthica, S. entemophila, S.ficaria, S.fonticola и S. odorifera.S. marcescens и S. odorifera содержат биогруппы, a S. liquefaciens представляет собой группу, состоящую из 3 различных видов: S. liquefaciens sensu stricto, S. proteamaculans и S. grimesii. Но поскольку в большинстве клинических лабораторий невозможна дифференциация этих видов, S. liquefaciens рассматривают как группу.
б) Морфология. Бактерии рода Serratia обычно подвижны, факультативные анаэробы, почти все штаммы могут расти при температуре от 10 до 36°С. Обладают выраженной каталазой. На плотной питательной среде формируют биопленку.
Некоторые штаммы продуцируют два различных пигмента: продигиозин и пиримин. Продигиозин не диффундирует в среду, в воде нерастворим, продуцируется S. marcescens и большинством штаммов S. plymuthica и S. rubidaea. Пигментированные колонии имеют красный цвет различной интенсивности. Цвет зависит от условий культивирования. Пигмент лучше выявляется при культивировании бактерий на глицерин-пептонном агаре при 20-35°С. S. marcescens способны синтезировать розовый водорастворимый пигмент — пирамин. Такие штаммы, как правило, продиогиозаноотрицательны. S. odorifera, S.ficatia и S. rubidaea вырабатывают алкилметоксипирозин, обладающий запахом картофеля. Характеристика ферментативных свойств отдельных видов Serratia представлена в таблице ниже.

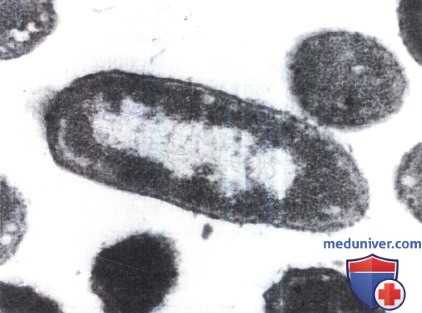
Биопленка Serratia marcescens. Ув. х 3000. СЭМ
в) Роль в патологии. Serratia встречаются в кишечнике здоровых людей, животных, в почве, воде, на растениях, но известно, что S. marcescens могут вызывать бактериемию, сепсис, менингиты. Часто встречаются при внутригоспитальных инфекциях. В частности, 4 % госпитальных пневмоний обусловлено S. marcescens. Внутрибольничные инфекции мочевого тракта также могут быть вызваны серрациями. Представители рода Serratia способны размножаться при окружающей температуре в жидкостях, содержащих минимальное количество питательных веществ. Кроме S. marcescens, в клиническом материале могут находиться S. liquefaciens и S. odorifera.
г) Факторы патогенности. Как и все энтеробактерии, бактерии рода Serratia имеют эндотоксин, обладающий иммуномодулирующей активностью. Известна способность некоторых штаммов серраций синтезировать циотоксический гемолизин ShlA (Serratia hemolysin, англ.), контролируемый хромосомными генами, синтез которого зависит от наличия в среде ионов трехвалентного железа. Для захвата гемолизина необходим белок HasA (Hemoglobin acquisition of Serratia, англ.). Известны также термолабильный цитотоксин, являющийся цинк-зависимой металлопротеазой. К факторам патогенности относятся также продигиозан, оказывающий иммуносупрессивное действие с проапоптотической активностью. Некоторые штаммы способны синтезировать полисахаридную капсулу, фимбриальные адгезины, термостабильный энтеротоксин, протеолитические ферменты и др..
д) Лабораторная диагностика. Схема бактериологического исследования стандартна. Материалом для выделения Senatia как предполагаемого возбудителя, может быть ликвор, кровь, моча, фекалии, рвотные массы, вода, пищевые продукты и др. Исследуемый материал (кроме крови и ликвора) засевают методом разведений. Пробы с плотным материалом вначале измельчают, гомогенизируют, а затем готовят 10-кратные разведения в фосфатном буферном растворе. На среды Эндо, Плоскирева высевают из разведения 10 3 , 10 5 по 0,1 мл.
Четвертый день. Учитывают результаты дополнительных тестов, определяют способность образовывать ацетилметилкарбинол (реакция Фогеса-Проскауэ-ра) и реакцию с метиловым красным на среде Кларка. Идентификация значительно облегчается при выделении штаммов, образующих пигмент. Для идентификации S. marcescens полезным является тест на наличие ДНК-азы, отличающий их от гафний.
При обнаружении в клиническом материале микробных клеток изолята в концентрации 10 5 и выше КОЕ/мл выделенные бактерии могут быть заподозрены в качестве этиологического агента.
е) Лекарственная устойчивость. Серрации обладают природной устойчивостью к полимиксину, цефалотину, ампициллину, карбенициллину, стрептомицину. Спектр приобретенной резистентности формируется в зависимости от тактики антибактериальной терапии. Резистентность к антибактериальным препаратам определяют диско-диффузионным методом на агаре Мюллера-Хинтона или среде АГВ. При необходимости определения минимальной ингибирующей концентрации используют метод серийных разведений на жидких средах.
Читайте также:
