Воспаление в соединительной ткани. Процессы воспаления в соединительной ткани.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Артрит: причины появления, симптомы, диагностика и способы лечения.
Определение
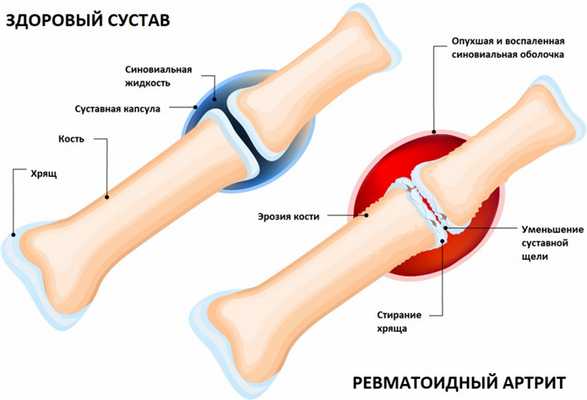
Артриты – это собирательный термин для обозначения группы различных воспалительных заболеваний суставов, поражающих их синовиальную оболочку, капсулу (суставную сумку) и суставной хрящ. Капсула окружает суставную полость и обеспечивает ее герметичность. Синовиальная оболочка представляет собой внутренний слой суставной капсулы и покрывает все внутрисуставные структуры, кроме суставных поверхностей костей (они покрыты хрящом). В синовиальной оболочке располагается большое количество нервных волокон и сосудов, которые отвечают за питание суставного хряща. Суставной хрящ обеспечивает скольжение суставных поверхностей при движении, ослабляет нагрузку при воздействии механических факторов (амортизирующая функция).
Заболеваемость артритом составляет 9,5 случаев на 1000 человек; распространенность высока среди лиц разного возраста, включая детей и подростков, но чаще артрит развивается у женщин после 40 лет.
Причины появления артрита
Описано более 100 различных форм заболеваний суставов или патологических процессов, при которых артрит является частым, а порой ведущим проявлением.
Причиной развития воспалительного процесса в суставе часто становится аутоиммунный процесс в организме, то есть нарушение функционирования иммунной системы, которая начинает воспринимать собственные ткани как чужеродные и повреждать их. Этиология некоторых тяжелых воспалительных суставных заболеваний (например, ревматоидного артрита, анкилозирующего спондилоартрита) до сих пор изучена недостаточно.
Среди факторов, способствующих развитию или обострению артрита, называют переохлаждение и физическую перегрузку сустава.
Другая нередкая причина заболевания - инфекция. Возможные возбудители – бактерии (гонококки, стафилококки, стрептококки, микобактерии туберкулеза, бледная трепонема), вирусы (вирус Эпштейна-Барра, аденовирусы, вирус краснухи, гепатита В и С) и грибы (аспергилла, кандида и др.). Они могут проникать в сустав напрямую (через рану, порез, прокол) или из удаленных очагов с током крови. Попав в сустав, возбудители начинают активно размножаться, выделяя токсичные продукты жизнедеятельности и провоцируя развитие воспаления.
Классификация заболевания
Поражения суставов можно разделить на две большие группы: воспалительные и дегенеративные. Воспалительные – это именно артриты (в медицинской терминологии суффикс «-ит» обозначает воспаление). Дегенеративные или дистрофические изменения суставов невоспалительного характера называются артрозами («-оз» от греч. –ōsis - интенсивное патологическое состояние).
Нередко артрит и артроз становятся стадиями одного процесса: воспаление может приводить к повреждению хряща, а изнашивание хряща может вызывать воспаление.
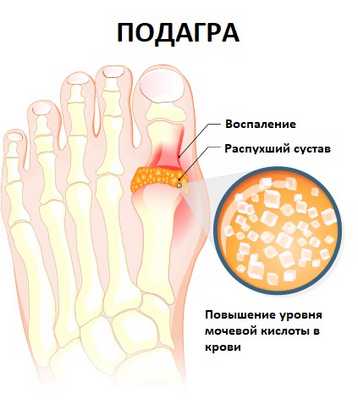
В зависимости от причины заболевания различают: инфекционные и неинфекционные артриты. Как говорилось выше, причиной инфекционных артритов могут быть различные возбудители – бактерии, вирусы и грибы. Неинфекционные артриты развиваются на фоне аутоиммунных процессов (например, при ревматоидном артрите), метаболических нарушений (например, при подагре), возникают при заболеваниях крови, печени, кожи.
По характеру течения различают острый, подострый и хронический артриты.
По распространенности поражения различают:
- моноартрит (воспаление одного сустава);
- олигоартрит (воспаление 2-3 суставов);
- полиартрит (воспаление 4 и более суставов).
Олигоартрит встречается при ревматоидном артрите в дебюте заболевания, при серонегативных спондилоартритах, в частности болезни Бехтерева, при инфекционных заболеваниях – гонорее, бруцеллезе.
Полиартрит имеет вирусную природу, фиксируется при ревматоидном артрите и др.
Симптомы артрита
Для артрита характерны жалобы пациентов на боли в суставах, изменение их формы, нарушение функции, изменение температуры и окраски надсуставных кожных покровов.
Боль при артритах чаще беспокоит в покое, но может усиливаться или, наоборот, уменьшаться во время движения. Наиболее интенсивную боль пациенты отмечают во второй половине ночи и утром (так называемый воспалительный тип боли). Если она возникает при нагрузке на сустав и/или усиливается к вечеру, то, скорее всего, речь идет об артрозе сустава, а боль носит механический характер.
При остром артрите боль обычно очень сильная и постоянная, что значительное ограничивает функционирование сустава.
Изменение формы сустава расценивается как дефигурация и деформация. Дефигурация сустава – временное изменение формы сустава, связанное обычно с отечностью, припухлостью или атрофией мягких тканей.
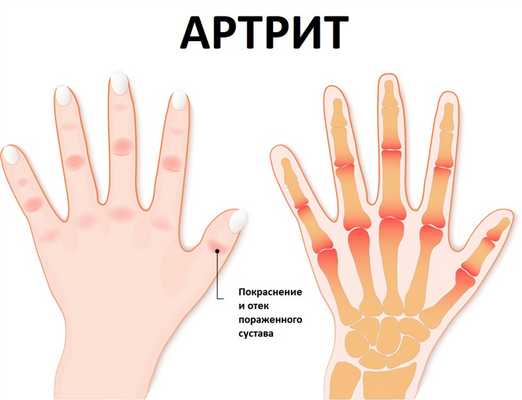
Деформация – патологическое изменение формы сустава, обусловленное изменениями костных структур, стойкими контрактурами (невозможностью полного сгибания или разгибания сустава), вывихами.
Степень нарушения функции сустава может быть как легкой, не лишающей больных трудоспособности, так и полной, когда сустав теряет подвижность. При острых артритах ограничение подвижности обычно носит обратимый характер. Для хронических форм характерно прогрессирующее ограничение подвижности, вначале обусловленное болью, затем - развитием фиброзного процесса (разрастанием соединительной ткани).
Локальное повышение температуры кожных покровов — довольно частый симптом заболевания при острых, подострых артритах и обострении хронических. Возможна сопутствующая гиперемия (покраснение) и отек кожи.
Течение артритов отличается большой вариабельностью. Наблюдаются острые, непродолжительные и полностью обратимые формы (при вирусных инфекциях), а также длительные, прогрессирующие хронические артриты, исходом которых может быть костный или фиброзный анкилоз – полная неподвижность сустава (при ревматоидном, септическом артритах и др.). Хронические формы нередко приводят к инвалидизации больных.
Диагностика артрита
Предварительный диагноз устанавливается на основании жалоб и результатов осмотра пациента. Во время пальпации пациент может отмечать разлитую резкую болезненность, врач может заметить флюктуацию (колебание) вследствие наличия жидкости в суставной полости, отечность периартикулярных (околосуставных) тканей. Подвижность в суставе может быть ограничена.
При длительно существующем артрите обнаруживают более грубое изменение формы сустава, контрактуры, подвывихи, анкилозы. Пальпация показывает наличие плотной болезненной припухлости мягких тканей.
Для диагностики имеет значение локализация, количество, симметричность или асимметричность пораженных суставов, ритм болей, обстоятельства возникновения, длительность болей и факторы, усиливающие и ослабляющие боль.
Инструментальные методы обследования.
Основным методом считается рентгенография суставов в двух проекциях. Для уточнения диагноза может быть назначена пункция сустава с извлечением и анализом синовиальной жидкости. С целью осмотра сустава изнутри, выполнения биопсии синовиальной оболочки проводится артроскопия.
Лабораторная диагностика. Степень выраженности воспалительного процесса устанавливают с помощью клинического анализа крови и определения С-реактивного белка.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Воспаление в соединительной ткани. Процессы воспаления в соединительной ткани.
Воспалительные изменения в легких при диффузных болезнях соединительной ткани.
Развивающиеся при диффузных болезнях соединительной ткани воспалительные процессы в легких, приводящие к дезорганизации соединительной ткани, в основе своей имеют аутоиммунную природу. Выраженность воспалительных изменений зависит как от степени активности, так и от продолжительности самого заболевания.
В рабочей классификации и номенклатуре ревматических болезней, соответствующей многим зарубежным классификациям, в рубрику "Диффузные болезни соединительной ткани" (ДБСТ) включены: системная красная волчанка (СКВ), системная склеродермия (ССД), диффузный фасциит, дерматомиозит (ДМ) или полимиозит, синдром Шегрена (первичный и вторичный), перекрестные (overlap's) синдромы и смешанное заболевание соединительной ткани, рецидивирующий полихондрит.
По данным различных авторов изменения в легких отмечаются у 40-90% больных СКВ, при ССД в 30-90%, реже - при дерматомиозите -в 5-23% и синдроме Шегрена -в 9-29%. Вместе с тем, воспалительные процессы в легких аутоиммунного характера наблюдаются при других ревматических заболеваниях, выделенных в самостоятельные рубрики: ревматоидный артрит (1,6-45%), системные васкулиты, включая узелковый периартериит (до 97%) и др. Поэтому их также продолжают рассматривать как диффузные болезни соединительной ткани - системные ревматические заболевания.
Нерешенным остается вопрос о фиброзирующих альвеолитах и, прежде всего, идиопатическом фиброзирующем альвеолите, особенно в тех случаях, когда у больных выявляется ревматоидный фактор - РФ. Существует мнение, что эта патология представляет собой коллагеновое заболевание (по старой номенклатуре) с преимущественным поражением легких. Доказано развитие воспалительного процесса при ИФА под влиянием иммунных комплексов.
Патогенез воспалительных изменений в легких соответствует общим механизмам развития ДБСТ. Диффузные болезни соединительной ткани объединяет аутоиммунная природа заболевания с развитием иммунокомплексного воспаления, относящегося к III типу аллергических реакций по классификации Coombs R.R., Gell P.G.. Воспалительные процессы в легких, как и другие висцеропатии, связываются при данных заболеваниях с возникновением иммунокомплексных васкулитов. Выделяют три формы иммунокомплексных васкулитов легких: 1) васкулиты с некробиотическими узлами или гранулемами - гранулематоз Вегенера, ревматоидные гранулемы, синдром Каплана; 2) васкулиты с эозинофильными инфильтратами - узелковый периартериит и др.; 3) васкулиты с неэозинофильной экссудацией - СКВ.
Считается, что аутоиммунное воспаление и дезорганизация соединительной ткани легких (как и других органов) обусловлены первичным поражением путей микроциркуляции иммунными комплексами, которые откладываются в капиллярах альвеолярных перегородок, артериолах и венулах. Причем, процесс этот активный, связан с повышенной проницаемостью сосудов, обусловленный влиянием на сосудистую стенку биогенных аминов. При образовании циркулирующих иммунных комплексов (ЦИК) и активации комплемента они высвобождаются из тучных клеток, базофилов, тромбоцитов. Откладывающиеся иммунные комплексы, разрушая тканевые структуры, в конечном итоге вызывают воспаление, которое захватывает все три оболочки сосуда - возникает панартериит, артериолит.
Воспалительный процесс со стенки сосудов переходит в периваскулярную, соединительную ткань, способствуя ее дезорганизации. Высказано мнение, что воспаление в соединительной ткани с лимфогистиоцитарными инфильтратами представляет собой проявление аллергического ангиита терминальных сосудов с деструктивно-пролиферативными изменениями и имеющего хроническое рецидивирующее течение. Развитие этого процесса представляется на примере воспаления капилляров и венул в серозных оболочках, которое приводит к редукции сосудистого русла, спадению сосудов или инфильтрации их просвета и межуточной ткани лимфоцитами, моноцитами с последующей пролиферацией. В результате внутри и вокруг сосудов возникают скопления мононуклеаров с последующим разрушением стенок сосудов. Вследствие этого, клеточные инфильтраты могут восприниматься как находящиеся вне сосудов. На модели париетальной плевры, импрегнированной серебром, изучена при системных аллергических васкулитах топография вовлечения в патологический процесс путей микроциркуляции в серозных оболочках. Показана очаговость поражения сосудистого русла, однотипность, но различная степень изменения его участков. Наибольшие повреждения отмечены в посткапиллярах и венулах париетальной плевры: в дренажно-депонирующих звеньях, где осуществляется реабсорбция и транспорт соединений. На втором месте по выраженности изменений находятся капилляры - в них происходят обменные процессы. Наименее поврежденными в париетальной плевре оказались артериолы и прекапилляры, в которых происходит приток и распределение крови. Полученные данные подтверждают, что развитие септоальвеолярного склероза, как результата воспалительного процесса в легких, а также плеврита с последующими склеротическими изменениями при ДБСТ вызваны иммуно-комплексными васкулитами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Воспаление с поражением соединительной ткани в легких.
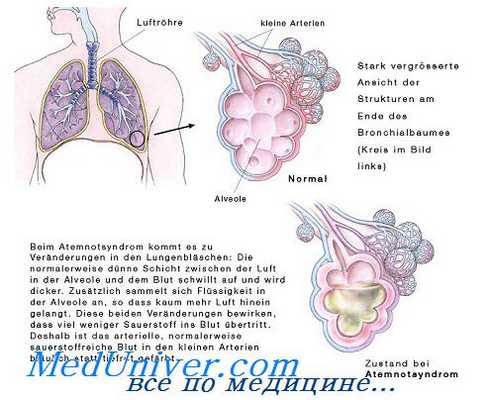
Воспаление, с преимущественным поражением соединительной ткани легких, имеет место при интерстициальных заболеваниях легких. Этиология некоторых из них до настоящего времени остается неясной.
S.C. Bell с соавт. (1994), исследуя катехоламины и их промежуточный метаболизм при кистозном фиброзе у взрослых во время обострения, нашли, что содержание норадреналина в крови у больных во время обострения было значительно выше, чем у здоровых и у больных со стабильным течением кистозного фиброза. Изменения в уровне норадреналина коррелировали с концентрацией неэтерифицированных жирных кислот (НЭЖК). Авторы заключают, что активность симпатической нервной системы повышается во время обострения кистозного фиброза и падает до нормы в ответ на терапию антибиотиками. Падение уровня НЭЖК параллельно с уровнем норадреналина является косвенным доказательством уменьшения липолиза в результате проводимого лечения.
Прослежена связь биохимического состава КВВВ с клиническими особенностями течения фиброзирующих альвеолитов и гранулематозов легких. У всех больных отмечено повышение содержания серотонина по сравнению с практически здоровыми лицами. Достоверное повышение уровня норадреналина имело место у больных фиброзирующими альвеолитами и саркоидозом. У всех больных была увеличена концентрация белка, однако только при саркоидозе это повышение сочеталось с возрастанием уровня молекул средней массы. Высокие уровни молочной кислоты, диеновых коньюгатов, наряду со сниженной антиокислительной активностью, были характерны для всех групп больных. Влаговыделительная функция легких была снижена. Четкой зависимости биохимических показателей КВВВ от активности воспалительного процесса у больных выявить не удалось.
Одновременно имела место активация калликреин-кининовой системы, выражающаяся в протеолизе, особенно при фиброзирующем альвеолите по сравнению с саркоидозом и гистиоцитозом X, кининогенезе со снижением активности ингибиторов калликреина, особенно медленнодействующего, и повышением активности ангиотензинконвертирующего фермента, особенно при саркоидозе. Изменения активности фермента зависели от стадии заболевания.

При хроническом воспалительном процессе, с одной стороны, повышается проницаемость эндотелия легочных капилляров, обусловленная действием вазоактивных биогенных аминов, метаболизм которых нарушается в условиях легочной патологии. С другой стороны, накапливаются продукты распада соединительной ткани, оказывающие неблагоприятное влияние на структуры клеточных мембран, интенсифицируя перекисное окисление липидов (ПОЛ), изменяя коллоидно-осмотическое взаимодействие и занимая ключевую позицию в отношении влаговыделительной способности легких и тем самым пролонгируя время состояния повышенной проницаемости сосудов и даже усиливая это состояние.
Учитывая регулирующее влияние БАВ на обмен липидов, углеводов, белков, входящих в состав легочного сурфактанта, следует отметить их тесную связь.
Прежде чем рассматривать характер изменений в системе легочного сурфактанта (ЛС), следует отметить, какие факторы могут влиять на его убыль. Это может зависеть от нарушения процесса биосинтеза поверхностно-активных веществ, определяющих основное значение ЛС. Изредка это может происходить у плода в последние 2 месяца беременности, следствием чего может развиться респираторный дистресс-синдром при рождении ребенка. Отрицательное влияние на ЛС оказывают высокие концентрации свободных жирных кислот, лизофосфатидилхолина, некоторых белков и гликопротеинов. Несомненно и то, что массивная микробная инвазия, эндотоксемия, токсическое воздействие окислителей, лучевое и термическое поражения создают серьезные предпосылки для развития дистресс-синдрома взрослых.
Форсированное дыхание при наличии воспаления приводит к интенсивному выведению ЛС, что регистрируется повышением содержания фосфатидилхолина в ЖБАЛ и КВВВ. Неблагоприятное влияние на сурфактантную систему могут оказывать повышенные концентрации кислорода, используемые при длительной ИВЛ. Гипоксия, гиповентиляция и легочная гипертензия ведут к снижению выработки ЛС. Отрицательным влиянием обладает табачный дым, липиды сурфактанта подвергаются распаду при непосредственном воздействии компонентов смога, окислов азота и других соединений, являющихся инициаторами свободнорадикальных реакций.
Переходя непосредственно к фактам, полученным при изучении ЛС в условиях воспаления, следует упомянуть о работе сотрудников лаборатории биохимии ГНЦП МЗ РФ. На модели создания воспалительного бронхолегочного процесса у кроликов было выявлено, что интенсивность снижения поверхностно-активных свойств идет параллельно увеличению объема поражения легких воспалительным процессом.
Аутоиммунные заболевания соединительной ткани
Аутоиммунные заболевания — это класс заболеваний, разнородных по клиническим проявлениям, развивающихся вследствие патологической выработки аутоагрессивных антител или размножения аутоагрессивных клонов киллерных клеток против здоровых, нормальных тканей организма, приводящих к повреждению и разрушению нормальных тканей и развитию аутоиммунного воспаления.
Причины развития аутоиммунных заболеваний
Причинами развития аутоиммунных заболеваний становятся:
- Инфицирование микроорганизмом, антигенные детерминанты (эпитопы) важнейших белков которого напоминают антигенные детерминанты нормальных тканей организма хозяина. По такому механизму развивается аутоиммунный гломерулонефрит после стрептококковой инфекции или аутоиммунные реактивные артриты после гонореи.
- Деструкция или некроз тканей или изменение их антигенной структуры, так что измененная ткань становится иммуногенной для организма хозяина. По такому механизму развивается аутоиммунный хронический активный гепатит после перенесенного гепатита В.
- Нарушение целостности тканевых (гистогематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и соответственно от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус не производит уничтожения аутоагрессивных лимфоцитов против этих тканей. По такому механизму развивается аутоиммунный тиреоидит.
- Гипериммунное состояние (патологически усиленный иммунитет) или иммунологический дисбаланс с нарушением «селекторной», подавляющей аутоиммунитет, функции тимуса или снижением активности Т-супрессорной субпопуляции клеток.
Механизм развития многих аутоиммунных заболеваний (системной склеродермии, узелкового периартериита, приобретенной гемолитической анемии и др.) не выяснен. Большинство их развивается по типу аллергических реакций замедленного типа с участием иммунных лимфоцитов. При аутоиммунных поражениях крови первостепенное значение имеют циркулирующие в крови антитела.
В качестве аутоантигенов могут вступать белки, нуклеиновые кислоты, фосфолипиды, сахара, сами иммуноглобулины (ревматоидный фактор — это аутоантитела к IgG). Находящиеся в крови в норме в небольшом количестве естественные аутоантитела, обычно IgM-класса, не вызывают патологических процессов, а стимулируют регенерацию тканей.
Аутоиммунные заболевания можно разделить на:
- Органоспецифические (с поражением щитовидной железы, надпочечников, желудка, поджелудочной железы — тиреоидит Хасимото (Хашимото), первичная микседема, тиреотоксикоз, пернициозная анемия, болезнь Аддисона, сахарный диабет I типа и др.).
- Органонеспецифические (с поражением кожи, почек, суставов, мышц — дерматомиозит, системная красная волчанка, склеродермия, ревматоидный артрит и др.).
Обнаружение в сыворотке крови различных аутоантител имеет порой решающее диагностическое значение для подтверждения того или иного заболевания, тесно связано с активностью болезни или может определять прогноз. Применяемые лабораторные тесты являются важным инструментом при выборе метода лечения и мониторинга эффективности проводимой терапии.
Прогностическое значение имеет изменение уровня аутоантител как в сторону повышения титров, так и их снижения. Большинство аутоантител не являются специфичными для какого-либо заболевания, они обнаруживаются в различных комбинациях.
Ревматические заболевания
К ревматическим заболеваниям соединительной ткани относят:
- (СКВ) (миозит) или дерматомиозит (РА)
- миастения Гравис
- рассеянный склероз (РС)
- иногда антифосфолипидный синдром и узелковый периартериит, хотя в большинстве последних публикаций это заболевание «открывает» группу системных васкулитов
Лабораторная диагностика ревматических заболеваний
Лабораторная диагностика ревматических заболеваний включает определение:
- аутоантител
- иммуноглобулинов
- циркулирующих иммунных комплексов
- компонентов системы комплемента
- белков острой фазы воспаления
- показателей дисфункции/повреждения эндотелия
- генетических маркеров
- маркеров костного метаболизма
Ревматоидный фактор (РФ)
Ревматоидный фактор (РФ) — это антитела против Fc-фрагмента IgG. Чаще эти антитела относятся к IgM, но встречаются и IgG-, IgA-, IgE-антитела. Ревматоидный фактор (РФ) имеют 75-80% больных ревматоидным артритом, его также обнаруживают при синдроме Шегрена, склеродермии, дерматомиозите, гиперглобулинемиях, В-клеточных лимфопролиферативных заболеваниях. Наличие ревматоидного фактора считается важным прогностическим признаком быстропрогрессирующего деструктивного поражения суставов и системных проявлений при ревматоидном артрите.
Антитела к циклическому цитруллинированному пептиду (анти-ССР)
Антитела к циклическому цитруллинированному пептиду (анти-ССР) относятся к гетерогенной группе аутоантител, которые распознают антигенные детерминанты филагрина и других белков, содержащих атипичную аминокислоту цитруллин. Эти антитела присутствуют в 79% сывороток от больных ревматоидным артритом. Анти-ССР обнаруживаются на очень ранней стадии РА. Кроме того, тест позволяет дифференцировать эрозивную (анти-ССР-положительные пациенты) и неэрозивную (анти-ССР-отрицательные пациенты) формы РА.
Антитела к модифицированному цитруллинированному виментину (anti-MCV)
Виментин является белком цитоскелета различных типов клеток, таких, как клетки мезенхимы и эндотелия, фибробласты, хондроциты и остеоциты. Он используется в качестве маркера опухолей мягких тканей. Виментин синтезируется и модифицируется макрофагами под регуляцией провоспалительных и противовоспалительных цитокинов и встречается в синовиальной жидкости пациентов с ревматоидным артритом. Около половины РФ-негативных пациентов выявляются с помощью анти-MCV.
Циркулирующие иммунные комплексы (ЦИК)
Формирование циркулирующих иммунных комплексов (ЦИК) представляет собой физиологический механизм защиты, приводящий к быстрому устранению через ретикулоэндотелиальную систему либо эндогенных, либо экзогенных антигенов (микроорганизмов, вирусов, паразитов, растительных антигенов, антигенов грибов, пыльцы или пищевых продуктов).
Высокий уровень циркулирующих иммунных комплексов (ЦИК) в сыворотке и/или в других биологических жидкостях наблюдается при многих воспалительных и злокачественных заболеваниях, что может стать причиной развития патологии.
Определение циркулирующих иммунных комплексов (ЦИК) в сыворотке — это важный маркер для оценки активности заболевания, особенно при аутоиммунных болезнях.
Рыхлая соединительная ткань — это система многих клеточных дифферонов, или гистогенетических рядов — дивергентных линий клеточной дифференцировки. Несмотря на большое разнообразие клеточных форм, все они составляют единую систему, выполняющую защитную и трофическую функции. Между кровью и соединительной тканью существуют тесные взаимосвязи и постоянный обмен клеточными элементами.
Структурно-функциональной единицей соединительной ткани считается гистион. Он включает участок микроциркуляторного русла с окружающими его клетками и межклеточными структурами. Рыхлая соединительная ткань находится в динамических взаимодействиях с другими тканями, в частности, с эпителиальными, ретикулярной, эндотелиальной, жировой, пигментной, плотными волокнистыми соединительными тканями.
Воспаление и регенерация. При действии повреждающих агентов (механических, химических, бактериальных и других) в рыхлой соединительной ткани развивается сложная сосудисто-тканевая защитно-приспособительная реакция — воспаление. При воспалении наблюдаются как общие, так и местные изменения. Местные проявления реакции организма в очаге воспаления включают несколько взаимосвязанных фаз: 1) альтерация (повреждение) тканей; 2) высвобождение физиологически активных веществ — так называемых медиаторов воспаления; 3) сосудистая реакция с экссудацией, включающая изменение кровотока в микроциркуляторном русле, повышение проницаемости сосудов; 4) резорбция продуктов распада тканей; 5) пролиферация клеток с образованием "грануляционной ткани" и последующей регенерацией тканей. Завершается воспаление образованием зрелой волокнистой соединительной ткани.

При описании воспаления обычно выделяют три фазы: лейкоцитарную, с преобладанием в очаге воспаления нейтрофильных гранулоцитов; макрофагическую, когда продукты распада активно резорбируются макрофагами; фибробластическую, на протяжении которой на месте повреждения разрастается соединительная ткань.
Лейкоцитарная фаза воспаления характеризуется передвижением нейтрофильных гранулоцитов в очаг распада ткани на месте ее повреждения. Пусковым механизмом воспаления является выброс медиаторов и цитокинов (гистамина, серотонина, лизосомных гидролаз и других биологически активных веществ). Источником выделения медиаторов являются тканевые базофилы (тучные клетки), лейкоциты, кровяные пластинки, макрофаги и лимфоциты. При этом развивается комплекс сосудистых изменений, включающий повышение проницаемости микроциркуляторного русла, экссудацию жидких составных частей плазмы, эмиграцию клеток крови. Уже через 6 ч от начала воспаления образуется лейкоцитарный инфильтрат. Нейтрофильные гранулоциты проявляют высокую фагоцитарную активность, поглощая главным образом микроорганизмы (отсюда их название — микрофаги). Часть нейтрофилов при этом распадается, выделяя большое количество лизосомных гидролаз. Это способствует очищению очага воспаления от поврежденных тканей.
Макрофагическая фаза воспаления протекает при явлениях активизации макрофагов как гематогенных (возникающих из моноцитов крови), так и гистиогенных (оседлых макрофагов — гистиоцитов). Макрофаги энергично фагоцитируют продукты тканевого распада. Вместе с тем они вырабатывают вещества — стимуляторы восстановительных процессов в очаге воспаления.
Фибробластическая фаза является завершающей фазой воспаления. Она характеризуется пролиферацией (размножением) клеток фибробластического ряда и их передвижением к воспалительному очагу. Поскольку к этому времени заканчивается в основном очищение места повреждения от продуктов тканевого распада, фибробласты заполняют бывший дефект ткани. Они интенсивно вырабатывают межклеточное вещество. При этом образуются вначале тонкие аргирофильные, а позднее и коллагеновые волокна. Вместе с клетками эти волокна отграничивают воспалительный очаг от неповрежденной ткани. Развитие фибробластов постепенно приводит к замещению воспалительного очага соединительной тканью. При значительном дефекте ткани на месте очага воспаления формируется рубец. При наличии инородного тела вокруг него образуется соединительнотканная капсула, отчетливо выраженная на 5-7-е сутки от начала воспаления. Относительно источников развития фибробластов в очаге повреждения существуют разные гипотезы. Так различают две субпопуляции фибробластов, имеющие разные источники и отличающиеся неодинаковой продолжительностью жизни (коротко- и долгоживущие фибробласты).
Фибробласты, которые развиваются из стволовых кроветворных клеток — это короткоживущая популяция фибробластов защитно-трофического типа, участвующая в процессах воспаления, заживления ран и т. д. Другие фибробласты происходят от стволовых стромальных клеток (механоцитов) костного мозга. Это популяция долгоживущих фибробластов опорного типа с преимущественно механическими функциями. Кроме того, существуют специализированные формы фибробластов — фиброкласты и миофибробласты, развивающиеся из адвентициальных клеток. Фиб-рокласты обеспечивают перестройку соединительной ткани путем разрушения межклеточного вещества. В цитоплазме клеток обнаруживается хорошо развитый аппарат лизиса коллагеновых фибрилл. Клетки выявляются преимущественно в области формирования рубцовой ткани после повреждения органов. Миофибробласты отличаются от фибробластов большим содержанием сократительных филаментов (актина гладкомышечного типа). Они также участвуют в регенерации путем контракции краев раны.
Читайте также:
