Лечение пороков сердца с легочной гипертензией. Сердечная недостаточность при пороке сердца
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Легочное сердце (ЛС) – это гипертрофия правого желудочка, развившаяся при заболеваниях, поражающих функцию или структуру легких либо то и другое одновременно, за исключением случаев, когда изменения легких яв ляются результатом первичного поражения левых отделов сердца или врожденных пороков сердца.
Согласно классификации ВОЗ, предложенной в 1960 г., все заболевания, приводящие к развитию ЛС, разделяют на три группы:
1. Заболевания, первично влияющие на прохождение воздуха в легких и альвеолах. К этой группе относится 21 нозология: хронический бронхит, бронхиальная астма, эмфизема легких, туберкулез, пневмокониозы, бронхоэктатическая болезнь, саркоидоз, эозинофильная гранулема, бериллиоз, хронический диффузный интерстициальный фиброз, системная красная волчанка и др.
2. Заболевания, первично влияющие на движения грудной клетки: кифосколиоз и другие деформации грудной клетки, плевральный фиброз, хронические нервно-мышечные заболевания (например, полиомиелит), альвеолярная гиповентиляция, в том числе идиопатическая, а также состояние после торакопластики.
3. Заболевания, первично поражающие легочные сосуды: первичная легочная гипертензия (ПЛГ), узелковый полиартериит, другие артерииты, тромбозы и эмболии (в том числе паразитарные) сосудов легких, сдавление ствола легочной артерии и легочных вен опухолями средостения, аневризмой и др.
Основным звеном патогенеза ЛС является уменьшение суммарного поперечного сечения сосудов легких. При этом у пациентов, относящихся к 1 и 2-й группе заболеваний по классификации ВОЗ, это происходит вследствие спазма мелких легочных артерий в ответ на альвеолярную гипоксию. Этот феномен был описан впервые в 1946 г. Von Euler и Liliestrand. У больных, относящихся к 3-й группе, сужение легочных артерий возникает не только вследствие вазоспазма, которому не предшествует альвеолярная гипоксия, но также из-за сужения или закупорки их просвета в результате тромбозов и эмболий, некротизирующего артериита (ПЛГ, системные васкулиты). Уменьшение суммарного поперечного сечения сосудов легких приводит к возрастанию общего легочного сосудистого сопротивления и повышению давления в малом круге кровообращения. В этих условиях правые отделы сердца и, в первую очередь, правый желудочек, испытывают перегрузку давлением, а в дальнейшем, при развитии недостаточности трехстворчатого клапана, и объемом. Это приводит к гипертрофии и дилатации правого сердца. С течением болезни может произойти срыв компенсации – развивается правожелудочковая недостаточность, которая является терминальной стадией данного состояния.
Диагностика ЛС, как правило, не представляет трудностей и заключается в выявлении гипертрофии и дилатации правых отделов сердца у пациентов с перечисленными заболеваниями. Основными методами, позволяющими определить увеличение правого сердца, являются электрокардиография, рентгенография органов грудной клетки, эхокардиография (ЭхоКГ).
Лечение пациентов с ЛС комплексное. Оно направлено на снижение давления в легочной артерии (ЛА), устранение легочной и сердечной недостаточности, чего можно добиться своевременной и адекватной терапией заболевания, приводящего к его возникновению.
Более подробно лечение конкретных болезней, осложняющихся развитием ЛС, описано в соответствующих монографиях. В данной статье будут рассмотрены подходы к терапии собственно ЛС.
Общие рекомендации
К общим рекомендациям для больных с ЛС можно отнести соблюдение режима труда и отдыха с исключением чрезмерных физических нагрузок, особенно у пациентов с признаками недостаточности кровообращения. Следует избегать простудных заболеваний и, прежде всего, гриппа, которые могут приводить к значительному ухудшению клинического состояния больных с хроническими бронхолегочными заболеваниями и ПЛГ. Пребывание в условиях высокогорья также может привести к ухудшению состояния, так как усиливает вазоконстрикцию в ответ на альвеолярную гипоксию, развивающуюся в горах. Женщинам с ПЛГ при выборе метода контрацепции следует иметь в виду, что противозачаточные таблетки могут вызвать прокоагуляционные изменения в свертывающей системе крови и вследствие этого приводить к утяжелению состояния.
Антагонисты кальция
Эта группа лекарственных средств является одной из главных в лечении пациентов с легочной гипертензией (ЛГ) и ЛС. Основной целью назначения вазодилататоров является снижение давления в малом круге кровообращения и предупреждение недостаточности кровообращения. Ранее всего у пациентов с ЛС начали применять препараты из группы a-адреноблокаторов (фентоламин, празозин), затем – гидралазин, нитропруссид натрия, нитроглицерин. Все перечисленные препараты приводили к достоверному снижению давления в ЛА и общего легочного сосудистого сопротивления, повышению сердечного выброса. Тем не менее, ряд причин ограничил широкое применение этих препаратов у больных с ЛС. В первую очередь, это вызываемая ими системная артериальная гипотония, не позволяющая назначать высокие дозы лекарств, необходимых для адекватного снижения давления в малом круге кровообращения. Кроме того, при длительном назначении некоторых вазодилататоров (например, нитропруссида натрия) развивается толерантность, требующая постоянного увеличения их дозы.
Эта группа лекарственных средств является одной из главных в лечении пациентов с легочной гипертензией (ЛГ) и ЛС.
Очевидно, что “идеальный” для лечения ЛГ вазодилатирующий препарат должен снижать сопротивление сосудов малого круга кровообращения значительно активнее, чем большого. Этим требованиям наиболее соответствуют антагонисты кальция из группы дигидропиридинов. Первый представитель этого класса препаратов нифедипин при сравнении с гидралазином и ингибитором фосфодиэстеразы амриноном наиболее значимо снижал давление в ЛА, не вызывая столь выраженного падения системного давления (S. Rich и соавт., 1983). Это позволило авторам предположить, что нифедипин может вызывать селективную дилатацию легочных сосудов. Позже проф. В.Ю. Мареев и соавт. (1990) получили аналогичные результаты. При сравнительном исследовании влияния кратковременного назначения нифедипина, нитроглицерина, простагландина Е1, каптоприла и празозина на показатели центральной гемодинамики у пациентов с ПЛГ было выявлено, что именно нефидипин достоверно снижает давление в ЛА, действуя на сосуды малого круга кровообращения в большей степени, чем на сосуды большого круга.
В дальнейших работах (S. Rich, 1985) было показано, что применение нифедипина эффективно не только при кратковременном назначении, но и при длительной – до 2 лет и более терапии.
Назначение нифедипина в максимально переносимых дозах (до 240 мг/сут) приводило к достоверному снижению давления в ЛА у половины пациентов с ПЛГ, которые считаются наименее перспективной в плане лечения группой.
В 1992 г. были опубликованы данные проспективного наблюдения за 64 пациентами с ПЛГ в течение 5 лет (S. Rich и соавт.): 23% больных находились на постоянной терапии большими дозами нифедипина в течение всего времени. При этом наблюдалось значительное улучшение их клинического статуса и выживаемости (94% остались живыми к концу периода наблюдения) в сравнении с “неответчиками” и теми, кто ответил на терапию нифедипином, но не лечился (только 36% больных из этой группы остались в живых к концу периода наблюдения).
Основным механизмом действия нифедипина является расслабление гладких мышц сосудов вследствие уменьшения внутриклеточного движения ионов кальция во время сокращения.
Нифедипин выпускается в различных формах. Помимо нифедипина короткого действия, который в настоящее время применяется крайне редко – для проведения острых проб, купирования гипертонических кризов, созданы его пролонгированные формы, при которых постепенное медленное высвобождение препарата происходит в течение 24 ч. Это позволяет предотвратить или, по крайней мере, значительно уменьшить выраженность таких побочных реакций, как тахикардия, системная гипотония, покраснение лица, голеней, отеки стоп, что ограничивает назначение препарата в адекватных дозах.
Помимо антагонистов кальция дигидропиридинового ряда, к которым относится нифедипин, для лечения больных с ЛС могут применяться бензотиазепины (дилтиазем). К преимуществам препаратов относится отсутствие тахикардии при их применении, к недостаткам – более слабое по сравнению с дигидропиридинами сосудорасширяющее действие.
В последние годы в клиническую практику внедрены новые антагонисты кальция – амлодипин и исрадипин. Препараты зарекомендовали себя как высокоэффективные лекарственные средства для лечения как системной гипертензии, так и ЛГ.
Следует отметить, что тактика назначения антагонистов кальция у пациентов с ЛС несколько отличается от таковой при терапии других заболеваний и заключается в соблюдении основных четырех правил.
Правило первое: дозу препаратов следует “титровать”, начиная с небольших дозировок и постепенно их увеличивая, доводя до максимально переносимой.
Для нифедипина начальные дозы составляют 20–40 мг/сут; каждые 3–5 дней дозу увеличивают на 20 мг/сут.
Исрадипин: начальные дозировки 2,5–5 мг/сут, каждые 3–5 дней доза повышается на 2,5–5 мг/сут.
Дилтиазем: начальная доза 30–60 мг/сут, каждые 3–5 дней дозу увеличивают на 30 мг/сут.
Правило второе: подобрать дозу препарата с учетом уровня давления в ЛА: при систолическом давлении в легочной артерии (СДЛА), определенном при катетеризации правых отделов сердца или ЭХОКГ-иследовании менее 50 мм рт.ст.: нифедипин – 40–60 мг/сут, исрадипин – 7,5–10 мг/сут, дилтиазем – 120–180 мг/сут; при СДЛА от 50 до 100 мм рт.ст.: нифедипин – 80–120 мг/сут, исрадипин – 10–12,5 мг/сут, дилтиазем – 180–240 мг/сут; при СДЛА более 100 мм рт. ст.: нифедипин – 120–180 мг/сут, исрадипин – 12,5–15 мг/сут, дилтиазем – 240–360 мг/сут.
Правило третье: дифференцированно подходить к возникающим побочным эффектам при назначении антагонистов кальция: в то время как системную гипотонию и выраженную тахикардию можно отнести к серьезным побочным реакциям, требующим коррекции дозы, такие побочные эффекты, как покраснение конечностей, лица, чувство жара, отеки лодыжек не должны вызывать паники у лечащих врачей.
Правило четвертое: не ожидать немедленного эффекта от антагонистов кальция, так как лишь в четверти случаев можно наблюдать быстрое, развивающееся через несколько дней от начала терапии улучшение, в остальных случаях заметное клиническое улучшение наблюдается, как правило, лишь через 3–4 нед.
Простагландины
Другой группой лекарственных препаратов, использующихся у пациентов с ЛС, являются простагландины.
Предпосылкой к их внедрению в клиническую практику послужили исследования, выполненные в 70-х годах, в которых было показано, что простагландины играют важную роль в поддержании сосудистого тонуса как в нормальных условиях, так и при различных формах ЛГ.
С середины 80-х годов простагландин Е1 стал применяться уже и для лечения пациентов с ЛГ. Положительным качеством препарата являлось то, что 70% его инактивируется в легких и при внутривенном введении препарат поступает в большой круг кровообращения в ничтожно малом количестве, не вызывая заметной системной гипотонии. Кроме того, препарат обладает выраженным антиагрегантным действием, что делает его еще более привлекательным для терапии больных с ЛС и ЛГ, многие из которых имеют склонность к тромбозам. В то же время значительным недостатком простагландина Е1 является необходимость его постоянного внутривенного введения для поддержания вазодилатации.
Поэтому для длительной инфузии применяют специальный портативный насос, соединенный с катетером Хикмана, который находится в яремной или подключичной вене. Осложнения при длительном введении простагландина Е1 связаны, как правило, с нарушением работы инфузионной системы (например, тромбозом или инфекцией катетера), повреждением насоса или прекращением инфузии вследствие самых различных причин. Дозы препарата, применяющиеся у больных с ЛГ, варьируют от 5 нг/кг/мин до 100 нг/кг/мин. В Российском кардиологическом научно-производственном комплексе применяется следующая схема назначения препарата: начальная доза – 5–10 нг/кг/мин, в дальнейшем постепенно увеличивается до 30 нг/кг/мин. При таком назначении максимальная легочная вазодилатация может быть достигнута с минимальным количеством побочных реакций, к которым относятся, системная гипотония, боли в сердце неопределенного характера, головные боли и боли в животе, покраснение лица и конечностей, тошнота.
Следует отметить, что простагландин Е1 назначается пациентам с ЛГ, как правило, лишь в качестве монотерапии. В то же время может быть оправдано его сочетание с другими вазодилататорами, в частности, антагонистами кальция, учитывая разность в механизмах их вазодилатирующего эффекта. Нами была предложена схема курсового применения простагландина Е1, вводимого в суточной дозе 60 мкг на фоне постоянного приема антагонистов кальция. При применении этой комбинации в течение 21 дня более чем у половины пациентов отмечалось улучшение клинического статуса. При этом побочные реакции (в частности, системная гипотония) были выражены незначительно и не приводили к отмене препаратов.
В последнее время применяется и другой препарат из группы простагландинов – простациклин. Рекомендуемые дозы составляют 2–24 нг/кг/мин. Он является несколько более активным вазодилататором, чем простагландин Е1, обладая практически теми же достоинствами и недостатками, что и последний. Но непомерная стоимость простациклина не позволяет его широко использовать. Вообще, в настоящее время простагландины применяются у пациентов с ЛС при непереносимости кальциевых антагонистов или при их неэффективности. Некоторые авторы называют терапию простагландинами “мостом” к трансплантации. Известны случаи, когда постоянное введение простагландинов длилось до 5 лет, хотя в среднем максимальный срок их непрерывного применения не превышает нескольких месяцев.
Оксид азота (II)
В последнее время в клиническую практику лечения ЛГ внедряется оксид азота (II) (NO). Его вазодилатирующее действие основано на активации гуанилатциклазы в гладкомышечных клетках легочных сосудов, которое приводит к повышению уровня цикло-ГМФ и снижению внутриклеточного содержания кальция.
NO применяется в виде ингаляций. При таком способе введения происходит быстрое соединение данного вещества с гемоглобином, что предотвращает попадание NO в системный кровоток и развитие артериальной гипотонии. Поэтому NO можно считать селективным вазодилататором, действующим исключительно на сосуды малого круга кровообращения.
NO является “золотым стандартом” для проведения острых проб с целью выявления “ответчиков” и “неответчиков” на вазодилатирующую терапию. Он выгодно отличается от простагландинов более коротким периодом действия, простотой назначения (ингаляция через лицевую маску или назальный катетер), практически полным отсутствием побочных эффектов, низкой стоимостью. Для проведения острой пробы используют ингаляцию NO в возрастающей концентрации. Как правило, максимальное падение давления в ЛА отмечается уже после применения начальной дозы через 2 мин.
Следует отметить, что лишь 25–50% больных с ЛГ “отвечают” на терапию вазодилататорами, то есть у них можно добиться снижения давления в ЛА и повышения сердечного выброса без значимой системной гипотонии.
Существуют следущие критерии “ответа” на вазодилатирующую терапию во время проведения острых проб:
• более чем 20% снижение легочного сосудистого сопротивления;
• более чем 20% снижение легочного сосудистого сопротивления, сопровождающееся падением соотношения легочного сосудистого сопротивления к общему сосудистому сопротивлению;
• повышение сердечного выброса (>10%) вместе с уменьшением среднего давления в легочной артерии;
• более чем 30% снижение легочного сосудистого сопротивления в сочетании с более чем 10% снижением давления в легочной артерии.
Безусловно, проведение острой пробы имеет некоторые ограничения, о которых уже было сказано ранее, но тем не менее с ее помощью можно достаточно точно предсказать, будет ли целесообразным назначение вазодилататоров у того или иного пациента.
Определенно сказать, чем обусловлен “неответ” на вазодилатирующую терапию у больных с ЛС, в настоящее время невозможно. Наиболее обоснованными являются две точки зрения.
Согласно первой, рефрактерность к вазодилататорам возникает в случаях, когда преобладают необратимые изменения мелких легочных сосудов, такие как фиброз интимы, плексогенные и дилатационные поражения.
Вторая точка зрения, подтвержденная данными наших исследований, – “неответ” на вазодилатирующую терапию может возникать у пациентов с выраженными нарушениями в системе гемостаза, когда на первый план выходят прокоагуляционные изменения, а вазоспазм не играет ведущей роли. Чаще всего это пациенты с тромбозами легочной артерии и ПЛГ. Таким больным, по-видимому, к базисной терапии вазодилататорами целесообразно добавить антикоагулянты.
1. Беленков Ю.Н., Чазова И.Е., Самко А.Н. и др. Применение антагониста кальция исрадипина у больных с первичной легочной гипертензией // Кардиология. – 1995; (7): 9–13.
2. Мухарлямов Н.М. Легочное сердце. – М. Медицина, 1973; 264.
3. Чазова И.Е., Жданов В.С., Веселова С.П., Мареев В.Ю. Патология первичной легочной гипертензии //Арх. патологии. 1993; (3): 77–80.
4. Чазова И.Е., Мареев В.Ю. Первичная легочная гипертензия: вопросы, требующие ответа //Тер.архив. 1994; (3): 77–80.
5. Bardsley P., Evely R., Howard P. Hypoxic cor pulmonale. A review // Herz. 1986; (11): 155–68.
6. Pulmonary circulation / Ed. A. Fishman . – USA. Philidelphia: Univ. Pensilvania press, 1990; 551.
7. Pulmonary hypertension / Eds. E.K. Weir, J.T. Reeves. – USA, NY, Futura, 1984; 442.
8. Rubin L. Primary pulmonary hypertension // Chest. 1993; (104): 236–50.
9. Vender R. Chronic hypoxic pulmonary hypertension. Cell biology to pathophysiology // Chest. 1994; (106): 236–43.
Коринфар (торговое название)
• препараты следует назначать с небольшой дозы, постепенно ее увеличивая, доводя до максимально переносимой;
• подбирать дозу препаратов с учетом уровня давления в легочной артерии;
• дифференцированный подход к возникающим побочным эффектам;
• не следует ожидать немедленного эффекта от антагонистов кальция.
• оксид азота (II) (NO) в виде ингаляций.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Лечение пороков сердца с легочной гипертензией. Сердечная недостаточность при пороке сердца
До настоящего времени еще нет препаратов, уменьшающих степень легочной гипертензии. Правда, применение эуфиллина (или диафиллина), особенно при внутривенном введении, до некоторой степени уменьшает спазм легочных сосудов. Так как гипертензия в первую очередь обусловлена сбросом крови слева направо, то только оперативное лечение порока сердца совершенно устраняет или уменьшает степень ее.
У детей раннего возраста легочная гипертензия — одно из показаний для раннего оперативного лечения порока сердца. Хирургическая коррекция врожденных пороков сердца у них в настоящее время производится во многих клиниках. При открытом артериальном протоке и дефекте межпредсердной перегородки показана радикальная коррекция порока.
Следует только учесть, что легочная гипертензия в этом возрасте сочетается с сердечной недостаточностью. Поэтому предоперационная подготовка должна быть направлена на ликвидацию явлений декомпенсации (сердечные гликозиды, кокарбоксилаза, АТФ, витамины, эуфиллин).
В Институте хирургии им. А. А. Вишневского оперировано (Е. С. Клеменова, 1964) 7 детей раннего возраста с открытым артериальным протоком и высокой легочной гипертензией без летальных исходов.
При дефекте межжелудочковой перегородки производят паллиативную операцию, сужение общего ствола легочной артерии по Мюллеру—Мешалкину, так как при пластике дефекта наблюдается высокая смертность.
У больных старшего возраста вопрос о хирургическом лечении врожденных пороков сердца решается в зависимости от вида порока, степени и характера легочной гипертензии. Изучение непосредственных и отдаленных результатов перевязки боталлова протока у 400 больных показало, что у одной группы давление в легочной артерии снижается до нормы сразу после операции, у второй — снижается значительно и приходит к норме через 1—2 года и у третьей — оно остается высоким (как и до операции) на протяжении 10—15 лет. Это можно объяснить тем, что существуют две причины легочной гипертензии при врожденных пороках сердца: гиперволемия, после устранения которой давление сразу или в течение нескольких месяцев снижается до нормы, и первичный склероз сосудов легкого, при котором давление после операции остается высоким на протяжении многих лет. Оно может даже повышаться и превышать системное, не имея тенденции к обратному развитию.
Сердечная недостаточность при пороке сердца
Сердечная недостаточность — одно из наиболее частых осложнений врожденных пороков сердца, нередко приводящее к летальному исходу. Данные о частоте ее противоречивы, зависят от возраста и количества обследованных больных.
Так, при дефекте межжелудочковой перегородки на первом году жизни погибает от сердечной недостаточности, по секционным данным, 80—90% детей (Schoemakers, 1955), а по клиническим—около 50% (Gross, Brockhoff с соавт., 1960; Н. С. Кухарева, 1965). В более старшем возрасте частота ее значительно ниже: у больных до 4 лет— 21%, а до 14—10,4% (Apitz, Stoermer, 1967). При открытом артериальном протоке данные о частоте сердечной недостаточности столь же противоречивы. По данным Abbott, погибают 50%, по данным П. Г. Кишш (1962), Keys, Shapiro (1943) — 20—30% больных.
Описаны многочисленные клинические наблюдения сердечной недостаточности у детей раннего возраста с открытым артериальным протоком (Holman, Cooley, 1964; К. Ф. Ширяева, 1965, и др.).
Несколько реже и в более позднем возрасте отмечена сердечная недостаточность при дефекте межпредсердной перегородки. Так, по данным Ourback с соавторами (1962), при дефекте межпредсердной перегородки она наблюдается у больных старше 40 лет, по данным Mark (1963) —старше 17. Лишь при первичном дефекте межпредсердной перегородки возможно развитие сердечной недостаточности в раннем возрасте.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Причины сердечной недостаточности при пороке сердца. Диастолическая перегрузка при пороке сердца
При коарктации аорты сердечная недостаточность также является частым осложнением и развивается как у грудных детей, так и в более позднем возрасте (Nadas, 1958; Ю. Е. Березов с соавт., 1967). Описаны многочисленные наблюдения ее при изолированном стенозе легочной артерии (Marguis, 1951, и др.), аортальном стенозе и др.
При цианотических пороках сердца, особенно при транспозиции магистральных сосудов, сердечная недостаточность — частое осложнение в раннем возрасте (Hauk, Nadas, 1958; Cooley, 1964; К. Ф. Ширяева, 1965, и др.). Исключение составляют больные тетрадой Фалло, у которых декомпенсация развивается в старшем возрасте, при выраженной миокардиодистрофии.
В большинстве случаев сердечная недостаточность — результат нарушения функции рабочей мускулатуры миокарда, ее способности к сокращению (Г. Ф. Ланг, 1938, 1957). Ф. З. Меерсон (1960) определяет ее как состояние, при котором нагрузка, падающая на сердце, превышает его способность совершать работу.
Хотя врожденные пороки сердца существуют со дня рождения, явления сердечной недостаточности у больных развиваются в разном возрасте при различных пороках.
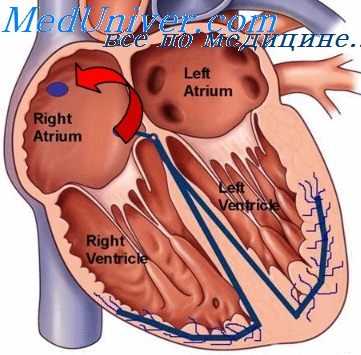
При компенсированном пороке сердца, как и в норме, венозный приток крови к сердцу равен количеству крови, выбрасываемому сердцем в аорту или легочную артерию. При этом происходит непрерывная гиперфункция миокарда, непосредственной причиной которой является скопление в полостях сердца большего, чем в норме, количества крови. При врожденных пороках сердца наблюдается увеличение притока крови к сердцу (диастолическая перегрузка желудочков), препятствие к ее изгнанию (систолическая перегрузка) или сочетание обоих этих факторов.
При диастолической перегрузке полость желудочков растягивается; согласно закону Стерлинга, степень растяжения миокарда определяется количеством притекающей во время диастолы крови. Для того чтобы выбросить увеличенный объем крови, желудочек должен усилить свое сокращение, в результате чего развивается гипертрофия миокарда. Однако растяжение миокарда, так называемая тоногенная дилатация его, возможна дс определенного предела. При дальнейшем растяжении возникает слабость миокарда, так называемая миогенная дилатация сердца.
При систолической перегрузке, развивается концентрическая гипертрофия стенки желудочка, степень которой прямо пропорциональна степени препятствия. Размеры полости желудочка при этом не изменяются или несколько уменьшаются.
В конечном итоге при обоих видах перегрузок увеличиваются размеры желудочка. Степень увеличения того или иного отдела сердца будет большей при диастолической перегрузке, так как при этом наблюдается расширение полости желудочка, а не гипертрофия его (Л. И. Фогельсон, 1951).
- Вернуться в оглавление раздела "Кардиология."
Митральные пороки сердца и легочная гипертензия в практике ревматолога и терапевта (Лекция № 2. Митральная недостаточность. Современные вопросы диагностики и лечения)
Для цитирования: Шостак Н.А., Клименко А.А., Аничков Д.А., Новиков И.В. Митральные пороки сердца и легочная гипертензия в практике ревматолога и терапевта (Лекция № 2. Митральная недостаточность. Современные вопросы диагностики и лечения). РМЖ. 2009;8:514.
Митральная недостаточность (регургитация) – состояние, сопровождающееся перегрузкой объемом левого предсердия и левого желудочка. Обычно заболевание протекает бессимптомно многие годы, но, в конце концов, приводит к сердечной недостаточности. Митральная регургитация (МР) – второй по частоте клапанный порок сердца (после аортального стеноза), частота в развитых странах составляет 5 случаев на 10000.
Митральную регургитацию классифицируют:
а) по течению (острая и хроническая);
б) в зависимости от этиологии (неишемическая и ишемическая);
в) по степени тяжести.
Среди причин острой МР, в основе которой могут быть разрыв сухожильных хорд, сосочковых мышц, отрыв створок митрального клапана и т.д., можно выделить:
- острый инфаркт миокарда
- инфекционный эндокардит
- тупую травму сердца
Разрывы сосочковых мышц при инфаркте миокарда приводят к летальному исходу в 80–90% случаев.
Хроническая митральная регургитация – состояние, сопровождающееся перегрузкой объемом левого предсердия и левого желудочка. Ключевое значение для компенсации кровообращения имеет податливость (compliance) левого предсердия. При нормальной податливости левое предсердие практически не увеличивается в ответ на перегрузку дополнительным объемом крови, но значительное повышение давления в легочной артерии приводит к застою в малом круге кровообращения. При хронической митральной регургитации в сочетании с нарушением податливости левого предсердия последнее достигает больших размеров, при этом давление в легочной артерии повышено незначительно и клинических признаков заболевания может не быть в течение длительного времени.
Среди причин хронической митральной недостаточности выделяют: 1) воспалительные (ревматическая болезнь сердца, системная красная волчанка, системная склеродермия); 2) дегенеративные (миксоматозная дегенерация, синдром Марфана, Элерса–Данло, кальциноз митрального кольца); 3) инфекционные (инфекционный эндокардит); 4) структурные (разрыв сухожильных хорд, надрыв или дисфункция папиллярных мышц, дилатация митрального кольца, гипертрофическая кардиомиопатия, недостаточность протеза клапана); 5) врожденные (расщепление, фенестрация митральных створок, парашютовидная деформация клапана).
В настоящее время ведущими причинами митральной регургитации являются миксоматозная дегенерация и кальциноз створок клапана, а также ишемическая болезнь сердца с развитием ишемической дисфункции митрального комплекса. Известно, что последняя наблюдается у 10% больных с постинфарктным кардиосклерозом; хроническая дисфункция папиллярных мышц ведет к развитию застойной сердечной недостаточности. На долю ревматической болезни сердца приходится около 14% среди всех причин изолированной митральной недостаточности.
Клиническая картина и диагностика
Самой частой жалобой пациентов является одышка, которая сначала возникает при физической нагрузке, но постепенно достигает стадии пароксизмальной ночной астмы и ортопноэ. Кроме того, больных беспокоят сердцебиения, слабость, утомляемость. Кровохарканье чаще встречается при митральном стенозе. При аускультации сердца I тон обычно ослаблен. II тон часто расщеплен на аортальный и легочный компоненты.
Наиболее характерным аускультативным признаком митральной регургитации является голосистолический шум, начинающийся сразу после I тона. Лучше всего он выслушивается на верхушке сердца в фазе выдоха, особенно в положении на левом боку после физической нагрузки. Чем громче и продолжительнее шум, тем тяжелее митральная регургитация. Так как систолический шум у пожилых больных может свидетельствовать о наличии кальцинированного аортального стеноза, рекомендуется пальпировать пульс на сонной артерии. При митральной регургитации пульс живой, в то время как при аортальном стенозе пульс замедлен и ослаблен.
При тяжелой митральной регургитации часто выслушивается III тон. В то же время наличие III тона не обязательно указывает на хроническую сердечную недостаточность – это может быть следствие быстрого заполнения левого желудочка увеличенным объемом крови из левого предсердия.
Инструментальные исследования
На ЭКГ при митральной регургитации могут наблюдаться признаки увеличения левого предсердия и гипертрофии левого желудочка, а также признаки мерцательной аритмии. При выполнении рентгенографии грудной клетки могут наблюдаться признаки застоя в малом круге кровообращения, увеличения левого предсердия и левого желудочка, а при развитии легочной гипертензии – правых отделов сердца.
Основным методом диагностики митральной регургитации является допплер–эхокардиография, которая позволяет оценить структуру митрального клапана, размеры и функцию левого предсердия и левого желудочка, оценить тяжесть регургитации и давление в легочной артерии (рис. 1).
Степень регургитации можно оценить и по фракции регургитации, то есть отношению объема регургитации к общему объему притекающей крови. Фракция регургитации >60% соответствует тяжелой митральной недостаточности, 40–60% – умеренной, 20–40% – легкой. Однако это исследование требует больших затрат времени и мастерства, в связи с чем предпочтение отдается полуколичественным и качественным показателям (рис. 2).
Катетеризация полостей сердца проводится редко, лишь для уточнения наличия сопутствующей ИБС (коронароангиография) и степени легочной гипертензии (оценка давления в легочной артерии, давления заклинивания, а также для исключения врожденных дефектов). Классификация митральной регургитации по степени тяжести представлена в таблице 1.
Дифференциальная диагностика
Митральную регургитацию дифференцируют с: 1) гипертрофической кардиомиопатией; 2) легочной или трикуспидальной регургитацией; 3) дефектом межжелудочковой перегородки. У пожилых больных необходимо дифференцировать митральную регургитацию с кальцинированным аортальным стенозом.
Пример формулировки диагноза
• Недостаточность митрального клапана умеренной ст. (перенесенный инфекционный эндокардит от …). ХСН 0, I ФК.
• Ревматическая болезнь сердца. Комбинированный митральный порок с преобладанием недостаточности. Митральный стеноз легкой степени. Митральная регургитация умеренной степени. ХСН II А стадии, II ФК.
• ИБС, постинфарктный кардиосклероз. Ишемическая дисфункция митрального клапана. Митральная регургитация тяжелой степени. ХСН IIБ стадии, III ФК.
• Пролапс митрального клапана, идиопатический, III ст. с митральной регургитацией умеренной степени. ХСН I стадии, I ФК.
Лечение
Бессимптомным пациентам рекомендуется ограничить интенсивные физические нагрузки. При декомпенсации и явлениях ХСН рекомендовано ограничение натрия в пище.
При невозможности хирургического лечения (например, при тяжелых сопутствующих заболеваниях) проводится медикаментозное лечение митральной регургитации. Обосновано применение нитратов и диуретиков, хотя контролируемые исследования эффективности этих препаратов при митральной регургитации не проводились. Применение ингибиторов АПФ, по данным небольшого количества исследований, эффективно у больных митральной регургитацией и ХСН. Надо отметить, что при ишемической митральной регургитации применение ингибиторов АПФ и других вазодилататоров более эффективно, т.к. уменьшает степень регургитации. При мерцательной аритмии показано назначение дигоксина и антикоагулянтов.
В целом пациенты с митральной регургитацией менее склонны к эмболическим осложнениям по сравнению с пациентами с митральным стенозом, но более склонны к инфекционному эндокардиту.
Основной метод лечения митральной регургитации – хирургический (пластика или протезирование митрального клапана). Оперативное лечение показано при появлении симптомов ХСН или при нарушении систолической функции левого желудочка.
Наиболее важными факторами, влияющими на исход операции при митральной регургитации, являются возраст больного, наличие клинических симптомов, фибрилляции предсердий, значение фракции выброса левого желудочка перед операцией и состояние клапанных структур. Реконструктивная операция (пластика митрального клапана) предпочтительнее протезирования у большинства пациентов с тяжелой митральной регургитацией; пациентов необходимо направлять в кардиохирургические центры, имеющие опыт реконструктивных операций на митральном клапане (класс I, уровень доказанности C).
Хирургическое лечение тяжелой митральной недостаточности органической природы показано в следующих клинических ситуациях:
1. Митральная регургитация, сопровождающаяся симптомами сердечной недостаточности с фракцией выброса левого желудочка более 30% и конечным систолическим размером менее 55 мм (класс I, уровень доказательности В).
2. «Бессимптомные» пациенты с дисфункцией левого желудочка (конечный систолический размер более 45 мм и/или фракция выброса 60% и менее) (класс I, уровень доказательности C).
3. «Бессимптомные» пациенты с сохраненной функцией левого желудочка в случае наличия фибрилляции предсердий или легочной гипертензии (систолическое давление в легочной артерии в покое более 50 мм рт.ст.) (класс IIа, уровень доказательности C).
4. Пациенты с тяжелой дисфункцией левого желудочка (фракция выброса менее 30% и/или конечный систолический размер более 55 мм) и незначительным числом сопутствующих заболеваний, рефрактерные к консервативному лечению, у которых высока вероятность эффективной пластики митрального клапана (класс IIа, уровень доказательности C).
5. «Бессимптомные» пациенты, с высокой вероятностью благоприятного прогноза после проведения пластики митрального клапана и низким операционным риском (класс IIb, уровень доказательности B).
6. Пациенты с тяжелой дисфункцией левого желудочка (фракция выброса менее 30% и/или конечный систолический размер более 55 мм) и незначительным числом сопутствующих заболеваний, рефрактерные к консервативному лечению, у которых низка вероятность эффективной пластики митрального клапана (класс IIb, уровень доказательности C).
При неишемической митральной регургитации операцией выбора является реконструктивная операция (пластика митрального клапана), вне зависимости от возраста и необходимости выполнения коронарного шунтирования. Иными словами, пожилому пациенту с ревматической митральной регургитацией и сопутствующей ИБС с сохраненной функцией левого желудочка показана именно пластика, а не протезирование митрального клапана. У лиц старше 60 лет пластика митрального клапана по сравнению с протезированием ассоциируется с меньшей операционной летальностью и лучшей выживаемостью при наблюдении в течение 15 лет.
При ишемической этиологии митральной недостаточности зачастую затруднено проведение реконструктивной операции, так как сам клапан часто сохраняет нормальное анатомическое строение, а регургитация является следствием повреждения сосочковых мышц. С другой стороны, выполнение аорто–коронарного шунтирования может улучшить функцию левого желудочка и уменьшить степень регургитации. Таким образом, выбор метода операции при ишемической природе митральной недостаточности остается спорным, вплоть до предпочтения протезирования митрального клапана.
Пациенты с легкой митральной регургитацией без дилатации или дисфункции левого желудочка и без легочной гипертензии должны наблюдаться ежегодно. Пациенты должны знать, что при появлении симптомов необходимо обратиться к врачу, не дожидаясь запланированного визита. Ежегодное выполнение эхокардиографии не обязательно.
При умеренной митральной регургитации во время ежегодного обследования необходима эхокардиография. Бессимптомные пациенты с тяжелой митральной регургитацией должны наблюдаться врачом с интервалом 6–12 мес. Помимо эхокардиографии, возможно проведение нагрузочных тестов. При появлении симптомов необходимо хирургическое лечение, даже при сохраненной функции левого желудочка.
Профилактика
Больным с ревматической митральной регургитацией показана вторичная профилактика рецидивов ревматической лихорадки (бензатин бензилпенициллин 2,4 млн Ед. внутримышечно взрослым и 1,2 млн. Ед. внутримышечно детям ежемесячно).
Профилактика инфекционного эндокардита включает в себя применение антибактериальных средств перед предстоящими медицинскими манипуляциями. В соответствии с последними рекомендациями Американского колледжа кардиологов и Американской ассоциации сердца от 2008 г. антибактериальная профилактика инфекционного эндокардита должна назначаться лишь у пациентов, имеющих высокий риск развития данного осложнения (уровень доказательности IIа):
• перенесенная операция протезирования клапанов сердца или реконструктивная операция на клапанах с использованием искусственных материалов;
• инфекционный эндокардит в анамнезе;
• врожденные пороки сердца «синего» типа;
• перенесенная реконструктивная операция по поводу врожденных пороков сердца с использованием искусственных материалов с полным восстановлением функции в течение 6 месяцев после операции;
• резидуальные клапанные дефекты после перенесенной реконструктивной операции по поводу врожденных пороков сердца;
• трансплантация сердца с клапанной регургитацией, связанной со структурными аномалиями клапанов трансплантата.
Список манипуляций, перед проведением которых необходима антибактериальная профилактика, включает в себя стоматологические манипуляции, при производстве которых происходит повреждение слизистой оболочки полости рта, ткани десен или периапикальной области зубов, и инвазивные манипуляции, связанные с повреждением слизистой оболочки респираторного, желудочно–кишечного трактов и мочевыводящих путей. Не рекомендуется проведение антибактериальной профилактики перед осуществлением чреспищеводной эхокардиографии, эзофагогастродуоденоскопии, колоноскопии или диагностической бронхоскопии без биопсии в отсутствие очагов активной инфекции в организме.
Прогноз
При митральной недостаточности наблюдается достаточно длительный период компенсации. При формировании систолической дисфункции левого желудочка появляются симптомы ХСН. Прогноз при ревматической митральной регургитации более благоприятный, чем при ишемической.
Классификация легочной гипертензии. Клиника легочной гипертензии
Мы подразделяем легочную гипертензию на четыре степени (классификация Н. К. Таланкина): I — давление в легочной артерии от 30 мм рт. ст. до 70% системного; II — более 70% системного: а) сброс крови слева направо, б) переменный; III — сброс крови справа налево; IV—легочная гипертензия+сердечная недостаточность.
Подобная классификация учитывает характер сброса крови и выраженность декомпенсации кровообращения, что важно для определения показаний к операции. Так, для больных с открытым артериальным протоком высокая легочная гипертензия не является противопоказанием к операции так же, как и для больных раннего возраста с дефектом межжелудочковой перегородки.
Диагностика легочной гипертензии без применения катетеризации полостей сердца трудна. Однако имеются косвенные клинические симптомы ее при различных врожденных пороках сердца. У детей раннего возраста отмечаются выраженный двусторонний сердечный горб, разлитой сердечный толчок, акцент и раздвоение II тона над легочной артерией, передаточная пульсация эпигастральной области, склонность к повторным пневмониям, сердечная недостаточность, гипертрофия желудочков, отставание в росте и весе.
Диагноз подтверждается данными рентгенологического и инструментальных методов исследования: фонокардиографией, электрокимографией, реовазографией и катетеризацией полостей сердца (Rudolf, Cayler, 1958; В. И. Бураковский, Б. А. Константинов, 1964; Ю. Д. Волынский с соавт., 1967, и др.).
При умеренной легочной гипертензии I степени у больных старшего возраста сохраняется типичная клиническая картина, характерная для данного порока. Такие больные жалуются на одышку, возникающую при небольшой физической нагрузке. При обследовании у них отмечаются умеренно выраженная сердечная недостаточность (обычно IIА степени), акцент и расщепление II тона над легочной артерией, изменение на электрокардиограмме и фонокардиограмме.
При выраженной легочной гипертензии исчезают характерные симптомы порока, уменьшается или исчезает шум, появляется цианоз, сначала непостоянный, при физической нагрузке, а затем и в покое, увеличиваются симптомы сердечной недостаточности, нарушается газообмен в легких. Такие больные жалуются на быструю утомляемость, одышку при незначительной физической нагрузке, сердцебиение и боли в области сердца, головные боли. Периодически могут наблюдаться носовые или легочные кровотечения. В дальнейшем присоединяется тяжелая декомпенсация, протекающая по правожелудочковому типу.
При врожденных пороках сердца, осложненных легочной гипертензией, лечебная тактика различна в зависимости от характера ее, возраста больного, вида врожденного порока сердца и выраженности декомпенсации кровообращения.
Читайте также:
