Лечение рецидивов острого миелоидного лейкоза - принципы
Добавил пользователь Евгений Кузнецов Обновлено: 06.01.2026
К сожалению, у большинства пациентов (60 - 70%), у которых достигнута ПР ОМЛ, в течение 3 лет развивается рецидив заболевания. В целом прогноз у пациентов при развитии рецидива неблагоприятен и терапевтических подходов крайне мало. Долгосрочная выживаемость зависит от возможности достижения повторной ремиссии и выполнения ТГСК в качестве консолидации. Пациенты с очень ранним рецидивом (длительностью ремиссии менее полугода), неблагоприятными цитогенетическими аномалиями и старшего возраста имеют плохой прогноз [1, 7]. Из-за неблагоприятного прогноза пациентов в рецидиве необходимо оценивать, насколько терапия может быть выполнена у конкретного пациента. Оценка перспективы долгосрочной выживаемости может быть сделана на основе прогностического индекса рецидива [72](Приложение Г5). Прогностический индекс можно использовать при определении лечебной тактики у конкретного пациента: 1) проведение терапии, направленной на "излечение" с использованием ТГСК; 2) включение в клиническое исследование по применению новых лекарственных препаратов; 3) паллиативная терапия.
В рекомендациях NCCN, которых придерживаются и российские эксперты, используется более простой принцип определения прогноза ОМЛ после развития рецидива: если рецидив ранний (продолжительность ПР менее 12 месяцев) - прогноз неблагоприятный, поздний (продолжительность ПР 12 месяцев и более) - прогноз более благоприятный [8]. Оба подхода (прогностический индекс и деление рецидивов на ранние и поздние) к классификации рецидива ОМЛ используются в российских исследовательских центрах.
- Рекомендуется пациентам при констатации первичной резистентности ОМЛ проведение терапии по программам лечения рефрактерных форм и рецидивов ОМЛ [73].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: терапия цитарабином** в высоких дозах (если его не применяли в 1-й линии индукции) в сочетании с антрациклинами может рассматриваться в качестве индукции ремиссии перед алло-ТГСК. Для улучшения результатов ТГСК у пациентов с рефрактерными ОМЛ используют режимы кондиционирования - последовательное применение интенсивной ХТ и через 3 дня - режим кондиционирования пониженной интенсивности с последующей алло-ТГСК (так называемый протокол FLAMSA-RIC) и в дальнейшем - профилактическое использование трансфузий донорских лимфоцитов и/или терапия азацитидином**.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: повторение индукционного курса ХТ целесообразно при отсутствии, в сравнении с исходными показателями, нарастания числа бластных клеток в миелограмме. В случае прогрессирования заболевания (увеличение процента бластных клеток, появление ранее не выявляемых экстрамедуллярных очагов) в качестве 2-го индукционного курса целесообразно выполнение курса ХТ цитарабином** в высоких дозах в сочетании с новыми антрациклиновыми антибиотиками (см. Приложение А3.2).
- Не рекомендуется выполнение ТГСК пациентам, у которых не достигнута ремиссия после нескольких линий индукционной терапии [74].
Комментарий: эти пациенты являются кандидатами на включение в клинические исследования по изучению новых лекарственных препаратов.
- Рекомендуется у пациентов при констатации позднего рецидива ОМЛ (продолжительность 1-й ПР более 1 года) в выборе терапевтической тактики руководствоваться информацией о ранее проведенной ХТ, на которой была получена 1-я ПР [1, 7, 8].
Комментарий: классическим выбором является повторение 1-й индукционной программы (см. Приложение А3.2). Также может быть использовано сочетание цитарабина** в стандартных дозах (100 мг/м2 2 раза в день или 200 мг/м2 в день непрерывно в 1 - 7-й дни) и идарубицина** (12 мг/м2 1 раз в день в 1 - 3-й дни). Шансы достижения 2-й ПР достаточно высокие ( 70%).
- Рекомендуется пациентам при развитии раннего рецидива ОМЛ (продолжительность 1-й ПР менее 1 года) в качестве 2-й линии терапии использовать цитарабин** в средней (1 г/м2) или высокой (3 г/м2) дозе либо сочетание цитарабина** в высоких дозах с антрациклинами [73, 75, 76].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Рекомендуется пациентам при достижении очередной ремиссии ОМЛ в качестве консолидирующей терапии выполнение алло-ТГСК [77].
Комментарий: если выполнение алло-ТГСК невозможно (например, из-за отсутствия подходящего донора), ауто-ТГСК может рассматриваться в качестве 2-й линии терапии, но ее эффективность четко не определена.
- Рекомендуется у пациентов с тяжелым соматическим статусом, особенно в возрасте старше 45 - 50 лет, длительными периодами цитопении на индукционных курсах, а также при наличии неблагоприятных хромосомных аномалий проведение программы низкодозного воздействия с гипометилирующим праймингом (децитабин/азацитидин**, идарубицин**, цитарабин**) (см. Приложение А3.2) [78].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: выполняют 2 индукционных курса и, если получена ПР, еще 2 консолидирующих. В дальнейшем осуществляют постоянную поддерживающую терапию в течение 3 лет аналогичными курсами без идарубицина**.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: в случае развития осложнений препараты временно отменяются и через 2 - 3 недели прием возобновляют в сниженной дозировке с последующим постепенным возвращением к лечебной дозе.
- Рекомендуется у пациентов с ОМЛ с мутациями гена c-kit или высокой экспрессией на бластных клетках CD117 рассмотреть возможность назначения ингибитора протеинкиназ дазатиниба** (140 мг/сутки постоянно) [80].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Рекомендуется у пациентов с ОМЛ из группы благоприятного цитогенетического прогноза рассмотреть возможность назначения дазатиниба** (140 мг/сутки 14 дней с момента окончания курса ХТ) [80].
- Рекомендуются пациентам при развитии рецидива ОМЛ после алло-ТГСК прекращение иммуносупрессивной терапии и проведение реиндукционного курса "7 + 3" с выполнением в период аплазии на 7-й день после курса трансфузий лимфоцитов донора [81].
Комментарий: пациентам с поздним рецидивом (более 1 года после алло-ТГСК) может быть выполнена 2-я алло-ТГСК после достижения повторной ремиссии.
Лечение рецидивов острого миелоидного лейкоза - принципы
Постремиссионная терапия острого миелоидного лейкоза - трансплантация костного мозга
Несмотря на существующие противоречия относительно формы проведения постремиссионной терапии при остром миелобластном лейкозе (ОМЛ), ее необходимость не вызывает сомнений. Индукционная терапия не в состоянии обеспечить полную эрадикацию лейкозного клона.
Современная терапия острого миелобластного лейкоза (ОМЛ)
1. Острые миелоидные лейкозы:
Индукционная терапия: режимы на основе антрациклина и цитарабина.
Интенсивная постремиссионная терапия: ТКМ или терапия высокими дозами цитарабина необходимы для обеспечения длительной ремиссии.
Поддерживающая терапия обычно не показана, за исключением случаев острого промиелоцитарного лейкоза (ОПЛ).
2. Острый промиелоцитарный лейкоз: Индукционная терапия: ретиноевая кислота в сочетании с режимами, содержащими цитарабин и антрациклин; мероприятия по профилактике и лечению синдрома ДВС: введение криопреципитата или свежезамороженной плазмы для поддержания уровня фибриногена больше 1 г/л; трансфузии тромбоцитов для поддержания количества тромбоцитов больше 50 х 10 9 /л.
3. Рецидив: миелотрансплантация или высокодозная терапия цитарабином.

В связи с эффективностью высоких доз цитарабина при лечении рецидивов острого миелоидного лейкоза (ОМЛ) эта программа применяется и для постремиссионной терапии. Введение цитарабина в дозах от 1 до 3 г/м2 (обычно от 6 до 12 введений каждые 12 часов в виде 3-часовой инфузии) обеспечивает 5-летнюю выживаемость у 30-40% больных, что существенно выше, чем при использовании стандартных режимов консолидации.
Интенсификация высокими дозами цитарабина после достижения полной ремиссии (ПР) на фоне программы «7+3» приводит к длительной безрецидивной выживаемости более чем у 80% больных с прогностически благоприятными изменениями кариотипа, t(8;21) или inv(16). Иногда используется поздняя интенсификация (через 6-12 месяцев после достижения полной ремиссии (ПР)).
Аллогенная трансплантация костного мозга (АлТКМ) или периферических стволовых клеток (АлТСКК) в качестве постремиссионной терапии представляют собой интенсификацию, требующую использования миелоаблативных режимов терапии для максимального уничтожения лейкозных клеток. Донорский костный мозг или СКК периферической крови оказывают иммунологическое действие на реципиента за счет реакции «трансплантат против лейкоза», являющейся частью реакции «трансплантат против хозяина» (РТПХ).

Аллогенная миелотрансплантация в первой полной ремиссии (ПР) является эффективным методом терапии острого миелоидного лейкоза (ОМЛ) у больных моложе 50-55 лет и обеспечивает длительную безрецидивную выживаемость у 45-50% пациентов; рецидив развивается в 10-20% случаев. В настоящее время АлТКМ/ТСКК может быть выполнена у 10% больных острым миелоидным лейкозом (ОМЛ), поэтому интенсивно разрабатываются и внедряются альтернативные виды миелотрансплантации: АлТКМ/ТСКК от неродственных гистосовместимых доноров и после немиелоаблативных режимов кондиционирования.
Трансплантация аутологичного костного мозга (АТКМ) или стволовых клеток периферической крови (АТСКК) — метод высокодозной постремиссионной терапии у больных острым миелоидным лейкозом (ОМЛ), не имеющих совместимого донора. Данный подход исключает возможность развития РТПХ, но при этом существует опасность контаминации трансплантата резидуальными лейкозными клетками. Клиническая эффективность различных методов очистки костного мозга не очевидна. Безрецидивная выживаемость после проведения АТКМ/АТСКК составляет 40-50%.
Таким образом, у молодых больных острым миелоидным лейкозом (ОМЛ) существует три варианта постремиссионной терапии (АлТКМ/АлТСКК, АТКМ/АТСКК и высокодозная химиотерапия), причем существенные различия в общей выживаемости больных отсутствуют (прежде всего за счет высокой токсичности аллогенной трансплантации).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение рецидива острого миелоидного лейкоза - эффективность схем
У большинства больных острым миелобластным лейкозом развивается рецидив. Химиотерапия в этих случаях часто неэффективна, а медиана выживаемости не превышает нескольких месяцев после достижения второй полной ремиссии (ПР). Длительную вторую полную ремисиию (ПР) может обеспечить АлТКМ/АлТСКК, однако отсутствует единое мнение о времени ее выполнения.
Теоретически более правильным является проведение противорецидивного лечения с целью достижения второй полной ремиссии (ПР). У значительной части больных, однако, этого сделать не удается, поэтому часть авторов считает проведение АлТКМ/АлТСКК в раннем рецидиве столь же эффективным, как и миелотрансплантацию после получения второй полной ремиссии (ПР).
Аналогичная стратегия используется при аутологичной трансплантации: больным, у которых была произведена заготовка СКК, может быть выполнена АТКМ/АТСКК как метод индукции второй полной ремиссии (ПР). Длительная безрецидивная выживаемость при второй полной ремиссии (ПР) составляет 30%, при третьей полной ремиссии (ПР) — 20%.
Большинству пациентов миелотрансплантация не может быть выполнена. В этом случае проводится противорецидивная химиотерапия. Прогностическое значение имеет длительность первой полной ремиссии (ПР). Эффективность лечения ниже при раннем рецидиве (длительность первой полной ремиссии (ПР) менее 12 месяцев), а при рецидиве, развившемся ранее 6 месяцев после достижения первой полной ремиссии (ПР), вероятность ответа чрезвычайно низка.
При позднем рецидиве (длительность первой полной ремиссии (ПР) более 12 месяцев) вторая ПР может быть достигнута при использовании прежних индукционных режимов. При планировании лечения следует учитывать характер и интенсивность предшествующей терапии (кумулятивные дозы доксорубицина и даунорубицина не должны превышать 550 мг/м2, митоксантрона — 160 мг/м2, эпирубицина — 1000 мг/м2, винкристина — 15-25 мг/м2).

Большинство пациентов с рецидивом острым миелоидным лейкозом (ОМЛ) не отвечают на проводимую терапию, поэтому проводится поиск методов, способствующих преодолению химиорезистентности. К ним относятся:
1) назначение высоких доз препарата для увеличения его внутриклеточной концентрации;
2) комбинация цитарабина с флударабином;
3) применение колониестимулирующих факторов (КСФ) для стабилизации лейкозных клеток в клеточном цикле и усиления чувствительности к цитостатикам;
4) использование дериватов циклоспорина с целью реверсии mdr-гена (гена «множественной лекарственной устойчивости»).

При развитии рецидива острого миелоидного лейкоза (ОМЛ) после аллогенной миелотрансплантации медиана выживаемости больных составляет 3-4 месяца. В ряде случаев у молодых пациентов с поздним рецидивом может быть выполнена повторная АлТКМ/ТСКК, однако при этом 3-летняя выживаемость не превышает 10%. Альтернативные подходы включают в себя инфузию донорских лимфоцитов или отмену иммуносупрессивной терапии циклоспорином с целью развития реакции «трансплантат против лейкоза».
Проводятся испытания новых методов лечения острого миелоидного лейкоза (ОМЛ), к которым относятся:
1) иммунотерапия (ИЛ-2, анти-CDЗЗ, радиоиммуноконъюгаты с 131I,90Y, дендритические клетки);
2) модуляторы множественной лекарственной устойчивости (велкейд, генасекс, PSC-833);
3) молекулярная терапия (ингибиторы трансмембранной тирозинкиназы, тирозинкиназы c-kit, фарнезилтрансферазы и др.).
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
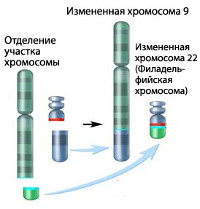
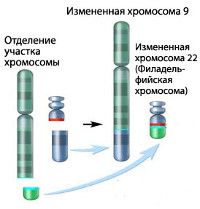
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая – при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Читайте также:
