Легочные вены. Бронхиальные артерии, безымянные вены и верхняя полая вена
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Корниенко Н.А. 1 Чаплыгина Е.В. 1 Каплунова О.А. 1 Корниенко А.А. 2 Каракозова Е.А. 1 Балышев О.О. 1 Марайкин В.О. 1
2 ГБУ РО «Ростовская областная клиническая больница», отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции»
Знание развития легочных вен облегчает понимание морфофункциональных особенностей пациентов с различными формами транспозиции легочных вен, механизмов формирования обструкции легочного венозного кровотока и нарушения гемодинамики, что актуально для совершенствования лечения и повышения качества жизни пациентов. Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий. На основании изучения данных литературы систематизированы имеющиеся сведения об аномалиях развития легочных вен, уточнены основные этапы развития легочных вен в антенатальном периоде развития. Процесс, в котором недифференцированная спланхническая легочная сеть консолидирует в легочные вены, объясняет большинство их вариантов и аномалий. Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих аномальный дренаж легочных вен, когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.

1. Чаплыгина Е.В., Корниенко Н.А., Каплунова О.А., Корниенко А.А. Особенности анатомического строения задненижнего отдела правого предсердия у людей различных конституциональных типов // Морфология. 2013. Т. 144. № 6. С. 33-36.
4. Eidem B.W., Cetta F., O′Leary P.W. Echocardiography in Pediatric and Adult Congenital Heart Disease. Philadelphia, 2009. 500 p.
5. Русаков Д.Ю., Вологдина Н.Н., Тулаева О.Н. Развитие исчерченной сердечной мышечной ткани в стенках полых и легочных вен // Журнал анатомии и гистопатологии. 2015. Т. 4. № 3. С. 105-105. DOI: 10.18499/2225-7357-2015-4-3-105-105.
7. Farmer C.G. Evolution of the vertebrate cardio-pulmonary system. Annu Rev Physiol. 1999. Vol. 61. P. 573–592. DOI: 10.1146/annurev.physiol.61.1.573.
8. Van den Berg G., Moorman A.F.M. Development of the Pulmonary Vein and the Systemic Venous Sinus: An Interactive 3D Overview. PLoS One. 2011. Vol. 6. no 7. Р. e22055. DOI: 10.1371/journal.pone.0022055.
9. Ho M.-L., Bhalla S., Bierhals A., Gutierrez F. MDCT of partial anomalous pulmonary venous return (PAPVR) in adults. Journal of Thoracic Imaging. 2009. Vol. 24. no 2. P. 89-95. DOI: 10.1097/RTI.Ob013e318194c942.
10. Kirklin J.W., Barratt-Boyes B.G. Total anomalous pulmonary venous connection. In Kirklin J.W., Barratt-Boyes B.G. (eds). Cardiac Surgery. Fourth Edition. Saunders. 2013. P. 1182-1208.
11. Haghigh Z.O., Sadeghpour A., Alizadehasl A. Isolated right sided anomalous pulmonary venous connection associated with significant right ventricular enlargement and intact interatrial septum. J. Cardiovasc Thorac Res. 2012. Vol. 4. no 4. P. 123-124. DOI: 10.5681/jcvtr.2012.029.
12. Podzolkov V.P., Chiaureli M.R., Kovalev D.V., Zaets S.B. Repair of isolated partial anomalous pulmonary venous connection of the right upper pulmonary veins to the left vertical vein. Interactive CardioVascular and Thoracic Surgery. 2016. Vol. 23. no 3. P. 501-502. DOI: 10.1093/icvts/ivw151.
14. Клинические рекомендации. Тотальный аномальный дренаж легочных вен. МКБ 10: Q26.2. Ассоциация сердечно-сосудистых хирургов России. 2016.
15. Клинические рекомендации: Частичный аномальный дренаж легочных вен (ЧАДЛВ), МКБ 10: Q26.3. Ассоциация сердечно-сосудистых хирургов России. 2016.
16. Schmiady M., Valsangiacomo-Buechel E., Hübler M., Dave H. Significance of preoperative imaging in children with total anomalous pulmonary venous connection. European Heart Journal. 2017. Vol. 38. Is. 26. P. 2040. DOI: 10.1093/eurheart/ehw515.
17. Graig J.M., Darling R.C., Rothney W.B. Total pulmonary venous drainage into the right side of the heart: report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab. Invest. 1957. Vol. 6 (1). P. 44-64.
18. Купряшов А.А. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен. В кн.: Бокерия Л.А., Шаталов К.В. (ред.). Детская кардиохирургия: руководство для врачей. ФГБУ "НМИЦССХ им. А. Н. Бакулева" МЗ РФ, 2016. С. 294-312.
19. Бокерия Л.А., Беришвили Д.О., Нефедова И.Е., Баринштейн Д.Б., Степаничева О.А. Хирургическая коррекция транспозиции магистральных артерий с тотальным дренажем легочных вен в портальную вену // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2019. Т. 20. № 1. С. 77-80. DOI: 10.24022/1810-0694-2019-20-1-77-80.
20. Абдуллаев Ф.З., Багиров И.М., Казимзаде Н.Дж., Шихиева Л.С., Байрамов Р.Б., Рустамова Я.К., Самедов Р.Р. Коррекция тотального аномального дренажа легочных вен у взрослых больных // Кардиология и сердечно-сосудистая хирургия. 2015. № 6. С. 74-79. DOI: 10.17116/kardio20158674-79.
Известно, что в структуре общей заболеваемости и смертности в мире доминируют сердечно-сосудистые заболевания. Врожденные пороки развития по частоте занимают 4-е место среди причин летальности у детей до 5 лет, составляя при этом 13%. Появление высокотехнологичных диагностических методов, таких как компьютерная и магнитно-резонансная томография, электроанатомическое картирование, расширило возможности не только клиницистов, но и морфологов [1, 2].
Наряду с лечением приобретенных нарушений работы сердечно-сосудистой системы современная кардиология все большее внимание уделяет диагностике и лечению врожденных пороков развития сердца и сосудов. Одним из методов лечения является транспозиция легочных вен, когда легочные вены имеют атипичное расположение и место впадения [3].
Несмотря на единичные работы, посвященные развитию исчерченной сердечной мышечной ткани в стенках легочных вен [4, 5], нет работ, систематизирующих сведения о развитии и аномалиях легочных вен.
Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий.
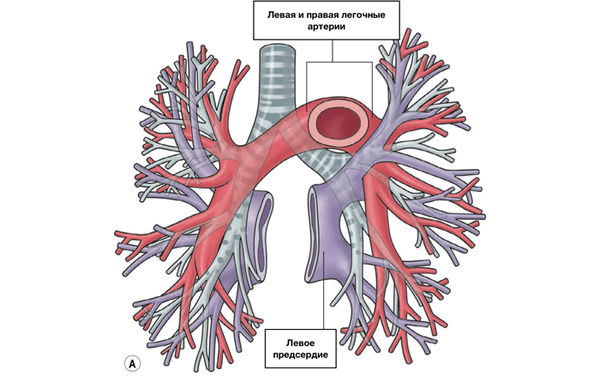
Известно, что во время раннего эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения, связанного с передними кардинальными и желточно-брыжеечными венами, но не связанного с сердцем (рис. 1) [6].
Выпячивание левого предсердия соединяется с сосудистым руслом легких общей легочной веной. Общая легочная вена, также называемая легочным венозным коллектором, полностью соединяется с нижним отделом левого предсердия в течение первого месяца внутриутробного периода развития. При присоединении легочной вены связи спланхнического сплетения исчезают. Легочная вена, вначале единая, делится на две вены – левую и правую легочные вены. В свою очередь, обе эти вены делятся на две ветви, предназначенные для каждой половины легких, так что потом в левое предсердие впадают четыре самостоятельные легочные вены.
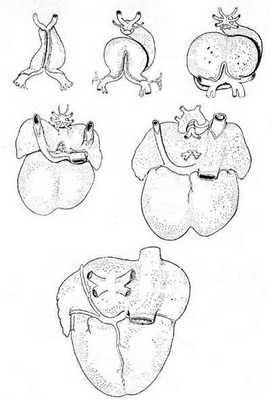
Рис. 1. Шесть стадий развития сердца, отражающих изменение отношений венозного синуса и впадающих в сердце крупных вен; вид сзади [6]
Известны основные принципы развития легочных вен. На ранних эмбриональных стадиях развития имеется сосудистое сплетение, окружающее первичную кишку. Одновременно с образованием дыхательной системы из выпячивания первичной кишки, от общего сосудистого сплетения отделяются отток венозной крови от органов пищеварительной системы и отток от органов дыхательной системы [7].
Филогенетически легочные вены возникают как самостоятельные сосуды, отводящие кровь из зачатков легких [4]. Они сходятся в общий ствол, несущий кровь в левое предсердие с дорзальной стороны. По мере роста сердца этот ствол постепенно врастает в стенку предсердия, а из четырех его притоков образуются легочные вены.
В период эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения [4], которое не имеет связи с сердцем, однако соединяется с передними кардинальными и желточно-брыжеечными венами (рис. 2А).
По данным B.W. Eidem et al. [4], выпячивание левого предсердия соединяется с сосудистым руслом легких легочным венозным коллектором (общей легочной веной), который полностью соединяется с левым предсердием в течение первого месяца внутриутробного периода развития (рис. 2Б). При этом присоединении связи спланхнического сплетения, т.е. кардинальных и желточно-брыжеечных вен, с предсердием исчезают (рис. 2С). Легочная вена, вначале единая, делится на парные легочные вены (рис. 2Д). Эти вены также делятся на две ветви, каждая из них самостоятельно впадает в левое предсердие. Аномалии количества легочных вен проявляются их уменьшением до трех или двух или появлением добавочных легочных вен с нормальным или аномальным дренажом [3].
Исторически предметом дискуссий является связь между легочной веной и системными венозными притоками. Широко обсуждался вопрос: становится ли легочная вена непосредственно связанной с левым предсердием? Выполненные Van den Berg [8] исследования показали, как развивается легочная вена при отделении от большого венозного сплетения, расположенного в мезодерме спланхноплевры и простирающегося от сердца к печени, что предполагает развитие венозного полюса сердца и возникновение клинических проявлений аномального дренажа легочных вен (АДЛВ). Системные венозные притоки, напротив, развиваются латерально на стыке между висцеральной и соматической мезодермой из мезенхимы, окружающей общие кардинальные вены. Концепция Van den Berg [8] формирования легочной вены из этого большого спланхнического сплетения предлагает полезную информацию о развитии венозного полюса сердца, клинических проявлениях аномального легочного венозного возврата и проливает свет на эволюционные аспекты развития сердца.
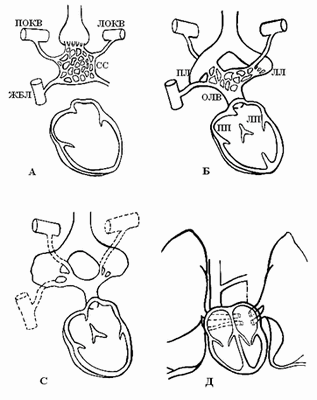
Рис. 2. Развитие легочных вен [4]. ЛОКВ – левая общая кардинальная вена, ПОКВ – правая общая кардинальная вена, ЖБВ – желточно-брыжеечная вена, ОЛВ – общая легочная вена, ЛП – левое предсердие, СС – спланхническое сплетение, ЛЛ, ПЛ – зачатки левого и правого легких
Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих АДЛВ [9], когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие.
При формировании АДЛВ левые легочные вены соединяются с левой плечеголовной веной, венечным синусом, развивающимися из левой кардинальной вены [10, 11], а правые – с полыми венами или с правым предсердием. Спланхническое сплетение располагается по центру эмбриона, что объясняет возможность оттока крови от легких слева или справа в систему правой кардинальной вены. Наиболее часто такой аномальный сброс формируется от верхних долей легких [10, 12].
При АДЛВ наблюдаются увеличение легочного кровотока и перегрузка правой половины сердца [13]. АДЛВ может также входить в состав комбинированных пороков сердца [6].
АДЛВ может быть тотальным (ТАДЛВ) или частичным (ЧАДЛВ). При ТАДЛВ все легочные вены впадают в другие вены или в правое предсердие [4, 14, 15]. Развитие ТАДЛВ связано с нехваткой выпячивания легочных вен от задней поверхности левого предсердия для соединения с легочно-венозным сплетением, окружающим легочные ростки. За небольшим исключением обязательным компонентом, позволяющим поддерживать гемодинамику при ТАДЛВ, являются дефект межпредсердной перегородки или открытое овальное окно [13].
Выделяют 4 формы ТАДЛВ [4]: 1) кардиальная форма – легочной венозный коллектор впадает в венечный синус сердца или в правое предсердие (рис. 3-1); 2) подкардиальная форма – легочной венозный коллектор впадает в нижнюю полую вену (рис. 3-2); 3) надкардиальная форма – легочные вены впадают в коллектор, а он – в левую плечеголовную вену (рис. 3-3); 4) смешанная форма – два легочных венозных коллектора впадают в правое предсердие или в полые вены.
Помимо этого, каждая из анатомических форм ТАДЛВ с различной частотой встречаемости может сопровождаться обструкцией легочного венозного возврата, что оказывает решающее влияние на состояние гемодинамики и клинические проявления порока< [15]. ТАДЛВ составляет 1,5–3% случаев в общей структуре аномалий развития сердца [10]. ТАДЛВ редко встречается у людей старше 18–20 лет, что связано с высокой частотой смертности в раннем детстве (50% детей погибают в первые 3 месяца и более 80% – к концу первого года жизни ребенка) [15].
Данный порок формируется посредством атрезии справа или слева крупной ветви общего легочного сплетения [9].
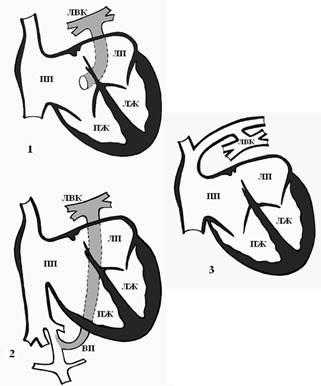
Рис. 3. Формы тотального аномального дренажа легочных вен [4]: 1 – кардиальная форма – в венечный синус, 2 – подкардиальная форма – в нижнюю полую вену, 3 – надкардиальная форма – в левую плечеголовную вену. ЛВК – легочный венозный коллектор, ЛПВ – левая плечеголовная вена, ВПВ – верхняя полая вена, ВП – венозный проток, ПП – правое предсердие, ПЖ – правый желудочек, ЛП – левое предсердие, ЛЖ – левый желудочек
Легочные вены могут впадать в правое предсердие, венечный синус, притоки полых вен [14, 15]. По данным различных исследователей, частота встречаемости ЧАДЛВ колеблется от 0,7% до 9,4% и составляет около 2/3 всех случаев аномального дренажа легочных вен [12, 16]. Половина пациентов с изолированным ЧАДЛВ способны дожить до 30–40 лет [12].
При ЧАДЛВ в функциональном аспекте принципиальны анатомические особенности левой части сердца. Такие изменения, естественно, отражаются на состоянии системной гемодинамики, что вызывает снижение размеров левого предсердия [10, 11].
Наиболее распространенной классификацией ЧАДЛВ является классификация R.S. Darling et al. [17], в основе которой, как и при ТАДЛВ, лежит анатомический принцип уровня впадения легочных вен. Выделяют четыре типа порока:1) супракардиальный, когда легочные вены впадают в левую безымянную, верхнюю полую вены или в одну из их ветвей; 2) кардиальный – дренирование всех или части легочных вен в полость правого предсердия; 3) инфракардиальный – часть легочных вен впадает в венозный сосуд, расположенный ниже сердца; 4) смешанный.
Пациентам с подозрением на ЧАДЛВ показано выполнение МРТ для оценки анатомических особенностей легочных вен, особенно при неубедительных результатах ЭхоКГ [18].
Катетеризация сердца с ангиографией показана при подозрении на легочную гипертензию или для выявления сопутствующих аномалий сердца [18, 19].
Единственным способом устранения ТАДЛВ является ее кардиохирургическая коррекция [19, 20]. Несмотря на современные достижения в области хирургической техники, не существует универсального подхода к выбору оптимальной хирургической коррекции сложных вариантов аномального дренажа легочных вен [3, 13, 19]. Общая хирургическая летальность при изолированном ТАДЛВ достигает 16% [15], летальность при коррекции ЧАДЛВ не превышает 1–2% [3]. Основным осложнением и основной причиной повторной операции в хирургии ТАДЛВ является возникновение легочной венозной обструкции [3].
Заключение. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.
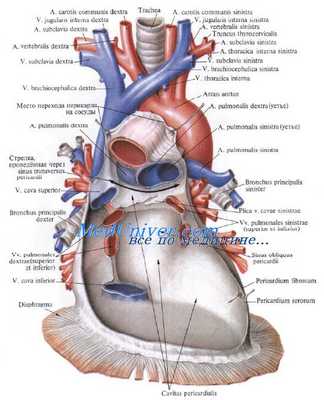
Легочные вены. Бронхиальные артерии, безымянные вены и верхняя полая вена
Легочные капилляры, сливаясь, образуют посткапилляры, из которых в свою очередь формируются венулы по две в каждой легочной дольке, располагающиеся по периферии ее. Периферическое расположение характерно и для сегментарных вен в отличие от бронхов и артерий, располагающихся в центре сегмента.
В корне легкого сегментарные вены сливаются в два крупных венозных ствола: верхнюю и нижнюю легочные вены. Нижняя легочная вена справа и слева является коллектором для вен нижней доли. Верхняя легочная вена слева образуется путем слияния сегментарных вен верхней доли, тогда как справа она принимает также вены средней доли.
Венозная система легких более вариабельна, чем артериальная. Это касается и магистральных венозных стволов. Так, верхняя и нижняя легочные вены могут сливаться и впадать в левое предсердие общим стволом; напротив, иногда наблюдается раздельное впадение в предсердие четырех зональных вен. К порокам развития относится впадение легочной вены в правое предсердие.
Определяемые на ангиопульмонограмме проекционные отношения артерий и вен детально разработаны В. Я. Фридкиным.
Бронхиальные артерии. Характерной особенностью легких является двойное кровоснабжение, причем питание бронхов и паренхимы легких обеспечивается бронхиальными артериями, относящимися к большому кругу кровообращения.
Бронхиальные артерии начинаются от нисходящей аорты наз уровне 4-го грудного позвонка. Слева их две, справа — одна. Правая бронхиальная артерия в части случаев начинается or правой третьей межреберной артерии.
Бронхиальные вены впадают справа в непарную вену, слева — в полунепарную или межреберные вены. Множество мелких бронхиальных вен впадает в легочные вены.
Бронхиальные и легочные артерии образуют систему анастомозов между большим и малым кругом кровообращения. Эти анастомозы располагаются преимущественно в области респираторных бронхиол и под плеврой и представляют собой артерии замыкающего типа. Кровоток в бронхопульмональных анастомозах направлен из большого круга в малый и усиливается при патологических процессах, вызывающих нарушение кровотока в легочной артерии.
Расширение бронхиальных сосудов и бронхопульмональных анастомозов наблюдается при гипертонии малого круга кровообращения и в области воспалительных очагов легочной паренхимы.
Безымянные вены и верхняя полая вена
Эти сосуды первыми контрастируются при общей ангиопульмонографии, и изменения их свидетельствуют о наличии первичного или вторичного патологического процесса в средостении.
Правая и левая безымянные вены образуются путем слияния соответствующих внутренней яремной и подключичной вен на уровне грудинно-ключичных сочленений. Левая безымянная вена имеет длину около 6 см, правая — около 2,5 см; последняя — больше по диаметру (Д. Надь).
Верхняя полая вена образуется на уровне первого правого реберно-грудинного сочленения путем слияния левой и правой безымянных вен и идет вертикально вниз. На уровне нижнего края третьего правого реберного хряща она впадает в правое предсердие. Длина верхней полой вены около 6—7 см, диаметр — 15—25 мм.
Правый край верхней полой вены проходит приблизительно на 0,5 см кнаружи от правого края грудины. На левом внутреннем крае вены на ангиограммах может определяться дугообразное вдавление, обусловленное прилежанием дуги аорты (А. Н. Новиков, А. X. Трахтенберг, С. Я. Марморштейн).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Анатомия сосудов легких. Легочная артерия
Предметом изучения в настоящей статье являются сосуды, катетеризируемые и контрастируемые при ангиопульмонологическом исследовании. К ним относятся сосуды малого круга кровообращения (легочная артерия и ее ветви, легочные капилляры и легочные вены), бронхиальные артерии, безымянные и верхняя полая вены, непарная и полунепарная вены.
Легочная артерия. Общая легочная артерия (по PNA — легочный ствол) начинается от артериального конуса правого желудочка и располагается внутриперикардиально спереди и слева от восходящей аорты. Длина общей легочной артерии варьирует в пределах 4—6 см, диаметр ее составляет в среднем 2,5—3,5 см (Н. П. Бисенков, 1956; Д. Надь, 1959).
Общая легочная артерия у взрослых несколько шире аорты, отличаясь от последней более тонкой и растяжимой стенкой. На ангиопульмонограммах общая легочная артерия проецируется на уровне 6—7-го грудных позвонков слева от средней линии. Проецируется она на уровне тела 7-го грудного позвонка.
До вступления в ворота легкого правая легочная артерия делится на верхнюю и нижнюю ветви (последнюю еще называют междолевой).
Верхняя ветвь правой легочной артерии делится на две или три сегментарных ветви, идущие к 1, 2 и 3-му сегментам верхней доли. Последний в большинстве случаев получает сегментарную ветвь также из нижней (междолевой) ветви правой легочной артерии.
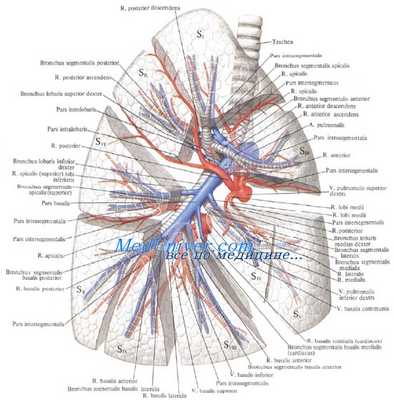
Элементы корня правого легкого - сосуды, бронхи
Левая легочная артерия может разделяться на две ветви — верхнюю и нижнюю, аналогично правой (Е. С. Серова, 1962), но, по данным В. Я. Фридкина (1963), Д. Надя (1959) и других, в большинстве случаев общий ствол, идущий к верхней доле, отсутствует и сегментарные ветви к верхней доле, включая язычковые сегменты, отходят от общего ствола левой легочной артерии.
Деление ветви левой легочной артерии, идущей к нижней доле, в целом аналогично строению артерий нижней доли правого легкого (В. Я. Фридкин, 1963).
Разветвления легочных артерий в основном соответствуют сегментарному строению легких, и сегментарные и субсегментарные артерии обычно следуют за соответствующими бронхами и носят те же наименования. При этом индивидуальные различия в форме ветвления легочных артерий весьма различны (Н. П. Бисенков, 1955).
По гистологическому строению артерии легких относятся к сосудам мышечно-эластического типа, тогда как в мелких артериях (диаметром менее 1 мм) мышечные волокна преобладают. В артериолах мышечный слой представляется неполным, а в прекапиллярах он полностью отсутствует.
Легочные капилляры образуют густую ячеистую сеть, располагающуюся в межальвеолярных перегородках. Протяженность легочного капилляра составляет 60—250 микрон, диаметр — около 10 микрон. На ангиопульмонограммах отдельные капилляры не контурируются и капиллярная сеть имеет вид равномерного затемнения с четкими границами.
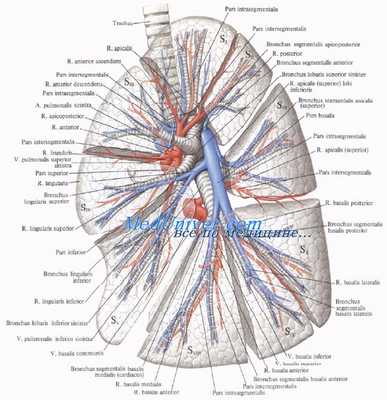
Элементы корня левого легкого - сосуды, бронхи
Сосуды легких
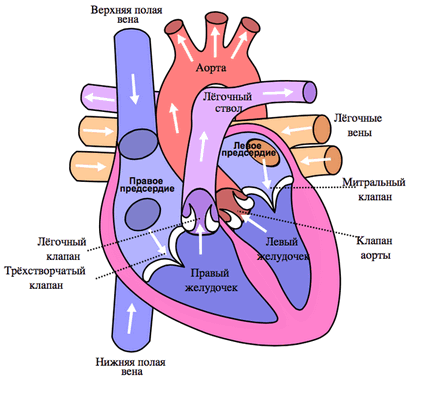
Легочный ствол (truncus pulmonalis) диаметром 30 мм выходит из правого желудочка сердца, от которого он отграничен своим клапаном. Начало легочного ствола и соответственно его отверстие проецируются на переднюю грудную стенку над местом прикрепления хряща III левого ребра к грудине. Легочный ствол расположен кпереди от остальных крупных сосудов основания сердца (аорты и верхней полой вены). Справа и позади него находится восходящая часть аорты, а слева прилежит левое ушко сердца. Легочный ствол, находящийся в перикардиальной полости, направляется впереди аорты влево и кзади и на уровне IV грудного позвонка (хряща II левого ребра) делится на правую и левую легочные артерии. Это место называется бифуркацией легочного ствола (bifurcаtio tninci pulmonalis). Между бифуркацией легочного ствола и дугой аорты расположена короткая артериальная связка(ligamentum arteriosum), представляющая собой заросший артериальный (боталлов) проток (ductus arteriosus).
Правая легочная артерия (a.pulmonаlis dextra) диаметром 21 мм следует вправо к воротам правого легкого позади восходящей части аорты и конечного отдела верхней полой вены и кпереди от правого бронха. В области ворот правого легкого впереди и под правым главным бронхом правая легочная артерия разделяется на три долевые ветви. Каждая долевая ветвь в соответствующей доле легкого в свою очередь делится на сегментарные ветви. В верхней доле правого легкого различают верхушечную ветвь (r.apicаlis), задние нисходящую и восходящую ветви (rr.posteriores descendens et ascendens), передние нисходящую и восходящую ветви(rr.anteriores descendens et ascendens), которые следуют в верхушечный, задний и передний сегменты правого легкого.
Ветвь средней доли (rr.lobi medii) делится на две ветви — латеральную и медиальную (r.lateralis et r.mediаlis).
Эти ветви идут к латеральному и медиальному сегментам средней доли правого легкого. К ветвям нижней доли (rr.lobi inferioris) относятся верхняя (верхушечная) ветвь нижней доли [r.superior (apicаlis) lobi inferioris], направляющаяся к верхушечному (верхнему) сегменту нижней доли правого легкого, а также базальная часть(pars basаlis). Последняя делится на 4 ветви: медиальную, переднюю, латеральную и заднюю (rr.basаles mediаlis, anterior, laterаlis et posterior). Они несут кровь в одноименные базальные сегменты нижней доли правого легкого.
Левая легочная артерия (a.pulmonаlis sinistra) короче и тоньше правой, проходит от бифуркации легочного ствола по кратчайшему пути к воротам левого легкого в поперечном направлении впереди нисходящей части аорты и левого бронха. На своем пути артерия перекрещивает левый главный бронх, а в воротах легкого располагается над ним. Соответственно двум долям левого легкого легочная артерия делится на две ветви. Одна из них распадается на сегментарные ветви в пределах верхней доли, вторая — базальная часть — своими ветвями кровоснабжает сегменты нижней доли левого легкого.
К сегментам верхней доли левого легкого направляются ветви верхней доли (rr.lobi superioris), которые отдают верхушечную ветвь(r.apicаlis), передние восходящую и нисходящую (rr.anteriores ascendens et descendens), заднюю (r.posterior) и язычковую(r.lingulаris) ветви. Верхняя ветвь нижней доли (r.superior lobi inferioris), как и в правом легком, следует в нижнюю долю левого легкого, к его верхнему сегменту. Вторая долевая ветвь — базальная часть (pars basаlis) делится на четыре базальные сегментарные ветви: медиальную, латеральную, переднюю и заднюю (rr.basаles mediаlis, laterаlis, anterior et posterior), которые разветвляются в соответствующих базальных сегментах нижней доли левого легкого.
В ткани легкого (под плеврой и в области дыхательных бронхиол) мелкие ветви легочной артерии и бронхиальных ветвей, отходящих от грудной части аорты, образуют системы меж- артериальных анастомозов. Эти анастомозы являются единственным местом в сосудистой системе, в котором возможно движение крови по короткому пути из большого круга кровообращения непосредственно в малый круг.
На рисунке представлены артерии, соответствующие сегментам легких.
Правое лёгкое
Верхняя доля
- верхушечный (S1);
- задний (S2);
- передний (S3).
Средняя доля
Нижняя доля
- верхний (S6)
- ;медиобазальный (S7);
- переднебазальный (S8);
- латеральнобазальный (S9);
- заднебазальный (S10).
Левое лёгкое
- верхушечно-задний (S1+2);
- передний (S3);
- верхний язычковый (S4);
- нижний язычковый (S5).
- верхний (S6);
- переднебазальный (S8);
- латеральнобазальный, или латеробазальный (S9);
- заднебазальный (S10).
ЛЕГОЧНЫЕ ВЕНЫ
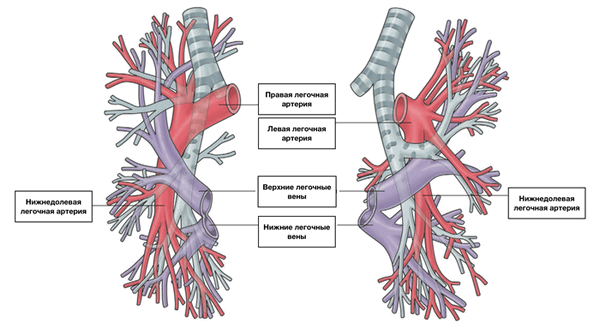
Из капилляров легкого начинаются венулы, которые сливаются в более крупные вены и в каждом легком формируют по две легочные вены.
Из двух правых легочных вен больший диаметр имеет верхняя, так как по ней оттекает кровь от двух долей правого легкого (верхней и средней). Из двух левых легочных вен больший диаметр имеет нижняя вена. В воротах правого и левого легких легочные вены занимают их нижнюю часть. В задней верхней части корня правого легкого расположен главный правый бронх, кпереди и книзу от него — правая легочная артерия.
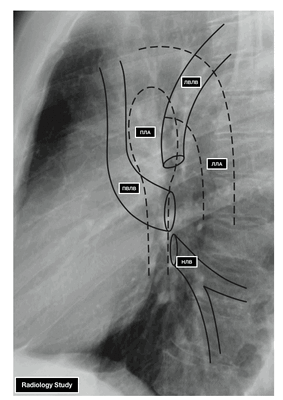
- ЛВЛВ — левая верхняя легочная вена
- ПВЛВ — правая верхняя легочная вена
- НЛВ — нижняя легочная вена
- ПЛА — правая легочная артерия
- ЛЛА — левая легочная артерия
У левого легкого сверху находится легочная артерия, кзади и книзу от нее — левый главный бронх. У правого легкого легочные вены лежат ниже артерии, следуют почти горизонтально и на своем пути к сердцу располагаются позади верхней полой вены, правого предсердия и восходящей части аорты. Обе левые легочные вены, которые несколько короче правых, находятся под левым главным бронхом и направляются к сердцу также в поперечном направлении, кпереди от нисходящей части аорты. Правые и левые легочные вены, прободая перикард, впадают в левое предсердие (их конечные отделы покрыты эпикардом).
Правая верхняя легочная вена (v.pulmonаlis dextra superior) собирает кровь не только от верхней, но и от средней доли правого легкого. От верхней доли правого легкого кровь оттекает по трем венам (притокам): верхушечной, передней и задней. Каждая из них в свою очередь формируется из слияния более мелких вен: внутрисегментарной, межсегментарной и др. От средней доли правого легкого отток крови происходит по вене средней доли(v.lobi medii), образующейся из латеральной и медиальной частей (вен).
Правая нижняя легочная вена (v.pulmonаlis dextra inferior) собирает кровь от пяти сегментов нижней доли правого легкого: верхнего и базальных — медиального, латерального, переднего и заднего. От первого из них кровь оттекает по верхней вене, которая образуется в результате слияния двух частей (вен) — внутрисегментарной и межсегментарной. От всех базальных сегментов кровь оттекает по общей базальной вене, формирующейся из двух притоков — верхней и нижней базальных вен. Общая базальная вена, сливаясь с верхней веной нижней доли, формирует правую нижнюю легочную вену.
Левая верхняя легочная вена (v.pulmonаlis sinistra superior) собирает кровь из верхней доли левого легкого (ее верхушечнозаднего, переднего, а также верхнего и нижнего язычковых сегментов). Эта вена имеет три притока: задневерхушечную, переднюю и язычковую вены. Каждая из них образуется из слияния двух частей (вен): задневерхушечная вена — из внутрисегментарной и межсегментарной; передняя вена — из внутрисегментарной и межсегментарной и язычковая вена — из верхней и нижней частей (вен).
Левая нижняя легочная вена (v.pulmonаlis sinistra inferior) более крупная, чем одноименная правая вена, выносит кровь из нижней доли левого легкого. От верхнего сегмента нижней доли левого легкого отходит верхняя вена, которая образуется из слияния двух частей (вен) — внутрисегментарной и межсегментар- ной. От всех базальных сегментов нижней доли левого легкого, как и в правом легком, кровь оттекает по общей базальной вене. Она образуется от слияния верхней и нижней базальных вен. В верхнюю из них впадает передняя базальная вена, которая, в свою очередь, сливается из двух частей (вен) — внутрисегментарной и межсегментарной. В результате слияния верхней вены и общей базальной вены формируется левая нижняя легочная вена.
Синдром верхней полой вены ( Кава-синдром , СВПВ )
Синдром верхней полой вены – это симптомокомплекс, развивающийся вследствие нарушения кровообращения в системе верхней полой вены и затруднения оттока венозной крови от верхних отделов туловища. Классическими признаками синдрома верхней полой вены служат: цианоз; одутловатость головы, шеи, верхних конечностей, верхней половины грудной клетки; расширение подкожных вен; одышка, охриплость голоса, кашель и др. Нередко развиваются общемозговые, глазные, геморрагические проявления. Диагностический алгоритм может включать проведение рентгенографии ОГК, венокаваграфии, КТ и МРТ грудной клетки, УЗДГ, медиастиноскопии, торакоскопии с биопсией. При синдроме может быть предпринята эндоваскулярная баллонная ангиопластика и стентирование, тромбэктомия, резекция ВПВ, обходное шунтирование, паллиативное удаление опухоли с целью декомпрессии средостения.
МКБ-10

Общие сведения
Под синдромом верхней полой вены (СВПВ), или кава-синдромом, понимают вторичное патологическое состояние, осложняющее многие заболевания, связанные с поражением органов средостения. В основе кава-синдрома лежит экстравазальная компрессия или тромбоз верхней полой вены, нарушающие отток венозной крови от головы, плечевого пояса и верхней половины туловища, что может приводить к жизнеугрожающим осложнениям. Синдром верхней полой вены в 3-4 раза чаще развивается у пациентов мужского пола в возрасте 30-60 лет. В клинической практике с синдромом верхней полой вены приходится сталкиваться специалистам в области торакальной хирургии и пульмонологии, онкологии, кардиохирургии, флебологии.
Верхняя полая вена (ВПВ) располагается в среднем средостении. Она представляет собой тонкостенный сосуд, окруженный плотными структурами - грудной стенкой, аортой, трахеей, бронхами, цепочкой лимфоузлов. Особенности строения и топографии ВПВ, а также физиологически низкое венозное давление обусловливают легкое возникновение обструкции магистрального сосуда. Через ВПВ оттекает кровь от головы, шеи, верхнего плечевого пояса и верхних отделов грудной клетки. Верхняя полая вена имеет систему анастомозов, выполняющих компенсаторную функцию при нарушении проходимости ВПВ. Однако венозные коллатерали не могут полностью заменить ВПВ. При синдроме верхней полой вены давление в ее бассейне может достигать 200-500 мм вод. ст.
Причины СВПВ
Развитию синдрома верхней полой вены могут способствовать следующие патологические процессы: экстравазальная компрессия ВПВ, опухолевая инвазия стенки ВПВ или тромбоз. В 80-90% случаев непосредственными причинами кава-синдрома выступают рак легкого, преимущественно правосторонней локализации (мелкоклеточный, плоскоклеточный, аденокарцинома); лимфогранулематоз, лимфомы; метастазы рака молочной железы, рака простаты и рака яичка в средостение; саркома и др.
В остальных случаях к компрессии ВПВ могут приводить доброкачественные опухоли средостения (кисты, тимомы), фиброзный медиастинит, аневризма аорты, констриктивный перикардит, инфекционные поражения: (сифилис, туберкулез, гистоплазмоз), загрудинный зоб. Синдром верхней полой вены может быть обусловлен тромбозом ВПВ, развивающимся на фоне длительной катетеризации вены центральным венозным катетером или пребывания в ней электродов электрокардиостимулятора.
Симптомы СВПВ
Клинические проявления синдрома верхней полой вены обусловлены повышением венозного давления в сосудах, кровь от которых в норме оттекает через ВПВ или безымянные вены. На выраженность проявлений влияют скорость развития синдрома верхней полой вены, уровень и степень нарушения кровообращения, адекватность коллатерального венозного оттока. В зависимости от этого клиническое течение синдром верхней полой вены может быть медленно прогрессирующим (при компрессии и инвазии ВПВ) или острым (при тромбозе ВПВ).
Классическая триада, характеризующая синдром верхней полой вены, включает отек, цианоз и расширение поверхностных вен на лице, шее, верхних конечностях и верхней половине туловища. Пациентов может беспокоить одышка в покое, приступы удушья, охриплость голоса, дисфагия, кашель, боли в груди. Указанные симптомы усиливаются в положении лежа, поэтому больные вынуждены принимать в постели полусидячее положение. В трети случаев отмечается стридор, обусловленный отеком гортани и угрожающий обструкцией дыхательных путей.
Осложнения
Часто при синдроме верхней полой вены развиваются носовые, легочные, пищеводные кровотечения, вызванные венозной гипертензией и разрывом истонченных стенок сосудов.
Нарушение венозного оттока из полости черепа приводит к развитию церебральных симптомов:
- головной боли
- шума в голове
- сонливости
- спутанности и потери сознания.
В связи с нарушением функции глазодвигательных и слуховых нервов могут развиваться:
- диплопия
- двусторонний экзофтальм
- слезотечение
- утомляемость глаз
- снижение остроты зрения
- слуховые галлюцинации
Диагностика
Физикальное обследование пациента с синдромом верхней полой вены выявляет набухание вен шеи, расширенную сеть подкожных венозных сосудов на груди, полнокровие или цианоз лица, отек верхней половины туловища. При подозрении на синдром верхней полой вены всем больным показано рентгенологическое обследование - рентгенография грудной клетки в двух проекциях, томография (компьютерная, спиральная, магнитно-резонансная). В некоторых случаях для определения локализации и выраженности венозной обструкции прибегают к проведению флебографии (венокаваграфии).

КТ органов грудной клетки. Резкое сужение просвета верхней полой вены за счет прорастания в нее опухоли средостения с выраженным затруднением оттока венозной крови от головы и верхних конечностей
С целью дифференциальной диагностики тромбоза ВПВ и обструкции извне показана УЗДГ сонных и надключичных вен. Осмотр глазного дна офтальмологом позволяет выявить извитость и расширение вен сетчатки, отек перипапиллярной области, застойный диск зрительного нерва. При измерении внутриглазного давления может отмечаться его значительное повышение.
Для определения причин синдрома верхней полой вены и верификации морфологического диагноза может потребоваться проведение бронхоскопии с биопсией и забором мокроты; анализа мокроты на атипичные клетки, цитологического исследования промывных вод из бронхов, биопсии лимфатического узла (прескаленной биопсии), стернальной пункции с исследованием миелограммы. При необходимости может выполняться диагностическая торакоскопия, медиастиноскопия, медиастинотомия или парастернальная торакотомия для ревизии и биопсии средостения.
Дифференциальную диагностику кава-синдрома проводят с застойной сердечной недостаточностью: при синдроме верхней полой вены отсутствуют периферические отеки, гидроторакс, асцит.
Лечение СВПВ
Симптоматическое лечение синдрома верхней полой вены направлено на повышение функциональных резервов организма. Оно включает назначение низкосолевой диеты, ингаляций кислорода, диуретиков, глюкокортикоидов. После установления причины, вызвавшей развитие синдрома верхней полой вены, переходят патогенетическому лечению.
Так, при синдроме верхней полой вены, обусловленном раком легкого, лимфомой, лимфогранулематозом, метастазами опухолей других локализаций, проводится полихимиотерапия и лучевая терапия. Если развитие синдрома верхней полой вены вызвано тромбозом ВПВ, назначается тромболитическая терапия, проводится тромбэктомия, в некоторых случаях – резекция сегмента верхней полой вены с замещением резецированного участка венозным гомотрансплантатом.
При экстравазальной компрессии ВПВ радикальные вмешательства могут включать расширенное удаление опухоли средостения, удаление медиастинальной лимфомы, торакоскопическое удаление доброкачественной опухоли средостения, удаление кисты средостения и др. В случае невозможности выполнения радикальной операции прибегают к различным паллиативным хирургическим вмешательствам, направленным на улучшение венозного оттока: удалению опухоли средостения с целью декомпрессии, обходному шунтированию, чрескожной эндоваскулярной баллонной ангиопластике и стентированию верхней полой вены.
Прогноз
Отдаленные результаты лечения синдрома верхней полой вены зависят, прежде всего, от основного заболевания и возможностей его радикального лечения. Устранение причин приводит к купированию проявлений кава-синдрома. Острое течение синдрома верхней полой вены может вызвать быструю гибель больного. При синдроме верхней полой вены, обусловленном запущенным онкологическим процессом, прогноз неблагоприятный.
1. Синдром сдавления верхней полой вены – диагностика и лечебная тактика/ Фастаковский В. В., Важенин А.В., Фокин А. А., Лукин А.А.// Сибирский онкологический журнал. – 2004 - №4 (12).
3. Хирургическая коррекция флебогемодинамических нарушений при синдроме верхней полой вены: Автореферат диссертации/ Омаров К.С. – 2010.
4. Синдром верхней полой вены/ Проценко С. А., Новик А.В.// Практическая онкология. – 2006 – Т.7, №2.
Читайте также:
- Спиральный орган. Строение спирального органа. Гистофизиология слуха.
- Йод и мерказолил в лечении диффузного токсического зоба. Перхлорат калия при базедовой болезни
- Лечение рубцовой алопеции. Рекомендации
- Механизмы развития наследственного сфероцитоза - патогенез
- Железодефицитная анемия на почве повышенного расходования железа. Хронические постгеморрагические анемии.
