Лекарства для лечения ревматоидного артрита. Коксибы в лечении ревматоидного артрита
Добавил пользователь Валентин П. Обновлено: 04.01.2026
Течение ревматоидного артрита (РА) весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно.
Течение ревматоидного артрита (РА) весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно. Диагностические критерии, предложенные Американским колледжем ревматологов (ACR) в 1987 году, не отвечают требованиям ранней диагностики РА. Поэтому в последние годы совместными усилиями Европейской антиревматической лиги (EULAR) и ACR разрабатываются новые критерии, ориентированные на как можно более раннее установление диагноза РА. Известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания.
В крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) [1] (рис. 1). Морфологическое исследование синовиальной оболочки, полученной при биопсии у больных в первые месяцы после дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у большей части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [2]. Таким образом, даже в дебюте развития суставного поражения болезнь может представлять хроническую стадию. Поэтому задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) ухудшает отдаленный прогноз РА, как функциональный, так и жизненный. Для новых диагностических критериев EULAR/ACR выбраны четыре группы параметров, а каждый параметр на основании многомерного статического анализа получил балльную выраженность (табл. 1), при сумме баллов 6 и более устанавливается определенный диагноз РА.
В последние годы постоянно обсуждается вопрос, когда врач имеет право назначить БПВП. В соответствии с рекомендациями Ассоциации ревматологов России [3] основной группой препаратов для лечения РА (категория доказательности А) являются метотрексат и другие широко назначаемые препараты — лефлуномид и сульфасалазин, БПВП следует назначать как можно раньше (в пределах 3–6 месяцев от первого появления симптомов), даже если пациенты формально не соответствуют диагностическим критериям 1987 г. В рекомендациях Европейской антиревматической лиги (EULAR) 2007 года [4] указывается, что при риске развития персистирующего эрозивного артрита, даже если больной не отвечает классификационным критериям РА, показано назначение БПВП. Первым должен назначаться метотрексат, а при невозможности его назначения препаратами первой линии считаются лефлуномид, сульфасалазин и соли золота [4]. По рекомендациям ACR 2008 года [5] БПВП должны назначаться как можно раньше после дебюта симптомов артрита и препаратами первой линии считаются метотрексат и лефлуномид.
Далее во всех современных рекомендациях обращается внимание, что тактика лечения больного РА зависит от адекватности (или неадекватности) лечения. Таким образом, перед клиницистом стоят три задачи: выбор препарата, оценка адекватности терапии на ее этапах и своевременная коррекция лечения.
Последние рекомендации ACR (2008) [5] по лечению больных РА БПВП и ГИБП включают в себя определение основных параметров, которые следует учитывать при назначении препаратов. К ним относятся:
Длительность РА, которая подразделяется на ранний РА (длительность болезни < 6 месяцев), средняя длительность болезни (6–24 месяца) и устоявшийся (длительный) РА при длительности симптомов более 24 месяцев.
Наличие прогностически неблагоприятных признаков: активная болезнь (большое число болезненных и припухших суставов), наличие эрозий на ранней стадии, повышение РФ и/или АЦЦП [6, 7], повышение СОЭ и/или С-реактивного белка (СРБ) [8, 9]. Плохой прогноз при РА означает рентгенологическое прогрессирование деструкции суставов, утрату функции и увеличение смертности, а также увеличение риска необходимости проведения хирургических операций на суставах.
В соответствии с рекомендациями ACR (2008 г.) [5] лечение БПВП проводится в виде монотерапии или двойных и тройных комбинаций (рис. 2А, Б, В) в зависимости от длительности терапии и наличия факторов неблагоприятного прогноза.
Метотрексат и лефлуномид — БПВП 1-й линии для монотерапии, назначаются при любой длительности и любой активности, при наличии прогностически неблагоприятных признаков.
Гидроксихлорохин (Плаквенил) — назначается больным без признаков неблагоприятного прогноза и при длительности РА ≤ 4 месяца.
Сульфасалазин — назначается при любой активности РА [10, 11] больным без наличия прогностически неблагоприятных признаков либо при умеренной активности РА с отсутствием признаков плохого прогноза [12].
Рекомендации ACR в отношении места комбинированного лечения 2–3 БПВП опираются на данные нескольких рандомизированных клинических исследований, в которых комбинация БПВП была более эффективна, чем монотерапия (исследования COBRA, BeST и др.) [13, 14, 15]. В качестве эффективных предлагаются следующие комбинации БПВП.
Двойная комбинация БПВП — используется при высокой активности РА у больных с наличием признаков плохого прогноза [16, 17]. Комбинация метотрексата и гидроксихлорохина рекомендуется при большой длительности РА и низкой активности (уровень доказательности С). Комбинацию метотрексата и лефлуномида рекомендуется назначать при средней длительности (> 6 месяцев) и наличии факторов плохого прогноза и проводить терапию так долго, как долго будет сохраняться высокая активность [18]. Метотрексат в комбинации с сульфасалазином предлагается назначать при любой длительности РА, высокой активности, наличии признаков плохого прогноза (уровень доказательности А для длительности РА < 6 месяцев и более 24 месяцев; уровень доказательности С для средней длительности РА) [10, 12, 19]. Комбинация сульфасалазина и гидроксихлорохин в соответствии с этими рекомендациями используется только в одной ситуации: средняя длительность РА (6–24 месяца) с высокой активностью, но без наличия признаков плохого прогноза.
Тройная комбинация БПВП — метотрексат + гидроксихлорохин + сульфасалазин — назначается при наличии факторов плохого прогноза и при умеренной/высокой активности болезни независимо от длительности болезни [20].
Другие БПВП являются препаратами 2-й и 3-й линии и используются при неэффективности или непереносимости этих четырех БПВП.
Рекомендации EULAR 2010 года несколько отличаются от рекомендаций ACR (2008 г.):
Как только больному устанавливается диагноз РА, ему сразу должно быть назначено лечение синтетическим БПВП.
Цель лечения. Как можно более быстрое достижение ремиссии или низкой активности болезни у каждого пациента; если эта цель не достигается, необходим подбор терапии путем частого и непосредственного мониторинга (каждые 1–3 месяца).
Первый БПВП. Метотрексат должен быть частью первой стратегической схемы лечения у больных активным РА.
Альтернативные первые БПВП. В случае противопоказаний к назначению метотрексата (или его непереносимости) следующие БПВП должны обсуждаться в качестве (первой) стратегии лечения: сульфасалазин, лефлуномид и соли золота (инъекции).
Монотерапия или комбинация. Для больных, ранее не получавших БПВП, рекомендуется монотерапия, а не комбинированная терапия синтетическими БПВП.
Мы считаем, что начало терапии РА, тем более на ранней стадии болезни, должно начинаться с монотерапии. А дальнейшая тактика врача зависит от результата терапии. При лечении любым БПВП возможно несколько вариантов результата лечения: 1) снижение активности РА до низкой или достижение ремиссии; 2) снижение активности без достижения низкого ее уровня; 3) минимальное улучшение или его отсутствие. Первый и третий вариант не вызывают трудностей: терапия продолжается без изменений (1-й вариант) и препарат отменяется (3-й вариант). Наибольшие сложности представляет 2-й вариант — то есть развитие частичного эффекта на лечение БПВП. В этой ситуации возможна как замена БПВП, если степень достигнутого улучшения параметров активности не превышает 40–50% или присоединение к БПВП при 50% и более улучшении другого лекарственного средства (БПВП или генно-инженерного биологического препарата — ГИБП).
Использование комбинации двух и более БПВП является принятым при РА, когда у пациента развивается частичный ответ на препарат (более 20% и менее 50% улучшения). Наличие у лефлуномида уникального механизма действия и прием его однократно в день создает предпосылки для использования его в комбинации с другими БПВП. При назначении лефлуномида в комбинации с БПВП некоторые авторы рекомендуют использовать его в более низкой дозе или более редко для лучшей переносимости [21, 22]. К 2005 году по данным базы CORONA, в которую вошли 5436 больных, получавших БПВП между октябрем 2001 года и мартом 2004 года, 88% больных получали монотерапию БПВП и 12% комбинации БПВП [22]. Из них 597 больных получали лефлуномид, и 2/3 этих больных принимали его в комбинации с другими БПВП, что позволило повысить общую эффективность лечения.
Лефлуномид в комбинации с метотрексатом. Метотрексат является БПВП, который часто используют в комбинированной базисной терапии РА. В открытом исследовании лефлуномида у 30 больных РА комбинация его с метотрексатом показала ee перспективность [23]. С учетом этого было проведено многоцентровое РКИ исследование эффективности комбинации метотрексата с лефлуномидом или плацебо у 263 больных с персистирующей активностью РА в течение последних 6 месяцев монотерапии метотрексатом [21, 24]. Дозы метотрексата были 15–20 мг/нед (или 10–15 мг/нед при непереносимости более высоких доз), начальная доза лефлуномида была 10 мг/сутки, при отсутствии эффекта через 8 недель дозу его увеличивали до 20 мг/сутки. Через 24 недели число ответивших по критериям ACR20, ACR50 и ACR70 было значительно больше при комбинации лефлуномида и метотрексата, чем при монотерапии метотрексатом (рис. 3).
Данные проспективного 24-месячного исследования эффективности и переносимости комбинации лефлуномида и метотрексата показали хорошую ее переносимость [25]: 72,4% больных закончили 6-месячный прием двух БПВП и далее отмен из-за симптомов непереносимости не было. В недавнем 5-летнем исследовании по безопасности этой комбинации было показано отсутствие увеличения серьезных побочных реакций или смертности [26] по сравнению с монотерапией лефлуномидом.
Лефлуномид в комбинации с сульфасалазином. Изучение данной комбинации БПВП было проведено в контролируемом рандомизированном исследовании (2-й этап которого был плацебо-контролируемым) RELIEF, дизайн которого представлен на рис. 4. Как видно из дизайна исследования, комбинация лефлуномида и сульфасалазина или лефлуномида и плацебо назначалась больным, не ответившим на монотерапию лефлуномидом, что составило 13% от общего числа больных, включенных в исследование и пролечившихся 24 недели [27]. Число больных с ответом по критериям ACR20 и DAS28 было несколько выше при использовании комбинации лефлуномида и БПВП, при использовании комбинации лефлуномида и сульфасалазина удалось достичь 50% улучшения по критериям ACR у 9% больных против 0% в группе больных, получавших лефлуномид и плацебо. Переносимость терапии была одинакова в обеих группах (табл. 4).
При РА очень важен принцип длительного непрерывного лечения БПВП. Поэтому врач должен быть хорошо ориентирован в спектре возможных побочных реакций того или иного БПВП для организации правильного мониторинга за переносимостью лечения: кратности осмотров, проведения лабораторных анализов или инструментальных обследований и т. д. Необоснованная отмена БПВП и следующий за этим перерыв в базисной терапии приводят к обострению воспаления, которое не всегда удается подавить при возобновлении приема препарата через несколько месяцев, что ухудшает течение болезни. К сожалению, нередко врачи окончательно отменяют метотрексат или лефлуномид при развитии банальной вирусной респираторной инфекции, когда вполне достаточно прервать прием препарата до купирования катаральных явлений.
Развитие неосложненной пневмонии или другой неосложненной инфекции (цистита, бронхита и т.?п.) также не является причиной для окончательной отмены цитостатика. Если больной получает не только базисные, но и симптоматические средства, следует дифференцировать, с каким именно препаратом связано развитие побочной реакции. Многие годы считалось, что базисная терапия имеет большой спектр нежелательных реакций, а нестероидные противовоспалительные (НПВП) считались более безопасными средствами. Однако внедрение в практику клинициста эндоскопических, радионуклидных методов оценки безопасности лечения показало, что НПВП обладают большой частотой развития тяжелых, потенциально жизнеопасных побочных проявлений, вызывая повреждение слизистой желудочно-кишечного тракта у 30–40% больных, отрицательно влияя на функцию почек, печени, тромбоцитов. Смертность вследствие применения НПВП по зарубежным данным сопоставима по частоте со смертностью из-за лейкемий и СПИДа [28]. Базисная терапия с этих позиций является более безопасным видом терапии.
Но даже при грамотном подходе к лечению больных РА классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности, прогрессирования болезни, переносимостью лечения) тяжелый вариант болезни все же развивается. По нашим данным и данным литературы у 15–25% больных последовательно назначаемые БПВП не приводят к развитию выраженного эффекта (хороший эффект по критериям EULAR либо более чем 50% улучшение по критериям ACR) или приводят к развитию побочных реакций, требующих отмену базисного средства. Создание ГИБП позволило в значительной степени оптимизировать лечение больных РА.
С учетом высокой стоимости ГИБП большое значение имеет отбор больных, нуждающихся в таком лечении. В первую очередь — это больные, у которых, несмотря на применение БПВП, сохраняется высокий темп прогрессирования либо риск быстрого прогрессирования, то есть высокий уровень СРБ, сохранение припухлости в суставах и т. п.
Как было показано в исследовании BeST [14], при неэффективности двух последовательно назначенных классических БПВП дальнейшее использование других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы одним из критериев отбора больных для назначения ГИБП является неэффективность двух БПВП.
Особый интерес представляет опыт использования лефлуномида в сочетании с биологическими агентами, в первую очередь с ингибиторами фактора некроза опухоли альфа (ФНО-альфа). Такая комбинация имеет теоретическое обоснование, так как лефлуномид в основном действует на Т-клетки — ключевые клетки, которые передают сигнал на макрофаги, что сопровождается выбросом провоспалительных цитокинов, и на фибробласты, продуцирующие медиаторы работы хондроцитов [29].
До настоящего времени рандомизированных контролируемых исследований комбинации лефлуномида и инфликсимаба не проводилось. В ретроспективных исследованиях комбинация лефлуномида и инфликсимаба показала некоторое клиническое превосходство перед монотерапией, а побочные эффекты соответствовали известному для каждого из этих препаратов профилю переносимости [30–32]. Есть данные, что при комбинации лефлуномида с инфликсимабом число ответивших по критериям ACR20 достигает 100% [33].
В открытых проспективных исследованиях комбинация лефлуномида и инфликсимаба ассоциировалась с большим числом побочных реакций, но данных за синергизм развития симптомов непереносимости не было получено [31, 34–36]. Сыпь была наиболее частым побочным явлением в одном из них [36], чего не наблюдалось другими авторами [34, 35]. Такое расхождение данных может быть связано с тем, что в первом исследовании инфликсимаб добавлялся к двухнедельному лечению лефлуномидом, а в остальных пациенты получали лефлуномид в течение 16 недель до начала комбинированной терапии, так что пациенты с гиперчувствительностью к лефлуномиду не вошли в группу комбинированной терапии. Все три открытых исследования свидетельствуют о прекрасной клинической активности такой комбинации у большинства больных. Так, в исследовании Antoni C. и соавт. [35] (n = 72) ответивших по критериям ACR20 было 47,1% через 30 недель лечения, а число ответивших по критериям ACR50 достигло 21,4%. Частота побочных эффектов и их спектр при назначении комбинации инфликсимаба с лефлуномидом или инфликсимаба с другими БПВП по данным Голландского регистра больных [36], получающих биологические агенты, представлены в табл. 5. Более частым симптомом непереносимости комбинации лефлуномида и инфликсимаба также была кожная сыпь, частота других нежелательных симптомов была сходной в обеих группах.
Открытые исследования показали эффективность и безопасность комбинации лефлуномида и адалимумаба [37, 38]. В первом исследовании пациенты с активным РА были рандомизированы на две группы: терапия адалимумабом + плацебо или терапия адалимумабом в комбинации с ранее назначенными БПВП. Группа больных, в которой адалимумаб добавлялся к БПВП, продемонстрировала достоверно большее клиническое улучшение, чем группа с монотерапией адалимумабом и плацебо. Комбинация лефлуномида и адалимумаба была столь же эффективна, как и комбинация метотрексата и адалимумаба [37]. Всего во втором исследовании [38] (n = 318) 88 больных получали лефлуномид, к сожалению, авторы не дают данных по эффективности и переносимости каждой из комбинаций адалимумаба и БПВП.
В совещании 18 экспертов [33] было высказано мнение об эффективности и переносимости комбинации лефлуномида и биологических агентов (табл. 6).
Эксперты обсудили возможные ситуации для назначения комбинации лефлуномида и биологических агентов:
Лечение ревматоидного артрита базисными противовоспалительными препаратами
Лефлуномид является активным базисным противовоспалительным препаратом для терапии больных ревматоидным артритом. Препарат отличается быстрым развитием эффекта, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества ж
Leflunomide is an active basic resolvent for rheumatic arthritis patients therapy. The medication is remarkable for the fast development of the effect, which leads to sustainable improvement of the support-motor apparatus functions and improvement of the patients' life quality. The side reactions are rare.
Лечение ревматоидного артрита (РА), заболевания с неизвестной этиологией, сложным многокомпонентным патогенезом, чрезвычайной вариабельностью вариантов дебюта и течения, всегда представляло определенные трудности для практикующего врача.
Очевидно, что успех лечения во многом зависит от ранней диагностики и, соответственно, раннего начала патогенетической терапии. Последние классификационные критерии РА облегчают эту задачу, так как, используя их, врач в большинстве случаев может установить диагноз РА в течение первых 3–4 месяцев [1].
Лечение РА ориентировано на подавление активности и прогрессирования заболевания. Для лечения воспалительного процесса используются два вида терапии: 1) симптоматическая терапия нестероидными (НПВП) или глюкокортикоидными (ГК) противовоспалительными препаратами и 2) терапия базисными противовоспалительными препаратами (БПВП). Симптоматические средства способны уменьшить выраженность воспаления в синовиальной оболочке, уменьшить боль и скованность, однако эти препараты не влияют на течение РА.
Лечение синтетическими базисными противовоспалительными препаратами (БПВП) начинают сразу после установления диагноза РА (уровень доказательности 1а, уровень соглашения 9,9 ± 0,4) [2]. При раннем начале лечения (первые 3–6 месяцев) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью [3–6], что по современным представлениям и является основной целью лечения РА [7]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 рандомизированных клинических исследований (РКИ) была оценена частота развития эффекта у 1440 больных (1178 получали различные БПВП и 262 — плацебо) при различной длительности РА учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник состояния здоровья HAQ (Health Assessment Questionnaire) и др.) [8]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» ( < 1 года) до 35% «ответчиков» (>10 лет) (табл. 1).
Помимо раннего начала лечения РА БПВП, необходим и жесткий контроль за выраженностью достигнутого эффекта, со своевременной коррекцией терапии. При таком подходе, как это было показано в ряде исследований [9–13], результат лечения лучше, чем при рутинном подходе. Это послужило основанием для формирования концепции современного лечения РА. В последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу «Лечение РА до достижения цели» (в оригинале — инициатива «Treat to target» — Т2Т) [7].
Общие принципы инициативы Т2Т:
А) Лечение ревматоидного артрита следует проводить на основании совместного решения пациента и ревматолога.
Б) Основная цель при лечении больного ревматоидным артритом — обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля клинических проявлений, предотвращения структурного поражения суставов, нормализации функционирования и социальных возможностей пациента.
В) Устранение воспаления — наиболее важный способ достижения этих целей.
Г) Для оптимизации исходов при ревматоидном артрите лечение следует проводить до достижения определенной цели, контролируя активность заболевания и соответствующим образом корригируя терапию.
Первый пункт этих рекомендаций ставит перед врачом задачу обязательного обучения больного для того, чтобы он осознанно участвовал в лечении. Пациенту необходимо разъяснить, что такое хроническое заболевание, какова цель лечения, необходимость длительного многомесячного непрерывного лечения для предотвращения тяжелых исходов и осложнений РА (выраженной деструкции, утраты функции, амилоидоза и пр.).
Основные рекомендации инициативы Т2Т определяют главную цель лечения — достижение клинической ремиссии или, как альтернатива, низкой активности РА, что должно поддерживаться в течение всего периода болезни. Для достижения этой цели больные с умеренной/высокой активностью болезни должны осматриваться ежемесячно, при стабильно низкой активности — реже, раз в 3–6 месяцев, с регистрацией количественных параметров активности и использованием валидированных индексов. Таким образом, врач на каждом визите должен объективно оценить динамику активности болезни. При отсутствии достижения цели (ремиссии или низкой активности, т. е. индекс активности болезни DAS28 > 3,2) через 3 месяца следует принять решение о коррекции терапии. Если врач видит отчетливую стабильно нарастающую тенденцию к улучшению, нет необходимости менять терапию каждые 3 месяца и следует подождать, когда улучшение прекратится и смена терапии станет обоснованной.
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) лечение РА начинают с монотерапии БПВП, а не с комбинации препаратов, и первым БПВП, назначаемым сразу после установки диагноза РА, должен быть Метотрексат (MTX) [2], по рекомендациям ACR (Американская коллегия ревматологов, American College of Rheumatology) первыми БПВП могут быть MTX и лефлуномид (LEF) [14]. Метаанализ 2008 года [15] показал равнозначную эффективность без значительных различий в переносимости и длительности применения между БПВП (MTX, LEF и Сульфасалазин (SSZ)), которые являются препаратами, наиболее часто применяемыми при РА. В настоящее время Сульфасалазин редко используется как первый препарат в лечении РА (при низкой активности серонегативного варианта болезни).
Метотрексат является высокоэффективным препаратом [16, 17], причем его эффект является дозозависимым [18]. Минимальная терапевтическая доза MTX составляет 10 мг/неделю, но при умеренной/высокой активности РА она должна быть увеличена в течение первых месяцев лечения до 15 мг/нед, а далее доза корригируется в зависимости от успеха лечения. Применяется как в таблетированной, так и в парентеральной форме.
И терапевтические эффекты, и токсичность MTX определяются фолатзависимыми механизмами. Подавление активности дигидрофолатредуктазы, ведущее к снижению синтеза ДНК, наблюдается главным образом при назначении очень высоких доз MTX онкологическим больным и составляет основу антипролиферативного действия препарата. При использовании низких доз MTX в ревматологии ингибиция дигидрофолатредуктазы, вероятно, имеет меньшее значение, а клиническая эффективность связана с действием его глутамированных производных. Весьма вероятно, что на фоне лечения низкими дозами MTX именно накопление метаболитов приводит к противовоспалительному и мягкому иммуносупрессивному эффекту. Таким образом, низкие дозы Метотрексата, используемые в лечении РА, приводят к противовоспалительному эффекту, а не к цитотоксическому, что имеет место при использовании высоких доз MTX в лечении опухолей [19].
Препарат обладает быстрым началом действия (в течение 2–3 месяцев) и дозозависимым эффектом [20]. В таблетированной форме препарата назначается 1 раз в неделю по 2,5 мг через 12 часов, вначале в пробных дозах 5 мг и 7,5 мг/нед, далее доза увеличивается до терапевтической. При применении парентеральных форм лечение также начинают с пробной дозы (5–7,5 мг/нед), далее доза может варьировать от 10 до 30 мг/неделю в зависимости от эффективности и переносимости. В контролируемом многомесячном исследовании было выявлено преимущество формы для подкожного введения перед таблетированной: более высокая эффективность при использовании одинаковых доз [21].
Лефлуномид (Арава) является дериватом изоксазола, создан специально для лечения РА, хотя в последние годы он начал использоваться и для лечения псориатической артропатии. Лефлуномид является «пролекарством», в желудочно-кишечном тракте и плазме быстро превращается в активный метаболит — малононитриламид (А77 1726), имеющий, в отличие от лефлуномида, открытое боковое ароматическое кольцо. Именно действием активного метаболита А77 1726 опосредован эффект лефлуномида.
По данным многочисленных экспериментальных исследований основным механизмом действия лефлуномида на активированные клетки является угнетение de novo синтеза пиримидиновых нуклеотидов в поздней G1-фазе клеточного цикла [22]. Предполагают, что лефлуномид действует избирательно на активированные Т-клетки, в то время как преобладающее большинство лимфоцитов находятся в фазе G0 до тех пор, пока не появится потребность в иммунном ответе [23]. Под воздействием метаболита А77 1726 не уменьшается количество клеток и внутриклеточная концентрация белков в угнетенных клетках после 72 часов воздействия метаболита А77 1726 в концентрации 100 мкмоль/л остается такой же, как в клетках в состоянии покоя. Лефлуномид не влияет на фагоцитоз человека. Все вышеперечисленные свойства позволяют рассматривать лефлуномид в большей степени как иммуномодулятор, нежели как иммунодепрессант.
Угнетение Т-клеточного аутоиммунного ответа сопровождается снижением синтеза провоспалительных цитокинов (интерферона-гамма, фактора некроза опухоли-альфа (ФНО-альфа), интерлейкина 6 (IL-6), интерлейкина-бета (IL-бета), простагландина Е2), оксида азота и матриксных металлопротеиназ (ММР-1, ММР-3, ММР-12) в крови и в культуре синовиальной ткани больных РА. Недавно получены данные о противовоспалительном эффекте лефлуномида в отношении культуры моноцитов и макрофагов синовиальной оболочки больных РА: показано уменьшение синтеза провоспалительных цитокинов культурами клеток [24].
Из-за длительной элиминации А77 1726 лечение лефлуномидом рекомендуется начинать с насыщающей дозы 100 мг в течение 3 дней для достижения устойчивой равновесной концентрации препарата в плазме крови. Без насыщающей дозы лекарства для достижения равновесной концентрации А77 1726 потребуется около 2 месяцев. В ходе многочисленных исследований терапевтическая доза определена как 20 мг/сутки (при слабых симптомах непереносимости возможно временное уменьшение дозы до 10 мг/сутки). Выведение препарата осуществляется желудочно-кишечным трактом (48%) и почками (43%). Возраст и пол не оказывают влияние на фармакокинетику А77 1726; однако у больных РА отмечается более высокая плазменная концентрация свободной фракции А77 1726. Метаболизм лекарства происходит быстрее у курильщиков.
Хотя в целом эффективность LEF и MTX равнозначна [15], но клиническая эффективность LEF имеет ряд особенностей.
Следует отметить очень быстрое развитие эффекта при применении LEF. Эффект LEF проявляется через 4 недели от начала приема, что продемонстрировано в зарубежных исследованиях (рис. 1) [31] и подтверждено нашим собственным опытом [25–28]. Уже через 1 месяц после начала лечения (табл. 2) отмечается отчетливое уменьшение выраженности суставного синдрома и заметное снижение концентрации С-реактивного белка (СРБ) — практически в 2 раза [28]. Известно, что СРБ является лабораторным тестом, гораздо более тесно коррелирующим с активностью РА, чем СОЭ. При продолжении лечения эффект препарата быстро нарастает в течение первых 4–5 месяцев и продолжает увеличиваться при продолжении лечения до 12 месяцев.
Оценивая динамику индекса активности болезни (Disease activity score, DAS) в различной его модификации — DAS 4, DAS 28 (рис. 2), можно увидеть, что Арава через 6, 12, 18, 24 и 36 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (критерии EULAR). Из рис. 2 видно, что уже через 3–4 месяца средний уровень активности соответствовал низкой.
Такое быстрое подавление активности РА при приеме LEF обусловило и еще одну особенность препарата. При сравнении влияния лефлуномида на деструктивный процесс в суставах с базисным действием Метотрексата и Сульфасалазина было показано, что эффект LEF сопоставим с действием Метотрексата, но превышает действие Сульфасалазина [29–31]. По нашим многолетним исследованиям влияния базисных препаратов на темпы деструкции при РА (рис. 3) было показано [32], что только под влиянием LEF выраженное уменьшение числа новых эрозий отмечается уже в первые 6 месяцев лечения. Под влиянием всех других базисных средств, включая Метотрексат, в первое полугодие терапии темп прогрессирования деструктивного артрита значительно не меняется и только к 12 месяцам успешной терапии можно зарегистрировать подавление прогрессирования деструкции в суставах кистей и стоп, а наиболее отчетливое подавление деструкции при приеме различных БПВП можно зарегистрировать только через 18 месяцев успешной терапии. Судя по быстрому снижению концентрации СРБ под влиянием лефлуномида, можно утверждать, что Арава быстрее других базисных средств подавляет ревматоидное воспаление в синовиальной оболочке, что и приводит к ранней остановке прогрессирования деструкции. Впервые нами продемонстрировано заживление костной эрозии у больного с тяжелым РА (исходное число эрозий более 100), на фоне ремиссии отмечено заживление эрозии в крючковидной кости левого запястья через 18 месяцев приема LEF (рис. 4) [33].
Лефлуномид возможно применять в длительные сроки (в исследованиях до 5 лет) без развития вторичной неэффективности (рис. 5), что очень важно с учетом хронического характера течения РА [34, 35].
Основной отдаленной целью терапии при РА является сохранение функциональной способности больного, предупреждение развития инвалидности. Поэтому особый интерес представляет влияние терапии лефлуномидом на функциональное состояние больных, оцениваемое по стандартным тестам (HAQ, SF-36): уже через 6 месяцев только у 10% больных средний балл индекса HAQ-DI составлял 1,6–2,1; а средний балл 0,5 (то есть практически полное отсутствие функциональной недостаточности) отмечалось у 54% больных [36]. При оценке качества жизни больных РА по тесту SF-36 уже через 6 месяцев достигнуто достоверное улучшение по 5 из 8 доменов (данные Института ревматологии РАМН). Сравнение влияния на качество жизни лефлуномида и Метотрексата за 1–2 года терапии было продемонстрировано преимущество лефлуномида с достоверным улучшением по 3 из 8 доменов (телесная боль, жизнеспособность и ролевое эмоциональное функционирование) (рис. 6) [37]. Как видно из рисунка, при приеме LEF в ряде доменов качество жизни пациентов приблизилось к популяционной норме.
Отмечается хорошая переносимость лефлуномида в сроки лечения до 2–3 лет, как по данным отечественных, так и зарубежных авторов [31, 41]. Среди наших 50 больных лефлуномид был отменен из-за диареи в 1 случае и из-за кожного зуда у 6 больных, причем отмена препарата вследствие непереносимости потребовалась только у лиц старше 50 лет [28]. У половины больных, получавших LEF, в первые месяцы лечения отмечается повышенное выпадение волос, не потребовавшее отмены лечения. Примерно у 10% больных при назначении LEF может появиться артериальная гипертензия (или измениться течение существовавшей артериальной гипертензии), что требует мониторирования артериального давления и коррекции антигипертензивной терапии. Повышение печеночных ферментов отмечается реже, чем при приеме MTX, однако необходим регулярный мониторинг за уровнем аспартатаминотрансферазы и аланинаминотрансферазы (рис. 8). Развитие инфекционных заболеваний требует перерыва в лечении Аравой до купирования инфекции, далее можно продолжать лечение в обычной суточной дозе. Частота развития реакций непереносимости в контролируемых исследованиях лефлуномида показала, что переносимость лефлуномида не уступает переносимости Метотрексата [30, 35, 42].
Таким образом, лефлуномид является активным базисным противовоспалительным препаратом более чем у 90% больных РА. Препарат отличается быстрым развитием эффекта как в отношении параметров активности РА, так и в отношении прогрессирования деструкции, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества жизни больных. Побочные реакции на фоне лефлуномида развиваются редко и в большинстве случаев не ведут к его отмене.
Литература
Н. В. Чичасова, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Лекарства для лечения ревматоидного артрита. Коксибы в лечении ревматоидного артрита
Базисное лечение ревматоидного артрита. Противомалярийные средства при ревматоидном артрите
Если НПВС или низкие дозы глюкокортикостероидов не помогают при ревматоидном артрите в активной стадии, необходимо назначить БПРП. К БПРП относят противомалярийные препараты, сульфасалазин, азатиоприн, циклоспорин, лефлуно-мид, этанерцепт, инфликсимаб. Сильный активный артрит обычно лечат одним или несколькими препаратами этой группы в дополнение к НПВС и/или с низкими дозами глюкокортикостероидов. Эти лекарства можно применять для легких, средних и тяжелых форм артрита.
Противомалярийные препараты назначают для легких случаев, а в паре с другим препаратом — для средних и тяжелых форм. Лечение средних и тяжелых форм артрита обычно начинают с метотрексата. Сульфасалазин может заменить метотрексат, если он вызывает побочные эффекты. Разработка препарата лефлуномида привела к снижению применения золота, азатиоприна, пенициламина и циклоспорина. Новые биологические агенты, этанерцепт и инфликсимаб, которые подавляют действие ФНО-0С, применяют все чаще, если лечение менее дорогими препаратами не дает результатов либо ограничено побочными эффектами или важно быстро остановить развитие болезни.
Гидроксихлорохин и хлорохин — противомалярийные средства, которые применяют, если необходимо вызвать ремиссию или уменьшить воспаление при ревматоидном артрите. Из всех БПРП противомалярийные средства считаются самыми слабыми, но они обладают наименьшей токсичностью. Для определения эффективной дозы необходимо применять их в течение 6 мес. В зависимости от назначенной дозы необходимо контролировать в течение 6-12 мес цветовое и периферическое зрение.
Противовоспалительный механизм действия хлороина и гидроксихлорохина неясен. Имеются сведения, что они нарушают функцию лейкоцитов. Препараты могут подавлять производство IL-1 макрофагами, лимфопролиферативную реакцию и цитотоксическую реакцию Т-лимфоцитов. При использовании в высоких дозах (что редко) они также оказывают подавляющий эффект на синтез ДНК.
Сульфасалазин часто используют как базисное средство лечения ревматоидного артрита в Великобритании; в США этот препарат не столь популярен. Его считают таким же эффективным, как и соли золота, и у него меньше побочных эффектов. Сульфасалазин представляет собой комбинацию 5-аминосалициловой кислоты, ковалентно соединенной с сульфапиридином. Он плохо всасывается при пероральном введении, но расщепляется на активные компоненты бактериями толстой кишки.
Сульфапиридин постепенно выводится с мочой. Механизм действия неясен, но имеются признаки того, что он снижает активность NK-клеток и влияет на другие функции лейкоцитов. К сильным побочным эффектам, вызванным сульфапиридином, относят острый гемолиз у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы и редко — агранулоцитоз. Высыпания наблюдаются у 20-40% пациентов. Возможны также тошнота, лихорадка и артралгия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства, которые используют для лечения ревматоидного артрита, можно классифицировать на основе их терапевтического эффекта, по симптоматическому или противовоспалительному действию, сравнивая их способность вызывать ремиссию и останавливать развитие болезни и связанное с ней разрушение костей. Лечение пациентов с ревматоидным артритом основывается на понимании биологии, истории возникновения этого заболевания в сочетании с результатами клинических исследований. Разрушение суставов нередко происходит вскоре после начала заболевания. Это обусловливает необходимость применения мощных препаратов, обладающих способностью влиять на развитие ревматоидного артрита, с самого начала заболевания.
Ацетаминофен, аспирин, НПВС и коксибы назначают для облегчения симптоматических проявлений, но не для предотвращения разрушения суставов. Кроме того, для подавления раздражения в воспаленном суставе применяют глюкокортикостероиды. С другой стороны, есть большая группа лекарств, которые называют базовыми противоревматическими препаратами, поскольку они подавляют развитие болезни. К ним относят противомалярийные препараты, метотрексат, препараты золота, D-пеницилламин, сульфасалазин, азатиоприн, циклоспорин, лефлуномид, этанерцепт и инфликсимаб. В последнее время начальную терапию ревматоидного артрита проводят мощными БПРП.
Аспирин — очень эффективное и недорогое противовоспалительное средство. Отличается от других НПВС, поскольку является ингибитором циклооксигеназы необратимого действия и ацетилирует активную форму энзима циклооксигеназы. Ранее салицилаты применяли для лечения ревматоидного артрита (их продолжают применять из-за низкой стоимости). Покрытый специальной оболочкой аспирин в ЖКТ усваивается лучше, чем обычный. Как правило, аспирин принимают 3-4 раза в день, обычно с едой, чтобы уменьшить побочное действие на желудок. Всасывание обычно полное и быстрое; если аспирин покрыт оболочкой, то немного медленней.
Аспирин преобразуется в активный метаболит с долгим периодом полувыведения. В сравнительно невысоких дозах выведение аспирина можно описать как типичную кинетику первого уровня. В высоких дозах салицилаты демонстрируют кинетику нулевого порядка с постоянным количеством действующего вещества, которое преобразуется за единицу времени. Клинически это важно, поскольку при желании можно принимать высокие дозы аспирина 2 раза в день. Однако высокие дозы аспирина могут вызывать длительную токсичность. Максимальная концентрация должна составлять 200-300 мг/мл, уровень в сыворотке измерять не нужно, поскольку побочные эффекты (желудочно-кишечные нарушения, шум в ушах и глухота) ограничивают дозы.
НПВС в течение последних 20 лет являются главным средством лечения ревматоидного артрита, но, подобно салицилатам, они не оказывают влияния на развитие болезни. Выбор конкретного препарата зависит от опыта врача, знания точной дозы и схемы приема. Если симптомы не контролируются, врач должен осторожно увеличивать дозу до максимально рекомендуемой. Если в течение 2 нед применение лекарства не дает результатов, необходимо назначить альтернативный препарат из этой группы. Можно испробовать различные НПВС до получения оптимального контроля над симптомами.
Одновременное применение второго препарата из группы НПВС или салицилатов не рекомендуется, поскольку возрастает риск побочных эффектов, связанных с ЖКТ. Терапевт должен уведомить пациента о таком риске, поскольку во многих лекарственных средствах, отпускаемых без рецепта, содержатся салицилаты и НПВС, а пациенты принимают их без консультации с врачом.
Применение коксибов (ингибиторов ЦОГ-2 избирательного действия) для уменьшения боли и отека при воспалительном артрите заметно возросло, но наличие у применяющих их пациентов сердечно-сосудистых заболеваний обусловливает осторожное применение этих препаратов.
Низкие дозы глюкокортикостероидов, например преднизолона, в виде мазей очень эффективны и вызывают меньше соматических побочных эффектов, и применяют их в случае поражения одного или двух суставов. Основной риск — занесение в сустав инфекции, а возможный — ускорение разрушения хряща в пораженном суставе.
Лечение ревматоидного артрита препаратами нового типа
Одно из поражений соединительной ткани – ревматоидный артрит (РА). Это системное заболевание, которое известно давно, но даже за многовековой опыт изучения патологии многие нюансы о ней остаются неизвестными. Самым главным объектом дискуссий до сих пор остается этиология. Эрозивно-деструктивный процесс ежегодно выявляют у 0.5-1% людей планеты. Поскольку течение воспаления сопровождается изнурительными симптомами, необходимо медикаментозно добиться его ремиссии. Только врач назначает лечение ревматоидного артрита: препараты подбирают с учетом возраста пациента, стадии заболевания, поражений других органов.

Симптоматика
Предопределяющая роль в развитии ревматоидного артрита принадлежит наследственной предрасположенности. К группе риска относятся люди, перенесшие инфекцию в виде герпеса или гепатита. Провоцирующим фактором развития болезни признаны такие состояния, как переохлаждение, пребывание в стрессовой среде и другие факторы, предполагающие пагубное воздействие на иммунитет.
В целом, интенсивность проявления патологии зависит от таких факторов, как локализация очага воспаления, вероятность развития осложнений и степень наличия таковых.
Когда ревматоидный артрит находится в латентной стадии, отмечаются:
- Повышенная утомляемость и слабость, вынуждающие пациента больше отдыхать, чем осуществлять двигательную активность.
- Беспричинное снижение массы тела.
- Необъяснимое повышение общей температуры тела.
- Миалгия разной локализации.
Сложность заболевания заключается в том, что оно поражает не только суставную ткань, но и другие органы и системы. Это особенно тяжело переносить пациентам, которые и без того претерпевают хронические патологии.
Патология имеет бурное течение:
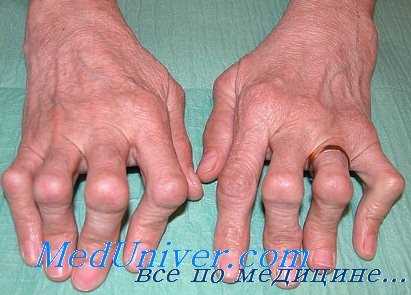
- отек синовиальных сумок сопровождается интенсивным болевым синдромом, покраснением тканей над пораженными суставами. Из-за припухлости пациент не может разжать пальцы, сжать их в кулак. Болезненность возрастает при перемене погоды;
- заболевание отличается симметричностью проявлений: как только происходит поражение суставов одной руки, на второй начинаются аналогичные изменения;
- оказывается пагубное воздействие на органы пищеварительного тракта. Больной не замечает специфических признаков: в 95% клинических случаев его беспокоят лишь общие нарушения состояния пищеварения. Чаще – снижение аппетита, повышенное газообразование, тянущая болезненность в подвздошной области;
- наблюдаются неврологические расстройства: возникает раздражительность, панические атаки, спонтанные и частые перемены настроения, психологическая уязвимость. Нарушается сон, что связано с постоянной болезненностью пораженных суставов. Из-за недосыпания возникают проблемы с запоминанием и способностью концентрировать внимание. Поэтому, назначая препараты при ревматоидном артрите, специалист учитывает перечисленные проявления. Общие назначения дополняются лекарственными средствами группы транквилизаторов и снотворных, чтобы пациент мог полноценно отдохнуть, восстановиться.
Поражение крупных суставов (голеностопных, коленных, плечевых, локтевых) происходит отсроченно, к тому времени патология уже достигает поздней стадии развития. Чаще этот период занимает несколько недель или даже месяцев.
Лечение медикаментами
Очень важно начинать устранение ревматоидного артрита на начальной стадии его развития, когда возникают первые симптомы проблемного состояния суставов. В этом случае появляется больше шансов на быстрое выздоровление.
Врач назначает следующие виды лекарственных средств:
- Миорелаксанты – для расслабления мышечного гипертонуса. Устранив перенапряжение, удастся сократить, а затем и полностью купировать болевые ощущения. Представителями лекарств группы миорелаксантов являются Мидокалм, Седуксен.
- Цитостатики. Препараты обладают свойством подавлять иммунитет, поскольку именно на основании сопротивляемости организма развивается ревматоидный артрит. Данной группой препаратов онкологи лечат злокачественные опухоли. Вероятность развития побочных эффектов минимальна: лишь у 15% пациентов возникают трудности с опорожнением кишечника и высыпания на коже.
- Широко применяют препараты золота при ревматоидном артрите. Пациент принимает соли золота внутрь. Эффективность ауротерапии сравнима только с применением средства Метотрексат. Длительное применение солей золота существенно замедляет появление кист внутри суставов у пациентов с серопозитивным ревматоидным артритом. Улучшается общее состояние костного рельефа, повышается уровень минерализации ткани. Известны случаи, когда кости восстановились даже при ранее имеющихся дефектах. Под благотворным воздействием солей золота особенно быстро заживают повреждения мелких суставов.
- Лечение ревматоидного артрита препаратами нового поколения предполагает назначение средства Ремикейд. Препарат относится к группе цитостатиков, характеризуется способностью очень быстро обеспечивать терапевтический эффект. Это дорогое лекарственное средство (вне зависимости от страны проживания). Главное показание для назначения препарата Ремикейд – необходимость быстро купировать тяжелую форму РА. Лекарство представляет собой настоящее спасение для людей, страдающих ревматоидным артритом, но имеющих непереносимость НПВС и гормонов.
- Селективные ингибиторы ЦОГ 2. Препараты этой группы практически не обезболивают, но качественно подавляют воспалительный процесс, протекающий в суставах. По своим фармакологическим особенностям они угнетают фермент, провоцирующий появление воспаления и способствующий его развитию. Самыми эффективными представителями этой группы признаны Мелоксикам (Мовалис), который пациент должен получать из расчета 8.5-16 мг/день, Пироксикам – по 40-45 мг/день и Рофекоксиб – 13.5 мг/день.
Перечисленные медикаментозные средства характеризуются минимальной вероятностью побочных реакций и обладают целенаправленным видом воздействия. Назначение указанных средств оправдано при наличии заболеваний пищеварительного тракта. Особенности применения лекарственных препаратов этой группы — такие же, как у всех НПВС.
Если у вас есть индивидуальная непереносимость определенных лекарственных средств, нужно изначально сообщить об этом врачу. Даже если ухудшение самочувствия возникло в то время, когда вы уже получаете лечение ревматоидного артрита, новое терапевтическое назначение врача будет не менее эффективным, но без ущерба для здоровья.
На протяжении проводимого лечения врач ориентируется на показатели контрольного лабораторного исследования.
Обезболивание
Доминирующий признак РА — боль в суставах. Неприятное ощущение возникает среди ночи, пробуждает ото сна. Поэтому первостепенная задача при заболевании – купирование болевого синдрома. Врач назначает НПВС при ревматоидном артрите; начинают обычно с Диклофенака. Его свойства оптимальны для купирования признаков заболевания в период рецидива.
Диклофенак обеспечивает следующие реакции:
- сокращает степень проявления болевых ощущений;
- минимизирует отек проблемного участка тела;
- снижает местную гиперемию.
Для достижения положительной динамики нужно придерживаться главного правила – максимальная дозировка препарата не должна превышать 150 мг/день (для взрослого пациента весом до 80 кг вне зависимости от его половой принадлежности).
Для применения всех нестероидных средств существуют такие основы:
- Лекарственные препараты указанной группы обладают накопительным эффектом: не нужно ожидать облегчения самочувствия в первый час после введения раствора. Средний срок, через который отмечаются первые улучшения – 3-4 сутки применения препарата, не раньше.
- Отсутствие терапевтического эффекта по истечении 4 суток говорит о том, что выбранный препарат – слабый в данном клиническом случае, его необходимо заменить более мощным в анальгетическом плане.
- Для предупреждения развития осложнений со стороны пищеварительного тракта и сердца нежелательно применять сочетание из 2 препаратов рассматриваемой группы.
- Инъекции Диклофенака, Ибупрофена или любого другого НПВС проводят только после того, как пациент принял пищу – активные компоненты указанных лекарств сильно раздражают слизистый покров желудка.
Главное осложнение использования НПВП связано с состоянием ЖКТ пациента. Не желая усугубить его, рекомендуется ограничить введение нестероидных средств. Жалобы на боли в желудке, тошноту или рвоту должны послужить основанием для отмены назначения. Обезболивающий эффект по шкале приоритетов менее важен, чем развитие эрозивного гастрита, язвенной болезни желудка или 12-перстной кишки, которыми опасны НПВП. Свести угрозу развития осложнений к минимуму позволит одновременное назначение с НПВС гастропротекторов, защищающих целостность и общее состояние слизистой оболочки желудка. Самым распространенным представителем этой группы является Омепразол – его назначают в дозировке 20 мг.
Проведение гормонотерапии
Чтобы предотвратить развитие патологии и расширение воспалительного спектра, назначают проведение активной гормональной терапии. Положительно зарекомендовали себя кортикостероиды. Гормоны имеют натуральное или искусственное происхождение. Они участвуют в метаболических процессах всех видов.
Востребованность и важность включения гормонов в общий набор лекарств от ревматоидного артрита объясняется их способностью повышать иммунитет до уровня, достаточного для борьбы с системной патологией. Ценится противовоспалительная активность указанных средств.
Гормоны назначают не только отдельно от общего комплекса терапии, но и в качестве дополнения таковой, когда нет ожидаемого эффекта от применения противовоспалительных лекарственных средств нестероидной группы. Кортикостероиды ликвидируют основную симптоматику болезни, купируют процесс поражения внутренних органов.
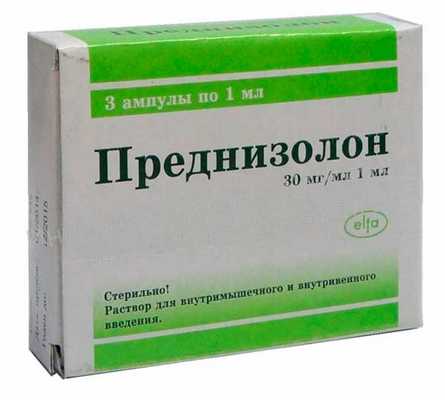
В клинической практике востребован препарат Преднизолон при ревматоидном артрите. Его назначают из расчета 15-20 мг/день, остальные глюкокортикоиды приравниваются к нему в эквивалентной дозе. К примеру, 5 мг Преднизолона равен 4мг Метилпреднизолона или 0,75 мг Триамцинолона.
Планируя проведение гормонотерапии, врач учитывает:
- показатели артериального давления больного (гипертония или высокая предрасположенность к таковой – прямое противопоказание к назначению гормонов);
- состояние иммунитета;
- содержание электролитов в крови (концентрацию ионов калия, кальция, натрия, хлора удается выявить только лабораторным способом);
- возраст, пол и вес пациента.
Во избежание побочных эффектов, которые свойственны некорректному применению гормонов, нужно соблюдать основные принципы их использования и фармакокинетические особенности:
- Схема применения гормонов предполагает ежедневное нарастание дозировки. Начинать применение Преднизолона нужно с незначительной дозировки, а подобрав оптимальную терапевтическую дозу для конкретного клинического случая, придерживаться ее.
- Вечерний объем гормонов не должен превышать утренний.
- Достигнув терапевтического эффекта, допустимо незначительно снизить кратность приема глюкокортикоидов. Сокращают применение гормонов до 1 раза в 6-7 дней, а затем полностью отменяют лекарственное средство.
Гормональные лекарства от ревматоидного артрита эффективны с точки зрения обезболивающего свойства, способности купирования воспалительного процесса. Однако на протяжении всего периода их применения нужно контролировать самочувствие пациента. В частности, мониторировать уровень артериального давления, поскольку этот жизненный показатель под влиянием гормональной терапии возрастает.
Выраженный регресс симптомов неврологического происхождения, быстрое купирование боли, расширение возможностей двигательной активности пораженных суставов, улучшение динамики физического состояния пациента создают положительное клиническое впечатление от проведенного лечения.
Лечение Пентоксифиллином
Пентоксифиллин (ПФ) – востребованное медикаментозное средство для лечения ревматоидного артрита. Лекарственный препарат имеет синтетическое происхождение. Является производным веществом Метилксантина (МТ). Препарат активно применяется при стойком нарушении периферического кровообращения. Ценится способность лекарственного средства улучшать реологические свойства крови, одновременно вызывая вазодилатацию.
До настоящего времени среди специалистов присутствовали дискуссии относительно целесообразности применения ПФ и МТ. Однако у пациентов в группе применения ПФ суставная болезненность и величина СОЭ были немного меньше, чем в группе МТ. Существенных различий по исходным параметрам между группами пациентов, получавших различные варианты терапии, не установлено.
ПФ применяют только в форме раствора для инъекций – таблетки при ревматоидном артрите менее эффективны. Таблетированные средства характеризуются накопительным эффектом и купируют главные признаки не сразу, а при рассматриваемом заболевании необходимо устранить изнурительную болезненность в минимальные сроки.
Ревматоидный артрит (РА) – достаточно распространенное ревматическое заболевание. Течение патологии на всех этапах сопровождается упорным развитием, сложно поддающимся коррекции и устранению. Опасность системного заболевания заключается в том, что при запускании оно приводит человека к инвалидности. Этот факт в сочетании со статистикой отягощений на фоне и вследствие ревматизма должны послужить серьезным основанием для обращения к врачу.
Не нужно дожидаться развития осложнений, перехода воспаления в хроническую форму – посетите врача при наличии отека и скованности в суставах.
Спектр препаратов, применяемых для лечения РА, ограничен, поэтому оправдан активный поиск новых средств, способных подавлять ревматоидное воспаление. Исследователи отметили, что ПФ снижает активность болезни при РА (симптомы воспаления, число припухших и болезненных суставов).
Длительность лечения Пентоксифиллином при ревматизме составляет не менее 1 месяца. Терапевтический эффект от применения ПФ неоспорим, но в 15% из 100 улучшение может быть отсрочено. Положительная динамика в состоянии пациента (базисный эффект) наступает только при условии применения ПФ длительностью не менее 6 месяцев.
Пентоксифиллин известен не только положительным воздействием на суставы: препарат предполагает вероятность развития побочных эффектов.
Таблица побочных эффектов и изменения показателей лабораторного исследования крови пациентов, принимающих Пентоксифиллин
| Длительность применения средства | Физические осложнения | Изменения лабораторных показателей крови |
| 35 пациентов принимали препарат одновременно с нестероидными средствами на протяжении 14 дней, что позволило визуализировать следующие явления: | Повышенная потливость – у 1 пациента. Чувство прилива жара – у 11. Алопеция – у 1. Кожные высыпания – у 1. Стоматит – у 1. Развитие периферических отеков – у 1 пациента. Гастралгия возникла у 1 больного | В биохимическом анализе крови удалось выявить снижение C-реактивного белка. Клинический анализ крови отражает сниженную скорость оседания эритроцитов (СОЭ). Однако через 6 месяцев терапевтического курса оцениваемые результаты соответствовали исходным данным |
| 30 пациентов принимали препарат отдельно от нестероидных средств на протяжении 21 дня, что позволило визуализировать следующие явления: | Боль в правом подреберье возникла у 2 пациентов. Нарушение вкуса беспокоило 1 больного. Диспепсические расстройства (тошнота, рвота) возникали у 5 человек. Сердцебиение учащалось у 2 пациентов. Головная боль и головокружение возникали у 2 человек | Уменьшение болевого синдрома происходит только при условии применения ПФ вместе с МТ и только на протяжении курса длительностью 3 месяца |
Суммируем проведенные наблюдения: в группе больных, получавших ПФ не в составе комплексной терапии, достоверно не улучшился ни один показатель за весь период наблюдения.
Заключение
Ревматоидный артрит – это серьезное заболевание. Оно не несет угрозы для жизни, как онкологические новообразования, но изнурительная симптоматика и постепенное поражение внутренних органов на фоне ослабленного иммунитета разрушительны для здоровья. Категорически противопоказано проводить терапию по собственному усмотрению.
Даже самое эффективное лекарство от ревматоидного артрита не поможет, если его назначал не врач. Ликвидировать патологию удается не во всех случаях – качественные препараты, которые принимались пациентом по схеме, установленной специалистом, позволяют достичь ремиссии. Однако первое уменьшение болезненности в суставах и минимальное улучшение самочувствия не должны послужить поводом для прекращения лечения – пройдите курс полностью!
Читайте также:
- Лучевая оценка межтеловых спейсеров позвоночника
- Дилатация сердца. Дилатационная кардиомиопатия без нарушений проводимости
- Диагностика тогавирусов. Лечение тогавирусной инфекции. Профилактика тогавирусной инфекции.
- Диагностика причины гемифациального спазма по МРТ
- Изменения анализов при хроническом гепатите, холецистите и холангите
