Лекарства и токсины приводящие к панкреатиту
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Актуальность проблемы острого панкреатита определяется высокой заболеваемостью, большой продолжительностью лечения, значительным уровнем послеоперационной летальности при деструктивных формах [4, 5]. Тяжелое состояние больных и летальные исходы при остром панкреатите уже в ранние сроки, определяемые часами с момента начала заболевания, обусловлены тяжелым панкреатогенным эндотоксикозом. Печень оказывается первым органом-мишенью, на который приходится основной удар токсичных продуктов в виде массивного поступления в кровь воротной вены токсинов, активированных панкреатических и лизосомальных ферментов, биологически активных веществ [2, 6], что в последующем приводит к развитию недостаточности печеночной функции различной степени выраженности. В настоящее время важная роль в насыщении организма эндотоксинами придается энтеральной недостаточности, которая потенцирует степень эндогенной интоксикации и обусловливает дальнейшее прогрессирование синдрома полиорганной недостаточности [3]. Патогенетический подход к терапии острого панкреатита, основанный на изучении его молекулярных механизмов, является одним из наиболее перспективных в повышении эффективности лечения [1, 8]. С учетом значимости функциональной недостаточности печени и кишечника в прогрессировании синдрома эндогенной интоксикации становится очевидной необходимость своевременной гепато- и энетеропротекторной терапии [7], которая может быть наиболее адекватной при углубленных знаниях патогенеза острого панкреатита.
Цель работы - изучение влияние нового мембранопротектора ремаксола (комплексный инфузионный отечественный препарат, содержащий янтарную кислоту, рибоксин, никотинамид, метионин, натрий, калий, магния хлорид) на показатели функционально-метаболических характеристик печени и кишечника в аспекте оценки эффективности препарата в коррекции синдрома эндогенной интоксикации при остром панкреатите.
Материал и методы
В основу работы положены экспериментальные исследования на взрослых беспородных половозрелых собаках обоего пола массой от 7,8 до 12,1 кг, разделенных на 2 группы. 1-я группа (n=15) – контрольная: животным с целью воспроизведения синдрома эндогенной интоксикации моделировали острый панкреатит по способу В.М. Буянова и соавт. (1989). Собакам под тиопентал-натриевым наркозом (0,04 г на 1 кг массы) выполняли срединную лапаротомию, пунктировали желчный пузырь, забирали желчь с последующим лигированием места пункции. Затем желчь вводили в паренхиму вертикальной части поджелудочной железы по 0,6 мл в 5 точек. В контрольные сроки (1-е, 3-и, 5-е сутки) животным осуществляли биофизические исследования, забор крови, биопсию ткани печени, кишечника. В динамике заболевания исследовали функционально-метаболические параметры печени и кишечника, определяли состав мембранных липидов, содержание маркеров эндотоксикоза. В послеоперационном периоде животным проводили инфузионную терапию (внутривенные введения 5% раствора глюкозы и 0,89% раствора натрия хлорида из расчета 50 мл на 1 кг массы животного). 2-я группа (n=15) - опытная: при развитии синдрома эндогенной интоксикации оценивали эффективность ремаксола (внутривенные введения препарата из расчета 15 мл/кг) в коррекции патологических изменений изучаемых показателей гомеостаза.
Проводили определение молекул средней массы (О.И. Пикуза, Л.З. Шакирова; 1994 г.), общей и эффективной концентрации альбумина - ОКА, ЭКА (Ю.А. Грызунов, Г.Е. Добрецов, 1994 г.), мочевины в сыворотке крови (Р. Досон и соавт., 1991 г.), креатинина, билирубина (метод Яффе), активности аланиновой и аспарагиновой аминотрансфераз в сыворотке крови (Р. Досон и соавт., 1991 г.), вено-венозный градиент определяли по методу Лендиса; регистрировали окислительно-восстановительный потенциал, устанавливали коэффициент диффузии кислорода на основе учета темпа падения диффузного тока восстановления по уравнению И.М. Эпштейна, использовали хроматографические методы анализа липидов (тонкослойная хроматография); количественное определение липидов, изучение показателей интенсивности ПОЛ (Д.Ю. Егоров, А.В. Козлов, 1988 г.) и активности фосфолипазы А2.
Результаты
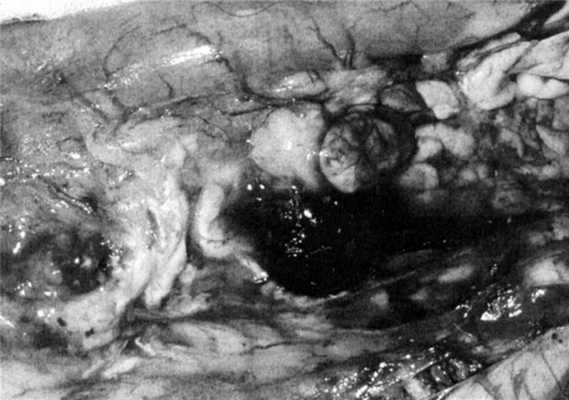
Экспериментально установлено, что при выбранной модели у всех животных возникал острый панкреатит с соответствующими макро- и микроскопическими проявлениями (рис. 1), Рисунок 1. Макроскопическая картина поджелудочной железы с прилежащими к ней тканями на 3-и сутки развития острого панкреатита. причем в 4 случаях происходило прогрессирование панкреатита, развивался тотальный панкреонекроз. Одним из клинико-лабораторных признаков острого панкреатита явилось повышение (на 145-297,9%) уровня α-амилазной активности и синдром эндогенной интоксикации, прогрессирующий несмотря на применение инфузионной терапии, что проявлялось существенным повышением в плазме крови уровня гидрофильных и гидрофобных токсичных продуктов (индекс токсичности плазмы крови превышал норму на 60,0-290,2%; р<0,05).
Формирование синдрома эндогенной интоксикации сопровождалось модификацией функционально-метаболических параметров печени, что проявилось накоплением в крови продуктов азотистого обмена, билирубина, «печеночных» ферментов и кишечника: проницаемость сосудов микроциркуляторного русла кишечника для воды и белка была повышена, коэффициент диффузии кислорода снижался на 27,9-58,1% (p<0,05), электрогенез уменьшался на 25,1-68,0% (p<0,05).
Известно, что функциональная активность паренхиматозных клеток зависит от количества и состава липидов тканевых структур [2]. Данный факт нашел подтверждение и в этой серии экспериментов при выявлении существенных липидных дестабилизаций тканевых структур печени и кишечника на фоне эндогенной интоксикации. Это сопровождалось интенсификацией основных липидмодифицирующих процессов.
Проведенные исследования выявили достоверную корреляционную зависимость (r=0,75-0,98) между нарушениями функционально-метаболического статуса печени и кишечника и выраженностью синдрома эндогенной интоксикации, что подтверждает необходимость своевременной коррекции обнаруженных расстройств с включением в терапию острого панкреатита гепато- и энтеропротекторного компонента.
Экспериментально установлено, что включение ремаксола в терапию не только предупреждало прогрессирование острого панкреатита, но и способствовало сравнительно быстрому купированию воспалительных явлений в поджелудочной железе (рис. 2), Рисунок 2. Макроскопическая картина поджелудочной железы с прилежащими к ней тканями на 3-и сутки развития острого панкреатита на фоне применения ремаксола. что сопровождалось снижением активности α-амилазы на 19,7-48,43% (р <0,05) относительно контроля. Одним из характерных признаков благотворного действия препарата явилось уменьшение случаев трансформации морфологических поражений органа (тотальный панкреонекроз отмечен у 1 животного). Безусловно, одним из факторов положительного влияния препарата была быстрая и эффективная коррекция функциональной активности печени и кишечника. Так, на фоне применения препарата активность АСТ и АЛТ незначительно возрастала относительно нормы, но была достоверно ниже контроля на 12,9-11,4 и 14,2-16,0% (р<0,05) соответственно; содержание билирубина и креатинина уменьшалось по сравнению с контролем на 8,3-16,2 и 9,6-34,1% (р<0,05) соответственно. Проницаемость сосудов микроциркуляторного русла кишечника для воды и белка была ниже, чем в контрольной группе (рис. 3); Рисунок 3. Показатели транскапиллярного обмена в ткани кишечника при остром панкреатите на фоне применения ремаксола. Здесь и на рис. 4: * - достоверность различия показателей по отношению к контролю при p<0,05; к - данные контрольной группы исследований; о - данные опытной группы исследований); КФ - капиллярный фильтрат, ПБ - потеря белка. коэффициент диффузии кислорода возрастал относительно контрольных данных на 53,9-57,1% (p<0,05); окислительно-восстановительный потенциал превосходил контроль на 22,93-29,68% (p<0,05).
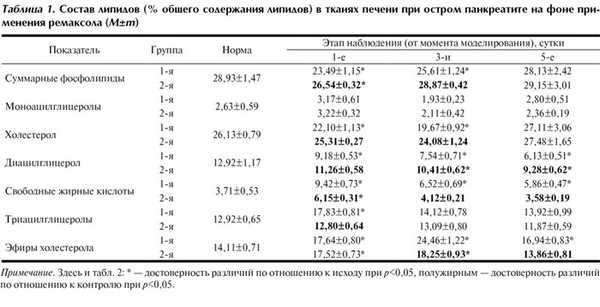
Восстановление функционального состояния печени и кишечника на фоне применения ремаксола тесно коррелировало со снижением выраженности дислипидных явлений в биомембранах клеточных структур печени и кишечника. На фоне применения апробируемого препарата была зафиксирована положительная динамика состава липидов тканевых структур печени уже в 1-е сутки терапии (табл. 1).
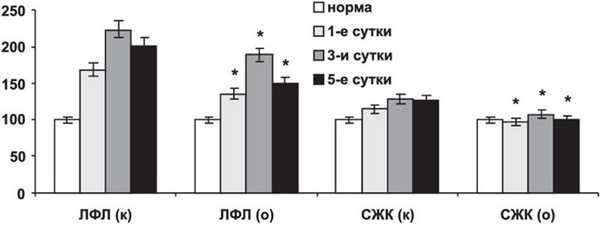
В ткани кишечника содержание суммарных фосфолипидов, холестерола, эфиров холестерола, триацилглицеролов и фосфатидилхолина было выше данных контроля и существенно не отличалось от нормы (за исключением двух последних фракций); содержание фосфатидилинозита возрастало относительно контроля на 30,0-71,2% (p <0,05), фосфатидилсерина - на 23,2-48,2% (p<0,05); удельный вес свободных жирных, лизофосфолипидов, моноацилглицеролов и диацилглицеролов был достоверно ниже контрольных данных (рис. 4). Рисунок 4. Состав липидов ткани кишечника при остром панкреатите на фоне применения ремаксола. ЛФЛ - лизоформы фосфолипидов, СЖК - свободные жирные кислоты.
Экспериментально установлено, что применение ремаксола в терапии острого панкреатита приводит к уменьшению воспалительных явлений в поджелудочной железе, обусловливает снижение выраженности эндогенной интоксикации, что было зафиксировано в виде уменьшения концентрации в плазме крови токсичных продуктов гидрофильной и гидрофобной природы. Корреляционный анализ показал, что важную роль в реализации детоксикационного эффекта ремаксола играют выявленные гепато- и энтеропротекторные эффекты препарата.
Применение ремаксола способствовало восстановлению функционального потенциала печени. Так, снижение содержания неутилизированных продуктов в плазме крови на фоне терапии острого панкреатита ремаксолом являлось фактическим доказательством восстановления метаболизма данных веществ в печени. Кроме того, применение апробируемого препарата приводило к восстановлению пигментрегулирующей функции печени, что проявилось снижением концентрации общего билирубина в плазме крови. Уменьшение активности в крови печеночных ферментов - аланин- и аспартатаминотрансферазы следует расценивать как снижение интенсивности воспалительных и цитолитических процессов в печени, что свидетельствует о значительном гепатопротекторном эффекте препарата. Использование ремаксола в комплексном лечении острого экспериментального панкреатита позволило ограничить нарушения функциональных параметров кишечника за счет восстановления трофики, микроциркуляции и биоэнергетики тканей органа.
Следует отметить, что механизмом коррекции печеночной и кишечной дисфункции ремаксола явилась его способность восстанавливать липидный метаболизм тканевых структур органов. Мембранопротекторное действие препарата в отношении клеточных структур исследованных органов проявляется за счет его способности снижать интенсивность процессов перекисного окисления липидов, фосфолипазной активности, повышать антиоксидантный энзимный потенциал, предотвращая прогрессирование печеночной и энтеральной недостаточности с начальных стадий заболевания. Подчеркнем, что положительный эффект ремаксола проявляется уже с первых суток применения.
Таким образом, применение ремаксола в терапии острого панкреатита способствует уменьшению воспалительных явлений в органе, эффективной коррекции синдрома эндогенной интоксикации, что определяется способностью препарата предупреждать развитие печеночной и энтеральной недостаточности, корригируя начальные проявления дисфункции печени и кишечника.
Выраженный гепато- и энтеропротекторный эффект ремаксола обусловлен мембраностабилизирующим действием за счет его способности уменьшать интенсивность процессов перекисного окисления липидов и активность фосфолипазы А2, улучшать трофику, электрогенез и диффузионную способность тканей для кислорода.
Лекарства и токсины приводящие к панкреатиту
Лекарства приводящие к метаболическим нарушениям
Некоторые индуцируемые лекарствами метаболические расстройства перечислены ниже.
Фармакогенные метаболические расстройства и лечение связанных с ними критических состояний:
1. Избыток жидкости:
а) Причины. Избыток углеводов и Na; внутривенные вливания.
б) Коррекция. Мониторинг поступления/выведения, максимальное концентрирование всех жидкостей, ограничение Na.
2. Гиперкалиемия:
а) Причины. К-сберегающие диуретики, избыточное введение К, ацидоз.
б) Коррекция. Мягкая стимуляция диуреза петлевыми диуретиками, миниторинг К в сыворотке и моче, бывает необходим полистиролсульфонат натрия.
3. Гипернатриемия:
а) Причины. Препараты с высоким содержанием Na; кровепродукты.
б) Коррекция. Мягкая стимуляция диуреза с введением "чистой воды", избегание препаратов с высоким содержанием Na; ограничение Na и декстрозы; мониторинг уровней Na в сыворотке и моче.
4. Гипокальциемия:
а) Причины. Избыток цитрата при поступлении с кровепродуктами, агрессивное введение фосфата.
б) Коррекция. Введение Са с учетом сывороточной концентрации, поддержание величины Са х фосфат < 70.
5. Гипокалиемия:
а) Причины. Амфотерицин В, кортикостероиды, диуретики, алкалоз.
б) Коррекция. Компенсация потерь К с мочой, мониторинг К в сыворотке и моче.
6. Гипомагниемия:
а) Причины. Цисплатин, циклоспорин, диуретики.
б) Коррекция. Введение Mg с учетом сывороточной концентрации; при необходимости — мониторинг потерь с мочой.
7. Гипонатриемия:
а) Причины. Диуретики, назогастральные потери.
б) Коррекция. Компенсация диуретических и назогастральных потерь, мониторинг Na в сыворотке, моче и назогастральной жидкости.
8. Гипофосфатемия:
а) Причины. Содержащие аллюминий антациды; кортикостероиды, высокий сывороточный инсулин, агрессивное введение Са.
б) Коррекция. Введение фосфата с учетом сывороточной концентрации; < 0,96 ммоль/кг в сутки; поддержание соотношения Са х фосфат
9. Метаболический ацидоз:
а) Причины. Амфотерицин В, аминогликозиды.
б) Коррекция. Оценка кислотного (анионного) дефицита, мониторинг газов артериальной крови и снятие дефицита ацетатами.
10. Метаболический алкалоз:
а) Причины. Диуретики, минералокортикостероиды, большие назогастральные потери с низким рН > 140 мэкв цитрата с кровепродуктами.
б) Коррекция. Оценка катионного дефицита, мониторинг газов артериальной крови и снятие дефицита хлоридами и/или HCl; применение антагонистов Н2 при больших назогастральных потерях с низким желудочным рН.
Фармакогенная гиперкалиемия может быть результатом нарушения поступления калия в клетки (ингибирования Na+/К+-АТФазы), которое наблюдается при использовании наперстянки, антагонистов b2-адренорецепторов и средств, вызывающих ацидоз. Пониженная экскреция калия отмечается при приеме калийсберегающих диуретиков, ингибиторов ангиотензинпревращающего фермента, нестероидных противовоспалительных средств и агентов, нарушающих функцию почечных канальцев.
Гиперкалиемия следует за блокадой натриевых каналов (амилорид) и сочетается с абдоминальными и мышечными болями, поносом, слабостью, изменениями ЭКГ (высокие заостренные зубцы Т, подавленный сегмент ST, удлиненные интервал P—R и комплекс QRS) и сердечными аритмиями (желудочковыми тахикардией и фибрилляцией). Лечат это расстройство глюкозой, вливанием инсулина, бикарбонатом натрия и глюконатом кальция. Могут потребоваться ионообменные смолы и гемодиализ.
Фармакогенная гипокалиемия возникает при усиленном поступлении калия в клетки (повышение активности Na+/К+-АТФазы, индуцированное b2-агонистами, теофиллином, инсулином), при конкурентной блокаде калиевых каналов (хлорохин, барий), желудочно-кишечных потерях и фармакогенном метаболическом алкалозе.
Гипокалиемия ведет к генерализованной мышечной слабости, паралитической непроходимости кишечника, электрокардиографическим изменениям (плоские или обращенные зубцы Т, выраженные зубцы U, подавленный сегмент ST) и сердечным аритмиям (предсердная тахикардия, сердечная блокада, предсердно-желудочковая диссоциация, желудочковые тахикардия и фибрилляция). Если сывороточный уровень калия превышает 3 ммоль/л, его дают перорально, если этот уровень ниже, — вводят внутривенно.
Фармакогенная гипернатриемия наблюдается при избыточном потреблении натрия и солевых рвотных средств, применении солевых клизм, внутривенном вливании физраствора, чрезмерных потерях воды и применении средств, вызывающих несахарный диабет, включая литий, фенитоин и алкоголь. Лечение заключается в ограничении поступления воды, иногда с использованием петлевых диуретиков.
Фармакогенная гипонатриемия наблюдается при чрезмерном поступлении в организм воды и нарушении ее экскреции почками, обусловленной повышенной активностью антидиуретического гормона, что связано с интоксикацией карбамазепином, хлорпропамидом и нестероидными противовоспалительными средствами. Лечение заключается в ограничении потребления воды, иногда с использованием петлевых диуретиков.
Если сывороточный уровень натрия ниже 120 ммоль/л и присутствуют церебральные симптомы, осторожно вливают гипертонический солевой раствор. При слишком быстрой коррекции гипонатриемии существует опасность центрального понтинного миелинолиза и отека мозга.
Browning и соавт. считают, что введение 50 % раствора глюкозы показано только больным с гипогликемией. Предварительные данные по животным и человеку наводят на мысль о нежелательности внутривенного введения содержащих глюкозу растворов пациентам с риском церебральной ишемии, например при остром инсульте, грозящей остановке сердца или тяжелой гипотензии, а также лицам, проходящим сердечно-легочную реанимацию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Медикаментозный панкреатит
Медикаментозный панкреатит – воспаление поджелудочной железы, вызванное применением определенных лекарственных средств. Его причиной может быть использование фармакопрепаратов различных групп: стероидов, антибиотиков, ингибиторов протонной помпы, гипотензивных, статинов и других. Основные симптомы – боль и диспепсические явления. В диагностике важна детальная оценка данных анамнеза, лабораторных и инструментальных методов исследования: УЗИ поджелудочной железы, КТ, МРТ органов брюшной полости. Лечение заключается в отмене препарата, ставшего причиной заболевания, обезболивании, дезинтоксикации, подавлении панкреатической ферментативной активности.
Общие сведения
Медикаментозный панкреатит – относительно редкая нозологическая форма, ее частота составляет около 3% всех случаев острых панкреатитов. Несколько чаще данное заболевание встречается у представителей групп риска: пациентов детского возраста и ВИЧ-инфицированных. Несмотря на то, что первый случай медикаментозного панкреатита был описан еще в 1950-х годах, проблема не утрачивает актуальность. С каждым годом расширяется список фармакологических препаратов, которые могут спровоцировать поражение поджелудочной железы. При этом довольно затруднительно оценить способность лекарственного средства вызвать медикаментозный панкреатит: у одних препаратов имеется достаточная доказательная база, у других – лишь единичные сведения, базирующиеся на мнении клинициста об отсутствии другой этиологии заболевания.
С накоплением доказательной базы была разработана классификация лекарственных препаратов по их способности вызывать поражение поджелудочной железы. Данная классификация учитывает 4 критерия: панкреатит развился в период лечения данным лекарственным средством; нет доказательств влияния других вероятных этиологических факторов; симптомы заболевания исчезли после отмены препарата; при повторном его назначении патология рецидивировала.
Причины
К лекарственным средствам, достоверно ассоциированным с развитием медикаментозного панкреатита, относятся следующие: антимикробные препараты (цефтриаксон, ампициллин, тетрациклин, рифампицин, эритромицин, изониазид, нитрофурантоин, метронидазол); противовирусные препараты, которые применяются для лечения ВИЧ (нелфинавир, диданозин); диуретики (хлортиазид, гидрохлортиазид, фуросемид); препараты, используемые в лечении заболеваний ЖКТ (ранитидин, циметидин, омепразол, октреотид), сердечно-сосудистой системы (каптоприл, эналаприл, амиодарон, лозартан); иммуносупрессанты/цитостатики (цитозин, арабинозид, ифосфамид, дексаметазон, паклитаксел, такролимус); другие часто назначаемые препараты (преднизолон, дексаметазон, кодеин, симвастатин, правастатин, парацитомол, эстрогены, эрготамин, даназол, индометацин).
Патогенез медикаментозного панкреатита окончательно не изучен. Крайне редко заболевание развивается при явной передозировке препарата. Существуют теории иммуносупрессивного, осмотического, цитотоксического и метаболического воздействия лекарственных средств, тромбоза панкреатических кровеносных сосудов при применении определенных препаратов. В большинстве случаев медикаментозный панкреатит возникает вследствие идиосинкразии, которая подразумевает развитие побочных эффектов при использовании препарата в стандартных дозировках. Данный тип побочных реакций не зависит от дозировки и непредсказуем.
Симптомы повреждения поджелудочной железы могут развиваться отсрочено, даже уже после отмены препарата, что связывают с накоплением токсических метаболитов. Некоторые лекарственные средства вызывают медикаментозный панкреатит даже спустя месяцы после отмены (например, пентамидин, азатиоприн), другие – даже после однократного приема.
Симптомы медикаментозного панкреатита
Медикаментозный панкреатит практически всегда острый, его течение может варьировать от легкого до крайне тяжелого. В большинстве случаев заболевание протекает как острый отечный панкреатит, в редких случаях развивается некротическая геморрагическая форма, при которой возможен летальный исход.
Клиническая картина медикаментозного панкреатита напоминает таковую при типичном остром воспалении поджелудочной железы. Наиболее характерный симптом – боль в эпигастрии, подреберьях. Болевой синдром может иметь разную интенсивность – от умеренных ноющих ощущений до нестерпимой опоясывающей боли, при которой пациент занимает вынужденное положение (это характерно для некротической формы медикаментозного панкреатита). Также типичны диспепсические явления: тошнота, рвота, диарея. Возможно головокружение, выраженная общая слабость.
Диагностика
Диагностика медикаментозного панкреатита вызывает большие трудности. Это связано с тем, что очень многие лекарственные препараты могут вызывать повреждение поджелудочной железы, время между приемом препарата и развитием клинической картины существенно варьирует, а характерные именно для данного заболевания признаки, выявляемые при лабораторных и инструментальных методиках, отсутствуют. В диагностике очень важна консультация гастроэнтеролога, тщательный опрос пациента, настороженность врача в отношении данной патологии и выявление в анамнезе сведений о применении лекарственных средств, которые потенциально могут вызвать данную патологию.
Очень важно исключение другой причины панкреатита, в первую очередь – алкогольного повреждения и желчнокаменной болезни. Однако на фоне воспаления поджелудочной железы любой этиологии при приеме препарата, индуцирующего лекарственное повреждение, вполне возможен медикаментозный панкреатит, но симптомы чаще всего связывают именно с «привычными» этиологическими факторами. При этом без отмены препарата течение заболевания становится тяжелым, резистентным к мощной терапии.
К возможным биохимическим маркерам медикаментозного панкреатита относят уровень С-реактивного белка. При данной патологии СРБ повышается в значительно меньшей степени, чем при остром воспалении поджелудочной железы другой этиологии, поэтому у всех пациентов с панкреатитом неясного генеза с незначительно повышенным уровнем СРБ можно предположить медикаментозную этиологию заболевания. С целью исключения аутоиммунной причины определяют уровень IgG4, который должен быть в норме. В общем анализе крови при медикаментозном панкреатите выявляется лейкоцитоз, повышение СОЭ, в биохимических анализах крови – повышение амилазы крови, Г-ГТП, ЛДГ, возможно повышение глюкозы крови.
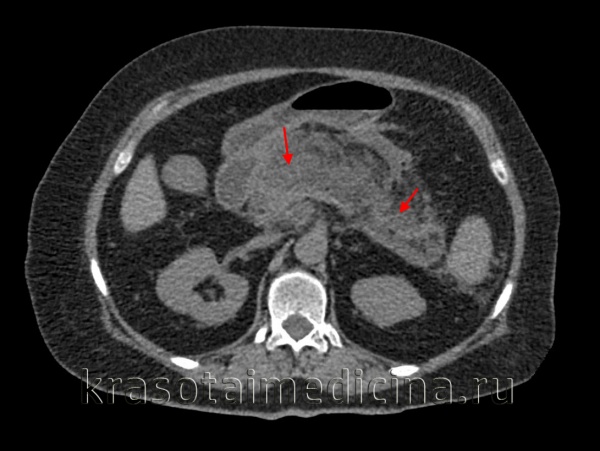
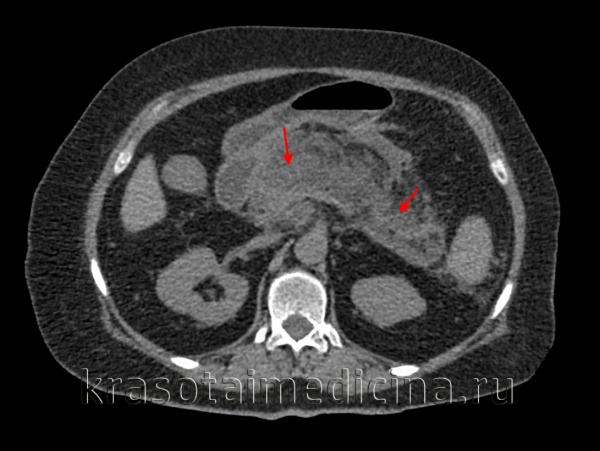
Инструментальные методы исследования, которые проводятся при подозрении на медикаментозный панкреатит, выявляют воспаление поджелудочной железы, однако типичных именно для лекарственной этиологии признаков нет. УЗИ поджелудочной железы позволяет определить увеличение органа, изменение эхогенности паренхимы. Для детальной оценки состояния поджелудочной железы и соседних органов проводится КТ, МРТ, МСКТ органов брюшной полости.
Лечение медикаментозного панкреатита
Лечение пациентов с медикаментозным панкреатитом в зависимости от тяжести течения заболевания может проводиться в отделении гастроэнтерологии или интенсивной терапии. Обязательно назначается диета (в первые сутки полный голод с постепенным переходом на стол №5). Главное в лечении данного заболевания – отмена лекарственного средства, вызвавшего повреждение поджелудочной железы.
Консервативная терапия заключается в применении обезболивающих препаратов, дезинтоксикации. С целью предупреждения инфекционных осложнений назначаются антибиотики. Также вводятся спазмолитические препараты, глюкозо-новокаиновая смесь, применяются антигистаминные препараты. Внутривенно капельно вводят инфузионные растворы с ингибиторами протеаз (апротинин).
При геморрагической форме медикаментозного панкреатита с целью обезболивания вводят промедол. В случае массивной панкреатогенной токсемии применяют методы экстракорпоральной гемокоррекции. При неэффективности консервативной терапии при некротическо-геморрагическом медикаментозном панкреатите проводят хирургическое лечение, которое заключается во вскрытии панкреатической капсулы, дренировании железы, удалении участков некротизированной паренхимы (некрэктомии). В редких случаях производят резекцию части поджелудочной железы или ее полное удаление.
Прогноз и профилактика
Прогноз при медикаментозном панкреатите зависит от степени тяжести заболевания. В большинстве случаев патология протекает в доброкачественной форме и хорошо поддается терапии после отмены препарата. Однако при некротическо-геморрагической форме летальность высокая – около 70%. Очень важен контроль проводимой фармакотерапии в случае применения препаратов, потенциально опасных в плане повреждения поджелудочной железы.
Специфической профилактики данного заболевания нет. Категорически запрещается самостоятельное применение лекарственных препаратов, особенно из тех групп, которые могут стать причиной медикаментозного панкреатита.
Острый панкреатит
Острый панкреатит – воспаление поджелудочной железы. Симптомы острого панкреатита: острая, нестерпимая боль в области живота. В зависимости от того, какая часть железы воспалена, локализация боли возможна в правом или в левом подреберье, в подложечной области, боль может быть опоясывающей. Хронический панкреатит сопровождается потерей аппетита, нарушением пищеварения, острыми болями (как при острой форме), возникающими после употребления жирной, острой пищи или алкоголя.
МКБ-10
Панкреатит – заболевание, характеризующееся развитием воспаления в ткани поджелудочной железы. По характеру течения панкреатит разделяют на острый и хронический. Острый панкреатит занимает третье место среди заболеваний брюшной полости острого течения, требующих лечения в хирургическом стационаре. Первое и второе место занимают острые аппендицит и холецистит.
Согласно данным мировой статистики, в год острым панкреатитом заболевает от 200 до 800 человек из миллиона. Это заболевание чаще встречается у мужчин. Возраст больных колеблется в широких пределах и зависит от причин развития панкреатита. Острый панкреатит на фоне злоупотребления алкоголем возникает в среднем в возрасте около 39 лет, а при панкреатите, ассоциированном с желчекаменной болезнью, средний возраст пациентов – 69 лет.
Факторы, способствующие возникновению острого панкреатита:
- злоупотребление алкоголем, вредные пищевые привычки (жирная, острая пища);
- желчекаменная болезнь;
- инфицирование вирусом (свинка, вирус Коксаки) или бактериальное заражение (микоплазма, кампилобактерии);
- травмы поджелудочной железы;
- хирургические вмешательства по поводу других патологий поджелудочной железы и желчевыводящих путей;
- прием эстрогенов, кортикостероидов, тиазидных диуретиков, азатиоприна, других лекарственных средств с выраженным патологическим действием на поджелудочную железу (медикаментозный панкреатит);
- врожденные аномалии развития железы, генетическая предрасположенность, муковисцидоз;
- воспалительные заболевании органов пищеварения (холецистит, гепатит, гастродуоденит).
Патогенез
В развитии острого воспаления поджелудочной железы согласно самой распространенной теории основным фактором выступает повреждение клеток преждевременно активированными ферментами. В нормальных условиях пищеварительные ферменты вырабатываются поджелудочной железой в неактивной форме и активизируются уже в пищеварительном тракте. Под воздействием внешних и внутренних патологических факторов механизм выработки нарушается, ферменты активизируются в поджелудочной железе и начинают переваривание ее ткани. Результатом становится воспаление, развивается отек ткани, поражаются сосуды паренхимы железы.
Патологический процесс при остром панкреатите может распространяться на близлежащие ткани: забрюшинную клетчатку, сальниковую сумку, брюшину, сальник, брыжейку кишечника и связки печении ДПК. Тяжелая форма острого панкреатита способствует резкому повышению уровня различных биологически активных веществ в крови, что ведет к выраженным общим нарушениям жизнедеятельности: вторичные воспаления и дистрофические расстройства в тканях и органах – легких, печени, почках, сердце.
Классификация
Острый панкреатит классифицируется по степени тяжести:
- легкая форма протекает с минимальным поражением органов и систем, выражается в основном интерстициальным отеком железы, легко поддается терапии и имеет благоприятный прогноз к быстрому выздоровлению;
- тяжелая форма острого панкреатита характеризуется развитием выраженных нарушений в органах и тканях, либо местными осложнениями (некроз тканей, инфицирование, кисты, абсцессы).
Тяжелая форма острого панкреатита может сопровождаться:
- острым скоплением жидкости внутри железы либо в околопанкреатическом пространстве, которые могут не иметь грануляционных или фиброзных стенок;
- панкреатическим некрозом с возможным инфицированием тканей (возникает ограниченная или разлитая зона отмирающей паренхимы и перипанкреатических тканей, при присоединении инфекции и развитием гнойного панкреатита повышается вероятность летального исхода);
- острой ложной кистой (скоплением панкреатического сока, окруженным фиброзными стенками, либо грануляциями, которое возникает после приступа острого панкреатита, формируется в течение 4 и более недель);
- панкреатическим абсцессом (скопление гноя в поджелудочной железе или близлежащих тканях).
Симптомы острого панкреатита
Характерные симптомы острого панкреатита.
- Болевой синдром. Боль может локализоваться в эпигастрии, левом подреберье, носить опоясывающий характер, иррадиировать под левую лопатку. Боль носит выраженный постоянный характер, в положении лежа на спине усиливается. Усиление боли происходит и после приема пищи, особенно – жирной, острой, жареной, алкоголя.
- Тошнота, рвота. Рвота может быть неукротимой, содержит желчь, не приносит облегчения.
- Повышение температуры тела.
- Умеренно выраженная желтушность склер. Редко – легкая желтуха кожных покровов.
Кроме того, острый панкреатит может сопровождаться диспепсическими симптомами (метеоризм, изжога), кожными проявлениями (синюшные пятна на теле, кровоизлияния в области пупка).
Осложнения
Опасность острого панкреатита заключается в высокой вероятности развития тяжелых осложнений. При инфицировании воспаленной ткани железы бактериями, обитающими в тонком кишечнике, возможен некроз участков железы и возникновение абсцессов. Это состояние без своевременного лечения (вплоть до хирургического вмешательства) может закончится летальным исходом.
При тяжелом течении панкреатита может развиться шоковое состояние и, как следствие, полиорганная недостаточность. После развития острого панкреатита в ткани железы могут начать формироваться псевдокисты (скопления жидкости в паренхиме), которые разрушают структуру железы и желчных протоков. При разрушении псевдокисты и истечении ее содержимого возникает асцит.
Диагностику панкреатита гастроэнтерологи осуществляют на основании жалоб, физикального осмотра, выявления характерных симптомов. При измерении артериального давления и пульса зачастую отмечают гипотонию и тахикардию. Для подтверждения диагноза служат лабораторные исследования крови и мочи, МСКТ и УЗИ органов брюшной полости, МРТ поджелудочной железы.
- Биохимия крови. При исследовании крови в общем анализе отмечаются признаки воспаления (ускорена СОЭ, повышено содержание лейкоцитов), в биохимическом анализе крови обнаруживают повышение активности панкреатических ферментов (амилаза, липаза), возможна гипергликемия и гипокальциемия. Может отмечаться билирубинемия и повышения активности печеночных ферментов.
- Биохимия мочи. Проводят определение концентрации ферментов в моче. При диагностировании острого панкреатита берут биохимический анализ мочи и определяют активность амилазы мочи.
- Инструментальные методы. Визуальное исследование поджелудочной железы и близлежащих органов (УЗИ, КТ, МРТ) позволяет выявить патологические изменения паренхимы, увеличение органа в объеме, обнаружить абсцессы, кисты, наличие камней в желчных протоках.

Дифференциальную диагностику острого панкреатита проводят с:
- острым аппендицитом и острым холециститом;
- перфорациями полых органов (прободные язвы желудка и кишечника);
- острой кишечной непроходимостью;
- острым желудочно-кишечным кровотечением (кровоточащая язва желудка и 12п. кишки, кровотечение из варикозных вен пищевода, кишечное кровотечение);
- острый ишемический абдоминальный синдром.
Лечение острого панкреатита
При остром панкреатите показана госпитализация. Всем пациентам предписан постельный режим. Основными целями терапии является снятие болевого синдрома, снижение нагрузки на поджелудочную железу, стимуляция механизмов ее самовосстановления.
Терапевтические меры:
- новокаиновая блокада и спазмолитики для снятия выраженного болевого синдрома;
- голод, лед на область проекции железы (создание локальной гипотермии для снижения ее функциональной активности), питание осуществляют парентеральное, желудочное содержимое аспирируют, назначают антациды и ингибиторы протонной помпы;
- дезактиваторы панкреатических ферментов (ингибиторы протеолиза);
- необходимая коррекция гомеостаза (водно-электролитного, кислотно-основного, белкового баланса) с помощью инфузии солевых и белковых растворов;
- дезинтоксикационная терапия;
- антибиотикотерапия (препараты широкого спектра действия в больших дозировках) в качестве профилактики инфекционных осложнений.
Хирургическое лечение
Хирургическая тактика показана в случае выявления:
- камней в желчных протоках;
- скоплений жидкости в железе или вокруг нее;
- участков панкреатического некроза, кист, абсцессов.
К операциям, проводимым при остром панкреатите с образованием кист или абсцессов, относятся: эндоскопическое дренирование, марсупиализация кисты, цистогастростомия и др. При образовании участков некроза, в зависимости от их размера, проводят некрэктомию или резекцию поджелудочной железы. Наличие камней является показанием к операциям на протоке поджелудочной железы.
К хирургическому вмешательству могут прибегать и в случае сомнений в диагностики и вероятности пропустить другое хирургическое заболевание, требующее хирургического лечения. Послеоперационный период подразумевает интенсивные меры профилактики гнойно-септических осложнений и восстановительную терапию.
Лечение легкой формы панкреатита, как правило, не представляет трудностей, и положительная динамика отмечается уже в течение недели. Для излечения от тяжелой формы панкреатита требуется заметно больше времени.
Прогноз при остром панкреатите зависит от его формы, адекватности терапии и наличия осложнений. Легкая форма панкреатита обычно дает благоприятный прогноз, а при некротических и геморрагических панкреатитах высока вероятность летального исхода. Недостаточное лечение и несоблюдение врачебных рекомендаций по диете и режиму могут привести к рецидивам заболевания и развитию хронического панкреатита.
Первичной профилактикой является рациональное здоровое питание, исключение алкоголя, острой, жирной обильной пищи, отказ от курения. Острый панкреатит может развиться не только у лиц, регулярно злоупотребляющих алкоголем, но и как следствие однократного приема спиртосодержащих напитков под жирную, жареную и острую закуску в больших количествах.
Кафедра госпитальной хирургии №1 лечебного факультета Первого московского государственного медицинского университета им. И.М. Сеченова Минздравсоцразвития РФ
ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава РФ, Москва, Россия
Отделение хирургии печени, желчных путей и поджелудочной железы Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, Москва
Антисекреторная терапия при остром панкреатите
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2017;(4): 69‑72
Острый панкреатит (ОП) — одно из наиболее распространенных и тяжелых ургентных заболеваний, составляющих 5—13% всех хирургических болезней, но до настоящего времени нет единого представления об этиологии и патогенезе ОП, что и определяет различные подходы к его лечению. В случае поражения забрюшинной клетчатки процесс склонен к скорейшему распространению из-за отсутствия тканевых барьеров и пагубного воздействия ферментов на клетчатку. Показатели летальности и гнойных осложнений при ОП все еще остаются высокими, что требует своевременного проведения комплекса консервативных мероприятий и по показаниям — хирургических вмешательств [2, 4, 5, 7, 15]. При этом в структуре летальности на долю гнойных осложнений приходится от 40 до 80%. Для предотвращения подобных осложнений необходимо адекватное лечение заболевания в фазе энзимной токсемии и промежуточной фазе ОП [1, 4, 5, 7, 12, 15, 24].
Основными звеньями консервативного лечения, имеющего целью профилактику развития гнойно-некротических осложнений, являются антибактериальная терапия и подавление секреции поджелудочной железы (ПЖ) [5, 12, 22]. В отличие от вопросов антибактериальной терапии в вопросах, касающихся антисекреторной терапии, возникают разногласия [1, 10, 20]. Особая роль отводится антисекреторной терапии именно в ранних фазах О.П. Все исследователи признают стимулирующее влияние приема воды и пищи через рот на секрецию ПЖ и недопустимость перорального питания в ранние фазы заболевания [9, 10, 12, 30, 33].
Среди немедикаментозных методов угнетения секреции ПЖ выделяют лечебное голодание, назогастральное дренирование и аспирацию желудочного содержимого [5, 20, 24], гипотермию ПЖ [10] и кишечный лаваж, антисекреторный эффект которого обусловлен снижением высвобождения гастроинтестинальных пептидов, стимулирующих экзокринную функцию ПЖ, что позволяет устранить явления динамической кишечной непроходимости в кратчайшие сроки, тем самым способствуя снижению частоты гнойных осложнений и общей летальности [5, 13, 14, 22].
Предложено интрадуоденальное введение протеолитических ферментов для обратного торможения секреции ПЖ, но единичный характер таких исследований препятствует широкому распространению метода [14]. Холиноблокаторы при ОП (атропин, платифиллин, скополамин) способствуют снижению секреторной активности ПЖ, однако их применение не приводит к существенному улучшению течения ОП, поэтому с учетом побочных действий эту группу препаратов в последнее время практически не используют. Ряд исследователей предлагают использовать селективные блокаторы H2-рецепторов [14, 20], такие как циметидин, ранитидин, квамател (фамотидин), роксатидин. Механизм их действия основан на блокировании H2-рецепторов обкладочных клеток слизистой оболочки желудка и снижении по этой причине продукции и поступления соляной кислоты в просвет желудка. Вместе с тем некоторые авторы скептически относятся к применению этих препаратов при ОП.
Существуют данные о благоприятном влиянии ингибиторов протеаз на течение ОП в ранних фазах, в разных дозах и при различных путях введения (внутривенное, внутриаортальное, внутрибрюшинное, комбинированное, селективно в чревную и общую печеночную артерию) [10, 23]. В клинической практике довольно широкое распространение получили следующие ингибиторы протеаз: контрикал, трасилол, гордокс, пантрипин, цалол. Общим свойством ингибиторов (антиферментных препаратов) является способность блокировать активность протеолитических ферментов путем образования с ними стойких неактивных комплексов. К настоящему времени опубликовано более 2000 работ, посвященных применению антиферментных препаратов для лечения ОП как в клинике, так и в эксперименте, однако единого мнения о патогенетической обоснованности их применения, эффективности, дозах, путях введения не сложилось. Многие хирурги считают применение ингибиторов неэффективным, ссылаясь на то, что антиферментные препараты даже в больших дозах не прерывают некротический процесс в железе и парапанкреатической клетчатке. При отечной форме панкреатита использование трасилола и других антиферментных препаратов не оправдано как с клинической, так и с экономической точки зрения. Все же полностью отказываться от применения ингибиторов протеаз не рекомендуется [8, 20].
Достигнуты успехи в лечении ОП цитостатиками и панкреатической рибонуклеазой, которые, блокируя клеточную транскрипцию и трансляцию, угнетают энзимопродукцию ациноцитами П.Ж. Одни авторы рекомендуют 5-фторурацил [10], другие — циклофосфан. Токсичность цитостатиков, угнетение иммунной системы, эритро- и лейкопоэза ограничивают их использование. Для уменьшения побочных эффектов и повышения концентрации препаратов в ткани ПЖ предлагают их селективное введение в чревный ствол и проток П.Ж. Рибонуклеаза позволяет весьма быстро купировать болевой синдром, способствует выведению больных из токсического шока, блокируя патологический выброс ферментов в кровь, но не имеет преимуществ перед цитостатиками [19, 22].
Для угнетения секреции ПЖ ряд авторов предлагают использовать нейропептидный препарат даларгин, который способствует подавлению секреции пищеварительного сока и ускорению заживления язвенных поражений желудочно-кишечного тракта, снижает активность ферментов липолиза и протеолиза, базальную и стимулированную секрецию ПЖ и лечебный эффект которого связан с действием на эндокринные клетки — мишени в ПЖ [8, 16]. В настоящее время этот препарат в клинической практике не используется. Пристальное внимание хирурги уделяют соматостатину и его синтетическим аналогам, в частности октреотиду, позволяющим улучшить результаты лечения ОП, повысить эффективность консервативного лечения свищей ПЖ, они могут также использоваться для профилактики гнойных осложнений [4, 32]. Известно, что соматостатин стимулирует образование ц-АМФ, играющего основную роль в процессе секреции гормонов. Соматостатин препятствует процессу проникновения кальция внутрь секреторных клеток, что было продемонстрировано в эксперименте на изолированной группе клеток П.Ж. Инфузия пептидов соматостатина человеку приводит к угнетению секреции соматотропина, тиреотропного гормона, инсулина, глюкагона, гормонов пищеварительного тракта (гастрина, вазоактивного интестинального пептида, холецистокинина), снижению секреции соляной кислоты, ферментов ПЖ, уменьшению всасывания жиров и аминокислот [13, 25]. Эффекты соматостатина реализуются путем его взаимодействия с соматостатиновыми рецепторами (SSTR) [6, 17, 18].
Аналог соматостатина октреотид является ингибитором эндокринной и экзокринной секреции ПЖ, модулятором моторики кишечника, всасывания электролитов и питательных веществ, секреции желудка и ПЖ, уменьшает артериальное кровоснабжение висцеральных органов и портальный кровоток. Октреотид существенно снижает магистральный мезентериальный кровоток вследствие непосредственного действия на гладкую мускулатуру мезентериальных сосудов [28, 29]. В отличие от естественного гормона, быстро разрушающегося эндопептидазами и имеющего период полувыведения всего 2—6 мин, период полувыведения октреотида достигает 90 мин. Синтетические аналоги гормона, включая октреотид, обладают высоким сродством к SSTR2 и SSTR5 и почти не действуют на SSTR1- и SSTR4-подтипы соматостатиновых рецепторов. Активность октреотида по отношению к рецепторам SSTR2 в 3—10 раз превышает таковую естественного гормона [6, 17, 18, 31]. Препарат применяется по 100—300 мг подкожно 3—4 раза в день в течение 5 дней в зависимости от тяжести заболевания, возможно использование препарата в суточной дозе до 1200 мг и внутривенного пути введения (внутривенные инфузии по 25—50 мг/ч).
По данным разных авторов, применение октреотида снижает смертность при ОП тяжелого течения. R. Wang и соавт. [37] оценили влияние дозы октреотида при лечении ОП. В стандартную схему лечения больных первой группы был включен октреотид в высокой дозе — 50 мг/ч в течение 3 суток + 25 мг/ч в течение 4 суток, во второй группе пациенты получали октреотид в низкой дозе — 25 мг/ч в течение 7 суток. Авторы отметили явное снижение частоты осложнений при назначении высоких доз октреотида с 59,8% во второй группе до 37,5% в первой группе с более быстрой нормализацией биохимических показателей крови. Таким образом, введение октреотида в схемы лечения больных ОП при условии раннего использования достаточных доз позволяет эффективно купировать явления панкреатической токсемии, осуществлять профилактику прогрессирования панкреонекроза в период полиорганной недостаточности и является эффективным лечебным средством, способствующим полной ликвидации панкреатических свищей [6, 36]. В плацебо-контролируемом исследовании A. Fabian и соавт. [31] применили октреотид в лечении свища ПЖ и выявили, что суточный дебит отделяемого у больных в группе наблюдения составлял от 100 до 2000 мл. На фоне лечения октреотидом в дозе 300 мг в сутки отмечено постепенное уменьшение отделяемого до полного его прекращения в сроки от 5 до 7 дней при отсутствии рецидива образования свища в последующие 4 года.
Целесообразно применение октреотида для предотвращения осложнений в функционировании ПЖ после эндоскопической ретроградной холангиопанкреатографии или операций на фатеровом соске или общем желчном протоке (эндоскопические папиллотомия, санация общего желчного протока, супрадуоденальная холедоходуоденостомия). Частота развития ОП после эндоскопических манипуляций и операций в панкреатодуоденальной зоне составляет 2—3%. Несмотря на невысокую частоту этого осложнения, оно может представлять угрозу для жизни больного, в связи с чем рекомендуется проводить профилактическое назначение октреотида. В нескольких исследованиях, включающих 3818 пациентов, доказано, что октреотид надежно снижает риск развития ОП после эндоскопических вмешательств на большом сосочке двенадцатиперстной кишки, а также уменьшает частоту патологического повышения уровня сывороточной амилазы (p<0,01) и липазы (p<0,05) крови [34]. Рекомендуется назначать октреотид за 1 ч до эндоскопической операции в дозе 100 мг подкожно и продолжать введение в стандартной дозе (по 100 мг подкожно 3 раза в сутки в течение последующих 5 суток).
Одни исследователи подтверждают эффективность соматостатина и октреотида в лечении острого панкреатита [2—4, 11, 35], по данным других, эти препараты, способствуя уменьшению частоты гнойно-некротических осложнений и продолжительности лечения, не приводят к снижению летальности [20] и не предотвращают осложнений ОП [26, 27]. В двойном слепом плацебо-контролируемом исследовании было установлено, что применение соматостатина способствовало снижению летальности с 40 до 20% и частоты развития осложнений с 58 до 33%. Ю.В. Иванов [11] отмечает, что октреотид способствует снижению общей летальности при ОП с 21,7 до 12,8%, но не предотвращает расширения зоны некроза, прогрессирования процесса в забрюшинной клетчатке и развития гнойно-некротических осложнений. Аналогичные данные получены и в другом исследовании, согласно которому использование сандостатина и октреотида при стерильном панкреонекрозе снижает летальность на ранней стадии заболевания, но не влияет на частоту развития инфицированного панкреонекроза [21]. Ограничивает широкое использование сандостатина и октреотида их высокая стоимость [1, 2], но несмотря на это, октреотид способствует уменьшению общей стоимости лечения в 1,7—1,8 раза. Есть данные, что при ОП средней тяжести эффективность сандостатина и кваматела одинакова (к примеру, частота гнойных осложнений 8 и 7,1% соответственно) и применение кваматела соответственно экономически более выгодно [1].
Таким образом, основой антисекреторной терапии при остром панкреатите являются препараты группы сандостатина и H2-блокаторы. Вместе с тем до настоящего времени продолжается дискуссия о клинической эффективности и целесообразности использования различных методов антисекреторной терапии при заболевании в ранних фазах и об определении их роли в профилактике ранних и поздних гнойно-некротических осложнений ОП, что подчеркивает необходимость проведения дальнейших исследований.
Читайте также:
