Лекарства влияющие на мочеиспускание. Фармакология мочевыводящего тракта
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Гиперактивный мочевой пузырь (ГАМП) - одна из наиболее распространенных и сложных проблем в современной урогинекологии. И хотя данное заболевание не ведет к летальному исходу или серьезным нарушениям общего состояния, но приводит пациенток к социальному остракизму, резкому снижению "качества жизни", депрессиям, неврозам, сексуальным расстройствам (11).
Актуальность данной проблемы обусловлена широкой распространенностью ГАМП среди населения, как женского, так и мужского пола. По данным последних популяционных исследований, проведенных в европейских странах (Франции, Германии, Италии, Испании, Швеции, Великобритании) и США, симптомы ургентного мочеиспускания отмечает не менее 17% населения старше 40 лет, из них 56% - женщины и 44% - мужчины. Причем с возрастом частота симптомов возрастает до 30% у лиц старше 65 лет и до 40% - после 70 лет (12).
Говоря о причинах ГАМП (синдроме императивных нарушений мочеиспускания), надо отметить, что данное заболевание является многофакторным.
Одной из наиболее частых причин развития данной патологии у женщин являются воспалительные заболевания мочевых путей. По данным разных авторов, от 50 до 70% пациенток, страдающих императивными формами расстройств мочеиспускания, отмечают в анамнезе хронические циститы или уретриты (8).
Второй по значимости и распространенности причиной развития синдрома императивного мочеиспускания является эстрогенная недостаточность. Большинство женщин старше 45 лет указывают на то, что начало заболевания совпадает с наступлением менопаузы. Причем распространенность этого симптомокомплекса зависит от длительности постменопаузы и увеличивается с 15,5% при постменопаузе до 5 лет, до 71,4% при длительности постменопаузы более 20 лет, что связывают с нарастанием эстрогенного дефицита и, как следствие этого, ишемией мочевого пузыря и атрофией уротелия (1,3,14).
Причиной развития синдрома императивного мочеиспускания может стать различная неврологическая патология: ишемия головного мозга, инсульт, рассеянный склероз, паркинсонизм, травмы, опухоли, кисты головного и спинного мозга (3, 10). Нередко ГАМП возникает у женщин, перенесших различные гине-кологические операции: экстирпация матки, гистерэктомия, а также эндоуретральные операции. Развитие нарушений мочеиспускания и недержания мочи у женщин после радикальных операций на матке связаны с парасимпатической и соматической денервацией мочевого пузыря, уретры и мышц тазового дна, нарушением анатомических взаимоотношений органов малого таза; если при операции удаляются яичники, то дополнительно возникает гипоэстрогения (5,15).
Среди других причин возникновения данного заболевания некоторые авторы выделяют сахарный диабет и малоподвижный образ жизни (10,14).
Патогенез ГАМП дискутируется и до настоящего времени до конца не изучен. Старое представление о патогенезе синдрома императивного мочеиспускания базируется на нарушении иннервации мочевого пузыря и уретры. Вышеперечисленные причины (воспаления, ишемия, травмы) могут вызывать повреждение холинэргических нервных волокон, иннервирующих детрузор. В неизмененных холинэргических волокнах развивается повышенная чувствительность к холинэргической нервной стимуляции, что проявляется нестабильными сокращениями детрузора (3,10).
| Одним из эффективных препаратов группы а-адреноблокаторов, применяемых для лечения ГАМП, является Фокусин ® (тамсулозин, Zentiva). Фокусин ® обладает высокой селективностью, избирательно и конкурентно блокируя постсинаптические a1A-адренорецепторы в гладкой мускулатуре шейки мочевого пузыря и проксимальной части уретры, а также a1Д-адренорецепторы в теле мочевого пузыря. |
В настоящее время существуют несколько теорий развития ГАМП. Доминируют: нейрогенная теория и теория миргенной дистрофии детрузора. Согласно нейрогенной теории, мочеиспускание представляет собой сложный рефлекторный акт, контролируемый центрами спинного и головного мозга. Накопление мочи зависит: 1) от спинальных рефлекторных механизмов, активирующих симпатические (через поясничный отдел спинного мозга) и соматические проводящие пути к уретре; 2) от тонической подавляющей системы в головном мозге, которая подавляет передачу парасимпатического возбуждения к детрузору. Мочеиспускание осуществляется посредством угнетения симпатических и соматических путей передачи и активации спинобульбоспинальных парасимпатических рефлекторных путей, проходящих через центр мочеиспускания в "клювовидном мосту" (rostral pons). Результаты экспериментальных, физиологических и анатомических исследований подтверждают предположение о наличии в стволовой части мозга (rostral pons) центра мочеиспускания, который функционирует по типу "вспышек" нейрогенной активности и стимулирует рефлекторную цепь мочеиспускания. Пусковая точка, по-видимому, регулирует "возможности" мочевого пузыря (он начинает функционировать при критическом уровне афферентной активности, поступающей от барорецепторов в стенке мочевого пузыря), а также координирует активность мочевого пузыря и наружного сфинктера уретры. Центр мочеиспускания в стволе находится под влиянием высших регулирующих центров головного мозга. Стимуляция участков переднего и латерального гипоталамуса у животных вызывает сокращения мочевого пузыря и мочеиспускание. Стимуляция задних и медиальных участков гипоталамуса приводит к подавлению активности мочевого пузыря. Исследования у людей с использованием томографии с протонной эмиссией показали, что два участка коры (правый дорсолатеральный префронтальный участок коры и передняя опоясывающая извилина) в момент мочеиспускания активны. Установлено, что активные участки располагаются преимущественно справа - в правой части мозга (3,5,9). Таким образом, очевидно, что различные изменения как в периферической, так и в центральной нервной системе могут быть причиной развития гиперактивности детрузора.
Согласно миогенной теории, патогенез ГАМП заключается в том, что в основе дисфункции детрузора лежит недостаточность его энергетического метаболизма, обусловленная многими факторами, в том числе расстройствами кровообращения. Указанное звено патогенеза схематически можно представить следующим образом: повышение активности симпатического отдела вегетативной нервной системы --> спазм артериальных сосудов мочевого пузыря --> нарушение поступления и утилизации кислорода в гладкомышечных клетках детрузора --> энергетическая гипоксия --> дистрофические изменения в клетках детрузора --> чрезмембранные нарушения транспорта кальция --> гиперактивность детрузора --> уменьшение резервуарной функции мочевого пузыря --> синдром императивного мочеиспускания (2).
В последние годы рассматривается роль уротелия в патогенезе ГАМП (уротелиогенная теория), которая предполагает, что изменения чувствительности и сцепления в сети уротелий - миофибробласт приводит к повышению активности детрузора. Уротелиогенная гипотеза опирается на изменение в уротелий - сети интерстициальных клеток - 1C-LP. Имеющиеся данные свидетельствуют о том, что патология мочевого пузыря приводит к нарушению связей между интерстициальными клетками и миофибробластами, что в свою очередь ведет к формированию функционального синцития с пейсмекерной активностью (автономный водитель ритма), вызывая патологические сокращения детрузора. Несмотря на множество теорий, выделить ведущее звено патогенеза сложно, и вероятнее всего, изменения в центральном и периферическом звеньях сочетаются и усугубляют друг друга.
Гиперактивный мочевой пузырь - это симптомокомплекс, обусловленный избыточной активностью мышцы мочевого пузыря - детрузора, неадекватной реакцией его на наполнение и включающий:
Лекарства влияющие на мочеиспускание. Фармакология мочевыводящего тракта
Лечение стрессового недержания мочи. Лечение гиперплазии предстательной железы (аденомы простаты)
Медикаментозное лечение направлено на увеличение сопротивления току мочи. Умеренное или выраженное стрессовое недержание мочи эффективно лечат хирургически. Традиционное медикаментозное лечение назначают пациентам с умеренно выраженными клиническими проявлениями для их уменьшения у пациентов, которым не помогают, например, упражнения для укрепления мышц тазового дна. Цель лечения — увеличить сопротивление току мочи. Теоретически это можно достичь увеличением интрауретрального давления или усилением функциональных возможностей слизистой оболочки мочеиспускательного канала.
Альфа-адреностимуляторы при стрессовом недержании мочи. Эти средства увеличивают давление в уретре. Наиболее широко используемый препарат — эфедрин, однако он действует также на р-рецепторы как косвенный симпатомиметик, способствующий выбросу норэпинефрина из нервных окончаний, поэтому он может повышать артериальное давление, вызывать нарушения сна и тремор. Есть данные, что при длительном назначении эфедрина развивается тахифилаксия. В качестве альтернативы в США ранее применяли фенилпропаноламин.
Эстрогены при стрессовом недержании мочи. Терапевтический эффект эстрогенов заключается в индукции пролиферации слизистой оболочки мочеиспускательного канала с последующим увеличением сопротивления току мочи. Кроме того, эстрогены усиливают эффект агонистов возбуждения периуретральных гладких мышц. Терапия может включать комбинацию эстрогенов и адренергических агонистов. Традиционно эстрогены назначают в виде имплантируемого кольца.
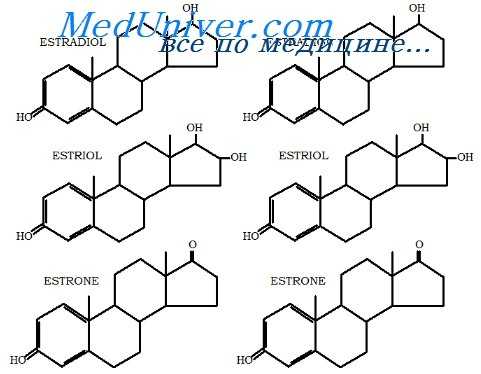
Лечение гиперплазии предстательной железы (аденомы простаты)
Лечение гиперплазии предстательной железы направлено на уменьшение размера простаты с помощью ингибиторов 5а-редуктазы или на уменьшение сокращения гладких мышц, окружающих уретру, с помощью селективных а1-адреноблокаторов. Медикаментозное лечение обычно используют при умеренных клинических проявлениях. У пациентов с выраженной симптоматикой или задержкой мочи предпочтительным методом является хирургический.
Признаками гиперплазии предстательной железы является нарушение оттока мочи, связанное с увеличением размеров простаты и рестрикцией мочеиспускательного канала. Существуют два компонента обструкции: (1) механический, являющийся результатом физической непроходимости, вызванной увеличением простаты; (2) динамический (непостоянный), связанный с изменениями тонуса гладких мышц простаты. Лечение направлено либо на уменьшение механической обструкции, либо на стимуляцию периуретральных гладких мышц простаты.
Препараты, используемые в лечении гиперплазии предстательной железы, уменьшают размер простаты либо снижают тонус гладких мышц простаты.
В пролиферации предстательной железы участвуют различные факторы, но андрогены, в частности дигидротестостерон, играют первостепенную роль. Для лекарственной терапии доброкачественной гиперплазии предстательной железы основными препаратами являются ингибиторы 5а-редуктазы, т.к. они влияют на метаболизм андрогенов, особенно на дигидротестостерон. Повышение концентрации андрогенов поддерживает доброкачественный рост предстательной железы, а снижение уровня андрогенов приводит к существенной инволюции железисто-эпителиального компонента простаты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Показания для назначения мочегонных (диуретиков)
Диуретики (салуретики) увеличивают образование мочи (диурез). Строго говоря, этот термин относится к препаратам с прямым воздействием на почки. Основной эффект таких препаратов — усиление экскреции мочи за счет угнетения реабсорбции NaCl и воды.
Наиболее значимые показаниям к применению диуретиков перечислены ниже.
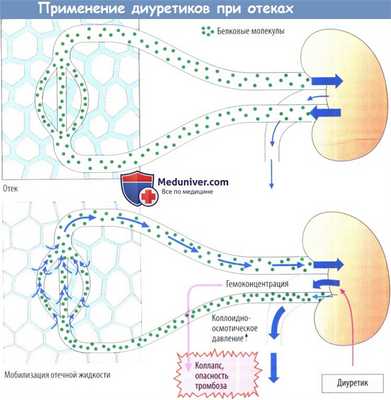
а) Устранение отека. При отеке в тканях происходит избыточное накопление жидкости, главным образом во внеклеточном (интерстициальном) пространстве. Повышенная почечная экскреция Na + и воды после приема диуретика приводит к уменьшению объема плазмы и гемоконцентрации.
В результате этого наряду с концентрацией белка в плазме возрастает и онкотическое давление, жидкость перемещается из интерстициального пространства в капиллярное русло. Количество жидкости, содержащейся в ткани, уменьшается, и отек сходит. Уменьшение объема плазмы и жидкости, содержащейся в интерстициальном пространстве, означает снижение объема внеклеточной жидкости (ВКЖ).
В зависимости от конкретного состояния используют тиазидные и петлевые диуретики, антагонисты альдостерона и осмотические диуретики.
б) Антигипертензивная терапия. Диуретики относятся к препаратам первого выбора для снижения АД. Даже в низкой дозировке они уменьшают общее периферическое сопротивление (без значительного снижения объема ВКЖ) и посредством этого нормализуют АД.
в) Лечение застойной сердечной недостаточности. Снижая периферическое сопротивление, диуретики помогают сердцу выбрасывать кровь (уменьшение постнагрузки); возрастает минутный объем сердца и устойчивость к физической нагрузке. В связи с увеличением экскреции жидкости снижается объем ВКЖ и венозный возврат (уменьшение преднагрузки).
Проходят такие симптомы венозного застоя крови, как отеки голеней и стоп, увеличение печени. В основном используют тиазидные (во можно сочетаниес калийсберегающими) и петлевые диуретики.
г) Профилактика почечной недостаточности. При недостаточности кровообращения (шок), например вторично из-за массивной кровопотери, почки могут прекращать продукцию мочи (анурия). Отток мочи пытаются поддерживать с помощью диуретиков. Показано применение либо осмотических, либо петлевых диуретиков.
Активное применение диуретиков влечет за собой риск возникновения побочных эффектов:
1) снижение ОЦК может привести к гипотензии и коллапсу,
2) в связи с увеличением концентрации эритроцитов и тромбоцитов возрастает риск внутрисосудистого свертывания или тромбоза.
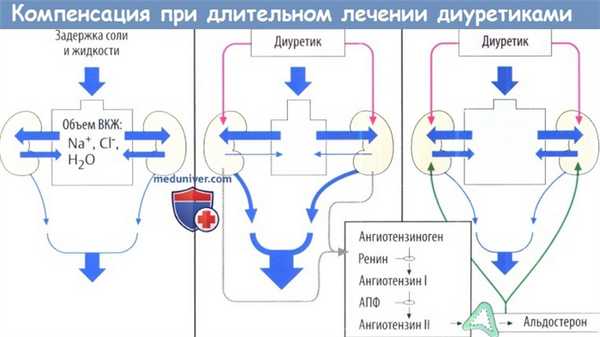
Когда в результате лечения диуретиками происходит значительное уменьшение количества NaCI и воды (снижение объема ВКЖ), организм запускает механизмы компенсации, в частности происходит активация РААС. Из-за снижения ОЦК подвергается опасности почечный кровоток. Это приводит к выделению из почек ренина, который ферментативно катализирует образование ангиотензина I.
Ангиотензин I с помощью АПФ превращается в ангиотензин II. Ангиотензин II стимулирует высвобождение альдостерона. Этот минералокортикоид вызывает реабсорбцию NaCI и воды в почках и тем самым противодействует эффекту диуретиков. Ингибиторы АПФ и антагонисты ангиотензина II повышают эффективность диуретиков, предотвращая этот дисрегуляторный ответ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Основные принципы фармакотерапии рецидивирующих инфекций мочевых путей
Рецидивирующие инфекции нижних мочевых путей (РИНМП) являются широко распространенными заболеваниями, которые с трудом поддаются лечению. Как правило, терапия РИНМП включает курсы антибиотиков и растительных препаратов, обладающих противовоспалительным и мочегонным действием.
Канефрон® Н – комбинированный лекарственный препарат, который оказывает комплексное действие: диуретическое, спазмолитическое, противовоспалительное, антиоксидантное, антимикробное и нефропротективное. Эффективность и безопасность препарата Канефрон® Н в лечении РИНМП подтверждены результатами целого ряда клинических исследований и опытом применения препарата как в России, так и за рубежом.
- КЛЮЧЕВЫЕ СЛОВА: инфекции мочевыводящих путей, инфекция, мочевые пути, заболевания мочевыводящих путей, урология
Инфекции мочевых путей (ИМП) представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе регистрируется свыше 10 млн случаев ИМП [1]. При ИМП отмечается высокая частота рецидивов инфекции, которая принимает хронический характер и протекает с частыми обострениями. При неосложненной инфекции нижних мочевых путей воспалительный процесс затрагивает слизистую оболочку уретры и мочевого пузыря, в дальнейшем, при восходящем пути инфицирования, он может распространяться и на почечную лоханку. Поражение почечной паренхимы инфекционно-воспалительным процессом может привести к развитию пиелонефрита, хронической почечной недостаточности и бактериемии.
Рецидивирующие инфекции нижних мочевых путей у женщин остаются в настоящее время весьма распространенным и трудно поддающимся лечению заболеванием. Инфекции мочевых путей – одно из самых частых заболеваний у женщин репродуктивного возраста. Ежегодно в США диагностируется 7 млн случаев РИНМП среди женщин. У 25–35% пациенток в возрасте от 20 до 40 лет отмечается, по крайней мере, один эпизод инфекции в год, а к 65 годам он развивается у каждой третьей женщины [2, 3]. В период постменопаузы риск РИНМП возрастает, что обусловлено изменениями, связанными с дефицитом эстрогенов.
Для обозначения заболевания существует более 20 терминов, отображающих его этиологию и патогенез. До внедрения в урологическую практику эндоскопических методов исследования подобные состояния обозначались как cystospasm, vesica hysterica, neuralgia vesicae и т.д., что соответствовало представлениям о нейрогенном генезе РИНМП. С появлением цистоуретроскопии появились новые термины: cystitis colli, trigonitis, cystitis trigoni, отражающие представления о воспалительной природе заболевания. Однако отсутствие ответа на ряд вопросов – почему заболеванию подвержены только женщины, почему неэффективна противовоспалительная антибактериальная терапия, почему моча таких больных, как правило, стерильна – способствовало широкому распространению таких терминов, как цисталгия, цистопатия, асептический уретрит, уретральный синдром. Высокая частота РИНМП у гинекологических больных обусловила появление таких определений, как генитально-пузырная дисфункция, гинекологический невроз мочевого пузыря. Термин «рецидивирующие инфекции нижних мочевых путей» представляется наиболее удачным, так как является собирательным понятием, объединяющим воспалительные заболевания мочеиспускательного канала и мочевого пузыря, протекающие со сходными клиническими проявлениями.
В международной литературе существует однозначное определение неосложненной инфекции мочевых путей – это инфекция у здоровой небеременной амбулаторной пациентки в возрасте 16–65 лет, не сопровождающаяся лихорадкой [4, 5]. РИНМП следует разделять на вновь возникающие (эндогенная реинфекция) и инфекции с новым микроорганизмом (экзогенная рецидивирующая инфекция). У женщин чаще наблюдается последняя форма. При экзогенных рецидивирующих инфекциях в ходе дальнейшей диагностики обычно не выявляют анатомических отклонений. Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К неосложненным инфекциям мочевых путей относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких-либо нарушений оттока мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Это обычный острый восходящий цистит или пиелонефрит без нарушения оттока мочи, сопровождающийся расстройствами мочеиспускания, наличием примесей гноя в моче, иногда – крови в моче, субфебрильной температурой тела и болями в боку. В большинстве случаев острый цистит является поверхностной инфекцией слизистой мочевого пузыря, которая легко поддается терапии антимикробными препаратами. В то же время цистит очень часто рецидивирует, даже у пациентов с анатомически нормальными мочевыми путями.
Этиология и патогенез
Осложненные ИМП вызываются большим количеством разнообразных грамотрицательных и грамположительных микроорганизмов. Спектр возбудителей данных инфекций определяется географическим регионом, а также зависит от профиля отделения, даже в пределах одного лечебного учреждения. По данным четырех крупномасштабных исследований бактериальных возбудителей нозокомиальных ИМП (SENTRY, 1998; ESGNI-003, 2000; PEP, 2003 и исследования структуры госпитальных ИМП г. Штраубинга, 2001), в 70–80% случаев этиологическими агентами инфекций являлись такие грамотрицательные микроорганизмы, как E. coli, Pseudomonas spp., Proteus spp., Klebsiella spp., Enterobacter spp. Грамположительные бактерии вызывали осложненные ИМП в 15–30% случаев и были представлены энтерококками и стафилококками [6]. При длительном дренировании (более 28 дней) мочевых путей у больных с нейрогенными расстройствами мочеиспускания полимикробную бактериурию выявляют практически во всех случаях. При длительном дренировании мочевого пузыря из мочи больных часто выделяют такие микроорганизмы, как E. coli, Pseudomonas spp., Proteus spp., Morganella spp., Acinetobacter spp., Enterococcus spp., P. stuartii (табл. 1). Особое значение в развитии ИМП у больных с нейрогенными расстройствами мочеиспускания имеет образование биопленки на поверхности мочевого дренажа [4, 7, 8]. Биопленка представляет собой скопление микроорганизмов и продуктов их жизнедеятельности, формирующих структурное сообщество, связанное с какой-либо поверхностью. Биопленка формируется в три этапа:
При воздействии уреазы на мочевину повышается рН мочи и в гель матрикса биопленки добавляются ионы кальция и магния, что приводит к образованию кристаллов фосфата кальция и магния с аммонием. Формирование кристаллов в щелочной моче и прикрепление бактерий к поверхности биопленки способствуют ее агрегации и росту. Основным структурным элементом биопленки является микроколония – оформленное в матриксе сообщество из бактериальных клеток одного или нескольких видов. Обычно биопленка состоит из трех слоев: прикрепленного к дренажу, основного (микроорганизмы) и свободного поверхностного слоя. Биопленка является особой формой выживания бактерий, которая резистентна не только к антимикробным препаратам, но и к факторам защиты макроорганизма, что может приводить к развитию хронических персистирующих инфекций. Бактерии в составе биопленки обладают кооперативной чувствительностью и взаимодействуют друг с другом. Кроме того, в пределах как моно-, так и полимикробных пленок между различными штаммами и видами бактерий осуществляется передача генетической информации, которая обусловливает лекарственную устойчивость. В биопленках бактерии обычно выживают при концентрациях антимикробных препаратов, в 1000–1500 раз превышающих необходимые для гибели микроорганизмов того же вида в форме планктона.
В присутствии мочевого дренажа ИМП могут распространяться следующим образом: восходящим путем (по биопленкам и просвету дренажа) и с турбулентным потоком бактерий в виде планктона. Неполное опорожнение мочевого пузыря, обструктивные уропатии, пузырно-мочеточниковый рефлюкс также способствуют восходящему развитию ИМП. Предрасполагающими факторами ИМП у больных с нейрогенными расстройствами мочеиспускания являются инфравезикальная обструкция, катетеризация мочевого пузыря и другие инструментальные вмешательства [4, 8]. Возникновению ИМП у больных с нейрогенными расстройствами мочеиспускания также способствует
нарушение трофики тканей мочеиспускательного канала и мочевого пузыря.
Причины рецидивирования
Высокая частота рецидивов ИМП обусловлена следующими факторами [6]
анатомо-физиологическими особенностями женского организма (короткая и широкая уретра, ее близость к естественным резервуарам инфекции – анусу, влагалищу);
способностью грамотрицательных микроорганизмов, вызывающих инфекционный процесс в уретре и мочевом пузыре, к адгезии к клеткам эпителия вследствие наличия фимбрий и ворсин;
воспалительными процессами влагалища, гормональными нарушениями, приводящими к дисбиозу влагалища и размножению в нем патогенной микрофлоры;
Фармакотерапевтические возможности
Таким образом, поиск возможных путей решения проблемы ИМП, и в частности рецидивирующих форм, требует объединения усилий акушеров-гинекологов и урологов. Согласно рекомендациям по лечению ИМП, этиологической является антибактериальная терапия. Выбор препарата должен основываться на результатах длительных многоцентровых плацебоконтролируемых исследований. Такое исследование (ARESC) было проведено в 2003–2006 гг. В ходе исследования были определены возбудители неосложненных ИМП и их чувствительность к антибактериальным препаратам. Оказалось, что более чем в 70% случаев возбудителями ИМП являются грамотрицательные микроорганизмы (E. coli). При назначении антибактериальной терапии целесообразным является выбор препаратов, резистентность к которым составляет менее 10%. При беременности рекомендовано применение защищенных пенициллинов, цефалоспоринов II–III поколения 7-дневными курсами. Фосфомицина трометамол, который обладает пролонгированным (до 80 ч) действием, может назначаться однократно. Следует учесть, что проведение курса антибактериальной терапии (в том числе у беременных) не является гарантией отсутствия рецидивов заболевания. Так, по данным метаанализа клинических исследований ципрофлоксацина, частота эрадикации возбудителей острого цистита у женщин при трех- и семидневном приеме препарата составила 95% (340 из 359 и 241 из 255 больных соответственно), а частота рецидивов – 14 и 18% соответственно [4, 6].
Особенностью хронических заболеваний мочевыводящих путей очень часто является бессимптомное течение, вследствие чего они нередко обнаруживаются только при значительном снижении функции почек. Такие заболевания лечат длительно, чередуя курсы антибиотиков и растительных препаратов. Принципы современной терапии острого пиелонефрита можно представить следующим образом:
Важно отметить, что при выявлении осложненной инфекции мочевыводящих путей обязательной является эрадикация поддающихся коррекции осложняющих факторов. Так, при остром обструктивном пиелонефрите прежде всего необходимо восстановить отток мочи из пораженной почки путем катетеризации лоханки или установления пункционной нефростомы.
При неосложненном пиелонефрите (неосложненной инфекции верхних мочевых путей) продолжительность антибиотикотерапии обычно составляет 7–14 дней. При остром неосложненном пиелонефрите легкой и средней тяжести рекомендуется терапия пероральными фторхинолонами, такими как ципрофлоксацин или левофлоксацин. В качестве альтернативы (при распространенности в популяции E. сoli, продуцирующей бета-лактамазу расширенного спектра действия, менее 10%) могут быть использованы пероральные цефалоспорины III поколения – цефтибутен. Амоксициллин/клавуланат не рекомендуется для эмпирической терапии пиелонефрита. Его применение целесообразно только при выявлении чувствительного грамположительного микроорганизма. В популяциях с высокой (более 10%) резистентностью к фторхинолонам и высокой распространенностью (более 10%) кишечной палочки с бета-лактамазой расширенного спектра действия исходная эмпирическая терапия до получения результатов посева проводится парентерально аминогликозидом или карбапенемом.
При неосложненном пиелонефрите тяжелого течения (с тошнотой и рвотой), когда пациент не может принимать препараты перорально, изначально терапия проводится парентеральным антибиотиком, относящимся к одной из перечисленных выше групп. Пациентки с пиелонефритом тяжелого течения обязательно должны быть госпитализированы и получать инфузионную терапию. По окончании 1–2-недельного курса антибиотикотерапии острого пиелонефрита в случае сохранения у пациентки каких-либо симптомов показано контрольное бактериологическое исследование мочи. У больных, перенесших острую инфекцию нижних или верхних мочевых путей, для поддержания уровня диуреза (2 и более литров в сутки) целесообразно обильное потребление жидкости.
В настоящее время отмечается явный рост интереса к фитотерапии – лечению лекарственными средствами растительного происхождения. Фитотерапия имеет давнюю историю: первые упоминания о ней относятся к XXVII веку до н.э. На сегодняшний день эффективность применения лекарственных растений доказана не только опытом лечения, но и с помощью биохимических, биологических (на молекулярном и клеточном уровне), а также структурно-аналитических методов. Современная медицина научилась работать с растениями и использовать их потенциал. Актуальность фитотерапии сегодня обусловлена следующими факторами:
экстракты лекарственных растений не уступают по эффективности химическим веществам, а нередко даже превосходят их;
фитотерапевтическое лечение характеризуется низким риском развития осложнений и нежелательных побочных эффектов;
комплексные фитотерапевтические препараты обладают дополнительными преимуществами благодаря их многокомпонентному разнонаправленному действию.
Таким образом, растительные препараты, обладающие противовоспалительным и мочегонным действием, приобретают все большее значение в терапии заболеваний мочевыводящих путей. Применять растительные препараты можно в течение длительного времени, они редко вызывают осложнения и нежелательные побочные действия. Канефрон® Н – комбинированный лекарственный препарат, в состав которого входят трава золототысячника (Centaurium umbellatum), корень любистока (Levisticum officinale) и листья розмарина (Rosmarinus officinale), оказывающие разнонаправленное действие на человеческий организм (табл. 2).
Фармакологические эффекты препарата Канефрон® Н
Различные механизмы действия препарата Канефрон® Н на организм определяются входящими в его состав эфирными маслами (любисток, розмарин), фенолкарбоновыми кислотами (розмарин, любисток, золототысячник), фталидами (любисток), горечами (золототысячник). Диуретический эффект Канефрона Н обусловлен комплексным воздействием лекарственных веществ препарата на различные мишени. Эфирные масла расширяют сосуды почек, что способствует улучшению кровоснабжения почечного эпителия, а также оказывают влияние на функцию эпителия почечных канальцев. Это проявляется, главным образом, в уменьшении реабсорбции ионов Na+ и воды. Диуретическое действие фенолкарбоновых кислот объясняется осмотическим эффектом: при попадании в просвет почечных канальцев они создают высокое осмотическое давление (обратному всасыванию эти препараты не подвергаются), вследствие чего значительно снижается реабсорбция воды и ионов Na+. В результате выведения из организма избытка жидкости и солей натрия снижается артериальное давление. Растительные мочегонные препараты обладают более щадящим действием по сравнению с современными синтетическими препаратами. Как известно, основные признаки воспаления связывают с действием медиаторов воспаления (брадикинин, простагландины, гистамин, серотонин и др.). Противовоспалительные свойства Канефрона Н в основном обеспечиваются розмариновой кислотой и связаны с подавлением синтеза медиаторов воспаления или замедлением их высвобождения и активации.
Все лекарственные растения, входящие в состав препарата Канефрон® Н, содержат вещества (фенолкарбоновые кислоты, эфирные масла и др.), обладающие антимикробным действием. Следует отметить широкий противомикробный спектр лекарственных растений и их активность при устойчивой к синтетическим препаратам микрофлоре. Особенностью данных лекарственных растений является сочетание противомикробных и противовоспалительных свойств, что особенно важно при лечении хронических инфекций мочевыводящих путей. Установлено, что Канефрон® Н усиливает выведение солей мочевой кислоты. Усиление выделения мочевой кислоты препятствует выпадению в мочевыводящих путях кристаллов, росту имеющихся камней и формированию новых. Также было отмечено, что данный препарат подщелачивает мочу, если она резко кислая при уратном нефролитиазе, и поддерживает уровень pH в диапазоне 6,2–6,8, что также препятствует образованию уратных камней. Спазмолитическое действие Канефрона Н обусловлено флавоноидами. В результате действия препарата Канефрон® Н на тубулярный аппарат почки значительно снижается выделение белка с мочой из-за ранее перенесенных патологических процессов, повреждающих тубулярный аппарат. Высокая эффективность и безопасность Канефрона Н (отсутствие острого и хронического токсического действия, в том числе тератогенного) были подтверждены экспериментальными и клиническими данными, полученными в ходе проведенных исследований, а также многолетним опытом применения препарата как в России, так и за рубежом.
Итак, лечение РИНМП должно быть патогенетически обоснованным и включать в себя:
Антибиотики при инфекциях мочевыводящих путей: выбор с учётом возбудителя
В 2015 году планируется пересмотр национальных рекомендаций «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов».
Об ожидаемых изменениях, новых данных и том, чем должны руководствоваться урологи, УС рассказала проф. Л.А. Синякова.
УС: Какими данными должны пользоваться урологи, сталкиваясь с инфекциями мочевыводящих путей (ИМП)?
ЛС: Новых российских данных о распространенности резистентных штаммов не существует, все современные отечественные рекомендации основаны на результатах последнего российского исследования - «ДАРМИС», 2010-2011.
Согласно «ДАРМИС», E. сoli присутствует в 63,5 % наблюдений, и резистентность к ампициллину составляет 41 %, а к ко-тримоксазолу 23 %. В странах Европы, Азии, Африки и Северной Америки резистентность всех уропатогенов к ципрофлоксацину, ко-тримоксазолу, ампициллину составляет в среднем 50 %, к цефалоспоринам - 30-40 %; резистентность к карбапенемам остается на уровне примерно 10 %. Среди пероральных препаратов наибольшей активностью в отношении E. coli обладает фосфомицина трометамол (98,4 %), фуразидин калия (95,7 %), нитрофурантоин (94,1 %) и цефалоспорины III поколения (цефтибутен и цефиксим).
Данные региональных и зарубежных исследований подтверждают нарастающую резиситентность E. coli и других грам- отрицательных уропатогенов к ампициллину триметоприму, фторхинолонам и цефалоспо- ринам, что должно быть учтено при лечении неосложненных ИМП.
Национальные рекомендации Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов, переизданные в 2014 году, будут ежегодно пересматриваться. И в 2015 году мы планируем переиздать рекомендации с учетом новых данных по резистентности возбудителей, в том числе о распространенности продуцентов бета-лактамаз расширенного спектра.
УС: Есть ли какая-та интрига или особые ожидания в отношении обновленных рекомендаций?
ЛС: Никакой интриги не существует, экстраординарных данных нет. Единственное, что могу сказать, - нарастает резистентность к фторхинолонам, поэтому мы подтвердим, что применение этих препаратов должно быть ограничено, особенно у женщин с острыми циститами. Будет также подчеркнуто, что для больных рецидивирующими циститами, чтобы не усугублять проблему с резистентностью, необходимо делать выбор с учётом выделенного возбудителя; так же должно быть ограничено использование препаратов, способствующих распространению резистентных штаммов, в первую очередь - цефалоспоринов третьей генерации.
УС: Как часто урологи не знают, с каким возбудителем связано заболевание, насколько актуальна эта проблема для отечественных клиницистов?
ЛС: Такая проблема существует не только в России. У больных рецидивирующими инфекциями возбудители выделяются примерно в 50 % случаев, что вовсе не означает отсутствие инфекции. Во-первых, возбудитель может не расти на обычных питательных средах. Во-вторых, под маской циститов могут протекать абсолютно другие заболевания.
Хочу обратить внимание, что только в половине случаев при наличии одних и тех же симптомов, в т. ч. учащенного болезненного мочеиспускания, действительно выявляется цистит - у остальных же пациентов эти жалобы могут быть связаны с наличием других заболеваний, например, гиперактивного мочевого пузыря или интерстициального цистита.
Симптоматика, схожая с циститом, может быть связана с воспалительными гинекологическими заболеваниями, дисбиозом влагалища, ИППП, в том числе вирусными.
Так же необходимо помнить, что рецидивирующие ИМП предполагают наличие двух обострений в течение 6 мес или трех в течение года. Если у женщины больше обострений, это означает, что есть иная проблема, решить которую с помощью антибактериальной терапии невозможно.
В таком случае пациентка нуждается в тщательном обследовании для выявления истинной причины - стоит обратить внимание на гормональный фон и необходимость проведения заместительной терапии, количество остаточной мочи, вероятность наличия пролапса и так далее.
Я считаю, что проблема рецидивирующих циститов - это не столько вопрос выбора препарата, сколько адекватной диагностики.
ИМП у беременных: выбор эмпирической терапии в каждом триместре
В 2014 году опубликованы данные ретроспективного исследования по бактериальному профилю и противомикробной терапии среди беременных женщин (Unlu B.S., et al., Ginecol Pol.) В исследование было включено более 700 пациенток, которым в каждом из триместров потребовалась госпитализация в связи с ИМП.
E. coli оказалась наиболее распространенной бактерией, выделенной всего в 82,2 % случаев госпитализации. Следующим по распространенности оказались Klebsiella spp., выделенные в 11,2 % случаев. При анализе по подгруппам E. coli оказалась возбудителем ИМП в 86 %, 82,2 % и 79,5 % случаев госпитализации в каждом из триместров соответственно. Для Klebsiella spp. распространенность по триместрам составила 9 %, 11,6 % и 12,2 % соответственно.
Enterococcus spp. были изолированы как третий микробный агент, выделяемый в каждом триместре - всего в 5,7 % случаев госпитализации.
«Мы продемонстрировали высокую распространенность E. coli и Klebsiella spp. среди беременных женщин с ИМП в каждом триместре, - подводят итог исследования авторы статьи Urinary tract infection in pregnant population, which empirical antimicrobial agent should be specified in each of the three trimesters? - Мы рассматриваем фосфомицина трометамол в качестве наиболее адекватной терапии первой линии, благодаря его высокой активности к уропатогенам, простоте и безопасности применения».
УС: Позволяет ли хорошая диагностика излечить рецидивирующие циститы?
ЛС: Нет, и это вторая сторона вопроса: задача уролога при рецидивирующих ИМП - увеличить безрецидивный период. Чаще всего мы назначаем антибиотики, что способствует росту резистентности возбудителей, провоцирует дисбактериоз и дисбиоз влагалища. Поэтому стоит вопрос о том, чтобы во время одного из эпизодов цистита применять не антибиотики, а препараты с другими механизмами действия. Но такая тактика справедлива только при рецидивирующей инфекции, при остром же цистите нам необходимо избавить пациентку от симптомов болезни, устранив возбудителя - т. е. никаких других вариантов, кроме адекватной антибактериальной терапии, применяться не должно.
УС: Какие препараты могут быть альтернативой антибиотикам во время одного из эпизодов рецидивирующего цистита?
ЛС: В 2010 году проведено исследование по изучению эффективности ципрофлоксацина в сравнении с нестероидным противовоспалительным препаратом - ибупрофеном. Оказалось, что на четвертый и седьмой день у женщин с обострением рецидивирующего цистита клиническая эффективность была аналогичной или даже несколько выше при применении нестероидного противовоспалительного препарата, то же было и на седьмой день. Поэтому во время одного из обострений мы можем использовать и этот препарат.
Международное сообщество считает, что мы имеем право начать лечение одного из обострений рецидивирующего цистита растительным препаратом Канефрон. Если в течение двух дней выраженность симптомов не уменьшается, то необходимо обсуждать вопрос о применении антибактериальной терапии.
УС: С какими биологическими особенностями возбудителя связана сложность лечения рецидивирующих ИМП?
ЛС: Уропатогенные штаммы E. coli очень часто образуют сообщество - биоплёнки, биофильмы. Ранее считалось, что биоплёнки формируются только на инородных телах - камнях в мочевых путях, катетерах, дренажах и т. д. Теперь мы знаем, что эти ассоциации могут формироваться и на слизистых мочевых путей, особенно на фоне урогенитальных инфекций, когда нарушен защитный слой мочевого пузыря.
Часто мы не имеем эффекта от антибактериальной терапии именно из-за биопленок. Дело в том, что часть препаратов, применяемых для лечения рецидивирующих ИМП, действует только на планктонные формы бактерий, не проникая внутрь биоплёнок.
Это способствует рецидиву инфекций, так как периодически возбудитель выходит из этих сообществ, вызывая очередное обострение. Учитывая эти биологические особенности, предпочтение следует отдавать препаратам, обладающим проникающими способностями внутрь биоплёнок.
В настоящее время у нас есть информация о двух группах препаратов, способных воздействовать на возбудителя в сообществе, - это фторхинолоны и фосфомицина трометамол. Однако, как было отмечено выше, из-за высокой резистентности E. coli к фторхинолонам мы вынуждены ограничить их применение.
УС: Каковы первичные причины рецидивов?
ЛС: Одна из основных - это предшествующая неадекватная антибактериальная терапия: примерно в 40 % случаев пациенты не обращаются за помощью к врачам. В этой группе больных наиболее часто появляются рецидивы, так как они либо применяют неэффективную антибактериальную терапию, либо избавляются от симптомов заболевания, используя общие процедуры, в результате чего на фоне «излечения» возбудитель остается сохранным.
УС: Какие приемы профилактики рецидивирующих инфекций рекомендованы научным сообществом и наиболее целесообразны?
ЛС: В составе комплексной терапии возможно применение эстрогенов, которые у определенной группы пациенток, в постменопаузе или при приеме гормональных контрацептивов, создают благоприятный фон для более эффективных методов лечения.
Возможно применение препаратов клюквы.
В отношении этого подхода проведено достаточно много исследований и имеется адекватная доказательная база. Однако эффективны препараты, содержащие необходимое количество активного вещества - проантоцианидина А (ПАЦ). Согласно рекомендациям EAU, для повседневной практики достаточно принимать препарат, содержащий 36 мг ПАЦ. Поэтому для комплексного лечения и профилактики ИМП можно принимать препарат Монурель (Замбон), в отношении которого доказано достоверное снижение адгезии возбудителей ИМП к эпителию мочевых путей.
Наибольшую доказательную базу имеют иммунологически активные препараты, в отечественной практике - Уро-Ваксом. Он повышает защитные свойства слизистых оболочек мочевых путей и хорошо переносится, примерно у половины пациентов снижает лейкоцитурию и бактериурию, являясь препаратом выбора для профилактики рецидивирующих циститов.
Другой подход, активно позиционируемый в Европе - это использование длительной низкодозной антибактериальной терапии, в отношении которой нет консенсуса. Длительное применение низкодозной антибактериальной терапии приводит к росту резистентности возбудителей, аллергическим реакциям, дисбактериозу и дисбиозу влагалища, и, что самое главное, после окончания указанной терапии примерно у половины больных в течение 3-4 мес возникают рецидивы заболевания.
УС: Каковы возможности применения фосфомицина трометамола как препарата с наибольшей активностью по отношению к E. coli?
ЛС: Использование фосфомицина трометамола, как и других препаратов при рецидивирующих инфекциях, рекомендовано полными курсовыми дозами - одна упаковка препарата (3 г) один раз в десять дней на протяжении трех месяцев. Эта рекомендация должна быть выполнена, если установлен диагноз рецидивирующий цистит, обострение; исключены ИППП и вирусные инфекции, как причина развития уретрита. После завершения трехмесячного курса мы должны начать противорецидивное лечение, в том числе патогенетическое лечение - внутрипузырные инстилляции для восстановления гликозаминогликанового слоя мочевого пузыря.
УС: Есть ли какие-то разногласия в отношении фосфомицина трометамола?
ЛС: Нет, по этому вопросу консенсус достигнут - доказательная база достаточная и рекомендация абсолютно обоснованна.
В 2014 году опубликован ряд работ, в которых подтверждена высокая эффективность фосфомицина в отношении наиболее распространенных уропатогенов и продуцентов бета-лактамаз расширенного спектра.
УС: Обострение рецидивирующего цистита наиболее вероятно при беременности. Какими должны быть действия врача?
ЛС: Действительно, каждая 10-я беременная страдает той или иной ИМП, в 20-40 % случаев развивается острый пиелонефрит во втором и третьем триместре. Эта проблема наиболее распространена среди женщин, столкнувшихся с ИМП до беременности и должным образом не подготовленных к ней.
При появлении клинических признаков ИМП у беременной женщины требуется антибактериальная терапия, так как нарушения уродинамики опасны не только для здоровья, но и для жизни матери и будущего ребёнка.
У беременных могут быть использованы препараты, которые по классификации FDA относятся к группе «В», т. е. пенициллинов, цефалоспоринов, некоторых макролидов. Фосфомицина трометамол исследовался в том числе и у беременных женщин и включен в список «В». Нитрофурантоин - единственный препарат из группы нитрофуранов для лечения неосложненных ИНМП во втором триместре беременности.
Перечисленные препараты безопасны, разрешены и могут применяться по показаниям, начиная со второго триместра беременности.
УС: Каковы ваши ожидания в наступающем году?
ЛС: У нас запланировано и проводится ряд научных работ и исследований, результаты которых, в том числе по проблеме лечения ИМП, подготовлены к публикации. Надеюсь, что благодаря активной научной и просветительской работе, со временем часть проблем, связанных с диагностикой и лечением ИМП, будет решена.
Читайте также:
