Локальная гипертермия при лечении опухоли. Химиотерапия опухоли кожи.
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Гипертермия – способ лечения злокачественных опухолей, при котором участок либо всё тело подвергается действию высокой температуры (свыше 39,5°С).
Проведенные многочисленные исследования показали, что при воздействии высокой температуры происходит значительное повреждение или полное уничтожение опухолевых клеток без повреждения нормальных тканей. Повреждая белковые структуры, гипертермия уничтожает опухолевые клетки, тем самым уменьшает объём опухоли. Эффективность гипертермических способов лечения постоянно изучается в клинических условиях.
2. Как используется гипертермия при лечении рака?
Гипертермия почти всегда используется совместно с другими способами терапии опухолевых заболеваний, такими как лучевая терапия и химиотерапия. При сочетанном использовании лучевой терапии гипертермия делает одни опухолевые клетки более чувствительными к радиации, другие – препятствует восстановлению при сублетальных повреждениях опухолевых клеток. При совместном использовании гипертермии и лучевой терапии воздействия следуют с интервалом в один час друг после друга. Гипертермия также позволяет повысить эффективность целого ряда химиопрепаратов (антрциклинов, цисплатинсодержащих препаратов и других). На многочисленных клинических исследованиях были изучены комбинации гипертермии с лучевой терапией и/или химиотерапией. Эти исследования сосредоточились на лечении многих типов опухолей, включая саркомы мягких тканей, меланому, рак головы и шеи, опухоли мозга, легкого, пищевода, молочной железы, мочевого пузыря, прямой кишки, печени, шейки матки, мезотелиомы и других. В большинстве из этих исследований было показано значительное уменьшение объёма опухолей в тех случаях, когда гипертермия сочеталась с другим видом лечения. Однако не все эти исследования показали увеличение выживаемости при таком сочетанном лечении.
3. Какие существуют методы гипертермии?
В настоящее время изучаются несколько методов гипертермии, включая локальную, региональную, гипертермию всего тела (общую).
- При локальной гипертермии высокая температура создаётся на небольшом участке с расположенной опухолью. При этом используются различные методы нагрева. Наибольшее распространение получили методы создания высокой температуры при помощи электромагнитного излучения (135 кГц, 40,68 МГц, 430-460 МГц, 915 МГц), а так же ультразвук (2-4 МГц). В зависимости от места локализации опухоли существует несколько способов подвода излучения.
- Внешний способ используются при лечении опухолей, которые находятся на поверхности или в толщине кожи. При этом внешние аппликаторы располагаются вокруг интересующей области, чтобы энергия излучения была максимально сконцентрирована на опухоли для создания наибольшей температуры внутри неё.
- Внутрипросветные или внутриполостные способы используются для лечения опухолей расположенных внутри полых органов, таких как пищевод и прямая кишка. Излучатель при таком способе помещается в просвете органа над опухолью, чтобы сконцентрировать энергию для максимального нагрева.
- Внутритканевые способы используются для лечения опухолей расположенных глубоко в теле человека, например опухоли головного мозга. При такой технике в опухоли создаётся более высокая температура, чем при использовании внешнего способа за счёт непосредственного введения излучателя в опухоль. Для контроля локализации излучателя используется ультразвук. Радиочастотная абляция (RFA) является вариантом внутритканевой гипертермии, которая использует радиоволны.
- Глубокая регионарная гипертермия применяется для лечения опухолей глубоко расположенных в теле человека, например рак шейки матки или рак мочевого пузыря. При этом внешние аппликаторы располагаются вокруг анатомической области, где находится опухоль. В качестве энергии используется электромагнитное излучение с частотой 60-110 МГц (аппарат «BSD-2000»).
- Региональная перфузия используется при локализации опухолей на конечностях, таких как меланома, саркома, или при локализации опухоли в органах, таких как печень или легкое. При данной процедуре в качестве теплоносителя служит кровь пациента, которая забирается, нагревается во внешнем теплообменнике, и затем возвращается в конечность или орган. Как правило, во время этого лечения вводятся противоопухолевые препараты.
- Непрерывная гипертермическая перитонеальная перфузия (CHPP) способ лечения злокачественных опухолей в пределах брюшной полости, таких как первичная перитонеальная мезотелиома и диссеминированный рак желудка. При данном способе происходит омывание брюшной полости и расположенных в ней органов горячим (41,5-42,2°С) раствором химиопрепаратов после выполнения основного хирургического пособия.
Эффективность лечения с использованием гипертермии зависит от величины температуры, достигнутой во время лечения, а так же от продолжительности воздействия, особенностей опухолевых клеток и тканей. Чтобы гарантировать, что необходимая температура достигнута, но не превышена, проводится постоянный температурный контроль в опухоли и окружающих тканях в течение всего сеанса лечения. Для контроля температуры в интересующих областях используются инвазивные микротермометры, которые устанавливаются под местной анестезией.
4. Какие существуют осложнения и побочные эффекты гипертермии?
Большинство нормальных тканей не повреждаются во время гипертермии, если температура не превышает 43,5°С. Однако, из-за различий в биологических характеристиках тканей, может происходить локальный перегрев виде локальных пятен. Это может закончиться ожогами, индуратами, дискомфортом или болезненностью. При перфузии могут происходить отёк тканей, тромбоз, кровотечение, или другие виды повреждений нормальных тканей в перфузированной области; однако, большинство этих побочных эффектов имеет временный характер. Общая гипертермия может вызвать более серьезные побочные эффекты, включая нарушения сердечного ритма и кровообращения, но это происходит очень редко. Как правило, из побочных эффектов после проведения сеанса общей гипертермии наиболее часто встречается диарея, тошнота, рвота.
5. Каковы перспективы использования гипертермии?
Многие исследователи считают, что необходимо решить ещё много вопросов, прежде, чем гипертермия можно будет считать стандартным методом лечением опухоли. Проводится большое количество клинических испытаний, чтобы оценить эффективность гипертермии. Одни исследования направлены на изучение эффективности гипертермии в комбинации с другими методами лечения различных опухолей. Другие – сосредоточены на улучшении методов гипертермии.
Локальная гипертермия при лечении опухоли. Химиотерапия опухоли кожи.
Лучевая терапия опухоли. Значение лучевой терапии в дерматоонкологии.
До настоящего времени не утратила своего значения лучевая терапия эпителиальных новообразований кожи, обеспечивающая гибель опухолевых клеток путем повреждения хромосомного аппарата и торможения митотическои активности. При этом следует учитывать, что большинство пролиферирутощих клеток опухоли радиочувствительны на стадии митоза и сразу после нее, непролиферирующие же клетки отличаются очень низкой радиочувствительностью и легко восстанавливают повреждения, давая рост новым клеткам. Невозможность уничтожения 100% злокачественных клеток из-за нахождения их в разных периодах жизненного цикла требует фракционирования суммарной дозы облучения.
Применяют следующие методы лучевой терапии: использование электронного пучка, низковольтную или ортовольтную рентгенотерапию, а также близкофокусную рентгенотерапию и имплантацию радиевых игл. Показаниями для проведения лучевого лечения являются: плоскоклеточный рак кожи, базалиома (в частности, кистозная и язвенная формы), эритроплазия Кейра, болезнь Боуэна, рецидивные эпителиальные новообразования кожи, возникшие после других методов лечения и локализующиеся вблизи естественных отверстий (глаза, носа, ушные раковины и т.д.). Лучевое лечение проводят больным с наличием противопоказаний к хирургическому лечению, лицам пожилого возраста, а также при диаметре новообразования, не превышающем 20 мм. Оно также проводится в качестве адъювантной герапии при глубоких инвазивных и метастатических раках кожи.
Лучевая терапия обычно безболезненна и хорошо переносится больными. В то же время она сопровождается развитием местных лучевых реакций нормальных тканей в облучаемой зоне. Степень их выраженности зависит как от методики облучения (уровень разовых и суммарных поглощенных доз, ритм облучения, размер полей), так и от распространенности опухоли, состояния нормальных окружающих тканей и др. Существенное влияние на течение лучевых реакций оказывает и общее состояние больного. Острые лучевые реакции кожи, как правило, ограничиваются эритемой и явлениями сухого эпидермита, которые не требуют перерыва в лечении, проходят самостоятельно или купируются 5% метилурациловой или пар-мидиновой мазью. При проведении лучевой терапии нередко имеется и риск развития лучевых осложнений (лучевых дерматитов, конъюнктивитов, катаракты, перихондритов, трофических язв, общей слабости, потери аппетита, головных болей и головокружения, лейко- и лимфопении, тромбоцитопении идр.), наблюдающихся примерно в 18% случаев. Это требует постоянного контроля состояния периферической крови и коррекции осложнений путем назначения гемостимулирующих препаратов, витаминов, дезинтоксикационной терапии, симптоматического лечения и т.д. Лучевая терапия неэффективна при склерозирующих формах опухолей и малоэффективна при наличии фистул и рубцов.
![лучевая терапия опухоли]()
В ряде случаев, особенно в зависимости от площади воздействия, период заживления кожи после лучевой терапии может продлиться до 8 недель. Ограничивает ее применение и развитие неудовлетворительных в косметическом отношении атрофических рубцов с депигментацией и телеангиэктазиями, особенно часто возникающих в области груди и конечностей, а также невозможность повторного использования при развитии рецидива опухоли. Рубец после лучевой терапии существенно затрудняет диагностику рецидива. Важно отметить, что лучевая терапия приводит к нарушению кровоснабжения кожи, костей и мягких тканей, ухудшая заживление ран, в связи с чем рецидив после применения лучевой терапии очень сложно поддается и хирургическому лечению. В таких случаях также затруднено проведение пластических реконструктивных операций.
Для лечения эпителиальных новообразований кожи наиболее широко применяется фракционная близкофокусная рентгенотерапия, которая осуществляется путем ежедневного воздействия на очаг; поглощенная разоваядоза составляет 3-5 Гр (300-500 рад), общая суммарная доза — 50-70 Гр (5000-7000 рад).
При опухолях, расположенных в области губ, ушных раковин, век, с выраженной инфильтрацией подлежащих тканей методом выбора является внутритканевая гамма-терапия.
По данным литературы, косметический эффект после проведения лучевой терапии в 57,2% случаев был хорошим, в 24,8% — удовлетворительным и в 11,1% — плохим; однако частота осложнений варьировала от 4,9 до 80% случаев; рецидивы же после лучевой терапии базалиомы отмечались в 5-20% случаев.
Частота рецидивирования выше при локализации опухоли на волосистой части головы, носу, в периорбитальной области, а также при большей площади очагов поражения.
Суммируя приведенные данные, необходимо отметить, что несмотря на появление новых, более эффективных и более безопасных методов, рентгенотерапия не утратила своего значения при ряде злокачественных новообразований кожи и может явиться методом выбора при лечении некоторых форм базалиомы, плоскоклеточного рака кожи, эритроплазии Кейра, болезни Боуэна.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.1. Тяжелая сопутствующая патология.
2. Иммунодефицитное состояние.
Интерферонотерапия характеризуется местным или системным применением иммуномодулирующих препаратов. Применяют рекомбинантные интерфероны — альфа-2β-реаферон, виферон (Россия), интрон, А (США), местный иммунотропный препарат крем имиквимод. После проведения интерферонотерапии отмечается регресс большинства опухолей [1, 7]. Однако метод характеризует ряд побочных эффектов: общая слабость, энцефалопатия, анорексия, психомоторные нарушения, транзиторная лейкопения, тромбоцитопения, тошнота, нарушение вкуса, диарея. Широкое применение крема имиквимод ограничено возникновением таких побочных эффектов, как выраженная воспалительная реакция, невозможность использования на чувствительных участках кожи, системные побочные реакции. Также к недостаткам интерферонотерапии относят высокую стоимость проводимой терапии и относительно низкую степень излеченности [7].
Показания к интерферонотерапии
1. Отказ пациентов от хирургического лечения.
2. Язвенная форма.
3. Поверхностная форма.
4. Нодулярная форма.
5. Наличие неоперабельных крупных БКРК.
Ингибиторы Hedgehog сигналинга. С мутациями генов сигнального пути Hedgehog ассоциировано большинство случаев БКРК [28]. В 2012 г. FDA (Food and Drug Administration, Управление по контролю за продуктами и лекарствами, США) был одобрен препарат висмодеглиб для лечения распространенного БКРК у взрослых пациентов. Препарат обладает низкой токсичностью и избирательным механизмом действия [29]. Наиболее частыми нежелательными явлениями при приеме висмодеглиба бывают мышечные спазмы, алопеция, изменение вкусовых ощущений, потеря массы тела, усталость, тошнота, рвота, диарея, констипационный синдром, артралгии, гипонатриемия, тератогенный эффект.
Показания к применению ингибитора Hedgehog сигналинга — препарата висмодегиб
1. Метастатический БКРК.
2. Рецидивирующий БКРК.
3. Местно-распространенный БКРК у пациентов, не подлежащих хирургическому или лучевому лечению.
Фотодинамическая терапия (ФДТ) представляет собой эффективный и неинвазивный метод лечения БКРК с отличными косметическими результатами, основанный на селективном фотодинамическом повреждении опухолевых клеток в ходе фотохимических реакций. Основным компонентом фотодинамической реакции является фотосенсибилизатор (ФС) — вещество, повышающее чувствительность тканей к свету. ФС бывают системными и местными [34]. К системным ФС 1-го поколения относят производные гематопорфирина: фотофрин (США), фотогем (Россия), фотосан (Германия), и характеризующиеся низким коэффициентом накопления в опухолевых клетках и фототоксичностью. Более перспективными считаются ФС 2-го поколения: фотодитазин (Россия), фотолон (Белоруссия), радахлорин (Россия), фоскан (Германия), аминолевулиновая кислота (АЛК) (Норвегия). Однако при использовании всех системных ФС развивается серьезный побочный эффект в виде длительной фотосенсибилизации всего кожного покрова, которого в свою очередь не наблюдается при использовании местных ФС [30, 32]. Синтез липофильных эфиров АЛК позволяет увеличить селективность ФС и его пенетрацию при проведении ФДТ [32, 33]. Одним из наиболее эффективных и современных местных фотосенсибилизаторов является метиламинолевулиновая кислота (МАЛК), которая выпускается в виде крема метвикс («Галдерма», Швейцария). Фотодинамическая терапия с метиламинолевулиновой кислотой (МАЛК-ФДТ) по сравнению с криодеструкцией и хирургическим иссечением характеризуется достижением более приемлемого косметического результата. В качестве источника света при МАЛК-ФДТ используют лампу, излучающую холодный видимый свет в красном спектре. Дозы световой энергии при ФДТ различных форм БКРК делятся на минимальные, средние и максимальные, которые в свою очередь зависят от размера и локализации очага. Применение МАЛК приводит к селективному увеличению количества порфиринов (сенсибилизаторы) в опухолевых клетках, в результате чего последние становятся чувствительными к свету. А в здоровых клетках, напротив, содержание фотоактивных порфиринов незначительное. При воздействии на опухолевые клетки красным светом происходит активация фотоактивных порфиринов. После активации светом в присутствии кислорода в результате взаимодействия с проактивными порфиринами нетоксичный триплетный кислород переходит в более активное состояние, образуя так называемый «синглетный» кислород, обладающий выраженным цитотоксичным действием, что приводит к селективному разрушению опухолевых клеток. Эффективность фотодинамической терапии при БКРК обеспечивается за счет трех механизмов: повреждения сосудов опухоли, цитотоксичности фотохимической реакции и за счет формирования иммунного ответа вокруг опухоли [30, 34]. Эффективность ФДТ зависит от формы БКРК, ее размеров, от вида используемого ФС и составляет 73—95%. Цитотоксический эффект зависит от концентрации ФС и глубины проникновения света в опухолевую ткань [33, 35].
МАЛК-ФДТ является современным и эффективным методом лечения БКРК и обладает рядом существенных преимуществ: селективностью поражения исключительно опухолевых клеток, органосохраняющим эффектом, возможностью удаления очагов в труднодоступных местах, возможностью многократного применения, косметически более приемлемым эффектом, отсутствием тяжелых местных и системных осложнений, возможностью проведения лечения пожилым людям и больным с тяжелой сопутствующей патологией, возможностью проведения процедуры в амбулаторных условиях. Кроме того, во время одного лечебного сеанса можно проводить обработку нескольких очагов поражения [33—35].
Гипертермия
![]()
Гипертермия (повышенная температура) – это вспомогательный метод, применяемый при лечении больных с онкологическими и неонкологическими заболеваниями.
В онкологической практике гипертермию проводят при температурах 41-45 °С с целью улучшения результатов лучевой-, химио- и/или гормонотерапии. Механизм её действия заключается в торможении восстановления клеток опухоли от повреждений, полученных после лучевой и лекарственной терапии.
У неонкологических больных гипертермия проводится в умеренном режиме (39-40 °С, 15-40 мин). Лечебный эффект связан с улучшением кровотока, обмена веществ в тканях, увеличением концентрации лекарственных препаратов в «больном» очаге и повышением местного иммунитета. Во многих случаях гипертермия оказывает лечебный эффект и в самостоятельном виде, т.е. без дополнительного применения лекарственных препаратов.
Нагревание осуществляется с помощью специальных аппаратов, генерирующих электромагнитные (ЭМ) излучения различных диапазонов волн.
Когда применяется гипертермия?
В онкологии гипертермия применяется в тех случаях, когда необходимо усилить действие лучевой, химио- и гормонотерапии, особенно если известно, что опухоль является устойчивой к таким видам лечения. Наиболее широко используется при лечении рецидивных опухолей или метастазов, которые, как правило, являются устойчивыми к любым видам противоопухолевой терапии.
В некоторых случаях, при противопоказаниях к лучевой или химиотерапии, гипертермия проводится в самостоятельном виде для повышения качества жизни больных: снятия болевых симптомов и улучшения общего самочувствия.
В неонкологической практике гипертермия применяется при лечении хронических неспецифических воспалительных заболевании (бронхит, пародонтит, простатит и др.), поздних лучевых фиброзов.
Методы гипертермии
Существуют следующие способы гипертермии:
- Наружная локальная гипертермия – нагревание только опухоли.
- Наружная регионарная гипертермия – нагревание органа с опухолью и регионарными лимфоузлами.
- Внутриполостная гипертермия – нагревание опухолей полых органов (прямая кишка, пищевод) с помощью специальных внутриполостных аппликаторов (излучателей).
- Общая гипертермия – нагревание всего тела человека, используется при обширных метастатических процессах.
Оборудование, используемое для гипертермии
Основными установками, которые используются в настоящее время для проведения лечебного нагрева, являются аппараты, генерирующие ЭМ-поле в СВЧ-, УВЧ- или ВЧ-диапазоне. Выбор методики и аппарата зависит от глубины залегания опухоли, её конфигурации и размера. В зависимости от этих параметров подбирается установка с определенной частотой излучения и длиной волны.
Противопоказания к проведению лучевой терапии
- острые соматические (заболевания внутренних органов) и инфекционные заболевания;
- соматические заболевания в стадии декомпенсации;
- тяжелые заболевания центральной нервной системы и психические расстройства (эпилепсия, шизофрения и т.п.);
- прорастание опухолью крупных сосудов или её распад, угроза кровотечения из облучаемой области;
- анемия, лейкопения, тромбоцитопения;
- раковая кахексия (истощение организма);
- выраженный синдром опухолевой интоксикации.
Как проводится лечение в онкологии?
Перед лечением выполняются необходимые исследования (рентгенография, УЗИ, компьютерная томография, магнитно-резонансная томография и др.), с помощью которых определяется точное месторасположение новообразования. На основании имеющихся данных принимается решение о способе лечения больного: выбор аппарата и аппликатора. Врач обязательно рассказывает пациенту о планируемом лечении, риске возникновения побочных эффектов и мерах по их профилактике. Врач выбирает план лечения пациента: методику гипертермии, количество сеансов и сочетание с другими методами лечения (по согласованию с другими специалистами). Процедура гипертермии проводится в течение 60-150 мин и завершается непосредственно перед лучевой терапией В случае комбинации её с химиотерапией нагрев осуществляется во время или сразу после завершения введения химиопрепаратов.
Наружная (локо-регионарная) гипертермия проводится на кушетке в удобном для больного положении. В случае лечения рака прямой кишки внутриполостной аппликатор вводится в просвет опухоли. Температура в опухоли контролируется введенными в нее 1-2 термодатчиками, или она вычисляется расчетным методом по специальной программе. Во время нагревания кожа или слизистая оболочка охлаждается водой (10-30 °С), циркулирующей в аппликаторе. Поэтому больной во время сеанса гипертермии чувствует только тепло разной степени выраженности и может даже читать или слушать музыку.
Общая гипертермия проводится на гипертермической установке "Яхта-5" под общим наркозом. Контроль температуры осуществляется в прямой кишке, при необходимости в пищеводе. Голова больного во время процедуры охлаждается с помощью холодного воздуха от специального аппарата. Курс лечения состоит из 2-4 процедур, проводимых 1 раз в 3-6 недель в комбинации с химиотерапией. Технически общая гипертермия осуществляется одинаково при всех локализациях опухолей, различие заключается в интенсивности и продолжительности нагревания, а также в количестве процедур и интервалов времени между сеансами, которое зависит от общего состояния пациента.
Как проводится лечение неонкологических больных?
При лечении неонкологических больных, по сравнению с онкологическими, применяется более низкий температурный режим (39-40 °С) и более короткое воздействие (15-40 мин). С другой стороны, это лечение схоже с физиотерапией, где также используется ЭМ-излучение. Отличие состоит в том, что при физиотерапии уровень нагрева в воспалительном участке весьма слабый, не превышает 37,5-38 °С (в основном греется кожа). Поэтому лечебный эффект при физиотерапии связан со специфическим воздействием ЭМ-поля и меньше всего – тепловым эффектом. При гипертермии лечебный эффект в основном связан с воздействием тепла.
Побочные эффекты гипертермии
Побочные эффекты наблюдаются при лечении только онкологических больных из-за необходимости поддержания высокой температуры в опухоли (41-45 °С) и продолжительностью воздействия.
Как правило, после процедуры кожа на месте нагрева краснеет и приобретает нормальный цвет в течение 4-6 часов. Но в некоторых случаях может появляться болезненность и припухлость кожи и подлежащих тканей, редко – ожоги кожи, которые наблюдаются, в основном, у больных с утраченной тактильной и термической чувствительностью после ранее проведенной лучевой терапии или операции. Все вышеуказанные изменения поддаются консервативной терапии. При покраснении кожи можно использовать кремы и лосьоны для ухода за детской кожей. В случае ожогов – аэрозоль «Пантенол». Кожа после гипертермии требует к себе бережного и щадящего отношения, поэтому пациентам следует носить свободную одежду, которая не стесняет место, где проводится нагревание, не натирает кожу. Нижнее белье должно быть изготовлено из льняной или хлопчатобумажной ткани. Для проведения гигиенических процедур следует использовать теплую воду и щадящее (детское) мыло.
В ФГБУ «НМИЦ радиологии» Минздрава России каждый случай заболевания рассматривается на междисциплинарном консилиуме при участии онколога, хирурга, онкоморфолога, онко-радиолога и многих других специалистов, которые вместе работают над тем, чтобы совместно определить тактику лечения пациента.
Что касается локальной гипертермии, то ее нельзя рассматривать как самостоятельный метод лечения опухолей кожи. Она используется в комплексе с химиотерапией или лучевой терапией, позволяя не только повысить эффективность, но и уменьшить частоту побочных эффектов этих методов. Метод гипертермии в СВЧ-, УВЧ- и ВЧ-диапазонах основан на том. что микрососудистая система опухолей в большей степени подвержена деструктивному воздействию гипертермии, чем микрососудистая система нормальной ткани.
Гипертермию с успехом использовали в комплексном лечении метастатической меланомы, болезни Боуэна, метастазов плоскоклеточного рака внутренних органов в кожу. Курс лечения продолжался до 3-4 мес. Клинический эффект (например, прилечении гипертермией болезни Боуэна) наступал через 2-4 нед., очаги, оставшиеся после курса гипертермии, были удалены хирургическим путем в пределах окружающих здоровых тканей; рецидив отмечался в 1 из 6 случаев. При гистологическом исследовании в регрессирующем очаге болезни Боуэна оказались более выраженными инфильтрация Т-лимфоцитами, васкуляри-зация, экспрессия рецепторов к Fas-антигену и фактору некроза опухоли.
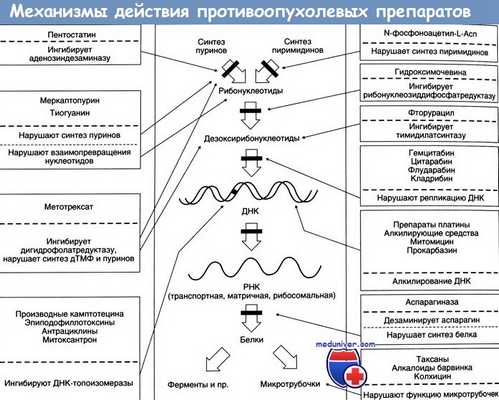
В некоторых случаях при новообразованиях кожи возможно применение общей химиотерапии. Для введения химиопрепаратов в организм используют пероральный, внутривенный, внутримышечный, внутриартериальный регионарный, эндолимфатический пути. Цитостатические средства, используемые в дермато-онкологической практике, представлены несколькими группами.
Первая группа химиопрепаратов — апеллирующие вещества. Они обладают цитостатической активностью, так как способны образовывать ковалентные связи с нуклеофильными соединениями, в том числе со структурными элементами ДНК, что приводит к блокаде митоза и нарушению жизнедеятельности клетки. В эту группу включают производные бисфхлорэтиламина, этиленамины и этилендиамины, алкилсульфонаты, производные нитрозомочевины и триазена. Обычно они используются при лечении множественной базалиомы и метатипического рака (проспидин), лимфомы кожи (проспидин, фотрин, хлорамбуцил, циклофосфамид, эмбихин, сарколизин, дакарбазин, дегранол, допан), саркомы Капоши (проспидин, циклофосфамид, фотрин), меланомы (дакарбазин).
Вторая группа химиопрепаратов — антиметаболиты — соединения, нарушающие синтез нуклеиновых кислот и представленные аналогами фолиевой кислоты (метотрексат, используемый, например, при лечении кератоакантомы), пуринов (фопурин, используемый для лечения лимфомы кожи и саркомы Капоши) и пиримидинов (фторофур, применяющийся для лечения лимфомы кожи).
В состав третьей группы химиопрепаратов входят алкалоиды (винбластин и винкристин, применяемые при лимфоме кожи), антибиотики: блеомицин (применяемый при лимфоме кожи, плоскоклеточном раке кожи, болезни Боуэна, бородавках); брунеомицин и доксорубицин (при лимфомах кожи); дактиномицин (при саркоме Капоши и меланоме).
Четвертая группа химиопрепаратов — синтетические вещества разного химического строения: производные мочевины (гидроксикарбамид, применяющийся при меланоме и болезни Ходжкина), а также рад других соединений.
Все перечисленные группы цитостатических средств обладают способностью оказывать действие не только на клеточные популяции, характеризующиеся злокачественным ростом, но и на другие тканевые системы, обладающие быстрой пролиферацией (иммунную систему, клетки слизистой оболочки желудочно-кишечного тракта, кожу и ее придатки). Многие из них высокотоксичны. Среди осложнений химиотерапии наиболее часто описываются: тошнота, рвота, диарея, анорексия, стоматит, алопеция, геморрагический синдром, анемия, тромбоцитопения, лейкопения, гепатит, нефрит, дерматит. Профилактика и лечение осложнений проводятся так же, как при лучевой терапии.
Химиотерапия противопоказана при выраженном истощении больного, диссеминации опухолевого процесса, особенно с метастазами в головной мозг, печень, почки; исходном угнетении гемопоэза (менее 3,0 х 10 9 \л лейкоцитов и 100 х 10 9 \л тромбоцитов), патологии сердечнососудистой системы, активном туберкулезе.
![Мишени противоопухолевых препаратов для химиотерапии]()
Читайте также:
- Острое облучение радиоактивным йодом. Влияние радиоактивного йода на щитовидную железу
- Рентгенограмма, КТ при изолированной травме таза
- Повреждение вен конечности. Эпидемиология, диагностика
- Рентгенограмма, КТ, МРТ при маделунговской деформации
- Косолапость (эквиварусная деформация стопы) - лучевая диагностика