Острое облучение радиоактивным йодом. Влияние радиоактивного йода на щитовидную железу
Добавил пользователь Евгений Кузнецов Обновлено: 20.01.2026
Лечение токсического зоба радиоактивным йодом и ее эффективность
Лечение I131 основано на повреждающем щитовидную железу действии бета-излучения и является таким образом методом «бескровной операции». Показаниями для применения I131 являются: диффузный токсический зоб средней и тяжелой формы, особенно при отсутствии терапевтического эффекта (консервативного лечения. В последнее время отечественные и зарубежные авторы сообщают о хорошем терапевтическом эффекте I131 при смешанных и узловых формах токсического зоба.
Противопоказанием служит форма токсического зоба, узловые формы токсического зоба (относительное противопоказание), возраст моложе 40 лет (опасность воздействия на наследственность), период беременности и лактации, Обострение язвенной болезни. Относительным противопоказанием является и загрудинная форма зоба, хотя имеются литературные данные о положительном результате лучевой терапии в подобных случаях.
Для определения необходимой терапевтической дозы I131 применяются несколько методов, в том числе клинические, клинико-физические и физико-математические. Все они направлены на выявление минимальной, необходимой для излечения больного дозы I131, однако все методы не учитывают индивидуальной биологической чувствительности тканей щитовидной железы к лучевой терапии.
В настоящее время используется дробный метод введения I131, позволяющий значительно уменьшить число гипотиреозов, обусловленных передозировкой I131.
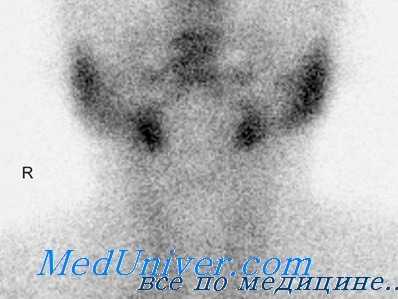
Необходимым условием лечения изотопом I131 является предшествующая ему отмена препаратов стабильного йода не менее чем за 1—2 месяца. Естественно, что при таком длительном перерыве в проведении антитиреоидной терапии возникает ухудшение течения токсического зоба. Поэтому в настоящее время проводится лечение мерказолилом, предшествующее введению I131. Следует отметить, что указанное лечение мерказолилом необходимо проводить особенно в тяжелых случаях заболевания для предупреждения обострения тиреотоксических признаков после применения I131.
Лечение мерказолилом прекращают за 5—7 дней до приема I131. С целью предупреждения тиреотоксического криза в результате усиленного выделения в кровь тиреоидиых гормонов в ответ на повреждающее щитовидную железу действие лучевой терапии через 3 дня возобновляется прием мерказолила из течение 2—3 педель.
В последнее время предложен метод комбинированного лечения I131 и мерказолилом, заключающийся в длительном применении мерказолила на фоне I131. Для оценки функции щитовидной железы необходимо делать перерывы в лечении мерказолилом. Данный метод позволяет несколько уменьшить необходимую для излечения дозу I131 при дробном методе лечения.
Примененииe I131 в терапии токсического зй'ба дает высокий процент излечения, достигающий 75—92 в зависимости от формы зоба (диффузная, смешанная). Однако несмотря на высокую эффективность данного метода лечения, он не лишен некоторых недостатков, а именно наблюдаются такие осложнения, паи гипотиреоз (в 1,6—3% случаев), тиреотокспческпй криз, который может возникать при лечении только I131 без (комбинации с мерказолилом (в 6—10% случаев), усиление экзофтальма и появление радиойодтиреоидитов. Последний вид осложнений наблюдается довольно редко.
Острое облучение радиоактивным йодом. Влияние радиоактивного йода на щитовидную железу
При остром поражении в костном мозге обнаруживается кратковременное относительное уменьшение эритробластических элементов за счет полихроматофильных нормобластов и некоторое увеличение клеток миелоидного ряда за счет миелоцитов, палочкоядерных и сегмеитоядерных форм. Такая реакция отличается от изменения органов кроветворения при попадании в организм остроэффектнвных количеств других продуктов деления 135I, что объясняется небольшой дозой энергии, поглощаемой костным мозгом от 131I.
Кроме того, после однократного поступления в организм 131I в дозах, вызываюших поражение щитовидной железы или общее хроническое заболевание, наступает (у крыс) изменение энхондрального окостенения с ранней ликвидацией эпнфизарной пластинки, тогда как при инкорпорировании 90Sr в равных активностях могут наблюдаться гиперпластнческие изменения хрящевой ткани [Стрельцова В. Н. и др., 1973]. В других органах и тканях обычно наблюдаются умеренные дистрофические изменения (Стрельцова В. Н., Новикова А. П., 1962; Васильева Л. А., 1972; Бойцова В. П., Ведерников В. П., 1977].
Тем не менее в поздние сроки поражения возможно развитие гепатита и миелолейкозов у людей при применении значительных терапевтических доз 13Ч [Ата-бек А. А., 1959].

Что касается щитовидной железы, то наибольшее значение в исходе общего поражения инкорпорированным радиоактивный йодом имеют отдаленные последствия, возникающие после кумуляции определенных местных доз поглощенной энергии. При поступлении в организм больших количеств радиоактивного йода, порядка 300 мкКи на крысу, наступает полная гибель железы [Golden A., Daveg В., 1973].
Эксперименты с введением 131I в дозах, соответствующих терапевтическим для людей, показывают, что в таких случаях через год после подкожного введения 131I в дозе 100 мкК.и на крысу обнаруживается атрофия фолликулов, резкое уменьшение в них коллоида, уплощение или слущивание фолликулярного эпителия, гиперплазия интерфолликулярного эпителия, разрастание межуточной ткани. Больше всего поражается центральная часть железы, тогда как по .периферии, как правило, имеются компенсаторно расширенные фолликулы, но с небольшим содержанием коллоида [Дроздова Н. И., Заркевич Н. Ф., 1963].
У людей, которым с терапевтическими целями вводили 131I, тоже наблюдаются довольно грубые дистрофические изменения паренхиматозных клеток щитовидной железы, развитие склероза, злокачественных и доброкачественных опухолей (сосочковая цистаденома, сосочковая адекокарцинома). Однако прямых доказательств непосредственной связи перечисленных изменений в щитовидной железе с действием 131I пока еше нет. Тем не менее имеется достаточно оснований обратить особое внимание на возможность развития опухолей после применения с лечебной целью радиоактивного йода [Колесникова Г. С, 1972; Ильин Л. А., Архангельская Г. В., 1973; Sheline G. E. et al., 1959].
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лучевая терапия рака щитовидной железы и ее эффективность
Лечение рака щитовидной железы радиоактивным иодом ( 131 I). В течение почти 50 лет радиоактивный изотоп иода ( 131 I) используется в качестве компонента терапевтических процедур. при лечении высокодифференцированной карциномы щитовидной железы.
Тактика послеоперационного лечения зависит от гистологических характеристик опухоли, степени ее распространения и объема хирургического удаления.
В большинстве наблюдений высокодифференцированного рака щитовидной железы (папиллярного и фолликулярного) для повышения абластичности операции больным назначают пероральный прием радиоактивного иода и проводят сканирование всего тела и области шеи.
Особенно это относится к случаям, когда у врача возникают сомнения в полноте хирургического удаления опухоли. Такая тактика лечения применяется почти в половине случаев фолликулярной карциномы и несколько реже для папиллярных опухолей. Для всех хорошо дифференцированных опухолей лечение 131 I не является необходимым, поскольку скрытые и интратиреоидные опухоли удаляются хирургическим путем и характеризуются очень благоприятным прогнозом. Поэтому при лечении этих опухолей, преимущественно встречающихся у больных молодого возраста, стараются избегать назначения им высоких доз излучения, особенно принимая во внимание возраст.
При необходимости терапии радиоактивным йодом больным следует назначать не очень большое количество радиоактивности, порядка 3 ГБк (в настоящее время вместо внесистемной единицы кюри используется беккерель, 1 Ки = 37 ГБк). При этом разрушается оставшаяся ткань щитовидной железы, которая в большей степени, чем опухоль, захватывает иод, что делает терапию 131 I неприменимой в случаях, когда после операции сохраняется значительная часть щитовидной железы. Если больному после операции назначали тироксин (Т4), то за месяц до начала йодной терапии его необходимо отменить, чтобы убедиться, что уровень TSH увеличился.
Важно увеличение уровня TSH, а не сама по себе отмена гормона. После проведения терапии йодом больному назначают короткий 6-недельный курс приема трииодтиронина (Т3). В отличие от Т4, последний обладает более продолжительным эффектом, который поэтому легче поддается контролю. Через 10 дней прием Т3 отменяют и больному снова проводят сканирование всего тела и шеи. Наличие области повышенного накопления изотопа в области шеи или в другом месте свидетельствует о наличии метастазов или неудаленной первичной опухоли. В таких случаях больным назначают терапевтическую дозу 131I (5,5-7,0 ГБк).
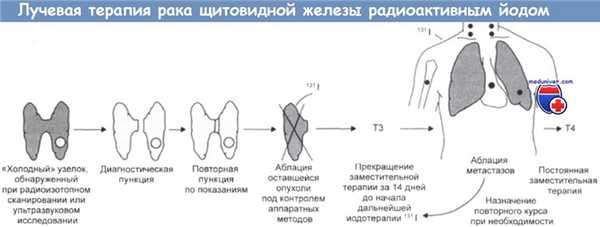
Лечение радиоактивным йодом относится к адресному типу лучевой терапии, который широко применяется для лечения рака у человека. Его можно повторять примерно через каждые три месяца (за 10 дней до начала йодной терапии нужно отменять назначение Т3) в течение всего времени, пока результаты повторного сканирования свидетельствуют о наличии очагов опухоли, т. е. фактически до полного исчезновения метастазов (если лечение вообще оказывается эффективным). Вместо отмены назначения тиреоидных гормонов можно использовать рекомбинатный препарат человеческого тиреотропина.
Несмотря на потенциальную опасность воздействия высоких доз радиации на шею, костный мозг, гонады и на другие критические органы, необходимо учитывать, что такой вид облучения оказывается эффективным даже для больных с множественными метастазами. Таким больным (фактически большинству с раком щитовидной железы) необходимо на протяжении всей жизни вводить Т4, поскольку вся функционально активная ткань щитовидной железы у них давно атрофирована. У больных, особенно молодого возраста, уже не реагирующих на йодную терапию, введение Т4 может привести к регрессии очагов остаточной опухоли, поскольку ее рост в определенной степени зависит от TSH, эффект которого снимается экзогенным Т4. В некоторых случаях, при прекращении больным приема ТЗ или Т4, ему следует назначить терапевтическую дозу 131 I. При этом за 2-3 дня до приема иода больному необходимо вводить TSH.
Хотя назначение 131 I после операции по поводу папиллярной карциномы сейчас рассматривается как перелечивание, в классических работах Маццаферри с сотрудниками (Италия) и Тюбиана с сотрудниками (Франция) продемонстрирована эффективность этой лечебной процедуры. К числу противопоказаний к йодной терапии относится возраст (более 40 лет), наличие большой первичной или плохо дифференцированной опухоли, а также ее распространение за пределы капсулы.
Локальные рецидивы возникают в два раза чаще после проведения субтотальной или тотальной тиреоэктомии, что приводит к увеличению смертности больных. Терапия радиоактивным иодом показана для больных с множественными, локально инвазивными и большими первичными опухолями, а также при отдаленных метастазах, для которых наблюдается хорошее поглощение изотопа. Разработка новых дозиметрических методов применительно к каждому больному обеспечивает более точное распределение изотопа и формирование более адекватной дозы облучения. Наконец, назначение Т4 полезно даже больным, которым не проводилась тотальная тиреоэктомия и которые не нуждаются в заместительной терапии.
Особенно важная роль уделяется постоянному наблюдению и периодическому обследованию больных, поскольку даже спустя много лет после полного излечения у них могут возникнуть рецидивы. Обследование должно включать тщательную пальпацию области щитовидной железы, регулярное рентгенографическое обследование грудной клетки (раз в три года, поскольку наиболее часто метастазы образуются в легких и в лимфатических узлах средостения), а также измерение уровня сывороточного тиреоглобулина. В настоящее время радиоизотопное сканирование используется редко, и прием больным Т4 должен сопровождаться ежегодным, в течение пяти лет после излечения, измерением уровня тиреоглобулина. В процессе дальнейшего наблюдения уровень тиреоглобулина измеряют через каждые два года.
Радиоизотопное сканирование проводят через 3-5 дней после назначения изотопа (в качестве безопасной амбулаторной дозы назначают 185 МБк радиоактивного иода). Этот метод все чаще используется при обследовании больных с аномальным уровнем тиреоглобулина, или прооперированных больных с неполностью удаленной опухолью.
Облучение рака щитовидной железы внешним пучком
Для больных, у которых не удается получить хорошую картину захвата радиоактивного иода, и особенно при наличии нерезектабельной локальной опухоли (включая большинство случаев анапластической карциномы и многие медуллярные карциномы), используют облучение внешним пучком.
Для предупреждения возникновения рецидива и обструкционного синдрома назначают достаточно радикальную дозу излучения, порядка 65 Гр за 7 недель. Такая доза обычно оказывает лечебное действие, которое, однако, лишь в редких случаях проявляется у больных с анапластической карциномой.
Для лечения больных с мелкоклеточными опухолями и лимфомами щитовидной железы почти всегда используется облучение внешним пучком. Эти опухоли облучают в меньшей дозе, порядка 40-50 Гр за 4-5 недель. Поскольку величина облучаемого объема ткани может достигать существенных размеров и захватывает часть спинного мозга, облучение щитовидной железы представляет собой трудную техническую задачу. В некоторых клиниках разработана специальная техника с использованием угловых или вращающихся полей.
В других предпочитают использовать более традиционную схему облучения с одного переднего поля, конфигурация которого задается с помощью свинцовых блоков, защищающих гортань и, при необходимости, легкие. Поля должны включать полностью щитовидную железу и, по возможности, надключичные и шейные лимфатические узлы, которые в первую очередь поражаются опухолью. При распространении опухоли на область верхнего средостения, поле облучения необходимо расширить вниз. Например, хорошо известно, что опухоли щитовидной железы могут распространяться внутритра-хеально, вызывая у больных стеноз.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Радиойодтерапия - все о методе лечения
История Радиойодтерапии ведет свое начало с 1941 года, когда в США (в Бостоне и Беркли) впервые было осуществлено введение радиоизотопов йода на практике.
С тех пор, за долгие годы использования, радиойодтерапия зарекомендовала себя в качестве достоверного, надежного и безопасного метода лечения при
- при гиперпродукции гормонов ЩЖ (диффузный токсический зоб, тиреотоксикоз, аденома ЩЖ);
- злокачественная опухоль ЩЖ (папиллярный и фолликулярный рак).
В большинстве стран мира (прежде всего в странах Европы и США) радиойодтерапия настолько безопасна, что небольшие дозы принимаются в амбулаторном режиме.
Современные российские национальные нормы радиационной безопасности РФ (НРБ-2009) позволяют проводить лечение радиоактивным йодом I 131 в амбулаторном режиме дозами, активностью, не превышающей 10,4 mCi. Во многих странах Европы данные нормы более «либеральные». Это делает возможным достижение желаемого результата с первого раза.
Хорошие результаты в лечение щитовидной железы методом радиойодтерапии во многом определяются грамотной подготовкой и реабилитацией после РЙТ.
Что такое радиоактивный йод (изотоп йода I-131)
Радиоактивный йод (I-131) – это один из изотопов самого обычного йода (I-126). Изотоп – это разновидность атома химического элемента, которая имеет тот же порядковый номер, но различается своим массовым числом. Такое отличие делает атом изотопа нестабильным, что приводит к его распаду с радиоактивным излучением. В природе существует много изотопов одного и того же химического элемента, исключением не стал и йод.
В медицине применение нашли 2 изотопа радиоактивного йода – I-131 и I-123. Йод с массовым числом 123 не имеет цитотоксического действия на клетки щитовидной железы и используется только в диагностических целях (сканирование ЩЖ).
I-131 обладает способностью к самопроизвольному распаду атома. Период полураспада составляет 8 суток. При этом образуется нейтральный атом ксенона, квант гамма-излучения и бета частица (электрон). Терапевтическое действие осуществляется именно благодаря бета частицам. Такие частицы имеют очень высокую скорость движения, но маленький пробег в тканях (до 2 мм). Таким образом, они проникают в биологические ткани (клетки ЩЖ) и разрушают клетку (цитотоксическое действие).
Благодаря тому, что йод накапливается в организме человека исключительно в клетках щитовидной железы, свое действие I-131 осуществляет только здесь, на другие ткани он не действует.
Гамма-излучение, которое образуется при радиоактивном распаде атома йода, проникает сквозь организм человека (имеет большой пробег, но маленькую энергию). Таким образом, оно не воздействует на клетки организма. Но может быть использовано в диагностических целях. Так можно определить, где еще в организме накопился йод с помощью специальной гамма-камеры, которая регистрирует такое излучение. Если такие очаги есть, то можно думать о существовании метастазов рака ЩЖ.
Радиойодтерапия в лечении щитовидной железы

Суть лечебного процесса основана на способности клеток щитовидной железы к связыванию и накоплению радиоизотопа йода I131, который обладает повреждающим действием на тиреоидную ткань. Известно, что период полураспада I 131 составляет всего 8 суток и, именно, локальный облучающий эффект, без повреждения других органов и систем делает метод радиойодтерапии таким привлекательным.
В настоящее время задачей специалистов является однократное лечение радиоактивным йодом I131 в достаточной дозе, которая вызывает развитие гипотиреоза. На второй план отходят дробные, малые дозы, которые, по сути, всего лишь отодвигают результат и часто требуют повторного введения. Безусловно, и объем расчетной дозы, а также прогноз во многом зависят от стадии заболевания, тяжести, наличия сопутствующей патологии. При тиреотоксикозе дозы радиойда I 131 в основном, варьируют от 3 до 30 mCi. При диффузно-токсическом зобе они, как правило, не превышают 25 mCi, при токсической аденоме 25-30 mCi. Однако, в каждом конкретном случае, ситуацию следует рассматривать индивидуально, на основании данных обследования. Для достижения ремиссии тиреотоксикоза при объемах щитовидной железы свыше 50-70 мл, может понадобиться повторное введение I131, что удлиняет достижение ремиссии. В отдельных случаях, можно рекомендовать оперативное лечение, как более предпочтительное.
Поправку на поглощение йода железой вносят, используя следующее уравнение:
Ожидаемым эффектом от радиойодтерапии является гипотиреоз. В первые 6-12 месяцев после приема I 131 он развивается более чем 80% случаев и является наилучшей гарантией отсутствия рецидива тиреотоксикоза. После приема I131 каждые 6-8 недель определяют уровни свТ4 и ТТГ в сыворотке и, при появлении признаков гипотиреоза, начинают заместительную терапию Т4 в дозе 0,05-0,2 мг в сутки.
Использование изотопа I 131 в качестве второго этапа лечения высокодифференцированного рака (папиллярный, фолликулярный) щитовидной железы требует назначение более высоких доз (до 200 mCi), безусловно, в зависимости от тяжести и распространенности процесса, а также соблюдение изоляционного режима в терапевтическом блоке в течение 2-3 дней.
Длительные наблюдения за больными показывают, что радиойодтерапия не приводит к бесплодию и порокам развития у плодов и не увеличивает частоту рака щитовидной железы.
Относительным противопоказанием к радиойодтерапии болезни Грейвса является тяжелая офтальмопатия, так как введение I 131 может обострять глазные проявления этого заболевания. Обострение болезни Грейвса особенно вероятно у больных с тяжелым тиреотоксикозом и у курильщиков. Однако его можно предотвратить введением преднизона по 40-60 мг в сутки на протяжении 1-2 месяцев после радиойодтерапии.
Терапия болезни Грейвса антитиреоидными средствами также не исключает развития гипотиреоза в отдаленном периоде (из-за аутоиммунной деструкции ЩЖ). Поэтому все больные нуждаются в пожизненном наблюдении.
Преимущества капсульной формы радиойода I131 жидкой

Раньше радиологические клиники и институты использовали радиойод в виде жидкого раствора, который пациенту предлагался для питья в пластиковом стаканчике.Однако, в связи с повышенным риском загрязнения окружающей среды, а также аварийности жидкой формы, данный протокол был отменен и современные медицинские учреждения перешли на капсульную форму.
- Точная дозировка радиойода в капсуле – капсула четко маркирована, упакована в свинцовый контейнер и ее удобно транспортировать до радиологических отделений. Медицинский работник всегда точно уверен в дозиметрическом контроле капсулы I131.
- Потери активности радиойода в капсульной форме минимальные. Он не остается на стенках стакана, исключаются риски случайного проливания жидкости при неосторожном обращении пациента со стаканом. Часто, у пожилых пациентов, с нарушением глотания, часть раствора может просто вытечь изо рта, или попасть «не в горло», что повлияет на результат лечения.
- При использовании капсульной формы радиойода возникает меньше побочных эффектов, чем при использовании жидкой формы. При использовании жидкой формы, орошается и полость рта, и пищевод; слюнные железы получают большую дополнительную радиационную нагрузку. В конечном итоге, больше раздражающего эффекта со стороны слизистой желудочно-кишечного тракта с соответствующими проявлениями (тошнота, вплоть до рвоты, неприятные ощущения при глотании, отечность шеи).
- Удобство использования для персонала радиологических отделений, в том числе хранения и транспорта. Вероятность возникновения аварийных ситуаций в таких отделениях сведена к минимуму.
- Комфортность для пациента, капсула не имеет запаха и вкуса, по размерам она не превышает капсулу антибиотика, витамина и т.д.
Таким образом, капсульная форма приема радиойода считается наиболее безопасной, более точной с точки зрения дозировки и с минимальными побочными эффектами. Рекомендуем Вам обращать пристальное внимание на то, в какой форме Клиника предлагает радиоактивный йод для приема пациентам.
Кюри или беккерель?
Это две единицы измерения, которые отображают одну и ту же физическую величину – радиоактивность материала.
Радиоактивность – это способность ядер атомов вещества распадаться на части. При распаде образуются ядра атомов гелия, электроны и кванты энергии – соответственно, альфа, бета и гамма лучи. Эти лучи губительно действуют на организм человека, но в умеренных дозах могут использоваться в медицинских целях.
Дозы измеряют в других единицах, а радиоактивность – в кюри и беккерелях. Подобно многим единицам в физике они названы фамилиями ученых, чья деятельность неразрывно связана с исследуемой областью. При этом сами единицы пишутся со строчной буквы, а в сокращении обозначаются заглавной – Ки (кюри) и Бк (беккерель).
За 1 Бк принято обозначать радиоактивность, при которой происходит 1 распад атомного ядра в секунду. Что касается кюри, то здесь принцип иной. 1 Ки отображает активность радона-222, газа, образующегося при распаде радия. Установлено, что в 1 г этого вещества происходит около 37 млрд. или 37•109 распадов в секунду.
Следовательно, 1 Ки = 37•109 или 3,7•1010 Бк. Соответственно, 1 Бк = 2,7027•10−11 Ки. Это значит, что 1 распад в секунду происходит всего лишь в 2,7027•10−11 граммах радия. Для значений, которые отличаются от стандартных единиц в тысячи, миллионы, миллиарды раз, используют приставки – милли (мКи), микро (мкКи), кило (кБк), мега (МБк), и др. В 1млрд. БК (1МБк) 0,027027•10 Ки, а в миллионной доле Ки (1мкКи) 3,7•104 Бк.
Исторически сложилось так, что радиоактивность измеряется в кюри, т. к. именно супруги Кюри внесли наиболее весомый вклад в открытие этого явления. Однако Генеральной конференцией по мерам и весам основной единицей измерения был признан беккерель, который входит в СИ – международную метрическую систему единиц измерения физических величин.
Поэтому в официальных докладах, в научных трудах радиоактивность, следуя правилам, представляют в беккерелях. На практике для обозначения радиоактивности, особенно ее больших значений, часто используют кюри.
Производная от радиоактивности величина – радиоактивное загрязнение, радиоактивность в единице объема, площади или массы. Здесь тоже кюри намного удобнее, чем беккерель. Поэтому степень радиоактивной загрязненности часто измеряют в Ки/м2, Ки/кг, Ки/л.
Преимущества радиойодтерапии
Согласно статистическим наблюдениям эффективность радиойодтерапии в лечении токсического зоба и аденомы составляет около 90%. Эта цифра превышает аналогичный показатель после хирургического вмешательства. К тому же хирургическое вмешательство предполагает операционную травму с высоким риском послеоперационных инфекционных осложнений. А радиойодтерапия не сопровождается болевыми ощущениями, и за исключением отдельных случаев легкого недомогания хорошо переносится пациентами. В случае щитовидного рака терапия радиоактивным йодом существенно снижает рецидивы роста опухоли и продлевает жизнь пациента.
Также после лечения изотопами йода НЕ остается страшных рубцов на шеи, чего очень боятся женщины, и нет многочисленных осложнений, как после хирургического удаления ЩЖ (гипопаратиреоз, потеря голоса, кровотечения, инфицирование раны). Организму не придется выдерживать нагрузку в виде наркоза.
Возможные осложнения и последствия

Чтобы избежать возможных осложнений после радиойодтерапии, мы разработали несколько программ реабилитации, одна из которых, включает в себя возможность восстановления здоровья в Реабилитационном Центре «Раменское». Под 24-часовым медицинским контролем наши пациенты получают весь комплекс мероприятий по скорейшему восстановлению и возвращению к привычному образу жизни.
Не менее актуальны вопросы безопасности применения радиойодтерапии, с учетом радиационного воздействия I-131 на организм. Большинство побочных эффектов удается минимизировать при правильной подготовке к лечению и соблюдении несложных правил профилактики.
Видео рекомендации по соблюдению режима и правилам поведения в терапевтическом блоке можно посмотреть здесь.
Ниже приведены как острые, так и возможные отдаленные последствия, которые могут встречаться после курса лечения радиойодом I-131:
Острые побочные явления
Сразу после проведения терапии радиойодом может возникнуть общая интоксикация, которая проявляется в виде тошноты и рвотных позывов, повышения температуры, общей слабости, боли в мышцах. Данные симптомы сугубо индивидуальны, и проходят достаточно быстро (в течение 48 – 72 часов). При необходимости подключаются симптоматические препараты, которые снимают интоксикационную нагрузку на организм.
Боли в области шеи, дискомфорт, отечность, боль при глотании. Симптомы, как правило, проходят самостоятельно в течение 14 дней после терапии, уменьшается их интенсивность и острота. При необходимости назначаются нестероидные противовоспалительные препараты.
Примерно у 10% пациентов возникает послерадиационный сиалоаденит (воспаление околоушной слюнной железы), который проявляется сухостью во рту, нарушением глотания твердой пищи, болью и припухлостью около уха. В качестве профилактики пациентам рекомендуется обильное питье, жевательные таблетки и леденцы с кислым вкусом, лимон.
Под действием радиации страдает и желудочно-кишечный тракт. Развивается лучевой гастрит и энтерит. Проявляется болью в животе, тошнотой, потерей аппетита, нарушением стула. Как правило, эти повреждения минимальны и самостоятельно проходят на протяжении нескольких дней. В последние годы используется радиоактивный йод в виде капсулы, вместо жидкого раствора, что существенно уменьшает повреждающее действия на слизистую пищевода, желудка и кишечного тракта.
В отдельных случаях, применение высоких доз радиоактивного йода угнетает кроветворную функцию костного мозга, которая проявляется в снижении количества лейко- и эритроцитов, тромбоцитов. Чаще всего, данное состояние самостоятельно проходит спустя 6 – 8 недель, однако, в ряде случаев может понадобиться консультация гематолога.
Мифы в отношении радиоактивного йода и самого метода терапии

По поводу радиойодтерапии существуют вполне объяснимые опасения, реальные и мнимые.За более, чем полувековой опыт применения радиоактивного йода I-131, клиническими исследованиями достоверно подтверждено что риск малигнизации (озлокачествления) при радиойодтерапии нисколько не превышает таковой риск при других методах лечения рака. Токсическое действие лучевой и химиотерапии несравненно сильнее, чем при использовании изотопов йода.
Доказано, что радиойод I131 захватывается клетками, имеющими на своей поверхности рецепторы к йоду, при минимальном воздействии на другие органы и ткани, что позволяет расширить показания и возрастные рамки использования данного метода.
Особенно актуальным вопросом являются мутагенные и тератогенные последствия радиойодтерапии. Долгосрочные клинические исследования не подтвердили мутагенного эффекта радиойода. Короткий период полувыведения, отсутствие накопительного эффекта, сохранность генетического материала и быстрое восстановление репродуктивных функций, позволяет пациентам, прошедшим курс радиойода I131, планировать беременность уже один год после радиойодтерапии. Как правило, этого времени организму вполне достаточно, чтобы “отремонтировать” все поломки и начать продуцировать здоровые половые клетки.
Согласно другим утверждениям, излучение от пациента, принявшего радиоактивные капсулы, может представлять опасность для окружающих. Соблюдение норм радиационной безопасности в лечебном учреждении сводит эту опасность к минимуму.
Также людей пугает то, что после курса радиойодтерапии ЩЖ перестает функционировать и развивается состояние гипотиреоза. Это действительно так, но такое состояние легко корригируется приемом синтетических тиреоидных гормонов и не несет опасности для здоровья.
г. Москва, Ленинский проспект,
д.42, корпус 2, офис 21-23.
Размещенная на сайте информация и прейскурант не являются публичной офертой.
Тиреотоксикоз: операция или радиойодтерапия
Для того, чтобы понятно ответить на этот вопрос, необходимо сделать небольшое медицинское отступление. Известно, что диффузный токсический зоб имеет достаточно высокий процент рецидивирующего течения. Следовательно, перед лечащим врачом и пациентом стоит главный вопрос – как сделать так, чтобы полностью вылечиться от этого неприятного недуга без необходимости принимать лекарственную терапию годами, не навредить своему организму и обойтись без негативных, побочных последствий.

В более чем половине случаев, лечение тиреотоксикоза начинается с назначения лекарственных препаратов из группы тирестатиков, к которым относятся:
- Мерказолил;
- Тирозол;
- Пропилтиоурацил (Пропицил).
Большой разницы в терапевтическом эффекте у них нет. При этом, назначенные медикаменты обладают целым спектром побочных эффектов, среди которых:
- струмогенный эффект (увеличение размеров железы по сравнению с начальным объемом);
- аллергические реакции (по типу крапивницы с сильным зудом);
- снижение уровня лейкоцитов в крови (как следствие - частые ангины, простуды);
- токсические эффекты на печень (повышение уровня билирубина, трансаминаз – АЛТ, АСТ).
Когда нужно рассматривать вопрос о радикальном лечении тиреотоксикоза?
Вопрос о радикальном лечении нужно рассматривать, если в течение 2-х лет (и более) наблюдаются следующие ситуации:
- нет эффекта от приема медикаментов;
- при попытке снижении дозировки, или отмены лекарственной терапии возникает рецидив (то есть возобновление симптомов тиреотоксикоза).
Если при этом в крови выявляется повышенный уровень антител к рТТГ* (рецепторам к ТТГ) – то, тем более, можно ожидать, что рецидив наступит. Данный анализ относится к прогностическому критерию слабой эффективности медикаментозной терапии. Чем выше уровень антител к рецепторам ТТГ (ат-рТТГ), тем более выраженный аутоимунный процесс и агрессивное воздействие антител на ткань щитовидной железы, которые постепенно ее разрушают.
Референсные значения антител к рецепторам ТТГ:
- Если уровень антител к ТТГ от 1 - 5 ед. – риск развития рецидива составляет 50%;
- Если уровень антител к ТТГ выше 5 и до 10 – почти в 70% случаев можно ожидать рецидива;
- Если уровень антител к ТТГболее 10 (особенно 15 – 30) – вероятность развития рецидива практически 100%.
Каковы симптомы этого состояния и его причины?
Неудовлетворительное отражение в зеркале, ухудшение качества жизни, отсутствие личной жизни и ее перспектив - вот что чаще всего подталкивает наших пациентов к поиску других путей решения проблемы и, зачастую, радикального лечения.
Особенно ярко негативная симптоматика при тиреотоксикозе проявляется у женщин. Плохое самочувствие, резкое снижение качества жизни, изменение внешности (в том числе: сухость кожи, ломкость ногтей, выпадение волос), нарушение менструального цикла, невозможность забеременеть (или сохранить беременность, в случае, если она наступила) – все это классические признаки далеко зашедшего тиреотоксикоза.
Если к уже имеющимся симптомам добавляется аритмия (перебои в работе сердца), суставные и мышечные боли, остеопороз, повышенные показатели уровня сахара в крови, то это говорит о глубокой степени тиреотоксикоза, - того состояния, когда патологический процесс может приобрести необратимую форму.
Мы прекрасно понимаем, что триггерами, то есть пусковыми факторами заболевания, служат разные состояния, и, прежде всего, – стрессовые. Уже давно известно, что любая стрессовая ситуация оставляет свой опечаток на человеке, - на его психическом и физическом здоровье. К сожалению, полностью исключить стресс из жизни невозможно. Конфликт в семейной жизни, болезнь или уход из жизни близкого человека, некоторые состояния в периоде от 3 до 6 месяцев после родов, долгое пребывание под прямыми солнечными лучами – это самые распространенные причины возникновения рецидива.
Поэтому врачи всегда призывают к своевременному лечению. И затягивать с принятием решения в данном случае просто опасно.
Какой метод лечения выбрать: операция или радиойодтерапия
Как уже отмечалось выше, если пациент в течение долгого времени (более 2-х лет) принимает (или принимал) тиреостатический препарат, а длительная ремиссия так и не наступила, – это уже веский повод для принятия решения о применении радикального метода лечения. Если такое решение, наконец, принято, то неизбежно возникает вопрос: "Какой метод лечения выбрать?"
На сегодняшний день радикальных методов лечения тиреотоксикоза два: хирургическое вмешательство и радиойодтерапия (РЙТ).
Сразу оговоримся, что задача обоих методов – добиться полного угасания функции щитовидной железы с последующим переходом на пожизненную заместительную терапию гормоном левотироксином (Л-тироксин или Эутирокс).
Вот теперь мы, наконец, можем перейти к основному вопросу данной статьи: в каких случаях стоит выбрать тот или иной вариант радикального лечения тиреотоксикоза.
На что стоит обратить внимание при выборе хирургического лечения?
В нашей практике были пациенты, которым удаляли только часть железы (как правило, одна доля), и со временем оставшаяся ткань разрасталась (пролиферировала) и, через какое-то время (возможно, у кого-то через полгода, возможно, и через 5 лет) – пациент приходил к своему врачу с той же проблемой. И перед хирургами вставал вопрос: «Что делать»?
- можно задеть паращитовидные железы – будет прямая проблема с уровнем паратгормона, который регулирует уровень кальция и фосфора в крови – отсюда ранний остеопороз;
- можно пациенту задеть возвратный нерв и, как последствие, лишить его голоса.
Щитовидная железа – богато кровоснабжаемый орган и достаточно сильно кровоточит при операции. Здесь находится много нейро-сосудистых пучков, которые можно травмировать.
Изначально маленький объем ЩЖ (без узловых образований) – также НЕ лучшая ситуация для операции.
Учитывая вышесказанное, если пациент все же принимает решение о хирургическом удалении щитовидной железы при диффузно-токсическом зобе – лучшим выбором объема операции будет тотальная тиреоидэктомия, или предельно субтотальная тиреоидэктомия, то есть удаление полностью всей ткани щитовидной железы, ради минимизации риска рецидива в будущем.
Повторимся, удаление только части железы (так называемая "резекция ткани железы") – влечет за собой высокий риск рецидива тиреотоксикоза в будущем. Причина тому ясна: аутоиммунный процесс, лежащий в основе диффузного токсического зоба, никуда не девается и удаление только части (одной доли) щитовидной железы со временем чревато увеличением в объеме ткани ЩЖ .
Хирургическое вмешательство будет правильным в случае узлового зоба, то есть наличия узла (тем более, нескольких узлов) в щитовидной железе, которые при сцинтиграфии окажутся «холодными» (не накапливающие радиофармпрепарат).
Естественно, прежде чем, выбирать тот или иной метод лечения, необходимо убедиться в доброкачественной природе данных узловых образований, что достигается путем выполнения тонкоигольной аспирационной биопсии (ТАБ). Золотой стандарт – проведение ТАБ под контролем ультразвука, из нескольких мест, а также соответствие описания биопсии международному протоколу Tirads.
В каких случаях радиойодтерапия будет являться лучшим выбором?
- небольшой объем щитовидной железы (в нашей практике объемы до 45 мл удается подавить с первого раза);
- отсутствие узловых образований;
- усиленный кровоток (васкуляризация ткани) при УЗИ щитовидной железы;
- отсутствие признаков эндокринной офтальмопатии;
- длительность анамнеза: безусловно, чем раньше начато лечение с момента дебюта (выявления) заболевания – тем лучше. Хотя, в нашей практике, мы сталкивались и с весьма успешным лечением тиреотоксикоза, который лечили медикаментозно очень долго (от 10 до 17 лет).

По нашей статистике, при условии, что пациент подготовлен к приему капсулы радиойода I131 правильно и качественно, успешность лечения тиреотоксикоза методом радиойодтерапии выше 95%. Это очень хороший показатель.
Мы принимаем самое непосредственное участие в подготовке пациентов к данной процедуре. Через наш эндокринологический отдел успешно прошло несколько тысяч человек. И нам очень приятно получать отзывы о том, что жизнь наладилась, что наши пациентки смогли забеременеть, родить и не одного ребенка, состояния удушья в горле перестали беспокоить, наладился менструальный цикл, восстановился сон и трудоспособность. Кто-то вышел замуж, кто-то родил долгожданного ребенка, а кто-то получает уже второе (третье) высшее образование.
- при объеме щитовидной железы свыше 45 мл есть риск, что одного лечения будет недостаточно. Так и было – у молодого мужчины, общий объем щитовидной железы приближался к 100 мл и загрудинное расположение создавало технические трудности для операции. Было принято решение о радиойодтерапии, с интервалом в полгода. Теперь – объем не превышает 5 мл, пациент принимает заместительную терапию, жалоб у него нет.
- диффузный – токсический зоб с эндокринной офтальмопатией (общий объем железы изначально был около 60 мл). Сама пациентка отказывалась от хирургического лечения и мы оговаривали многоступенчатую терапию I131 также с интервалом в 6 месяцев, под прикрытием глюкокортикоидной терапии, в целях защиты глазных яблок от возможного усиления симптомов ЭОП. Нам удалось со 2 раза добиться устойчивого гипотиреоза, симптомы ЭОП были смягчены. И тем не менее, в случае, когда у пациента выявлено данное осложнение со стороны глаз –мы рекомендуем хирургический метод лечения.
- индивидуальная особенность пациента, когда уровень аутоиммунного процесса сильно выражен (часто мы говорим про такую железу «маленькая, но злючая»)
Следует отметить, что наши пациенты после радиойодтерапии и пройденного этапа реабилитации ведут активный образ жизни: занимаются спортом, фитнессом, активно путешествуют, работают, воспитывают детей. Можно проводить время на свежем воздухе, на южных курортах, купаться в море и не испытывать никаких ограничений.
Необоснованные страхи набора лишнего веса НЕ страшны человеку, ведущему активный образ жизни и регулярно принимающему именно нужную ему дозировку Л-тироксина.
Беременность мы рекомендуем рассматривать через 1 год после прохождения РЙТ. И в нашей практике много примеров и историй успешных беременностей с рождением здоровых детей.
Страхи в отношении облучения при РЙТ также сильно преувеличены. Зная физические параметры I131 - период полураспада радиойода (8 суток), низкодозную нагрузку на окружающие органы, не поглощающие радиойод (в силу отсутствия соответствующих рецепторов), точечное лечение – позволяет отнести метод радиойодтерапии к наиболее перспективным в лечении диффузного-токсического зоба (тиреотоксикоза). Неспроста в странах Европы и США уже расширяют показания и снижают возрастную границу, при которой рассматривается РЙТ в качестве лечения первого выбора.
Что необходимо для успешной радиойодтерапии?
Безусловно, для того, чтобы лечение прошло максимально эффективно – необходимо выявить те факторы, которые могут помешать лечению:
- Необходимо грамотно интерпретировать данные УЗИщитовидной железы (зачастую при длительном тиреотоксикозе имеется тенденция к формированию «псевдоузлов», которые легко можно спутать с узлами;
- Необходимо уметь оценивать глазные симптомы, имеющиеся при эндокринной офтальмопатии (зачастую, можно ошибочно поставить диагноз ЭОП в то время, как у пациента имеется только отек век и легкое слезотечение);
- Необходимо понимать в какие сроки следует отменить тиреостатическую терапию перед проведением радиойодтерапии (так как, несвоевременная отмена может, с одной стороны, усилить симптомы и вызвать яркий гиперметаболизм – лечение будет менее эффективным). Или, если поздно отменить тиреостатики – железа будет долго заблокированной и это может привести к ошибочному расчету необходимой дозировки I131.
- В некоторых случаях требуется удлинение интервала соблюдения низкойодистой диеты, в том числе и после проведенного РЙТ;
- Зачастую врачи пропускают симптомы надпочечниковой недостаточности, которые могут сопровождать сильно выраженный тиреотоксикоз (если не обращать на данное состояние должного внимания и не лечить параллельно – можно ожидать неудовлетворительного эффекта от лечения).
- как избежать осложнений;
- как правильно подготовиться к беременности (если есть такой запрос);
- какая схема гормональной терапии будет наиболее приемлемой.
Кроме того, тех, кто решил сразу после радиойодтерапии провести реабилитационные мероприятия под непосредственным контролем врача вне дома, мы приглашаем в наш Реабилитационный центр "Раменское".
В новых, уютных корпусах пансионата, расположенного в тихом лесном массиве Раменского района Подмосковья, созданы все необходимые условия для проведения программ реабилитации после радиойодтерапии.
Нам очень приятно, что за более чем 15 лет работы мы смогли помочь нескольким тысячам пациентов, которые обрели красивую внешность здорового человека, создали /сохранили семью, родили здорового ребенка и продолжают делиться с нами своими успехами в жизни.
Читайте также:
