Лучевые признаки дефекта радиального луча у плода
Добавил пользователь Валентин П. Обновлено: 20.01.2026
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
филиал ГБУЗ ГКБ №24 Департамента здравоохранения Москвы «Перинатальный центр», Москва, Россия
Кафедра акушерства и гинекологии лечебного факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Влияние ионизирующего излучения на плод
Цель исследования — провести систематический анализ данных, имеющихся в современной литературе, относительно рисков развития патологии плода в результате воздействия ионизирующего излучения в ходе диагностических или лечебных процедур. Материал и методы. В обзор включены данные статей по выбранной теме, опубликованные в Pubmed за последние 10 лет. Результаты. Внутриутробная радиочувствительность зависит от гестационного возраста, максимальна она в период органогенеза. Анализ данных показал, что при использовании ионизирующего излучения, доза которого не превышает 100 мГр, риск негативного влияния на плод минимален. Заключение. При беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Воздействие ионизирующего излучения сопровождается увеличением риска спонтанных абортов, развития микроцефалии, задержки умственного развития и, возможно, развития онкологических заболеваний в течение жизни [1]. В связи с этим абсолютно логичным кажется, что согласно Федеральному закону «О радиационной безопасности населения» № 3-ФЗ от 09.01.96: «На период беременности и грудного вскармливания ребенка женщины должны переводиться на работу, не связанную с источниками ионизирующего излучения».
До момента нидации влияние радиации, как и других факторов, происходит по принципу «все или ничего», т. е. эмбрион или погибает, или формируется нормально. Существуют убедительные доказательства увеличения риска гибели эмбриона в предымплантационный период под действием облучения, причем при дозах менее 100 мГр частота летальных эффектов ионизирующего излучения очень мала.
Результаты многих исследований свидетельствуют о том, что внутриутробная радиочувствительность зависит от гестационного возраста с максимальной чувствительностью в период органогенеза. На основе данных, полученных на лабораторных животных, сделан вывод о наличии пороговой дозы облучения для индукции мальформаций, равной 100 мГр. Чаще всего аномалии связаны с центральной нервной системой. Суммарный риск нарушений развития плода и возникновения онкологических заболеваний в детском и юношеском возрасте при экспозиции радиации в дозе 0,1 Гр составляет приблизительно 3% (что сопоставимо с популяционными значениями). Поэтому воздействие радиации в дозе менее 0,1 Гр не может быть показанием к прерыванию беременности [2].
При анализе данных по исследованию выживших после атомных бомбардировок в отношении формирования тяжелой умственной отсталости у детей, подвергшихся внутриутробному облучению в наиболее чувствительный период внутриутробного развития (10—17 нед беременности), было показано, что порог дозы для развития такого повреждения находится на уровне как минимум 300 мГр. Облучение в дозе менее 100 мГр на уровень IQ и частоту мальформаций у ребенка однозначно не влияет [3].
Лучевая диагностика
Существовало мнение, что ионизирующее излучение уже при дозах 10 мГр может вызывать нарушение органогенеза у плода, а также увеличивать риск развития онкологических заболеваний у ребенка после рождения вплоть до подросткового возраста. Однако по результатам систематического обзора, проведенного в 2008 г., не было выявлено статистически значимой связи между пренатальным воздействием рентгеновских лучей и развитием онкологических заболеваний у ребенка (отношение рисков 0,99; 95% доверительный интервал 0,78—1,13) [4]. В Швеции в 2007 г. было проведено крупное исследование, в ходе которого были обследованы 652 ребенка, рожденных у матерей, подвергавшихся во время беременности диагностической рентгенографии. Частота лейкозов у этих детей не отличалась от таковой в контрольной группе [5].
В ходе крупного долгосрочного исследования J. Ray и соавт. [6] оценивали риск развития онкологических заболеваний у детей, подвергшихся внутриутробному воздействию ионизирующего излучения при проведении матери компьютерной томографии или радионуклидной диагностики. Статистически значимой связи между лучевой экспозицией и риском онкологических заболеваний у детей (ОШ (отношение рисков) 0,69; 95% ДИ (доверительный интервал) — 0,26—1,82) выявлено не было.
По данным Международной комиссии по радиологической защите, риск развития злокачественных новообразований равняется приблизительно одному случаю на 500 плодов, подвергшихся излучению в дозе 30 мГр. При этом пожизненный риск развития рака после внутриутробного облучения будет таким же, как и после облучения в раннем детском возрасте, т. е., по крайней мере, в 3 раза выше, чем у населения в целом [7].
Таким образом, в зависимости от возможного воздействия на плод, дозы ионизирующего излучения можно разделить следующим образом:
— до 100 мГр — безопасная для плода;
— 100—300 мГр — возможно повреждающее действие на плод;
— более 300 мГр — высока вероятность пороков развития, задержки роста и гибели плода, поэтому после воздействия такой дозы радиации в I триместре беременности следует поставить вопрос об искусственном прерывании беременности.
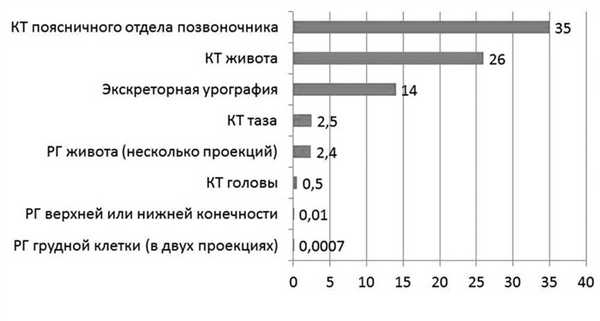
Большинство диагностических процедур, основанных на воздействии ионизирующего излучения (рентгенологическое обследование, флюорография), характеризуются дозировкой излучения менее 50 мГр (см. рисунок) Поглощаемая плодом доза ионизирующего излучения при проведении рентгенологических исследований (мГр) [8]. (например, доза для плода при рентгенографии грудной клетки составляет менее 1 мкГр, при флюорографии — 1,5 мкГр), поэтому даже при проведении нескольких рентгенологических исследований подряд вероятность неблагоприятного воздействия на плод крайне низка. Так, компьютерная томография (КТ) характеризуется довольно высокой дозой излучения (поскольку проводится серия рентгеновских снимков, излучение, сопровождающее каждый из них, суммируется). Поэтому К.Т. во время беременности должно выполняться по строгим показаниям, хотя риск для плода также невысок. Согласно современным рекомендациям, этот метод исследования имеет свою нишу при беременности. КТ рекомендуют проводить при сомнении в диагнозе острый аппендицит, подозрении на тромбоэмболию легочной артерии, при серьезных травмах, а в некоторых случаях и при необходимости уточнения строения и формы таза. При этом во всех случаях перед проведением этой процедуры с пациенткой необходимо провести беседу и информировать ее о потенциальных рисках для плода, получив с нее информированное согласие на манипуляцию [8].
Американская коллегия радиологов даже опубликовала меморандум о том, что ни одна диагностическая процедура, основанная на рентгеновском облучении, не угрожает здоровью и развитию эмбриона и плода. Несмотря на это, флюорография и рентгеновское исследование во время беременности должны проводиться только при наличии строгих показаний.
Лучевая терапия
Лучевую терапию, учитывая риск формирования пороков развития у плода, во время беременности используют редко. Дозы облучения, применяемые при лучевой терапии, составляет 30—70 Гр, что в 100—1000 раз выше, чем при диагностических процедурах. Соответственно, при невозможности отложить лучевую терапию нужно использовать методы экранирования плода. Кроме того, роль играет расстояние между зоной облучения и дном матки. Если это расстояние превышает 30 см, периферическая доза облучения для плода составит 0,04—0,2 Гр. При высоком стоянии дна матки (III триместр беременности, многоплодная беременность и т. д.) периферическая доза облучения для плода может превысить 2 Гр [11, 12].
В связи с этим риск для плода минимален при облучении опухолей, локализующихся выше диафрагмы (опухоли головы и шеи, рак молочной железы), а при раке шейки матки лучевая терапия несовместима с жизнеспособностью плода [2, 12].
В 2009 г. S. Luis и соавт. [13] провели анализ 109 случаев лучевой терапии при беременности. Средний период наблюдения за детьми составил 37 мес. Было зафиксировано 13 наблюдений неблагоприятного завершения беременности (2 самопроизвольных аборта, 6 наблюдений перинатальной гибели, 1 случай нейросенсорной тугоухости, случай затруднения в обучении и сколиоза, 1 наблюдение сочетания крипторхизма и дефекта межжелудочковой перегородки, 1 наблюдение гипоспадии, а также случай нарушения психомоторного развития).
Радиоизотопная терапия
Радиоактивные вещества даже при их однократном поступлении в организм беременной могут надолго задерживаться в нем, переходить через плацентарный барьер и быть источником облучения плода. Особенно значимо поражаются у беременной гормональная, иммунная и репродуктивная системы. Влияние на эти системы обусловлено тем, что в период гестации в организме беременной происходят значительные изменения в эндокринной системе, за счет угнетения адаптивного иммунитета смещается иммунное равновесие, а в репродуктивной системе (в матке) развивается плодное яйцо, элементы которого с различной интенсивностью и специфичностью накапливают отдельные радионуклиды.
Такие радиоактивные элементы, как 131 I, 32 P, 134 Cs излучают α-, β-, γ-лучи, обладающие различной проникающей способностью. Существуют следующие пути передачи радионуклидов: 1) гематогенный ( 131 I, 32 P, 134 Cs); 2) накопление радионуклидов в тканях плаценты с последующим воздействием на плод (трансурановые элементы); 3) параплацентарный переход через плодные оболочки и околоплодные воды (радиоактивный плутоний).
Беременность является противопоказанием к терапии радиоизотопами, за исключением случаев, когда без проведения терапии существует риск для жизни пациентки.
Некоторые радиоизотопы, включая 131 I в виде иодида и 32 Р в виде фосфата, быстро проходят через плаценту, поэтому перед проведением терапии радиоактивными препаратами следует исключить беременность. На практике, так как рак щитовидной железы обладает относительно низкой агрессивностью течения, и хирургическое, и радиоизотопное лечение можно отсрочить до родов.
На ранних сроках беременности наиболее опасным для плода является γ-излучение радиоактивного йода, скапливающегося в мочевом пузыре. Доза, которая действует на плод при радиоизотопной терапии при беременности, составляет приблизительно 50—100 мкГр на 1 МБк от введенного препарата. Дозу можно снизить, рекомендовав пациентке обильное питье и частое мочеиспускание.
В сроке более 10 нед щитовидная железа может накапливать йод, что может приводить как к аблации щитовидной железы плода, так и к индукции в дальнейшем у него рака щитовидной железы [14].
Таким образом, при беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Врожденная косорукость
Врожденная косорукость – это устойчивая деформация, в результате которой кисть отклоняется в локтевую либо лучевую сторону от продольной оси предплечья. Возникает во внутриутробном периоде. Является следствием недоразвития одной из костей предплечья либо ассоциированных с этими костями сухожилий. Проявляется искривлением верхней конечности – кисть расположена под углом к предплечью. Может сочетаться с другими врожденными пороками конечности. Диагноз выставляется на основании рентгенологической картины и данных осмотра. Лечение хирургическое, проводится в раннем возрасте (обычно до 1 года). После операции назначается ЛФК, массаж и физиотерапия.
МКБ-10
Общие сведения
Врожденная косорукость – аномалия, при которой кисть располагается под углом к предплечью. Данный вид деформации конечностей возникает вследствие недоразвития костей и/или сухожилий предплечья во внутриутробном периоде. Является редкой патологией, по литературным данным лучевая косорукость выявляется у одного из 55 тыс. новорожденных, локтевая косорукость – у одного из 220-550 тыс. новорожденных. Может быть односторонней или двухсторонней. Нередко сочетается с другими врожденными пороками развития. Лечение осуществляют детские ортопеды. Рекомендуется оперативное вмешательство в раннем возрасте.
Причины
Врожденная косорукость формируется в результате воздействия ряда внешних и внутренних факторов. К числу внешних (экзогенных) факторов, которые могут вызвать развитие данной патологии, относится недостаточное питание матери, инфекционные заболевания, прием некоторых лекарственных препаратов, а также ионизирующее облучение. В числе внутренних (эндогенных) причин – поздняя беременность, гормональные нарушения, тяжелые соматические заболевания матери, функциональные расстройства и патологические изменения матки. Большое значение имеет время воздействия – критическим периодом считаются первые 5 недель беременности. Генетическая предрасположенность не выявлена.
Классификация
Выделяют два типа врожденной косорукости: лучевую и локтевую. Лучевая косорукость формируется при недоразвитии либо отсутствии лучевой кости и ассоциированных с ней сухожилий, локтевая – при недоразвитии либо отсутствии локтевой кости и соответствующих сухожилий. Каждый тип врожденной косорукости подразделяется на несколько подтипов с учетом степени недоразвития кости.
Локтевая косорукость:
- Умеренная гипоплазия. Локтевая кость укорочена на 10-29% в сравнении с лучевой.
- Выраженная гипоплазия – локтевая кость укорочена на 30-69% в сравнении с лучевой.
- Рудимент локтевой кости – локтевая кость укорочена на 70-99% в сравнении с лучевой.
- Аплазия локтевой кости – локтевая кость полностью отсутствует.
Лучевая косорукость:
- 1 степень – лучевая кость укорочена не более, чем на 50% от нормы.
- 2 степень – лучевая кость укорочена более, чем на 50% от нормы.
- 3 степень – лучевая кость полностью отсутствует.
Кроме того, при лучевой косорукости специалисты в области ортопедии и травматологии выделяют 4 типа кисти:
- 1 тип – гипоплазия первой пястной кости и мышц тенара (возвышения, расположенного между I пальцем и лучезапястным суставом).
- 2 тип – I пястная кость отсутствует, выявляется недоразвитие фаланг 1 пальца.
- 3 тип – I пястная кость и I палец отсутствуют, может также наблюдаться отсутствие II и III пальцев.
- 4 тип – кости кисти развиты нормально.
Симптомы врожденной косорукости
При лучевой косорукости кисть находится в положении пронации, между кистью и предплечьем образуется угол, открытый в сторону лучевой поверхности (сторону большого пальца). По тыльной поверхности выявляется проксимальное смещение кисти по отношению к головке локтевой кости. Кисть вращается вокруг головки, как флажок флюгера.
У большинства пациентов с врожденной косорукостью наблюдаются различные дефекты кисти: отсутствие I пальца, отсутствие I пястной кости, отсутствие I, II и III пальцев. I палец может быть укороченным, состоять из одной фаланги или из-за отсутствия I пястной кости висеть на кожной ножке. V и IV пальцы при этом развиты нормально. Из-за недоразвития и контрактур пальцев функциональные возможности кисти резко ограничены, захват предметов часто невозможен.
Предплечье обычно укорочено, головка локтевой кости выступает. Из-за деформации локтевой кости возникает дугообразное искривление предплечья с выпуклостью, обращенной в локтевую сторону (сторону V пальца). Мышцы предплечья недоразвиты. Пронаторы и супинаторы предплечья, длинные мышцы I пальца и плечелучевая мышца нередко отсутствуют. Возможно также отсутствие длинной головки бицепса плеча. При аплазии лучевой кости также наблюдается отсутствие лучевой артерии.
При локтевой косорукости кисть находится в положении супинации, между кистью и предплечьем образуется угол, открытый в локтевую сторону (сторону V пальца). V и IV пальцы часто отсутствуют или недоразвиты. Предплечье укорочено. Из-за деформации лучевой кости образуется дугообразное искривление, обращенное выпуклостью в лучевую сторону (сторону I пальца). Движения в локтевом суставе ограничены из-за вывиха головки лучевой кости. Мышцы предплечья с локтевой стороны недоразвиты или отсутствуют. Функция кисти нарушена меньше, чем при лучевой косорукости.
Диагностика
Постановка диагноза врожденная косорукость не представляет затруднений из-за визуально видимых деформаций и явных нарушений функции конечности. Для точной оценки степени недоразвития костных структур и уточнения дальнейшего плана лечения выполняют рентгенографию костей предплечья и рентгенографию костей кисти. Для оценки состояния мягких тканей назначают МРТ предплечья и электромиографию.
Лечение врожденной косорукости
Лечение начинается с первых дней жизни. Младенцам, не достигшим 6-месячного возраста, назначается консервативная терапия, направленная на «растягивание» мягких тканей, уменьшение и предотвращение развития контрактур. Пациенты направляются на ЛФК, массаж и ношение ортезов. Операции рекомендуется проводить в возрасте до 1 года, оптимальный период – 6-9 месяцев.
Показанием к хирургическому вмешательству являются неустраняемые контрактуры в лучезапястном и локтевом суставах, некорригируемое отклонение кисти по отношению к предплечью и ограничения функции кисти. В зависимости от степени и вида деформации вмешательство может быть как одномоментным, так и многоэтапным. На первом этапе ликвидируют самую функционально значимую деформацию, на последующих этапах проводят коррекцию мелких деформаций и, при возможности – косметических дефектов.
При лучевой косорукости проводятся хирургические вмешательства, направленные на восстановление «вилки» в области лучезапястного сустава. При выраженных контрактурах вмешательство на костях выполняется в сочетании с удлинением сгибателей кисти и кожной пластикой. При аплазии лучевой кости осуществляется радиализация или централизация кисти. В течение 1-2 мес. кисть выводят в правильное положение, используя дистракционное устройство (аппарат Илизарова), а затем стабилизируют ее на локтевой кости. Выраженное дугообразное искривление предплечья является показанием для проведения корригирующей остеотомии.
При локтевой косорукости выполняется иссечение фиброзного тяжа, соединяющего недоразвитую локтевую кость с лучезапястным суставом, в сочетании с корригирующей остеотомией лучевой кости. Если длина локтевой кости составляет более 50% от нормы, кость удлиняют, используя аппарат Илизарова. Иногда вмешательство приходится проводить в два этапа: на первом этапе кость выводят в правильное положение и устраняют вывих головки луча, на втором формируют однокостное предплечье.
Синдактилии (сращения пальцев) при локтевой и лучевой косорукости обычно устраняют на заключительном этапе, после коррекции более значимых деформаций. На место отсутствующих пальцев пересаживают пальцы со стопы. В послеоперационном периоде обязательно назначают физиотерапию, массаж и ЛФК для профилактики контрактур и вторичных деформаций.
Лучевые признаки дефекта радиального луча у плода
УЗИ при синдроме Холт-Орама у плода
а) Определения:
• Синдром Холт-Орама, также известный как «синдром рука-сердце», характеризуется аномалиями развития верхней конечности и сердца
б) Лучевая диагностика:
1. Общие сведения:
• Критерии диагностики:
о Дефект радиального луча у плода с положительным семейным анамнезом в отношении синдрома Холт-Орама
(Слева) УЗИ плода в 19 нед. Синдром Холт-Орама. На кисти определяются 4 пальца, I палец отсутствует. Отмечается клинодактилия V пальца.
(Справа) Тот же случай. Клиническая фотография кисти новорожденного. Медиальная девиация кисти обусловлена отсутствием лучевой кости Кроме того, плечевая и локтевая кости гипоплазированы. I палец отсутствует, присутствуют только 4 пальца. Клинодактилия V пальца совпадает с более ранней находкой по УЗИ. (Слева) УЗИ плода во II триместре. Синдром Холт-Орама. Определяется дефект радиального луча: лучевая кость гипоплазирована, кисть медиально отклонена. Изначально по результатам пренатальной лучевой диагностики предполагалось отсутствие I пальца кисти, однако после рождения ребенка установлена гипоплазия пальца.
(Справа) Четырехкамерный срез сердца плода в III триместре. Визуализируется небольшой ДМЖП. Самым частым пороком сердца, встречающимся при синдроме Холт-Орама, является ДМПП, обнаружить который до родов особенно сложно. (Слева) УЗИ верхней конечности плода в 26 нед. Синдром Холт-Орама. Отмечаются выраженная гипоплазия лучевой кости медиальная девиация кисти и олигодактилия. I палец отсутствует.
(Справа) Клиническая фотография. Рука женщины с тяжелой формой синдрома Холт-Орама. Присутствуют только 4 пальца, определяются камптодактилия, а также выраженное укорочение руки вследствие аплазии лучевой и гипоплазии плечевой кости.
2. УЗИ при синдроме Холт-Орама у плода:
• Дефекты радиального луча, определяемые с I триместра:
о Первая и наиболее явная патологическая находка у плода с положительным семейным анамнезом
• Выраженность дефицита радиального луча варьирует, обычно присутствует асимметрия
• Пороки развития нижних конечностей (реже)
• Пороки сердца:
о Самый частый порок сердца - ДМПП; во внутриутробном периоде диагностируется редко
о ДМЖП встречается реже
3. Рекомендации по лучевой диагностике:
• Советы по проведению исследования:
о 3D/4D УЗИ позволяет более детально исследовать дефекты конечностей
о ЭхоКГ показана всем плодам из группы высокого риска, в том числе при отсутствии явных дефектов конечностей
4. Рентгенография при синдроме Холт-Орама у плода:
• Поражение верхних конечностей включает различную степень гипоплазии или аплазию лучевой кости, костей запястья и I пальца
в) Дифференциальная диагностика синдрома Холт-Орама у плода:
1. Дефекты радиального луча, изолированные или в составе синдромов:
• Анемия Фанкони:
о Аплазия лучевой кости о Различные варианты поражения I пальца
• Тромбоцитопения с отсутствием лучевой кости (TAR-синдром):
о I палец присутствует всегда о Аплазия лучевой кости
• Ассоциация VACTERL:
о Аномалии развития позвонков, атрезия ануса, пороки сердца, трахеопищеводный свищ, АП, агенезия почек, различные аномалии развития конечностей, в том числе дефекты радиального луча
• Изолированная гипоплазия или трехфалангизм I пальца кисти
2. Изолированный ДМПП:
• Диагностика во внутриутробном периоде затруднена
(Слева) УЗИ кисти плода в конце I триместра. Синдром Холт-Орама, дефект радиального луча верхней конечности. Определяются только 4 пальца, I палец отсутствует.
(Справа) УЗИ плода во II триместре. Синдром Холт-Орама. Отмечаются умеренная гипоплазия лучевой кости, медиальная девиация, а также выраженная гипоплазия кисти. Локтевая кость умеренно искривлена. (Слева) УЗИ плода в 12 нед. Беременная страдает синдромом Холт-Орама. Визуализируются признаки дефекта радиального луча, а также косорукость. Указанные патологические находки, а также отягощенный анамнез матери позволяют заподозрить у плода синдром Холт-Орама.
(Справа) Тот же случай. Клиническая фотография. Диагноз синдрома Холт-Орама подтверждается при осмотре новорожденного. Определяются двусторонние дефекты радиальных лучей (поражение слева более тяжелое, чем справа). Большие пальцы отсутствуют на обеих кистях. По результатам ЭхоКГ плода и новорожденного нарушения не обнаружены. (Слева) Тот же случай. Клиническая фотография кисти, принадлежащей матери новорожденного. Отмечаются проксимально расположенный гипоплазированный I палец и шрам от хирургической операции на сухожилиях
(Справа) Клиническая фотография обеих кистей женщины. Определяется трехфалангизм I пальца правой кисти. Пациентка считает эту руку здоровой. Левая рука сравнительно меньших размеров супинация кисти ограничена. Также в детстве у женщины был диагностирован ДМЖП, впоследствии устраненный с помощью хирургического лечения.
г) Патологоанатомические особенности. Общие сведения:
• Этиология:
о Мутации гена, кодирующего транскрипционный фактор ТВХ5 (12q24.21):
- Мутации приводят к функциональной гаплонедостаточ-ности с ослаблением активации транскрипции генов-мишеней
- ТВХ5 играет ключевую роль в инициации роста верхних конечностей
- Генетические факторы
о Аутосомно-доминантный тип наследования:
- Риск появления заболевания у потомства носителей составляет 50%
о Практически полная пенетрантность
о Вариабельная экспрессивность
о Генотипирование ТВХ5 обладает высокими показателями чувствительности и специфичности в отношении синдрома Холт-Орама только при строгом соблюдении диагностических критериев:
- Мутации гена ТВХ5 обнаруживаются по меньшей мере у 70% пациентов с синдромом Холт-Орама и преаксиальными дефектами радиального луча
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Дефекты радиального луча различной степени тяжести
о Порок сердца
• Другие субъективные и объективные симптомы в постнатальном периоде:
о ДМПП, дефект вторичной перегородки (ostium secundum)
о Нарушения ритма и проводимости сердца
2. Демографические особенности:
• 1:100 000 детей, рожденных живыми
• 85% случаев - мутации de novo
3. Естественное течение и прогноз:
• Общий прогноз зависит от тяжести порока сердца и степени поражения верхних конечностей
• Возможна нормальная продолжительность жизни
• Отставание в умственном развитии наблюдают не чаще, чем в среднем в популяции
4. Лечение синдрома Холт-Орама:
• В пренатальном периоде:
о Генетическое консультирование
о При наличии у родителей установленной мутации ТВХ5 возможна пренатальная диагностика с помощью амниоцентеза или биопсии ворсин хориона
о Преимплантационная генетическая диагностика возможна только при наличии установленной мутации
• В постнатальном периоде:
о Междисциплинарный подход к ведению заболевания
о Хирургическое лечение пороков сердца
о Ортопедическое лечение поражений кисти, направленное на улучшение ее функции:
- Поллицизация II пальца кисти или стопы для воссоздания утраченного пальца кисти
о Наблюдение:
- Электрокардиография (1 раз в год)
- При наличии нарушений проводимости сердца - холте-ровское мониторирование (1 раз в год)
- ЭхоКГ (1 раз в 1-5 лет)
е) Список использованной литературы:
1. Al-Qattan ММ et al: Molecular basis of the clinical features of Holt-Oram syndrome resulting from missense and extended protein mutations of the TBX5 gene as well as TBX5 intragenic duplications. Gene. 560(2): 129-36, 2015
2. Wall LB et al: Defining features of the upper extremity in Holt-Oram syndrome. J Hand Surg Am. 40(9):1764-8, 2015
3. Barisic I et al: Holt Oram syndrome: a registry-based study in Europe. Orphanet J Rare Dis. 9:156, 2014
Редактор: Искандер Милевски. Дата обновления публикации: 18.11.2021
Врождённая лучевая косорукость — консервативное и хирургическое лечение
Клиника хирургии кисти и реконструктивной микрохирургии ФГБУ «НМИЦ детской травматологии и ортопедии имени Г. И. Турнера» Минздрава России располагает опытом лечения и отслеживания результатов данной проблемы более 40 лет, что позволило определить наиболее рациональные алгоритмы комплексного лечения с достижением достойных результатов как по мнению специалистов, так и по мнению наших пациентов.
Врождённая лучевая косорукость (ВЛК) — это порок развития верхней конечности, при котором нарушено развитие лучевой кости. Симптомы заболевания очевидны не только сразу после рождения ребенка, но, на сегодняшний день, возможно диагностировать этот порок ультразвуковым методом при проведении исследования во время беременности после 15 недели.
Основными признаками являются укорочение и деформация предплечья, часто сочетающаяся с недоразвитием первого пальца кисти. Врожденная лучевая косорукость может быть как односторонней, так и двусторонней, как отдельным пороком, так и входить в структуру других пороков, синдромальных заболеваний. Наиболее часто этот порок развития сочетается с аномалиями других внутренних органов или отделов опорно-двигательного аппарата: синдромом Holt-Oram, синдромом VATER, TAR- синдромом.

Причины возникновения лучевой косорукости
Однозначная причина формирования патологии не выявлена. Считается, что она возникает на фоне воздействия на плод различных патологических факторов, особенно в первые месяцы беременности.
Лечение ВЛК в России – эффективные методики в ФГБУ «НМИЦ детской травматологии и ортопедии имени Г. И. Турнера» Минздрава России
Лечение этого порока начинается с первых дней жизни – консервативное лечение. Комплекс консервативных мероприятий, который включает в себя массаж, лечебную физкультуру, проводится ежедневно 5-6 раз в сутки. Это необходимо для того, чтобы кисть не отклонялась в сторону укороченной лучевой кости, а свободно выводилась в среднее положение. Затем, в возрасте 1,5-3 месяцев, необходимо начинать изготовление ортезов (гипсовых или из термопластических материалов), меняя их по мере роста и развития ребенка. Эти лечебные мероприятия должны проводиться вплоть до хирургического лечения. Проведение раннего консервативного лечения снижает риск развития возможных осложнений, может уменьшить количество операций, а также сокращает сроки нахождения пациента в стационаре. Хирургическое лечение деформаций предплечья рекомендовано начинать в возрасте 10 месяцев и старше. Объем и сложность оперативного вмешательства зависит от тяжести и выраженности лучевой косорукости. Зачастую это не одна операция, а их комплекс, проводящийся на этапах развития и роста ребенка. Целью оперативного лечения является восстановление конечности для наиболее выгодного повседневного пользования и приобретения необходимых навыков для социальной адаптации и даже для выбора профессии.
а) Терминология:
1. Синонимы:
• Гипоплазия/аплазия радиальных лучей
2. Определения:
• Группа пороков развития, включающая гипо- или аплазию любого из перечисленных сегментов:
о Лучевая кость
о Кости запястья со стороны лучевой кости
о I палец кисти
1. Общие сведения:
• Критерии диагностики:
о Единственная кость предплечья
о Лучевая девиация кисти
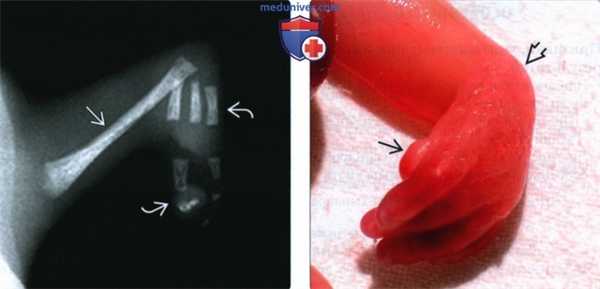
(Слева) Рентгенограмма мертворожденного с диабетической эмбриопатией и аплазией обеих костей предплечья. Плечевая кость - единственная трубчатая кость верхней конечности. Также определяется олигодактилия. Представлена крайняя форма аномалии радиального луча.
(Справа) Другой случай. Клиническая фотография мертворожденного от матери с неудовлетворительным контролем СД. Более типичный вид дефекта радиального луча. Девиация кисти и гипоплазия I пальца кисти.
2. УЗИ при дефекте радиального луча у плода:
• УЗИ в режиме серой шкалы:
о Гипо- или аплазия лучевой кости
о Аномальное положение кисти:
- Лучевая девиация («лучевая косорукость»)
- Положение фиксировано
- Определяется с I триместра
о Строение I пальца вариабельно:
- Гипо- или аплазия
- Проксимальное прикрепление
- Трехфалангизм («дигитализация»)
- В случае аддукции может с трудом визуализироваться при УЗИ
о Нередко сочетается с другими аномалиями и синдромами
о Множественные аномалии повышают вероятность анеуплоидии или ассоциации VACTERL
• 3D УЗИ:
о Позволяет определить положение кисти и сосчитать пальцы
о Оценивают I палец кисти
о Позволяет обнаружить черты лица, характерные для того или иного синдрома
о Наглядность метода используется при консультировании родителей
3. Рекомендации по лучевой диагностике:
• Предпочтительный метод исследования:
о В случае отягощенного семейного анамнеза - прицельное ТВУЗИ в I триместре
• Измеряют все трубчатые кости:
о Соотносят с нормативными данными
о Дефекты радиальных лучей могут сочетаться с аномалиями других костей
• Во всех случаях рекомендована ЭхоКГ плода
• Тщательный поиск сопутствующих аномалий:
о У 86% пациентов с гипоплазией I пальца кисти обнаруживают другие аномалии:
- У 44% — синдром Холта-Орама или ассоциацию VACTERL
• Дифференциальная диагностика с артрогрипозом (положение кисти также нарушено):
о Отсутствие активных движений плода приводит к развитию контрактур
о Лучевая или локтевая девиация кисти:
- Присутствуют все кости предплечья и пальцы кисти
• Наблюдение за динамикой роста плода:
о ЗРП:
- Хромосомные аномалии, в частности Т18
- Синдром Корнелии де Ланге
- Анемия Фанкони
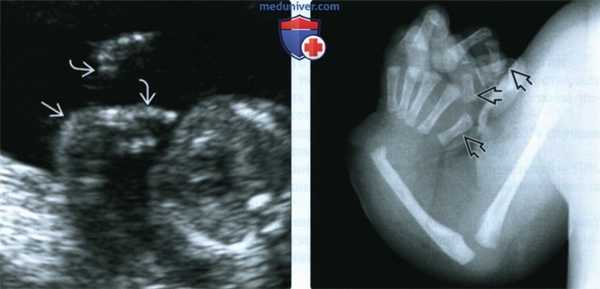
(Слева) УЗИ плода во II триместре. Тромбоцитопения с отсутствием лучевой кости (TAR-синдром). Определяется лучевая девиация кисти вследствие гипоплазии лучевой кости, I пальцы сформированы Последнее - важная находка для диагностики TAR-синдрома.
(Справа) Рентгенография руки новорожденного с TAR-синдромом. Лучевая кость отсутствует, однако кости I пальца сформированы. Наличие I пальца -отличительная черта данного заболевания.
в) Дифференциальная диагностика дефекта радиального луча у плода:
1. Изолированная:
• Одно- или двусторонняя локализация, различные дефекты 1 пальца
2. Ассоциация VACTERL/VATER:
• Характерные пороки развития: позвоночника, аноректальные, трахеопищеводный свищ ± АП, пороки развития почек, сердца и конечностей(радиальных лучей)
3. Хромосомные аномалии:
• Т18:
о Как правило, множественные аномалии
о Выраженная ЗРП
о Дефекты радиальных лучей обычно двусторонние и асимметричные
• Делеция 13q:
о Гипоплазия I пальцев кистей, синдактилия, аномалии цнс
4. Синдром Холта-Орама:
• ВПС:
о ДМПП - 34%, ДМЖП - 23%
• Пороки верхних конечностей (обычно тяжелые и асимметричные), радиальных лучей, фокомелия
5. Диабетическая эмбриопатия:
• Чаще встречается у беременных с неконтролируемым СД
• Пороки развития конечностей различной степени тяжести - гипоплазия бедренной кости и радиальных лучей, преаксиальная полидактилия
• Множественные аномалии, в том числе дефекты нервной трубки, сердца, головного мозга
6. Тромбоцитопения с отсутствием лучевой кости (TAR-синдром):
• Двустороннее отсутствие лучевой кости, I пальцы обеих кистей сформированы
• Возможно нарушение функций I пальцев
• Тромбоцитопения: врожденная или развивается в течение первых месяцев жизни
• Другие скелетные пороки: нижних конечностей, ребер, позвоночника
• Другие пороки развития: сердца, мочеполовой системы
• Связана с внутренней микроделецией 1q21.1
7. Анемия Фанкони:
• В 49% случаев обнаруживают дефекты радиальных лучей и I пальцев кисти (гипоплазия, аплазия, добавочные пальцы)
• ЗРП
• В 75% случаев обнаруживают другие пороки: мочеполовой системы, органа зрения, ЦНС, ЖКТ, сердца, гиперпигментацию кожи
• Медианный возраст появления гематологических симптомов: 7 лет (варьирует от 0 до 31 года)
• Повышенный риск малигнизации, в частности развития острого лейкоза
8. Тератогены:
• Фетальный вальпроатный синдром:
о В 45-65% случаев - пороки развития конечностей, в том числе радиальных лучей
о В 1-2% случаев - дефекты нервной трубки о ЗРП
о Задержка умственного развития
9. Другие синдромы с дефектами радиальных лучей:
• Акрофациальный дизостоз Нагера: микрогнатия, гипоплазия скуловой кости, пороки органа слуха, дефекты радиальных лучей
• Синдром Корнелии де Ланге: редукционные пороки развития конечностей, дизморфия лица, ЗРП, диафрагмальная грыжа; в 50-60% случаев связан с мутацией гена NIPBL
• Анемия Даймонда-Блекфена (синдром Аазе-Смита типа 2): гипоплазия лучевой кости, трехфалангизм I пальца, красноклеточная аплазия, другие врожденные аномалии и ЗРП
• Синдром радиальных лучей Дуэйна: аутосомно-доминантный тип наследования; пороки развития радиальных лучей, глазных яблок и (редко) почек; мутации гена SALL4

(Слева) УЗИ плода в 14 нед. Определяется единственная кость предплечья, а также изогнутая под острым углом и медиально отклоненная кисть с четырьмя пальцами I палец отсутствует. Дефект радиального луча можно заподозрить в I триместре, если определяются единственная кость предплечья и аномальное положение кисти.
(Справа) Фотография, полученная при аутопсии плода с Т18. Характерный вид дефекта радиального луча. Кисть в неестественном положении, I палец отсутствует. Также отмечается синдактилия II и III пальцев.
г) Патологоанатомические особеннотси. Общие сведения:
• Этиология:
о Эмбриология:
- Повреждение апикальной эктодермы почки конечности в 6-12 нед.
- В норме рука окончательно формируется к 14-й неделе
о СД у матери:
- Наибольшему риску подвержены беременные с неудовлетворительным контролем СД
о Тератогены:
- Считается, что вальпроевая кислота может стать причиной дефектов хондрогенеза
• Генетические факторы:
о Аутосомно-доминантный тип наследования:
- Синдром Холта-Орама: мутации ТВХ5
- Синдром Нагера: мутации гена SF3B4 в 1q21
о Аутосомно-рецессивный тип наследования:
- Мутации при панцитопении Фанкони и анемии Фанкони комплементарны
- TAR-синдром: микроделеция участка 1q21.1 длиной 200 кб (при синдроме делеции/дупликации 1q21.1 поражен другой участок)
о Анеуплоидия:
- Т18, Т13
- Диплоидная/триплоидная миксоплоидия
о Х-сцепленные рецессивные формы (редко)
1. Клиническая картина:
• Другие субъективные и объективные симптомы:
о ВПС
о Тромбоцитопения
о Демографические особенности
• Эпидемиология:
о 1:30 000-80 000 живых новорожденных:
- В 50% случаев двусторонняя, возможна асимметрия
о У плодов встречается чаще (трисомии, летальные синдромы); высока вероятность невынашивания:
- Врожденные дефекты конечностей (в том числе радиальных лучей) выявляют приблизительно в трети случаев самопроизвольных абортов во II-III триместре
2. Естественное течение и прогноз:
• Зависит от этиологии и сопутствующих аномалий:
о Тромбоцитопения с отсутствием лучевой кости (TAR-синдром):
- Риск кровотечения
- 40% погибают в младенчестве
о Анемия Фанкони:
- Прогрессирующая недостаточность костного мозга в детском возрасте, высокий риск малигнизации
о Т18: низкая продолжительность жизни
• Риск повторного возникновения зависит от этиологии:
о Вероятность повторного возникновения Т18 составляет около 1% для женщин в возрасте до 35 лет, затем неуклонно растет
о Аутосомно-рецессивный тип наследования: 25% случаев
о Аутосомно-доминантный тип наследования:
- При наличии заболевания у одного из родителей - 50%
- При мутации de novo риск повторного возникновения низкий:
Повышенный риск повторного возникновения может быть связан с гонадным мозаицизмом или недиагно-стированным заболеванием у одного из родителей
3. Лечение дефектов радиального луча:
• Генетическое консультирование
• Цитогенетический анализ, матричная сравнительная геномная гибридизация (aCGH):
о Анеуплоидия
о Анемия Фанкони: повышенная нестабильность хромосом в результате воздействия перекрестносшивающего агента (эпоксибутан, митомицин С)
о При TAR-синдроме - микроделеции
• Необходимо исключить СД у беременной
• Поиск неявных дефектов у родителей:
о Выраженность пороков развития конечностей значительно варьирует
• Если семейный анамнез отягощен по TAR, показан кордоцентез:
о Тромбоцитопения
о Выявление микроделеций
• Тщательное клиническое обследование новорожденного и членов семьи
• Реконструктивная хирургия в специализированных центрах:
о Гипоплазия I пальца кисти: поллицизация указательного пальца или пересадка I пальца стопы улучшает функцию кисти
е) Особенности диагностики. Признаки, учитываемые при интерпретации результатов:
• При аномалии радиальных лучей большое значение имеет идентификация синдрома:
о Прогноз и специфические осложнения у разных заболеваний отличаются
• Диагностика специфического синдрома возможна с учетом особенностей строения I пальца кисти
ж) Список использованной литературы:
1. Al-Qattan ММ: The ubiquitin/SUMO pathway and radial ray deficiency syndromes. Ann Plast Surg. 70(2):240-5, 2013
2. Bottillo I et al: Prenatal diagnosis and post-mortem examination in a fetus with thrombocytopenia-absent radius (TAR) syndrome due to compound heterozygosity for a 1 q21.1 microdeletion and a RBM8 A hypomorphic allele: a case report. BMC Res Notes. 6:376, 2013
3. Pakkasjarvi N et al: Characteristics and associated anomalies in radial ray deficiencies in Finland - a population-based study. Am J Med Genet A. 161A(2):261-7, 2013
4. Stoll C et al: Associated malformations among infants with radial ray deficiency. Genet Couns. 24(2):223-34, 2013
Редактор: Искандер Милевски. Дата обновления публикации: 4.11.2021
Читайте также:
- Проявления и признаки скарлатины. Терапия и профилактика скарлатины
- Нозогнозия - сознание болезни. Важность сознания заболевания
- Регидратация при гипертонической болезни. Объем инфузий при гипертонической болезни
- Поздние токсические реакции в трансфузиологии. Клиника поздних токсических реакций
- Миокардиопатические, органические шумы сердца. Функциональные шумы сердца
