Лучевые признаки гетеротаксического и кардиоспленического синдромов плода
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
На основания изучения данных литературы систематизированы имеющиеся сведения об аномалиях положения органов и сосудов грудной и брюшной полостей таких как частичное и полное обратное положение органов грудной и брюшной полостей, гетеротаксия с левым изомеризмом (каждая сторона тела правая) при асплении, или, наоборот, с правым изомеризмом (каждая сторона тела левая) при полисплении, аплазия нижней полой вены, синдром Картагенера. Уточнены возможные механизмы и частота встречаемости этих аномалий развития. Один из наследственых синдромов – синдром Картагенера или синдром неподвижных ресничек характеризуется зеркальным расположением органов, бесплодием и слабым обонянием. В статье приводятся данные литературы, посвященные исследованию причин происхождения этого синдрома. Данные об аномалиях положения органов грудной и брюшной полостей совмещены с материалами из архивов кафедры нормальной анатомии и кафедры лучевой диагностики факультета повышения квалификации и постдипломной профессиональной специализации Ростовского медицинского университета.
1. Ахмадшин А.Ю., Потапова Н.Е. Пренатальная ультразвуковая диагностика синдрома обратного рапсоложения органов // Пренат. Диагн. 2005. Т.4(4). С. 310-312.
2. Брагина Е.Е. Закономерности нарушения сперматогенеза человека при некоторых генетических и инфекционных заболеваниях Автореф. дис…д-ра биол. наук. М. 2001, 53с.
3. Вишневская Ю.Г., Телышева В.М. Пренатальная диагностика visceral situs // Пренат. Диагн. 2007.-Т.6(4).С.310-313.
4. Демидов В.Н., Машинец Н.В., Гус А.И., Подуровская Ю.Л., Буров А.А. // Редкий случай врожденной правосторонней диафрагмальной грыжи в сочетании с обратным расположением внутренних органов у плода // Пренат. Диагн. 2015. Т.14. №4. С.343-349.
5. Ежова В.В., Павленко Л.И., Воинцева А.А., Бакулина Е.Г. Пренатальная диагностика редких врожденных пороков и синдромов. LIII. Синдром Ивемарка // Пренат. Диагн. 2011. Т.10 (3). С.243-246.
6. Зиверт А.К. Случай врожденной бронхоэктазии у больного с обратным расположением внутренних органов. СПб: Русский врач, 1902, 1(38): 1361-1362.
9. Пьянков В.А. Случай ультразвуковой диагностики situs viscerus inversus totalis // Ультразвук. Диагн. 2000. №3. С.101-102.
10. Розинова Н.Н., Захаров П.П., Соколова Л.В. Синдром Картагенера: отдаленные наблюдения. Российский вестник перинатологии и педиатрии. 2008, Т. 53, № 4.-С 25-27.
11. Afzelius B.A. The immotile cilia syndrome: a microtubule-associated defect. CRC Critical Reviews in Biochemistry. 1985, 19(1): 63-78.
12. Ergun T., Lakadamyali H., Lakadamyali H., Eldem O. Adult Polysplenic Syndrome Accompanied by Aberrant Right Subclavian Artery and Hemangioma in a Cleft Spleen: A Case Report. Annals of Vascular Surgery. 2008, Vol. 22, 4.- P. 579-581.
13. Kartagener M., Mulli K. Familiares Vorkommen von brouchiktasien. Schweiz. Z. Tuberk. 1956. V. 13.- P. 221-225.
Введение. Инверсия - обратное положение органа относительно его собственной оси или срединной плоскости тела - результат раннего нарушения эмбрионального поворота. Некоторые из аномалий компенсированы и клинически бессимптомны. Другие являются причиной заболеваний и смерти [5].
Цель работы - уточнить возможные механизмы образования и частоту встречаемости врожденных аномалий положения органов и сосудов грудной и брюшной полостей, проиллюстрировать наблюдениями из архивов кафедры нормальной анатомии и кафедры лучевой диагностики факультета повышения квалификации и постдипломной профессиональной специализации РостГМУ.
В раннем эмбриональном периоде грудные и брюшные органы располагаются по средней линии. В норме ротация и рост происходит вправо, а при situs viscerus inversus – влево. Situs viscerus inversus обычно наблюдается у сросшихся близнецов (рис.1). Эта аномалия крайне редко встречается у остальных людей (1 на 8000-25000 новорожденных) [14].
Аномальное положение может касаться всех органов - situs viscerus inversus totalis, органов одной полости или даже отдельных органов - situs viscerus inversus partialis [4].
При situs viscerus inversus totalis отмечается полное обратное положение органов. Состояние здоровья людей с данной аномалией без сопутствующих пороков обычно нормальное [9].
Situs viscerus inversus partialis встречается крайне редко (1 на 10000 живорожденных). При этой аномалии возможно обратное расположение органов только грудной полости (рис.2), или только брюшной полости [5, 9].
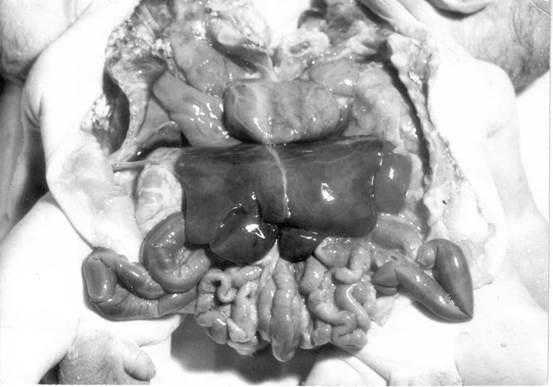
Рис.1. Внутренние органы торакоабдоменопагусов. Видна одна печень, одно сердце, один желудок, но кишечник у каждого близнеца раздельный.

При situs ambiqus – удвоении правосторонности или левосторонности отмечается нарушение латерализации в эмбриональном периоде развития и обозначается как гетеротаксия [5]. Подобное нарушение приводит к развитию плода с правым изомеризмом (каждая сторона плода правая) при асплении, или, наоборот, с левым изомеризмом (каждая сторона плода левая) при полисплении [12].
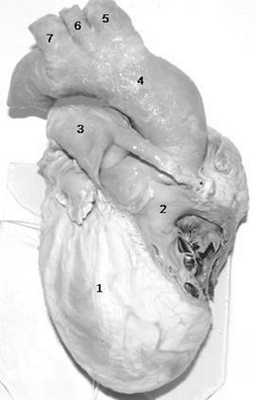
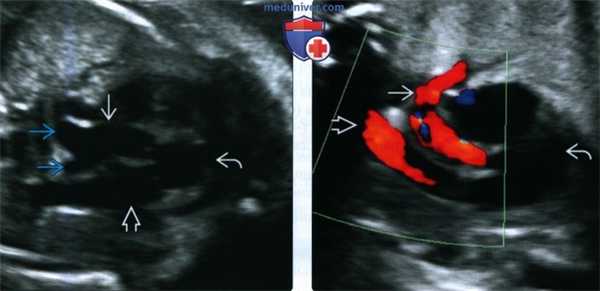
При полисплении, или левом изомеризме [12] возможны следующие аномалии развития: оба легких состоят из двух долей, оба предсердия имеют морфологию левого, выявляются множественные селезенки, аплазия нижней полой вены с дренированием в непарную вену (рис.3), врожденные пороки сердца, удвоение верхней полой вены или её отсутствие.
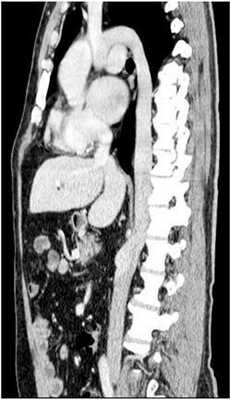
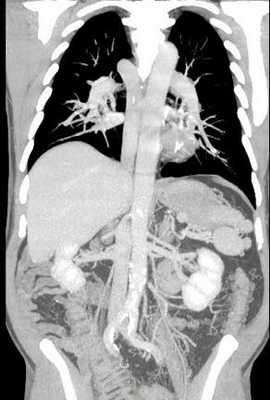
Рис.3. СКА сосудов брюшной и грудной полостей (справа – фронтальный, слева - сагиттальный срез). Аплазия предпочечного и печеночного отделов нижней полой вены с дренированием в непарную вену, полиспления.
При асплении, или правом изомеризме [12] наблюдаются следующие аномалии развития: оба легких состоят их трех долей, оба предсердия имеют морфологию правого, отсутствует венечный синус, отсутствует селезенка, печеночные вены могут впадать в левое предсердие, наблюдаются удвоение нижней полой вены и верхней полой вены, врожденные пороки сердца. При асплении пороки сердца более тяжелые, чем при полисплении.
Описано более 50 наследственных синдромов, включающих обратное расположение органов [1, 3]. Один из таких синдромов – синдром Картагенера или синдром неподвижных ресничек [5].
Мужчин с синдромом Картагенера характеризует зеркальное расположение органов, бесплодие и слабое обоняние. Впервые сочетание бронхоэктазов с обратным расположением органов и синуситом описал А.Зиверт [6]. После того как синдром описал M.Kartagener в 1936 году [13], именем которого названа триада, причинная связь между характерными чертами синдрома ещё долго оставалась скрытой. В 1976 году шведский врач B.Afzelius [11] обнаружил, что плохое обоняние и бесплодие вызываются дефектом ресничек. Дефект ресничек эпителия дыхательных путей способствует развитию воспалительных процессов и, как следствие, плохому обонянию. Во взрослом состоянии мужское бесплодие объясняется отсутствием подвижности сперматозоидов, так как хвост сперматозоида – это тоже большая ресничка. В основе подвижности ресничек лежит белковый комплекс, динеин, состоящий из десятка крупных белков, каждый из которых кодируется одним геном. В настоящее время уже выделены 2 гена при синдроме Картагенера [8].
B.Afzelius выявил, что situs viscerus inversus характерен только для половины людей с синдромом Картагенера, как и для одного из сросшихся близнецов. B.Afzelius предположил, что реснички представляют важную часть механизма, используемого эмбрионом для отличия правой и левой стороны, но объяснить их роль не смог. Этот механизм был обнаружен в последние годы [8]. На одном конце эмбриона имеется группа мезодермальных клеток с ресничками, так называемый организатор. Движение ресничек вызывает определенное течение окружающей эмбрион жидкости, которое собирает сигнальные молекулы с левой стороны эмбриона. В окружающих организатор клетках включаются гены, кодирующие сигнальные молекулы. Последние передают зачатки асимметрии, заданной организатором эмбриону и усиливают её. Когда будущие сросшиеся эмбрионы представлены лежащими рядом полосками, каждая из них формирует собственную пространственную геометрию. Формирование одного близнеца нарушают сигналы, исходящие от другого близнеца, и с вероятностью пятьдесят на пятьдесят его органы могут переместиться на противоположную сторону.
Синдром Картагенера - заболевание наследственное, частота его встречаемости – 1: 50000 в популяции в целом [10].
Мужское бесплодие и риск бесплодия у женщин при данном синдроме объясняются структурными изменениями в жгутиках сперматозоидов и ресничках маточных труб аналогичными таковым в ресничках дыхательных путей [2, 7, 11]. Отдаленные наблюдения [10] показали, что у женщин с синдромом Картагенера может сохраниться детородная функция, для мужчин подобное является редкостью.
Лучевые признаки гетеротаксического и кардиоспленического синдромов плода
а) Терминология:
1. Синонимы:
• Гетеротаксический синдром
• Висцеральная гетеротаксия
• Неопределенное положение внутренних органов
• Многообразие терминов, описывающих одну и ту же патологию, порождает путаницу:
о Приведенные ниже термины используют в отношении конкретного сочетания патологических находок (термины не всегда синонимичны)
• ППИ:
о Аспления
о Двусторонняя симметрия правых отделов сердца
• ЛПИ:
о Полиспления
о Двусторонняя симметрия левых отделов сердца
2. Определения:
• Нарушение, характеризующееся неправильным расположением органов в грудной клетке и брюшной полости относительно средней линии тела:
о Локализация органов не соответствует ни situs solitus (норма), ни situs inversus (зеркальное расположение)
б) Лучевая диагностика:
1. Общие сведения:
• Критерии диагностики:
о Локализация сердца и желудка с противоположных сторон
о Нарушение взаимного расположения брюшной аорты и нижней полой вены
о Увеличение печени и смещение ее к средней линии
о Полная АВ-блокада на фоне сложного ВПС

(Слева) Фотография, полученная во время аутопсии плода. Выявлены декстрокардия, увеличение и расположение печени по средней линии, незавершенный поворот кишечника. Указанные патологические находки характерны для ППИ.
(Справа) Атрезия легочной артерии. Определяются антеградный кровоток в дуге аорты, ретроградный кровоток к легочной артерии через инвертированный артериальный проток. В норме направление кровотока в артериальном протоке и дуге аорты совпадает.
2. УЗИ при гетеротаксическом и кардиоспленическом синдроме у плода:
• УЗИ в режиме серой шкалы:
о ЛПИ: перерыв нижней полой вены:
- Вены печени впадают непосредственно в предсердие
- Непарная вена (продолжение нижней полой вены) расширена, находится позади аорты
о ППИ: нижняя полая вена и аорта находятся по одну сторону от позвоночного столба, при этом нижняя полая вена лежит кпереди от аорты
о Двусторонняя верхняя полая вена:
- Характерно для ЛПИ и ППИ
о Нарушение локализации желудка:
- Справа, слева или по центру в зависимости от расположения печени
о Смещение печени к средней линии
о При ЛПИ может отсутствовать желчный пузырь
• ЦДК:
о Находят селезеночную артерию:
- При полисплении (ЛПИ) сохранена
- При асплении (ППИ) отсутствует
о Находят и отслеживают ход вен большого круга кровообращения и легочных вен
3. ЭхоКГ при гетеротаксическом и кардиоспленическом синдроме у плода:
• ЭхоКГ выполняют в случае необходимости более тщательного исследования сердца плода
• Аномалии развития сердца возможны на любом уровне:
о Предсердные, АВ, желудочковые, вентрикулоартериальные
• Возможно любое сочетание аномалий, однако всегда существует определенная закономерность:
о Наиболее частые формы ВПС, встречающиеся при том или ином виде гетеротаксии, приведены ниже
• ЛПИ:
о Декстрокардия (30—40%)
о Двусторонняя верхняя полая вена (40%)
о Перерыв нижней полой вены (>70%)
о Аномальный дренаж легочных вен, как правило частичный, - 20-40%
о Единственное предсердие или ДМПП - 80%
о АВ-канал (20-40%)
о Единственный желудочек (10%)
о Обструкция выносящего тракта ЛЖ (40%)
о Аномалии развития конотрункуса (15-30%):
- Стеноз или атрезия легочной артерии
- Транспозиция магистральных сосудов
• ППИ:
о Декстрокардия (30—40% случаев)
о Двусторонняя верхняя полая вена (50-70%)
о ТАДЛВ-50-70%
о Единственное предсердие или ДМПП (90%)
о АВ-канал (85%)
о Единственный желудочек (>50%)
о Аномалии развития конотрункуса (80%):
- Удвоение выходного отверстия ПЖ
- Стеноз или атрезия легочной артерии
- Транспозиция магистральных сосудов
4. Рекомендации по лучевой диагностике:
• Советы по проведению исследования:
о Если сердце и желудочек расположены с противоположных сторон грудной клетки или брюшной полости:
- Проводят тщательный поиск изменений со стороны сердца:
«Нашли одно нарушение — ищите два»
«Нашли два нарушения - ищите восемь»
- Находят изменения сосудов большого и малого круга кровообращения
- Находят смещение печени к средней линии
о Исследование анатомии плода в полном объеме
(Слева) Срез через выносящий тракт сердца (плоскость четырехкамерного среза наклонена кпереди). Видны параллельно расположенные магистральные сосуды, выходящие из ПЖ. Легочная артерия (узнаваемая за счет рано отходящих ветвей) находится позади аорты, что характерно для транспозиции.
(Справа) ЦДК в той же плоскости. Визуализируются аорта и легочная артерия, обе выходят из ПЖ В данном случае имеется удвоение выходного отверстия ПЖ - характерная находка при ППИ.
в) Дифференциальная диагностика гетеротаксического и кардиоспленического синдрома у плода:
1. Изменение положения сердца:
• Отклонение оси сердца или смещение в правую половину грудной клетки может быть связано с наличием в грудной клетке объемного образования:
о ВДГ
о ВМДП
о БЛС
• Декстрокардия
• Полная транспозиция органов (situs inversus)
2. Изменение положения желудка:
• ВДГ или агенезия легкого
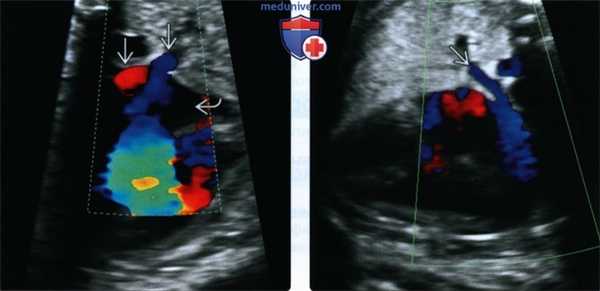
(Слева) Четырехкамерный срез, увеличенное изображение. Визуализируются левые легочные вены, впадающие в расположенное слева предсердие. Данное наблюдение не позволяет утверждать о нормальном строении всех легочных вен - необходимо исследовать правые легочные вены, чтобы исключить частичный аномальный дренаж легочных вен.
(Справа) Тот же случай. Легочная вена, идущая от правого легкого, впадает в предсердие, расположенное справа. При ЛПИ легочная вена от правого легкого направляется к расположенному справа предсердию, а от левого легкого - к ЛП, поскольку морфологически оба предсердия являются «левыми».
г) Патологоанатомические особенности. Общие сведения:
• Генетические факторы:
о Чаще всего возникает случайным образом
о Характерна генетическая гетерогенность; известны мутации как минимум семи генов, связанных с гетеротаксией (NODAL, ZIC3, CFC1, FOXH1, LEFTY2, GDF1,ACVR2B)
о В случае семейных форм заболевания возможно как доминантное, так и Х-сцепленное рецессивное (ZIC3) наследование
о Клинические проявления различаются даже у членов одной семьи с одинаковой мутацией
о Возможные причины (редко) - делеция или дупликации хромосом, а также анеуплоидия
о Важно выявлять пациентов с гетеротаксией на фоне первичной цилиарной дискинезии, которым дополнительно требуется лечение нарушений со стороны органов дыхания
• Сопутствующие нарушения:
о ЛПИ:
- Двустороннее ушко ЛП (пальцевидной формы)
- Полиспления (96% случаев)
- Оба легких состоят из двух долей; бронхи подартериальные
- Неправильное положение желудка
- Незавершенный поворот кишечника (70%)
- Печень неправильной формы, смещена к средней линии
- Атрезия внепеченочных желчных протоков
- Отсутствие или гипоплазия желчного пузыря с его расположением по средней линии
- Отсутствие синусового узла:
Часто проявляется АВ-ритмом или АВ-блокадой
о ППИ:
- Двустороннее ушко ПП (пирамидальной формы)
- Аспления (74%)
- Оба легких состоят из трех долей; бронхи надартери-альные
- Печень сферической формы, смещена к средней линии
- Желудок по средней линии или слева (60%)
- Незавершенный поворот кишечника (-70%)
- Два синусовых узла; характерна наджелудочковая тахикардия
• Под определение гетеротаксии попадает широкий спектр нарушений:
о Декстрокардия + нормальное положение органов брюшной полости
о Левокардия + транспозиция органов брюшной полости
о Описаны случаи изомеризма с нормальным положением селезенки
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о У плода:
- Нарушение положения органов
- Перерыв нижней полой вены с продолжением в непарную вену
- Смещение печени к средней линии
- Два вида ВПС или более
- АВ-блокада
о У новорожденного:
- Клиническая картина широко варьирует - от ацианотичности до цианоза
- Нарушенное положение органов по данным рентгенографии грудной клетки
2. Демографические особенности:
• Эпидемиология:
о М:Ж =1:2 при ЛПИ
о М:Ж = 2:1 при ППИ
о 4% всех новорожденных с ВПС
о 30% случаев нарушенного положения сердца у новорожденных
о ЛПИ чаще всего обнаруживают во внутриутробном периоде:
Сопутствующая полная АВ-блокада → водянка плода → внутриутробная смерть плода
о ППИ чаще всего выявляют в постнатальном периоде
3. Естественное течение и прогноз:
• Зависят от вида и тяжести сопутствующих пороков сердца:
о Ранняя выживаемость в настоящее время значительно улучшилась
• В отношении единственного желудочка прогноз по-прежнему менее благоприятный
• Нарушения, связанные с высоким риском смерти:
о Обструкция легочных вен
о Умеренная или выраженная недостаточность АВ-клапанов
о Единственный желудочек
• Выживаемость детей, родившихся живыми:
о 5-летняя - 64%
о 10-летняя - 57%
о 15-летняя - 53%
о При ТАДЛВ и единственном желудочке выживаемость до выписки из стационара составляет 57%
• Возможные осложнения:
о Аритмия, тромбоэмболия, кишечная непроходимость, инфекции
4. Лечение гетеротаксического и кардиоспленического синдрома у плода:
• При ВПС в сочетании с множественными пороками развития показано кариотипирование
• Тщательный сбор семейного анамнеза
• Пренатальная консультация неонатолога и детского кардиолога
• Роды в условиях стационара III уровня:
о При выявлении дуктус-зависимых пороков может потребоваться введение простагландинов
о Для лечения ТАДЛВ с обструкцией легочных вен может потребоваться экстренное хирургическое вмешательство
• Хирургическое лечение обструкции выносящего тракта в 1-ю неделю жизни
• Дополнительную коррекцию единственного желудочка сердца выполняют в течение первых 6 месяцев жизни
• Может потребоваться дополнительная коррекция сложных нарушений со стороны вен большого круга кровообращения
е) Особенности диагностики. Важно знать:
• Положение органов оценивают при каждом УЗИ
ж) Список использованной литературы:
1. Gottschalk I et al: Extracardiac anomalies in prenatally diagnosed heterotaxy syndromes. Ultrasound Obstet Gynecol. ePub, 2015
- Вернуться в оглавление раздела "Акушерство."
Редактор: Искандер Милевски. Дата обновления публикации: 7.10.2021
Эмбриогенез и лучевая анатомия сердечно-сосудистой системы у плода
а) Общие сведения:
Клетки - предшественники тканей сердца происходят из мезодермы, образуя у головного конца эмбриона первичный кардиальный серп. Вторичное сердечное поле, медиально граничащее с первичным серпом, служит источником клеток, входящих в состав выносящего тракта и предшественника ПЖ. По мере удлинения и сворачивания эмбриона ножки серпа сближаются и срастаются по средней линии, образуя сердечную трубку, которая перемещается в грудную клетку. По мере удлинения и дифференцировки прямая сердечная трубка совершает поворот, сворачивается и образует петлю (D-loop), желудочки при этом перемещаются в правую и левую стороны. Проксимальный (венозный) полюс остается фиксированным в дорсальной части и входит в состав предсердия, в то время как артериальный полюс изгибается вправо и вентрально, становясь выносящим трактом. Пролиферация клеток приводит к образованию сердечной петли и отдельных камер сердца. На рисунке показаны ПЖ и ЛЖ, а также будущие ПП и магистральные сосуды. Ранние этапы развития четырехкамерного сердца. ЛЖ образуется из первичного сердечного поля (красный цвет), ПЖ и выносящий тракт (ВТ) - из вторичного сердечного поля (синий цвет). Третичное поле (оранжевый цвет) участвует в образовании предсердий и служит источником клеточных компонентов, входящих в состав желудочков.
2. Первичная сердечная трубка:
• Состоит из эндотелиальных клеток, покрытых миоэпикар-диальной мантией и погруженных в сердечный гель
• Каудальный → краниальный (или венозный → артериальный) полюсы:
о Венозный синус, зачаток предсердия, зачаток желудочка, сердечная луковица, артериальный ствол:
- Аорта и ее ветви отходят от артериального полюса
- Артериальный ствол дает начало восходящему отделу аорты и легочной артерии
• Сокращения сердечной трубки появляются приблизительно в 4 нед.
• Эффективное кровообращение устанавливается к 5-й неделе
4. Формирование перегородок:
• 30-40-й дни беременности
• Предсердия:
о Первичная перегородка растет сверху вниз, достигая эндокардиальных валиков:
- При ее слиянии с эндокардиальными валиками первичное отверстие закрывается
- В результате апоптоза в центре первичной перегородки образуется вторичное отверстие
о Вторичная перегородка растет справа от первичной перегородки
о В результате фенестрации вторичной перегородки образуется овальное окно
• АВ-канал:
о Изначально направлен к зачатку желудочка (развивающемуся ЛЖ)
о К 5-й неделе бульбовентрикулярная складка делит желудочек на две равные части
о Передний, задний и боковой эндокардиальные валики растут кнутри:
- Клетки, произошедшие из эндокарда или нервного гребня
о В результате сращения эндокардиальных валиков образуются митральный и трикуспидальный (ТК) клапаны, отделяющие предсердия от желудочков
• Желудочки:
о Разделены мышечной перегородкой, растущей вниз по мере роста самих желудочков
о От нижних эндокардиальных валиков отходит мембранозная перегородка
о Перегородка выносящего тракта отходит от валиков выносящего тракта в луковице сердца
• Магистральные артерии:
о Выпячивания артериальных конуса и ствола образуют эндокардиальные гребни
о В результате роста эндокардиальных гребней на 7-й неделе происходит разделение магистральных артерий
о Изгиб крупных артерий формируется в результате следующих событий:
- Ориентация трункальных гребней вверху или внизу
- Ориентация конусных гребней слева или справа
- Межтканевое взаимодействие между вторичным сердечным полем и клетками нервного гребня посредством сигнальных путей
Четырехкамерный срез сердца во II триместре позволяет детально оценить анатомию сердца, размеры которого в данном случае не превышают примерно 18 мм. ЧСС составляет 130-160 уд./мин. В ПЖ определяется модераторный тяж. Данный признак служит подтверждением визуализации ПЖ, который в норме располагается спереди. Четырехкамерный срез сердца при большем увеличении. Изображение получено в режиме исследования сердца, позволяющем усилить контрастность и обнаружить мелкие детали сердца. В ЛП находится клапан овального окна. Он обеспечивает движение крови справа налево, при этом оксигенированная кровь из ПВ и венозного протока попадает в левые отделы сердца, откуда поступает к головному мозгу. Срез по короткой оси через желудочки редко используют при УЗИ у беременных, однако исследование в данной плоскости является неотъемлемым компонентом ЭхоКГ плода, позволяя оценить размеры и функцию желудочков в режиме реального времени. В центральной части полости ПЖ виден ТК в поперечном сечении. Срез через выносящий тракт ЛЖ предпочтителен для исследования мембранозной межжелудочковой перегородки. Дефект перегородки может быть как изолированным перимембранозным, так и сочетающимся с поражениями выносящего тракта ПЖ или конотрункуса, такими как тетрада Фалло или удвоение выходного отверстия ПЖ. Стандартный срез через выносящий тракт ПЖ по короткой оси на уровне аортального клапана. Плоскость позволяет обнаружить главную легочную артерию и артериальный проток, идущий кзади по направлению к позвоночному столбу и впадающий в нисходящую аорту. На парасагиттальном срезе через выносящий тракт ПЖ обнаруживают дугу артериального протока, более широкую и уплощенную, чем дуга аорты, и не дающую ветвей к голове и шее. Четырехкамерный срез сердца одного плода из монохориальной двойни. У плода присутствовала ишемическая кардиомиопатия, ставшая причиной его смерти. Как видно, предсердия и желудочки могут оставаться симметричными, даже несмотря на наличие патологии. Предсердия увеличены вследствие недостаточности предсердно-желудочкового клапана. Она, в свою очередь, обусловлена ишемией миокарда и нарушением сократительной способности желудочков. На снимке определяются правая легочная вена, пересекающая среднюю линию и впадающая в ЛП, а также левая легочная вена, впадающая в ЛП. Правая легочная вена окрашена синим цветом, что свидетельствует о том, что датчик расположен спереди и справа от плода. Бикавальный срез позволяет исследовать вены большого круга кровообращения, впадающие в ПП. Печеночная вена впадает в нижнюю полую вену. При впадении нижней полой вены в непарную вену печеночные вены могут впадать непосредственно в ПП. Важно уметь отличать печеночные вены от нижней полой вены (последняя значительно крупнее). В случае впадения нижней полой вены в непарную вену на четырехкамерном срезе увеличенная непарная вена визуализируется как второй сосуд сзади от сердца.
б) Эмбриональное развитие артерий:
1. Аортальные дуги:
• По обе стороны от хорды в мезенхиме формируются парные дорсальные аорты:
о Хорда - первичная ось развивающегося туловища
• По мере изгибания краниального конца эмбриона сердечная трубка перемещается в грудную клетку
• Дорсальные аорты повторяют формирование сердечной петли → первая дуга аорты
• Образуются и регрессируют группы других дуг → анатомия артерий взрослого:
о Шесть парных дуг кровоснабжают жаберные дуги и сообщаются с дорсальной частью ипсилатеральной аорты:
- Правая дорсальная аорта, первая, вторая и пятая дуги редуцируются
- Третьи дуги → внутренние сонные артерии
о Левая четвертая дуга → дуга аорты
о Правая четвертая дуга → правая подключичная артерия
о Левая шестая дуга → артериальный проток, левая легочная артерия
о Правая шестая дуга → правая легочная артерия
• Парные дорсальные аорты сливаются на уровне от IV грудного до IV поясничного позвонков → единая аорта, располагающаяся по средней линии
2. Конотрункус:
• Конотрункус является выносящим трактом первичной сердечной трубки
• Рост эндокардиального гребня приводит к разделению артериального ствола на восходящую аорту и легочную артерию
о В результате этого же процесса образуются клапаны аорты и легочной артерии
• Клапан аорты обычно располагается справа и сзади от клапана легочной артерии
• Изначально присутствуют два подартериальных конуса:
о Субпульмональный конус сохраняется
о Субаортальный конус подвергается резорбции:
- Фиброзные компоненты аортального и митрального клапанов непрерывно соединены
- Аорта «заякорена» в ЛЖ:
При разобщении аорты и предсердно-желудочковой перегородки возникает S-образная деформация АВ-канала (в форме гусиной шеи)
3. Легочная артерия:
• Спереди и слева от корня аорты
• У плода главная легочная артерия разделяется на три сосуда: артериальный проток, правую и левую легочные артерии
• У взрослых главная легочная артерия в месте выхода из перикарда разделяется на два сосуда: правую и левую ветви:
о В результате атрофии артериального протока образуется артериальная связка
Анатомический вариант персистенции левой верхней полой вены наблюдают в том случае, если левая передняя кардинальная вена не подвергается инволюции. Левая верхняя полая вена впадает в ПП опосредованно через увеличенный коронарный синус. Расширение коронарного синуса обнаруживают на четырехкамерном срезе сердца. Сагиттальный срез через левую верхнюю полую вену, впадающую в расширенный коронарный синус и ПП. В подобных случаях необходимо исключать аномальный дренаж легочных вен, который также может стать причиной расширения коронарного синуса. Четырехкамерный срез сердца. Расширение коронарного синуса (звездочка). Данная находка позволяет заподозрить персистенцию левой верхней полой вены.
в) Эмбриональное развитие вен:
1. Венозный синус:
• Имеет в составе правый и левый рога
• В каждый рог впадают желточная, пупочная и кардинальная вены
• По мере роста и дифференцировки входное отверстие синуса смещается вправо, в формирующееся правое предсердие (ПИ)
2. Развитие вен большого круга кровообращения:
• Правая передняя кардинальная вена → верхняя полая вена
• Левая передняя кардинальная вена подвергается инволюции, левый рог венозного синуса → коронарный синус:
о Персистенция левой передней кардинальной вены становится причиной появления добавочной левой верхней полой вены
• Желточные вены, обеспечивающие отток крови от желточного мешка, становятся печеночной и воротной венами
• Левая пупочная вена (ПВ) впадает в венозный проток, обеспечивая возврат оксигенированной плацентарной крови в сердце плода
• Правая ПВ подвергается инволюции
• ПВ также входит в печень через воротный синус:
о Облитерированная ПВ становится круглой связкой
г) Анатомия сердца:
1. Названия сегментов:
• В основе наименований сегментов сердца лежит его морфология
• В основе анатомического описания сердца лежат наличие сегментов, их взаимное расположение и взаимосвязь
Оксигенация крови плода происходит в плаценте, возврат крови к сердцу осуществляется через ПВ. Насыщенная кислородом кровь (красный цвет) проходит по венозному протоку и попадает через овальное окно в левые отделы сердца, обеспечивая кровоснабжение головы. Бедная кислородом кровь (синий цвет) возвращается в ПП по верхней и нижней полым венам. Эта кровь преимущественно попадает в ПЖ, откуда небольшое ее количество поступает в легочные артерии, а основной объем - в артериальный проток. Оксигенация крови у взрослого происходит в легких, кровь возвращается к левым отделам сердца по легочным венам. Левые отделы сердца доставляют кровь к туловищу через аорту и ее ветви. Бедная кислородом кровь возвращается по нижней и верхней полым венам в правые отделы сердца, откуда затем направляется к легким, где происходит газообмен. ПА становятся медиальными пупочными связками, ПВ - круглой связкой печени, артериальный проток - артериальной связкой.
д) Кровообращение:
1. Фетоплацентарное:
• Кровь по артериям движется от сердца:
о Аорта кровоснабжает головной мозг и тело
о ПА (ветви внутренних подвздошных артерий) несут бедную кислородом кровь от сердца к плаценте:
- У взрослого они становятся медиальными пупочными связками
о Главная легочная артерия несет кровь от ПЖ к туловищу через артериальный проток:
- Небольшой объем крови также попадает к легким плода, поскольку они не участвуют в газообмене
• По венам кровь доставляется к сердцу:
о ПВ несет насыщенную кислородом кровь от плаценты к сердцу:
- Основной объем оксигенированной крови через овальное окно попадает в левые отделы сердца и направляется к мозгу
о Нижняя полая вена несет бедную кислородом кровь от туловища к ПП
о Верхняя полая вена доставляет бедную кислородом кровь от головы к ПП
• Распределение сердечного выброса плода значительно отличается от такового у взрослого:
о Главная легочная артерия сообщается с нисходящей аортой посредством артериального протока:
- Благодаря этому оксигенированная кровь из ПЖ направляется непосредственно к туловищу, минуя легкие: У взрослых артериальный проток становится артериальной связкой
о Вклад ПЖ в общий сердечный выброс (ОСВ) у плода составляет 55%, ЛЖ - 45%:
- 40% ОСВ → к туловищу через артериальный проток
- 15% ОСВ → к легким через ветви легочной артерии
- 30% ОСВ → к головному мозгу через восходящую аорту
- 10% ОСВ → к туловищу через дугу аорты, перешеек и нисходящую аорту
- 3% ОСВ → к сердцу через венечные артерии
• Разделение потоков обеспечивает оптимальную доставку оксигенированной крови к голове:
о Насыщенная кислородом кровь из ПВ поступает в ПП через венозный проток и нижнюю полую вену:
- Основная часть потока через овальное окно поступает в ЛП и ЛЖ
- Перфузия сердца и головного мозга осуществляется кровью с наибольшей концентрацией кислорода
о Бедная кислородом венозная кровь из большого круга кровообращения попадает в ПП через верхнюю и нижнюю полые вены:
- Поток крови попадает преимущественно в ПЖ
Видео анатомия кровообращения плода и плацентарного кровотока
Синдром ЕЕС. Возможности пренатальной диагностики и особенности медико-генетического консультирования
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
Синдром ЕЕС (ectrodactyly-ectodermal dysplasia-clefting syndrome) - редкий генетический синдром, обычно проявляющийся триадой признаков: расщелиной лица, эктродактилией конечностей и признаками эктодермальной дисплазии [1]. Выделяют 2 типа синдрома: ЕЕС-1 и ЕЕС-3. Ранее был описан также и ЕЕС-2, однако на сегодняшний день локализация гена, кодирующего ЕЕС-2, считается ошибочной, следовательно, и формы ЕЕС-2 не существует. Первый тип характеризуется мутацией в 7-й хромосоме в области 7q11.2-q21.3, третий - имеет в большинстве случаев мутацию Тp63-гена и другие новые, спонтанные мутации на 3-й хромосоме 3q27 [2]. В OMIM (ежедневно обновляемом международном классификаторе Online Mendelian Inheritance in Man), где представлены все известные на сегодняшний день фенотипы и генотипы менделирующих (наследуемых) болезней человека, эти виды синдрома кодируются по-разному: ЕЕС-1 - 129900, а ЕЕС-3 - 604292 [3].
ЕЕС-синдром - наследственная патология с аутосомно-доминантным типом наследования, характеризующаяся различной пенетрантностью (проявляемостью) и экспрессивностью (степенью выраженности) [1].
Манифестные признаки синдрома ЕЕС (синдромальное ядро)
Эктродактилия - это расщелина кистей и/или стоп с отсутствием одного или нескольких центральных пальцев, известная также под названием "Split hand-split foot malformation" (SHFM). Часто внешний вид кистей и стоп сравнивают с клешней краба. Нередко встречается в сочетании с синдактилией (сращением пальцев).
Эктодермальная дисплазия проявляется особенностями строения всех производных эктодермы. Изменения затрагивают волосы, зубы, ногти [11]. Волосы и ресницы у таких людей тусклые, редкие и жесткие. Характерны аномалии зубов, гипоплазия зубной эмали, снижение пигментации волос, кожи, радужной оболочки глаз, что вызывает светлый их цвет. Также часто сочетание синдрома с фотобоязнью [1], обструкцией носо-слезных каналов [12], кондуктив- ной тугоухостью [13].
Эктодермальная дисплазия проявляется отсутствием потовых желез, что характеризуется наличием гипогидротинового синдрома, проявляющегося в резкой сухости и шелушении кожи. Характерным проявлением этого синдрома является хриплый, осипший голос из-за нарушения увлажнения голосовых связок, вследствие чего не происходит полного их смыкания [14].
Нарушение речи у больных с ЕЕС-синдромом имеет много причин. Во-первых, это связано с последствиями наличия расщелины губы и/или неба и "гиперназальной" речью, во-вторых, правильной артикуляции может препятствовать не только изменение голосовых связок, но и патология зубов. В-третьих, из-за аномалий слуховых косточек часто прогрессирует тугоухость, ведущая к когнитивным расстройствам и расстройствам речи.
Дети с этим синдромом обычно имеют нормальный уровень интеллекта. Лечение основано на коррекции пороков лица и конечностей. Признаки эктодермальной дисплазии проявляются в постнатальном периоде [1]. Врожденные пороки развития (ВПР) мочевыделительной системы у больных с синдромом ЕЕС возникают более чем в половине случаев. Среди них описаны: мегауретер, гидронефроз, уретероцеле, аплазия почки, аномалии гениталий, уретровезикальный рефлюкс с частыми инфекциями мочевыделительных путей [12].
Пренатальная диагностика синдрома ЕЕС
Учитывая выраженность проявлений при синдроме ЕЕС, пренатальная диагностика этой патологии, безусловно, возможна. Однако на сегодняшний день в мировой литературе встречается незначительное число публикаций, посвященных диагностике этого редкого синдрома 15, что связано, видимо, с редкостью возникновения данной аномалии. В основном сроками постановки диагноза являются 16-30 недель беременности. Большую помощь в диагностике данной патологии, учитывая выраженные изменения фенотипа лица и конечностей, оказывает применение новых ультразвуковых технологий 3D/4D с методиками поверхностной реконструкции [16].
Первое описание пренатальной диагностики синдрома датировано 1993 годом и принадлежит M. Bronshtein и R. Gershoni, когда при применении трансвагинальной эхографии у плода была выявлена расщелина губы и неба и эктродактилия в 14 недель беременности [17]. Уникальность этого факта в том, что, пожалуй, впервые из известных случаев диагностики врожденных аномалий дебют дородового выявления порока принадлежит сроку первого триместра. Примечательно и то, что авторами не только описаны отдельно выявленные пороки развития плода, но и пренатально установлена нозология этого состояния. Другими словами, диагноз не звучал, как "множественные врожденные пороки развития", когда невозможно говорить об этиологии заболевания, а следовательно, и о мерах специфической профилактики данной патологии в дальнейшем в семье. Пренатальный диагноз был выставлен полно и абсолютно корректно, что особенно важно при проведении медико-генетического консультирования с формированием тактики адекватного репродуктивного поведения семьи в дальнейшем.
Из-за незначительного количества публикаций, посвященных пренатальной диагностике этого генетического синдрома, представляем ряд собственных наблюдений диагностики синдрома ЕЕС в разные сроки беременности, в том числе и в первом триместре. Особо рассмотрим особенности проведения медико-генетического консультирования при диагностике различных форм синдрома с аутосомно-доминантным типом наследования для выработки специфических мер профилактики данного наследственного заболевания.
Клиническое наблюдение 1
Пациентка Н. 24 лет. Беременность первая. Женщина и муж соматически здоровы, брак неродственный. Обратилась в медико-генетическое отделение МОНИИАГ в 21,4 недели беременности в связи с подозрением на порок развития конечностей у плода. Были выявлены: эктродактилия кистей (рис. 1) и стоп плода (рис. 2.). Из особенностей строения выявлены двусторонние пиелоэктазии (рис. 3). Проведено медико-генетическое консультирование. Семья приняла решение прервать данную беременность в связи с наличием инвалидизирующих пороков конечностей. При патологоанатомическом исследовании ВПР конечностей подтверждены, а также дополнительно выявлена расщелина мягкого неба и признаки эктодермальной дисплазии (гипертрофия десен, характерный лицевой фенотип). Окончательный диагноз: "синдром ЕЕС, аутосомно-доминантный тип наследования". Мутация de novo.
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии, Москва.
Курс пренатальной диагностики, ФГБОУ ДПО РМАПО Минздрава России, Москва.
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5" высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика – современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11–12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1–4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11–14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7–9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Читайте также:
