Механизмы активации эозинофилов.
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Активация эозинофилов. Взаимодействие эозинофилов с другими клетками.
Перечень факторов, приводящих к активации эозинофилов, представлен был ранее. В соответствии с химической структурой и молекулярным весом все эти факторы могут быть разделены на липиды, белки и пептиды.
PAF является потенциальным стимулятором для отдельных клеток воспаления, включая эозинофилы, и должен быть одним из важнейших факторов, ответственных за инфильтрацию тканей легкого клетками воспаления при БА. Помимо этого, в период активного формирования болезни чувствительность эозинофилов к действию PAF повышается. PAF вызывает повышение целого спектра эозинофильных функций: хемотаксиса in vitro и in vivo, адгезии эозинофилов к эндотелиальным клеткам, цитотоксичности в отношении паразитов, генерации супероксид аниона, высвобождения из гранул энзимов и белков и снижения плотности эозинофилов.
Не только PAF является фактором, активирующим эозинофилы, но и сами эозинофилы являются важнейшим источником этого медиатора. Основная роль липидов заключается в максимальном привлечении в очаг воспаления эффекторных клеток через образование амплификаторной петли (обратной связи). PAF также может действовать как модулятор эозинофильного ответа на действие таких агонистов, как С5а и FMLP. Однако PAF не обладает селективным действием и влияет как на эозинофилы, так и на нейтрофилы.
Различные группы белков (иммуноглобулины, компоненты комплемента, цитокины) обладают способностью активировать эозинофилы. Из компонентов комплемента в активации эозинофилов участвуют СЗа и особенно С5а. Последний способствует хемотаксису, адгезии и дегрануляции эозинофилов, высвобождению белков, кислородзависимому взрыву и продукции простаноидов. В последнее время обнаружено множество цитокинов, влияющих на эозинофилы.

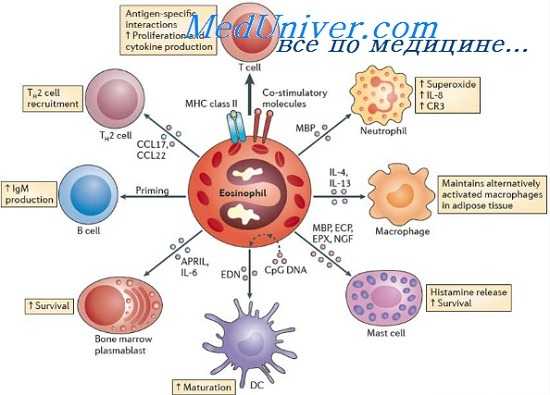
Взаимодействие эозинофилов с другими клетками.
Эозинофилы участвуют в реакциях воспаления, находясь в постоянном взаимодействии с другими клетками. В последние годы были установлены сложные механизмы этого взаимодействия.
Несмотря на различное происхождение, тучные клетки и базофилы обладают многочисленными общими характеристиками, включающими не только экспрессию FcsRI и содержание медиаторов, но также и общие механизмы кооперации с эозинофилами. Например, многочисленными исследованиями было показано, что МБР, ЕСР и ЕРО индуцируют высвобождение гистамина как базофилами , так и тучными клетками человека. ЕРО также связывается с отрицательно-заряженными гранулами тучных клеток, образуя сложный комплекс, который сдерживает токсическую активность бактерий в присутствии Н202. Тучные клетки, которые в норме содержат небольшое количество пероксидазы, могут интернализировать экзогенную ЕРО с помощью везикулярной транспортной системы и включают пероксидазу в цитоплазматические гранулы. С другой стороны, тучные клетки и базофилы способны противодействовать токсическому воздействию продуктов эозинофилов. Например, тучные клетки и базофилы человека быстро секвестируют токсические эозинофильные белки с помощью эндоцитоза. Это наблюдение дает объяснение присутствию МБР и ЕРО в базофилах и тучных клетках. Помимо этого, гепарин и различные анионы, которые связывают гистамин в тучных клетках и базофильных гранулах, нейтрализуют токсические свойства МВР, что было показано в отношении эпителиальных клеток бронхов и опухолевых клеток. Наконец, различные медиаторы базофилов и тучных клеток (PAF и цитокины) могут облегчить функцию эозинофилов. Хотя тучные клетки вовлечены в немедленную аллергическую реакцию IgE-зависимого типа, высвобождение этих медиаторов может способствовать участию других клеток воспаления (например, эозинофилов) в поздней аллергической реакции.
Нейтрофилы и макрофаги могут быть вовлечены в воспалительную реакцию эозинофильного типа через высвобождение эйкозаноидов, кислородных радикалов и цитокинов. С другой стороны, нейтрофилы и макрофаги, продуцируя многочисленные медиаторы, способны сами модулировать функцию эозинофилов. Например, в исследованиях in vitro было показано, что супернатанты альвеолярных макрофагов, полученные от больных хронической эозинофильной пневмонией, способны стимулировать хемилюминесценцию эозинофилов.
Адгезия и последующая трансмиграция эозинофилов через эпителиальный барьер приводит к их попаданию в бронхоальвеолярное пространство. Эпителиальные клетки дыхательной системы человека продуцируют GM-CSF, PAF, PGE2, PGF2a, которые могут влиять на функциональную активность эозинофилов, когда они достигают бронхоальвеолярного пространства. Более того, также как эндотелиальные клетки, клетки дыхательного эпителия экспрессируют ICAM-1, и адгезия эозинофилов может быть частично блокирована моноклональными антителами против ICAM-1.
Два важнейших хемоаттрактанта для эозинофилов, PAF и RANTES, продуцируются тромбоцитами и могут участвовать в тромбоцит-зависимой миграции эозинофилов. Более того, доказательства важной роли тромбоцитов в аллергическом воспалении основаны на данных о повышенном содержании медиаторов тромбоцитов (PF-4, p-TG) у астматиков, которое коррелирует с повышенным уровнем эозинофильных продуктов. С другой стороны, такие медиаторы эозинофилов, как МБР и ЕРО, способны активировать тромбоциты.
Лимфоциты являются источником двух хемоаттрактантов для эозинофилов: LCF и IL-2. Кроме того, цитокины, продуцируемые ТН2-лимфоцитами (IL-3, IL-5, GM-CSF), участвуют в эозинофилопоэзе, активации эозинофилов и т.д. Некоторые цитокины, продуцируемые лимфоцитами, могут способствовать дополнительному привлечению в очаг воспаления лимфоцитов и эозинофилов. Например, IL-4, продуцируемый ТН2 клетками, способствует повышению экспрессии VCAM-1 на эндотелиальных клетках, что в будущем облегчает привлечение и активацию эозинофилов и лимфоцитов.
Отдельные исследования показали, что в условиях ex vivo жизнеспособность и другие характеристики эозинофилов находятся в зависимости от цитокинов, продуцируемых монослоем фибробластов. Более того, в экспериментах на фибробластах легких человека было показано, что они самостоятельно повышают жизнеспособность эозинофилов in vitro и этот эффект преимущественно связан с GM-CSF. С другой стороны, получены данные о способности эозинофилов продуцировать факторы, индуцирующие и поддерживающие фиброгенез.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Механизмы активации эозинофилов.
Эффекторные функции эозинофилов. Эозинофилы реализуют свои эффекторные функции через различные механизмы, которые можно разделить на некислородзависимые, кислородзависимые и гуморальные.
Некислородзависимые механизмы активации эозинофилов. Как было сказано ранее, три основных белка гранул эозинофилов обладают токсическими свойствами, независимо от присутствия кислорода. Например, МВР, ЕРО и ЕСР в присутствии перекиси водорода в условиях in vitro убивают гельминтов. Кроме того, эти белки являются токсичными для опухолевых клеток, клеток млекопитающих, включая паренхиму легкого человека, интерстициальную ткань, клетки легочного эпителия. Более того, было показано, что МВР повреждает эпителий бронхов человека, приводя к его десквамации и деструкции. Наконец, при высвобождении этих белков из гранул эозинофилов, активированных PAF, удавалось имитировать патологические сдвиги дыхательного эпителия, характерные для больных БА. Дополнительно к цитотоксическому действию катионные белки эозинофилов в субтоксических концентрациях способны стимулировать различные клетки воспаления. Например, МВР и ЕСР вызывают дегрануляцию тромбоцитов, индуцируют высвобождение гистамина из тучных клеток и базофилов, так же как генерацию супероксид аниона и высвобождение нейтрофилами лизосомальных энзимов. Наконец, эозинофильные белки могут влиять на функцию дыхательной мускулатуры и гиперреактивность. Последние исследования по оценке эффектов, возникающих при прямом интратрахеальном введении очищенных белков эозинофильных гранул приматам, показали, что МБР индуцирует дозозависимое повышение реактивности дыхательных путей в ответ на ингаляцию метахолина. На той же экспериментальной модели было показано, что МБР и ЕРО являются причиной бронхоспазма, длительность которого составляет около 1 часа. Интересно, что другие гранулярные белки эозинофилов не оказывают влияния на реактивность бронхов или функцию легких.
Кислородзависимые механизмы активации эозинофилов. Эозинофилы также могут проявлять свои эффекторные функции с помощью двух кислородзависимых механизмов. При первом происходит генерация токсических кислородных радикалов, а при втором - продукция НОВг, НЮ3, НВr03. Кроме того, вновь образуемый супероксид анион спонтанно превращается в Н202, проявляющий токсические эффекты. Еще более выраженный токсический эффект характерен для комплекса ЕРО/ Н202, который токсичен для бактерий (E.coli, Staphylococcus aureus, Legionella pneumophila, Mycobacterium leprae), грибов, паразитов (Schistosoma mansoni, Trichinella spiralis, Trypanosoma cruzi trypomastigotes, Toxoplasma gondii), опухолевых клеток и тучных клеток.

Механизмы активации эозинофилов, опосредованные липидными медиаторами. Эозинофилы вовлекаются в воспаление через генерацию и высвобождение de novo липидных медиаторов: PAF, LTC4, PGE, PGFr TxA2, PGD2, PGF2a. Большинство из перечисленные медиаторов (PAF, LTC4, TxA2, PGD2, PGF2a) участвуют в развитии воспаления, бронхоспазма и гиперреактивности бронхов в поздней фазе астматической реакции. В то же время, PGE обладает способностью угнетать функцию эозинофилов и поэтому может рассматриваться как сигнал, обеспечивающий регуляцию эозинофилов по принципу "обратной связи".
Роль эозинофилов при заболеваниях человека. Эозинофилы участвуют в развитии большого числа заболеваний человека: инфекционных, аллергических, онкологических, аутоиммунных и т.д. Перечень этих заболеваний представлен в таблице.
Инфекционные заболевания, вызванные паразитами и эозинофилы.
Взаимосвязь между гельминтозами и эозинофилией периферической крови была обнаружена еще в начале XX века. За последние два десятилетия было обнаружено 4 основных доказательства участия эозинофилов в защите организма против паразитов. Во-первых, антиэозинофильная антисыворотка снижает количество эозинофилов в периферической крови и повышает чувствительность к паразитам. Во-вторых, эозинофилы прямо участвуют в киллинге гельминтов. В-третьих, белки эозинофильных гранул и метаболиты кислорода токсичны для паразитов. Наконец, эозинофилы накапливаются и дегранулируют в месте локализации паразитов. Несколько позже была изучена роль цитокинов в регуляции противогельминтной защиты. Введение антител против IL-5 и IL-4 мышам значительно снижало количество эозинофилов в крови и в тканях, а также уровень сывороточного IgE, но не сопровождалось снижением иммунитета против паразитов. Наоборот, введение антител против IFN-y приводило к частичному снижению иммунитета против шистосом в легких.
Функции и значение эозинофилов
Эозинофилы отличаются от других лейкоцитов не только морфологией и составом продуцируемых веществ, но и тем, что количество этих клеток меняется лишь при некоторых заболеваниях. Они представляют собой полностью дифференцированные неделящиеся клетки диаметром около 8 мкм с двудольным ядром и развиваются из стволовых клеток-предшественниц в костном мозге под влиянием продуцируемых Т-лимфоцитами ИЛ-3, ГМ-КСФ и (особенно) ИЛ-5. Характерные специфические гранулы эозинофилов окрашиваются эозином в красновато-коричневый цвет; их прозрачная сердцевина, состоящая из главного основного белка, окружена матриксом, в котором содержатся катионный белок эозинофилов, пероксидаза эозинофилов и нейротоксин эозинофилов.
Эти белки оказывают цитотоксическое действие на личинки гельминтов (Schistosoma mansoni), а также участвуют в патогенезе бронхиальной астмы, вызывая слущивание эпителия дыхательных путей и связанные с ним клинические симптомы. В дыхательных путях больных, умерших в результате бронхиальной астмы, присутствует большое количество главного основного белка и катионного белка эозинофилов, причем считается, что именно они повреждают эпителиальные клетки, повышая чувствительность дыхательных путей. Главный основный белок может активировать другие клетки, участвующие в процессе воспаления, в том числе тучные клетки, базофилы, нейтрофилы и тромбоциты. Эозинофилы выделяют большое количество липидных медиаторов воспаления — фактор активации тромбоцитов и лейкотриен-С4, которые сужают сосуды и стимулируют секрецию слизи.
Эти клетки служат источником ряда провоспалительных цитокинов, включая ИЛ-1, ИЛ-3, ИЛ-5 и ГМ-КСФ. Таким образом, эозинофилы обладают мощным арсеналом веществ, способных вызывать и поддерживать воспалительную реакцию.
Миграция эозинофилов из сосудистого русла в ткани зависит от связывания особых рецепторов лейкоцитов с их лигандами или аналогичными структурами на эндотелиальных клетках посткапиллярных сосудов. Проникновение эозинофилов (как и нейтрофилов) через стенку сосуда начинается с образования рыхлой связи между их селектиновыми рецепторами и углеводными лигандами на поверхности эндотелия. Это приводит к перекатыванию эозинофилов по эндотелиальному слою до тех пор, пока они не встретятся с хемоаттрактантом. Затем образуется высокоаффинная связь между интегриновыми рецепторами эозинофилов и соответствующими Ig-подобными лигандами.
В отличие от нейтрофилов, которые перед проникновением через межклеточные контакты эндотелия приобретают плоскую форму, эозинофилы связываются с молекулой адгезии клеток сосудов (VCAM-1) с помощью особого интегрина VLA-4, что делает их связь с эндотелиальными клетками более прочной и облегчает проникновение из сосуда в ткань. Миграция эозинофилов в очаги воспаления направляется хемокином эотаксином. Это обусловливает избирательное накопление эозинофилов при аллергических и воспалительных процессах. В норме эозинофилы локализуются главным образом в органах с эпителиальной поверхностью — дыхательных путях, ЖКТ и нижних отделах мочеполовых путей, где могут сохраняться неделями.
ИЛ-5, помимо стимуляции образования эозинофилов и их адгезии на эндотелиальных клетках, оказывает ряд важных эффектов на функцию эозинофилов. Показано, что он играет центральную роль в накоплении эозинофилов. ИЛ-5 является главным цитокином в индуцируемой аллергеном поздней фазе легочной аллергической реакции. В опытах на животных антитела к ИЛ-5 блокируют эозинофильную инфильтрацию легких и бронхиальную гиперреактивность в ответ на аллергены. Эозинофилы обладают уникальными рецепторами к ряду хемокинов, таких, как белки RANTES, эотаксин, белок хемотаксиса моноцитов-3 и -4. Эти хемокины являются основными медиаторами накопления эозинофилов в тканях.
Количество эозинофилов крови не всегда отражает степень их накопления в пораженных тканях. Абсолютное число эозинофилов в крови, рассчитываемое по числу лейкоцитов, умноженному на процент эозинофилов, обычно меньше 450 клеток на 1 мкл и подвержено суточным колебаниям. Оно наиболее велико ранним утром и снижается по мере возрастания уровня эндогенных глюкокортикоидов. После введения кортикостероидов, а также при некоторых бактериальных и вирусных инфекциях развивается эозинопения.
Эозинофилы
Эозинофилы являются высокоспециализированными гранулоцитарными эффекторными клетками, которые продуцируют и хранят разнообразные биологически активные молекулы, в том числе цитотоксические, цитостимулирующие белки, липидные медиаторы, хемотаксические пептиды и цитокины. В различных условиях эозинофилы могут проникать в определенные органы-мишени после трансэндотелиальной миграции и секретировать свои продукты в окружающую ткань, вызывая тем самым локальное воспаление и ремоделирование ткани. Когда эозинофилия в тканях и / или крови зафиксирована и является стойкой, термин гиперэозинофилия (HE) является наиболее подходящим. У пациентов с HE вещества, продуцируемые из эозинофилов, могут вызывать заметные изменения в микроокружении и, следовательно, хроническое (и потенциально необратимое) повреждение органов. У этих пациентов может присутствовать множество симптомов, связанных с эозинофилией, а воспаление тканей часто сопровождается локальным (внеклеточным) отложением белков, полученных из эозинофилов. В подгруппе этих пациентов может развиться тканевый фиброз и / или тромбоз.
Эозинофилы постоянно пополняются из пула плюрипотентных и предрасположенных к линии происхождения гематопоэтических клеток-предшественников в костном мозге. Бипотентные клетки-предшественники для эозинофилов и базофилов (CFU-eo / ba) обнаруживаются в костном мозге и периферической крови у здоровых субъектов, а также у пациентов, страдающих аллергическими или другими воспалительными реакциями. Производство эозинофилов из мультипотентных и ограниченных по происхождению предшественников строго контролируется сетью транскрипционных факторов (GATA-1, PU.1, c / EBPs и др.), факторов роста и ингибирующих рост цитокиов. Основными факторами роста для эозинофилов являются IL-5, гранулоцитарный / макрофагальный колониестимулирующий фактор (GM-CSF) и IL-3. Эти регуляторы роста вырабатываются и секретируются (активированными) иммунными клетками, такими как Т-клетки и тучные клетки, стромальные клетки и самими эозинофилами. Рецепторы клеточной поверхности для IL-3, IL-5 и GM-CSF выявляются на незрелых мультипотентных клетках-предшественниках эозинофилов, предшественниках эозинофилов и на зрелых эозинофилах. В соответствии с этим наблюдением, эти цитокины вызывают не только пролиферацию клеток эозинофилов предшественников, но и миграцию, присоединение, продукцию цитокинов, активацию и выживаемость (с замедленным апоптоза) зрелых эозинофилов. Мобилизация эозинофилов из костного мозга в кровь регулируется преимущественно IL-5 и эотаксином. В дополнение к классическим эозинофильным факторам роста, другие цитокины, такие как тромбоцитарный фактор роста или NGF, могут играть роль в регуляции развития и функционирования эозинофилов.
Несмотря на то, что конститутивно активированные рецепторы этих цитокинов могут быть вовлечены в развитие гиперэозинофилии, влияние фактора роста тромбоцитов и NGF на рост и функцию эозинофилов в основном остаются неизвестными. Другие цитокины и хемокиновые лиганды (CCL), такие как IL-16, фактор роста эндотелия сосудов, CCL5 (RANTES), CCL11 (эотаксин), CCL24 (эотаксин-2), CCL26 (эотаксин-3) и фактор, активирующий тромбоциты, индуцируют миграция эозинофилов и хемотаксис. Большинство из этих пептидных медиаторов также запускают активацию эозинофилов, а некоторые из них изменяют адгезивные свойства эозинофилов. Эозинофил-активирующие цитокины, такие как IL-3 или IL-5, также были описаны , как факторы повышения чувствительности эозинофилов к другим пептидам и цитокинам. Отметим, что эозинофилы, выделенные из воспаленной ткани, демонстрируют усиленные миграционные реакции на различные лиганды по сравнению с эозинофилами в здоровой ткани и, таким образом, находятся в активированном ("загрунтованном") состоянии.
Наконец, рост, выживание и функции эозинофилов крови контролируются различными «негативными регуляторами», такими как сиглек-8 и другие рецепторы, ингибирующие клеточную поверхность. Кроме того , было описано , что TGF-β, IFN-α и IFN-γ подавляют цитокининдуцирующий рост и дифференцировку эозинофилов в пробирке. Кроме того, TGF-β индуцирует апоптоз у зрелых эозинофилов. Более того, такие растворимые «негативные регуляторы», такие как IFN-γ, противодействуют индуцированной цитокинами миграции эозинофилов. Считается, что все эти цитокиновые эффекты опосредованы специфическими рецепторами, экспрессируемыми на эозинофилах. Эозинофилы также обладают рецепторами глюкокортикостероидов (GC), которые ингибируют рост и функцию эозинофилов, а количество GC-рецепторов, обнаруживаемых в эозинофилах, коррелирует с реакциями этих клеток на GC.
Адгезия, миграция, активация и выживание эозинофилов регулируются сетью цитокинов, хемокинов, других биологически активных лигандов и их рецепторов. В самом деле, эозинофилы имеют уникальный состав рецепторов клеточной поверхности , имеющих отношение к адгезии, наведению и миграции. Некоторые из этих рецепторов участвуют в трансмиграции эозинофилов через эндотелиальные монослои и, таким образом, в возвращении к тканям, что имеет решающее значение для развития локального инфильтрата эозинофилов, обычно наблюдаемого у пациентов с повреждением органов, связанным с гиперэозинофилией. Также сообщалось, что эозинофилы экспрессируют L-селектин, а также лиганды E- и P-селектина, различные интегрины, сиалил Льюис x, молекулу 1 межклеточной адгезии, рецептор C3bi (CD11b / CD18) и антиген-1 функции лейкоцитов ( CD11a / CD18). Кроме того, эозинофилы экспрессируют лейкозиалин (CD43) и рецептор инвазии лейкоцитов CD44. Принимая во внимание, что селектины, как полагают, опосредуют скручивание и связывание эозинофилов на мембранах эндотелиальных клеток и, таким образом, маргинализацию эозинофилов в кровотоке, интегрины и другие рецепторы адгезии обеспечивают прочное связывание эозинофилов с эндотелием перед трансмиграцией.
Эозинофилы и их производные играют важную роль в патогенезе различных реактивных и опухолевых расстройств. В зависимости от основного заболевания, молекулярного дефекта и вовлеченных в патологический процесс цитокинов, может развиться гиперэозинофилия и привести к повреждению органов.У некоторых пациентов персистирующая эозинофилия сопровождается типичными клиническими проявлениями, но этиологическая роль и влияние эозинофилии остаются неизвестными. Для пациентов с патологией органов, опосредованных эозинофилией, раннее терапевтическое вмешательство с препаратами, снижающими количество эозинофилов, может быть эффективным для ограничения или предотвращения необратимого повреждения органов.
Если в кровь и / или ткани обнаруживается гиперэозинофилия , то это свидетельствует о различных воспалительных реакциях, некоторых гематологических злокачественных новообразований , а иногда, и солидных опухолях. Реактивная эозинофилия обычно обнаруживается у пациентов с гельминтными инфекциями, токсическими или аллергическими лекарственными реакциями и атопическими расстройствами.
Гематопоэтические злокачественные новообразования, обычно (но не всегда), сопровождающиеся эозинофилией, представляют собой миелопролиферативные новообразования (MPN), некоторые варианты острого миелолейкоза (AML), меньшую подгруппу пациентов с миелодиспластическими синдромами (MDS), некоторые нарушения MDS / MPN, несколько (чаще всего, Т-клеточного происхождения) лимфопролиферативных нарушений и (расширенный) системный мастоцитоз (СМ). Эти дифференциальные диагнозы следует учитывать в случаях необъяснимого повышения эозинофилов , особенно в контексте других нарушений в анализе крови. У таких пациентов следует начинать гематологическое исследование, включая исследования костного мозга с цитогенетическим, FISH и молекулярным анализом. У пациентов с миелоидными или стволовыми клетками эозинофилы обычно относятся к злокачественному клону. У этих пациентов могут присутствовать так называемы "слитые гены", включающие PDGFRA, PDGFRB, FGFR1 или другие тирозинкиназы. Это имеет большое значение, учитывая тот факт, что иматиниб очень эффективен у пациентов с PDGFRA или PDGFRB слитыми генами, но не в новообразованиях с FGFR1 слитыми генами. При хронической эозинофильной лейкемии (CEL) слитый ген FIP1L1-PDGFRA (и связанная с ним цитогенетическая делеция суррогата CHIC2 с помощью FISH) обнаруживается примерно в 10–20% всех случаев и, таким образом, является наиболее частой рецидивной аберрацией при CEL. Сообщалось также о множестве других цитогенетических дефектов, таких как потеря Y-хромосомы, трисомия 8, трисомия 15, del (6q), del (20q) или i (17q) .
Полагают, что эозинофилы - это редкие лейкоциты, деятельность которых в основном разрушительна и имеет отношение только к паразитарным инфекциям и астме. Однако правильный ли этот достаточно банальный вывод? Воспалительные заболевания кишечника характеризуются вторжением лейкоцитов в слизистую оболочку кишечника. Однако, наблюдается смешанная воспалительная картина, которая включает нейтрофилы, лимфоциты, моноциты и эозинофилы. До сегодняшнего дня роль эозинофилов в здоровье и заболевании остается неясной. Традиционно,исследования их функции связаны, главным образом, с аллергическими заболеваниями, астмой и паразитарными инфекциями. В отличие от легких или кожи, эозинофилы находятся в нормальной слизистой оболочке кишечника и усиливают патологические состояния; следовательно, сложная система должна регулировать их миграцию и численность.
Значительный объем литературы описывает эозинофилы, присутствующие в микроокружении желудочно-кишечного тракта, где они могут взаимодействовать с другими резидентными клетками, тем самым способствуя ремоделированию кишечника, образованию слизи, эпителиальному барьеру, выработке цитокинов, ангиогенезу и высвобождению нейропептидов. Ряд доказательств подтверждает как потенциальную полезную, так и вредную роль эозинофилов в кишечнике.
Эозинофилы представляют собой плейотропные многофункциональные лейкоциты, участвующие в инициации и распространении различных воспалительных реакций, а также модуляторы врожденного и адаптивного иммунитета. Представляет интерес биология эозинофилов, причем основное внимание здесь стоит уделить транскрипционной регуляции дифференцировки эозинофилов, характеристике растущих свойств гранул эозинофильных белков, поверхностных белков и плейотропных медиаторов и молекулярным механизмам дегрануляции эозинофилов. Важны новые взгляды на роль эозинофилов в гомеостатической функции, включая биологию развития и врожденный и адаптивный иммунитет (а также их взаимодействие с тучными клетками и Т-клетками) и их предполагаемую роль в процессах заболевания, включая инфекции, астму и желудочно-кишечные расстройства.
Эозинофильные гранулоциты издавна считались мощными эффекторными клетками, способными высвобождать целый ряд медиаторов воспаления, участвующих в цитотоксичности, для гельминтов и разрушения тканей при хронических воспалительных заболеваниях, таких как астма. Однако стало очевидно, что эозинофилы также участвуют в регуляторных механизмах, модулирующих местные тканевые иммунные ответы. Эозинофилы участвуют в механизмах ремоделирования и репарации и способствуют локализованному врожденному и приобретенному иммунному ответу, а также системному адаптивному иммунитету. Кроме того, эозинофилы участвуют в нейроиммунных взаимодействиях, модулирующих функциональную активность периферических нервов. Нейромедиаторы также могут модулировать функциональную активность эозинофилов, выявляя двунаправленные взаимодействия между двумя типами клеток. Эозинофилы являются тканеспецифичными клетками и были обнаружены в непосредственной близости от периферических нервов.
Хотя функциональная роль эозинофилов в первую очередь считается защитой хозяина от паразитарной инфекции, современные исследования показывают, что эта сложная клетка идеально приспособлена для других ролей, которые могут включать иммунную модуляцию и восстановление тканей. Эозинофил является важным источником основных белков, липидных медиаторов, цитокинов и факторов роста. При болезненных состояниях мобилизация эозинофилов из костного мозга и кровообращения может быть очень быстрой, но высокоорганизованной и избирательной в отношении клеток, особенно в ответ на интерлейкин (IL) 5 и эотаксин. Такой сложный путь рекрутирования регулируется серией взаимодействий рецепторов эозинофилов и лигандов эндотелия и внеклеточного матрикса. Несколько механизмов примирования активируют эозинофилы во время этого процесса рекрутирования, так что клетка достигает пункта назначения ткани, подготовленного к немедленному действию и продленному выживанию ткани. Дегрануляция строго контролируется и позволяет клетке по-разному высвобождать свое содержимое упорядоченным образом. Это важно для предотвращения повреждения тканей во время миграции. Терапия по-прежнему ограничена в отношении заболеваний, вызванных эозинофилом, но вмешательство в ключевые события, которые управляют набором эозинофилов и эффекторной функцией, может быть выходом из положения.
Некоторые роли эозинофилов основаны на острых, эффекторных реакциях этой клетки, ее способности генерировать биологически активные липидные медиаторы и высвобождать содержимое гранул, включая характерные катионные белки. В то время как эффекторные ответы эозинофилов важны для их вклада в острый патогенез аллергических заболеваний, более полное понимание эозинофилов требует оценки роли, которую эта клетка может играть в тканевых участках, особенно в подслизистых участках, где клетка обычно локализована в отсутствие болезней. Кроме того, для долгоживущего, резидентного эозинофила, определение взаимодействий, которые происходят между эозинофилами и другими иммунными клетками, очень важно для понимания функций эозинофилов как при острых, так и при хронических заболеваниях. Многие аллергические заболевания характеризуются повышенным накоплением эозинофилов и являются хроническими заболеваниями.
Инфильтрация эозинофилов в тканевое аллергическое воспаление опосредуется сочетанием процессов. L-отбор эозинофилов и антиген очень поздней активации (VLA-4) могут избирательно регулировать адгезию эозинофилов к эндотелию. Активирующие цитокины, такие как интерлейкин (IL) -5, регулируются при активации в нормальных Т-клетках (RANTES) и хемотаксический пептид моноцитов (MCP) -3 специфически действуют на эозинофилы. Кроме того, эозинофилы от больных аллергией могут быть активированы для увеличения адгезии и движения хемокинами, высвобождаемыми в местах аллергического воспаления. Вместе эти процессы вызывают специфическую инфильтрацию эозинофилов.
Пониженные уровни глутатиона в крови и содержание эозинофилов в крови изучались в течение многих недель у пациентов, которым вводили плацебо. Лабораторные изменения, сопровождающие улучшение, происходящее от плацебо, развиваются медленно и отличаются от быстрых изменений, вызываемых некоторыми препаратами.
Эозинофилы могут регулировать местные иммунные и воспалительные реакции, а их накопление в крови и тканях связано с несколькими воспалительными и инфекционными заболеваниями. Таким образом, терапия, направленная на эозинофилы, может помочь контролировать различные заболевания, включая атопические расстройства, такие как астма и аллергия, а также заболевания, которые не связаны в первую очередь с эозинофилами, такие как аутоиммунныезаболевания и злокачественные новообразования. Препараты, нацеленные на эозинофилы, которые таргетированы на блокирование определенных этапов, связанных с развитием, миграцией и активацией эозинофилов, недавно прошли клинические испытания и дали обнадеживающие результаты и понимание роли эозинофилов
Активация эозинофилов приводит к высвобождению предварительно образованных и вновь синтезированных продуктов, включая цитокины, хемокины, липидные медиаторы и белки цитотоксических гранул, которые могут инициировать, усиливать и поддерживать местные воспалительные и ремоделирующие реакции. Вторичные гранулы эозинофилов состоят из высоко заряженных основных белков, включая основные белки эозинофильных гранул, катионный белок эозинофилов, нейротоксин, полученный из эозинофилов, и пероксидазу эозинофилов. Кроме того, эозинофильные гранулы содержат множество предварительно образованных цитокинов, хемокинов, ферментов и факторов роста, что приводит к разнообразной биологической активности эозинофилов при инфекции и воспалении. НЕсмотря на то, что глюкокортикоиды очень эффективны для снижения количества эозинофилов в крови и тканях, пациенты часто имеют опасные побочные эффекты и развивают резистентность к этим препаратам. Терапия, направленная против фактора роста эозинофилов - интерлейкина-5 (IL-5), была протестирована в клинических испытаниях на эффективность при некоторых расстройствах, связанных с эозинофилезом, и выглядит многообещающей. Тем не менее, снижение эозинофилии ткани и улучшение симптомов было переменным и зависит от фенотипов пациентов (подгрупп). Таким образом, необходимы дополнительные подходы к отбору пациентов и новых лекарственных препаратов, основанные на понимании механизма эозинофилии и эффекторных функций эозинофилов.
Доклинические исследования показывают, что ингибирование миграции эозинофилов из кровотока в ткани обладает терапевтическим потенциалом, но клинические успехи на сегодняшний день были ограниченными. Недостаточная эффективность может быть связана с комплексной регуляцией рекрутирования эозинофилов в воспалительные ткани. Доклинические исследования, таргетированные на содействие апоптозу эозинофилов, подтверждают значимость исследований связывающей сиаловую кислоту иммуноглобулин-подобной терапии, нацеленной на лектин 8 (SIGLEC-8), так как привлечение SIGLEC-8 приводит к селективному апоптозу эозинофилов.
Лечение пациентов с аллергической астмой с использованием омализумаба - рекомбинантного моноклонального антитела, связывающегося с иммуноглобулином Е, приводит к снижению эозинофилии в крови и тканях посредством еще неизвестного механизма.
Клозапин
Эозинофильный миокардит - редкая форма миокардита, характеризующаяся инфузией миокарда, состоящая в основном из эозинофилов. Известно, что он может развиваться со скоростью 0,2-3% при длительной терапии, особенно при использовании клозапина. Стандартное лечение не может быть установлено из-за редкости заболевания и трудностей в определении этиологии. При обследовании участков миокарда с помощью светового микроскопа были сделаны общие выводы: повреждение миоцитов сопровождалось пятнистым распределением периваскулярного и интерстициального воспалительного инфильтрата, богатого эозинофилами. Эти объекты могли развиться в результате реакции гиперчувствительности из-за длительного использования антипсихотических препаратов. Эозинофильный миокардит встречается как редкое клиническое заболевание и, вероятно, это подтип миокардита, который не всегда распознается. Сбой в клинической диагностике и задержка лечения могут привести к необратимому повреждению миокарда. Эндомикробная биопсия до сих пор является золотым стандартом в диагностике эозинофильного миокардита.
Читайте также:
- Операция при травматическом шоке. Диагностика полостных кровотечений
- Профессиональные нейроциркуляторные дистонии. Трудоспособность при вегето-сосудистой дистонии
- Тактика при травме сосудов грудной полости. Сортировка пациентов
- Влияние печени на психику. Гепатиты как причина неврозов
- Кости при болезни Эрдгейма-Честера - лучевая диагностика
