Механизм ангиогенеза опухоли
Добавил пользователь Skiper Обновлено: 29.01.2026
Гипотеза о том, что рост солидных опухолей и возникновение метастазов зависят от образования новых кровеносных сосудов, была выдвинута J. Folkman более 25 лет назад и в настоящее время в значительной степени подтверждена открытиями в области молекулярных и клеточных процессов, касающихся регуляции пролиферации, миграции и взаимодействия клеток, образующих сосуды [6, 7, 13, 15, 16].
Одним из основных типов клеток, формирующих кровеносные сосуды, являются клетки эндотелия, выстилающие внутреннюю поверхность капилляров, артерий и вен [5, 17]. С образования капилляроподобных трубок, стенки которых состоят из эндотелиальных клеток, начинается формирование кровеносной системы при эмбриональном развитии. Далее вокруг капилляров собираются другие клетки мезодермального происхождения, такие как перициты, которые по мере укрупнения сосудов замещаются полностью дифференцированными гладкомышечными клетками, образующими стенки крупных сосудов. Вследствие этого исследование процессов, регулирующих пролиферацию, миграцию и взаимодействие именно этих типов клеток, в первую очередь необходимо для понимания механизмов ангиогенеза.
По гистологической классификации ВОЗ опухоли из элементов костного мозга (саркома Юинга и злокачественная лимфома кости, PNET - primitive neyroektodermal tumor) составляют 30-35% всех первичных злокачественных опухолей костей [1, 8, 9].
Саркома Юинга нуждается в дальнейшем изучении, так как обладает определенными особенностями клинического течения [3, 4] и требует гистологической верификации [10, 12] для выбора адекватного специфического лечения [2, 11, 14].
Цель нашего исследования - анализ клинико-статистических признаков и иммуногистохимические исследования ангиогенеза при саркоме Юинга.
Материал и методы
В работе проведен анализ результатов обследования 68 больных саркомой Юинга, находившихся на лечении в городском онкологическом диспансере им. А.Т. Аббасова, НИИ травматологии и ортопедии, Травматологической и ортопедической клинической больнице и онкологической клинике АМУ (Баку) с 1998 по 2007 г.
Мужчин было 43 (63,24%), женщин - 25 (36,76%). Наиболее часто опухоль локализовалась в бедренной кости - 24 (35,29%) наблюдения, в большеберцовой кости - 8 (11,76%), в малоберцовой кости - 7 (10,29%), в тазовых костях - 10 (14,71%), в плечевой кости - 9 (13,24%), в лучевой кости - 3 (4,41%), в ребрах - 3 (4,25%), в лопатке - 2 (2,94%), в локтевой кости - 1 (1,47%), в ключице - 1 (1,47%).
Саркому Юинга более часто диагностировали у больных в возрасте от 4 до 37 лет. Так, в возрасте от 1 года до 10 лет было 4 (5,88%) больных, от 11 до 20 лет - 49 (72,06%), от 21 года до 30 лет - 12 (17,65%), от 31 года до 40 лет - 3 (4,41%) больных.
Лишь у небольшой группы больных клиническое течение соответствует классическому описанию Ewing [2]. В наших наблюдениях только у 20 (29,41%) больных отмечено острое начало заболевания. У большинства заболевание начиналось среди полного здоровья, без видимой причины или через какой-то промежуток времени после травмы.
Травма в анамнезе отмечена у 25 (36,76%) наблюдавшихся нами больных. Клинические проявления заболевания возникли в различные промежутки времени - от нескольких дней до 2 лет.
У большинства больных клинические признаки заболевания отмечались в течение первых 3 мес после повреждения, непосредственно после травмы или вскоре после нее.
В большинстве наблюдений заболевание начиналось медленно, постепенно появлялись легкие, скоропреходящие боли в пораженном отделе кости со значительными промежутками между приступами. С течением времени болевые атаки учащались, продолжительность их увеличивалась, затем боль становилась постоянной. Такое течение заболевания отмечено у 52 (76,47%) из 68 больных.
Для решения поставленных задач во всех наблюдениях использовали клинические, рентгенологические, цитологические, гистологические, гистохимические, иммуногистохимические и статистические методы исследования.
При цитологическом и гистохимическом исследованиях дифференциальную диагностику проводили со злокачественной лимфомой кости, в отличие от которой клетки саркомы Юинга характеризуются меньшим полиморфизмом и обычно значительно более низким количеством атипичных фигур митоза, а также отсутствием аргирофильных ретикулиновых волокон.
Для иммуногистохимического исследования использовали материал, замороженный в жидком азоте, из которого изготавливали криостатные срезы с последующей фиксацией в ацетоне, а также материал парафиновых блоков, фиксированных в 10% формалине. Исследования проводили с использованием ферментных иммунных комплексов. Использовали реактивы фирмы DАКО (France): CD 31, Endothelial Cell, clone JC 70A, isotype: Lg GI, kappa 0,2/l ml).
Полученные данные подвергнуты статистической обработке непараметрическими методами с использованием χ 2 -критерия Пирсона.
Результаты и обсуждение
Собственные наблюдения и данные литературы убедили нас в том, что по клиническим проявлениям можно выделить две группы поражений опухолью Юинга. Первая, более многочисленная, по клиническому течению более благоприятна. Опухоль сравнительно длительное время остается в пределах одной кости и дает поздние метастазы в лимфатические узлы и легкие. Метастазы в других костях могут выявляться лишь в терминальной фазе заболевания (43 наблюдения - 63,23%). Во второй группе саркома, вызывая быстрое и обширное разрушение кости, бурно метастазирует в другие отделы скелета. Из локального поражения в течение первых месяцев заболевание превращается в генерализованное.
Продолжительность клинических симптомов с момента их появления до первого обращения больного к врачу, по нашим данным, колеблется от нескольких дней до 3 мес.
Как и при других злокачественных новообразованиях скелета, с наибольшим постоянством при саркоме Юинга повторяется характерная триада симптомов: боль в пораженном отделе скелета, припухлость, нарушение функции.
Боль является доминирующим симптомом заболевания и в большинстве наблюдений болевые ощущения возникали раньше видимых на рентгенограмме изменений кости. Отмечалась широкая вариабельность интенсивности боли - от резкой стреляющей до незначительной тупой, появляющейся при физической нагрузке и проходящей в покое. Как и при большинстве сарком костей, интенсивность боли увеличивалась в ночное время. По данным наших исследований, боль при саркоме Юинга никогда не доходила до острой «скелетной» боли, характерной для остеосаркомы.
Другим постоянным симптомом заболевания являлась припухлость. В наших наблюдениях она определялась у 55 (80,88%) больных, как первый признак заболевания - у 28 (41,17%). Размеры припухлости были различны - от небольшой локализованной до обширной деформации пораженной конечности.
Общая реакция организма на заболевание проявляется в виде подъема температуры тела, изменений со стороны крови, иногда отмечается снижение массы тела, в терминальных стадиях - истощение.
Температура тела в различные периоды болезни повышалась у 36 (52,94%) больных, однако мы не отметили непосредственной связи между степенью злокачественности опухоли и температурной реакцией.
Гистологические исследования. Макроскопически ткань опухоли белого цвета, мягкая, обычно с многочисленными участками некроза и обширными очагами кровоизлияний от темно-красного до бурого цвета в зависимости от давности геморрагии. Опухоль обычно вызывает возникновение тромбозов и сдавливает кровеносные сосуды, что в свою очередь приводит к значительным нарушениям кровообращения как в самой опухоли, так и в прилежащих участках кости и окружающих мягких тканях.
Характер периостальной реакции при саркоме Юинга позволяет определить скорость роста опухоли. Наличие слоистого периостоза свидетельствует об относительно медленном росте новообразования. При большой скорости роста саркомы Юинга опухоль проникает через периваскулярные пространства питающих кость артерий. Нарушение кровоснабжения с ухудшением питания при саркоме Юинга сравнительно быстро ведет к дегенеративно-некротическим изменениям в кости, лизису и разрушению ее на значительном протяжении и замещению опухолевой тканью. При данном заболевании некрозы составили примерно 10-15% общей массы опухоли.
Микроскопические исследования. Во-первых, обращает на себя внимание преобладание в опухоли клеточной массы при почти незаметном стромальном компоненте. Во-вторых, клетки саркомы Юинга отличаются сравнительно мелкими размерами, округлой формой и мономорфностью.
При малых увеличениях микроскопа опухолевая ткань состоит действительно из мономорфных мелких клеток с округлым или несколько овальным ядром и узким ободком светлой цитоплазмы без четких границ. Нередко клетки расположены компактно и образуют сплошные поля. В других участках среди клеточных скоплений можно видеть тонкостенные (выстланные эндотелием) сосудистые каналы, построенные по капиллярному типу, вблизи них нередко встречаются массивные кровоизлияния. В очагах некроза жизнеспособная опухолевая ткань сохраняется в виде клеточных периваскулярных муфт.
При большом увеличении микроскопа клетки опухоли выглядят более разнообразными. Ядра клеток варьируют в размерах от 0,5 до 3 диаметров нормального эритроцита. Количество хроматина, определяющего интенсивность окраски ядра, бывает также различным в разных клетках. Но почти всегда хроматин имеет тонкую структуру и равномерно распределен по ядру. В большинстве случаев нуклеолы ядер опухолевых клеток мелкие или даже отсутствуют, но иногда они выделяются очень четко. Ядра обычно овальные, иногда круглые, и хотя они могут варьировать в размерах, очертания их обычно четкие. Размеры клеток в 2-3 раза превышают размеры ядра. Цитоплазма обычно светлая, прозрачная, но иногда окрашивается эозином и напоминает цитоплазму макрофага. Часть опухолевых клеток концентрируется вокруг мелких (капиллярного типа) сосудов, образуя в продольном сечении неправильной формы тяжи, а в поперечном - структуры псевдорозеток. Волокнистых элементов стромы в ткани опухоли выявить почти не удается. Аргирофильный каркас представлен только в сосудах и на очень небольшом протяжении в периваскулярных зонах.
Гистохимические исследования. После фиксации в спирте при воздействии реактива Шиффа (РАS-реакция) и контрольном исследовании содержания амилазы в клетках опухоли Юинга всегда удается обнаружить значительное содержание гликогена. pas-позитивный внутриклеточный гликоген обнаружен во всех 68 наблюдениях саркомы Юинга, обычно в периферических отделах опухоли. При импрегнации серебром сеть из аргирофильных ретикулиновых волокон не выявлялась.
Иммуногистохимическое исследование ангиогенеза. Установлено, что иммуноглобулин CD-31 вырабатывается эндотелиоцитами, а также периваскулярными элементами сосудов. CD-31 определяется в клеточной оболочке и цитоплазме этих клеток.
Среди эндотелиальных клеток выраженная позитивность (+++) идентифицирована у 39 больных (57,1±10,8% клеток), положительная реакция (++) - у 23 больных (33,3±10,3% клеток), постоянная негативность (–) - у 6 больных (9,5±6,4% клеток).
Для изучения ангиогенеза нами произведен подсчет сосудов, эндотелиальные клетки которых экспрессируют CD-31. Установлено, что количество сосудов на срезах в интактной ткани составляет 2,15±0,84%, в срезах ткани при саркоме Юинга - 11,38±1,58%, т.е. по сравнению с интактной тканью количество сосудов, экспрессирующих CD-31, при саркоме Юинга увеличивается более чем в 5 раз (p<0,001).
Иммуногистохимическое исследование ангиогенеза при саркоме Юинга в зависимости от лимфоидной инфильтрации опухоли. При иммуногистохимическом исследовании ангиогенеза при саркоме Юинга в 16 (23,5%) случаях обнаружена низкая степень лимфоидной инфильтрации опухоли при умеренной васкуляризации. В 51 (75%) случае отмечена высокая экспрессия CD-31 и низкая степень лимфоидной инфильтрации. Лишь в 1 (1,5%) случае выявлена постоянная негативность CD-31 и высокая степень лимфоидной инфильтрации. Таким образом, обнаружена обратно пропорциональная корреляционная зависимость между лимфоидной инфильтрацией патологического очага и экспрессией CD-31 позитивных клеток (r=0,394; p
Иммуногистохимическое исследование ангиогенеза при саркоме Юинга в зависимости от спонтанной некротизации опухоли. При исследовании в 15 (22%) из 68 случаев выявлена низкая степень спонтанной некротизации опухоли. В 51 (75%) случае обнаружена высокая степень экспрессии CD-31 эндотелиальными элементами. Лишь в 2 (3%) случаях экспрессия CD-31 отсутствовала.
Таким образом, установлена достоверная обратная корреляция (r=0,21) между спонтанной некротизацией ткани и экспрессией стромальными элементами CD-31 (χ 2 =14,61; р<0,01).
Анализируя изученные данные, можно утверждать, что активность секреции CD-31 эндотелиальными элементами прямо коррелирует с интенсивностью васкуляризации опухоли (r=0,322; p<0,01). Другими словами, продукция CD-31 увеличивается в случаях высокой васкуляризации опухоли.
Полученные данные еще раз подтверждают прогностическую значимость увеличения количества сосудов при саркоме Юинга, в эндотелиальных клетках которых экспрессируется CD-31.
Таким образом, указанные иммуногистохимические особенности ангиогенеза при саркоме Юинга должны быть приняты во внимание при проведении лечебных мероприятий.
Механизм ангиогенеза опухоли
Ангиогенез опухоли. Рост кровеносных сосудов.
Особая роль в процессе канцерогенеза принадлежит ангиогенезу — новообразованию в опухоли сети кровеносных сосудов. Ангиогенез — неотъемлемая часть нормального эмбриогенеза и онтогенеза. Нарушение его приводит к развитию доброкачественных и злокачественных опухолей (невуса Спитца, саркомы Капоши и др.). Он играет важную роль в пролиферации солидных опухолей и метастазировании.
Понимание механизмов ангиогенеза способствует повышению эффективности лечения опухолей кожи.
Как известно, в норме эпидермис не содержит эндотелиальных клеток. Поверхностная артериальная сеть располагается между сосочковым и сетчатым слоями дермы, от нее отходят капилляры, снабжающие кровью сосочки дермы.
Первые эндотелиальные клетки возникают из эмбриональных предшественников — ангиобластов, которые, в свою очередь, могут возникать из более примитивных клеток— гемангиобластов. Таким образом, часть эндотелиальных сосудов может иметь общее эмбриональное происхождение с клетками циркулирующей крови, а не с другими сосудистыми (например, гладкомышечными или соединительнотканными) клетками. Поэтому многие маркеры, первоначально считавшиеся связанными с клетками гемопоэза (например CD34 и CD 136), также экспрессируются эндотелием, а многие из считавшихся связанными с эндотелием — например РЕСАМ/ 1 (CD31) и эндотелин (CD 105) — обнаруживаются на поверхности клеток циркулирующей крови.
Вновь сформированные ангиобласты обычно мигрируют, дифференцируясь в эндотелиальные клетки в тканях эндодермального происхождения (например в легких, сердце, кишечнике) и по мере дифференцировки формируют канатики и трубочки, являющиеся первыми кровеносными сосудами. Эндотелиальные клетки трубочек в дальнейшем индуцируют дифференцировку примитивных мезенхимальных клеток в клетки, составляющие сосудистую стенку (гладкомышечные клетки и перициты). Формирование выстланных эндотелием трубочек из дифференцирующихся анги-областов называется васкулогенезом, а развитие новых кровеносных сосудов из предсуществующих кровеносных сосудов, выстланных эндотелием, — ангиогенезом.
Для нормального развития сосудистой сети также требуется новообразование сосудов (ремоделирование). Сосудистая сеть начинает формироваться в эмбриональном периоде и продолжает изменяться в течение развития плода, а также в постнатальном периоде. Зрелые эндотелиальные клетки сохраняют способность регенерировать, в связи с чем при травме могут развиваться новые кровеносные сосуды (как часть процесса репарации). Такие сосуды возникают путем ангиогенеза, инициированного эндотелиальными клетками в сосудах, расположенных по соседству с местом ранения. Кроме того, ангиогенез обеспечивается присутствующими в крови взрослых ангиобластами, способными «засевать» место травмы. По мере созревания молодой грануляционной ткани новые сформированные сосуды подвергаются сосудистому ремоделированию.
Ангиогенез у эмбриона, так же как ангиогенез при заживлении ран, контролируется рядом полипептидных факторов, которые связываются со специфическими рецепторами белка ти-розинкиназы на эндотелиальных клетках. Среди факторов роста сосудистого эндотелия наиболее изучен сосудистый эндотелиальный стимулятор ангиогенеза/фактор сосудистой проницаемости (VEGF/VPF) — высокоспецифичный митоген для эндотелиальных клеток, не действующий на гладкие мышцы сосудов, фибробласты и эпителиальные клетки. Рецепторы к нему (fit-1 и KDR) экспрессируются главным образом на ангиобластах и зрелых сосудистых эндотелиальных клетках.
Если в маленькие опухоли питательные вещества и кислород поступают путем диффузии или через соседние капилляры, то клетки опухолей более крупного размера приобретают способность к сосудообразованию и выделяют белковый фактор, потенцирующий врастание капилляров в опухолевую ткань из прилежащей сохранной ткани. Этот полипептид называется фактором Фолькмана. При этом процесс опухолевого ангиогенеза происходит в условиях взаимодействия между опухолевыми клетками, эндотелиальными клетками и экстрацеллю-лярным матриксом. Выделяют три этапа опухолевого ангиогенеза, следующих друг за другом по мере опухолевой инвазии
— пролиферацию эндотелиальных клеток;
— разрушение окружающего экстрацеллюлярного матрикса:
— миграцию эндотелиальных клеток. Ангиогенез в опухоли происходит на фоне измененного экстрацеллюлярного матрикса в условиях нарушенных межклеточных и паренхиматозно-стромальных взаимоотношений. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, часто имеющих прерывистую базальную мембрану с нарушенной эндотелиальной выстилкой.
Важную роль в ангиогенезе играют стимуляторы (факторы роста сосудов) и ингибиторы ангиогенеза. Факторы роста сосудов продуцируются различными клетками и связываются с рецепторами на поверхности эндотелиальных клеток. Процесс ангиогенеза косвенно зависит и от некоторых других пептидов, способствующих миграции в очаг опухолевого роста клеток-продуцентов факторов роста сосудов. Активированные таким образом эндотелиальные клетки начинают размножаться и расти в сторону опухоли. Процесс опухолевого ангиогенеза завершается образованием из массы эндотелиальных клеток трубочек—сосудов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
• Рост опухоли ограничивается доступностью питательных субстратов и механизмом выведения продуктов жизнедеятельности
• Опухоль может стимулировать рост кровеносных сосудов (ангиогенез), которые, в свою очередь обеспечивают увеличение ее массы
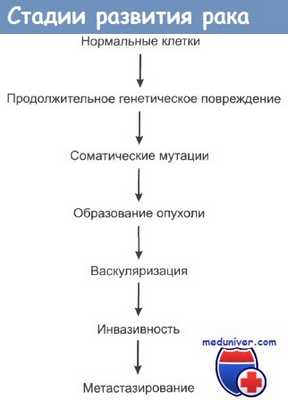
Способность клеток растущей опухоли к пролиферации зависит от ряда факторов, наиболее важным из которых является адекватная система кровоснабжения. Известно, что развивающаяся опухоль, т. н. первичная опухоль, может достигнуть размера лишь 0,2 мм, а затем начинает испытывать затруднения с доступом к питательным компонентам и кислороду; в то же время такой опухоли уже необходимо иметь систему выведения отходов жизнедеятельности и двуокиси углерода. Клетки, испытывающие гипоксию, могут вступить в апоптоз.
Проблем не возникает, если в опухоли развилась сосудистая система. Сосуды решают вопросы, связанные со снабжением опухоли кислородом и питательными компонентами, а также с выведением отходов жизнедеятельности. В отличие от здоровых тканей, патологическая ткань опухоли обычно не развивается вместе с артериально-венозной сетью. Вместо этого опухолевые клетки должны обеспечить рост сосудов de novo за счет примыкающих здоровых тканей.
Процесс образования новых кровеносных сосудов называется нео-ангиогенез или просто ангиогенез. Он начинается, когда клетки опухоли секретируют ростовые факторы, называемые ангиогенными, которые взаимодействуют с эндотелиальными клетками, образующими капилляры в соседних здоровых тканях. В ответ на воздействие ангиогенных факторов эти эндотелиальные клетки начинают пролиферировать и проникают в ткань опухоли, начиная формировать сосудистую сеть, которая в дальнейшем поддерживает рост опухоли.
Очевидно, что в небольшой первичной опухоли клетки в течение многих лет делятся с постоянной скоростью. Несмотря на это, на протяжении этого периода масса опухоли не увеличивается. В отсутствие системы кровоснабжения клетки в такой опухоли погибают с той же скоростью, с какой они образуются. Эта гибель вызывается нехваткой кислорода (аноксия) и отравлением отходами своей жизнедеятельности.
Действительно, такой может быть конечная судьба большинства первичных опухолей, образовавшихся в тканях человека. В течение этого периода равновесия процесс диффузии обеспечивает потребность небольшой опухоли в кислороде и питательных компонентах, используя находящиеся рядом хорошо васкуляризованные ткани.
После нескольких лет такого скромного клеточного деления некоторые клетки в небольшой массе опухоли внезапно приобретают способность стимулировать ангиогенез. Когда это происходит, масса опухоли вступает на путь быстрого роста. Такая быстрая смена характера роста опухоли, которая происходит в ходе многоэтапного опухолевого процесса, называется ангиогенное переключение. Этот процесс представляет собой еще один барьер, который здоровые ткани воздвигают на пути неограниченной экспансии опухолевых клеток.
В некоторых опухолях формирование кровеносных сосудов не происходит в ходе одного отдельного события при многоэтапном развитии опухоли (подобно ангиогенному переключению). Вместо этого в опухоли по мере ее роста происходит прогрессивное образование сосудов.
Процесс управления ангиогенезом включает сложные кооперативные взаимодействия между клетками опухоли и соседними здоровыми клетками, которые попадают в опухоль и начинают взаимодействовать с раковыми клетками. Считается, что наряду с ангиогенными факторами, которые непосредственно высвобождаются раковыми клетками, фибробласты и макрофаги высвобождают другие важные факторы.
Вместе они индуцируют образование сосудистой сети, которая отвечает всем потребностям опухоли и начинает обеспечивать ее практически неограниченным запасом питательных компонентов и кислорода. Также через опухоль могут прорасти лимфатические сосуды, которые служат для удаления отходов ее жизнедеятельности и интерстициальной жидкости. Однако по сравнению с системой кровоснабжения лимфатические сосуды в жизни опухоли играют довольно скромную роль.
В зависимости от плотности сети капилляров опухоли, различают несколько стадий ее развития. Про опухоли с плотной сетью капилляров говорят, что они сильно васкуляризованы; это часто служит причиной болей у раковых больных и указывает на агрессивно растущую популяцию раковых клеток. Наличие сосудов в опухоли создает еще более угрожающую ситуацию. Это говорит о том, что опухоль получила доступ к основным сосудам организма, что облегчило миграцию ее клеток и заселение ими отдаленных органов.
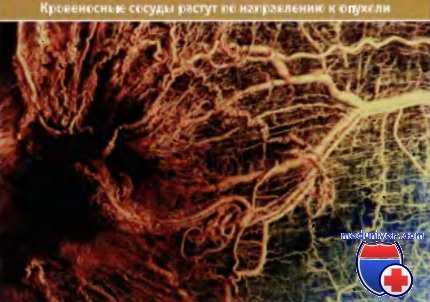
Кровеносные сосуды растут по направлению к опухоли (крысиная саркома мышц).
Сама опухоль находится слева в виде темной области.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инвазия, ангиогенез и метастазирование опухолевых клеток - рака
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
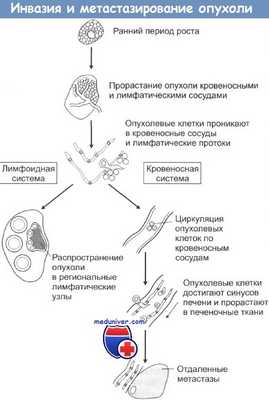
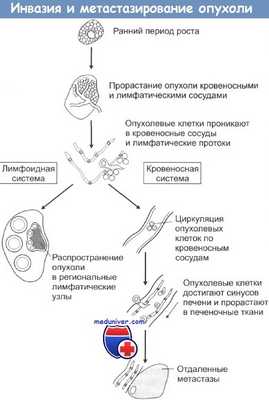
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Ангиогенез (А) – это сложный процесс созревания молодой сосудистой сети или формирования путем миграции и пролиферации эндотелиальных клеток новых кровеносных сосудов в органах или тканях, из сформированной ранее сети сосудов. Новые капилляры образуются из мелких кровеносных сосудов путем активизирования эндотелиальной клетки, преобразовании в них протеиназ, деградации внеклеточной структуры ткани, разрастания и передвижения клеточных структур. Впоследствии благодаря формированию клетками первичных высокопроницаемых сосудов, начинается стабилизация и «взросление» структур клетки с помощью притягивания перикапиллярных клеток и клеток гладких мышц. В результате чего строится многогранная сеть сосудов. В норме ангиогенез представлен ответной реакцией на стимуляцию гормонов (ангиогенез в репродуктивной системе) или на изменяющуюся окружающую среду (ишемия способствует расширению сосудов). Основной стимул, способствующий развитию ангиогенеза, – это гипоксия, которая, активируя транскрипцию факторов ангиогенеза –HIF-1α (Hypoxia-induciblefactor 1-alpha), стимулирует преобразование фактора роста (ФР) эндотелия сосудов (VEGF) и его синапсов. Затем, на этапе развития новой сети сосудов принимает участие проангиогенный фактор, который сдерживает эндотелиальную пролиферацию, снижает проницаемость сосуда и содействующий притягиванию перикапиллярных клеток.
1. Tahara T., Shibata T., Nakamura M. et.al. Eff ect of polymorphisms in the 3’ untranslated region (3’ – UTR) of vascular endothelial growth factor gene on gastric cancer and peptic ulcer diseases in Japan. MolCarcinog. 2009. vol. 48. no. 11. Р. 1030–1037.
2. Спринджук М.В., Ковалев В.А., Кончиц А.П., Демидчик Ю.Е., Фридман М.В., Богуш А.Л., Ляховский В.В. Ангигенез: программное обеспечение для исследования феномена и вопросы количественной оценки гистологических изображений // Врач и информационные технологии. 2010. № 3. С. 38–46.
3. Парфенова Е.В., Ткачук В.А. Терапевтический ангиогенез: достижения, проблемы, перспективы // Кардиологический вестник. 2007. № 2 (14). С. 5–14.
5. Fu J., Bai P., Chen Y., Yu T., Li F. Inhibition of miR-495 Improves Both Vascular Remodeling and Angiogenesis in Pulmonary Hypertension. J. Vasc. Res. 2019. V. 26. Р. 1–10. DOI: 10.1159/000500024.
6. Davidson S.M. A mitochondrial route to the stimulation of angiogenesis? E. Bio. Medicine. 2019 Apr 24. pii: S2352-3964(19)30272-5.
9. Shibuya M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases. J. Biochem. 2013. vol. 153. no. 1. Р. 13–19.
10. Wustmann K., Zbinden S., Windecker S., et al. Is there functional collateral flow during vascular occlusion in angiographically normal coronary arteries? Circulation. 2003. vol. 107. Р. 2213–2220.
11. Гавриленко Т.И., Рыжкова Н.А., Пархоменко А.Н. Сосудистый эндотелиальный фактор роста в клинике внутренних заболеваний и его патогенетическое значение. Украинский кардиологический журнал. 2011. № 4. С. 87–95.
13. Nehls V., Denzer K., Drenckhahn D. Pericyte involvement in capillary sprouting during angiogenesis in situ. Cell and Tissue Research. 1992. Vol. 270 (3). P. 469–474.
14. Sen S., McDonald S.P., Coates P.T., Bonder C.S. Endothelial progenitor cells: novel biomarker and promising cell therapy for cardiovascular disease. Clinical Science. 2011. Vol. 120 (7). Р. 263–283. DOI: 10.1042/CS20100429.
15. Humphries M.J., Travis M.A., Clark K., Mould A.P. Mechanisms of integration of cells and extracellular matrices by integrins. Biochemical Society Transactions. 2004. Vol. 32. P. 822–825.
16. Sprindzuk V.M. Angiogenesis in thyroid malignant neoplasm: State of the art and advances of the modern digital pathology and nanotechnology. Journal of Clinical Pathology and Forensic Medicine. 2010. Vol. 1 (3). P. 16–34.
18. Петрова Л.В., Кушлинский Н.Е., Ильина Л.В. Фактор роста эндотелия сосудов как показатель гипоксии тканей, его возможная роль в патогенезе плоского лишая слизистой оболочки рта // Вестник дерматологии и венерологии. 2004. № 5. С. 7–8.
19. Sen S., McDonald S.P., Coates P.T., Bonder C.S. Endothelial progenitor cells: novel biomarker and promising cell therapy for cardiovascular disease. Clinical Science. 2011. Vol. 120 (7). Р. 263–283. DOI: 10.1042/CS20100429.
20. Baburamani A., Joakim C., Walker D.W., Castillo-Melendez M. Vulnerability of the developing brain to hypoxic-ischemic damage: contribution of the cerebral vasculature to injury and repair? Front Physiol. 2012. DOI: 10.3389/fphys.2012.00424.
21. Shyu K.-G., Chang H., Isner J.M. Synergistic effect of angiopoietin-1and vascular endothelial growth factor on neoangiogenesis inhypercholesterolemic rabbit model with acute hind limb ischemia. Life Sciences. 2003. Vol. 73. Р. 563–79.
22. Cao R., Brakenhielm E., Pawliuk R. et al. Angiogenic synergism, vascularstability and improvement of hind-limb ischemia by a combinationof PDGF-BB and FGF. Nat. Med. 2003. Vol. 9. Р. 604.
23. Вирстюк Н.Г., Сенютович Н.Р. Роль факторов роста в патогенезе поражений печени у больных с метаболическим синдромом и хроническим бескаменным холециститом // Клиническая медицина. 2013. № 9. С. 22–25.
24. Танашян М.М., Лагода О.В., Антонова К.В., Коновалов Р.Н. Хронические цереброваскулярные заболевания и метаболический синдром: подход к патогенетической терапии когнитивных нарушений // Журнал неврологии и психиатрии им. С.С. Корсакова. 2016. № 116 (9). С. 106–110. DOI: 10.17116/jnevro201611691106-110.
25. Baburamani A., Joakim C., Walker D.W., Castillo-Melendez M. Vulnerability of the developing braint ohypoxic-ischemicdamage: contribution of the cerebral vasculature to injury and repair? Front Physiol. 2012. DOI: 10.3389/fphys.2012.00424.
Ангиогенез (а) – сложный процесс формирования новых кровеносных сосудов в органах либо тканях, предопределенный строго поочередной работой множества факторов в пространственно-временной позиции. Новые капилляры образуются из мелких кровеносных сосудов, путем активизирования эндотелиальной клетки, преобразования в них протеиназ, деградации внеклеточной структуры ткани, разрастания и передвижения клеточных структур. Впоследствии благодаря формированию клетками первичных высокопроницаемых сосудов, начинается стабилизация и «взросление» структур клетки с помощью притягивания перикапиллярных клеток и клеток гладких мышц. В результате чего строится многогранная сеть сосудов. В норме ангиогенез происходит в спокойном темпе, активируется он при условии тканевых ранений, наличия тромбов и других патологических процессах [1]. Физиологический ангиогенез – это реакция ткани на гормональную стимуляцию (ангиогенез в репродуктивной системе) или изменения в окружающей среде (в ответ на ишемию ткань может расширять сосудистую сеть). Исследования последних научных работ приходят к выводу, что главным стимулом ангиогенеза является дефицит кислорода, который вызывает гипоксию или ишемию, при этом HIF-1 содействует выразительности васкулярных факторов, а именно фактору роста внешнего сосудистого слоя VEGF и его нервных окончаний, который является основой регулирования роста сосудов в различных периодах развития организма [2]. Физиологический ангиогенез представлен реакцией адаптации к дефициту кислорода, поскольку VGEF считается стресс-индуцированным белком, регулируемый глюкозой и кислородом. Фактор роста индивидуально отбирает эндотелиальные клетки (ЭК) для активации их преобразования и передвижения. Увеличивает пропускаемость сосуда для прохода белков в периваскулярное пространство, необходимое для контролируемой миграции ЭК и развитию вазодилатации [3]. В этапе развития новой сети сосудов принимает участие проангиогенный фактор, который сдерживает эндотелиальную пролиферацию, снижает проницаемость сосуда и содействует притягиванию перикапиллярных клеток. Tie2 (тирозинкиназные рецепторы) играют ведущую роль в процессах роста, развития и дифференцировки клеток. Они вместе с ангиопоэтинами играют роль в корректировке сопряжения эндотелия с рядом лежащими клетками [4]. Для роста системы сосудов в эмбриональном периоде необходима система сигналов Tie/Ang, соединяемая с VEGF и его рецепторами, равно как и каскад сигнализации. Tie2/Ang1 является несамостоятельным, промотирующим ассоциацию перицитов и эндотелия, снижающим сосудистую проницаемость и обладающим противовоспалительной активностью каскадом сигнализации [5]. Ang1 помогает образовывать связь между перицитами и эндотелиальными клетками при связывании с экспрессируемым на поверхности клеток эндотелия рецептором Tie2, помогая стабилизации, находящегося в стадии развития сосудистой системы [6, 7]. 2. Тромбоцитарный ФР (PDGF), который привлекает перициты и ГМК. Это белок, синтезируемый в мегакариоцитах и находящийся в гранулах тромбоцита. Все элементы – это результат роста фактора около тысячи молекул тромбоцитов. Фактор – мощный стимул восстановления тканей. Рецепторы для этого находятся в стенке сосудов на поверхности фибробласта и клетках гладкой мускулатуры. PDGF активизирует пролиферацию таких клеток. Более того, PDGF усиливает выработку компонентов соединительной ткани (коллагена, гистамина и др.) [8]. 3. Трансформирующий ФР-β1 (TGF-β1) стимулирует синтез белков внеклеточной матрицы. Контролирующий пролиферацию полипептид (представитель цитокинов) в большинстве клеток также регулирует дифференциацию и другие функциональные особенности. Члены семейства TGF-β1 проявляют множественное воздействие на огромное количество видов клеток и способствуют контролю роста клеток, дифференциации и апоптоза, а также в модуляции иммунной системы [9]. Артериогенез способствует формированию коллатеральных сосудов из неактивных артериальных сетей, по которым кровь проходит в места замыкания. Главным катализатором такого процесса является увеличение напряжения сдвига выше места окклюзии, способствующего преобразованию молекул адгезии клетками эндотелия с последующей аккумуляцией моноцитов в стенке сосуда. Они секретируют функционирующие ФР, основными регуляторами артериогенеза являются фактор роста фибробластов (FGF), и PDGF, VEGF и CXC-хемокины (подсемейства, характеризующиеся наличием одной аминокислоты, которая разделяет N-концевые цистеины) [10]. Действия ангиогенеза контролируются ФР во временном пространстве, этот факт следует учесть во время терапевтического ангиогенеза. Стабильное состояние сосудистой сети в организме постнатального периода обеспечивается равноценным соотношением между активаторами ангиогенеза (в основном ФР и цитокинами) и его ингибиторами (тромбоспондином, ангиостатин, тумастин, эндостатином и др.), движение такого баланса в сторону активаторов, в большинстве случаев, непродолжительный, ведет за собой активацию ангиогенеза [11]. Примерами являются воспаление, заживление ран, ишемия.
Данный процесс и образование отростчатых сосудов проходит в несколько последовательных шагов. В первой фазе начинается активация перицитов, которые находятся в тесном контакте с эндотелием, они увеличиваются в объеме, укорачивая свои отростки. Таким образом, происходит ослабление межклеточных контактных соединений. Перициты проецируются в периваскулярное пространство, происходит деградация базальной мембраны и диссоциация перицитов и эндотелия [12]. Хотя процесс на начальных стадиях роста эндотелиоцитов в новообразованную васкуляризованную ткань может протекать без помощи перицитов, в последующей работе именно они локализуются по ходу прорастания эндотелия и формируют процессы, которыми направляются новообразованные сосуды [13]. Клетки эндотелиоциты берут начало своего роста в тканях по направлению Ang-1 продуцирующей ткани и, производя ферменты, катепсины и активаторы плазминогена, которые ведут к ухудшению базальной мембраны, так же матриксные металлопротеиназы (MMPs), являющиеся основными протеолитическими энзимами, принимающими участие в этом процессе. Внеклеточный матрикс, расщепляясь, формирует полипептиды, фрагменты этих белков имеют как про- так и антиангиогенные эффекты. Растворение белков внеклеточного матрикса проходит под контролем ингибиторов протеаз (UAP, PAI) [14]. При участии молекул клеточной адгезии и 17 интегринов, лигандами для которых служат белки внеклеточного матрикса (фибронектин, ламинин, витронектин), ослабление межклеточных контактных соединений эндотелиальных клеток и разрушение базальной мембраны дает начало далее следующему перемещению эндотелиальных клеток в околососудистый участок [15]. Клетки эндотелия начинают активно пролиферировать, сформировывая структуры в виде канала, далее преобразовываясь в зрелую сосудистую сеть. Некоторые сосуды микроциркуляторного русла объединяются в целостную сеть, посредством которой происходит перфузия тканей (рис. 1). До этого момента VEGF влияет на сохранение клеток эндотелия и их целостность [16].
Рис. 1. Этапы ангиогенеза
Момент подъема эндотелия сосудов. В процессе проницаемости сосудов лежит база регулировки А. VEGF – мощнейший индуктор ангиогенеза в целом ряде опытных моделей in vivo [17]. Он представляет собой гомодимерный, высокогликолизированный, митогенный белок, предназначенный для эндотелиальных клеток. Большинство ученых считают, что VEGF взаимодействует с цитокинами, которые имеют сенсоры с протеолитическими ферментами и растворимые антагонисты. Они, взаимодействуя, регулируют высвобождение цитокинов из внеклеточного матрикса [18]. Группа VEGF включает в себя ряд образцов: EGF-A способствует наращиванию проницаемости сосуда; VEGF-B регулирует спад внеклеточного матрикса, адгезии и клеточного передвижения; VEGF-C и VEGF-D играют главную роль в регуляции лимфатических кровеносных сосудов; так же VEGF-E является вирусным гомологом и способствует плацентарному подъему (PIGF). Он отвечает за построение сосудистой сети в плаценте (рис. 2).
Рис. 2. Семейство VEGF
Совместное взаимодействие VEGF с рецепторами VEGFR-2 подключает активацию всех имеющихся сигнальных путей каскада. Два таких примера показаны на рисунке. Такое взаимодействие приводит к выживанию клетки и проницаемости сосудов, путем поглощения генов, которые способствуют пролиферации и передвижению клеток эндотелия. К примеру, связывание VEGF с сенсором VEGFR-2 приводит к димеризации сенсора с дальнейшей активацией пути синтеза ДНК и подъема клеток PLC-PKC-Raf-MEK-митогенактивированной белковой киназы (MAPK), а еще дальнейшей инициацией синтеза ДНК и подъема клеток, за это время как активация фосфатидилинозита 3’-киназы (PI3K)-Akt-way обязана прирастить подъем эндотелиальных клеток. Передвижение клеток и изменения в цитоскелете актина вызывает ген Src. Рецепторы VEGF располагаются на поверхности эндотелиальной клетки, но не теряют способности стать внутриклеточными [19]. Они являются участниками процесса приспособления клетки для выживания. VEGFR-2 представлен полноразмерным сенсором, прикрепляющимся к плоскости клеточки. VEGF-CcVEGFR-3 связывание опосредует лимфангиогенез. VEGF имеет возможность вязать рецепторный нейропилин (NRP), который имеет возможность работать как coreceptor с VEGFR-2 (горизонтальная стрелка 1) и имеет возможность регулировать A [20]. Комбинированное внедрение VEGF в экспериментальных исследовательских работах, а еще фактора стабилизации сосудов ангиопоэтин-1, и тромбоцитов FR (PDGF-BB) в композиции с FGF-2 вызывает возникновение сосудистой сети, которая продолжает оставаться размеренной сквозь 1 год впоследствии остановки данных моментов [21, 22]. Иным раскладом к более равновесной стимуляции ангиогенеза, вполне вероятно, может быть создание генетических структур, основанных на консистенции геномной ДНК, а еще cDNA-форм гена VEGF, имеющие в для себя экзоны и интроны в иной области слияния. Другая стратегия имеет возможность основываться на применении генов, которые кодируют моменты, которые активируют поглощение множества ангиогенных молекул [23]. Фактором, обеспечивающим больше обобщенные сигналы ангиогенеза, имеет возможность быть активатор плазминогена наподобие урокиназы (urokinase) – протеаза серина, ведущей регулятор внеклеточного протеолиза, а еще моделирование тканей. Урокиназа инициирует составление капилляров и артериол и наращивает скопление макрофагов в зоне периинфаркции, сокращаяет величину возникших, увеличивает васкуляризацию, готовит более скорым восстановление перфузии и не позволяет развиваться некрозу в ишемической конечности [24].
Заключение
Дефицитность кровоснабжения приводит к гипоксии по причине понижения диффузии воздуха. Гипоксия считается более необходимым катализатором A, есть активация метаболических стезей, которые индуцируются белками, этими как момент гипоксии 1, собственно, что приводит к наращиванию экспрессии проангиогенных моментов, этих как моменты подъема VEGF и фибробластов [25]. Впоследствии подключения А случается перелом соединительнотканной пластинки и внеклеточного матрикса (ВКМ), вследствие увеличенной энергичности матрикса. Далее клетки организуются в канальцы, с просветами образуя свежую капиллярную металлопротеиназу (ММП). Во время сего процесса притягиваются перициты, которые прикрепляются к свежим кровеносным сосудам и стабилизируются. До сего этапа созревания единство и выживание эндотелиальных клеток находятся в зависимости от VEGF1.13. Другой методикой экспрессии считается втягивание воспалительных клеток, цитокинов ФНО (фактор некроза α-опухолей) и ИЛ-1, которые в собственную очередь индуцируют продукцию обычных клеток. Подъем микрососудов продолжается до тех пор, пока же не достигнется очень максимально вероятная близость к клеточке. Впоследствии А. перебегает в стадию спокойствия (в дамской репродуктивной системе ангиогенный цикл считается исключением). Каждое наращивание массы ткани сопрягается с уноваскуляризацией, которая поддерживает необходимую плотность сосудов. Например, А. индуцируется, когда метаболическая надобность выше перфузионную дееспособность имеющих место быть сосудов. По-видимому, устройство данной адаптивной реакции заключается в том, собственно, что условный недостаток воздуха приводит к ужесточению ангиогенных стимулов.
Читайте также:
- Методика сегментарного заполнения бронхов. Катетеры Метра для бронхографии
- Диагностика столбняка. Микробиологическая диагностика столбняка. Выявление столбняка. Биологическая проба при столбняке.
- Диагностика болезни Менетрие. Париетография при болезни Менетрие
- Лучевая диагностика болезни Вильсона-Коновалова по печени
- Рентгенограмма, КТ при аномалии Клиппеля-Фейля
