Механизм действия фосфопротеинфосфотаз на действие киназ
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
• Фосфопротеинфосфатазы аннулируют действие протеинкиназ
• Фосфопротеинфосфатазы могут дефосфорилировать фосфосерин/треонин, фосфотирозин или все три остатка
• Обычно специфичность фосфопротеинфосфатаз обеспечивается образованием специфических белковых комплексов
Фосфорилирование белков аннулируется действием фосфопротеинфосфатаз. Эти ферменты обладают выраженной специфичностью и характеризуются различными способами регуляции активности. В соответствии со специфичностью и степенью гомологии первичной структуры фосфопротеинфосфатазы подразделяются на две большие группы: белок-серин/треонин фосфатазы и белок-тирозин фосфатазы.
Активность большинства белок-серин/треонин фосфатаз регулируется за счет их связывания с другими белками. Основным фактором, определяющим субстратную специфичность, является характер их локализации. Фосфопротеинфосфатазы 1 (РР1) связываются с большим количеством регуляторных субъединиц, которые специфическим образом направляют их к определенным органеллам. Одна из субъединиц (известная как субъединица G), например, принимает участие в связывании с гликогеном. Взаимодействие с этой субъединицей регулируется за счет фосфорилирования. Ингибиторы, представляющие собой небольшие белки, могут подавлять активность РР1.
Фосфопротеинфосфатазы 2А (РР2А) содержат каталитическую субъединицу, каркасную субъединицу и одну из множества регуляторных субъединиц. Регуляторная субъединица модулирует активность и локализацию фосфатаз. Некоторые вирусы изменяют свойства клетки, поскольку в результате инфекции изменяется активность фосфатаз. Например, в клетках, трансформированных вирусом SV40, экспрессируется вирусный белок, называемый малый t-антиген вируса. Этот белок вытесняет регуляторную субъединицу фосфатазы РР2А и изменяет активность и субклеточную локализацию фермента. Вместе с тем, такие природные токсины, как окадаевая кислота, каликулин и микроцистин, как in vitro, так и в клетках, в различной степени ингибируют РР2Аи РР1.
Еще одна из основных белок-серин/треонин фосфатаз называется кальцинеурином (она также обозначается как фосфопротеинфосфатаза 2В) и регулируется Са 2+ калмодулином. Наряду с участием во многих событиях, эта фосфатаза играет существенную роль в развитии сердечной мышцы и в активации Т-клеток. Основной механизм действия иммунодепрессантов, циклоспорина и FK506 заключается в ингибировании кальцинеурина.
Тирозинфосфатазы (РТР) представляют собой цистеин-зависимые ферменты, которые для гидролиза фосфоэфирных связей в своих субстратах используют консервативную последовательность, Cys-Xaa-Arg. У человека РТР кодируются более чем 100 генами и подразделяются на четыре семейства: фосфотирозин-специфические фосфатазы, фосфатазы Cdc25, фосфатазы, обладающие двойной специфичностью (DSP), и низкомолекулярные фосфатазы.
Тридцать восемь РТР проявляют высокую специфичность по отношению к фосфотирозиновым остаткам в субстратах. Некоторые из фосфатаз, селективных к фосфотирозину, представляют собой трансмембранные белки, в то время как другие связаны с мембранами. Основная функция РТР состоит в аннулировании результата деятельности тирозинкиназ; однако функция некоторых из них заключается в передаче сигналов тирозинкиназы. Например, тирозинфосфатаза SHP2 (которая также обозначается SHPTP2) связывается с определенными рецепторами тирозинкиназы посредством SH2 домена, и сама фосфорилирует свой тирозин, тем самым создавая сайт связывания для адаптерного белка, Grb2, содержащего SH2 домен, что приводит к активации Ras.
Фосфатазы Cdc25 узнают представителей семейства циклин-зависимых киназ (CDK) в качестве субстратов, и играют критическую роль в увеличении активности CDK на ключевых участках клеточного цикла. Подобно киназам с двойной специфичностью, обладающие двойной специфичностью фосфатазы проявляют это свойство для ограниченного набора субстратов. Некоторые DSP дефосфорилируют МАРК; эти DSP называются фосфатазы МАР киназы, или МКР. Некоторые из них участвуют во входе МАРК в ядро и в выходе фермента из ядра. Некоторые МКР кодируются генами раннего ответа, продукты которых активны в начале вхождения клетки в цикл.
Субстраты представителей других семейств РТР, такие как супрессор опухолевого роста PTEN, включают фосфоинозитиды, представляющие собой фосфолипиды, содержащие фосфорилированный остаток инозита, которые выполняют функции вторичного мессенджера. Удаление фосфатной группы приводит к инактивации вторичного мессенджера. Пока остается неясным, активны ферменты этого семейства по отношению только к фосфоинозитидам или также используют остаток фосфотирозина в качестве субстрата.
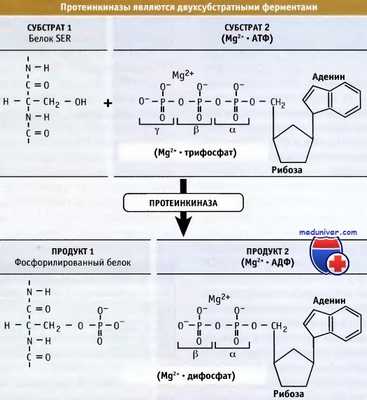
Протеинкиназы переносят у-фосфатную группу от АТФ на остатки серина, треонина или тирозина в белковых субстратах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Механизм действия фосфопротеинфосфотаз на действие киназ
• MAPK активируются при фосфорилировании Tyr и Thr
• Необходимость фосфорилирования обоих остатков обусловливает существование порога сигнала
• Пути передачи сигналов через EKR1/2 МАРК обычно регулируются с участием Ras
Протеинкиназы, активируемые митогенами (MAPK), обнаружены у всех эукариот. Они представляют собой наиболее распространенные многофункциональные протеинкиназы, участвующие в процессах, регулирующих реакцию клетки на воздествие многих лигандов и других стимулов.
Как показано на рисунке ниже, МАРК активируются протеинкиназным каскадом, содержащим, по меньшей мере, три последовательно действующих протеинкиназы. Активация МАРК катализируется МАРК киназой (МАР2К), которая, в свою очередь, активируется за счет фосфорилирования киназы МАРК киназы (МАРЗК). МАРЗК активируются по разным механизмам, включающим фосфорилирование под действием МАР4К, олигомеризацию и связывание с такими активаторами, как небольшие G-белки.
МАР2К активируются при фосфорилировании двух остатков Ser/Thr; затем МАР2К активируют МАРК, фосфорилируя оба остатка Tyr и Thr. Каждая МАР2К фосфорилирует ограниченный набор МАРК и неактивна (или почти неактивна) в отношении других субстратов. Высокая специфичность МАР2К служит способом изоляции МАРК от активации этой киназы при неподходящих сигналах. Для проявления максимальной ферментативной активности МАРК необходимо фосфорилирование Tyr и Thr.
Исследования МАРК ERK2 прояснили существо процессов, играющих важную роль в увеличении активности фермента, и индуцированных фосфорилированием. Изменения конформации включают формирование нативной структуры у петли активации, которая улучшает позиционирование субстрата и позволяет перегруппировку каталитических остатков. Это наиболее очевидно для перегруппировки спирали С, которая содержит остаток Glu, участвующий в переносе фосфатных групп.
При смещении каскада от МАР3К к МАР2К происходит амплификация, поскольку МАР2К гораздо более многочисленны, чем МАР3К На этапе МАР2К — МАРК сигнал также может амплифицироваться, если МАРК находится в избытке по сравнению с МАР2К Вместе с тем, фосфорилирование МАРК под действием МАР2К, которое происходит по остаткам Tyr и Thr, приводит к кооперативной активавции МАРК.
Это представлет собой еще один механизм, в дополнение к описанным для РКА и калмодулина, который позволяет создать порог и обеспечивает кооперативное связывание компонентов сигнальных процессов в узком диапазоне входного сигнала. Такой многоэтапный каскад обеспечивает множественные сайты для модулирующих сигналов, поступающих по другим путям.
Важную роль также играет стабильность взаимодействий между отдельными компонентами систем передачи сигналов. Субстраты МАР2К и МАРК, а также МАРК фосфатазы обычно содержат основную/гидрофобную докинг-последовательность, которая взаимодействует с кислыми остатками и связывается в гидрофобной бороздке каталитического домена МАРК Для эффективной активации МАРК каскада в клетках, необходимы дополнительные компоненты, включающие каркасные структуры, которые обычно также обладают дополнительными функциями.
Известны три каркасных белка, каждый из которых связывает два или более компонентов трех основных МАРК каскадов: ERK1/2, JNK1-3, а также р38а, b, у и δ.
Сигнальный путь с участием ERK1/2 регулируется большинством поверхностных клеточных рецепторов, включая рецепторы тирозинкиназы, GPCR и другие. Рецепторы PDGF, подобно большинству других, активируют каскад ERK1 /2 посредством Ras. PDGF стимулирует аутофосфорилирование своего рецептора и последующую ассоциацию эффекторов со своим цитоплазматическим доменом.
В ответ на PDGE, ERK1/2 активирует клеточную пролиферацию и дифференцировку за счет фосфорилирования мембранных ферментов и белков, участвующих в формообразовании и подвижности клеток, а также концентрируется в ядре, где осуществляет фосфорилирование регуляторных факторов, контролирующих транскрипцию.

Процессы передачи сигналов с участием МАРК регулируются группой различных механизмов, которые часто включают такие компоненты, как адаптеры, небольшие G-белки и МАР4К.
Все эти молекулы нарушают активность МАР3К. В зависимости от локализации и структурной роли, МАР3К регулируют одну или более МАР2К.
Киназы МАР2К обнаруживают большую избирательность по отношению к типу МАРК.
Для МАРК характерно существование перекрывающихся и уникальных субстратов.
Эти киназы участвуют в сигнальных каскадах, обеспечивающих разнообразные клеточные реакции.
Механизм действия и применение ингибиторов протеинкиназ
• Ингибиторы протеинкиназ применяются для исследования процессов передачи сигнала и как лекарства
• Ингибиторы протеинкиназ обычно блокируют сайт связывания АТФ
Для исследования функций протеинкиназ используется много ингибиторов. Важная роль, которую эти ферменты играют в патогенезе различных заболеваний, позволяет использовать их в качестве мишеней при скрининге ингибиторов протеинкиназ.
Большинство фармакологических ингибиторов протеинкиназ конкурируют с АТФ за сайт связывания в молекуле фермента. Поскольку в клетке имеется огромное количество белков, способных связывать АТФ, всегда существуют сомнения относительно специфичности ингибитора не только в отношении других протеинкиназ, но и относительно других белков, связывающих нуклеотид.
Эта проблема с большей или меньшей остротой возникает при скрининге групп химических соединений, при структурной модификации известных ингибиторов, и при исследовании их влияния на активность различных протеинкиназ.
Например, многие ингибиторы РКА или РКС эффективны в отношении некоторых других представителей семейства AGC киназ. Хотя существует множество фармакологических ингибиторов, эффективных в отношении РКА, наиболее селективные из них являются производными небольшого природного белка, известного под названием PKI или ингибитор Уэльша.
В исследованиях in vitro и при скрининге были отобраны гораздо более селективные ингибиторы для МАР2К, являющейся компонентом процесса с участием ERK1/2. Эти ингибиторы в меньшей степени эффективны в отношении других протеинкиназ, поскольку они, вероятно, не связываются с АТФ-сайтом. Среди ингибиторов, перспективных с точки зрения использования в клинике, существенный интерес представляют соединения, являющиеся блокаторами рецептора EGF и некоторых других протеинтирозинкиназ.
Протеинкиназы переносят у-фосфатную группу от АТФ на остатки серина, треонина или тирозина в белковых субстратах. Структуры нефосфорилированной, неактивной формы МАРК, ERK2, и фосфорилированной, активной ERK2.
ERK2 обладает типичной структурой протеинкиназы. Меньший, N-концевой домен состоит в основном из b-листов, а более крупный С-концевой домен имеет структуру а-спирали.
Активный сайт формируется на границе двух доменов.
Петля активации выходит из активного сайта и после фосфорилирования остатков Tyr и Thr повторно скручивается,
что изменяет положение аминокислотных остатков в активном сайте. АТФ (не показан) связывается с внутренней частью активного сайта;
связывание белковых субстратов с поверхностью С-концевого домена облегчается реорганизацией петли активации.
Структуры построены по данным Protein Data Bank files 1ERK и 2ERK.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
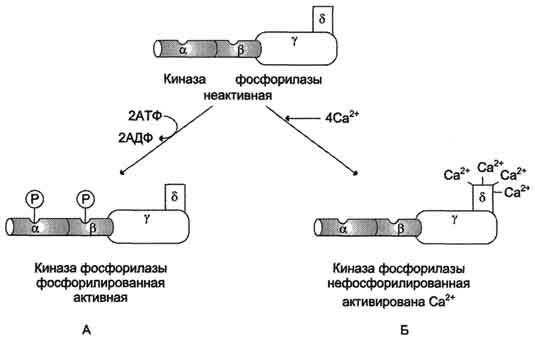
Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. Фп-фосфатаза (гр) - фосфопроте-инфосфатаза гранул гликогена. Пк (pp90s6) - протеинкиназа, активируемая инсулином.
В период пищеварения преобладает влияние инсулина, так как инсулинглюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
•снижает уровень цАМФ в клетках, фосфорилируя (опосредованно через Ras-путь) и тем самым активируя протеинкиназу В (цАМФ-независимую). Протеинкиназа В, в свою очередь, фосфорилирует и активирует фосфодиэстеразу цАМФ - фермент, гидролизующий цАМФ с образованием АМФ. Механизм влияния инсулина на уровень цАМФ в клетке подробнее будет изложен в разделе 11;
•активирует (через Ras-путь) фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
•индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке. Следует напомнить, что регуляторным фактором в метаболизме гликогена является также величина Кm глюкокиназы, которая много выше, чем Кm гексокиназы. Смысл этих различий понятен: печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы.
Всё это вместе приводит к тому, что инсулин одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, переключая процесс мобилизации гликогена на его синтез.
Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
В печени существует и аллостерическая регуляция гликогенфосфорилазы, обеспечивающая внутриклеточные потребности в глюкозе, но гормональные сигналы имеют приоритет над внутриклеточными и преследуют другие физиологические цели. Ранее (см. раздел 6) рассматривалось значение изменения в клетке уровней АТФ, АДФ и АМФ как показателя, отражающего потребности клетки в энергии. Замедление утилизации АТФ сопровождается снижением активности гликогенфосфорилазы и уменьшением скорости распада гликогена. Напротив, увеличение расходования АТФ ведёт к повышению уровня АМФ, активации гликогенфосфорилазы и ускорению распада гликогена. АТФ и АМФ являются аллостерическими эффекторами по отношению к гликогенфосфорилазе. Существует также и метаболический контроль активности гликогенфосфорилазы. Так, при повышении концентрации глюкозо-6-фосфата активность этого фермента в клетках печени снижается.
Вопрос 45. Роль аденилатциклазы, протеинкиназы и фосфопротеинфосфатазы в регуляции процессов распада и синтеза гликогена.
Роль аденилатциклазы, протеинкиназы, фосфопротеинфосфотазы. Аденилатциклаза – активация этого фермента приводит к усилению распада гликогена и одновременно к подавлению его синтеза. Протеинкиназы – внутриклеточный фермент. В отсутствие цАМФ протеинкеназа неактивна. В присутствие активен. Протеинкеназа играет центральную роль в гормональной регуляции синтеза и распада гликогена в печени. Фосфопротеинфосфотаза – синтез гликогена обеспечивает скорость мобилизации гликогенов.
Вопрос 46. Физиологическое значение резервирования и распада гликогена.
Физиологическое значение распада гликогена. За счет распада гликогена печень поставляет в кровь около 300гр глюкозы за сутки, из них примерно 2/3 из гликогена.
Вопрос 47. Гликогенозы и агликогенозы, причины возникновения, биохимические нарушения.
Глюкогенез и агликогенез. Гликогенез – если нарушена мобилизация гликогена, то гликоген накапливается в клетках в больших количествах, что может привести к разрушению клеток. Такие болезни называются гликогенозами. Известно несколько типов гликогенезов (болезнь Кирля, Кори, Помпэ, Хорсэ). Симптомы гликогенеза: увеличение печени, мышечная слабость. Агликогенез – если нарушен синтез гликогена, то содержание гликогена в клетках понижена. Эти формы болезни называются агликогенозы. Характерный симптом гипоглюкоземия натощак.
Вопрос 48. Особенности обмена глюкозы в разных органах и клетках (эритроцитах, мозгу, жировой ткани, печени.
Особенности обмена глюкозы в разных органах. 90% глюкозы окисляется дихотомически. Апотомический распад восстанавливает НАДФ и рибоза для образования нуклеиновых кислот. Эритроциты – все процессы анаэробные. Гликолиз идет на поддержание формы эритроцитов и трансмембранный перенос. Печень - распад и синтез гликогена поддержание уровня глюкозы в крови. 2/3 дихотомически, 1/3 апотомический. Жировая ткань – 30% идет на аэробное окисление. Восстанавливается НАДФ на синтез липидов.
Вопрос 49. Протеогликаны, строение, роль.
Протеогликаны – высокомолекулярные соединения состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Вопрос 50. Гликозаминогликаны, представители, строение, физиологическая роль. Глюкозаминогликаны – линейные гетерополисахаридные построенные из повторяющихся дисахаридных единиц. В состав входят гексуроновые кислоты и производные глюкозамина или галактозамина. Представители: гиалуроновая кислота – построенная из повторяющихся единиц, включающих глюкуроновую кислоту и N-ацетилглюкозамин. Хондроитинсульфат состоит из глюкуроновой кислоты и N-ацетил галактозамина. Дераматосульфаты. Гепарин - участвует в свертываемости крови. Роль – строительные компоненты межклеточного матрикса, формирует тургор ткани, препятствует распространению патогенных микроорганизмов.
Вопрос 51. Функции и особенности обмена гликозаминогликанов. они являются структурными компонентами межклеточного матрикса, протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса, все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей, протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов, гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах, гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках, кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы, гепарин – антикоагулянт, гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических
Читайте также:
