Механизм импорта белка в митохондрии
Добавил пользователь Дмитрий К. Обновлено: 16.01.2026
Транспорт белков в органеллы клетки
Основные положения:
• Транспорт белков в органеллу происходит с помощью рецепторных комплексов, которые встроены в ее мембрану
• Белки, поступающие в ядро, митохондрии и хлоропласты, после синтеза выходят в цитозоль, а затем связываются с органеллой
• Белки, поступающие в эндоплазматичекий ретикулум, переносятся на рецепторный комплекс мембран ЭПР во время синтеза
Для всех органелл, окруженных мембранами, существует одна общая проблема: каким образом получить белок, который образуется в цитозоле? При этом белок должен быть локализован либо в мембране, либо пройти через нее. Прохождение гидрофильного белка через гидрофобную мембрану невозможно из-за существования значительных энергетических препятствий.
Каждая органелла выработала собственное решение этой общей проблемы. В ее мембране присутствуют белковые гидрофильные поры, через которые и осуществляется транспорт, так что белку не нужно взаимодействовать с гидрофобной мембраной. Строение самой поры и природа взаимодействия с транспортируемым белком зависят от органеллы.
Ядерные поры представляют собой массивные структуры со сложным транспортным аппаратом, который определяет, какие белки должны транспортироваться в ядро, а какие выходить из него. Белки накапливаются на одной стороне оболочки, проходят через пору и выходят с другой стороны (см. рисунок Белки избирательно транспортируются в ядро через ядерные поры). Пора проходит через обе мембраны ядерной оболочки, и созревший белок транспортируется через всю пору.
В наружной и внутренней мембранах таких органелл, как митохондрии и хлоропласты, содержатся белки, функция которых заключается в транспорте в органеллу импортируемых белков. Экспорта белков из этих органелл не происходит. Белки образуются на рибосомах в цитоплазме и выходят в цитозоль. В их структуре находятся специфические последовательности, которые взаимодействуют с рецепторами, находящимися в мембране органеллы (импорт белков в митохондрии начинается с узнавания сигнальной последовательности на внешней мембране).
На рисунке ниже показано, что проходящий через мембрану канал очень узкий, и чтобы пройти через него, транспортируемый белок должен вначале развернуться, а на другом конце приобрести зрелую конфигурацию. Это требует активного участия дополнительных белков — шаперонов, контролирующих сворачивание белка (способность к свертыванию и развертыванию белковых структур является характерной особенностью всех клеток). Интересное исключение составляют пероксисомы, у которых существует система импорта белков, находящихся в зрелой свернутой конфигурации (белки сворачиваются перед импортом в пероксисомы).
Эндоплазматический ретикулум, аппарат Гольджи, эндосомы и плазматическая мембрана представляют собой отдельные органеллы, которые, однако, используют одну и ту же систему транспорта и адресации белков. Процесс начинается с этапа, когда вновь образующийся белок, который находится еще в цитозоле на рибосомах, связывается посредством специфической «сигнальной последовательности» с рецепторами на поверхности эндоплазматического ретикулума (белки вступают на путь секреции путем переноса через мембрану ЭПР).
Это связывание приводит к входу белка в канал, а рибосома в течение продолжающегося синтеза остается связанной с мембраной эндоплазматического ретикулума. По мере синтеза белок поступает в канал.
С этого момента белок может или пройти через мембрану в люмен эндоплазматического ретикулума, или начать в нее интегрироваться. Если место конечной локализации белка находится вне эндоплазматического ретикулума, в одной из цистерн аппарата Гольджи, в эндосоме, или в плазматической мембране (или он должен секретироваться через плазматическую мембрану во внешнюю среду), то белок узнается по специфической последовательности аминокислот и далее транспортируется за счет процесса, известного как траффик (перемещение) белка (белки транспортируются через ЭПР и аппарат Гольджи).
Для белков, локализованных в пределах мембраны, процесс носит более сложный характер. Связывание белков с мембраной осуществляется через те же поры, но вместо прохождения по каналу белок транспортируется в латеральном направлении к своему местонахождению в мембране. Механизм этого процесса недостаточно понятен, однако предполагается, что происходит временное разрушение поры для того, чтобы гидрофобные области белка могли связаться с окружающими липидами.
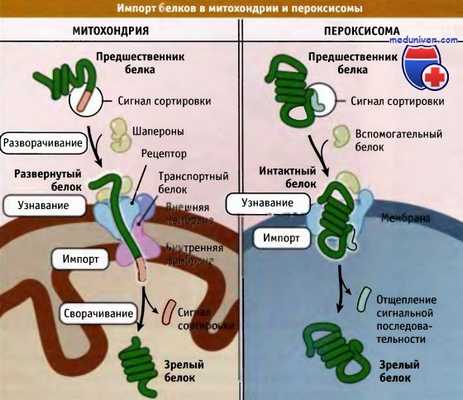
Белки, которые поступают в митохондрии,
должны быть в развернутом состоянии; напротив,
в пероксисомы транспортируются интактные белки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Механизм импорта белка в митохондрии
• Клетки эукариот обладают развитой системой внутренних структур, окруженных мембранами, которые называются органеллами
• Каждая органелла обладает уникальным составом (глико)протеинов и (глико)липидов и выполняет определенный набор функций
• Каждая органелла содержит один или несколько компартментов, ограниченных мембранами
• Органеллы выполняют свои функции автономно или в группах
• При эндоцитозе и экзоцитозе переносимые белки (белки карго) транспортируются между компартментами через транспортные везикулы, которые образуются отпочковыванием от поверхности органеллы и затем сливаются с мембраной-мишенью акцепторного компартмента
• Транспортные везикулы могут избирательно включать переносимый материал и исключать те компоненты, которые должны оставаться в органелле, из которой везикулы образовались
• Селективное включение в везикулы обеспечивается сигналами, присутствующими в первичной структуре белка или в углеводной структуре
• Транспортные везикулы содержат белки, которые направляют их к местам назначения и связывания. В дальнейшем везикулы сливаются с акцепторным участком мембраны
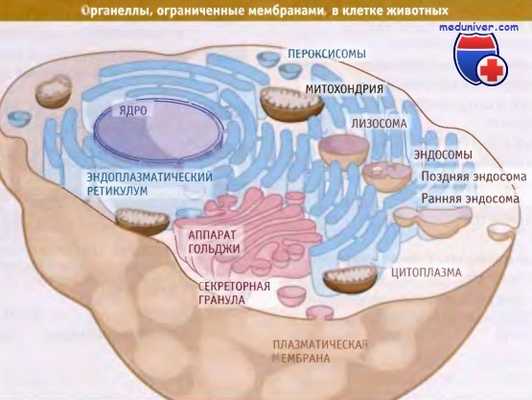
Компартменты, ограниченные мембранами в типичной клетке животных.
Одной из характерных особенностей эукариотической клетки является присутствие в ней развитой системы внутренних структур, окруженных мембранами, которые называются органеллы. Для клеток эукариот характерно присутствие мембран, разделяющих их внутреннее содержимое на функционально-различные компартменты, тогда как все клетки живых организмов обладают наружной двухслойной мембраной.
Одно из преимуществ компартментализации состоит в том, что клетка имеет возможность создавать необходимое окружение для выполнения функций, требующих определенного химического состава среды.
На проиллюстрировано строение и разнообразие органелл, имеющих мембрану, которые обычно присутствуют в эукариотической клетке (в данном случае в типичной животной клетке). Каждая органелла содержит один или несколько компартментов. Например, эндоплазматический ретикулум (ЭПР) представляет собой один компартмент; напротив, аппарат Гольджи состоит из нескольких окруженных мембранами компартментов, обладающих определенными биохимическими функциями.
Для митохондрии характерны два компартмента, матрикс и межмембранное пространство, содержащие набор определенных макромолекул.
Цитозоль может считаться одним компартментом, ограниченным плазматической мембраной и находящимся в контакте с наружной частью мембраны всех внутриклеточных органелл. Цитоплазма состоит из цитозоля и органелл. Аналогичным образом, нуклеоплазма ограничена внутренней ядерной мембраной.
Каждая органелла содержит уникальный набор белков (как мембранных, так и растворимых), липидов и других молекул, необходимых для выполнения ее функций. Некоторые липиды и белки ковалентно связаны с олигосахаридами. По мере роста и деления клеток должны синтезироваться их новые компоненты, необходимые для роста, деления и окончательного распределения внутриклеточного материала между двумя дочерними клетками. При дифференцировке и развитии клетки, а также в ответ на воздействие таких внешних факторов, как стресс, происходит синтез компонентов органелл.
Однако компоненты не всегда образуются в той органелле, где они функционируют. Обычно различные макромолекулы образуются в сайтах, специально предназначенных для их синтеза. Например, большинство белков образуются на рибосомах цитозоля, который является оптимальной средой для функционирования рибосом и синтеза белка.
Возникает следующий вопрос: каким образом компоненты органелл попадают в места их функционирования? С начала 1970-х гг. этот вопрос являлся центральным в клеточной биологии. Как следует из рисунке ниже, существует, по крайней мере, восемь основных типов органелл, каждая из которых состоит из сотен или тысяч различных белков и липидов.
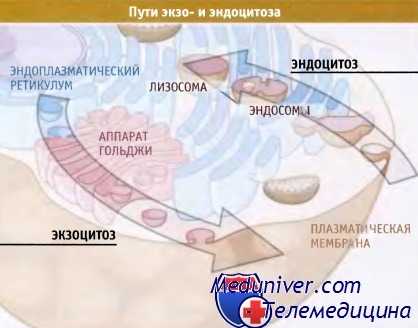
Экзоцитоз и эндоцитоз.
В экзоцитозе участвуют эндоплазматический ретикулум (включая ядерную оболочку)
и аппарат Гольджи (представлена одна стопка цистерн).
Эндоцитоз происходит с участием ранних и поздних эндосом и лизосом.
Все эти молекулы должны транспортироваться в органеллы, в которых они выполняют свои функции. Большинство белков образуется в цитозоле, и поэтому возникает вопрос: как они доставляются в соответствующие органеллы или же выходят из клетки, если принадлежат к секретируемым белкам? Во многих случаях ответом на этот вопрос служит наличие в молекуле белка специальных сигналов, обычно называемых сигналами сортировки или сигналами адресования. Они представляют собой короткие последовательности аминокислот, присутствующие в первичной структуре тех белков, которые должны быть локализованы не в цитозоле. Каждый адрес назначения белковой молекулы связан с одним или несколькими различными видами сигналов.
Сигналы сортировки узнаются специальными системами клетки по мере продвижения белка к месту назначения. Как показано на рисунке ниже, существует два основных транспортных механизма: экзоцитоз (или секреторный путь) и эндоцитоз, при котором материал (карго) транспортируется из клетки и в клетку соответственно.
Для всех вновь синтезированных белков, предназначенных для секреции из клетки, или для поступления в органеллы путем экзо- или эндоцитоза на мембране ЭПР существует общая точка входа. Сигналами к транслокации белка через мембрану ЭПР служат сигнальные последовательности. В настоящей главе мы рассмотрим сигналы сортировки, которые направляют белки к местам их назначения.
Находясь в ЭПР, белок не может транспортироваться через цитоплазму, и единственным путем его попадания в другие органеллы, окруженные мембранами, является везикулярный транспорт. Транспортные везикулы в основном состоят из белков и липидов и, как говорят, «отпочковываются» от мембраны. После того как везикула отпочковалась, она сливается со следующим компартментом, находящимся на ее пути. Компартмент, из которого возникла везикула, обычно называется донорский компартмент (или исходный компартмент), а компартмент назначения (или целевой) обычно называется акцепторный компартмент.
Транспортные везикулы прямым или непрямым путем переносят белки из ЭПР ко всем остальным компартментам на пути экзо- или эндоцитоза. При эндоцитозе везикулы образуются на плазматической мембране. Эти везикулы транспортируют заключенный в них материал в эндосомы, из которых образуются другие везикулы, переносящие материал в другие компартменты. Таким образом, состав транспортных везикул различается в зависимости от их происхождения и компартмента назначения.
Везикулярный транспорт создает проблему для органелл, с которыми обмениваются везикулы. Для нормального функционирования должен поддерживаться определенный внутренний состав органелл. Однако каким образом этого можно достичь, если везикулы все время изменяют этот состав? Масштаб проблемы становится очевидным при расчете эффективности транспорта. По пути эндоцитоза количество мембранных белков и липидов, эквивалентное их общему содержанию в плазматической мембране, способно транспортироваться через органеллы менее чем за час. Если сравнить со временем, необходимым для синтеза новой органеллы (обычно один день), то такая скорость впечатляет.
Решение этой проблемы связано с селективностью транспортного процесса. При отпочковывании в везикулу проходят только те белки, которые необходимо транспортировать. Резидентные белки органеллы в везикулу не попадают. Везикула удерживает эти белки и передает их следующей, находящейся на пути везикуле. Для поддержания гомеостаза между органеллами, по своей природе везикулярный транспорт всегда должен быть двунаправленным, т. е. компоненты донорского компартмента не должны непрерывно переноситься в акцепторный компартмент.
Механизм рециклирования возвращает некоторые компоненты везикул в донорский компартмент для их повторного использования. Поскольку селективность отбора белков несовершенна, специальный механизм утилизации возвращает назад резидентные белки, случайно попавшие в везикулу из донорского компартмента.
При везикулярном транспорте везикула отпочковывается
от мембраны одного компартмента и сливается с мембраной другого компартмента. Пути транспорта белков в типичной животной клетке.
Почти все транспортные потоки могут осуществляться в двух направлениях.
научная статья по теме Импорт белков в митохондрии Химия

Текст научной статьи на тему «Импорт белков в митохондрии»
БИООРГАНИЧЕСКАЯ ХИМИЯ, 2000, том 26, № 9, с. 643-661
ИМПОРТ БЕЛКОВ В МИТОХОНДРИИ
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН; * Московский государственный университет им. М.В. Ломоносова, биологический факультет, кафедра биоорганической химии, 119899, Москва, Воробьевы горы Поступила в редакцию 13.03.2000 г. Принята к печати 10.04.2000 г.
Обзор посвящен импорту процессируемых белков-предшественников в матрикс митохондрий, обсуждается также и импорт белков-переносчиков во внутреннюю мембрану митохондрий. В обзоре рассмотрены пост- и котрансляционные теории импорта, закономерности строения пресиквенсов, влияние цитозольных факторов на импорт белков-предшественников; суммированы данные по строению транслоказ белков-предшественников внешней (ТОМ-комплекс) и внутренней (Т1М-ком-плекс) мембран митохондрий и обсуждены существующие модели импорта белков-предшественников этими транслоказами.
Ключевые слова: импорт белка; митохондрии, транслоказы белков-предшественников митохондрий; ТОМ-комплекс; Т1М-комплекс.
Митохондрии - органеллы, присутствующие почти во всех эукариотических клетках. Наиважнейшая функция митохондрий - синтез АТР, сопряженный с окислительным фосфорилирова-нием.
Митохондрия состоит из четырех субкомпарт-ментов: внешней мембраны, проницаемой для небольших (меньше 10 кДа) молекул и ионов; внутренней мембраны, которая непроницаема для большинства ионов, и образует регулярные складчатые структуры (кристы); межмембранного пространства, расположенного между этими двумя мембранами, и матрикса. В матриксе находятся митохондриальная кольцевая ДНК и компоненты, необходимые для транскрипции и трансляции белков, кодируемых митохондриаль-ным геномом. Митохондриальный геном кодирует несколько собственных рРНК и тРНК, а также некоторые белки дыхательной цепи и АТР-азы. В зависимости от вида организма белков, кодиру-
Сокращения: ТОМ-комплекс и TIM-комплекс - транслока-за белков-предшественников внешней и внутренней мембраны митохондрий соответственно; GIP - основная пбра включения; MSF - митохондриальный импортстимулирую-щий фактор; PBF - пресиквенссвязывающий фактор; TF -адресующий фактор; Hsp70 - цитоплазматический белок теплового шока 70; mtHsp70 - митохондриальный белок теплового шока 70; MGE - митохондриальный шаперон (гомолог GrpE); МРР - митохондриальная матриксная пеп-тидаза процессинга; MIP - митохондриальная промежуточная пептидаза процессинга; p-FiATP-аза - (3-субъединица H+-F0F|ATP-a3bi; CoxIV - субъединица IV цитохром-с-ок-сидазы; Д\|/ - трансмембранная разность электрохимических потенциалов.
емых в митохондриях, может быть от 8 до 16. Как правило, все эти белки высокогидрофобны и локализованы на внутренней мембране митохондрий со стороны матрикса. В целом же рост и функционирование митохондрии невозможны без импорта белков, кодируемых ядерным геномом и синтезированных на цитоплазматических рибосомах (так называемых белков-предшественников, в англоязычной литературе "preproteins" или "precursors").
Импорт кодируемых ядерным геномом белков в митохондрии - сложный мультистадийный процесс (см. обзоры 2). Наряду с основным направлением импорта белков - в матрикс митохондрий - существуют пути импорта белков в другие митохондриальные субкомпартменты. В данном обзоре в основном будет рассмотрен импорт белков-предшественников в матрикс митохондрий.
КО- И ПОСТТРАНСЛЯЦИОННАЯ ТЕОРИИ ИМПОРТА КОДИРУЕМЫХ ЯДЕРНЫМ ГЕНОМОМ БЕЛКОВ В МИТОХОНДРИИ
В настоящее время существуют две основные теории транслокации предшественников кодируемых ядерным геномом белков в митохондрии: ко- и посттрансляционная.
Согласно посттрансляционной теории, связывание белков и включение их в мембрану митохондрий происходит только после окончания процесса их синтеза. Белок-предшественник отделяется от полисомы и лишь после этого импортируется в митохондрию. По мнению Нойперта с соавт., этот механизм является доминирующим [5].
Подтверждающими эту теорию могут служить следующие результаты исследований:
1) показано существование цитоплазматичес-кого пула белков-предшественников, находящихся в солюбилизированной форме, в клетках и сферопластах дрожжей Saccharomyces cerevisiae [6], клетках Neurospora crassa [7] и нейронах головного мозга крысы [8];
2) белки, меченные в процессе их синтеза, обнаруживаются в митохондриях только спустя достаточно длительное время после начала биосинтеза 5;
3) кинетика появления в митохондриях белков-предшественников варьирует для разных белков [5, 7];
4) ингибирование синтеза ряда белков цикло-гексимидом не сопряжено по времени с прекращением их импорта в митохондрии [7, 9];
5) синтезированные in vitro белки-предшественники при добавлении их к изолированным митохондриям могут успешно импортироваться [5,9,10];
6) цитозольные белковые факторы, такие, как митохондриальный импортстимулирующий фактор (MSF) 13, пресиквенссвязывающий фактор (PBF) [12,14], адресующий фактор (TF) [15,16] и цитозольный шаперон Hsp70 [12, 17, 18] стимулируют импорт белков-предшественников.
Согласно котрансляционной теории, импорт белков происходит одновременно с их синтезом, т. е. в процессе элонгации. Вернер с соавт. считают именно этот механизм основным [19]. В качестве подтверждения котрансляционной теории ее сторонники приводят следующие наблюдения:
2) только 1/3 рибосом, ассоциированных с митохондриями, удаляется обработкой раствором высокой ионной силы [21, 22];
3) связывание рибосом с митохондриями может иметь GTP-зависимый характер, сходный с
таковым для SRP' -зависимого котрансляционно-го импорта белков-предшественников в шероховатый эндоплазматический ретикулум [23];
4) для некоторых митохондриальных белков-предшественников, кодируемых ядерным геномом, показано, что основная часть их мРНК (60%) содержится именно в ассоциированных с митохондриями полисомах, доля которых составляет 12-18% от общего количества полисом в цитозо-ле [24];
5) импорт некоторых белков-предшественников, синтезирующихся in vitro в лизате клеток дрожжей в присутствии изолированных митохондрий, блокируется циклогексимидом [25]; in vivo также наблюдался этот эффект [26].
В последнее время считается, что в клетке могут реализовываться как ко-, так и посттрансляционная модели импорта [27, 28].
СТРОЕНИЕ ПРЕСИКВЕНСОВ МИТОХОНДРИАЛЬНЫХ БЕЛКОВ-ПРЕДШЕСТВЕННИКОВ
Большинство митохондриальных белков-предшественников, кодируемых ядерным геномом, имеют на А^-конце добавочную последовательность (сигнальный, лидерный, целевой, адресующий пептид или пресиквенс (presequence)), которая в митохондрии удаляется специфическими пептидазами процессинга (рис. 1).
Протяженность пресиквенса варьирует в основном от 15 до 60 а.о. [5]. Пресиквенсы богаты остатками Ala (-14%), Arg (-14%), Ser (-11%) и Thr (у низших эукариот); мало представлены Asp, Glu, Ile, Lys и Pro 31. Было показано, что изменения первичной структуры пресиквенса не играют критической роли до тех пор, пока сохраняется положительный заряд пептида и его способность формировать амфифильную структуру [30, 32].
С-Концевой домен пресиквенса узнается пептидазами матрикса митохондрий и содержит специфические сайты расщепления. Фон Хейне с соавт., проанализировав первичную структуру
Процессируемый белОК-ПреДШесТВеННИК Пресиквенс
Рис. 1. Схема импорта процеееируемых белков-предшественников, кодируемых ядерным геномом, в матрикс митохондрий (согласно [3]). Цифрами обозначены субъединицы ТОМ-комплекса и Т1М-субкомплекса в соответствии с их молекулярными массами, знаком ? - возможные неидентифицированные компоненты Т1М-комплекса. (А) - рецепция белка-предшественника субкомплексом Тот37-Тот70-Тот72; (Б) - рецепция белка-предшественника субкомплексом Тош20-Тош22.
большого числа пресиквенсов митохондриаль-иых белков-предшественников, выделили несколько консервативных последовательностей, которые находятся в непосредственной близости от места расщепления пептидазами процессинга (табл. 1) [29, 36]. Наиболее консервативен мотив Arg -3. Последовательность Arg -2 узнается матриксной пептидазой процессинга (МРР, mitochondrial matrix processing peptidase) и митох
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
• Митохондрии обладают внутренней и внешней мембранами, в каждой из которых присутствует транслокационный комплекс
• Импорт белков в митохондрии происходит после завершения трансляции
• Митохондриальная сигнальная последовательность узнается рецептором, расположенным на наружной мембране
• Комплексы ТОМ и TIM физически связаны между собой и при импорте белки непосредственно переходят от одного к другому
• Импорт белков обеспечивается энергией за счет Hsp70 матрикса митохондрий и мембранного потенциала внутренней мембраны
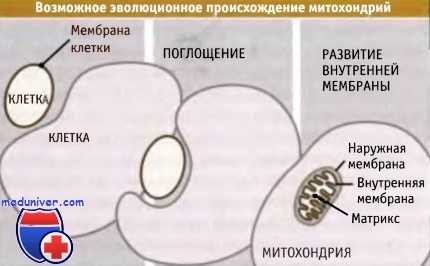
Считается, что митохондрии произошли из клеток прокариот, захваченных другими, более крупными клетками, что привело к развитию между ними симбиотических отношений. В результате таких эволюционных событий, в отличие от других органелл, митохондрия оказалось окруженной двумя мембранами, а не одной. Белки, предназначенные для внутренней части митохондрии (матрикса митохондрий), должны пройти через обе мембраны и через промежуток между ними (межмембранное пространство). Каждая мембрана пронизана специфическим мультиферментным комплексом, который включает канал транслокации.
Комплекс ТОМ (транслоказа внешней мембраны) пронизывает внешнюю мембрану, a TIM (транслоказа внутренней мембраны) — внутреннюю. В специфических точках между мембранами оба комплекса находятся в контакте, но они способны действовать независимо.
Митохондриальные белки переносятся к мембране после окончания трансляции. При этом узнается N-концевая сигнальная последовательность, длина которой обычно составляет 20-50 аминокислот. Эта последовательность обогащена как основными (положительно заряженными), так и гидрофобными аминокислотами. Эти остатки образуют амфипатические спирали, заряженные группы которых размещены с одной стороны, а гидрофобные остатки — с другой.
Сигнальная последовательность митохондриального белка вначале узнается Tom20, интегральным мембранным белком, который является компонентом ТОМ-комплекса. Tom20 связывается с гидрофобной стороной сигнальной последовательности, находящейся в мелкой бороздке (в отличие от глубокой и гибкой бороздки, которая используется SRP при таргетинге в ЭПР).
Как показывает рисунок ниже, взаимодействие между сигнальной последовательностью и Tom20 носит слабый характер и позиционирует положительно заряженные остатки в сигнальной последовательности вне связывающего кармана. Затем взаимодействие сигнальной последовательности с ТОМ-комплексом укрепляется вторым белком, Tom22. Tom22 содержит кислый цитозольный домен, который взаимодействует с остатками основных аминокислот в составе сигнальной последовательности. В основном в результате этих двух взаимодействий белок входит в контакт с комплексом ТОМ. При таргетинге митохондриальные белки находятся в несвернутом состоянии и подготавливаются к транслокации за счет связи с hsp70, находящимся в цитозоле.
Рисунок ниже иллюстрирует транспорт митохондриального белка с участием комплексов ТОМ и TIM. Наряду с белками Tom20 и Tom22, комплекс ТОМ содержит и другие белки. Из них в образовании канала, вероятно, принимает участие белок Тот40. До настоящего времени остаются не вполне понятными ни механизм узнавания транслоцируемого белка в канале, ни воротный механизм канала. Однако после прохода в канал основная сигнальная последовательность субстрата за счет сил электростатического притяжения входит в контакт в межмембранном пространстве с кислыми доменами белков Tom22 и Tim23.
Последний входит в комплекс TIM. Близость Tom22 и Tim23 обеспечивает прохождение белка между этими комплексами, минуя выход в межмембранное пространство. Существуют данные, свидетельствующие о том, что N-концевой участок Tim23 может быть ингегрирован во внешнюю мембрану. Это приводит к тесной ассоциации комплексов TIM и ТОМ и обеспечивает эффективный перенос белковой цепи от одного комплекса к другому. Предполагается также, что важная роль в транспорте предшественников белков от комплекса ТОМ в канал TIM23 принадлежит белку Tim50.
После причаливания цепи в комплексе TIM (который образуется в основном белками Tim23, Tim17 и Tim44; из них два первых, вероятно, образуют канал) она продвигается в матрикс под действием двух сил. Белок mtHsp70, являющийся гомологом в матриксе белка, Hsp70, связывается с каналом посредством взаимодействия с Tim44. Так же как и при посттрансляционной транслокации в ЭПР, mtH-sp70 связывает субстрат по мере его выхода из канала и действует как храповой механизм, или как мотор, а возможно, осуществляет обе функции. Многое здесь зависит от транслоцируемого субстрата.
Транслокации также способствует электрохимический потенциал внутренней мембраны, вероятно, за счет взаимодействия с положительно заряженной сигнальной последовательностью. Потенциал направлен поперек мембраны, что благоприятствует движению положительных зарядов в направлении матрикса. Пока, однако, неизвестно, каким образом потенциал, действительно, способствует транслокации. После входа в матрикс большинство сигнальных последовательностей отщепляются растворимой митохондриальной процессирующей протеазой (МРР).
Так же как и в случае белков, интегрированных в мембрану ЭПР, белки митохондриальной мембраны часто позиционируются с участием внутренней неотщеп-ляемой сигнальной последовательности. Эта последовательность также содержит инструкции по интеграции в виде отдельных участков гидрофобных аминокислот. Каким образом узнаются и интегрируются в одну из двух мембран трансмембранные домены, в общем, неизвестно. Белки, которым необходимо интегрироваться во внутреннюю мембрану, позиционируются в альтернативном транслоконе, состоящем из Tim22, Tim54 и Tim18. Транспорту белка из комплекса ТОМ в этот альтернативный транслокон способствуют небольшие белки, которые называются «Маленькие Тимы», и которые находятся в межмембранном пространстве. Последовательность событий представлена на рисунке ниже. Подробнее об этих процессах почти ничего не известно.
Белки внутренней мембраны, независимо от их кодирования в ядре или в митохондрии, интегрируются с участием белка внутренней мембраны Оха1р. Белки внутренней мембраны, кодируемые в ядре, вначале транслоцируются через обе мембраны в матрикс. Затем от белка отщепляется сигнальная последовательность, за счет которой происходит импорт, и еще одна последовательность направляет белок обратно к внутренней мембране, где она интегрируется с участием Оха1р. Белки, кодируемые митохондриальным геномом, синтезируются рибосомами матрикса, и затем непосредственно интегрируются во внутреннюю мембрану с участием Оха1р. Детали этого процесса пока точно не выяснены.
Идентифицирован еще один транслокон митохондрий, названный «комплекс SAM» (sorting and assembly machinery of the outer membrane complex; сортировочно-сборочный комплекс наружной мембраны). Хотя состав и механизм действия этого комплекса в деталях неизвестны, он, вероятно, благоприятствует транслокации и интеграции белков внешней мембраны, которые пронизывают мембрану b-структурами, а не более обычными а-спиралями. Так же как и комплекс Tim22, для транспорта субстратов из ТОМ канала, комплекс SAM использует «Маленьких Тимов».
Особый интерес представляет вопрос, как белки внутренней мембраны проходят через наружную мембрану и при этом не интегрируются в нее. Такая специфичность может объясняться различиями между трансмембранными доменами белков внутренней и наружной мембран, которые делают белки внутренней мембраны неузнаваемыми комплексом интеграции ТОМ. В то же время, не исключено, что комплекс TIM может узнавать белки внутренней мембраны до того, как они интегрируются во внешнюю мембрану комплексом ТОМ. Пока еще не совсем понятны воротные механизмы, регуляции и координации комплексов ТОМ и TIM. Хотя многие выполняемые ими функции аналогичны функциям транслокона ЭПР, остается неясным, насколько близки механизмы их функционирования.
При формировании спиральной структуры последовательность митохондриального сигнала образует поверхности с основными и гидрофобными свойствами.
Последовательность аминокислот, соответствующая митохондриальному сигналу,
представлена наверху, и та же последовательность, свернутая в спираль, показана справа.
Гидрофобный участок спирали взаимодействует с гидрофобной щелью Tom20; остатки положительно заряженных аминокислот взаимодействуют с кислым доменом Tom22.
Слева показана структура Tom20, связанная с сигнальной последовательностью; гидрофобная поверхность белка выделена желтым цветом. Белок, предназначенный для транслокации в матрикс митохондрии,
узнается на поверхности наружной мембраны и затем проходит между каналами в наружной и внутренней мембранах.
Когда белок достигает матрикса, сигнальная последовательность удаляется.
Необходимая для транспорта энергия поставляется за счет гидролиза АТФ шаперонами матрикса и за счет мембранного потенциала на внутренней мембране.
Белок Tim23 интегрирован в обе мембраны и связывает между собой каналы. Для импорта белков в различные отсеки митохондрий требуются различные пути.
Во многих из них может участвовать комплекс ТОМ, однако для комплексов внутренней мембраны характерна специализация.
Существуют два пути, посредством которых белки могут достигать внутренней мембраны.
Некоторые белки используют комбинированный путь: вначале они транспортируются в матрикс, а потом поступают назад в мембрану.
научная статья по теме НАПРАВЛЕННЫЙ ИМПОРТ МАКРОМОЛЕКУЛ В МИТОХОНДРИИ Биология

Текст научной статьи на тему «НАПРАВЛЕННЫЙ ИМПОРТ МАКРОМОЛЕКУЛ В МИТОХОНДРИИ»
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, 2007, том 41, № 2, с. 216-233
== ОБЩИЕ ПРОБЛЕМЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ =
НАПРАВЛЕННЫЙ ИМПОРТ МАКРОМОЛЕКУЛ В МИТОХОНДРИИ
© 2007 г. П. А. Каменский1, 2, Е. Н. Виноградова3, И. А. Крашенинников1, И. А. Тарасов2*
Московский государственный университет им. М.В. Ломоносова, Москва, 119992 2Французский национальный центр фундаментальных исследований, Страсбург, 67084, Франция 3Институт молекулярной биологии растений Французского национального центра фундаментальных исследований, Страсбург, 67084, Франция Поступила в редакцию 14.09.2006 г.
Принята к печати 13.10.2006 г.
Митохондрии - это многофункциональные органеллы эукариотических клеток, обеспечивающие клетки энергией за счет окислительного фосфорилирования. Они участвуют также в образовании железосерных кластеров, в окислении жирных кислот, в образовании некоторых аминокислот, а также играют важную роль в апоптозе. Митохондрии имеют свой собственный геном, который транскрибируется и транслируется. Однако большая часть макромолекул, функционирующих в митохондриях, импортируется в эти органеллы из цитоплазмы. К их числу относятся белки и некоторые малые РНК. Импорт белков в митохондрии - это универсальное явление, механизм которого очень сходен во всех эукариотических клетках. В настоящее время эти механизмы изучены достаточно детально. В то же время, импорт РНК известен только в нескольких группах эукариот. Тем не менее, предполагается, что этот процесс характерен для большинства видов. Набор молекул РНК, импортируемых в митохондрии разных организмов, не универсален. Механизмы импорта РНК изучены значительно менее подробно, чем в случае белков, но уже очевидно, что эти механизмы сильно отличаются от вида к виду. В данном обзоре производится попытка собрать воедино многочисленные данные об импорте вышеперечисленных макромолекул в митохондрии.
Ключевые слова: митохондрии, импорт белков, импорт РНК, внешняя митохондриальная мембрана, внутренняя митохондриальная мембрана, митохондриальный матрикс.
DIRECTED IMPORT OF MACROMOLECULES INTO MITOCHONDRIA, by P. A. Kamenski12, E. N. Vi-nogradova3, I. A. Krasheninnikov1, I. A. Tarassov2* (^Molecular Biology Department, Faculty of Biology, Moscow State University, Moscow, 119992 Russia; 2UMR 7156 "Génétique Moleculaire, Génomique et Microbiologie" CNRS-ULP, Strasbourg, 67084, France; 3Institute de Biologie Moleculaire des Plantes CNRS, Strasbourg, 67084 France; *e-mail: I.Tarassov@ibmc.u-strasbg.fr). Mitochondria are multifunctional organelles of eukaryotic cells that provide the energy for the cells by oxidative phosphorylation, play an important role in the apoptosis and take part in Fe-S clusters formation, fatty acids oxidation and synthesis of some aminoacids. They contain their own genome and are able to transcribe and to translate it. However, the vast majority of the macromolecules which function inside the mitochondria are imported into these organelles from the cytoplasm. The imported macromolecules include proteins and several types of small RNAs. Protein import is a universal process and its mechanism is conserved among all species. This mechanism is now known in detail. RNA import was shown to occur in several groups of eukaryotes, while the pool of imported RNA molecules varies in different organisms. Although the knowledge about the mechanisms of RNA import is less extensive than for the proteins, it becomes clear that these mechanisms are not universal among all the species possessing this pathway. In this review, we summarize the data about the import of macromolecules mentioned above into mitochondria.
Key words: mitochondria, protein import, RNA import, mitochondrial outer membrane, mitochondrial inner membrane, mitochondrial matrix.
Принятые сокращения: MTS (Matrix Targeting Signal) - сигнальные последовательности митохондрий; TOM (Translocase of Outer Membrane) - комплекс транслоказы внешней мембраны; SAM (Sorting and Assembly Mashinery) - комплекс, ответственный за встраивание в мембрану интегральных белков; TIM (Translocase complex) - комплекс транслокации; PAM (Pre-sequence-Associated import Motor) - транслокационный мотор; MPP (Mitochondrial Processing Peptidase) - процессирующая пептидаза митохондрий; MIP (Mitochondrial Intermediate Peptidase) - "промежуточная" пептидаза митохондрий; IMP (Inner Membrane Peptidase) - пептидаза внутренней мембраны; TAB (Tubulin Antisense-binding protein) - рецептор тубулина; RIC (tRNA Import Complex) - комплекс связывания и транспорта тРНК.
*Эл. почта: I.Tarassov@ibmc.u-strasbg.fr
Импорт белков в митохондрии играет важнейшую роль в биогенезе этих органелл, так как подавляющее большинство митохондриальных белков составляют именно импортируемые белки. Например, в митохондриальном геноме дрожжей Saccharomyces cerevisiae закодировано всего 8 белков, в то время как общее число белков составляет около 750-800. Система транспорта белков в митохондрии сложно организована и до сих пор до конца не изучена [1, 2]. Каждый индивидуальный белок направляется, в зависимости от места его конечного расположения, в митохондри-альный матрикс, в межмембранное пространство или в одну из митохондриальных мембран. Перечислим основные компоненты этой системы. Это сигнальные последовательности в составе белков, которые должны быть транспортированы в митохондрии; цитоплазматические факторы, обеспечивающие разворачивание импортируемых белков и доступность их сигнальных последовательностей для митохондриальных рецепторов; транслокационные комплексы внешней и внутренней митохондриальных мембран; комплекс внешней митохондриальной мембраны, осуществляющий встраивание в нее интегральных белков; митохондриальные пептидазы, отщепляющие сигнальные последовательности импортируемых белков в матриксе; митохондриальные шапероны, участвующие в фолдинге импортируемых белков в матриксе митохондрий; и, наконец, - митохондриальные белки, осуществляющие экспорт белков из матрикса во внутреннюю мембрану митохондрий.
Основными модельными объектами для изучения механизмов импорта белков в митохондрии служат S. cerevisiae и Neurospora crassa. У многих эукариотических организмов самых разных групп обнаружены белки, гомологичные всем компонентам системы импорта белков, что позволило сделать вывод об универсальности этого процесса.
Общая схема импорта белков в митохондрии изображена на рис. 1.
СИГНАЛЬНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ ИМПОРТИРУЕМЫХ БЕЛКОВ
Сигнальная последовательность - это часть предшественника митохондриального белка, необходимая и достаточная для его транспорта к поверхности митохондрий и для импорта через митохондриальные мембраны. В случае, если предшественник должен быть импортирован в митохондриальный матрикс, его сигнальная последовательность называется MTS (от англ. Matrix Targeting Signal). В митохондриальном матриксе большинство MTS протеолитически отщепляются. Сигнальные последовательности многих бел-
Рис. 1. Общая схема импорта белков в митохондрии. Пути импорта белковых предшественников показаны стрелками. Все предшественники импортируются из цитоплазмы (Cyt) через внешнюю мембрану митохондрий (OM) при помощи ТОМ-комплекса. Затем события могут развиваться по трем основным сценариям: 1) интегральные белки внешней мембраны встраиваются в нее при помощи SAM-комплекса; 2) предшественники митохондриальных белков, содержащие N-концевую сигнальную последовательность, импортируются через внутреннюю мембрану митохондрий (IM) при помощи ТШ23-комплекса; в этом процессе участвует также транслокационный мотор (РАМ). В результате предшественники проникают в митохондриальный матрикс (Mx). 3) Белки, содержащие внутренние сигнальные последовательности, при помощи TIM22-комплекса встраиваются во внутреннюю мембрану митохондрий. Во всех трех сценариях участвуют малые Tim-белки (sTim) межмембранного пространства (IMS). OXAl-комплекс осуществляет встраивание белков митохондриального матрикса во внутреннюю мембрану. (Все рисунки данного обзора являются авторскими.)
ков, импортирующихся в другие субмитохондри-альные компартменты, организованы иначе, расположены чаще всего во внутренних сегментах белка и не подвергаются протеолизу.
MTS в подавляющем большинстве случаев располагаются на N-конце молекулы предшественника. Обычно белковые предшественники проникают в митохондрии, начиная с N-конца, что определяется наличием MTS именно здесь. Однако существуют исключения: типичная сигнальная последовательность имеется на С-конце предшественника митохондриальной ДНК-хели-казы дрожжей, Hmilp [3]. При этом механизм импорта этого белка и белков с N-концевыми MTS ничем не отличаются, за исключением обратной ориентации белка (С —► N).
Типичные MTS содержат от 20 до 60 аминокислотных остатков, которые при взаимодействии с липидным бислоем формируют амфи-фильную а-спираль [4]. Специфических мотивов
первичной структуры в сигнальных последовательностях не имеется [5], однако известно, что существенная часть аминокислот в их составе представлена гидрофобными или положительно заряженными остатками.
Около 30% предшественников митохондри-альных белков не несут типичного MTS на Оконце. К этим белкам относятся практически все белки внешней митохондриальной мембраны, многие межмембранные белки и белки внутренней митохондриальной мембраны. В составе некоторых белков этого типа локализованы участки, ответственные за их проникновение через митохон-дриальные мембраны.
Белки внешней мембраны митохондрий подразделяются на два основных класса - в одном из них имеется только трансмембранный участок и белок не погружен в мембрану полностью. Сигнальные последовательности белков этих классов отличаются друг от друга [6].
В случае белков, только закрепленных в мембране, сигнальной последовательностью служит непосредственно трансмембранный сегмент, а также несколько аминокислот, окружающих его с той и с другой стороны. Первичная структура этих последовательностей не имеет большого значения для их сигнальной функции. Что же касается белков, погруженных во внешнюю ме
Читайте также:
