Механизм перемещения липидов в мембране - флиппинг
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Молекулам в изотропной жидкости присущи разные виды подвижности: вибрационные колебания, вращение, трансляционные движения. В анизотропном бислое, напротив, молекулярная подвижность его компонент упорядочена. Различные типы подвижности проиллюстрированы на рис. 1.
Молекулы фосфолипидов способны к нескольким видам подвижности в бислое:
изменение ориентации полярных голов,
колебания ацильных цепей,
образование кинков и их перемещение вдоль ацильных цепей (в поперечном направлении),
ротационная подвижность (вращение вокруг длинной оси),
переход с одной стороны бислоя на другую (по типу флип-флоп),
выход из бислоя.
Рассмотрим некоторые виды подвижности молекул фосфолипидов подробнее.
1 .1. Латеральное движение. Способность липидов перемещаться в мембране в латеральном (продольном) направлении показана многими экспериментами. Например, для суспензии яичного лецитина при 25ºС молекула преодолевает путь, равный 2,5 мкм за 1 сек. Таким образом, латеральная диффузия в упорядоченной мембране позволяет веществам перемещаться с относительно высокой скоростью. Она делает возможным образование липидных кластеров. Латеральная диффузия оказывается возможной даже при температуре кристаллического состояния. По-видимому, единственный механизм, который мог бы удовлетворительно объяснить этот факт, заключается в латеральной неоднородности мембраны, наличии дефектных зон (пустот), куда могут вытесняться молекулы из соседних упорядоченных областей.
1.2. Ротационная подвижность. Различные конфигурации молекул жирных кислот, возникающие при поворотах (вращении) вокруг единчной С-С связи, называют ротамерами, или конформерами, а изменение конформации молекулы за счет таких поворотов носит название транс-гош изомеризации. Вращательная подвижность молекул фосфолипидов, измеренная методом ЯМР, показала, что подвижность гидрофобных сегментов цепи повышается в направлении от сложноэфирной связи к метильной группе, т.е. к центру бислоя.
1.3. Трансмембранный переход «флип-флоп» типа. В липидных искусственных мембранах такие переходы осуществляются весьма медленно, например, полупериод перехода молекул холестерина с одной стороны бислоя на другую в липосомах из фосфатидилхолина занимает более 24 часов, однако, в принципе, такой переход возможен. Молекулы липидов не могут преодолеть липидный бислой в поперечном направлении путем перескока молекул с одной стороны бислоя на другую (флип-флоп), если в молекуле нет особых ферментов, известных под названием транслокаторов.
Липиды и в биологических мембранах с довольно большой частотой мигрируют с одной стороны мембраны на другую, то есть совершают «флип-флоп» переходы. Возможно, что гетерогенность липидного состава биологических мембран увеличивает вероятность «флип-флоп» перехода в природных мембранах. Одним из результатов этой гетерогенности является возможность образования гексагональной фазы (вывернутых везикул), кратковременное существование которых позволяет вовлекать молекулы липидов с одной стороны бислоя, а возвращать их на другую.
Следовательно, динамическое состояние бислоя с высокой подвижностью его компонентов определяется одновременно несколькими факторами. С одной стороны, это вращательная подвижность отдельных молекул фосфолипидов. Вблизи метильного конца она осуществляется для каждой молекулы независимо, но с приближением к полярной «голове» и возрастанием плотности упаковки (особенно начиная с 9 углеродного атома, ближе которого к поверхности бислоя не встречается цис-двойных связей) подвижность уменьшается.
Механизм перемещения липидов в мембране - флиппинг
• Основные клеточные фосфолипиды синтезируются в мембране ЭПР, главным образом, со стороны цитозоля.
• Регуляция синтеза новых липидов контролируется локализацией ферментов, участвующих в этом процессе.
• Биосинтез холестерина регулируется протеолизом фактора транскрипции, который интегрирован в мембрану ЭПР.
Наряду с транслокацией и подготовкой белков к секреторному процессу, эндоплазматический ретикулум (ЭПР) функционирует как место первичного образования клеточных фосфолипидов. Эти молекулы синтезируются в мембране эндоплазматического ретикулума (ЭПР) и затем распределяются по отдельным мембранам и органеллам внутри клетки. К их числу относится плазматическая мембрана, митохондрии и органеллы секреторного пути.
При возникновении необходимости клетка должна обладать способностью увеличивать количество мембран. Наиболее очевидно это проявляется при удвоении плазматической мембраны и всех органелл, которое происходит в ходе клеточного цикла. Наряду с этим, при гиперфункции, отдельные органеллы могут увеличиваться в размерах. Например, при созревании предшественников В-лимфоцитов в плазматические клетки, секретирующие антитела, ЭПР сильно увеличивается, что соответствует потребностям усиленного транспорта белков по секреторному пути.
Образование фосфолипидов из растворимых предшественников de novo происходит, главным образом, на мембране ЭПР со стороны цитоплазмы, в ходе процесса, называемого цикл Кеннеди. Как показано на при росте мембраны ЭПР две молекулы жирных кислот, связанные с ацетил КоА, реагируют с глицерин-3-фосфатом, образуя диацилглицерин (ДАТ). В отличие от своих предшественников, ДАГ достаточно гидрофобен для того, чтобы интегрироваться в мембрану ЭПР.
Попав в мембрану, ДАГ взаимодействует с «головой» будущей молекулы фосфолипида. Как показано на рисунке ниже, основные фосфолипиды различаются, главным образом, природой «головы» молекулы. Все они образуются при присоединении «головы» к ДАГ. Вначале происходит ее фосфорилирование, а затем присоединение к цитидиндифосфату (ЦДФ). После этого «голова» с одной из фосфатных групп переносится на ДАГ, и синтез завершается.
Присоединение головной группы холина к ЦЦФ с образованием фосфатидилхолина иллюстрирует использование клеткой субклеточной локализации белков для регуляции процессов биосинтеза. В этой реакции участвует фермент цитидилтрансфераза (ЦТ), и она контролирует скорость всего процесса синтеза фосфатидилхолина. В клетке ЦТ находится в двух различных формах: в неактивной, в цитозоле, и в активной, с цитозольной стороны мембраны ЭПР.
Механизм, который обеспечивает существование двух этих форм фермента, представляется не вполне ясным. Очевидно, однако, что условия внутри клетки, которые сигнализируют о необходимости усиления синтеза фосфатидилхолина, могут контролировать переход ЦТ из одной формы в другую. Например, увеличение в клетке концентрации свободного ДАТ или жирных кислот вызывает миграцию ЦТ на мембрану ЭПР, где эти компоненты реагируют с холином. В то же время, когда в клетке содержится много фосфатидилхолина, ЦТ локализуется в цитозоле. Таким образом, предотвращается синтез фосфатидилхолина.
Наряду с фосфатидилхолином, который является наиболее распространенным мембранным фосфолипидом, в цикле Кеннеди также образуются фосфатидилэтаноламин и фосфатидилинозитол. У дрожжей S. cerevisiae синтезируется фосфатидилсерин. У животных, однако, этот фосфолипид образуется за счет другой реакции, которая не требует участия ЦЦФ, однако также протекает с цитозольной стороны мембраны ЭПР.
Интересная особенность синтеза фосфатидилэтаноламина заключается в том, что хотя этот фосфолипид образуется в цикле Кеннеди, он также может синтезироваться в митохондриях. В этих органеллах он образуется при модификации фосфатидилсерина, который образовался в ЭПР. Образование фосфатидилэтаноламина в клеточных компартментах, отличающихся от тех, в которых синтезируется его предшественник, предполагает существование механизма транспорта липидов между двумя компартментами.
Имеются данные, позволяющие предполагать, что этот транспорт осуществляется посредством специального субдомена ЭПР, который называется мембраной, связанной с митохондрией (МСМ). МСМ представляет собой участок ЭПР, который физически ассоциирован с митохондрией. Он характеризуется плоской поверхностью и тесным контактом с органеллой. В МСМ находятся ферменты синтеза фосфатидилсерина. Возможно, что область контакта мембраны с митохондрией обеспечивает быстрый перенос фосфатидилсерина в органеллу, хотя механизм этого переноса остается неясным.
Наряду с участием в синтезе фосфолипидов, эндоплазматический ретикулум (ЭПР) является местом синтеза стеринов. К числу основных стеринов мембран клетки относится холестерин; его биосинтез осуществляется в несколько этапов. Первые несколько реакций происходят в цитозоле, а остальные в мембране ЭПР. Также в ЭПР находятся элементы, необходимые для регуляции образования холестерина. Ключевыми медиаторами этого регуляторного пути являются белки, связывающиеся с регуляторным стеринреспонсивным элементом (SREBP).
Эти белки обычно интегрированы в мембрану эндоплазматического ретикулума (ЭПР) и со стороны люмена содержат небольшую петлю, соединяющую два трансмембранных домена, N- и С-концевые участки которых ориентированы в сторону цитозоля. Также в ЭПР находится белок SCAP (белок, активирующий разрезание SREBP). Этот белок контролирует уровень внутриклеточного холестерина. Когда возникает необходимость в повышенном синтезе холестерина, SCAP транспортирует SREBP из ЭПР в аппарат Гольджи. Там происходит разрезание SREBP, и N-терминальный участок молекулы высвобождается в цитозоль. (В реакции участвуют те же протеазы, которые расщепляют АТФ 6 при возникновении стрессорных условий в ЭПР. Затем N-терминальный домен SREBP мигрирует в ядро, где действует как фактор транскрипции, активируя экспрессию генов в каскаде реакций биосинтеза холестерина.
При объединении водорастворимых цитоплазматических компонентов (глицерин-3-фосфата, ацил КоА и полярной головки) образуется молекула фосфолипида.
Новая растворимая в липидах молекула включается в мембрану. Основные мембранные фосфолипиды различаются по составу головок.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Механизм возвращения в цитозоль и деградации неправильно свернутых белков клетки - ERAD
• Транслоцированные в ЭПР белки могут экспортироваться обратно в цитозоль, где они подвергаются убиквитинилированию и деградации протеосомами — процесс известный как деградация, связанная с ЭПР.
• Белки возвращаются в цитозоль путем ретроградной транслокации, механизм которой менее понятен, чем механизм транслокации в ЭПР.
Такие белки должны каким-то образом деградировать. Одним из путей решения этой проблемы служит использование ретроградной транслокации (иногда называемой дислокация или ретротранслокация) для экспорта неправильно собранных белков обратно в цитозоль. Там они взаимодействуют с убиквитином и деградируют с участием больших протеазных комплексов, протеосом. Этот путь деградации называется — деградация, связанная с ЭПР (ERAD).
Открытие этого пути последовало после понимания того факта, что белки, обладающие неправильной нативной структурой, не накапливаются в ЭПР, а деградируют. Первоначально предполагалось, что деградация происходит в самом ЭПР, однако, несмотря на тщательные поиски, в этой органелле не были обнаружены соответствующие протеазы. Вместо этого начали появляться данные о том, что белки деградируют под действием протеаз, содержащихся в цитозоле.
Вначале было показано, что химические ингибиторы протеосом блокируют деградацию вновь синтезированного интегрального мембранного белка (CFTR, или регулятор трансмембранного переноса при кистозном фиброзе). Эти данные позволили предположить, что белки должны экспортироваться из ЭПР до деградации. В дальнейшем было показано, что ингибирование функций протеосом приводит к накоплению в цитозоле полностью транслоцированных белков.
Каким образом белок отбирается для ERAD? В отличие от процесса транслокации в ЭПР сигнальная последовательность на белке для его направления на деградацию отсутствует. Скорее всего, при ERAD распознаются какие-то свойства, которые отличают белки с неправильной структурой от белков, обладающих нативной конформацией или временно не имеющих правильной структуры высшего порядка.
Например, мутация, которая дестабилизирует нативную структуру белка, может вызывать ее деградацию. Фактически мутировавший белок может быть признан субстратом для ERAD, даже если мутация мало повлияла на его функцию. Даже белки, не обладающие заметными дефектами структуры, могут быть отобраны для ERAD, что свидетельствует о существовании скрытых, неизвестных нам признаков, которые, однако, узнаются клеткой.
Рисунок ниже иллюстрирует основные этапы ERAD. Первый этап отбора белка для ERAD — это обнаружение неправильной структуры. Хотя мы и не знаем, каким образом это происходит, возможно, что существенную роль здесь играют шапероны. Однако ассоциация с шаперонами не может являться единственным критерием отбора белка для ERAD, поскольку шапероны участвуют в организации конформации всех новообразующихся белков. Не исключено, что сигнал к ретроградной транслокации зависит от промежутка времени, в течение которого белок находится в связанной с шаперонами форме.
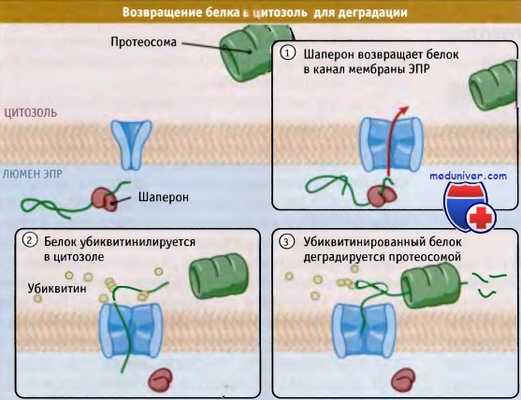
При ретроградной транслокации белки с неправильной нативной структурой возвращаются из люмена эндоплазматического ретикулума (ЭПР) обратно в его мембрану и в цитоплазму.
Там они подвергаются деградации в протеосомах. По-видимому, определенную роль в переадресовании играют шапероны люмена,
поскольку они должны связываться с белками, обладающими неправильной нативной структурой.
Шапероны остаются в связанной форме до тех пор, пока белок не приобретет нативную структуру. Если образование такой структуры невозможно, то белок дольше, чем обычно, будет оставаться связанным с шаперонами. Впрочем, вообще не ясно, каким образом продолжительность связи белка с шаперонами дает сигнал к ретроградной транслокации. В случае неправильной структуры гликопротеинов фермент а-маннозидаза I отщепляет маннозу и тем самым дает сигнал к деградации белка. Не ясно, однако, что служит сигналом к отщеплению маннозы.
После отбора белка для ретроградной транслокации, он должен пройти через мембрану ЭПР. Многочисленные генетические и биохимические данные позволяют предполагать, что роль канала ретроградной транслокации выполняет комплекс Sec61p. В некоторых случаях, однако, ретроградная транслокация не зависит от Sec61, и поэтому возникает вопрос о природе канала или даже о наличии нескольких каналов, специфичных для различных типов белков, обладающих неправильной структурой. Независимо от природы канала, для ретроградной транслокации надо выполнять те же шаги, как и для прямой транслокации.
Для того чтобы прошел экспорт, белок должен вначале попасть в канал, канал должен открыться, и затем — белок пройти через него в цитозоль.
Большинство белков направляются на деградацию только после завершения транслокации. Неизвестно, остаются ли эти белки поблизости от транслокона, пока не разрешится вопрос об их деградации. Также неизвестно, каким образом неправильно скрученные белки попадают в канал ретроградной транслокации. Фактически вырисовывающаяся картина позволяет предполагать, что путь, по которому направляется субстрат из ЭПР, и белки цитозоля, необходимые для деградации, сильно зависят от типа деградируемого белка и от того, где в нем располагается неправильно скрученная область.
Не исключено, что растворимые и трансмембранные белки деградируют по крайней мере частично отличающимся друг от друга путями и что среди трансмембранных белков эти пути зависят от положения мутации в домене люмена или цитозоля.
Как только белок оказался в ретроградном транслоконе, он, вероятно, начинает проходить через канал под действием сил цитозоля. Убиквитинилирование играет роль в экспорте многих (хотя и не всех) субстратов. Большинство субстратов деградации подвергается полиубиквитинилированию, и убиквитинилирование происходит, пока они еще находятся в связанном с мембраной состоянии. Мутации в каком-либо компоненте системы убиквитина приводят к образованию в ЭПР агрегатов, состоящих из белков неправильной структуры. Это позволяет предполагать, что канал блокируется в случае, когда субстрат не может модифицироваться.
Однако одного убиквитинилирования недостаточно для перехода белков в цитозоль. Также необходимо присутствие АТФазы цитозоля (р97 Cdc48 у дрожжей), которая связывается с мембраной ЭПР, при этом р97 связывает цитозольные кофакторы, которые прямо соединяются с субстратом ERAD. Пока неясно, каким образом эта АТФаза приводит к высвобождению субстрата в цитозоль, но аналогичные АТФазы бактерий и митохондрий непосредственно связываются с интегральными мембранными белками и извлекают их из мембраны. Не исключено, что АТФаза, требующаяся для ретротранслокации, действует аналогичным образом, связываясь или непосредственно с субстратом, или с присоединенным к нему остатком убиквитина и вытягивая белок из канала в цитозоль. Пока неизвестно, какую роль играет протеосома в процессе ретроградной транслокации.
Еще одним ключевым компонентом системы ERAD является небольшой мембранный белок дерлин. Этот белок необходим для ретроградной транслокации некоторых белков, обладающих неправильной структурой. Показано, что он взаимодействует как с неправильно скрученным белком в ЭПР, так и с р97 через связывание с белком VIMP. Поэтому дерлин представляет собой, по крайней мере, один компонент молекулярного «моста» между люменом ЭПР и аппаратом деградации цитозоля, хотя, конечно, существуют и другие.
Как иллюстрирует рисунок ниже, в некоторых случаях белки могут отбираться для деградации даже до завершения их транслокации в ЭПР. Это используется для особенно больших субстратов для того, чтобы избежать затрат энергии на транслокацию белка целиком, если он начинает принимать неправильную конфигурацию уже в самом начале синтеза. Отбор белков для ретроградной транслокации в процессе их импорта позволяет не помечать их повторно. Наилучшим примером этому является деградация аполипопротеина В. Это очень большой секретируемый белок, который на первом шаге сборки липопротеинов низкой плотности связывается с липидами люмена ЭПР и жирными кислотами.
Неспособность фермента люмена ЭПР переносить липиды на аполипопротеин В по мере транслокации вызывает начало деградации белка до момента завершения его синтеза и транслокации.
Когда белки достигают цитозоля, они обычно узнаются и деградируют. Однако в некоторых случаях экспортируемые белки подвергаются агрегации в цитоплазме. При этом белки накапливаются в цитоплазме в специальных образованиях, которые называются агресомы. Они способны сохранять для деградации большие количества белка.
Исследование ERAD еще только начинается. Очевидно, в этом процессе участвует больше компонентов, чем известно на сегодняшний день, и его молекулярные основы исследованы пока недостаточно. Сюда относятся фундаментальные вопросы, связанные с распознаванием белков, обладающих неправильной структурой. Выяснение деталей этих процессов позволит реконструировать их in vitro.
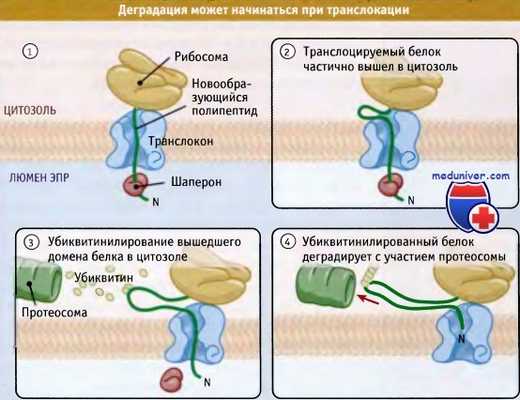
Деградация некоторых белков начинается до того момента, как они полностью транслоцировались.
Когда белок отобран для деградации, в цитоплазме начинают накапливаться и убиквитироваться фрагменты его цепи.
Механизм транспорта липидов между органеллами в клетке
• Каждая органелла обладает уникальным составом липидов, что предполагает специфичность транспорта липидов из ЭПР в каждую органеллу.
• Механизм транспорта липидов между органеллами неизвестен, но может включать прямой контакт между ЭПР и другими клеточными мембранами.
• При перемещении липидов через бислой возникает асимметричность слоев мембраны.
После синтеза липидов в ЭПР они должны транспортироваться на другие мембраны клетки. Этот процесс осложняется тем фактом, что мембранные органеллы различаются по составу липидов; таким образом, перенос должен представлять собой специфический процесс, а не просто обмен липидов. Поэтому должны существовать механизмы, которые обеспечивают не только движение липидов, но и направление этого процесса.
Хотя механизм транспорта липидов остается невыясненным, предложено несколько схем движения. Одна схема подразумевает наличие прямого контакта между мембранами, как это, например, имеет место между ЭПР и митохондриями в МСМ. Вероятно, когда мембраны двух органелл непосредственно примыкают друг к другу, это облегчает движение фосфолипидами между ними. Такая схема распределения липидов кажется вероятной, поскольку известно, что ЭПР непосредственно контактирует со всеми основными клеточными органеллами.
Последние включают плазматическую мембрану, транс-Гольджи сеть, пероксисомы, вакуоли и эндосомы/лизосомы. Хотя функциональное значение этих контактов выяснено не столь подробно, как для МСМ, но если они действительно имеют общую природу, то могут служить средством передвижения липидов из одной органел-лы в другую и обеспечивать специфичность этого процесса.
Для объяснения механизма транспорта липидов были предложены также другие гипотезы. До недавнего времени общепризнанным считалось представление о белках-переносчиках фосфолипидов. Эти белки были обнаружены в экспериментах in vitro по их способности обменивать липиды между мембранами.
Белки экстрагируют липиды из одной мембраны и помещают их в гидрофобный связывающий карман, где они находятся до того момента, как будут перенесены в другую мембрану. Хотя эти белки, возможно, участвуют в прямом переносе фосфолипидов между органеллами, они вряд ли обусловливают увеличение их липидного состава, поскольку при диссоциации липида от мембранного белка, его место занимает в белке другой липид этой же мембраны. Данные о роли этих белков в транспорте липидов in vivo отсутствуют.
Предполагается также, что при транспорте везикул по секреторному пути наряду с белками переносятся новые липиды. Однако этот механизм кажется маловероятным, поскольку вещества, препятствующие движению везикул по секреторному пути, не блокируют транспорт липидов от ЭПР к плазматической мембране. Секреторные везикулы не могут доставлять липиды к митохондриям и хлоропластам, поскольку ЭПР даже не связан с этими оранеллами через секреторный путь.
В некоторых случаях образующиеся в ЭПР липиды экспортируются в другие клетки. При этом некоторые специализированные клетки транспортируют по секреторному пути липиды, находящиеся в форме липопротеинов. Последние представляют собой крупные агрегаты, состоящие из белка и липидов, и используются для транспорта через кровоток водонерастворимых метаболитов, особенно холестерина и триацилглицеринов. Они состоят из ядра, содержащего холестерин и триацилглицерины, окруженного монослоем фосфолипидов и белка.
Существует несколько типов липопротеинов, различающихся по плотности. Особый интерес представляют липопротеиды низкой плотности (ЛНП), поскольку они образуются в люмене ЭПР клеток печени и кишечника, а затем транспортируются из них по секреторному пути. Предшественниками ЛНП являются фосфолипиды очень низкой плотности (ЛОНП), которые синтезируются на цитозольной стороне ЭПР, а затем, вероятно, проходят через мембрану Там они реагируют с белком АроВ, по мере его транслокации в люмен ЭПР. Сформировавшиеся ЛОНП частицы транспортируются по секреторному пути. Если частица не была правильно собрана в люмене ЭПР, то за счет ретроградной транслокации белок АроВ возвращается в цитозоль, где деградирует.
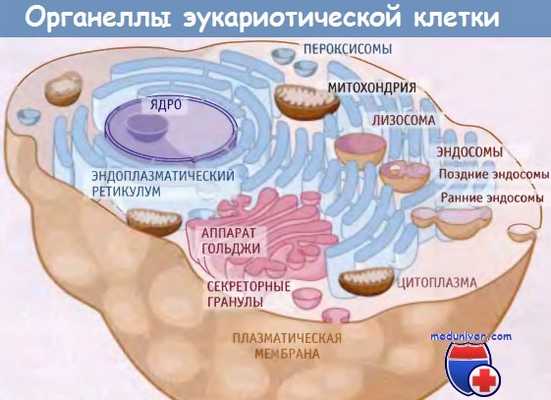
В цитоплазме эукариотической клетки содержится несколько компартментов, ограниченных мембранами.
Липидный бислой: текучесть
Важнейшее из свойств липидного бислоя - это текучесть .То, что отдельные молекулы липидов способны свободно диффундировать в пределах липидного бислоя, стало впервые известно в начале 197О-х годов. Первоначально это было показано на искусственных липидных бислоях. Для экспериментальных исследований оказались полезными искусственные мембраны двух типов:
1) липосомы , имеющие форму сферических пузырьков, диаметром от 25 до 1 мкм в зависимости от способа их получения, и
2) плоские бислои, называемые черными мембранами , закрывающие отверстие в перегородке между двумя отделениями сосуда, заполненными водой.
Поведение липидных молекул в клеточных мембранах в основном сходно с поведением этих молекул в искусственных бислоях: липидный компонент биологической мембраны представляет собой двумерную жидкость, в которой отдельные молекулы липидов быстро перемещаются, но только в пределах своего монослоя.
Другим фактором помимо температуры, определяющий текучесть мембраны, является холестерол . О том, что определенная текучесть мембраны имеет важное биологическое значение свидетельствует факт, что бактерии, дрожжи и другие пойкилотермные организмы изменяют жирнокислотный состав своих плазматических мембран таким образом, чтобы текучесть мембраны оставалась примерно постоянной.
Текучая структура липидного бислоя дает возможность мембранным белкам быстро диффундировать и взаимодействовать между собой, обеспечивает простой способ распространения мембранных компонентов от мест, где они вошли в состав бислоя после того, как были синтезированы, в другие области клетки. Текучесть позволяет мембранам сливаться друг с другом, причем способность к регуляции их проницаемости не утрачивается.
Общие принципы организации бислоя : Неполярные хвосты направлены внутрь мембраны и высокоупорядочены. Полярные головки расположены в плоскости мембраны и могут образовывать водородные связи. Хвосты фосфолипидов имеют два хвоста (похоже на цилиндр). Присутствие молекул с одним хвостом (лизолецитин), имеющих в пространстве форму, близкую к конусу, разрушает клеточные мембраны. Фосфолипидные молекулы, лишенные одного из хвостов, образуют поры в бислойной мембране, т.е. нарушается барьерная функция мембран.
Ацильные цепи расположены под некоторым углом к полярным головкам.
Микровязкость мембраны у концов липидных хвостов меньше, чем около полярных голов, высокая подвижность липидных молекул обусловливает латеральную (боковую) диффузию – это хаотическое тепловое перемещение молекул липидов и белков в плоскости мембраны. Рядом расположенные молекулы липидов скачком меняются местами и вследствие таких последовательных перескоков из одного места в другое молекула перемещается вдоль поверхности мембраны. Среднее квадратичное перемещение за секунду фосфолипидной молекулы по поверхности мембраны эритроцита - 5 мкм, что сравнимо с размерами клеток. Таким образом, за секунду молекула может обежать всю поверхность небольшой клетки. Частота перескоков- n = 3 ´ 10 7 с -1 . Каждая молекула, таким образом, в среднем претерпевает десятки миллионов перестановок в плоскости мембраны за секунду, то есть характерное время одного перескока i = 10 -7 – 10 -8 с.
Флип-флоп - это диффузия молекул мембранных фосфолипидов поперек мембраны.
Перескоки молекул с одной поверхности бис-лоя на другую совершаются значительно медленнее Т ~ 1 час.
Сочетание быстрой диффузии молекул вдоль мембраны и очень медленной диффузии поперек мембраны имеет большое значение для функционирования мембран, а именно для матричной функции мембраны. Благодаря затрудненному переходу поперек мембраны поддерживается упорядоченность в молекулярной структуре мембраны, ее анизотропия, асимметрия (относительно плоскости мембраны) расположения липидных и белковых молекул, определенная ориентация белков-ферментов поперек мембраны. Это имеет большое значение, например, для направленного переноса веществ через мембрану.
Фазовые переходы липидов. Липидная мембрана представляет собой динамическую структуру, строение бислоя может меняться в течении жизни или при изменении физических условий. Фазовые переходы мембраны происходят между двумя состояниями: Гель и Жидкий кристалл.
· Все Ацильные цепи полностью имеют транс-конформацию и вытянуты параллельно друг другу.
· Толщина мембраны больше.
· Площадь, приходящаяся на 1 молекулу меньше.
· Мембрана в целом более компактна.
2. Жидкий Кристалл:
· Часто встречаются транс-гош-переходы, кинки.
· Толщина мембраны меньше.
· Площадь, приходящаяся на 1 молекулу больше.
· Упорядоченность и компактность меньше, Энтропия системы больше.
Переход между этими двумя фазами является переходом 1 рода.
В матриксе одной фазы может существовать большое количество микроскопических доменов другой фазы.
Фазовые переходы происходят при определённой температуре, зависящей от состава липидов. от -20 °С (для мембран из ненасыщенных липидов) до + 60 °С (для насыщенных липидов). Также, чем больше ненасыщенность связей, тем меньше плотность упаковки мембраны и больше проницаемость мембраны.
При фазовом переходе может происходить увеличение пассивной проводимости мембраны, связанное с образованием каналов на границе участков мембраны, имеющих разное фазовое состояние. Этот процесс лежит в основе терморецепции и хеморецепции.
Читайте также:
