Механизм сборки промежуточных филаментов
Добавил пользователь Alex Обновлено: 30.01.2026
Промежуточные филаменты названы так потому, что их диаметр составляет около 10 нм, что является промежуточной величиной между диаметром микрофиламентов (6 нм) и микротрубочек (25 нм). В отличие от микрофиламентов и микротрубочек они являются не молекулярными полимерами, а поликонденсатами фибриллярных мономеров. Промежуточные филаменты обнаружены во всех клетках животных, но особенно много их в покровном эпителии, нервной и мышечных тканях.
В центральной части молекулы белков промежуточных филаментов содержится одинаковая аминокислотная последовательность из 130 остатков, формирующая a-спираль. Тем не менее, эти белки обладают выраженной тканевой специфичностью, которая определяется концевыми участками их молекул. Сборка филаментов происходит путем упорядоченной конденсации a-спиральных структур.
Белки промежуточных филаментов принадлежат к одной из четырех различных групп – кератинам, белкам мезенхимных клеток, белкам нейрофибрилл и ламинам.
Кератины представляют собой семейство фибриллярных белков с молекулярной массой 40–70 кД, специфичных для эпителиальных клеток. Отдельные белки, которых в семействе около тридцати, лишь незначительно отличаются по аминокислотной последовательности, но их комплексы могут формировать различные супрамолекулярные структуры, которые придают эпителиальным клеткам различные физико-химические свойства. В частности, именно кератины обеспечивают механические свойства волос, ногтей, перьев и других производных эпидермиса у позвоночных животных.
Белки промежуточных филаментов клеток мезенхимального происхождения представлены виментином клеток соединительной ткани, эндотелия сосудов и крови, десмином (скелетином) мышечных тканей и глиальным кислым фибриллярным белкомастроцитов и других клеток нейроглии. Эти белки имеют молекулярную массу 53-58 кД и формируют в клетках опорные структуры. В частности, десмин входит в состав Z-пластинок, к которым прикреплены актиновые нити в сократительных органоидах мышечных волокон – миофибриллах.
К белкам нейрофиламентов относятся три полипептида с молекулярной массой 68, 145 и 220 кД. Они вместе с микротрубочками входят в состав характерных для нервных клеток структур – нейрофибрилл, которые участвуют в формировании системы внутриклеточного транспорта в теле нейрона и его отростках.
Промежуточные филаменты цитоплазмы локализуются в основном вокруг клеточного ядра, а также образуют пучки, идущие от ядра на периферию клетки. Распределение промежуточных филаментов в клетке в значительной степени совпадает с распределением микротрубочек, что отражает их совместное участие во внутриклеточных транспортных системах.
В отличие цитоплазматических белков, образующих фибриллы, локализованные в клеточном ядре ламины A, B и C (молекулярная масса 60-70 кД) собраны в прямоугольные решетки. Сформированный ими остов, или ядерный матрикс, контактирует с внутренней мембраной нуклеолеммы, обеспечивая поддержание размеров и формы клеточного ядра. Ядерный матрикс из ламинов служит также опорной структурой для хромосом. При митозе или мейозе ламины фосфорилируются киназами клеточного деления, что приводит к их деполимеризации и распаду нуклеолеммы на отдельные рассеянные по цитоплазме пузырьки. В конце деления активируются фосфатазы, обеспечивающие полимеризацию ламинов и восстановление ядерного матрикса и нуклеолеммы.
Механизм сборки промежуточных филаментов
Промежуточные филаменты хрусталика
• Хрусталик глаза содержит два специфических белка промежуточных филаментов, СР49 и филензин, которые входят в VI группу гомологичных последовательностей
• Эти специфические белки промежуточных филаментов сохранили свою структуру в процессе эволюции позвоночных
Клеткам хрусталика глаза позвоночных свойственны крайне жесткие критерии программы дифференцировки, что необходимо для последующего правильного функционирования ткани. Клетки должны:
• Обладать достаточной упругостью и в то же время эластичностью, которая допускает аккомодацию хрусталика.
• Сохранять полную прозрачность для того, чтобы не затемнять хрусталик.
• Сохранять перечисленные качества на протяжении всей жизни организма.
В клетках хрусталика содержатся два специфических белка, которые образуют «филаменты типа бус». Такое название они получили за характерный профиль поверхности, видимый в электронном микроскопе (остальные промежуточные филаменты имеют гладкую поверхность).
Эти белки называются СР49 (или факинин) и филензин. Они относятся к белкам VI типа. Оба белка имеют структурные характеристики, свойственные другим типам белков, однако их последовательности не гомологичны ни одной последовательности среди белков остальных групп.
Одним из наиболее существенных различий является наличие у них «знаковой» последовательности, свойственной белкам промежуточных филаментов, а именно последовательности на конце спирального участка. У CP49 на конце стержнеобразного домена находится последовательность Tyr-His-Gly-Ile-Leu-Asp-Gly-Glu, в то время как у других белков промежуточных филаментов на этом месте присутствует консервативная последовательность Tyr-Arg-Lys-Leu-Leu-Glu-Gly-Glu.
Гены, кодирующие СР49 и филензин, сильно отличаются от генов, кодирующих другие белки промежуточных филаментов. Такое своеобразие этих генов дает им селективное преимущество перед соответствующими генами других клеток, поскольку высоко гомологичные белки хрусталика сохраняются у всех позвоночных.
Последовательность, соответствующая CP49/факинину, обнаружена в геноме сростночелюстной рыбы Fugu ribripes, позвоночного организма, эволюционно очень далеко отстоящего от млекопитающих. Консервативность структуры проявляется даже у специфической последовательности, находящейся на конце спирального участка СР49/факинина.
Белки клеток хрусталика проявляют особые свойства в силу ряда причин. Во-первых, они обеспечивают развитие максимально прозрачного хрусталика. Во-вторых, поскольку хрусталик должен функционировать в течение всей жизни организма, его полимерные структуры должны обладать исключительной биохимической устойчивостью с тем чтобы не допустить деградации белков и изменений их структуры, которые могут привести к нарушению его физических или оптических характеристик и к утрате функции.
Считается, что специфические последовательности и морфологические особенности CP49 и филензина каким-то образом способствуют поддержанию свойств этих белков. В экспериментах на животных с измененным характером экспрессии белков филаментов хрусталика показано развитие последовательных нарушений функционирования хрусталика глаза. Также показано, что доминантные мутации в CP49 являются причиной развития ранней семейной катаракты у человека.
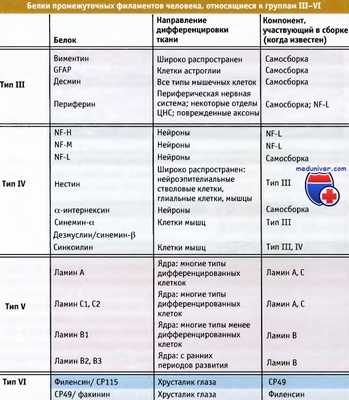
Белки промежуточных филаментов человека, объединенные в типы III—IV по принципу гомологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Промежуточные филаменты представляют собой основные компоненты ядерного и цитоплазматического цитоскелета
• Промежуточные филаменты необходимы для поддержания правильной структуры тканей и их функционирования
• По диаметру промежуточные филаменты находятся между актиновыми филаментами и микротрубочками и образуют прочные сети
• Промежуточные филаменты представляют собой полимеры, состоящие из белковых субъединиц
• Белки, из которых состоят промежуточные филаменты, гетерогенны и кодируются семейством больших и сложно устроенных генов
• У человека более 50 болезней обусловлены возникновением мутаций в белках промежуточных филаментов
Микротрубочки, актиновые филаменты (микрофиламенты) и промежуточные филаменты представляют собой три основные системы белковых филаментов, составляющих цитоскелет. Промежуточные филаменты образуют в цитоплазме и ядре сеть и присутствуют во всех клетках метазоа (животных).
В отличие от микротрубочек и актиновых филаментов, которые необходимы даже для выживания изолированных клеток in vitro, основная функция промежуточных филаментов проявляется на уровне тканевой организации, где они необходимы для надлежащего функционирования тканей и органов. Некоторые типы промежуточных филаментов участвуют в скреплении клеток друг с другом, что необходимо для формирования тканей.
Белки промежуточных филаментов кодируются несколькими большими семействами генов. Эти белки образуют сложную систему филаментов, на долю которых в клетке в нормальных физиологических условиях приходится до 80% общего клеточного белка. Внутриклеточное распределение промежуточных филаментов отличается от характерного для актиновых филаментов и микротрубочек.
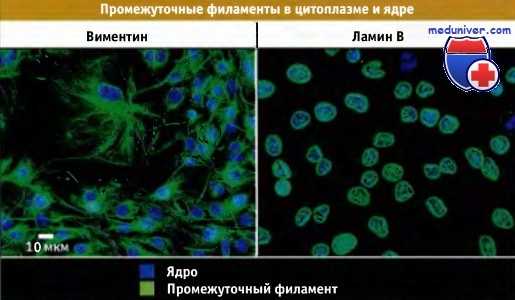
Распределение различных типов промежуточных филаментов в культивируемых фибробластах.
Иммунофлуоресцентное окрашивание на виментин и ламин В. Виментин находится в цитоплазме, а ламины в ядре.
Гистологи обнаружили их (в виде нейрофибрилл нейронов и тонофиламентов клеток эпидермиса) задолго до того, как в 1960-х гг. при электронно-микроскопическом исследовании мышечной ткани были описаны индивидуальные филаменты. В клетках мышц «промежуточные» филаменты занимали по диаметру среднее положение между «толстыми филаментами» миозина-II и «тонкими филаментами» актина. Их средний диаметр составляет около 10 нм, т. е. они толще, чем актиновые филаменты (около 8 нм), и тоньше микротрубочек (около 25 нм). Все три системы филаментов представлены рисунке ниже.
Белки промежуточных филаментов характеризуются общей молекулярной структурой и полимеризуются в филаменты, обладающие высокой механической прочностью. В электронном микроскопе они выглядят одинаково. У высших позвоночных семейство соответствующих белков организовано наиболее сложно, и этот вопрос будет рассмотрен в настоящей главе.
Похожие промежуточные филаменты также обнаружены у беспозвоночных, однако у них количество генов, кодирующих соответствующие белки, значительно меньше, чем у позвоночных. Также промежуточные филаменты беспозвоночных менее гетерогенны и обладают меньшей тканевой специфичностью, чем у млекопитающих. В геноме человека находится порядка 70 генов, кодирующих белки промежуточных филаментов. Принимая во внимание альтернативный сплайсинг для пары из них, общее количество этих белков приближается к 75.
Они представлены гораздо большим числом вариантов и более гетерогенны, чем актиновые или тубулиновые белки. Для всех белков промежуточных филаментов характерна тканеспецифическая экспрессия. Также их экспрессия изменяется в процессе дифференцировки.
Большинство сведений, касающихся экспрессии и биохимических свойств промежуточных филаментов, были получены до того, как были установлены их функции и связь с некоторыми заболеваниями. Сейчас показано, что мутации в генах белков промежуточных филаментов связаны с многими генетическими заболеваниями, которые характеризуются различными фенотипическими проявлениями. Они включают по меньшей мере 50 отдельных болезней, от фликтены до прогерии.
Почти все типы генов белков промежуточных филаментов связаны с той или иной формой проявления хрупкости тканей. Это позволяет предполагать, что для функционирования ткани in vivo необходима надлежащая механическая прочность и что в значительной степени она прямо или опосредованно связана с промежуточными филаментами. Принимая во внимание, что экспрессия генов белков промежуточных филаментов носит тканеспецифический характер, весьма возможно, что все эти белки придают клеткам тканей мельчайшие оттенки различия. Клеткам тканей необходимы различные свойства, такие как прочность, пластичность, быстрота сборки и разборки структур, обеспечивающих прочность.
Может быть, в этом кроется причина того, что в ходе эволюции возникло столь много генов, кодирующих белки промежуточных филаментов.

Основные компоненты цитоскелета в электронном микроскопе.
На ультратонком срезе клетки эпителия почки видны актиновые микрофиламенты, промежуточные филаменты К8/К18 и микротрубочки.
• In vitro сборка промежуточных филаментов происходит быстро и не требует участия дополнительных факторов
• Во всех белках промежуточных филаментов в центральной части присутствует протяженный а-спирализованный стержневой домен, который необходим для формирования димеров
• Сборка из антипараллельных тетрамеров определяет неполярную природу цитоплазматических промежуточных филаментов
• Сеть промежуточных филаментов является более прочной по сравнению с актиновыми филаментами или микротрубочками, и при нагрузке ее прочность усиливается
В настоящее время на основании данных анализа аминокислотных последовательностей и степени гомологии, а также сведений о биохимических свойствах и кристаллической структуре фрагментов накапливается информация о строении белков промежуточных филаментов.
Первая стадия сборки промежуточных филаментов состоит в образовании суперспирализованных димеров за счет взаимодействия а-спирализованных концевых доменов. Альфа-спираль является наиболее распространенным элементом вторичной структуры белков и впервые была обнаружена именно у белков промежуточных филаментов. У белков промежуточных филаментов а-спирали очень длинные. Для приобретения устойчивости в цитоплазме стержнеобразный домен должен образовать суперспираль с а-спирализованным стержневым доменом другого белка промежуточного филамента.
Необходимость такого взаимодействия объясняется присутствием протяженного гидрофобного участка, который распространяется вдоль а-спирали и служит причиной неустойчивости мономера в водном окружении цитозоля. В а-спирали на каждые семь остатков аминокислот (положения которых в каждой гептаде обозначаются буквами a-g) приходится два витка. В положениях а и d находятся, главным образом, гидрофобные (обычно это лейцин, изолейцин, валин, аланин или метионин) или объемные (фенилаланин или триптофан) остатки.
При образовании суперспирали гидрофобные остатки в положениях а и d в обоих полипептидах оказываются между двумя спиралями. (Эта последовательность а-спирали в белках иногда называется «лейциновая молния».) Структурным элементом 10-нм промежуточного филамента является суперспирализованный димер, в длину достигающий 45 нм. Если такого взаимодействия между белками промежуточных филаментов не происходит, то мономеры скручиваются неправильно и подвергаются протеолизу.
Исследования кератинов помогли прояснить многие детали начальных этапов сборки ранних филаментов, поскольку исследователи могли опираться на закономерности образования димеров тип I/тип II. В клетке мономер кератина неустойчив и начинает деградировать, поэтому для того, чтобы определить, какие особенности структуры способствуют образованию димеров, в клетки дополнительно трансфецируют различные кератиновые конструкции.
В подобных экспериментах было показано, что в клетке мономеры, действительно, оказываются неустойчивыми, и в отличие от гетеродимеров кератинов, гомодимеры не способны образовывать филаменты.
Промежуточные филаменты имеют неполярную природу и представляют собой полифибриллярные полимеры. Это сильно затрудняет изучение процесса их сборки. Почти вся доступная информация получена на основании исследований in vitro и относится только к стержневым доменам. На рисунке ниже представлена общая модель сборки цитоплазматических промежуточных филаментов in vitro. Согласно этой модели, димеры белков промежуточных филаментов цитоплазмы быстро образуют антипараллельные, наполовину смещенные тетрамеры, которые представляют собой минимальные стабильные элементы.
(В отличие от цитоплазматических филаментов, филаменты ядерной ламины собираются в виде параллельных димеров, расположенных ко-нец-в-конец, и соединенные в нити, причем димеры не ассоциируют в тетрамеры латерально.)
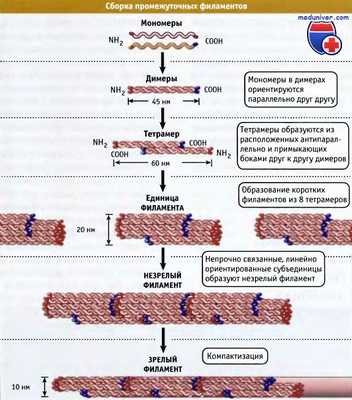
Современная модель сборки промежуточных филаментов из мономерных белков.
Образование димеров происходит очень быстро и является необходимым условием предотвращения деградации белка.
По-видимому, тетрамеры являются минимальными по величине агрегатами in vivo. Для простоты неспирализованные домены не показаны.
Последовательности на границе спирализованных и стержневого доменов обозначены красным (со стороны N-концевого участка) и синим цветом (со стороны C-концевого участка).
В клетках сборка в полимерные филаменты происходит, вероятно, быстро. Однако в системах, где процесс может замедляться, он проходит следующие три стадии:
• Быстрая латеральная ассоциация восьми тетрамеров с образованием коротких (60 нм) и толстых (20 нм ширины) «элементарных филаментов» (ULF), после чего
• Ассоциация ULF конец-в-конец в неплотный толстый незрелый филамент, а затем
• Дальнейшая компактизация незрелой структуры с образованием длинного зрелого 10-нм филамента, имеющего гладкую поверхность и среднюю толщину 32 полипептидных цепи.
Эта последовательность стадий сборки in vitro описана для нескольких белков промежуточных филаментов клеток различных организмов, хотя скорость и эффективность протекания отдельных стадий для разных белков варьируют. Предложенная модель сборки согласуется с характером аминокислотных последовательностей в белках промежуточных филаментов: латеральная ассоциация тетрамеров с образованием ULF происходит за счет взаимодействия в стержневом домене заряженных остатков, а ассоциация тетрамеров в филаменты по типу конец-в-конец происходит за счет консервативного мотива, расположенного на границе спирального участка.
Перекрывание пептидов, расположенных на границе спиральных участков, которое происходит по мере сборки субъединиц в филаменты, позволяет объяснить, почему мутации в этих последовательностях влекут за собой тяжелые последствия, и мутации по этим сайтам в белках К5/К14 приводят к сильному поражению кожи при EBS.
Анализ взаимодействий, которые существуют между ближайшими соседями зрелых филаментов, подтверждает наличие гораздо большего числа латеральных взаимодействий, чем в тетрамере. Некоторые из этих взаимодействий могли сформироваться при компактизации, за счет более плотной упаковки субъединиц, продольного сдвига цепей, а также взаимодействий между ними, т. е. когда филамент принимает зрелую конфигурацию.
Дальнейшее формирование филаментов может обеспечиваться взаимодействиями между концевыми доменами, участие которых в упаковке филамента в рамках модели, представленной на рисунке ниже, не учитывается. Исходя из данных структурного анализа, можно предполагать, что головные домены способны взаимодействовать со стержневыми доменами той же или соседней молекулы и что хвостовые домены могут быть более компактными (как в ламинах).
На рисунке ниже представлена модель строения тетрамера белка виментинд, построенная на основании информации, связывающей кристаллическую структуру участка стержневого домена виментина с расчетными структурами. В этой модели можно видеть, насколько протяженный участок занимают закрученные вокруг друг друга а-спирализованные субдомены каждого из двух димеров, изображенные в виде антипараллельных наполовину смещенных структур, т. е. так, как будто они находятся в составе тетрамера.
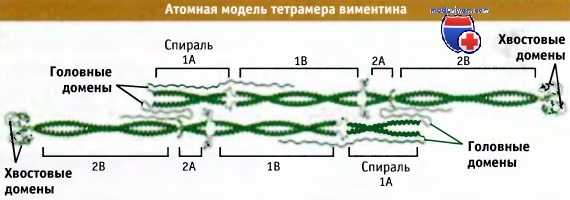
Атомная модель виментина, белка группы III, представляющего собой гомополимер.
Модель построена на основании данных по кристаллической структуре, имеющихся для отдельных частей молекулы, и гомологичного моделирования ее остальных частей.
Когда белок собирается в филаменты, головные домены, вероятно, ассоциируют со стержневыми в отмеченных областях.
В зависимости от типа промежуточного филамента, димеры представляют собой гомодимеры, или гетеродимеры (как кератины).
О сборке промежуточных филаментов in vivo известно немного. По-видимому, в клетке содержится мало неполимеризованных белков промежуточных филаментов (до 5% простых кератинов, в то время как для актина и тубулина эта цифра составляет 25-50%). Из-за нестабильности длинного а-спирального стержневого домена после синтеза белков должна происходить быстрая сборка филаментов. Возможно также участие шаперонов, которые связываются с белками-мишенями, обычно на промежуточных этапах сборки, и обеспечивают формирование у них правильных пространственных структур.
Некоторые шапероны, такие как, например, небольшие белки теплового шока Hsp27 и а-, b-кристаллины, взаимодействуют с белками промежуточных филаментов после получения клеткой повреждений. Для того чтобы обеспечить формирование нативной структуры, белки промежуточных филаментов должны взаимодействовать друг с другом (т. е. должно происходить быстрое образование суперспирального димера с другим белком с тем, чтобы предотвратить образование неправильной структуры и ее деградацию). Поэтому в роли шаперона для молекулы белка промежуточных филаментов может выступать другой белок промежуточных филаментов.
Наблюдения за характером экспрессии белков в дифференцирующихся клетках позволяют предполагать, что структура филамента может меняться за счет конкурентного замещения предшествующих белков в филаментах вторичными белками. Таким образом, первичные филаменты могут использоваться в качестве матрицы для сборки вторичных филаментов.
По данным экспериментов in vitro, промежуточные филаменты обладают гораздо большей прочностью на разрыв, чем микротрубочки и актиновые филаменты. Исследования растяжения кератиновых промежуточных филаментов показали их высокую прочность, эластичность, и формирование пластичных необратимых деформаций. Когда in vitro к разным типам промежуточных филаментов применяется механическое воздействие, они проявляют различные биофизические свойства. В отличие от микротрубочек и актиновых филаментов, промежуточные филаменты обнаруживают увеличение устойчивости к деформациям по мере усиления механического воздействия (это свойство называется механическое упрочнение).
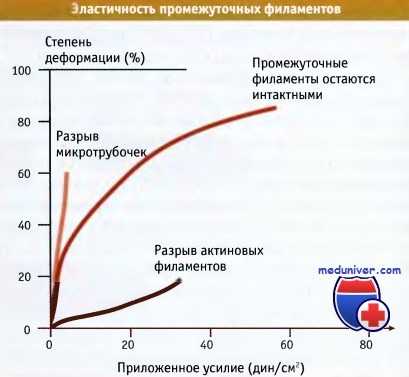
Промежуточные филаменты гораздо более устойчивы на разрыв,
чем микротрубочки или актиновые волокна, которые разрываются при небольших нагрузках.
Устойчивость к разрыву измеряли по степени деформации (растяжения),
которую вызывали усилием, приложенным к филаментам, выделенным из клеток.
Промежуточные филаменты
Промежуточные филаменты состоят из большой группы родственных белков, которую делят на четыре типа. Первый тип – кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярный вес кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходный молекулярный вес (45-53 тыс.). Это – виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин – характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии – в астроциты и некоторые Шванновские клетки. Периферин – входит в состав периферических и центральных нейронов.
Третий тип – белки нейрофиламентов (мол. вес от 60 до 130 тыс.) встречается в аксонах нервных клеток.
И наконец, четвертый тип – белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты, построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином, или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает a-спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину, и не имеют a-спирального строения. Наличие протяженных a-спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому, что приводит к образованию палочковидного димера, длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент, тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы и в конечном итоге в промежуточный полный филамент, состоящий из 8 продольных протофиламентов (рис. 242).
Белки ядерной ламины образуют рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживущим элементам цитоскелета.
Особенности строения и химическая устойчивость промежуточных филаментов определяет их физическую устойчивость. Они служат как бы истинно опорной системой в клетках подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ или нейрофиламенты создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клеток десминовые филаменты входят в состав z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
Читайте также:
