Механизмы накопления жировой ткани у плода
Добавил пользователь Skiper Обновлено: 24.01.2026
Цель исследования. Оценить особенности жирового обмена у беременных в зависимости от срока гестации, массы и характера распределения жировой ткани. Материалы и методы. В проспективном когортном исследовании приняли участие 939 женщин с одноплодной беременностью, наступившей в естественном цикле и завершившейся срочными родами, без тяжелой экстрагенитальной и инфекционной патологии, которые в зависимости от индекса массы тела (ИМТ) были разделены на 3 группы: с нормальным весом (n=392), c избыточной массой тела (n=312) и ожирением (n=235). Лабораторное обследование включало определение сывороточной концентрации общего холестерина (ОХ), липопротеинов низкой и высокой плотности (ЛПНП, ЛПВП) и триглицеридов (ТГ). Определяли массу жировой ткани (ЖМ) методом биоимпедансометрии, толщину подкожного (тПКЖ) и висцерального жира (тВЖ) с помощью ультразвукового исследования (УЗИ). Результаты. Средние концентрации липидов увеличивались у всех беременных с ростом срока гестации, при этом у женщин с избыточной массой тела и ожирением на протяжении всей беременности установлены более высокие показатели атерогенных фракций липидов на фоне снижения уровня ЛПВП. Выраженность дислипидемии независимо от исходного ИМТ определялась характером жироотложения, демонстрируя наиболее неблагоприятное сочетание с висцеральным типом жироотложения.
1. Lindsay K.L., Hellmuth C., Uhl O., Buss C., Wadhwa P.D., Koletzko B., et al.. Longitudinal Metabolomic Profiling of Amino Acids and Lipids across Healthy Pregnancy. Ashton N, ed. PLoS ONE. 2015. vol. 10. no 12. Р. 0145794.
2. Иванова О.О., Стародубцева Н.Л., Шмаков Р.Г. Роль липидов в развитии осложнений беременности // Акушерство и гинекология. 2018. № 4. С. 5–9.
3. Gallos I.D., Sivakumar K., Kilby M.D., et al. Pre-eclampsia is associated with, and preceded by, hypertriglyceridaemia: a meta-analysis. BJOG. 2013. vol. 120. no 11. Р. 1321–1332.
4. Ryckman K.K., Spracklen C.N., Smith C.J., Robinson J.G., Saftlas A.F. Maternal lipid levels durin., vol. 122. no 5. Р. 643–51.
6. Varadinova M.R., Metodieva R., Boyadzhieva N. Fetal programming of metabolic disorders. Akush Ginekol (Sofiia). Review. 2015. vol. 54. no 8. Р. 32-36.
7. Kabaran S., Besler H.T. Do fatty acids affect fetal programming? Journal of Health, Population and Nutrition. 2015. vol. 33. P. 14.
8. Shoji H., Murano Y., Mori M., Matsunaga N., Ohkawa N., Suganuma H., et al. Lipid profile and atherogenic indices soon after birth in Japanese preterm infants. Acta Paediatrica. Wiley. 2013. vol. 103. no 1. Р. 22–26.
9. Василькова Т.Н., Баклаева Т.Б., Матаев С.И., Рыбина Ю.А. Зависимость показателей липидного обмена от выраженности и характера жироотложения у больных артериальной гипертензией и ожирением // Медицинская наука и образование Урала. 2013. Т. 14. № 4 (76). С. 102–104.
10. Чабанова Н.Б., Василькова Т.Н., Баклаева Т.Б. Возможности ультразвукового исследования в диагностике ожирения у беременных // Российский электронный журнал лучевой диагностики. 2017. Т. 7. № 1. С. 108–114.
11. Armellini F., Zamboni M., Rigo L. et al. The contribution of sonography to the measurement of intra-abdominal fat. J. Clin. Ultrasound. 1990. vol. 18. no 7. Р. 563–567.
12. Tayama K., Inukai T., Shimomura Y. Preperitoneal fat deposition estimated by ultrasonography in patients with noninsulin-dependent diabetes mellitus. Diabetes Research and Clinical Practice. 1999. vol. 43. no 1. Р. 49–58.
13. Suzuki R., Watanabe S., Hirai Y. et al. Abdominal wall fat index, estimated by ultrasonography, for assessment of the ratio of visceral fat to subcutaneous fat in the abdomen. Am. J. Med. 1993. vol. 95. no 3. Р. 309–314.
14. Чабанова Н.Б., Василькова Т.Н., Полякова В.А., Шевлюкова Т.П. Оценка характера жироотложения в динамике гестационного процесса по данным ультразвукового исследования // Российский электронный журнал лучевой диагностики. 2018. Т. 8. № 1. С. 129–136.
15. Суплотова Л.А, Сметанина С.А., Плотников Н.В., Мурычева К.А. Клинико-метаболические и молекулярно-генетические ассоциации у женщин репродуктивного возраста при инсулинорезистентности, ожирении и метаболическом синдроме // Медицинская наука и образование Урала. 2013. Т. 14. № 2 (74). С. 84–87.
Физиологическая беременность сопровождается гормональными и метаболическими изменениями, в том числе и у здоровых женщин, не имеющих избыточной массы тела и ожирения, направленными на непрерывное поступление питательных веществ к плоду, независимо от особенностей и характера питания матери. Известно, что большое значение для развития плода и новорожденного имеет метаболизм липидов [1].
Экспериментальные и клинические исследования последних лет демонстрируют тесную взаимосвязь избыточного накопления жировой ткани с нарушением регуляции метаболического баланса, в том числе и липидного обмена, что в свою очередь может стать основной составляющей в этиологии акушерской патологии, в частности преэклампсии и гестационного сахарного диабета [2–4].
Пристальное внимание ученых в последние годы обращено к проблеме фетального программирования хронических заболеваний у взрослых, согласно которой риск ожирения и сопутствующей неинфекционной патологии предопределяется особенностями внутриутробного развития и во многом зависит от нутритивного статуса матери [5]. В литературе появляется все больше данных, свидетельствующих о роли гиперлипидемии при беременности в эпигенетическом программировании и увеличении риска атерогенеза для матери и ее потомства в будущем [6–8].
Вместе с тем данные о направленности метаболизма липидов во время беременности неоднозначны. Вероятно, объяснением этому служит тот факт, что в большинстве исследований в качестве маркера ожирения используется индекс массы тела, который на индивидуальном уровне не всегда в достаточной мере отражает массу жировой ткани и особенно характер ее преимущественного расположения. В то же время установлено, что развитие целого ряда метаболических нарушений связано в первую очередь с висцеральной жировой тканью. Ранее проведенными исследованиями было показано, что преимущественно висцеральный характер жироотложения является фактором риска сердечно-сосудистых осложнений у лиц, в том числе не имеющих избыточной массы тела и ожирения [9].
Несмотря на высокую распространенность избыточной массы тела и ожирения среди беременных, на сегодняшний день недостаточно изучено влияние характера накопления и распределения жировой ткани на развитие клинических метаболических нарушений, особенно у беременных с нормальной массой тела.
Учитывая вышеизложенное, раскрытие механизмов метаболических изменений во время беременности и их ассоциации с особенностями состава тела, массой и характером жироотложения, особенно у женщин, не имеющих избыточной массы тела и ожирения, является актуальным на сегодняшний день и должно способствовать пониманию взаимосвязи этих нарушений с акушерскими и перинатальными исходами.
Целью настоящего исследования явилось изучение особенностей липидного обмена у женщин в зависимости от индекса массы тела, срока беременности, а также массы и характера жироотложения.
Материалы и методы исследования. В проспективном когортном исследовании на основании добровольного информированного согласия приняли участие 939 женщин с одноплодной беременностью, наступившей в естественном цикле и завершившейся срочными родами, без тяжелой соматической и инфекционной патологии (за исключением избыточной массы тела и ожирения). При постановке на диспансерный учет по беременности всем женщинам проводили традиционное антропометрическое исследование с измерением роста в сантиметрах, веса в килограммах с последующим вычислением ИМТ отношением веса в килограммах к росту в метрах квадратных. В зависимости от исходного ИМТ женщины были разделены на 3 группы – с нормальной массой тела (n=392), с избыточной массой тела (n=312) и с ожирением (n=235). В соответствии с поставленной целью всем беременным дополнительно определяли массу жировой ткани (ЖМ) биоимпедансным методом с использованием аппарата АВС-01 «МЕДАСС» («МЕДАСС», Россия) и характер жироотложения с помощью ультразвукового исследования (УЗИ) [10]. Измеряли толщину подкожного жира (тПКЖ) и толщину висцерального жира (тВЖ), представленного двумя фракциями – слоем внутрибрюшного жира (тВБЖ) и преперитонеального жира (тППЖ) [11, 12] с последующим вычислением индекса жира брюшной стенки (ИЖБС) соотношением максимальной толщины ППЖ к минимальной толщине ПКЖ. Висцеральный тип преимущественного жироотложения устанавливали при величине индекса более 1 и подкожный тип – при показателе индекса менее 1 [13]. Лабораторное обследование включало определение концентрации общего холестерина (ОХ), триглицеридов (ТГ), липопротеинов низкой (ЛПНП) и высокой плотности (ЛПВП). Срок беременности определяли по анамнестическим данным (дате последней менструации, первой явке в женскую консультацию) и результатам ультразвуковой фетометрии. Исследование проводили трижды в течение беременности – в конце I, II и III триместра.
Статистическая обработка полученных данных выполнена с помощью пакета программ Statistica 12,0 (США). Проверка нормальности распределения количественных признаков в группах сравнения проводилась с использованием критериев Колмогорова–Смирнова, Шапиро–Уилка. Количественные переменные при нормальном распределении представлены в виде среднего значения и стандартного отклонения (М±SD), при распределении, отличном от нормального, – в виде медианы и значений 25–75-го перцентиля – Me [LQ; UQ]. Различия между выборками устанавливались путем проверок нулевых статистических гипотез с использованием непараметрического критерия Манна–Уитни (U-критерий) для дисперсионного анализа двух независимых выборок и с помощью критерия Краскела–Уоллиса (H-критерий) – при сравнении трех выборок. Для определения ассоциации между переменными использован метод ранговой корреляции Спирмена. Критическое значение уровня статистической значимости (р) при проверке нулевых гипотез принималось равным 0,05.
Результаты исследования и их обсуждение. В ходе анализа динамики показателей липидограммы по триместрам установлено, что средние концентрации липидов увеличиваются у всех беременных c ростом срока гестации, при этом концентрация атерогенных липидов, представленных ТГ, ЛПНП и ОХ, была достоверно выше у женщин с избыточной массой тела и ожирением (р<0,05) (рис. 1а-в). Вместе с тем уровень ЛПВП имеет тенденцию к снижению пропорционально предгестационному ИМТ (рис. 1г).
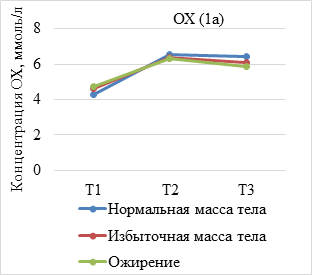
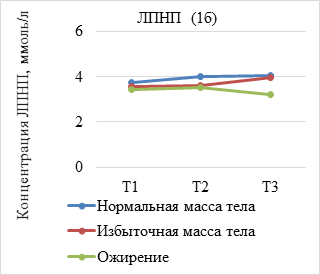
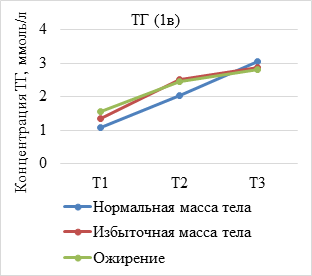
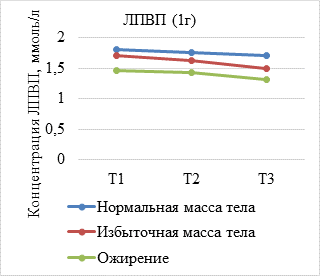
(А–Г). Динамика показателей липидограммы у беременных с нормальной, избыточной массой тела и ожирением. Т1 – I триместр; Т2 – II триместр; Т3 – III триместр
В результате оценки параметров липидограммы у беременных в I триместре установлено, что, несмотря на нормальные показатели уровня ТГ и ЛПВП во всех группах, наблюдалось статистически значимое уменьшение уровня ЛПВП (р=0,009) и нарастание концентрации триглицеридов (р=0,002) пропорционально увеличению ИМТ. Показатели ОХ увеличивались незначительно, а уровень ЛПВП уменьшался с ростом ИМТ при отсутствии статистически значимых различий между группами (р=0,430; р=0,378).
Во II триместре беременности уровень ОХ, ЛПНП и ТГ увеличивался во всех исследуемых группах. При этом содержание ОХ у женщин с нормальным весом составило 6,57±1,53 ммоль/л, что незначительно превышало данный показатель в группе с избыточным весом (6,4±1,2 моль/л) и ожирением (6,3±1,25 ммоль/л), различия между группами статистически не значимы (р=0,184). Концентрация ТГ во II триместре во всех группах превышала нормальные значения и составила 2,02±0,87 ммоль/л у женщин с нормальной массой тела и 2,50±0,66 ммоль/л при избыточном весе, что в 1,9 раз выше, чем в I триместре. У беременных с ожирением в конце II триместра концентрация триглицеридов в 1,6 раза превышала показатели I триместра. Различия между группами статистически значимы (р=0,035). Концентрация ЛПВН во II триместре уменьшилась при отсутствии достоверных различий между группами (р=0,109).
Сравнительный анализ динамики увеличения концентрации показателей липидограммы у беременных продемонстрировал различные темпы их роста в зависимости от предгестационного ИМТ. Так, у женщин с ожирением установлены более низкие темпы увеличения уровня ТГ, а также ОХ, ЛПНП.
Ранее нами было показано, что в период беременности происходят существенные изменения жирового компонента состава тела, которые наиболее выражены у женщин с предгестационным ИМТ 18–24,99 кг/м2. С помощью ультразвукового исследования было установлено, что у беременных с нормальной массой тела на протяжении всего гестационного периода наблюдалось увеличение тПКЖ (r=0,216; р=0,026) и тППЖ (r=0,587; p=0,000), что в совокупности приводило к увеличению ИЖБС (r=0,383; р=0,000), отражающего перераспределение жировых отложений с преимущественным накоплением в висцеральной области. Подобная тенденция наблюдалась у беременных с избыточной массой тела [14].
Анализ показателей липидограммы в зависимости от характера жироотложения позволил установить, что в I триместре беременности, несмотря на нормальные показатели липидного спектра, концентрация ОХ, ТГ и ЛПНП была выше, а ЛПВП – ниже при преимущественно висцеральном типе жироотложения по сравнению с аналогичными показателями в группе с подкожным типом распределения жировой ткани. Подобная тенденция наблюдалась в группе с избыточной массой тела. У беременных с ожирением на протяжении всего гестационного периода атерогенные фракции липидов также характеризовались наиболее высокими значениями в группе с преимущественно висцеральным типом накопления жировой ткани.
С целью оценки ассоциации изучаемых клинико-метаболических показателей у беременных был проведен корреляционный анализ, в ходе которого выявлено наличие тесных взаимосвязей между показателями липидограммы, антропометрическими данными, массой и характером распределения жировой ткани.
Установлено, что нарастающий дисбаланс показателей липидограммы сопровождался увеличением ИМТ и перераспределением жировых отложений с локализацией преимущественно в висцеральной области (таблица).
Корреляционные взаимосвязи показателей липидного обмена с антропометрическими данными и характером жироотложения по результатам УЗИ
Механизмы накопления жировой ткани у плода
Физиология обмена жиров у плода и новорожденного ребенка
Наиболее выраженные изменения метаболизма липидов происходят при рождении. Эти изменения касаются скорости поступления в организм жирных кислот, их роли как источников энергии и значения для накопления жировой ткани. Плод получает жирные кислоты от матери путем переноса их через плаценту.
В случае преждевременных родов этот путь передачи прерывается. После рождения ребенка способность усваивать энергетические субстраты и нутриенты зависит от степени зрелости и функциональных возможностей ЖКТ. У недоношенных детей, которые способны усваивать энтеральное питание, всасывание жирных кислот происходит через стенку кишечника после переваривания жира, находящегося в составе грудного молока или молочной смеси. К детям, находящимся на парентеральном питании, жирные кислоты поступают в форме внутривенных липидов.
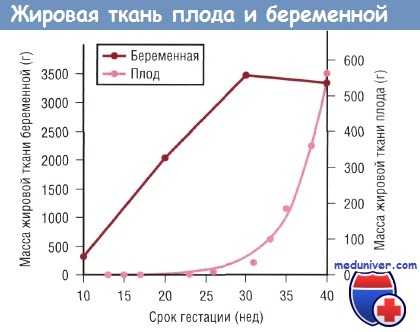
В процессе развития плода основным источником энергии является глюкоза, меньшее значение имеют лактат и излишек аминокислот. Жирные кислоты играют минимальную роль в энергетическом обеспечении плода, но после рождения ребенка они становятся основными источниками энергии. Накопление жировой ткани у плода происходит преимущественно в конце III триместра. Следовательно, преждевременно рожденные младенцы имеют ограниченный запас жировой ткани при рождении.
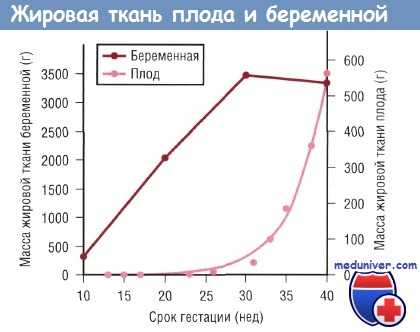
Изменения массы жировой ткани беременной и плода в зависимости от срока гестации. Данные по плоду отражают изменения в позднем фетальном периоде (в течение 9 нед до окончания полного срока беременности), когда рост плода зависит от поступающих через плаценту питательных веществ.
После рождения жирные кислоты, находящиеся в жировых депо, расходуются в качестве источников энергии и структурных компонентов новых клеточных мембран. Недоношенные дети, у которых при рождении запасы жировой ткани недостаточны, в большей степени по сравнению с доношенными младенцами зависят от поступления липидов с пищей или с парентеральным питанием для удовлетворения потребности в жирных кислотах. В перинатальном периоде ребенку необходимо большое количество жирных кислот для обеспечения высокой скорости роста, что особенно актуально для головного мозга.
При формировании мембран в нервной ткани нужно большое количество жирных кислот для образования фосфолипидов. Кроме того, необходимы стеролы и сложные липиды. Серое вещество головного мозга содержит в большом количестве как 22:6 n-3, так и 20:4 n-6. Палочки и колбочки сетчатки также содержат много 22:6 n-3. Около 50% всех жирных кислот в наружном сегменте палочек составляют жирные кислоты 22:6 n-3. Поскольку в организме млекопитающих образование омега-6 и омега-3 ПНЖК невозможно, они должны поступать с пищей или отдельно в виде DHA и ARA либо «родительских» жирных кислот — ALA и LA соответственно.
Многие смеси, предназначенные для вскармливания детей, содержат добавки ARA и DHA. Кроме того, стало возможным дополнительное обогащение DHA специализированных продуктов питания для беременных и кормящих женщин.
За последние два десятилетия наибольший интерес в исследованиях потребности в липидах вызывает роль омега-6 и омега-3 ДЦПНЖК в развитии зрительного анализатора и когнитивной функции ребенка. Особое внимание уделяется жирным кислотам 22:6 n-3 и 20:4 n-6. Они обнаружены в грудном молоке, причем уровни DHA колеблются от 0,1 до 1% общего количества жирных кислот. Уровни ARA менее вариабельны и составляют обычно 0,3—0,7% общего количества.
Кишечник ребенка может повреждаться при различных патологических состояниях, что приводит к нарушению усвоения пищи и возникновению ЯНЭК. Чем меньше срок гестации и масса тела при рождении, тем больше риск возникновения различных заболеваний. Клиническими показателями здоровья (или отсутствия заболевания) служат нутритивный статус (антропометрические и физиологические параметры) и функциональные возможности ребенка, связанные с физическим ростом и неврологическим развитием. Клиническая оценка питания заключается в оценке общего состояния ребенка, его толерантности к пищевой нагрузке, а также в наличии симптомов недостаточного или избыточного питания. Сниженные запасы жировой ткани и питательных веществ, связанные с недоношенностью или задержкой внутриутробного развития, необходимость в парентеральном питании, эпизоды ограниченного поступления в организм энергии и высокая потребность в питательных веществах могут влиять на рост и развитие ребенка.
Способ энтерального кормления для каждого конкретного ребенка выбирают с учетом срока гестации, массы тела при рождении и клинического состояния. Прежде чем начать энтеральное кормление, необходимо убедиться в отсутствии структурных аномалий, а также учесть состояние ЖКТ и респираторной системы. Для создания алгоритма энтерального кормления недоношенного ребенка необходимо ответить на следующие вопросы: когда начинать кормление, чем кормить ребенка (грудным молоком или смесью), каким способом, а также определить частоту приемов пищи и скорость увеличения объема питания. Некоторые дети до начала энтерального кормления получают парентеральное питание. Другими словами, выбор режима питания ребенка основывается на многих факторах, что обусловливает разнообразие индивидуальных подходов в отношении недоношенных детей и детей с задержкой внутриутробного развития.
Недоношенные дети с незрелым ЖКТ и ограниченными запасами жировой ткани составляют группу риска по постнатальной задержке физического развития. Плохая переносимость энтерального питания может привести к уменьшению поступающей к ребенку энергии, развитию дефицита питательных веществ, мальабсорбции жиров и клиническим симптомам дефицита незаменимых жирных кислот. Плохая переносимость питания может быть следствием незрелости ЖКТ и пищеварительных ферментов, получения ребенком питательной смеси с повышенной осмолярностью, слишком быстрого увеличения объема питания, а также следствием таких патологических состояний, как ЯНЭК или сепсис. К симптомам непереносимости пищи относят учащение периодов апноэ и брадикардии, связанных с питанием, увеличение остаточного объема содержимого желудка, вздутие живота, рвоту, обильные срыгивания, наличие в стуле крови или непереваренной пищи. Плохой сосательный рефлекс или неспособность координировать одновременно сосание и глотание также ограничивают возможность ребенка получать адекватное количество энергии и питательных веществ. Как было показано, первичное питание (питание небольшими объемами грудного молока или искусственной смесью) в первые несколько дней может стимулировать активность ЖКТ и улучшить толерантность к энтеральному кормлению. Для оптимального роста и развития очень важна возможность обеспечивать адекватное питание, одним из компонентов которого являются пищевые жиры.
Мальабсорбция жиров может привести к дефициту незаменимых жирных кислот, жирорастворимых витаминов (A, D, Е, К). Наиболее часто у недоношенных детей отмечают дефицит кальция, фосфора, витаминов D и Е, железа, цинка, карнитина, незаменимых жирных кислот и белка. Заподозрить мальабсорбцию жиров можно по изменению характера стула, который становится обильным, жирным, приобретает зловонный запах. В случае недостаточной функции поджелудочной железы или дефицита желчных кислот стул может стать белым, серым или цвета глины. Клинические симптомы дефицита незаменимых жирных кислот включают чешуйчатый дерматит, тромбоцитопению, повышенный риск возникновения инфекций, недостаточный рост и алопецию.
В течение неонатального периода, особенно у недоношенных детей или детей с задержкой внутриутробного развития, может отмечаться несовершенство терморегуляции. Новорожденные адаптируются к холодовому стрессу, вырабатывая тепло за счет калорий, необходимых для роста. Сокращение во время холодового стресса запасов бурой жировой ткани обеспечивает организм энергией за счет недрожательного термогенеза. Тепло также образуется, когда ребенок плачет и двигается. Метаболизм бурой жировой ткани, обеспечивающий производство тепла, характерен только для новорожденных. Дети с малой массой тела или менее зрелые к моменту рождения имеют неадекватные запасы жира, большую площадь поверхности по отношению к массе тела и большее содержание воды в организме. Это способствует большим потерям жидкости и, соответственно, тепла. Среди недоношенных детей нарушение температурного контроля встречается чаще, чем у доношенных.
Суммируя сказанное, можно сделать вывод о значимом различии между физиологией и метаболизмом липидов у плодов и недоношенных детей. Жиры пищи являются важнейшими источниками энергии после рождения. Существенными для развития ЦНС и, возможно, иммунной системы являются омега-6 и омега-3 ДЦПНЖК, которые ребенок получает постнатально в виде ARA и DHA или которые образуются in situ из незаменимых жирных кислот пищи LA и ALA. Преждевременно родившиеся дети зависят от функциональной зрелости ЖКТ, т.к. она определяет способность ребенка получать адекватное количество энергии для роста и необходимое количество омега-6 и омега-3 жирных кислот для развития ЦНС. За последние несколько лет произошли значительные сдвиги в понимании физиологии фетального и постнатального периодов, вопросов питания и лечения недоношенных детей, что мы представили в следующих статьях на нашем сайте МедУнивер. Тем не менее остается еще много нерешенных вопросов. Дальнейшие исследования могут помочь улучшить качество нутритивной поддержки недоношенных младенцев.
Механизмы переноса жирных кислот через плаценту
В основном плод получает жирные кислоты от матери трансплацентарным путем. Меньшее значение имеет синтез жирных кислот в организме плода. Поскольку организм млекопитающих не способен синтезировать омега-6 и омега-3 ПНЖК, плод должен получить их от матери в виде «родительских» жирных кислот с 18 атомами углерода в цепи (18:2 n-6, 18:3 n-3) или их длинноцепочечных аналогов (20:4 n-6, 20:5 n-3, 22:6 n-3).
Плацента, а также печень и головной мозг плода обладают способностью конвертировать 18:2 n-6 в 20:4 n-6; 18:3 n-3 в 20:5 n-3 и 22:6 n-3.
Однако появляется все больше доказательств того, что плод в большей степени ориентирован на трансплацентарную передачу уже сформированных омега-6 и омега-3 ДЦПНЖК для покрытия потребности в омега-6 и омега-3 ДЦПНЖК, необходимых для роста тканей. В крови плода уровни омега-6 и омега-3 ДЦПНЖК (преимущественно 20:4 n—6 и 22:6 n-3) выше, чем в крови матери.
Уровни 18:2 n-6 и 18:3 n-3 у плода ниже материнских. Процесс поступления жирных кислот 20:4 n-6 и 22:6 n-3 против градиента концентрации от матери к плоду называют биомагнификацией.
Перенос питательных веществ является важнейшей функцией гемохориальной плаценты человека, которая уникальна тем, что хорион плода непосредственно контактирует с кровью матери. Перенос омега-6 и омега-3 жирных кислот, которым отдается предпочтение, заключается в селективном захвате их синцитиотрофобластом путем метаболических механизмов внутриклеточной передачи отдельных жирных кислот и селективного экспорта в кровоток плода.
Жирные кислоты переносятся через микроворсины и базальные мембраны посредством простой диффузии или избирательно с помощью транспортных белков. Селективная передача жирных кислот и других нутриентов из материнской плазмы в плазму плода предполагает активное участие переносчиков, которые были обнаружены на поверхности как материнской, так и фетальной плацентарных мембран.
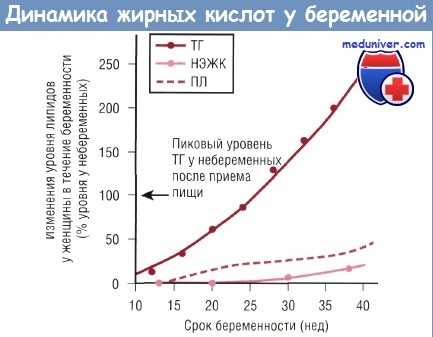
Изменение концентрации триглицеридов (ТГ), плацентарного лептина (ПЛ) и неэстерифицированных жирных кислот (НЭЖК) в плазме крови беременной в зависимости от срока беременности в сравнении с уровнем у небеременных женщин: указан типичный максимальный уровень при повышении триглицеридов плазмы в ответ на употребление жирной пищи.
Были опубликованы доказательства того, что связывающий жирные кислоты протеин, находящийся в цитоплазматической мембране плаценты (p-FABPpm), связывает преимущественно омега-6 и омега-3 жирные кислоты. Исследования плацентарных мембран человека помогли выявить специфичность их связывания, а также взаимодействия между жирными кислотами в этом процессе. Понимание процесса кинетики связывания p-FABPpm основано на проведенных ex vivo исследованиях, в которых изучали смесь жирных кислот, идентичную той, что содержится в составе материнской плазмы в III триместре беременности.
Смесь жирных кислот включала 16:0, 18:0, 18:1 n-9, 18:3 n-3, 18:2 n-6, 20:4 n-6 и 22:6 n—3. Пальмитиновая кислота (16:0) не связывалась с p-FABPpm, а связывание 18:0 и 18:1 n-9 с этим протеином было низким. В смеси среди омега-3 жирных кислот 83% 22:6 и-3 были связаны с p-FABPpm; связывания с 18:3 n—3 выявлено не было. Среди омега-6 жирных кислот 98% 20:4 n-6 и 23% 18:2 n-6 были связаны с p-FABPpm. Вероятно, что выбор отдельных жирных кислот при трансплацентарной передаче плоду зависит от состава жирных кислот в материнской плазме и достаточного количества мест связи с p-FABPpm.
В течение III триместра беременности в ответ на потребность плода в омега-6 и омега-3 жирных кислотах повышается уровень жирных кислот в плазме крови матери. Похоже, что у человека транспортируемые жирные кислоты конкурируют с омега-6 и омега-3 жирными кислотами за места связывания на плацентарных мембранах и высокие уровни циркулирующей материнской LA (18:2 n-6) могут негативно влиять на содержание омега-3 жирных кислот как в организме матери, так и в организме новорожденного.
Полиморфизмы p-FABP и такие метаболические состояния, как инсулинозависимый сахарный диабет и гестационный диабет, ассоциируются с низкими уровнями 20:4 n-6 и 22:6 п—3 в пуповинной крови.
Лептин был обнаружен в плаценте, амниотической жидкости и плазме плода при сроках гестации менее 18 нед. Есть предположение, что лептин плацентарного происхождения стимулирует мобилизацию жирных кислот из жировой ткани матери в пользу плода. Продукция плацентарного лептина увеличивается вместе с увеличением отношения массы плода к массе плаценты; это позволило предположить, что плацента может изменять объем продуцируемых ею веществ в ответ на меняющиеся потребности плода. Было выявлено, что 95% произведенного плацентой лептина транспортируются в плазму крови матери и только 5% идут к плоду.
Лептин также вырабатывается в белой жировой ткани плода, и, вероятно, этот процесс происходит независимо от продукции лептина плацентой. Было высказано предположение, что уровень лептина в пуповинной крови не зависит от выработки лептина плацентой и может служить маркером количества жировой ткани у плода человека. Новорожденные с малой массой тела для гестационного возраста имеют более низкие концентрации лептина в сыворотке крови, а задержка внутриутробного развития ассоциируется с пониженными уровнями лептина в крови как у новорожденных, так и у их матерей.
Более 90% отложения жировой ткани у плода происходит в последние 10 нед гестации. С помощью УЗИ была проведена количественная оценка скорости отложения жира у плода при физиологически протекающей беременности и в случае гестационного диабета. Несмотря на то что общая масса жировой ткани составляет только 12—14% массы тела ребенка при рождении, она влияет на вариабельность массы новорожденного в 46% случаев.
Ультразвуковая оценка отложений жира у плода может служить чувствительным маркером диспропорционального роста плода и, следовательно, может использоваться с диагностической целью. Нормативные скорости накопления безжировой и жировой массы тела у плода были определены с 4-недельным интервалом начиная с 19 нед гестации до окончания беременности у 36 некурящих здоровых женщин с нормальным индексом массы тела в период, предшествовавший беременности.
Количество подкожной жировой ткани увеличилось в 10 раз за период с 19 нед беременности до ее окончания, причем наибольшая скорость отложения жира отмечалась в последние 10 нед беременности. Безжировая масса тела, включающая периферические мышцы, абдоминальную зону и область головы, увеличивалась в 5-7 раз за период с 19 нед беременности до ее окончания.
Данное исследование, как и другие, выявило линейную зависимость накопления безжировой массы тела в целом на уровне всего организма. Однако для каждой отдельной составляющей безжировой массы тела была характерна своя модель роста: для периферических мышц — повышенная скорость роста, для абдоминальной зоны — линейная скорость, для области головы — небольшое снижение скорости роста.
Накопление массы жировой ткани у плода значительно выше в случае гестационного диабета у беременной по сравнению с таковой при нормально протекающей беременности и, как было показано, зависит от толерантности материнского организма к уровням глюкозы. Исследования показали увеличение массы жировой ткани у плодов женщин с умеренной степенью интолерантности к глюкозе при отсутствии у этих пациенток диагностических критериев гестационного диабета.
Срок гестации, уровень глюкозы у беременной через 1 час после приема пищи и индекс массы тела в период, предшествовавший наступлению беременности, коррелировали со скоростью отложения жировой ткани. Не было выявлено взаимосвязи между степенью толерантности беременной к глюкозе и ростом безжировой массы тела у плода. Все больше данных литературы свидетельствуют о низких уровнях 20:4 n-6 и 22:6 n—3 в крови детей, родившихся у женщин с диабетом типов I и II, а также гестационным диабетом.
Попытки понять значимость результатов указанных исследований для изучения метаболизма липидов диктуют необходимость проведения дальнейших исследований, причем особого внимания требует вопрос развития ЦНС и вопрос программирования и риска заболеваний в дальнейшей жизни.
Рост жировой ткани плода также зависит от эндокринного статуса беременной и самого плода. Для поздних сроков гестации характерен высокий уровень разобщающего белка 1-го типа (UCP1), являющегося уникальным для бурой жировой ткани. Кроме увеличения уровня UCP1 также повышаются концентрации IGF-I и IGF-II. Ограничение в питании беременной ведет к снижению объема откладываемого жира, но не влияет на уровень UCP1. Напротив, излишнее питание беременной приводит к увеличению как уровня UCP1, так и короткой формы рецепторов пролактина.
Экспоненциальный рост накопления массы жировой ткани плода в III триместре происходит одновременно с началом быстрого («спуртового») роста мозга и увеличения содержания ПНЖК (особенно 22:6 n-3 и 20:4 n-6) в ЦНС. Несмотря на то что относительное содержание 22:6 n—3 и 20:4 n-6 в головном мозге и жировой ткани плода одинаково, абсолютное количество этих жирных кислот, откладываемых в мозговой ткани, меньше по сравнению с таковым в жировой ткани. Было выявлено, что при доношенной беременности в жировой ткани накапливается в 50 раз больше 22:6 n—3, чем в головном мозге плода.
Содержание ARA и DHA у беременной и плода
| - | ARA (20:4 n-6, арахидоновая кислота) у беременной (% общего содержания жирных кислот) | DHA (22:6 n-3, докозагексаеновая кислота) у беременной (% общего содержания жирных кислот) | ARA (20:4 n-6, арахидоновая кислота) у плода (% общего содержания жирных кислот) | DHA (22:6 n-3, докозагексаеновая кислота) у плода (% общего содержания жирных кислот) |
| Пища | 0,5 | 0,4 | - | - |
| Фосфолипиды плазмы | 11,7 | 1,7 | 16,6 | 6,6 |
| Жировая ткань (при рождении) | 0,1 | 0,1 | 9,1 | 1,6 |
| Головной мозг (при рождении) | - | - | 8,9 | 4,1 |
Влияние жиров на центральную нервную систему плода
Более 30 лет назад Dobbing и соавт. (1973) показали, что скорость роста головного мозга наибольшая в период с середины беременности до второго года жизни ребенка. Этот период, часто называемый периодом «спуртового» роста головного мозга, приходится как раз на то время, когда развитие ЦНС ребенка особенно зависит от его питания.
Развитие нервной системы, с каких бы позиций ни рассматривали этот процесс — анатомических, биохимических или физиологических, — представляет собой последовательный, имеющий определенный порядок, интегрированный процесс. Ключевые этапы развития нервной системы включают нейрональную индукцию, нейрогенез, миграцию нейробластов, формирование аксонов и дендритов, арборизацию дендритов, синаптогенез, глиогенез, миелинизацию и апоптоз. Особенности развития отдельных структур головного мозга запрограммированы в течение всего срока созревания мозга в целом.
Увеличение содержания жирных кислот в перинатальном периоде роста головного мозга особенно значимо для формирования нейрональных и глиальных клеток, в структуре которых много клеточных мембран. В начале 1980-х гг. Clandinin и соавт. выявили, что скорости накопления омега-6 и омега-3 жирных кислот у плода человека в III триместре составляет 552 и 67 мг/сут соответственно.
DHA (22:6 n—3) может быть превращена в головном мозге в большинство омега-3 жирных кислот, в 20:4 n-6 и 22:4 n-6, а 22:5 n—6 превращается в большинство омега-6 жирных кислот.
Позднее Martinez и соавт. описали процесс увеличения содержания отдельных жирных кислот, в т.ч. омега-6 и омега-3, в составе фосфолипидов головного мозга в ходе фетального и постнатального развития.
Жировой обмен у недоношенных новорожденных детей и их развитие
Потребности в нутриентах у недоношенных детей и детей с задержкой внутриутробного развития высоки и варьируют в зависимости от степени недоношенности, незрелости органов, адекватности запасов субстратов в организме ребенка, а также наличия сопутствующих заболеваний. Младенцы с меньшими гестационным возрастом и массой тела при рождении имеют наибольший риск возникновения медицинских осложнений.
Начало и увеличение объема питания может быть отсрочено в связи с имеющимся риском возникновения медицинских осложнений, связанных с незрелостью ЖКТ и других жизненно важных органов. Вследствие этого не всегда удается достичь желаемой скорости роста ребенка. Переживаемый организмом ребенка стресс, обусловленный артериальной гипотонией, гипоксией, инфекцией, хирургической патологией, гипогликемией, может быть транзиторным или приводить к осложнениям, требующим каких-либо медицинских вмешательств.
Риск потенциальных серьезных осложнений, связанных с ЯНЭК и другими патологическими состояниями, оказывает влияние на принятие решений, касающихся объемов назначаемого питания и целей нутритивной поддержки у недоношенных младенцев. При обсуждении вопросов начала энтерального кормления и увеличения его объемов следует принимать во внимание возможное отрицательное воздействие высоких концентраций в плазме отдельных аминокислот, глюкозы, жирных кислот и других продуктов метаболизма на ЦНС и другие органы.
Наше понимание основ физиологии перинатального роста и развития, как и искусство выхаживания и лечения недоношенных детей, продолжает совершенствоваться.
Сразу после рождения в ходе адаптации к условиям внеутробной жизни в организме новорожденного запускается ряд физиологических и метаболических процессов. Особенно выражены адаптивные изменения в физиологии и метаболизме липидов. До рождения основным источником энергии для плода является глюкоза. В плацентарной передаче жирных кислот участвуют специфические, связывающие жирные кислоты протеины; отмечается феномен биомагнификации при переходе омега-6 и омега-3 ДЦПНЖК через плаценту; отложение жира в жировой ткани плода происходит в основном в последние 10 нед гестации.
После рождения основным источником энергии становятся жирные кислоты; ЖКТ начинает играть исключительную роль в процессе переваривания жира и всасывания жирных кислот; жировые запасы младенца удовлетворяют его потребности в энергии и являются поставщиками омега-6 и омега-3 ДЦПНЖК, необходимых для развития ЦНС. Для детей, родившихся преждевременно, незрелость ЖКТ и ограниченные жировые запасы являются серьезной помехой в адаптации к внеутробным условиям. Не стоит забывать об участии жировой ткани в процессе терморегуляции, а также ее амортизирующей роли для чувствительных внутренних органов ребенка.
Известно, что недоношенные дети имеют большие потребности в энергии по сравнению с доношенными детьми. Эта энергия может быть израсходована, запасена или утрачена ребенком. Расходуемая энергия — это энергия, предназначенная для обеспечения основного метаболизма, активности ребенка, синтеза новых тканей, терморегуляции или реакций на холодовый стресс.
Запасаемая энергия включает энергию жировых запасов и безжировой массы тела. Потеря энергии отмечается при неполном переваривании и всасывании макронутриентов. Затраты энергии на рост у недоношенного ребенка в среднем составляют 3,0-4,5 ккал/г/сут. Обычно рекомендуется среднее потребление энергии 105—130 ккал/кг/сут. Примерно 50% этого количества энергии обеспечивается за счет жира. Дети с БЛД, малой массой тела для гестационного возраста, а также имеющие ЭНМТ могут иметь более высокие потребности в энергии.
Жиры, основной источник энергии как в грудном молоке, так и в молочных смесях, обеспечивают 40-55% потребляемой энергии. Для детей, родившихся преждевременно, в случае недостаточного количества грудного молока у матери могут быть использованы специализированные смеси для недоношенных детей. Эти смеси, превосходящие по калоражу и «плотности» компоненты грудного молока и смеси для доношенных младенцев, были разработаны с целью достижения у недоношенного ребенка скорости роста, характерной для плода в соответствующие сроки гестации.
Большинство таких смесей обеспечивает 80 ккал/100 мл. Для усиления пищевой ценности грудного молока также возможно применение его фортификаторов. Недоношенные младенцы, которые не способны усвоить энтеральное кормление, могут получать жиры парентеральным путем.
Переваривание и всасывание жиров у недоношенных детей
У преждевременно родившихся детей процессы переваривания и всасывания жиров могут быть ограниченны из-за недостаточной активности панкреатической липазы, низкого уровня желчных кислот (ниже критической мицеллярной концентрации), незрелости системы всасывания энтероцитов и неразвитой энтерогепатической циркуляции. Липаза грудного молока (иногда называемая липазой, зависимой от солей желчной кислоты) является уникальным компонентом, который, как было выявлено, усиливает переваривание жиров грудного молока.
Присутствие этой липазы в грудном молоке может хотя бы частично объяснить лучшее всасывание жиров у недоношенных младенцев, получающих грудное молоко, по сравнению с детьми, которых кормят некоторыми искусственными смесями.
Было высказано предположение о критическом значении для биодоступности жирных кислот в постнатальном периоде процесса всасывания жирных кислот и 2-моноглицеридов. Это предположение было основано на исследованиях, посвященных созреванию у недоношенных детей способности всасывать жиры. При проведении данных исследований применяли меченые атомы 13С. В группах доношенных и недоношенных детей концентрации в сыворотке 1-13С-пальмитата были измерены после энтерального назначения 3-13С-пальмитоилглицерола.
Исследователи сделали заключение, что о созревании процессов переваривания и всасывания жиров можно в большей степени судить по способности кишечника всасывать жирные кислоты.
Эта способность становится полноценной в постконцептуальном возрасте 46 нед независимо от срока рождения ребенка. В настоящее время полностью не известно, насколько созревание активности липазы и формирование желчи для образования мицелл и внутрипросветного расщепления жира до жирных кислот и 2-моноглицеридов могут повлиять на всасывание жирных кислот у недоношенных детей.
Читайте также:
- Классификация плевральных сращений. Типы плевральных сращений
- Показания и подготовка к эндоскопии сформированного резервуара
- Суставы, кости при гемофилии - лучевая диагностика
- Недостаточность околощитовидных желез (тетания) - морфология, патологическая анатомия
- Дифференциальная диагностика туберкулеза пожилых. Лечение туберкулеза пожилых.
