Механизмы переноса жирных кислот через плаценту
Добавил пользователь Владимир З. Обновлено: 16.01.2026
В течение второй половины беременности масса тела плода экспоненциально увеличивается, при этом полностью завершается структурное формирование таких важных систем, как ЦНС. Энергетические потребности организма плода увеличиваются, при этом их оценивают так: 40-50 Ккал на кг веса в день идет на увеличение массы тела, а примерно 50 ккал на кг веса в день служат для окислительных процессов.
Обмен веществ матери максимально приспосабливается к основной цели — обеспечить оптимальный перенос питательных веществ и субстратов через плаценту к ребенку. Существенно увеличивается концентрация в крови глицерола, свободных жирных кислот, кетокислот. Благодаря ускоренному и активному транспорту аминокислот через плаценту создается парадоксальная ситуация, когда концентрация аминокислот в крови плода превышает таковую в крови матери. Многие исследования пытались связать питание матери и ее метаболизм с ростом плода. Определенные объяснения могут быть найдены на примере рассмотрения некоторых экстремальных ситуаций. Так оказалось, что показатели инсулин-резистентности матери, вес матери перед беременностью и набор веса в ходе беременности оказались связанными с процессом увеличения веса тела плода в ходе беременности и весом при рождении.
Эффект голодания матери на развитие плода был показан на примере Голландской голодной зимы, когда с ноября 1944 г. по апрель 1945 г. немецкие оккупационные войска вывезли основные продукты питания из Голландии в Германию. Оказалось, что этот голод по разному повлиял на плодов в зависимости от того на первый или третий триместр беременности пришелся период голода матери. Значительное снижение веса новорожденных отмечено было в том случае, когда наиболее интенсивное голодание пришлось на третий триместр, в то время как голодание матери в первом триместре сопровождалось компенсаторным ростом плаценты.
Большое количество исследований показало, что питание матери как в части количества, так и качества его могут иметь долговременный эффект и влиять на уровень заболеваемости и качество жизни потомства.
Основная функция плаценты — транспорт питательных веществ от матери к плоду в соответствии с метаболическими запросами и гормональными влияниями. Плацента — это не только пассивный фильтр, ее роль достаточно активна: она является главным регулятором обмена веществ между плацентой и плодом.
Нутриенты передаются плоду через плаценту с помощью сложных механизмов, включая транспортные системы микроворсин трофобластов, базальных мембран и эндотелиальных мембран капилляров плода. Плацентарная функция меняется в течение всей беременности, таким образом до середины беременности, плацента тратит половину кислорода и глюкозы на собственные нужды, а оставшуюся часть транспортирует плоду. По ходу прогрессирования беременности доля, предназначенная плоду увеличивается. Соответственно возрастает отношение массы плода к массе плаценты. При этом продолжается увеличение площади плаценты, через которую происходит транспорт субстратов от матери в сторону плода.
Транспорт глюкозы от матери к плоду представляет собой вариант облегченной диффузии, в которой участвуют трансмембранные переносчики. Несмотря на наличие переносчиков, скорость транспорта глюкозы от матери к плоду пропорциональна концентрации глюкозы в крови матери. Белковые молекулярные комплексы, предназначенные для транспорта аминокислот, также локализованы в мембранах ворсин и сосудов плаценты. Эти переносчики работают в соответствии с принципами работы активного транспорта — т.е. они тратят на транспорт аминокислот через мембраны энергию АТФ. Именно благодаря этому концентрация аминокислот в крови плода выше, чем в крови матери. Микроворсинки на клеточной мембране имеют несколько транспортных систем, включая систему А, (это зависимая от ионов Na + система транспортирует нейтральные аминокислоты, такие как, аланин, серин, пролип и глицин). Так же существуют независимые от Na+ транспортные системы, такие как система L для аминокислот сложного ветвистого строения (фенилаланин) и система U для лизина.
В отличии от аминокислотного, механизм транспортировки жирных кислот через плаценту полностью не изучен. Плацента транспортирует в основном полиненасыщенные жирные кислоты. Клеточное потребление и внутриклеточное перемещение неэстерифицированных жирных кислот предполагает многошаговый процесс, который облегчается различными мембрансвязующими и цитоплазматическими протеинами. Хотя все жирные кислоты могут проходить через жировые слои мембраны путем простой диффузии, в мембране обнаружены специальные белки, связывающие жирные кислоты, и обеспечивающие их транспорт в обоих направлениях (как в сторону плода, так и матери). Незаменимые жирные кислоты в основном перемещаются через мембраны связываясь с неэстерифицированными жирными кислотами и в связи с триглицеридами имеющими природу из жировой ткани и печени матери. Они высвобождаются липопротеиновой липазой, высокая активность которой продемонстрирована в человеческой плаценте. Мембраны плаценты так же содержат специфические места связей для липопротеинов, которые переносят эстерифицированные липиды.
Самые важные питательные вещества, поступающие к плоду, это: глюкоза, аминокислоты и жирные кислоты (ЖК) вместе с многими микроэлементами и витаминами. В течение последних десятилетий в большом количестве исследований были изучены результаты анализов крови внутриутробного плода. Это относительно мало инвазивная процедура облегчила исследования плацентарного снабжения питательными веществами и гормональный статус плода во время второй половины беременности.
Стало возможным определить соотношение концентрации глюкозы между плодом и матерью от 18 до 40-й недели. Начиная с 20 недели, концентрация глюкозы в крови плода постепенно снижается, но она всегда меньше, чем концентрация ее в крови матери и зависит от нее. Не показано сколько-нибудь значительного глюкогенеза в плаценте плода даже в случае синдрома задержки его развития. В отличие от глюкозы концентрация аминокислот в крови плода существенно не меняется в ходе беременности.
Было показано, что заменимые аминокислоты плода синтезируются в основном в плаценте. Такие аминокислоты как глицин, серин а также глютаматы, глютамин синтезируются в результате межорганного взаимодействия плаценты и печени плода.
Жирные кислоты представляют очень хорошую модель, демонстрирующую соотношения между диетой матери, ростом плода и его благополучием. Плод нуждается в главных жирных кислотах и их производных (арахидоновая кислота и т.д). Внутриутробные запросы в основных жирных кислотах во время последнего триместра беременности до первых недель жизни оценивается как 400 мг/кг для омега-6 и 50 мг/кг для омега-3. Полиненасыщенные жирные кислоты быстро проникает в структуру жиров мозга, где они поддерживают текучесть, проницаемость и конформацию мембран и играют важную функциональную роль в развитии мозга и функции зрения. Они являются предшественниками таких важных биологически активных соединений как простагландины, лейкотриены и тромбоксаны. Они так же являются важными источниками энергии. С точки зрения энергетики, жирные кислоты менее важны на начальной стадии беременности и наоборот, становятся более важными перед родами когда они представляют собой важный энергетический субстрат, отложенный в жировой ткани.
Роль микроэлементов важна на каждой стадии внутриутробного развития. Ретиноловая кислота (или провитамин А) ответственна за формирование зрительного анализатора; другие микроэлементы такие как цинк, за стабилизацию энзимов, медь и железо за центральные компоненты каталитических процессов. Дефицит железа, связанный с анемией матери увеличивает риск кровотечений матери и увеличивает соотношение веса плаценты и плода, а также может являться предвестником сердечно-сосудистых заболеваний в зрелом возрасте. Среди витаминов, жирорастворимые витамины играют важную роль. Особенно это относится к антиоксидантам, защищающим клетки от разрушения свободными радикалами. Существует комплексное взаимодействие между n-З и n-6 жирными кислотами и жирорастворимыми витаминами. Чрезмерный прием полинасыщенных жирных кислот приводит к уменьшению антиоксидантной способности витаминов. Гиперлипидемия при нормальной беременности связана с увеличением уровня окисления ЛДЛ, хотя этот эффект противодействует окислительной резистентности. Последнее происходит благодаря повышению уровня витамина Е, хотя другие витамины антиоксиданты такие как бета-каротин и витамин А остаются относительно стабильными или уменьшаются во время нормальной беременности.
В этом разделе мы публикуем статьи и материалы по медицинской тематике, присланные нашими читателями.
Если у вас есть что-то интересное, чем бы вы хотели поделиться с другими людьми, мы будем рады разместить вашу статью на нашем сайте.
Внимание!
В случае, если присланный вами материал не соответствует тематике сайта, он не будет опубликован без объяснения причины отказа в публикации. Если в вашей статье имеются ссылки, или статьи будут носить рекламный характер, то Вам сюда.
Защита авторских прав!
Присланный вами материал не должен нарушать авторских прав. Если это ваш материал, укажите ваше имя, и оно будет опубликовано в статье. В случае, если вы являетесь правообладателем и заметили, что размещенный на сайте материал нарушает ваши авторские права, напишите нам, этот материал будет немедленно удален с сайта. В письме приложите доказательства того, что вы являетесь автором материала или правообладателем.
По вопросам размещения пишите письма на email — [email protected]
Механизмы переноса жирных кислот через плаценту
Представлен обзор литературы, посвященный характеристике липидного компонента плаценты. Приведены данные о синтезе липидов плацентарной тканью, механизмах транспорта их к плоду, основных источниках липидов в фетоплацентарной системе. Обобщены материалы о составе различных классов липидов плаценты в разные периоды беременности. Обсуждается зависимость интенсивности метаболизма липидов от потребностей растущего плода в трофическом и энергетическом материале. Охарактеризованы особенности метаболизма и функциональное значение динамики фосфолипидов плазматических мембран трофобласта по мере развития беременности. Рассматривается роль липидного дисбаланса в плаценте как важного инициирующего фактора формирования акушерской патологии.
1. Погорелова Т., Линде В. Метаболизм плаценты и механизмы его регуляции // LAP LAMBERT Academic Publishing. – 2012. – 316 с.
2. Baschat A.A. Fetal responses to placental insufficiency: an update // BJOG. – 2004. – Vol. 111, № 10, – P. 1031–1041.
3. Bitsanis D., Crawford M.A., Moodley T., Holmsen H., Ghebremeskel, K., Djahanbakhch O.B. Arachidonic acid predominates in the membrane phosphoglycerides of the early and tern human placenta // J. Nutr. – 2005. – Vol. 135. – P. 2566–2571.
4. Coleman R.A. The role of placenta in lipid metabolism // Seminars Perinatol. – 1989. – Vol. 13. – P. 180–191.
5. Coleman R.A., Haynes E.B. Microsomal and lysosomal enzymes of triacylglycerol metabolism in rat placenta // Biochem. J. – 1984. – № 217. – P. 391–397.
6. Coleman R.A., Haynes E.B. Synthesis and release of fatty acids by human trophoblast cells in cuiture // J. Lipid Res. – 987. – Vol. 28. – P. 1335–1341.
7. Das T., Sa G., Mukherjea M. Characterization of cardiac fatty acid-binding protein from human placenta. Comparison with placenta heaptic types // Eur. J. Biochem. – 1993. – Vol. 211. – P. 725–730.
8. Demmer L.A., Levin M.S., Elovson J. Tissue-specific expression and developmental regulation of the rat apolipoprotein B gene // Proc. Natl. Acad. Sci. – 1996. – № 83. – P. 8102–8106.
9. Krukier I.I., Pogorelova T.N., Orlov V.I. Production and reception of growth factors in placenta during physiological pregnancy and the pregnancy, complicated with gestosis // Biochemistry (Moscow) Suppl. Biomedical chemistry. – 2007. – Vol. 1. – № 3. – P. 267–269.
10. Munro H.N. Role of the placenta in ensuring fetal nutrition // Fedn. Proc. – 1986. – Vol. 45. – P. 2500–2501.
11. Noble R.C., Shand J.N. The placenta – its role in the relationship between the lipids of mother and foctus // YRCS Med. Sci. – 1997. – Vol. 9. – P. 174–77.
12. Ogburn P.L., Rejeshwari M., Turner S.J. Lipid metabolism in human placental culture // Amer. J. Obstet Genecol. – 1998. – Vol. 172. –P. 648–655.
13. Pogorelova T.N., Orlov V.I., Gunko V.O. New Approaches to Molecular diagnostics of Prenatal Pathology // Bulletin of Experimental Biology and Medicine. – 2011. – Vol. 151, №5. – P. 567–570.
14. Sweiry J.H., Yudilevich D.L. Characterization of choline transport at maternal and fetal interfaces of the perfused guinea-pig placenta // J. Physiol. – 1985. – Vol. 366. – P. 251–266.
15. Thomas C.R. Placental transfer of non-esterified fatty scid in normal and diabetic pregnancy // Biol. Neonate. – 1987. – Vol. 51. – P. 94–101.
16. Thulin A.J., Allee G.L., Harmon D.L., Davis D.L. Utero-placental transfer of octanoic, palmiti and linoleic acids during late gestation in gilts // J. Amin. Sci. – 1999. – Vol. 11. – P. 738–745.
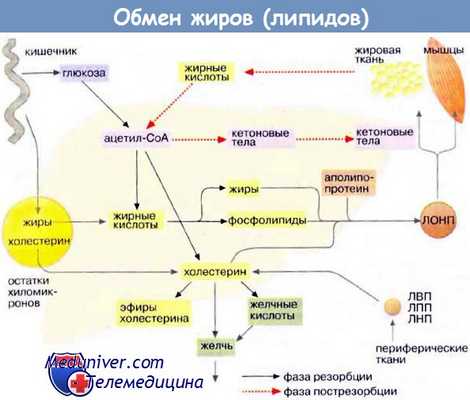
Роль плаценты в обмене липидов достаточно многообразна. Некоторые из липидов она синтезирует, другие поступают из материнской крови. В последующем часть липидов из плаценты попадает к плоду, часть возвращается к матери или остается в плаценте для удовлетворения ее собственных потребностей [11].
Общее количество липидов в плаценте составляет 12–14 % ее сухого веса, причем их содержание нарастает в первой половине и снижается в конце беременности. Необходимость сохранения определенного уровня липидов связана, прежде всего, с их важной ролью в поддержании клеточных структур и осуществлении транспортной, энергетической и эндокринной функций плаценты, а также в связи с существенным значением липидов в обеспечении полноценного питания, необходимого для роста и развития плода [10].
Плацентарная ткань синтезирует нейтральные липиды, фосфоглицериды, сфинголипиды, ганглиозиды и другие гликолипиды. В плаценте человека и животных обнаружены ферменты, катализирующие синтез и окисление жирных кислот [4], играющих важную роль в различных клеточных процессах, необходимых для развития плаценты и выполнения ее регуляторных функций в фетоплацентарной системе. Причем образование жирных кислот в развивающейся плаценте намного превышает этот процесс в зрелом органе. Липолитическая активность плаценты, напротив, возрастает к моменту родов. Повышенный синтез жирных кислот в плаценте в начале ее развития в определенной мере связывают с высокой активностью пентозо-фосфатного цикла в данный период. Известен факт, что по количеству глюкозы, окисляющейся через этот цикл, плацента аналогична жировой ткани, характеризующейся высокой скоростью образования липидов.
Фонд свободных жирных кислот гемохориальной плаценты, несмотря на его незначительный объем, обладает высокой степенью обмениваемости, в несколько раз превышающей удельную активность общих липидов. В его формировании принимают участие как транспортные механизмы, поставляющие жирные кислоты из крови матери, так и собственные ферментативные системы плаценты [15].
Транспорт жирных кислот в плаценте человека является многоступенчатым процессом. Перенос их в клетку, осуществляющийся при участии альбумина, в последующем, в пределах цитоплазмы, происходит с помощью специфических белков (fatty acid binding protein) [7]. Некоторые из этих белков выделены из плаценты, описаны их физико-химические свойства и динамика биосинтеза. Последний возрастает по мере развития беременности, коррелируя с усилением транспорта жирных кислот к плоду. Указанные белки составляют около 8 % суммарного уровня цитоплазматических протеинов, что подчеркивает их важную роль в метаболических реакциях. Они могут участвовать в депонировании свободных жирных кислот с дальнейшим освобождением по мере необходимости, а также вовлекаться в активацию плацентарных ферментов липогенеза. Установлено, что около пятидесяти процентов всей потребности плода в свободных жирных кислотах обеспечивается плацентой, хотя эта величина варьирует в разные сроки беременности и, очевидно, является гормонозависимым процессом [2].
Одним из основных внутритканевых источников жирных кислот в плаценте служат триглицериды липопротеинов очень низкой плотности, расщепляющиеся под действием липопротеинлипазы, локализованной на материнской поверхности плаценты [6]. Ни фосфолипиды, ни триглицериды из материнской крови не попадают непосредственно плоду. Внутриплацентарный транспорт и обмен жирных кислот происходит несколькими путями: либо использованием интактных молекул, либо после их предварительной модификации в результате десатурации, элонгации или частичного окисления [1]. Возможны промежуточные этапы этерификации, необходимые для образования фосфолипидов и триглицеридов, которые временно накапливаются, прежде чем вновь подвергнуться гидролизу фосфолипазами и ацилглицеролипазами для освобождения жирных кислот. Дополнительным источником жирных кислот в плаценте может служить синтез их de novo [2]. При инкубации клеточной культуры трофобласта с С14-ацетатом жирные кислоты синтезируются со скоростью? в 50–200 раз превышающей синтез в культуре гепатоцитов. Характерной особенностью жирнокислотного состава плаценты в отличие от многих тканей является высокое содержание арахидоновой кислоты [3], для которой возможны альтернативные пути образования. Уровень жирных кислот в плаценте более лабильный, чем таковой других липидных компонентов что, очевидно, связано с их активным участием в синтетических процессах. Хотя плацентарная ткань не способна к полному окислению жирных кислот, частичное их окисление в ней происходит. В этом процессе важная роль принадлежит пероксисомам. В механизмах транспорта жирных кислот из плаценты к плоду, вероятно, принимает участие альфа-фетопротеин, который способен связывать полиненасыщенные жирные кислоты, особенно арахидоновую кислоту, с высокой афинностью. Именно для арахидоновой кислоты, по данным P.L. Ogburn et al. [12], имеет место наиболее интенсивный транспорт через плаценту.
Изучение состава липидов плаценты человека показало, что большую их часть составляют фосфолипиды, связанные с мембранными структурами. Плацентарные фосфолипиды отличаются значительным разнообразием. В экстрактах зрелой плаценты в наибольшем количестве встречаются фосфатидилхолин и фосфатидилэтаноламин, составляющие около 50 % всех фосфолипидов, в меньших количествах находятся фосфатидилсерин, фосфатидилинозит, фосфатидная кислота, кардиолипин. На начальных этапах эмбриогенеза плацентарные фосфолипиды характеризуются высоким содержанием арахидоновой и арахиновой кислот и относительно низким содержанием пальмитиновой, стеариновой и олеиновой кислот [16]. Изменение набора и порядка расположения жирных кислот в молекуле фосфолипида, а также состава самих фосфолипидных фракций в формирующейся плаценте, очевидно, можно рассматривать как один из факторов, направленных на обеспечение эффективного транспорта веществ к плоду. Сходство состава жирных кислот плацентарных и плодовых фосфолипидов, отличие его от состава фосфолипидов сыворотки крови матери свидетельствует о том, что плацента является источником этих компонентов в крови плода. Плацента служит метаболическим барьером между фосфолипидами матери и плода, поскольку поступающие к ней фосфолипиды гидролизуются в хориальном эпителии ворсин и впоследствии ресинтезируются плацентарной тканью [14].
Преимущественное содержание фосфолипидов в общем фонде липидов плаценты объясняется их важной и многообразной ролью. Хотя фосфолипиды требуются главным образом для создания внутриклеточных и цитоплазматических мембран, они также выступают в качестве предшественников вторичных посредников клеточной регуляции, таких как инозитолфосфаты, диациалглицерол, тромбоцит-активирующий фактор и метаболиты арахидоновой кислоты. Что касается плода, то фосфолипиды необходимы ему, кроме того, для синтеза желчи, миелина, липопротеинов сыворотки крови и легочного сурфактанта.
В отличие от фосфолипидов на долю нейтральных эфиров приходится лишь 20 % общего содержания липидов плацентарной ткани. Однако высокая степень обмениваемости позволяет их считать промежуточными продуктами на пути синтеза фосфолипидов и, по-видимому, участниками трансплацентарного переноса жирных кислот из крови матери в кровь плода. В плаценте обнаружена достаточно высокая активность ферментов синтеза глицеридов. Так, активности глицерофосфатацилтрансферазы и диацилглицероацилтрансферазы плаценты аналогичны таковым в печени, характеризующейся весьма интенсивным синтезом триглицеридов [5]. В процессе развития плаценты активность этих энзимов возрастает, достигая максимальных величин к середине беременности. Кроме того, плацента способна синтезировать апопротеины, входящие в состав липопротеинов очень низкой плотности, являющихся главной транспортной формой эндогенных триглицеридов, причем уровень мРНК аполипопротеинов в зрелой плаценте крыс в 9 раз выше, чем в печени [8].
В липидном спектре плаценты присутствуют также гликолипиды, хотя и в значительно меньшем количестве, чем фосфолипиды. Основная часть гликолипидов, прежде всего ганглиозидов, находится в плазматических мембранах микроворсин синцитиотрофобласта. Углеводные компоненты мембран, входящие в состав гликолипидов, а также гликопротеинов плаценты, хотя и представлены в относительно незначительном количестве, выполняют чрезвычайно важные функции. Они принимают активное участие в процессах дифференциации и взаимного распознавания клеток, межклеточных контактах, адгезии, явлениях иммунитета, эндо- и экзоцитоза, служат рецепторами гормонов, медиаторов, антигенов, токсинов и других веществ. Большие потенциальные возможности для такой всесторонней рецепции обусловлены разнообразием олигосахаридных структур, входящих в состав гликолипидов плазматических мембран трофобласта.
Важным компонентом липидов плаценты является холестерин. Подобно основным липидным фракциям уровень свободного холестерина и его эфиров изменяется в процессе развития плаценты. С увеличением срока беременности их содержание в плаценте растет. В то же время коэффициент этерификации холестерина плаценты человека очень низок и составляет 0,22 для развивающегося органа и 0,19 – для зрелого [9].
В настоящее время не вызывает сомнения, что определенная часть холестерина поступает в плаценту из крови матери. В то же время, по мнению ряда авторов, плацента способна самостоятельно синтезировать холестерин из ацетата [10].
Поступивший из материнской крови или образующийся в плаценте холестерин, помимо использования для синтеза гормонов, может переходить к плоду. Однако трудно оценить значение этого процесса, поскольку печень плода обладает достаточно высоким самостоятельным синтезом холестерина. Как и в любом органе, холестерин в плаценте играет важную роль в формировании структуры плазматических и субклеточных мембран трофобласта, имеющих кардинальное значение в функционировании всего органа. Динамика холестерина в мембранах плаценты, как и в других ее структурах, в процессе физиологической беременности характеризуется постепенным нарастанием его уровня связанным, прежде всего, с необходимостью построения новых плазматических мембран в развивающемся органе. Одной из причин изменения содержания холестерина в мембранах плаценты может служить его перераспределение между плазмой крови и тканью, в котором принимают участие липопротеины высокой плотности. Удаление холестерина с поверхности мембран трофобласта с помощью этих молекул и синтеза его de novo в процессе внутриутробного онтогенеза происходит довольно эффективно.
Развитие плаценты сопровождается также повышением в ее плазматических мембранах коэффициента холестерин/фосфолипиды, в определенной мере характеризующего жидкостность мембран. Этот показатель возрастает к 39–40 неделям беременности на 30 % по сравнению с соответствующей величиной в раннем хорионе [9].
По мере развития гестации изменяется и относительное содержание отдельных фракций фосфолипидов плацентарных мембран. Так, содержание фосфотидилхолина и фосфатидилэтаноламина, максимальное в середине беременности, обнаруживает во второй ее половине тенденцию к снижению, а в III триместре составляет лишь 60 % от исходного уровня [1]. Уменьшение количества этих фосфолипидных фракций к концу беременности, вероятно, связано с их усиленным использованием в качестве основных поставщиков арахидоновой кислоты, необходимой для синтеза простагландинов, особенно в период инициации родовой деятельности. Обнаруженное резкое снижение коэффициента фосфатидилхолин/сфингомиелин в процессе развития физиологической беременности может приводить к изменению вязкости мембран. Противоположная динамика характерна для лизофосфатидилхолина, уровень которого значительно возрастает, что также вносит определенный вклад в характеристику свойств плацентарных плазматических мембран. Поскольку моноацильные производные фосфолипидов, к числу которых относится лизофосфатидилхолин, обладают высокой детергентной активностью, их появление в мембранных структурах приводит к увеличению проницаемости и изменению активности мембраносвязанных ферментов, своеобразными регуляторами которых они являются. Повышение количества лизофосфатидилхолина в процессе физиологического развития плаценты можно рассматривать как определенный компенсаторный механизм, направленный на поддержание текучести липидной составляющей мембран формирующейся плаценты.
Структурная перестройка липидной фазы мембран, имеющая место в ходе формирования плаценты, является одним из важных механизмов развития органа в целом. Изменение липидного состава мембран плаценты в процессе физиологического развития беременности носит, очевидно, адаптивный характер. Молекулярное строение фосфолипидов идеально приспособлено для выполнения адаптационных функций, т.к. позволяет даже без каких-либо изменений структуры молекулы, ее сложных связей с мембранными белками лишь заменой жирных кислот менять физико-химические свойства липида и соответственно влиять на функциональные характеристики мембран.
Следует особо отметить, что структура мембран во многом определяет скорость свободнорадикального окисления липидов, которое в свою очередь служит ее модификатором. Это приобретает особую значимость в связи с известным усилением данного процесса при различных осложнениях беременности, в том числе и при плацентарной недостаточности [13].
Таким образом, приведенные материалы свидетельствуют о важной роли липидов в поддержании общего метаболизма плаценты и фетоплацентарной системы, а также обеспечении трофики плода в разные периоды гестации. Нарушение липидного баланса в плаценте может явиться индуктором различных функциональных повреждений, участвующих в развитии акушерской и перинатальной патологии.
Рецензенты:
Каушанская Л.В., д.м.н., профессор кафедры акушерства и гинекологии № 1, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону;
Боташева Т.Л., д.м.н., профессор, главный научный сотрудник акушерско-гинекологического отдела, ФГБУ «Ростовский научно-исследовательский институт акушерства и педиатрии» Минздрава России, г. Ростов-на-Дону.
Физиология обмена жиров у плода и новорожденного ребенка
Наиболее выраженные изменения метаболизма липидов происходят при рождении. Эти изменения касаются скорости поступления в организм жирных кислот, их роли как источников энергии и значения для накопления жировой ткани. Плод получает жирные кислоты от матери путем переноса их через плаценту.
В случае преждевременных родов этот путь передачи прерывается. После рождения ребенка способность усваивать энергетические субстраты и нутриенты зависит от степени зрелости и функциональных возможностей ЖКТ. У недоношенных детей, которые способны усваивать энтеральное питание, всасывание жирных кислот происходит через стенку кишечника после переваривания жира, находящегося в составе грудного молока или молочной смеси. К детям, находящимся на парентеральном питании, жирные кислоты поступают в форме внутривенных липидов.
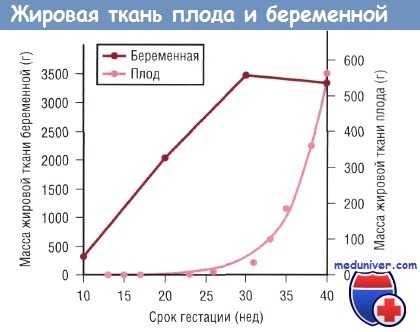
В процессе развития плода основным источником энергии является глюкоза, меньшее значение имеют лактат и излишек аминокислот. Жирные кислоты играют минимальную роль в энергетическом обеспечении плода, но после рождения ребенка они становятся основными источниками энергии. Накопление жировой ткани у плода происходит преимущественно в конце III триместра. Следовательно, преждевременно рожденные младенцы имеют ограниченный запас жировой ткани при рождении.
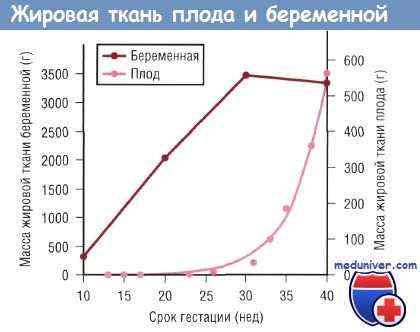
Изменения массы жировой ткани беременной и плода в зависимости от срока гестации. Данные по плоду отражают изменения в позднем фетальном периоде (в течение 9 нед до окончания полного срока беременности), когда рост плода зависит от поступающих через плаценту питательных веществ.
После рождения жирные кислоты, находящиеся в жировых депо, расходуются в качестве источников энергии и структурных компонентов новых клеточных мембран. Недоношенные дети, у которых при рождении запасы жировой ткани недостаточны, в большей степени по сравнению с доношенными младенцами зависят от поступления липидов с пищей или с парентеральным питанием для удовлетворения потребности в жирных кислотах. В перинатальном периоде ребенку необходимо большое количество жирных кислот для обеспечения высокой скорости роста, что особенно актуально для головного мозга.
При формировании мембран в нервной ткани нужно большое количество жирных кислот для образования фосфолипидов. Кроме того, необходимы стеролы и сложные липиды. Серое вещество головного мозга содержит в большом количестве как 22:6 n-3, так и 20:4 n-6. Палочки и колбочки сетчатки также содержат много 22:6 n-3. Около 50% всех жирных кислот в наружном сегменте палочек составляют жирные кислоты 22:6 n-3. Поскольку в организме млекопитающих образование омега-6 и омега-3 ПНЖК невозможно, они должны поступать с пищей или отдельно в виде DHA и ARA либо «родительских» жирных кислот — ALA и LA соответственно.
Многие смеси, предназначенные для вскармливания детей, содержат добавки ARA и DHA. Кроме того, стало возможным дополнительное обогащение DHA специализированных продуктов питания для беременных и кормящих женщин.
За последние два десятилетия наибольший интерес в исследованиях потребности в липидах вызывает роль омега-6 и омега-3 ДЦПНЖК в развитии зрительного анализатора и когнитивной функции ребенка. Особое внимание уделяется жирным кислотам 22:6 n-3 и 20:4 n-6. Они обнаружены в грудном молоке, причем уровни DHA колеблются от 0,1 до 1% общего количества жирных кислот. Уровни ARA менее вариабельны и составляют обычно 0,3—0,7% общего количества.
Кишечник ребенка может повреждаться при различных патологических состояниях, что приводит к нарушению усвоения пищи и возникновению ЯНЭК. Чем меньше срок гестации и масса тела при рождении, тем больше риск возникновения различных заболеваний. Клиническими показателями здоровья (или отсутствия заболевания) служат нутритивный статус (антропометрические и физиологические параметры) и функциональные возможности ребенка, связанные с физическим ростом и неврологическим развитием. Клиническая оценка питания заключается в оценке общего состояния ребенка, его толерантности к пищевой нагрузке, а также в наличии симптомов недостаточного или избыточного питания. Сниженные запасы жировой ткани и питательных веществ, связанные с недоношенностью или задержкой внутриутробного развития, необходимость в парентеральном питании, эпизоды ограниченного поступления в организм энергии и высокая потребность в питательных веществах могут влиять на рост и развитие ребенка.
Способ энтерального кормления для каждого конкретного ребенка выбирают с учетом срока гестации, массы тела при рождении и клинического состояния. Прежде чем начать энтеральное кормление, необходимо убедиться в отсутствии структурных аномалий, а также учесть состояние ЖКТ и респираторной системы. Для создания алгоритма энтерального кормления недоношенного ребенка необходимо ответить на следующие вопросы: когда начинать кормление, чем кормить ребенка (грудным молоком или смесью), каким способом, а также определить частоту приемов пищи и скорость увеличения объема питания. Некоторые дети до начала энтерального кормления получают парентеральное питание. Другими словами, выбор режима питания ребенка основывается на многих факторах, что обусловливает разнообразие индивидуальных подходов в отношении недоношенных детей и детей с задержкой внутриутробного развития.
Недоношенные дети с незрелым ЖКТ и ограниченными запасами жировой ткани составляют группу риска по постнатальной задержке физического развития. Плохая переносимость энтерального питания может привести к уменьшению поступающей к ребенку энергии, развитию дефицита питательных веществ, мальабсорбции жиров и клиническим симптомам дефицита незаменимых жирных кислот. Плохая переносимость питания может быть следствием незрелости ЖКТ и пищеварительных ферментов, получения ребенком питательной смеси с повышенной осмолярностью, слишком быстрого увеличения объема питания, а также следствием таких патологических состояний, как ЯНЭК или сепсис. К симптомам непереносимости пищи относят учащение периодов апноэ и брадикардии, связанных с питанием, увеличение остаточного объема содержимого желудка, вздутие живота, рвоту, обильные срыгивания, наличие в стуле крови или непереваренной пищи. Плохой сосательный рефлекс или неспособность координировать одновременно сосание и глотание также ограничивают возможность ребенка получать адекватное количество энергии и питательных веществ. Как было показано, первичное питание (питание небольшими объемами грудного молока или искусственной смесью) в первые несколько дней может стимулировать активность ЖКТ и улучшить толерантность к энтеральному кормлению. Для оптимального роста и развития очень важна возможность обеспечивать адекватное питание, одним из компонентов которого являются пищевые жиры.
Мальабсорбция жиров может привести к дефициту незаменимых жирных кислот, жирорастворимых витаминов (A, D, Е, К). Наиболее часто у недоношенных детей отмечают дефицит кальция, фосфора, витаминов D и Е, железа, цинка, карнитина, незаменимых жирных кислот и белка. Заподозрить мальабсорбцию жиров можно по изменению характера стула, который становится обильным, жирным, приобретает зловонный запах. В случае недостаточной функции поджелудочной железы или дефицита желчных кислот стул может стать белым, серым или цвета глины. Клинические симптомы дефицита незаменимых жирных кислот включают чешуйчатый дерматит, тромбоцитопению, повышенный риск возникновения инфекций, недостаточный рост и алопецию.
В течение неонатального периода, особенно у недоношенных детей или детей с задержкой внутриутробного развития, может отмечаться несовершенство терморегуляции. Новорожденные адаптируются к холодовому стрессу, вырабатывая тепло за счет калорий, необходимых для роста. Сокращение во время холодового стресса запасов бурой жировой ткани обеспечивает организм энергией за счет недрожательного термогенеза. Тепло также образуется, когда ребенок плачет и двигается. Метаболизм бурой жировой ткани, обеспечивающий производство тепла, характерен только для новорожденных. Дети с малой массой тела или менее зрелые к моменту рождения имеют неадекватные запасы жира, большую площадь поверхности по отношению к массе тела и большее содержание воды в организме. Это способствует большим потерям жидкости и, соответственно, тепла. Среди недоношенных детей нарушение температурного контроля встречается чаще, чем у доношенных.
Суммируя сказанное, можно сделать вывод о значимом различии между физиологией и метаболизмом липидов у плодов и недоношенных детей. Жиры пищи являются важнейшими источниками энергии после рождения. Существенными для развития ЦНС и, возможно, иммунной системы являются омега-6 и омега-3 ДЦПНЖК, которые ребенок получает постнатально в виде ARA и DHA или которые образуются in situ из незаменимых жирных кислот пищи LA и ALA. Преждевременно родившиеся дети зависят от функциональной зрелости ЖКТ, т.к. она определяет способность ребенка получать адекватное количество энергии для роста и необходимое количество омега-6 и омега-3 жирных кислот для развития ЦНС. За последние несколько лет произошли значительные сдвиги в понимании физиологии фетального и постнатального периодов, вопросов питания и лечения недоношенных детей, что мы представили в следующих статьях на нашем сайте МедУнивер. Тем не менее остается еще много нерешенных вопросов. Дальнейшие исследования могут помочь улучшить качество нутритивной поддержки недоношенных младенцев.
В основном плод получает жирные кислоты от матери трансплацентарным путем. Меньшее значение имеет синтез жирных кислот в организме плода. Поскольку организм млекопитающих не способен синтезировать омега-6 и омега-3 ПНЖК, плод должен получить их от матери в виде «родительских» жирных кислот с 18 атомами углерода в цепи (18:2 n-6, 18:3 n-3) или их длинноцепочечных аналогов (20:4 n-6, 20:5 n-3, 22:6 n-3).
Плацента, а также печень и головной мозг плода обладают способностью конвертировать 18:2 n-6 в 20:4 n-6; 18:3 n-3 в 20:5 n-3 и 22:6 n-3.
Однако появляется все больше доказательств того, что плод в большей степени ориентирован на трансплацентарную передачу уже сформированных омега-6 и омега-3 ДЦПНЖК для покрытия потребности в омега-6 и омега-3 ДЦПНЖК, необходимых для роста тканей. В крови плода уровни омега-6 и омега-3 ДЦПНЖК (преимущественно 20:4 n—6 и 22:6 n-3) выше, чем в крови матери.
Уровни 18:2 n-6 и 18:3 n-3 у плода ниже материнских. Процесс поступления жирных кислот 20:4 n-6 и 22:6 n-3 против градиента концентрации от матери к плоду называют биомагнификацией.
Перенос питательных веществ является важнейшей функцией гемохориальной плаценты человека, которая уникальна тем, что хорион плода непосредственно контактирует с кровью матери. Перенос омега-6 и омега-3 жирных кислот, которым отдается предпочтение, заключается в селективном захвате их синцитиотрофобластом путем метаболических механизмов внутриклеточной передачи отдельных жирных кислот и селективного экспорта в кровоток плода.
Жирные кислоты переносятся через микроворсины и базальные мембраны посредством простой диффузии или избирательно с помощью транспортных белков. Селективная передача жирных кислот и других нутриентов из материнской плазмы в плазму плода предполагает активное участие переносчиков, которые были обнаружены на поверхности как материнской, так и фетальной плацентарных мембран.
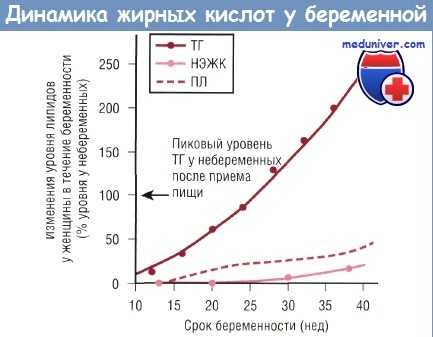
Изменение концентрации триглицеридов (ТГ), плацентарного лептина (ПЛ) и неэстерифицированных жирных кислот (НЭЖК) в плазме крови беременной в зависимости от срока беременности в сравнении с уровнем у небеременных женщин: указан типичный максимальный уровень при повышении триглицеридов плазмы в ответ на употребление жирной пищи.
Были опубликованы доказательства того, что связывающий жирные кислоты протеин, находящийся в цитоплазматической мембране плаценты (p-FABPpm), связывает преимущественно омега-6 и омега-3 жирные кислоты. Исследования плацентарных мембран человека помогли выявить специфичность их связывания, а также взаимодействия между жирными кислотами в этом процессе. Понимание процесса кинетики связывания p-FABPpm основано на проведенных ex vivo исследованиях, в которых изучали смесь жирных кислот, идентичную той, что содержится в составе материнской плазмы в III триместре беременности.
Смесь жирных кислот включала 16:0, 18:0, 18:1 n-9, 18:3 n-3, 18:2 n-6, 20:4 n-6 и 22:6 n—3. Пальмитиновая кислота (16:0) не связывалась с p-FABPpm, а связывание 18:0 и 18:1 n-9 с этим протеином было низким. В смеси среди омега-3 жирных кислот 83% 22:6 и-3 были связаны с p-FABPpm; связывания с 18:3 n—3 выявлено не было. Среди омега-6 жирных кислот 98% 20:4 n-6 и 23% 18:2 n-6 были связаны с p-FABPpm. Вероятно, что выбор отдельных жирных кислот при трансплацентарной передаче плоду зависит от состава жирных кислот в материнской плазме и достаточного количества мест связи с p-FABPpm.
В течение III триместра беременности в ответ на потребность плода в омега-6 и омега-3 жирных кислотах повышается уровень жирных кислот в плазме крови матери. Похоже, что у человека транспортируемые жирные кислоты конкурируют с омега-6 и омега-3 жирными кислотами за места связывания на плацентарных мембранах и высокие уровни циркулирующей материнской LA (18:2 n-6) могут негативно влиять на содержание омега-3 жирных кислот как в организме матери, так и в организме новорожденного.
Полиморфизмы p-FABP и такие метаболические состояния, как инсулинозависимый сахарный диабет и гестационный диабет, ассоциируются с низкими уровнями 20:4 n-6 и 22:6 п—3 в пуповинной крови.
Лептин был обнаружен в плаценте, амниотической жидкости и плазме плода при сроках гестации менее 18 нед. Есть предположение, что лептин плацентарного происхождения стимулирует мобилизацию жирных кислот из жировой ткани матери в пользу плода. Продукция плацентарного лептина увеличивается вместе с увеличением отношения массы плода к массе плаценты; это позволило предположить, что плацента может изменять объем продуцируемых ею веществ в ответ на меняющиеся потребности плода. Было выявлено, что 95% произведенного плацентой лептина транспортируются в плазму крови матери и только 5% идут к плоду.
Лептин также вырабатывается в белой жировой ткани плода, и, вероятно, этот процесс происходит независимо от продукции лептина плацентой. Было высказано предположение, что уровень лептина в пуповинной крови не зависит от выработки лептина плацентой и может служить маркером количества жировой ткани у плода человека. Новорожденные с малой массой тела для гестационного возраста имеют более низкие концентрации лептина в сыворотке крови, а задержка внутриутробного развития ассоциируется с пониженными уровнями лептина в крови как у новорожденных, так и у их матерей.
Жировой обмен у недоношенных новорожденных детей и их развитие
Потребности в нутриентах у недоношенных детей и детей с задержкой внутриутробного развития высоки и варьируют в зависимости от степени недоношенности, незрелости органов, адекватности запасов субстратов в организме ребенка, а также наличия сопутствующих заболеваний. Младенцы с меньшими гестационным возрастом и массой тела при рождении имеют наибольший риск возникновения медицинских осложнений.
Начало и увеличение объема питания может быть отсрочено в связи с имеющимся риском возникновения медицинских осложнений, связанных с незрелостью ЖКТ и других жизненно важных органов. Вследствие этого не всегда удается достичь желаемой скорости роста ребенка. Переживаемый организмом ребенка стресс, обусловленный артериальной гипотонией, гипоксией, инфекцией, хирургической патологией, гипогликемией, может быть транзиторным или приводить к осложнениям, требующим каких-либо медицинских вмешательств.
Риск потенциальных серьезных осложнений, связанных с ЯНЭК и другими патологическими состояниями, оказывает влияние на принятие решений, касающихся объемов назначаемого питания и целей нутритивной поддержки у недоношенных младенцев. При обсуждении вопросов начала энтерального кормления и увеличения его объемов следует принимать во внимание возможное отрицательное воздействие высоких концентраций в плазме отдельных аминокислот, глюкозы, жирных кислот и других продуктов метаболизма на ЦНС и другие органы.
Наше понимание основ физиологии перинатального роста и развития, как и искусство выхаживания и лечения недоношенных детей, продолжает совершенствоваться.
Сразу после рождения в ходе адаптации к условиям внеутробной жизни в организме новорожденного запускается ряд физиологических и метаболических процессов. Особенно выражены адаптивные изменения в физиологии и метаболизме липидов. До рождения основным источником энергии для плода является глюкоза. В плацентарной передаче жирных кислот участвуют специфические, связывающие жирные кислоты протеины; отмечается феномен биомагнификации при переходе омега-6 и омега-3 ДЦПНЖК через плаценту; отложение жира в жировой ткани плода происходит в основном в последние 10 нед гестации.
После рождения основным источником энергии становятся жирные кислоты; ЖКТ начинает играть исключительную роль в процессе переваривания жира и всасывания жирных кислот; жировые запасы младенца удовлетворяют его потребности в энергии и являются поставщиками омега-6 и омега-3 ДЦПНЖК, необходимых для развития ЦНС. Для детей, родившихся преждевременно, незрелость ЖКТ и ограниченные жировые запасы являются серьезной помехой в адаптации к внеутробным условиям. Не стоит забывать об участии жировой ткани в процессе терморегуляции, а также ее амортизирующей роли для чувствительных внутренних органов ребенка.
Известно, что недоношенные дети имеют большие потребности в энергии по сравнению с доношенными детьми. Эта энергия может быть израсходована, запасена или утрачена ребенком. Расходуемая энергия — это энергия, предназначенная для обеспечения основного метаболизма, активности ребенка, синтеза новых тканей, терморегуляции или реакций на холодовый стресс.
Запасаемая энергия включает энергию жировых запасов и безжировой массы тела. Потеря энергии отмечается при неполном переваривании и всасывании макронутриентов. Затраты энергии на рост у недоношенного ребенка в среднем составляют 3,0-4,5 ккал/г/сут. Обычно рекомендуется среднее потребление энергии 105—130 ккал/кг/сут. Примерно 50% этого количества энергии обеспечивается за счет жира. Дети с БЛД, малой массой тела для гестационного возраста, а также имеющие ЭНМТ могут иметь более высокие потребности в энергии.
Жиры, основной источник энергии как в грудном молоке, так и в молочных смесях, обеспечивают 40-55% потребляемой энергии. Для детей, родившихся преждевременно, в случае недостаточного количества грудного молока у матери могут быть использованы специализированные смеси для недоношенных детей. Эти смеси, превосходящие по калоражу и «плотности» компоненты грудного молока и смеси для доношенных младенцев, были разработаны с целью достижения у недоношенного ребенка скорости роста, характерной для плода в соответствующие сроки гестации.
Большинство таких смесей обеспечивает 80 ккал/100 мл. Для усиления пищевой ценности грудного молока также возможно применение его фортификаторов. Недоношенные младенцы, которые не способны усвоить энтеральное кормление, могут получать жиры парентеральным путем.
Переваривание и всасывание жиров у недоношенных детей
У преждевременно родившихся детей процессы переваривания и всасывания жиров могут быть ограниченны из-за недостаточной активности панкреатической липазы, низкого уровня желчных кислот (ниже критической мицеллярной концентрации), незрелости системы всасывания энтероцитов и неразвитой энтерогепатической циркуляции. Липаза грудного молока (иногда называемая липазой, зависимой от солей желчной кислоты) является уникальным компонентом, который, как было выявлено, усиливает переваривание жиров грудного молока.
Присутствие этой липазы в грудном молоке может хотя бы частично объяснить лучшее всасывание жиров у недоношенных младенцев, получающих грудное молоко, по сравнению с детьми, которых кормят некоторыми искусственными смесями.
Было высказано предположение о критическом значении для биодоступности жирных кислот в постнатальном периоде процесса всасывания жирных кислот и 2-моноглицеридов. Это предположение было основано на исследованиях, посвященных созреванию у недоношенных детей способности всасывать жиры. При проведении данных исследований применяли меченые атомы 13С. В группах доношенных и недоношенных детей концентрации в сыворотке 1-13С-пальмитата были измерены после энтерального назначения 3-13С-пальмитоилглицерола.
Исследователи сделали заключение, что о созревании процессов переваривания и всасывания жиров можно в большей степени судить по способности кишечника всасывать жирные кислоты.
Эта способность становится полноценной в постконцептуальном возрасте 46 нед независимо от срока рождения ребенка. В настоящее время полностью не известно, насколько созревание активности липазы и формирование желчи для образования мицелл и внутрипросветного расщепления жира до жирных кислот и 2-моноглицеридов могут повлиять на всасывание жирных кислот у недоношенных детей.
Читайте также:
- Послеоперационное кровотечение в полости рта. Паралич Белла. Гранулы Фордайса.
- Теория мультицентрического канцерогенеза. Гормональные причины мультицентричных опухолей
- КТ, МРТ, ангиограмма при травматической артериовенозной фистуле позвоночника
- Осложнения приема блокаторов рецепторов ангиотензина. Блокаторы бета-адренорецепторов
- Вирусная инфекция как причина саркоидоза. Экзогенный аллергический альвеолит
