Механизмы развития устойчивости опухоли к химиотерапии
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Причины развития устойчивости к противоопухолевым препаратам. Гипотеза Голди—Гольдмана
Эффективность любой противоопухолевой терапии ограничено лекарственной устойчивостью, которая может быть врожденной и приобретенной, может развиваться к одному или нескольким препаратам (множественная резистентность). Высказывалось предложение, что в основе лекарственной резистентности лежат спонтанные мутации. Такие мутации быстро появляются в злокачественных опухолях.
Эта концепция, гипотеза Голди—Гольдмана, была применена к росту злокачественных опухолей и имеет важное клиническое значение. Данная теория наводит на мысль о том, что большинство злокачественных клеток вначале имеет врожденную чувствительность к химиопрепаратам, но затем развивается спонтанная резистентность разной степени.
Голди и Гольдман разработали математическую модель, в которой излечение соотносится со временем появления клеток, резистентных к одному или двум химиопрепаратам. Предполагая, что есть спонтанная частота мутации, модель прогнозирует различия в размере устойчивой группы клеток опухоли того же размера и типа, которые зависят от спонтанной частоты мутации и особенностей, при которых мутация развивается. Таким образом, количественное соотношение резистентных клеток в любых опухолях, не подвергавшихся лечению, вероятно, будет небольшим и начальный ответ на лечение не будет влиять на количество резистентных клеток.
В клинической практике это означает, что полная ремиссия может быть достигнута, даже если существовала линия резистентных клеток. Однако неудачи в лечении таких больных непосредственно бы зависели от присутствия этих резистентных клеток. Такая модель спонтанной лекарственной устойчивости клеток предполагает, что для уменьшения появления клонов, устойчивых к препарату, необходимо, чтобы разнообразные эффективные лекарственные средства были применены как можно раньше при злокачественном процессе.
В клеточных линиях и экспериментальных моделях на животных устойчивость к специфическим препаратам, вероятно, возникает в результате разнообразных механизмов, хотя лишь только некоторые из них имеют клиническую значимость при злокачественных новообразованиях человека. Они включают улучшение качества репарации ДНК, уменьшение поглощения лекарственного средства или увеличение оттока его из клетки, повышение или изменение активности ферментов-мишеней данного химиопрепарата, изменения в лекарственной активации/деградации, амплификацию генов и нарушение метаболизма лекарственного средства. Эти механизмы представлены в таблице ниже.

Известны также различные механизмы множественной резистентности. Некоторые экспериментальные данные на моделях мышей указывают на то, что одна форма множественной лекарственной резистентности опухолевых клеток имеет отношение к способности резистентных к лекарственным средствам клеток опухоли ограничивать накопление препаратом структурно не связанных веществ. Эта перекрестная устойчивость чаще всего наблюдается при использовании природных препаратов (например, доксорубицина, этопозида, паклитаксела и алкалоидов барвинка).
Устойчивость к одному препарату может придать перекрестную устойчивость к структурно отличающимся препаратам с различными способами воздействия. Лучше всего исследован механизм множественной резистентности; было описано вовлечение в процесс гликопротеида р-170 и его гена MDR1. Линг и соавт. первые показали образование Р-гликопротеида с молекулярной массой 170 кДа на клеточной мембране. Появление плейотропной лекарственной устойчивости связывают с проницаемостью клетки, необходимой для накопления и удержания противоопухолевых препаратов.
Было описано, что этот Р-гликопротеид непосредственно связан с выраженностью устойчивости, а клетки, которые возвращаются в состояние чувствительности к препарату, теряют этот мембранный гликопротеид. ДНК может перемещаться из резистентных клеток в чувствительные клетки, обусловливая передачу плейотропной устойчивости в неэкспонированные клетки.
Маловероятно, что ген MDR1 служит самым распространенным механизмом образования устойчивости к химиопрепаратам при злокачественных новообразованиях яичника, особенно если учесть, что ген MDR1 этими опухолями не экспрессируется. Другой механизм, обусловливающий фенотип множественной лекарственной резистентности, характерен для алкилирующих средств, цисплатина и облучения. Устойчивость в этой группе была связана с повышением внутриклеточного уровня глутатиона и не связана с общим умеренным снижением накопления препарата. Для других транспортных белков, включая ассоциированные со множественной лекарственной резистентностью, было установлено, что р-170 гликопротеидный насос не участвует в механизме развития устойчивости.
Более того, были обнаружены изменения в генах, контролирующих апоптоз и задержку пролиферации. Несмотря на то что необходимо установить относительную значимость этих отдельных механизмов развития резистентности при раке яичника (РЯ), наиболее вероятно, что в клинической практике имеют место различные комбинации механизмов.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как раковые клетки становятся устойчивыми к противоопухолевым препаратам?
Прорывное исследование, результаты которого были недавно опубликованы в научном журнале Science, показало, что раковые клетки могут активировать альтернативные пути копирования ДНК, чтобы стать устойчивыми к противоопухолевым препаратам. Этот процесс называется стресс-индуцированным мутагенезом. Бактерии также его используют, чтобы выработать устойчивость к антибиотикам.
Каждый раз, когда делится клетка в организме человека, она должна очень точно скопировать около трех миллиардов «букв» генетического кода. Высокая точность нужна для того, чтобы дочерние клетки были жизнеспособны и нормально функционировали. Для раковых клеток это не так важно.
Ученые обнаружили, что при разных типах злокачественных опухолей, включая меланому, рак поджелудочной железы, саркомы и рак молочной железы, в ДНК раковых клеток во время деления при воздействии противоопухолевых препаратов происходит множество мутаций. Благодаря этим генетическим «ошибкам» и развивается устойчивость к химиопрепаратам.
Проблема резистентности рака
Даже если поначалу те или иные противоопухолевые препараты работали в конкретном клиническом случае очень хорошо, со временем они перестают быть эффективны. С этой проблемой ежегодно сталкиваются сотни тысяч онкологических больных. Зачастую еще остается возможность назначить «запасные» схемы терапии, но они тоже работают только в течение определенного времени. Рано или поздно, возникает ситуация, когда не помогает ни одна комбинация препаратов из актуальной версии протоколов лечения.
Ученым давно известно, что раковые клетки вырабатывают резистентность (устойчивость) к терапии в результате мутаций. Но пока непонятно, какие механизмы приводят к этим мутациям, и можно ли на них повлиять.
Команда ученых из Института медицинских исследований Гарвана (Garvan Institute of Medical Research, Австралия) во главе с профессором Дэвидом Томасом (David Thomas) проанализировала образцы опухолевой ткани, полученные от пациентов до и после курса таргетной терапии.
Исследователи были удивлены, когда увидели, что в опухолевых клетках после применения таргетных препаратов резко увеличился уровень повреждения ДНК, даже в случаях, когда ее не повреждал сам препарат. Было проведено секвенирование ДНК раковых клеток, чтобы оценить, как лечение привело к ускоренной эволюции генома опухолевой ткани.
Первый автор исследования, Аркади Сиппони (Arcadi Cipponi) отмечает:
Наши исследования показали, что в раковых клетках, подвергшихся воздействию таргетных препаратов, происходит стресс-индуцированный мутагенез. Они генерируют случайные генетические вариации с гораздо большей скоростью, чем раковые клетки, не подвергшиеся воздействию таргетных препаратов. Этот же механизм используют бактерии, когда оказываются в стрессовых условиях.
Рак использует двухступенчатую стратегию
Чтобы разобраться, почему в опухолевых клетках происходит стресс-индуцированный мутагенез, ученые начали поочередно «выключать» в них разные гены.
Когда был «отключен» ген, кодирующий белок MTOR, ученые обнаружили, что раковые клетки перестали расти, но парадоксальным образом ускорилась их эволюция в присутствии противоопухолевых препаратов.
Доктор Сиппони объясняет:
MTOR является сенсорным белком, он сигнализирует нормальным клеткам о том, что они оказались в стрессовых условиях, и им нужно прекратить расти. Мы обнаружили, что во время противоопухолевой терапии сигналы MTOR способствуют тому, что в раковых клетках меняется экспрессия (активность) генов, кодирующих белки, которые копируют и восстанавливают ДНК. Например, активируются ферменты, которые копируют ДНК и при этом часто совершают ошибки. Из-за этого в генах опухолевых клеток происходит большое количество изменений, благодаря чему и развивается резистентность к противоопухолевым препаратам.
Не менее интересен и тот факт, что такие реакции со стороны опухолевой ткани носят временный характер. Как только развивается устойчивость к препаратам, копирование ДНК снова становится точным, и генетические изменения перестают накапливаться в таком большом количестве.
Новые подходы к лечению онкологических заболеваний
Авторы исследования считают, что можно повысить эффективность лечения рака, если сочетать традиционную таргетную терапию с препаратами, влияющими на репарацию ДНК. Ученые проверили свое предположение на мышах с раком поджелудочной железы. Животным вводили два препарата:
- Палбоциклиб — блокирует ферменты циклинзависимые киназы, которые активируют размножение клеток.
- Рукапариб (Рубрака) — блокирует фермент PARP, который восстанавливает поврежденную ДНК.
В течение 30 дней терапии этой комбинацией рост злокачественной опухоли удалось затормозить на 60% эффективнее, чем при использовании только палбоциклиба.
Новые подробности об устойчивости опухоли к химиопрепаратам
Ученые обнаружили молекулярный механизм, который помогает опухоли вырабатывать устойчивость к химиопрепаратам. Он включается в качестве резервного варианта при отсутствии гена р53, который в норме помогает предотвращать мутации в здоровых клетках. Около половины опухолей не имеют р53.
Обнаруженный резервный механизм называется MK2. Он помогает клеткам восстанавливать поврежденную ДНК, не вызывая, в отличии от р53, их гибель. Таким образом, если клетка содержит поврежденную ДНК, не подлежащую ремонту, она продолжает делиться.
Химиопрепараты повреждают ДНК клетки и останавливают ее деление. Но при отсутствии р53 раковые клетки продолжают делиться, благодаря MK2. Опухоль продолжает расти, несмотря на химиотерапию.
Исследователи из Массачусетского технологического института в Кембридже (Massachusetts Institute of Technology in Cambridge) рассказывают в журнале Cancer Cell о том, что они обнаружили ключевое вещество в этом сигнальном пути – РНК-связывающий белок hnRNPA0. Старший автор исследования, профессор биологии и биологической инженерии Майкл Яффе (Michael Yaffe), объясняет:
«Я считаю, что этот РНК-связывающий белок – именно то, что делает опухолевые клетки, лишенные р53, устойчивыми к химиотерапии».
В здоровых клетках р53 контролирует деление и «выключает» его, если ДНК повреждена. А при сильном повреждении ДНК запускается апоптоз – программируемая клеточная гибель.
Профессор Яффе с коллегами обнаружили, что при отсутствии р53, – что характерно для половины всех опухолей, – его функции берет на себя механизм MK2. Создав препараты для таргетной терапии, направленные на этот резервный путь, можно будет существенно повысить чувствительность рака к химиопрепаратам.
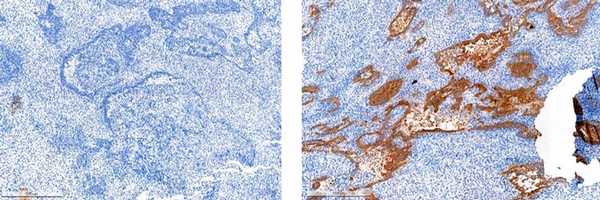
Отсутствие экспрессии p53 слева и выраженная экспрессия p53 справа
Кроме того, ученые считают, что, определяя в клетках больного р53 и MK2, можно будет предсказать, как он будет реагировать на химиотерапию. Это предположение было подтверждено в ходе исследования, в котором приняли участие пациенты, страдающие раком легких II стадии.
Далее, проводя опыты над мышами, ученые оценили, может ли механизм MK2 стать мишенью для таргетной терапии, которая поможет повысить чувствительность опухоли к химиопрепаратам. В частности, исследователи используют особые наногубки, которые «чистят» молекулы РНК-связывающего белка hnRNPA0 и не позволяют ему способствовать выживанию раковых клеток.
Это открытие стало еще одним шагом в развитии персонализированного лечения рака. Каждая опухоль содержит биомаркеры – особые молекулы, которые определяют ее характеристики и реакцию на те или иные химиопрепараты. Благодаря сотрудничеству с американскими лабораториями, в Европейской клинике имеется возможность составлять «молекулярный портрет» опухоли и подбирать наиболее эффективные комбинации препаратов.
Как понять, что химиотерапия работает?
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Медицина — не математика. То, что в ней происходит, нельзя четко разделить на «черное» и «белое». Организм человека можно сравнить со сложным уравнением, в котором тысячи неизвестных. Решая его, зачастую нельзя получить точный однозначный ответ. В медицине дважды два не равно четырем. Врач скажет, что получается примерно четыре с вероятностью 90% плюс-минус 0,051.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.

Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Но даже в рамках протоколов каждый пациент индивидуален. Например, два немелкоклеточных рака легких могут иметь очень разные молекулярно-генетические свойства, и против них будут эффективно работать разные комбинации препаратов. Нужен персонализированный подход, и современные технологии предоставляют такую возможность. В клиниках сети «Евроонко» можно провести специальный анализ и составить «молекулярный портрет» опухолевых клеток. Вместе с результатом анализа лаборатория выдает списки комбинаций химиопрепаратов, которые будут наиболее эффективны в конкретном случае.
Что такое ремиссия?
«Доктор, сможете ли вы избавить меня от рака?» Если онколог отвечает на этот вопрос однозначное «да», то он в некоторой степени кривит душой.
Что подразумевает пациент под словом «выздоровление»? Скорее всего, что в его организме не останется ни одной раковой клетки. Проблема в том, что это нельзя проверить ни одним самым современным методом диагностики. Раковые клетки крайне малы и могут находиться в организме где угодно. Они могут годами «спать», а потом начать быстро размножаться и образовать метастазы.
Вместо слова «выздоровление» в онкологии применяют специальный термин «ремиссия»: с помощью доступных на данный момент методов диагностики в организме пациента не обнаруживаются признаки злокачественной опухоли. Это не означает, что в будущем рак не может вернуться. Иногда рецидивирует прежнее онкологическое заболевание или возникает новое. Врачи применяют разные методы профилактического лечения, чтобы этого не произошло. Но полностью застраховаться нельзя, можно лишь снизить риски.
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.

В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
Химиотерапию проводят циклами. Это означает, что пациенту вводят препараты, а потом дают время на «передышку». Продолжительность цикла кратна неделе и составляет 7, 14, 21 день. Обычно для того чтобы оценить ответ на лечение, требуется 2–3 цикла. Для контроля используют те же методы, что и для диагностики рака:
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В клиниках «Евроонко» этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи «Евроонко» всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
Материалы конгрессов и конференций
Несмотря на достижения современной фармакологии, эффективность химиотерапии опухолей остается недостаточной. Это связано с важнейшей особенностью живых систем (в т.ч. опухолевых клеток) – способностью адаптироваться к изменениям внешней среды. Одно из проявлений такой пластичности – развитие в опухолевых клетках устойчивости к лекарственным препаратам. Множественная лекарственная устойчивость (МЛУ) злокачественных новообразований — сохранение клетками жизнеспособности в ответ на воздействие ряда лекарственных веществ — одна из основных причин прогрессирования болезни: опухоль нечувствительна к химиотерапии независимо от комбинации применяемых лекарств. Не будет преувеличением сказать, что МЛУ — наиболее подробно исследованный (и исследуемый) вид лекарственной устойчивости.
Основной механизм МЛУ - пониженное накопление препаратов в клетке, обусловленное активным выведением веществ в межклеточную среду [7]. Такой транспорт осуществляется белком плазматической мембраны Р гликопротеином (Pgp), кодируемым геном MDR1 (multidrug resistance 1) [6]. Этот механизм обеспечивает долговременное выживание клеток в присутствии веществ, различных по структуре и биологическому действию. Антрациклиновые антибиотики (адриамицин, даунорубицин), винкаалкалоиды (винкристин, винбластин), таксаны (таксол, таксотер), митоксантрон, ингибиторы топоизомераз (этопозид) — вот неполный перечень групп противоопухолевых препаратов, устойчивость к которым обусловлена Pgp-опосредованным транспортом. Увеличение количества иРНК MDR1 и Pgp часто служит фактором устойчивости многих типов опухолей к лечению [4, 9, 11, 15, 16, 20].
Рассмотрим два аспекта проблемы преодоления МЛУ: 1) срочное становление резистентности в ответ на действие противоопухолевых препаратов и 2) расширение роли Pgp за пределы транспортной функции и представление об этом белке как “универсальном” факторе выживания клетки. Анализ этих вопросов позволяет критически оценить подход к терапии новообразований, основанный на воздействии на конкретный механизм в опухолевой клетке.
МЛУ формируется в ответ на воздействие химиопрепаратов. Как клетка накапливает иРНК MDR1 и белок Pgp? Правомерно предположить, что устойчивые клетки несут несколько копий гена MDR1 (амплификация гена). Однако такой механизм не выявлен в опухолях человека. Следовательно, этот ген должен активироваться в ответ на внеклеточные сигналы. Действительно, однократного кратковременного (несколько часов) воздействия лекарств на культивируемые клетки достаточно, чтобы накопились иРНК MDR1 и функционирующий Pgp. Активация МЛУ подтверждена и в клинической ситуации, например, при интраоперационной перфузии адриамицином легких у больных с метастазами фибросаркомы [2]. МЛУ может развиваться в клетках различного тканевого происхождения в ответ на действие многих химиопрепаратов. В активации МЛУ участвуют многочисленные механизмы проведения внутриклеточных сигналов. Важно, что эти механизмы не уникальны для регуляции данного гена, а обеспечивают другие защитные реакции клетки на стресс.
Регуляция гена MDR1 (а значит и МЛУ) осуществляется на многих уровнях; возможны “обходы” сигналов, если тот или иной механизм не функционирует. Такая взаимозаменяемость механизмов надежно обеспечивает развитие МЛУ при действии лекарств.
Итак, МЛУ “с готовностью” развивается в клетках, переживших воздействие химиопрепаратов. Более того, активация гена MDR1 возрастает с увеличением концентрации токсина [5]. Поэтому применение высокодозных режимов лечения (оправданное потребностью повысить его эффективность) может вести к развитию МЛУ в выживших клетках. Снижение доз (с целью избежать развития МЛУ) заведомо неэффективно; концентрации же лекарств, требуемые для полной элиминации опухоли, могут оказаться выше допустимых для больного, что определяет предел эскалации доз.
МЛУ - компонент многофакторной защиты клетки. Казалось бы, один механизм устойчивости (даже обеспечивающий резистентность к нескольким веществам) не способен сильно ограничить возможности противоопухолевой терапии. Однако МЛУ оказывается не единственным фенотипом устойчивости, а Pgp — не только молекулярный транспортер. Исследования последних лет показывают, что Pgp может защищать клетку и помимо транспортной роли. Накапливаются свидетельства того, что Pgp может препятствовать гибели клетки, сопровождающейся активацией каспаз — протеолитических ферментов, вызывающих деградацию важнейших клеточных структур в ответ на действие токсинов [12]. Так Pgp выступает как один из механизмов анти-апоптоза.
Кроме того, Pgp - не единственный фактор защиты. Опухолевые клетки, пройдя отбор в организме на способность “ускользать” от контроля пролиферации и дифференцировки, накапливают механизмы, способствующие выживанию. Классические примеры - химерная тирозинкиназа Bcr-Abl в клетках острого лимфобластного лейкоза, хронического миелоидного лейкоза, стромальных опухолей желудочно-кишечного тракта, нарушения структуры и функции р53, рецепторов семейства фактора некроза опухоли и др. Это не удивительно: выдержали отбор те опухолевые клетки, в которых имеются (до лечения) молекулярные детерминанты выживаемости. Если в процессе химиотерапии в таких клетках накопится Pgp, то их резистентность будет действительно многофакторной. Таким образом, способность быстро приобретать МЛУ проявляется в уже устойчивых клетках. Как преодолеть эту плейотропную резистентность?
Механизм-специфическая химиотерапия и МЛУ. Возможно ли преодоление резистентности воздействием на конкретный механизм? Представляется дискутабельным доминирующее в современной литературе стремление к непременной идентификации клеточных мишеней в надежде на создание конкретного для отдельной опухоли (или, шире, клинической ситуации) подхода к лечению (mechanism-based therapy). Это стремление продиктовано необходимостью добиться максимального противоопухолевого эффекта при возможно меньшей обще резорбтивной токсичности. Мишенями направленной терапии служат нарушения, чаще встречаемые в опухолях (но не всегда специфичные для новообразований), чем в интактных клетках. Такие нарушения могут быть обусловлены изменениями структуры генов (например, инактивация функции р53 за счет мутаций или делеций гена) и/или эпигенетической дизрегуляцией экспрессии онкогенов и антионкогенов. Несомненно, детальное изучение механизмов выживания и смерти опухолевых клеток плодотворно и для фундаментальной биологии, и для практической онкологии. Уже сегодня в клинике применяются препараты-антагонисты конкретных механизмов регуляции пролиферации, в частности, ингибитор эпидермального фактора роста ZD1839 (Иресса) и блокатор тирозинкиназы Bcr-Abl STI-571 (Гливек). Однако безупречен ли подход к терапии опухолей, основанный на взаимодействии препарата с одной клеточной мишенью? Всегда ли целесообразно уменьшать обще резорбтивный эффект химиотерапии за счет прицельной манипуляции с конкретной структурой опухолевой клетки? Не послужит ли такая индивидуализация лечения сужению терапевтического спектра и снижению эффективности препарата?
Во-первых, специфичность взаимодействия малых молекул — а именно они составляют подавляющее большинство современных средств противоопухолевой терапии — с биологическими структурами относительна. Например, ингибиторы того или иного семейства протеинкиназ реагируют и с другими киназами. Ингибирование фермента предполагает взаимодействие малой молекулы с участком (участками) молекулы энзима, существенным для ее активности, в частности, с каталитическим сайтом или сайтом связывания АТФ. Однако структура этих районов редко бывает уникальной для конкретного фермента. Кроме того, проникновение в клетку чужеродного химического соединения вызовет ряд общих стрессорных реакций. Эти реакции (а они неизбежны как ответ на раздражитель!) в клетке налагаются на эффект взаимодействия потенциального модулятора с его основной мишенью. Еще более проблематична оценка эффекта ингибитора на уровне организма.
Второе возражение связано с биологической гетерогенностью опухоли. Экспрессия того или иного механизма может широко варьировать между участками опухоли. Поэтому неодинаковой будет и чувствительность к лечебному препарату отдельных клеток или клеток в разных зонах новообразования. Если так, то применение узко специфического агента предоставит селективное преимущество в выживании клеткам, в которых механизм-мишень экспрессирован слабее. Но тогда остаточная опухоль будет резистентна к препарату из-за отсутствия его мишени в клетках, т.е. эффект лечения оказывается заведомо неполным. Предположение же о том, что мишень, против которой действует препарат, есть единственный или главный фактор злокачественности в данной опухоли, может оказаться неправомерным. Ведь основные черты злокачественной трансформации — неконтролируемая пролиферация, способность к выживанию и делению без контакта с адгезивным субстратом, инвазия, метастазирование — обеспечиваются многочисленными механизмами, и блокирование одного фактора приведет к смене фенотипов резидуальной опухоли, но не обязательно к ее исчезновению. Как быть в случаях рецидивов опухоли в результате развития устойчивости, например, к STI571, благодаря выживанию клеток с мутацией в киназном домене Bcr-Abl [24]? А ведь МЛУ может развиваться быстро в ответ на воздействие многих веществ (см. выше); тогда рецидивная опухоль окажется резистентной и к STI571, и к ряду других препаратов.
Наконец, третье, важнейшее возражение, возвращает нас к поставленной в начале статьи проблеме необычайной пластичности опухолевой клетки как биологической системы. Функции клетки, нарушенные при злокачественном росте — пролиферация, смена фаз клеточного цикла и др. — регулируются чрезвычайно “надежно”. Мы представили это многообразие регуляторных механизмов на примере становления МЛУ; и преодоление этого фенотипа путем обхода механизмов устойчивости также обосновано сложностью (многочисленностью, взаимозаменяемостью) процессов, обеспечивающих выживание клеток. В ряде ситуаций удается блокировать приобретение клетками Pgp-опосредованной МЛУ, воздействуя на конкретный механизм [5, 12, 27]. Однако всегда остается возможность ускользания опухолевой клетки от терапевтических воздействий. Такая возможность может возрастать при прогрессии опухоли. Важнейшая особенность онкологического заболевания — именно развертывание каскадов регуляции клетки. “Вооружаясь” таким образом, клетка и получает способность ускользать от систем биологического контроля.
Приведенные соображения не умаляют значимости терапии опухолей, ориентированной на конкретный механизм. Однако постоянная возможность (или угроза) “ускользания” опухоли заставляет критически оценить стремление этой стратегии к универсальности. Многофакторная устойчивость — результат постоянного ускользания, приобретения опухолью новых возможностей надежного регулирования функций, важных для ее выживания; эта способность злокачественных клеток предполагает, что оптимизация противоопухолевой терапии может быть достигнута сочетанием механизм-специфических воздействий с активацией путей гибели, сохраняющих функцию при формировании резистентности.
Одним из таких путей является нарушение целостности плазматической мембраны. Некроз не нарушен в Pgp-экспрессирующих клетках с МЛУ [13, 25, 26]. При некрозе быстро произойдут повреждения практически любых субклеточных структур, в отличие от апоптотических каскадов, сопровождающихся последовательным расщеплением субстратов и строгой специфичностью взаимодействия протеаз с мишенями [29]. Блокирование одного или нескольких звеньев апоптотических каскадов прервет передачу сигналов на нижележащие механизмы, результатом чего станет ускользание клетки от гибели и, в итоге, формирование устойчивости. Такая возможность не исключена при формировании многофакторной резистентности, в том числе Pgp-опосредованной МЛУ. Еще и по этой причине для борьбы с МЛУ желательно, чтобы механизмы смерти были множественными и включали активацию каспаз и других протеаз (лизосомальных, протеосомальных, ядерных), путей потенцирования сигнала (митохондриальный путь) и нарушения проницаемости мембран. Таким образом, терапевтическими мишенями выступают не только отдельные молекулы, но и надмолекулярные комплексы (органеллы, плазматическая мембрана).
МЛУ — не единственный фенотип устойчивости клеток к ксенобиотикам, а Pgp — не единственный механизм, обеспечивающий выживание в присутствии токсинов. Сегодня не представляется возможным предсказать, совокупность каких факторов резистентности (транспорт веществ через плазматическую мембрану, внутриклеточный катаболизм токсинов, антиоксидантная защита и др.) определит неэффективность конкретного лечебного режима в отношении конкретной опухоли. Блокирование отдельного “специфического” механизма может оказаться заведомо недостаточным. Чем больше механизмов смерти удастся активировать в резистентных клетках, чем менее зависима такая стратегия от динамичного “молекулярного профиля” опухоли, тем надежнее конечный результат — преодоление многофакторной резистентности.
Список литературы:
1. Трунова С.А. Инициация вхождения в митоз и проблема избыточности функций митотических циклинов // XIV Всероссийский симпозиум “Структура и функции клеточного ядра”. Санкт-Петербург, 15-17 октября 2002 г.: Цитология. — 2002. — Т. 44. С. 910.
2. Abolhoda A., Wilson A.E., Ross H. et al. Rapid activation of MDR1 gene expression in human metastatic sarcoma after in vivo exposure to doxorubicin. // Clin. Cancer Res. — 1999. — Vol. 5. — P. 3352-3356.
3. Ambudkar S.V., Dey S., Hrycyna C.A. et al. Biochemical, cellular, and pharmacological aspects of the multidrug transporter // Annu. Rev. Pharmacol. Toxicol. — 1999. — Vol. 39. — P. 361-398.
4. Arceci R.J. Clinical significance of P-glycoprotein in multidrug resistance malignancies // Blood. 1993. — Vol. 81. — P. 2215-2222.
5. Chaudhary P.M., Roninson I.B. Induction of multidrug resistance in human cells by transient exposure to different chemotherapeutic drugs // J. Natl. Cancer Inst. — 1993. — Vol. 85. — P. 632-639.
6. Chen C.-J., Chin J.E., Ueda K. et al. Internal duplication and homology with bacterial transport proteins in the mdr1 (P-glycoprotein) gene from multidrug-resistant human cells // Cell. — 1986. — Vol. 47. — P. 381-389.
7. Dano K. Active outward transport of daunorubicin in resistant Ehrlich ascites tumor cells // Biochim. Biophys. Acta. — 1973. — Vol. 323. — P. 466-483.
8. Fang B., Roth J.A. Tumor-suppressing gene therapy // Cancer Biol. Ther. 2003. — Vol. 2. — P. S115-S121.
9. Goldstein L.J., Galski H., Fojo A. et al. Expression of a multidrug resistance gene in human cancers // J.Natl. Cancer Inst. 1989. — Vol. 81. — P. 116-124.
11. Hegewisch-Becker S., Hossfeld D.K. The MDR phenotype in hematologic malignancies: prognostic relevance and future perspectives // Ann. Hematol. 1996. — Vol. 72. — P. 105-117.
12. Johnstone R.W., Cretney E., Smyth M.J. P-glycoprotein protects leukemia cells against caspase-dependent, but not caspase-independent, cell death // Blood. 1999. — Vol. 93. — P. 1075-1085.
13. Johnstone R.W., Taiinton K.M., Rueffli A.A. et al. P-glycoprotein does not protect cells against cytolysis induced by pore-forming proteins // J.Biol. Chem. 2001. — Vol. 276 — P. 16667-16673.
14. Juliano R., Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants // Biochim. Biophys. Acta. — 1976. — Vol. 455. — P. 152-162.
15. Leith C.P., Kopecky K.L., Godwin J. et al. Acute myeloid leukemia in the elderly: assessment of multidrug resistance (MDR1) and cytogenetics distinguishes biologic subgroups with remarkably distinct responses to standard chemotherapy. A Southwest Oncology Group study // Blood. 1997. — Vol. 89. — P. 3323-3329.
16. Marie J.P. Drug resistance in hematologic malignancies // Curr. Opin. Oncol. 2001. — Vol. 13. — P. 463-469.
17. O'Dwyer M.E., Mauro M.J., Druker B.J. STI571 as a targeted therapy for CML // Cancer Invest. 2003. — Vol. 21. — P. 429-438.
19. Pallares-Trujillo J., Lopez-Soriano F., Argiles J.M. Lipids: A key role in multidrug resistance? // Int.J.Oncol. — 2000. — Vol. 16. — P.783-798.
20. del Poeta G., Stasi R., Aronica G. et al. Clinical relevance of P-glycoprotein expression in de novo acute myeloid leukemia // Blood. 1996. — Vol. 87. — P. 1997-2004.
21. Reddy A., Kaelin W.G.Jr. Using cancer genetics to guide the selection of anticancer drug targets // Curr. Opin. Pharmacol. — 2002. — Vol. 2. — P. 366-373.
23. Sattler M., Scheijen B., Weisberg E., Griffin J.D. // Adv. Exp. Med. Biol. 2003. — Vol. 532. — P.121-140.
24. Shah N.P., Sawyers C.L. Mechanisms of resistance to STI571 in Philadelphia chromosome-associated leukemias // Oncogene. — 2003. — Vol. 22. — P. 7389-7395.
25. Shtil A., Turner J., Durfee J. et al. Cytokine-based tumor cell vaccine is equally effective against parental and isogenic multidrug-resistant myeloma cells: the role of cytotoxic T-lymphocytes // Blood. — 1999. — Vol. 93. — P. 1831-1837.
26. Shtil A., Turner J., Dalton W., Yu H. Alternative pathways of cell death to circumvent pleiotropic resistance in myeloma cells: role of cytotoxic T-lymphocytes // Leukemia and Lymphoma. — 2000. Vol. 38. — P. 59-70.
27. Shtil A.A. Emergence of multidrug resistance in leukemia cells during chemotherapy: mechanisms and prevention. // J.Hematother. Stem Cell Res. — 2002. — Vol. 11. — P. 231-241.
28. Tamura K, Fukuoka M. Molecular target-based cancer therapy: tyrosine kinase inhibitors. // Int. J. Clin. Oncol. 2003. — Vol. 8. — P. 207-211.
29. Thornberry N.A., Lazebnik Y. Caspases: enemies within. //Science. — 1998. — Vol. 281(5381). — P.1312-1316.
30. Warmuth M., Damoiseaux R., Liu Y. et al. SRC family kinases: potential targets for the treatment of human cancer and leukemia. // Curr. Pharm. Des. 2003. — Vol. 9. — P. 2043-2059.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Читайте также:
