Мембранные иммуноглобулины. Поверхностные антитела
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Мы поставляем антитела Abcam дважды в месяц, с соблюдением температурного режима транспортировки.
Система AbPromise гарантирует качество в течение 6 месяцев после поставки.
Используя систему AbReviews, каждый пользователь продукции Abcam может поделиться результатами использования продукта.
Преимущества Abcam:
- высочайший контроль качества производства и 100% гарантия на продукцию;
- бесплатные и регулярные вебинары;
- техническая консультативная поддержка;
- международное профессиональное сообщество пользователей продукции Abcam.
Пластик, стекло, принадлежности
Химические реактивы
Ссылки:
Видеоролики:
Каталоги и буклеты:
Антитела Abcam — один из мировых лидеров в производстве и разработке антител для научных исследований. Каталог компании Abcam насчитывает более 450 000 продуктов высшего качества!
Мы поставляем антитела Abcam дважды в месяц, с соблюдением температурного режима транспортировки.
Система AbPromise гарантирует качество в течение 6 месяцев после поставки.
Используя систему AbReviews, каждый пользователь продукции Abcam может поделиться результатами использования продукта.
- высочайший контроль качества производства и 100% гарантия на продукцию;
- бесплатные и регулярные вебинары;
- техническая консультативная поддержка;
- международное профессиональное сообщество пользователей продукции Abcam.
Abcam — это более 450 000 продуктов использующихся в таких областях, как:
- исследования рака ;
- сердечно-сосудистые заболевания ;
- клеточная биология ;
- исследовательская биология ;
- разработка лекарств ;
- эпигенетика и ядерный сигналинг ;
- иммунология ;
- метаболизм ;
- микробиология ;
- нейрология ;
- передача сигналов ;
- стволовые клетки .
Антитела первичные и вторичные для любых методов исследования: иммуно-гистохимии (ИГХ) и иммуно-цитохимии (ИЦХ), иммуноблоттинг, проточная цитометрия
- Антитела моно- и поликлональные, первичные и вторичные.
- Наборы и реагенты для проведения ИФА-анализа при изучении механизмов апоптоза, клеточного сигналинга, пролифирации и онкогенеза.
- Гели, буферы, мембраны и красители Abcam для электрофореза белков и иммуноблоттинга.
- Окрашенные трёхцветные маркеры молекулярного веса Prism.
RabMab – это высокоспецифичные моноклональные кроличьи антитела
- Идеальное решение для требовательных иммунных методов анализа, таких как иммуно-гистология, иммуноблоттиг и проточная цитометрия.
- Увеличение чувствительности без потери специфичности.
- Отличный результат даже при высокой степени разведения (5 – 10x).
- Возможность использования при работе с различными методами фиксации ткани с минимальной предварительной обработкой.
- Высокое качество результатов двойного окрашивания с использованием моноклональных антител мыши или крысы.
Конъюгаты вторичных антител
- Для ИГХ, ИЦХ, иммуноблоттинга и иммуноприципитации.
- Более 2800 вариантов различного видового происхождения.
- Хромогенные и флуоресцентные конъюгаты, в т. ч. и для многоцветного анализа.
- DAB-наборы для детекции методом ИГХ.
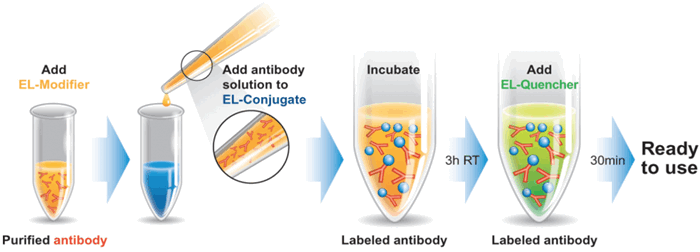
Наборы EasyLink для создания собственных конъюгатов, Abcam
- Большой выбор меток: 25 конъюгатов для ферментативной или флуоресцентной детекции.
- Простой и быстрый протокол: всего 3,5 часа.
- Прямая детекция: быстрые эксперименты, сниженный фоновый сигнал.
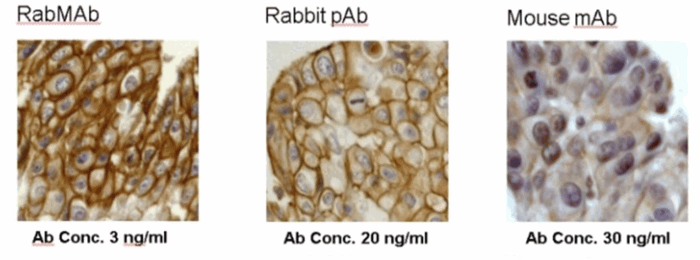
Параметры рака молочной железы, окрашенные с использованием 3-х разных типов антител
Красители и реагенты для флуоресцентной микроскопии
- Высокая стабильность и устойчивость к выгоранию.
- Широкий диапазон спектров (от УФ до БИК).
- CytoPainter для окраски органелл живых и фиксированных клеток.
- DRAQ5 – для окраски живых или фиксированных клеток.
- DRAQ7 – для окраски фиксированных и мёртвых клеток.
Флуоресцентные красители для окраски и картирования нейронов
- Определение локализации и активности пресинаптических окончаний.
- Визуализация высвобождения дофамина из отдельных пресинаптических окончаний.
Вспомогательные реактивы для флуоресцентного окрашивания
- Fluoroshield – среда для заливки на водной основе с уникальным составом, предотвращающая быстрое выцветание флуоресцентных меток на свету вовремя эксперимента.
- CyGEL – новый термообратимый гидрогель, позволяющий легко иммобилизовать живые неприкрепленные клетки и микроорганизмы; превращается в жидкость при охлаждении и в гель при нагреве выше 21 °C.
- CyGELSustain – для экспериментов, длящихся более 2 ч; имеет специальный состав, позволяющий добавлять в гель питательные среды (например, RPMI) для повышения выживаемости клеток в длительных экспериментах.
Наборы, реагенты, системы детекции для ИГХ
Наборы ИГХ EXPOSE для микрополимерной детекции (HRP/DAB-система детекции)
- Высокочувствительной метод детекции первичных антител мыши, крысы, кролика.
- Не чувствителен к эндогенному биотину.
- Системы детекции: HRP/DAB, HRP/AEC и AP Red.
Наборы ИГХ для Биотин-стрептавидиновой детекции (ABC-система детекции)
- Классический метод детекции первичных антител в гистологических срезах с использованием вторичных антител, конъюгированным стрептавидин-биотин комплексом (ABC) повышенной чувствительности.
Наборы ИГХ для многоцветного энзимного окрашивания препаратов на основе полимерной системы детекции.
- Снижение фона при окраске ткани, содержащий эндогенный биотин (например, почек, печени и селезенки).
- Оптимизированный протокол для упрощенного набора и развитие многоцветной экспериментов.
- Лучше отношение сигнала к шуму для четкой визуализации окрашивания и морфологии.
- Гибкие цветовые комбинации (до 3х цветов одновременно): на красный, зеленый, фиолетовый, коричневый и черный.
- Использование антител грызунов на грызунах ткани: протоколы для блокирования эндогенного IgG мыши или крысы IgG.
Наборы ИГХ для обработки мышиных гистологических срезов
- Оптимизированы для работы с мышиными антителами на мышиных срезах.
- Отличное соотношение сигнал-шум.
- Снижение фона при окраске ткани, содержащий эндогенный биотин (например, почек, печени и селезенки).
Наборы SimpleStep для ИФА-анализа с коротким протоколом постановки
- Инновационная технология SimpleStep ELISA от Abcam.
- Упрощённый протокол при постановке ИФА- анализа.
- Экономия времени без ущерба чувствительности: протокол поставановки – всего 90 минут.
Наборы для эпигенетических исследований EpiSeeker
Наборы EpiSeeker для детекции и количественного анализа эпигенетических модификаций гистоновых белков, цитозина, активности регуляторных ферментов.
- Простые и надежные количественные тесты.
- Колориметрический или флуориметрический формат.
- Возможность работы вручную или на высокопроизводительных автоматических приборах.

Наборы, реагенты и антитела для хроматиновой иммунопреципитации (ChIP)
- Исследования взаимодействия белков с ДНК.
- Транскрипция и сайленсинг генов.
- Детекция in vitro взаимодействия ДНК с транскрипционными факторами.
- Метилированние или ацетилирование гистона H3.
- Изучение гидроксиметилированной ДНК и метил-ДНК-связывающего белка из клеток или тканей.
Наборы для измерения модификаций и метилирования ДНК
- Наборы для выделения ДНК и проведения быстрой бисульфитной конверсии ДНК всего за 30 минут.
- Измерение общего содержания метилированной и гидроксиметилированной ДНК.
- Наборы для изучения метилирования в клетках и тканях без выделения ДНК.
- Количественные тесты активности метилаз, скрининг ингибирующих метилаз, измерение общей активности ДНК-деметилаз.
Наборы для изучения метилирования/деметилирования, ацетилирования/деацетилирования и фосфорилирования гистонов
- Изучение общей активности гистоновых метилаз и деметилаз.
- Проведение скрининга ингибирующих деметилаз.
- Количественное определение содержания метилированных/деметилированных, ацетилированных/деацетилированных и фосфорилированных по специфическим положениям гистонов.
Наборы для приготовления библиотек NGS Illumina
- Идеально походят для фрагментирования двух цепочечной ДНК, выделенной из образцов различных тканей или клеток.
- Минимально небходимое количество ДНК от 5 нг.
- Протокол – от 1,5 до 8 часов: библиотеки можно подготовить в течении 1 дня!
Реагенты и красители для блоттинга
Краситель Optiblot Blue:
- Ускоренный протокол: всего за 5 минут!
- Окрашивает только белковые полосы, фон остается абсолютно прозрачным.
- Пригоден для окраски готовых гелей и гелей, приготовленных вручную.
- Безопасен для здоровья (в состав краски не входит метанол, раствор не является токсичным.
- Экономичность: всего 20 мл на гель!
Окрашенные трёхцветные маркеры молекулярного веса Prism от Abcam
- Полностью готов к использованию.
- Может использоваться для оценки эффективности электрофореза белка в SDS-полиакриламидном геле, и переноса белков на мембраны из различного материала (ПВДФ, нейлона или нитроцеллюлозы).
Коктейли ингибиторов протеаз и фосфатаз
Защитите ваши образцы от деградации белка и сохраните их в состоянии фосфорилирования с удобными и простыми в использовании коктейлями ингибиторов протеаз и фосфатаз от компании Abcam.
- Коктейли ингибиторов протеаз для обеспечения максимальной защиты белков в клеточных лизатах от воздействия эндогенных протеаз путём блокировки активности внутриклеточных ферментов.
- Коктейли ингибиторов фосфатаз для изучения и сохранения белков в состоянии фосфорилирования.
- Коктейли ингибиторов протеаз и фосфатаз в сочетании идеально подходят для максимальной защиты образцов белка и оптимизированы для применения в масс-спектрометрии.
Мембранные мультиплексные количественные и полуколичественные методы (Membrane antibody array)
- Идеальный инструмент для скрининга, профилирования и мультипараметрического анализа.
- Анализ до 96 аналитов на мембрану.
- Более 350 белков.
- Всего 500 мкл образца.
- Протокол аналогичный постановке блоттинга.
- Детекция на любой хемидокментирующей системе.
Реагенты для клеточного и биохимического анализа
Белки и пептиды
Данная группа продуктов включает в себя молекулы белковой природы от нескольких аминокислотных остатков до полноразмерных, функциональных белков, в том числе:
- сигнальные белки;
- рецепторы и поверхностные клеточные маркеры;
- цитокины, химокины и факторы роста;
- ферменты, в т. ч. для функционального анализа;
- белки, свободные от молекул животного происхождения;
- иммуноглобулины;
- наборы для мечения антител и белков;
- синтетические пептиды-иммуногены.
Агонисты, активаторы, антагонисты и ингибиторы
Небольшие молекулы, как синтетические, так и биологического происхождения, которые влияют на:
- передачу сигналов внутри клеток;
- рецепторы и транспортные молекулы;
- работу ферментов;
- работу ионных каналов.
Положительные и отрицательные контроли (лизаты клеток и тканей)
А также субклеточных структур, которые могут применяться в качестве контролей, иммуногенов, а также в других применениях.
Мембранные иммуноглобулины. Поверхностные антитела
Мембранные иммуноглобулины. Поверхностные антитела
Все рассмотренные нами до сих пор механизмы и процессы относились к секретируемым иммуноглобулинам. На самом деле имеется два основных типа иммуноглобулинов: секретируемые и мембранные. Последние изучены значительно хуже, что объясняется, во-первых, их меньшим содержанием и, во-вторых, трудностями выделения их в чистом виде. Клеточная мембрана составляет 2—5% массы клеток, а иммуноглобулиновые рецепторы — не более 5% всех мембранных белков, т. е. ~103г на клетку (Marchalonis е. а., 1973).
В основном мембранные иммуноглобулины выявляются на В-клетках, не секретирующих значительных количеств антител (иммуноглобулинов). На поверхности нормальных плазматических клеток иммуноглобулинов обычно нет, хотя известны плазмоцитомы, содержащие мембранные иммуноглобулины, несмотря на высокий уровень секреции миеломного белка (Hiramoto, Ghata, 1973) Обнаружены поверхностные иммуноглобулины и на части секретирующих антитела плазматических клеток (Bankert с. а., 1976).
Обычно мембранные иммуноглобулины обладают той же специфичностью, авидностью, аллотипом и идиотипом и так же меняют класс в ходе иммунного ответа, как и секретируемые антитела. В связи с этим им отводится роль специфических рецепторов, через взаимодействие с которыми и осуществляется вовлечение (triggering) клетки антигеном в процессы биосинтеза антител (Сидорова, 1977).
Основным классом поверхностных иммуноглобулинов является 7S IgM с молекулярным весом 180 000 (Uhr, Vitetta, 1973; Askonas, 1975). Кроме того, у мышей и людей обнаружены поверхностные IgD (Melcher е. а., 1974; Fu е. а., 1974) и незначительное количество IgG, а у крыс и мышей — IgA (Baur е. а., 1972; Ramasamy, 1976). IgD обычно присутствует на поверхности вместе с IgM; таким образом, на одной клетке одновременно выявляется два класса иммуноглобулинов.
Вопрос этог мало изучен, но, по-видимому, IgD и IgM в ряде случаев обладают одинаковой идиотипической и антителыюй специфичностями (Fu с. а., 1974; Marchalonis, 1976).
Как известно, синтез иммуноглобулинов в организме появляется лишь на определенной стадии развития животного. При этом в первую очередь начинают работать механизмы, обусловливающие синтез пептидных цепей IgM, и лишь позднее возникает способность к образованию иммуноглобулинов других классов. По сути дела это означает, что раньше всего «разрешается» работа участков генома, ответственных за синтез цепей Vu и VL и Q, и CL и образование соответствующих мРНК.
Возможно, это находится в какой-то связи с тем, что поверхностные иммуноглобулиновые рецепторы представляют собой 7S мономеры IgM т. е. клетки в первую очередь стремятся обеспечить себя распознающими структурами и лишь затем превращаются в секретирующие гуморальные иммуноглобулины.
В мембране покоящихся лимфоцитов иммуноглобулиновые рецепторы представляют собой относительно устойчивые компоненты. Период полуобмена мембранных иммуноглобулинов составляет 10—40 час (Ramasamy, 1976), в то время как период полуобмена секретируемых миеломных иммуноглобулинов равен 2—4 час (Askonas, 1975). Различны, по-видимому, и пути высвобождения мембранных и секретируемых иммуноглобулинов из клеток (Vitetta е. а., 1974).
Известно, что обменивающийся иммуноглобулин «сходит» с мембраны в комплексе с какими-то еще компонентами; молекулярный вес комплексов составляет ~ 200 000.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Мембранные иммуноглобулины. Поверхностные антитела
Ткани и органы. Иммунная система
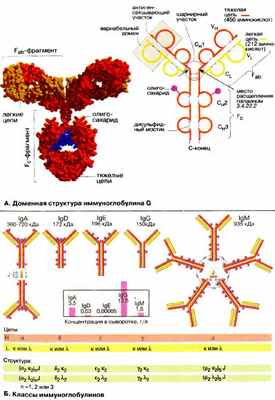
А. Доменная структура иммуноглобулина G
Иммуноглобулины (Ig), или антитела , являются семейством Y-образных (по пространственной структуре) гликопротеинов, у которых обе вершины («буквы Y») могут связывать антиген. Иммуноглобулины находятся в виде мембранных белков на поверхности лимфоцитов и в свободном виде в плазме крови. На схеме показана структура наиболее важного из них — иммуноглобулина класса G ( IgG ). Молекула представляет собой крупный тетрамер (Н 2 L 2 с 150 кДа) из двух идентичных тяжелых цепей (Н-цепей, на схеме красного или оранжевого цвета) и двух идентичных легких цепей (L-цепей, на схеме желтого цвета). В обеих H-цепях имеется ковалентно связанный олигосахарид (на схеме фиолетового цвета; см. также рис. 51).
Иммуноглобулины расщепляются протеиназой папаином на два F ab -фрагмента и один F c -фрагмент. Оба F ab -фрагмента (от англ. antigen binding fragment — антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и N-концевой части H-цепи. Изолированные F ab -фрагменты сохраняют способность связывать антиген. F с -Фрагмент (от англ. fragment crystallizable — способный кристаллизоваться) состоит из С-концевой половины обеих H-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе антител клетками.
Несмотря на большое разнообразие в иммуноглобулинах соблюдается общий принцип строения. Обе тяжелые пептидные цепи (Н-цепи) IgG состоят из четырех глобулярных доменов V H , С H 1, С H 2 и С H 3 , обе легкие (L- цепи) — из двух глобулярных доменов C L и V L . При этом буквы С и V соответственно обозначают константные (англ. constant) и вариабельные (англ. variable) области. Обе тяжелые цепи, а также тяжелая цепь с легкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри доменов стабилизируют третичную структуру. Домены имеют длину около 110 аминокислот и обладают взаимной гомологией (см. с. 292). Такая структура антител, очевидно, возникла благодаря дупликации гена.
В центральной области молекул иммуноглобулинов расположен шарнирный участок, который придает антителам внутримолекулярную подвижность.
Б. Классы иммуноглобулинов
Иммуноглобулины человека по структуре тяжелых цепей делятся на пять классов. Различия между IgA (с двумя подклассами), IgD, IgE, IgG (с четырьмя подклассами) и IgM определяются H-цепями , которые обозначаются греческими буквами — α, β, ε, γ и μ. L-Цепи имеют только две разновидности (κ и λ). IgM могут существовать в различных формах. Секретируемые IgM состоят из пяти взаимосвязанных димеров. IgA могут быть образованы из одного, двух или трех димеров. Олигомерные IgM и IgA удерживаются вместе благодаря связывающему J-пептиду (от англ. joining).
Иммуноглобулины всех пяти классов являются секретируемыми белками. Они поставляются в кровь зрелыми В-клетками (плазматическими клетками, см. с. 286), Ранние варианты IgM и IgD найдены также в виде интегральных мембранных белков на поверхности В-клеток (см. с. 292).
Антитела имеют различные функции. При контакте с чужеродным антигеном первыми образуются lgM -антитела. Ранние формы IgM связаны с поверхностью В-клеток (см. с. 292), более поздние формы секретируются в виде пентамеров плазматическими клетками. Антитела IgM особенно активны против микроорганизмов. В количественном отношении превалируют антитела IgG (см. таблицу сывороточных концентраций белков). Они находятся в крови и в интерстициальной жидкости; с помощью рецепторов они могут также проходить в плаценту и вследствие этого переноситься от матери к плоду. IgA обнаруживаются преимущественно в кишечном тракте и секретах. IgE присутствуют в плазме здорового человека лишь в незначительных, концентрациях. Повышение уровня IgE наблюдается при аллергических реакциях и паразитарных инфекциях * . Количества в плазме IgD , функция которого еще не выяснена, также весьма малы.
* IgE является атоническим (кожно-сенсибилизирующим) иммуноглобулином (реагином, см. рис. 271) — Прим. перев.
Антитела класса IgG к Borrelia burgdorferi (sensu lato), исследование методом Вестерн-блот (anti-Borrelia IgG, Western blot)
Бактерии, относящиеся к совокупности видов Borrelia burgdorferi sensu lato, являются возбудителями болезни Лайма (бореллиоза) у человека. Это заболевание относится к числу наиболее распространенных в России природно-очаговых инфекций с трансмиссивным путем передачи. Сегодня во всем мире известно более десяти видов Borrelia burgdorferi sensu lato, в том числе девять, строго связанных с Евразией (B. afzelii, B. garinii, B. japonica, B. lusitaniae, B. spielmanii, B. sinica, B. tanukii, B. turdi и B. valaisiana), три вида ассоциируется только с США (B. andersonii, B. californiensis и B. carolinensis).
Возбудитель Borrelia burgdorferi попадает в организм человека с укусом инфицированного клеща. Инкубационный период заболевания после инфицирования составляет 1-2 недели. В течение болезни Лайма выделяют стадии ранней (локальной и диссеминированной) и поздней инфекции. В месте проникновения возбудителя появляется мигрирующая эритема (порой это единственное проявление ранней стадии), которая держится около месяца. К сожалению, у 20-45% больных возможна безэритемная форма заболевания. Далее у 10-15% пациентов при диссеминации развиваются признаки поражения нервной системы (менингит, менингополирадикулоневрит, периферический паралич лицевого нерва) и/или сердечно-сосудистой системы, опорно-двигательного аппарата (у 60% пациентов). Поздняя стадия формируется на протяжении первых двух лет от начала заболевания, клинически характеризуется общей слабостью, поражением суставов и нервной системы. Патогномоничным поражением кожи является хронический атрофический акродерматит.
Клинические и лабораторные особенности, выявленные у больных с признаками персистенции боррелиозной инфекции (например, обнаружение ревматоидного фактора в крови), свидетельствуют о возможности аутоиммунных процессов, развивающихся в результате молекулярной мимикрии между эпитопами антигенов боррелии и тканями хозяина и обусловливающих варианты болезни Лайма, резистентные к лечению антибиотиками.
Диагностика болезни Лайма основывается на серологических (ИФА, иммуноблот) и молекулярно-генетических (ПЦР) методах анализа. Совершенствование серологического метода для диагностики боррелиоза позволило в последнее время в большинстве стран мира перейти от принципа трехшагового лабораторного подтверждения диагноза на двухшаговый – ИФА, иммуноблоттинг.
Отрицательный результат серологических тестов на ранних стадиях инфекции не является подтверждением ее отсутствия и требует перепроверки в динамике через 2-4 недели. Обнаружение антител класса IgM и дальнейшее появление IgG-антител является диагностическим критерием течения боррелиоза. На диссеминированной и хронической стадиях специфические антитела к возбудителю класса IgG присутствуют практически всегда. Антитела класса IgG циркулируют в крови длительный срок (от нескольких месяцев до нескольких лет) даже после успешной антимикробной терапии и излечения болезни. Поэтому по присутствию и титру антител об успехе лечения судить нельзя. Иммунитет к Borrelia burgdorferi носит нестерильный характер. У переболевших людей возможно повторное заражение через несколько лет. Выявление антител к Borrelia burgdorferi не всегда сопровождается клиническими признаками болезни Лайма. Поэтому, согласно принципу двухшагового лабораторного подтверждения данного диагноза, положительные результаты, полученные методом ИФА, обязательно должны подтверждаться другим методом.
Для исключения ложноположительных результатов ИФА, подтверждения диагноза, дифференцированной диагностики, мониторинга заболевания рекомендуется использовать метод иммуноблота, который позволяет раздельно определять IgM и IgG к отдельным белкам боррелии. Для быстрой интерпретации дифференциально-диагностическое значение имеет выявление IgM: OspC и IgG: VlsE (Variable major protein-like sequence, Expressed). Для референс-исследований наряду с этими белками имеет значение определение и других специфических антигенов.
Состав используемых для выявления антител к Borrelia специфических антигенов
Источником антигенов для тестов Anti-Borrelia EUROLINE-WB является специально подобранный штамм Borrelia afzelii. Тестовый набор содержит тестовые стрипы с электрофоретически разделенными экстрактами, содержащими антигены Borrelia afzelii и мембранный чип с рекомбинантным антигеном VlsE (экспрессированная основная вариабельная белковоподобная последовательность).
Мембранные иммуноглобулины. Поверхностные антитела

Местный иммунитет (барьерная защита от инфекций)
Первой линией обороны против инфекционных агентов служат кожа и слизистые оболочки, которые препятствуют проникновению микробов в ткани и выделяют вещества, оказывающие бактерицидное действие.
Важным фактором является механическая защита. Так бактерии, попавшие на кожу, удаляются при слущивании эпидермиса (образование перхоти, шелушение при некоторых инфекционных заболеваниях). Слизь, выделяемая стенками многих внутренних органов, действует как защитный барьер, препятствующий прикреплению бактерий к эпителиальным клеткам. Микробы и чужеродные частицы, захваченные слизью, удаляются механическим путем – за счет движения ресничек эпителия, с кашлем и чиханьем. К другим механическим факторам, защищающим поверхности эпителия, можно отнести вымывающее действие слез, слюны и мочи.
Механическая защита дополняется секреторной (выделительной) деятельностью кожных желез: потовых и сальных. Молочная кислота пота и ненасыщенные жирные кислоты сальных желез обладают противомикробным действием. Во многих жидкостях, производимых организмом (секретах организма), также содержатся бактерицидные компоненты:
- лизоцим в слезах, носовых выделениях и слюне,
- кислота в желудочном соке,
- продукты расщепления жирных кислот в тонкой кишке,
- спермин и цинк в сперме,
- лактопероксидаза в молоке.
Специфическую функцию защиты во внешних секретах организма выполняет секреторный иммуноглобулин А (IgA). Он содержится в секретах и на слизистых оболочках слюнных желез, носа, рта, бронхов, влагалища, кишечника, мочеточников, мочевого пузыря. Секреторный иммуноглобулин А блокирует накопление и размножение на слизистой оболочке бактерий путем блокады поверхностных антигенов бактерий, с помощью которых они прикрепляются к слизистой оболочки органов.
Барьерная защита – это своеобразный «скафандр», к сожалению, проницаемый для многих патогенных агентов.
Неспецифическая иммунная защита (защита на все возбудители)
Любой повреждающий агент-фактор, который по силе и длительности превосходит барьерные возможности ткани, вызывает ответную защитную реакцию организма – воспаление. Воспалительная реакция представлена единством трех явлений:
- повреждение и распознавание возбудителей;
- сосудистая реакция – нарушение микроциркуляции крови;
- клеточная реакция – миграция клеток иммунной системы в очаг воспаления.
Основная задача воспалительной реакции – уничтожение возбудителя и/или освобождение от собственных разрушенных клеток.
Можно выделить два типа уничтожения возбудителей:
- Внеклеточное разрушение возбудителя гуморальными факторами защиты (активными белками сыворотки крови).
- Внутриклеточная нейтрализация (фагоцитоз) (поглощение инфицированных клеток нейтрофилами и макрофагами с дальнейшим ферментативным разрушением структуры).
Внутриклеточное уничтожение микробных клеток происходит в внутри фагоцитов. Процесс поглощения возбудителя с дальнейшим ферментативным разрушением его структуры называют фагоцитозом. Этот процесс осуществляют два вида фагоцитов: нейтрофилы и макрофаги. Фагоцитоз является довольно надежным механизмом защиты организма от инфекционных агентов, но «включение» этой системы возможно только при условии сближения фагоцита и микроорганизма, сцепления микроорганизма с поверхностью фагоцита и активации мембраны фагоцита, которая приводит к поглощению микроорганизма. Микробные клетки обычно погибают в фагоцитах в течение нескольких минут.
Внеклеточные механизмы защиты реализуются несколькими путями:
- Система белков комплемента является важнейшим фактором защиты среди циркулирующих белков крови. Этот комплекс в процессе ряда каскадных реакций приобретает способность «продырявливать» клеточную мембрану бактерий и тем самым убивать чужеродные клетки.
- Другие белки сыворотки крови – лизины, убивающие в основном гаммаположительные бактерии, также относятся к гуморальным факторам защиты. Однако активны лизины только в присутствии достаточного количества ионов кальция.
- Естественные антитела всегда имеются в сыворотке крови независимо от проникновения в организм чужеродных микробов. Эти антитела, реагируя с различными микроорганизмами, вызывают нейтрализацию их токсинов.
- Интерфероны производятся лейкоцитами и макрофагами в ответ на воздействие вирусов (а также некоторых простейших, бактерий и риккетсий). Интерфероны – антивирусные агенты широкого спектра действия. Синтезируемый интерферон выделяется в межклеточное пространство, где связывается с рецепторами соседних клеток. Это стимулирует синтез белков, которые блокируют размножение вирусов.
- Внеклеточное разрушение возбудителя может происходить под действием более 60 активных белков, входящих в гранулы лейкоцитов. Активные белки в процессе дегрануляции высвобождаются во внешние ткани из гранул лейкоцитов. Эффект дегрануляции наиболее интенсивно развивается при реакции на крупные чужеродные объекты (гельминты, простейшие), когда фагоцит не способен поглотить этот объект.
Клеточные и гуморальные факторы активно дополняют друг друга.
Специфическая иммунная защита (иммунный ответ на конкретный возбудитель)
За реакциями воспаления, если они не смогли нейтрализовать возбудителей, развивается более специализированная линия обороны – иммунный ответ, который последовательно запускает многоуровневую иммунную реакцию на возбудителя. Развитие специфических иммунных реакций требует взаимодействия практически всех видов клеток иммунной системы.
На первом этапе иммунного ответа захваченный в процессе фагоцитоза возбудитель перерабатывается макрофагом и в иммуногенной форме выводится его антиген на поверхность (презентация антигена). Особая роль в дальнейшем принадлежит активации Т-хелперов, которая происходит при распознавании Т-хелпером соответствующего антигенного комплекса на поверхности макрофага (антигенпрезентирующей клетки). В результате данного контакта Т-хелперы начинают делиться и после нескольких делений разделяются на две популяции. Одна активизирует развитие гуморального иммунного ответа (выработку иммуноглобулинов и антител), а другая популяция является необходимым компонентом в активации клеточного иммунитета (цитотоксические Т-лимфоциты).
В дальнейшем цитотоксические Т-лимфоциты постоянно циркулируют по всему организму, чему способствует срок их жизни (месяцы и годы). Благодаря постоянной циркуляции лимфоциты удивительно быстро появляются в «горячих точках», осуществляя разрушение клеток, инфицированных вирусами.
Гуморальный иммунный ответ обеспечивается иммуноглобулинами или антителами, производимыми В-лимфоцитами. Продвигаясь по кровяному или лимфатическому руслу, антитела поражают чужеродные вещества на любой дистанции от лимфоцита. За счет гуморального иммунного ответа происходит уничтожение самих возбудителей и нейтрализация их токсинов, находящихся в межклеточном пространстве и на слизистых. Специфическая нейтрализация осуществляется за счет присоединения антител к антигенам с образованием растворимых и нерастворимых циркулирующих комплексов (ЦИК), которые активируют защитную систему белков комплемента, повышают фагоцитарную активность макрофагов и нейтрофилов, усиливают специфическое цитотоксическое действие Т-лимфоцитов (то есть повышается активность естественных киллеров).
Установлен ряд закономерностей динамики накопления антител после первого и повторного внедрения антигена. Первый пик концентрации антител появляется через несколько дней (скрытый период иммунного ответа) и обусловлен усиленным синтезом главным образом иммуноглобулина М (IgM). После второго внедрения того же антигена амплитуда ответа больше, он продолжается дольше и обусловлен возрастанием преимущественно синтеза иммуноглобулина G (IgG). Формирование стойкого иммунитета к возбудителям связано с образованием антител иммуноглобулина класса G.
Читайте также:
