Метаболизм плода. Потребление железа плодом
Добавил пользователь Евгений Кузнецов Обновлено: 13.01.2026
Показано, что профилактика анемии у женщин группы риска препаратом Ферро-Фольгамма способствует снижению частоты развития заболеваний, ассоциированных с дефицитом железа. На фоне отсутствия железодефицитной анемии уменьшается и исчезает гемическая и циркуляторная гипоксия, что предупреждает развитие вторичных метаболических расстройств и ведет к снижению частоты таких осложнений, как гестоз, фетоплацентарная недостаточность, преждевременные роды, а также аномалии родовой деятельности.
Ключевые слова: дефицит железа, беременные, Ферро-Фольгамма.
Correction of iron deficiency in pregnancy
P.V.Budanov, Z.M.Musaev
Department of obstetrics, gynecology and perinatology of the medical faculty of I.M.Sechenov First Moscow State Medical
University, Moscow
Possibility prevention of anemia in women from the risk group using Ferro-Folgamma with decreasing of probability of diseases associated with iron deficiency is shown. Absence of anemia promote decrease of hypoxia, prevent secondary metabolic disturbances and lead to decreasing frequency of gestosis, fetoplacental insufficiency, preliminary labor as well as birth activity.
Key words: iron deficiency, pregnancy, Ferro-Folgamma.
В настоящее время железодефицитная анемия остается социальным заболеванием с широкой распространенностью. Железодефицитная анемия беременных - состояние, обусловленное снижением содержания железа в сыворотке крови, костном мозге и депо в связи с большими его затратами на создание фетоплацентарного комплекса и перераспределением в пользу плода. Следствием дефицита железа является нарушение образования гемоглобина с развитием гипохромной анемии и трофических расстройств в тканях.
Железодефицитная анемия остается серьезной экстрагенитальной патологией в акушерстве, поскольку частота этого заболевания не снижается. Частота анемии беременных колеблется от 15 до 80%. Во время беременности у 98% женщин анемия носит железодефицитный характер.
У беременных увеличивается объем циркулирующей крови, повышается потребность в кислороде, поэтому дефицит железа осложняет течение беременности и родов, негативно влияет на развитие плода (таблица).
К факторам риска развития железодефицитной анемии у беременных относят:
• наличие анемии или хронических заболеваний до беременности;
• многоплодие;
• имеющиеся хронические инфекционные болезни или хронические заболевания внутренних органов;
• наличие раннего токсикоза;
• уровнень гемоглобина в I триместре меньше 120 г/л;
• длительность менструаций более 5 дней на протяжении нескольких лет до беременности.
Женщина потребляет ежесуточно с пищей 10-20 мгжелеза, из них усваивается не более 2 мг. До 75% здоровых женщин теряют за время менструации 20-30 мг железа. Такое количество железа не может быть усвоено даже при большом содержании его в пище. Возникает дисбаланс, ведущий к развитию анемии.
Транспорт плазменного железа и его эффективность неразрывно связаны с функцией депонирования железа в виде ферритина и гемосидерина. Основная часть железа (65%) находится в гемоглобине, меньше в миоглобине (3,5%), небольшое, но функционально важное количество в тканевых ферментах (0,5%), плазме (0,1%), остальное в депо (печень, селезенка и др.) - 31%. Всего в организме человека имеется 4 г железа. У беременных с хроническим гепатитом, гепатозом, при тяжелых токсикозах беременных возникает нарушение депонирования в печени железа, а также недостаточность синтеза белков, транспортирующих его - трансферрина и ферритина.
Потери железа при беременности, во время родов и при кормлении грудью составляют около 1 г, и чтобы пополнить запасы железа только из пищевых источников организму потребуется около 4 лет. Поэтому, если женщина повторно рожает ребенка в этот срок, то у нее неизбежно развивается дефицит железа.
Современные клинические рекомендации предполагают необходимость приема препаратов железа всем беременным во 2 и 3 триместрах гестации. Суточная доза в 18 мг железа для взрослых небеременных женщин в самых редких случаях покрывается только за счет питания, поэтому почти у половины всех женщин к началу беременности резервы железа очень малы. Согласно современным данным, дефицит железа в конце гестационного процесса развивается у всех без исключения беременных либо в скрытой, либо в явной форме. Это связано с тем, что беременность сопровождается дополнительной потерей железа: 320-500 мг железа расходуется на прирост гемоглобина и возросший клеточный метаболизм, 100 мг на построение плаценты, 50 мг на увеличение размеров матки, 400-500 мг на потребности плода (см. таблицу). В результате, с учетом запасного фонда, плод обеспечивается железом в достаточном количестве, но при этом у беременных нередко развиваются железодефицитные состояния различной степени тяжести.
Увеличение количества железа во время беременности
Распределение железа
Количество железа, мг
Увеличение размеров матки
Рост и функционирование плаценты
Активизация клеточного метаболизма и прирост гемоглобина
Биологическая значимость железа определяется его участием в тканевом дыхании. При дефиците железа у беременных возникает прогрессирующая гемиче-ская гипоксия с последующим развитием вторичных метаболических расстройств. Поскольку при беременности потребление кислорода увеличивается на 15-33%, это усугубляет развитие гипоксии. У беременных с тяжелой степенью железодефицитной анемии развивается не только тканевая и гемическая гипоксия, но и циркуляторная, обусловленная развитием дистрофических изменений в миокарде, нарушением его сократительной способности, развитием гипокинетического типа кровообращения.
При дефиците железа беременные женщины более восприимчивы к инфекционным заболеваниям, так как железо принимает участие в росте нервных клеток, синтезе коллагена, метаболизме порфирина, терминальном окислении и окислительном фосфорили-ровании в клетках. Наличие тканевой и гемической гипоксии приводит к снижению иммунитета, общей и противоинфекционной резистентности организма.
Пренатальный дефицит железа и недостаточное депонирование его в антенатальном периоде способствуют развитию железодефицитной анемии у новорожденных детей, приводя к изменению метаболизма клеточных структур, нарушению гемоглобинооб-разования, задержке умственного и моторного развития, появлению хронической гипоксии плода, а также к нарушениям в иммунном статусе новорожденных детей, проявляющимся снижением уровня иммуноглобулинов основных классов и комплемента, абсолютного и относительного числа Т и В лимфоцитов.
Среди факторов риска развития железодефицит-ной анемии в первую очередь выделяется беременность. Риск железодефицита и анемии резко возрастает в поздние сроки гестации, а в третьем триместре дефицит железа имеет место у всех без исключения беременных. Другие причины железодефицитной анемии связаны с нарушениями обмена железа: хронические кровопотери различной локализации; алиментарный фактор (недостаточное потребление железа); повышенная потребность в железе (беременность, лактация, интенсивный рост в пубертатный период); гастрогенные причины; энтерогенный фактор (нарушения процессов полостного и пристеночного пищеварения, ограничение процесса всасывания железа); нарушение транспорта железа в связи с дефицитом трансферрина в случае первичной патологии печени; изменения процесса депонирования железа при тяжелых острых и хронических заболеваниях печени; нарушения процесса реутилизации железа при кровопотере в замкнутые пространства или интенсивной аккумуляции железа зоной воспаления.
При легком течении болезни объективными признаками малокровия служат только лабораторные показатели. Клиническая симптоматика появляется обычно при средней степени тяжести анемии. Она обусловлена неполным кислородным обеспечением тканей и проявляется в виде общей слабости, головокружения, головной боли, сердцебиения, одышки, обмороков, снижения работоспособности, бессонницы.
Основными клиническими проявлениями дефицита железа являются:
• слабость, повышенная утомляемость, невнимательность, беспокойство, забывчивость, раздражительность;
• утренние головные боли, обмороки, головокружения;
• повышенная восприимчивость к инфекциям;
• бледность и сухость кожи, слизистых оболочек;
• трещины в углах рта, стоматит;
• ломкость ногтей и волос;
• одышка (как при физических нагрузках, так и в покое);
• нарушение пищеварения, плохой аппетит, метеоризм, понос, запор, трудности глотания;
• извращение вкуса и обоняния.
Чаще всего для исследования обмена железа в акушерской практике применяется определение ряда показателей периферической крови: гемоглобина, эритроцитов, цветного показателя, гематокрита. Основными критериями железодефицитной анемии, отличающими ее от других патогенетических вариантов анемий, являются: низкий цветовой показатель, гипохромия эритроцитов, снижение содержания сывороточного железа, повышение общей железосвязывающей способности сыворотки и клинические признаки гипосидероза. О тяжести течения болезни судят по уровню гемоглобина. Легкая степень анемии характеризуется снижением гемоглобина до 110-90 г/л; средняя степень - от 89 до 70 г/л; тяжелая - 69 г/л и ниже.
Для оценки запасов железа в организме используют также определение ферритина сыворотки. У здоровых женщин уровень ферритина сыворотки равен 32-35 мкг/л, при железодефицитной анемии - 12 мкг/л и менее. Однако содержание ферритина сыворотки не всегда отражает запасы железа. Оно зависит также от скорости освобождения феррити-на из тканей и плазмы.
К сожалению, в России большое распространение получили препараты, содержащие большое количество железа в расчете на одну таблетку. Появляющиеся при этом токсические эффекты терапии считались неизбежными, и для их предотвращения рекомендовался прием препаратов во время еды, с целью связать свободные ионы железа, предотвращая тем самым их неблагоприятное воздействие на желудочно-кишечный тракт. Получался своеобразный парадокс: рекомендовались большие дозы железа, одновременно с этим связывание железа белками пищи снижало его поступление во много раз. В результате терапевтический эффект не зависел от высокой дозы железа в препарате.
При выборе препарата, содержащего железо, необходимо учитывать несколько факторов. Поскольку из желудочно-кишечного тракта ионизированное железо всасывается только в двухвалентной форме и большое значение в этом процессе играет аскорбиновая кислота, то очень важно ее наличие в препарате. Существенная роль в гемопоэзе принадлежит фолиевой кислоте, усиливающей нуклеиновый обмен. Для нормального обмена фолиевой кислоты необходим цианокобаламин, который является основным фактором при образовании из нее активной формы. Дефицит этих веществ, часто возникающий при анемиях, связанных с кровопотерями, приводит к нарушению синтеза ДНК в кроветворных клетках, тогда как включение этих компонентов в препарат увеличивает активную абсорбцию железа в кишечнике, его дальнейшую утилизацию, а также освобождает дополнительное количество транс-феррина и ферритина. Все это значительно увеличивает скорость синтеза гемоглобина и повышает эффективность терапии железодефицитных состояний и железодефицитной анемии.
Кроме того, при медленном поступлении железа достигается более высокий уровень его всасывания.
Фолиевая кислота, как и железо, играет важную роль во многих физиологических процессах. Фолие-вая кислота участвует в синтезе ряда аминокислот, играет ключевую роль в процессах деления клетки. Во время беременности, когда происходит интенсивное новообразование клеток, значение фолиевой кислоты резко возрастает. Ее участие в пуриновом обмене определяет значение ее для нормального роста, развития и пролиферации тканей, в частности для процессов кроветворения и эмбриогенеза.
Высокая частота развития анемии во время беременности и установленный многими исследователями дефицит железа у беременных (латентный или явный) приводит к необходимости профилактических мероприятий. С целью профилактики анемии были обследованы 84 беременные с высоким риском развития малокровия. Все женщины были разделены на 2 группы: в первую (основную) группу вошли 54 пациентки, которым, начиная с 12-14 нед, проводилась медикаментозная профилактика развития анемии с помощью препарата Ферро-Фольгамма. Во вторую группу вошли 30 женщин, которым было рекомендовано придерживаться специальной диеты. Средний возраст пациенток составил 27,6±2,8 лет.
Диагностическими критериями диагноза железо-дефицитной анемии являлись: снижение Hb ниже 110 г/л, цветового показателя - ниже 0,85, среднего объема эритроцитов (MCV) - ниже 72 фл., содержания гемоглобина в эритроците (MCH) - ниже 25 пг, содержания сывороточного железа - ниже 12,5 мкмоль/л, сывороточного ферритина - ниже 12 нг/мл и повышение общей железосвязывающей способности сыворотки - выше 50,2 ммоль/л.
Больные основной группы принимали препарат Ферро-Фольгамма, доза которого рассчитывалась в зависимости от содержания запасов железа в депо (уровень сывороточного ферритина - СФ); 1 нг/мл СФ=8 мг. Нормальное содержание ферритина у здоровых женщин 32-60 нг/мл, что соответствует 356-480 мг железа в депо. Беременные с уровнем ферритина сыворотки крови ниже 20 нг/мл принимали по 1 таблетке препарата Ферро-Фольгамма 2 раза в сутки до еды в течение беременности, в эту группу вошла 21 (38,9%) женщина. Остальные пациентки с уровнем ферритина выше 20 нг/мл принимали по 1 таблетке препарата Ферро-Фольгамма в день за 30 мин до еды.
Всем женщинам основной группы проводилось исследование материнского и плодового кровотока в 20, 28, 32 и 38 нед беременности, в группе контроля эти исследования проводились перед родами.
Нами отмечено отсутствие развития анемии у 94,4% женщин основной группы на протяжении беременности и послеродового периода. Среди 21 женщины, имевших низкий исходный уровень сывороточного ферритина у 90,5% отмечена его нормализация и отсутствие развития железодефицитной анемии на протяжении гестации. При этом уровень сывороточного ферритина у 28,6% нормализовался на 6-8 нед лечения, а у остальных он возрос в среднем в 1,4 раза.
Высокие темпы прироста ферритина при лечении препаратом Ферро-Фольгамма могут быть обусловлены достаточным содержанием двухвалентного железа в препарате и его высокой биодоступностью, а также высоким содержанием в нем аскорбиновой кислоты, улучшающей всасывание двухвалентного железа.
Хороший клинический эффект препарата подтвержден данными клинических исследований. Так, для лечения анемии беременных использование препарата Ферро-Фольгамма по 1 капсуле 2 раза в день в течение 6 нед привело к нормализации клинических и лабораторных показателей у всех пациенток.
Применение препарата Ферро-Фольгамма у беременных с анемией и при сочетании с гестозом приводит к улучшению клинического состояния, достоверному повышению гематологических (гемоглобина на 15%, эритроцитов на 10%, гематокрита на 9%) и феррокинетических показателей (сывороточного железа на 32%, ферритина на 53%), уровня фолие-вой кислоты (на 24%) и витамина В12 (на 21,7%).
В связи с наличием дополнительных факторов риска все пациентки основной группы принимали препарат Ферро-Фольгамма на протяжении не менее 6 нед. Как известно, всасывание железа зависит от нескольких факторов, среди которых имеют значение степень дефицита железа, содержание в препарате двухвалентного железа, наличие в препарате различных веществ, усиливающих всасывание, функциональная активность кишечника. Если в норме (при отсутствии дефицита железа) всасывается не более 5-7% двухвалентного железа, то при латентном дефиците железа всасывание увеличивается до 15-17%, а при развитии ЖДА достигает 25-30%.
Анализ течения беременности показал, что частота гестоза у женщин, которые не получали препарат Ферро-Фольгамма, составила 33,3%, фетоплацен-тарная недостаточность отмечена в 36,7%. При этом у 30% женщин отмечены нарушения гемодинамики в системе мать-плацента-плод первой и у 6,7% -второй степени. Частота выявления синдрома задержки роста плода составила 10%.
В основной группе гестоз отмечен у 7,4% женщин, с такой же частотой зафиксировано развитие фето-плацентарной недостаточности (гемодинамические нарушения в системе мать-плацента-плод у 3,7% и синдром задержки роста плода у 3,7%).
Частота преждевременных родов в группе беременных, получавших с профилактической целью препарат Ферро-Фольгамма, составила 5,5%, преждевременное излитие околоплодных вод наблюдалось в 11,1%, аномалии родовой деятельности - в 12,9%. Частота оперативного родоразрешения путем кесарева сечения составила 7,4%, причем среди показаний преобладали: недоношенная беременность и тазовое предлежание плода.
У женщин группы риска развития анемии, не получавших профилактического лечения, частота преждевременных родов достигала 26,7%, несвоевременного излития вод - 36,7%, аномалий родовой деятельности - 23,3%.
Путем операции кесарева сечения родоразреше-ны 26,7% женщин. Показаниями к родоразрешению путем кесарева сечения в этой группе явились недоношенная беременность, гестоз, фетоплацентарная недостаточность, отсутствие эффекта от консервативного лечения, слабости родовой деятельности.
Полученные результаты показали, что профилактика анемии у женщин группы риска препаратом Ферро-Фольгамма способствует снижению частоты развития заболеваний, ассоциированных с дефицитом железа. На фоне отсутствия железодефицитной анемии уменьшается и исчезает гемическая и цирку-ляторная гипоксия, что предупреждает развитие вторичных метаболических расстройств и ведет к снижению частоты таких осложнений, как гестоз, фетоплацентарная недостаточность, преждевременные роды, а также аномалии родовой деятельности.
Удобный режим дозирования, отсутствие тяжелых побочных эффектов, обусловленное действием му-копротеазы, замедляющей всасывание ионов железа и защищающей слизистую оболочку пищеварительного тракта, указывает на хорошую переносимость Ферро-Фольгаммы.
Таким образом, при применении препарата Фер-ро-Фольгамма обеспечивается хорошая эффективность профилактики и лечения железодефицитной анемии за счет высокого содержания сульфата железа, цианокобаламина, фолиевой и аскорбиновой кислот, действующих синергично.
Метаболизм плода. Потребление железа плодом
а) Метаболизм плода. В качестве источника энергии плод использует в основном глюкозу и обладает высокой способностью запасать жиры и белки, главным образом жиры, которые он синтезирует из глюкозы даже в большей степени, чем получает готовыми из крови матери. Кроме того, в метаболизме плода можно подчеркнуть особенности, связанные с обменом кальция, фосфатов, железа и некоторых витаминов.
б) Метаболизм кальция и фосфатов. На рисунке ниже показана скорость запасания кальция и фосфатов плодом.
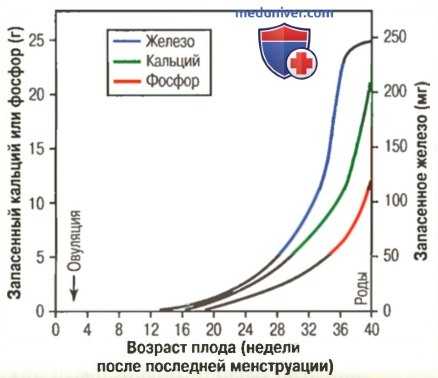
Запас железа, кальция и фосфора у плода на различных сроках гестации
Так, количество аккумулированного на протяжении всего периода гестации кальция составляет 22,5 г, а количество фосфора приближается к 13,5 г. Почти половину этого количества плод усваивает в последние 4 нед внутриутробного периода, что соотносится с периодом быстрой оссификации костей плода и быстрого прибавления веса.
На протяжении раннего периода внутриутробной жизни кости еще не начинают оссифицироваться и состоят в основном из похожего на хрящ матрикса. На рентгенограммах плода во время внутриутробного периода жизни некоторые признаки оссификации костей плода можно обнаружить только на 4 мес беременности.
Отметим, что общее количество кальция и фосфатов, необходимое плоду в течение всего периода гестации, составляет только около 2% веществ, присутствующих в костях материнского организма. Гораздо больше эти вещества извлекаются из организма матери после родов при лактации.
в) Потребление железа. На рисунке выше показано, что скорость потребления железа плодом оказывается даже выше, чем скорость потребления кальция и фосфатов. Большая часть железа уходит на образование гемоглобина, который начинает образовываться уже на 3 нед после оплодотворения яйцеклетки.
Небольшое количество железа накапливается эндометрием матки еще до имплантации бластоцисты; это железо захватывается клетками трофобласта и доставляется эмбриону, который использует его для образования рано формирующихся клеток крови. Около 1/3 железа, присутствующего в организме вполне сформировавшегося плода, запасается в печени. Это железо может быть использовано в течение нескольких месяцев после рождения для образования дополнительного количества гемоглобина.
г) Использование и хранение витаминов. Плод так же, как взрослый человек, нуждается в витаминах, иногда даже в большей степени. Роль витаминов в жизни плода — та же, что и в жизни взрослых людей (обсуждается в отдельной статье на сайте, просим вас пользоваться формой поиска выше). Тем не менее, следует упомянуть о важности некоторых витаминов в метаболизме плода.
Витамины группы В, особенно витамин B12 и фолиевая кислота, необходимы для образования красных клеток крови и формирования нервной ткани.
Витамин С необходим для правильного формирования внутриклеточных структур, особенно при образовании костей и волокон соединительной ткани.
Витамин D необходим для нормального роста костей плода и, что еще важнее, — для абсорбции достаточного количества кальция в желудочно-кишечном тракте матери. Если в организме матери содержится большое количество витамина D, часть его может запасаться в печени плода и использоваться им в течение нескольких месяцев после рождения.
Витамин Е, хотя его функция и не вполне понятна, необходим для нормального развития эмбриона на ранних сроках гестации. При его от сутствии у лабораторных животных возникали самопроизвольные выкидыши на ранних сроках беременности.
Витамин К используется печенью плода для синтеза таких факторов свертывания, как фактор VII, протромбин и др. Если витамин К не содержится в организме матери в нужном количестве, возникает дефицит фактора VII и протромбина в крови как матери, так и плода. Вследствие того, что большая часть витамина К образуется микрофлорой толстого кишечника матери, у новорожденного отсутствует источник витамина К в течение первых недель жизни после рождения и до тех пор, пока толстый кишечник ребенка не будет заселен нормальной микрофлорой, которая сможет продуцировать достаточное количество витамина К.
В связи с этим небольшие запасы витамина К, которые будут созданы в печени плода из содержащегося в материнской крови источника, смогут предупреждать у ребенка возникновение геморрагии, особенно геморрагии мозга, когда головка плода травмируется, проходя через родовые пути.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Развитие органов плода. Этапы развития органов эмбриона
На протяжении первого месяца после оплодотворения яицеклеткн почти все органы плода только начинают закладываться, и лишь в последующие 2-3 мес можно обнаружить основные признаки различных органов. После 4 мес гестации основные органы плода по преимуществу уже не отличаются от органов новорожденного, однако развитие клеток органов еще не завершилось, и требуется еще около 5 мес гестации для их полного развития. Даже после рождения отдельные органы, особенно нервная система, почки и печень не сформированы, что более подробно будет рассмотрено в данной главе.
а) Система кровообращение. Сердце человека начинает биться приблизительно на 4 нед после оплодотворения яйцеклетки, частота сокращении в это время составляет приблизительно 65 уд/мин. Частота сердцебиений возрастает приблизительно до 140 уд/мин непосредственно к моменту рождения.
б) Формирование клеток крови. Содержащие ядра красные клетки крови начина ют образовываться в фабрицневои сумке и мезотелиалыюм слое плаценты приблизительно на 3 нед внутриутробного разит ни. Неделей позже (на 4-5 нед) мезенхима плода и эндотелии ею кровеносных сосудов образуют безъядерные красные клетки крови. Затем на 6 нед образование красных клеток крови перемещается в печень, а на 3 мес гестацни селезенка и другие лимфоидные ткани начинают формировать белые клетки крови. По прошествии 3 мес гестации костный мозг постепенно становится главным источником красных клеток крови и большинства белых клеток, кроме лимфоцитов и плазматических клеток, продолжающих образовываться лимфоидной тканью.
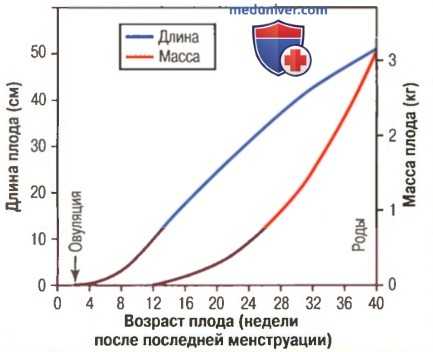
Рост плода
в) Дыхательная система. В течение внутриутробного периода легочное дыхание у плода отсутствует, т.к. амниотическая жидкость не содержит воздуха. Однако попытки дыхательных движений плода наблюдаются в конце первого триместра беременности, тактильные стимулы и асфиксия плода являются особенно мощными стимулами таких попыток дыхательных движений.
В течение последних 3-4 мес беременности дыхательные движения плода по непонятной причине практически отсутствуют, и легкие пребывают почти в полностью спавшемся состоянии. Торможение дыхательных движений на протяжении последних месяцев внутриутробной жизни предупреждает заполнение легких околоплодной жидкостью и поступление мекония, выделяемого желудочно-кишечным трактом плода в амниотическую жидкость. Более того, альвеолярный эпителий легких плода продуцирует небольшое количество жидкости, поступающей в легкие, и таким образом к моменту рождения в легких присутствует только эта чистая жидкость.
г) Нервная система. Большинство рефлексов плода обеспечиваются спинным мозгом и даже стволом мозга. Рефлексы представлены между 3 и 4 мес беременности, однако рефлекторные ответы, осуществляемые при участии коры больших полушарий, находятся в зачаточном состоянии даже на момент рождения ребенка. Миелинизация некоторых проводящих путей мозга полностью завершается только к первому году постнатального периода.
д) Желудочно-кишечный тракт. В середине беременности в желудочно-кишечный тракт плода начинает поступать и всасываться большое количество амниотической жидкости и к последним 2-3 мес беременности желудочно-кишечный тракт плода функционально приближается к желудочно-кишечному тракту новорожденного. К этому времени в желудочно-кишечном тракте постоянно образуется небольшое количество мекония, который через анальное отверстие поступает в околоплодную жидкость. Меконий состоит из веществ, содержащихся в амниотической жидкости, проглоченной плодом, частично — из слизи и других остатков, экскретируемых слизистой и железами желудочно-кишечного тракта.
е) Почки. Почки плода начинают экскретировать мочу на протяжении второго триместра беременности. Моча плода состоит на 70-80% из амниотической жидкости. У почек с нарушениями развития экскреторная функция значительно снижена. Они не в состоянии продуцировать амниотическую жидкость, и ее количество значительно снижается (маловодие), что может привести к гибели плода.
Хотя почки плода способны образовывать мочу, управление функциями почек еще недостаточно для регуляции объема внеклеточной жидкости, электролитного баланса и особенно — кислотно-щелочного равновесия. Эти функции почек практически отсутствуют до последнего периода внутриутробной жизни и не достигают полного развития еще на протяжении нескольких месяцев после рождения.
Железодефицитные состояния у беременных: Потребность в железе при беременности. Влияние ЖДС на течение беременности, роды, состояние плода и новорожденного.
Беременность сопровождается дополнительной потерей железа: 320-500 мг железа идёт на прирост гемоглобина и возросший клеточный метаболизм, 100мг - на построение плаценты, 50мг - на увеличение размеров матки, 400-500 мг - на потребности плода. Таким образом, всего за беременность расходуется дополнительно 1200 - 1140 мг железа.
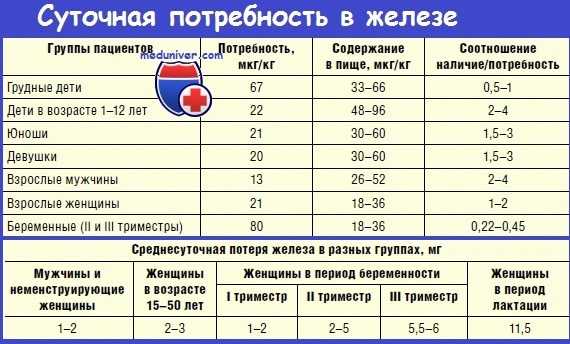
У беременных общая потребность в железе значительно выше, чем вне беременности. В I триместре она снижена. Во II и III триместрах происходит увеличение эритроцитарной массы, рост плода и плаценты, поэтому ежедневная потребность в железе нарастает и к концу беременности составляет около 6 мг/сут. Динамика суточной потребности в железе до, в течение и после процесса гестации представлена на рисунке 1.
РИСУНОК. CУТОЧНАЯ ПОТРЕБНОСТЬ В ЖЕЛЕЗЕ У ЖЕНЩИН ДО, В ТЕЧЕНИЕ И ПОСЛЕ БЕРЕМЕННОСТИ

Для поддержания нормального баланса железа во время беременности необходимо, чтобы, во-первых, запасы железа у женщины до наступления беременности были адекватными; во-вторых, диета беременной должна содержать достаточное количество биодоступного железа для обеспечения высокого уровня кишечной абсорбции во 2-ой половине беременности.
Так, как в развивающихся странах диета беременных не содержит достаточного количества биодоступного железа, дополнительное использование препаратов железа является обязательным во II и III триместрах, даже если исходный уровень запасов железа до зачатия является адекватным. В индустриально развитых странах среднее содержание негемового железа в пище значительно выше. Однако имеются данные, что даже в развитых странах, женщины во время беременности, испытывают недостаток биодоступного железа в пище из-за неправильного характера питания.
Таким образом, даже при достаточных исходных запасах железа в организме женщины, плод обеспечивается биоэлементом в достаточном количестве, но при этом у беременных нередко развиваются ЖДС различной степени тяжести.
III. ВЛИЯНИЕ ЖДС НА ТЕЧЕНИЕ БЕРЕМЕННОСТИ, РОДЫ, СОСТОЯНИЕ ПЛОДА И НОВОРОЖДЕННОГО.
По данным литературы, дефицит железа у беременных не только в манифестных, но и латентных проявлениях неблагоприятно отражается на течении беременности и родов, послеродового периода, состоянии плода и новорожденного. К последствиям, которые может повлечь за собой дефицит железа и крайняя его степень - ЖДА относятся: нарушение белкового обмена, увеличение частоты возникновения у беременных гестоза, пиелонефрита, невынашивания и преждевременных родов, плацентарной недостаточности, отставания роста, развития и внутриутробной гибели плода; инфекционных осложнений и гипогалактии у родильниц; частоты и объема патологической кровопотери в родах и послеродовом периоде, слабости родовой деятельности.
Кроме того, недостаточное депонирование железа в антенатальном периоде, сказывается на течении неонатального периода.
Плод получает железо от матери за счет активного транспорта через плаценту. У новорожденных от матерей с ЖДА уровень сывороточного ферритина, сывороточного железа, коэффициент насыщения трансферрина значительно снижены, что указывает на наличие латентного ДЖ, предшествующего развитию ЖДА. И действительно, у детей, родившихся от женщин с ЖДА при беременности, в возрасте до 1 года анемия развивается у 68%.
Имеются данные о снижении уровня умственного, моторного и речевого развития у детей с ЖДА первых лет жизни. На фоне терапии препаратами железа у таких детей происходит нормализация феррокинетических показателей и наблюдается положительный эффект.
При дефиците железа у детей, вследствие ЖДА у матери при беременности, происходят изменения метаболизма клеточных структур, нарушение гемоглобинообразования.
Наблюдается снижение устойчивости к инфекции, снижение иммунного статуса (снижение уровней иммуноглобулинов, комплемента, абсолютного и относительного числа В- и Т-лимфоцитов.
70% железа Нb у детей в возрасте 2 лет имеет материнское происхождение, в связи с чем, возрастает необходимость нормального обеспечения железом организма женщины во время беременности.
Физиология обмена железа и его эффекты
Назначение железа как доношенным, так и недоношенным детям является одним из наиболее противоречивых вопросов. Дефицит железа широко распространен, он оказывает долгосрочное влияние на развитие нервной системы и поведенческие функции, нарушение которых может быть необратимым процессом. В то же время известно, что избыток железа токсичен.
Граница между терапевтической и токсической дозами железа весьма условна. Вопросы, которые вызывают противоречивые мнения, касаются адекватных лабораторных методов для оценки содержания железа в организме; времени начала дополнительного введения железа и безопасности такого вмешательства у недоношенных детей с учетом возможного побочного действия избыточного количества железа; времени начала дополнительного введения железа детям, находящимся исключительно на грудном вскармливании.
Железо — важнейший нутриент, участвующий в биологических процессах, включающих репликацию ДНК, экспрессию генов, клеточное дыхание (в т.ч. образование АТФ), а также в транспорте и усвоении кислорода. Железо нужно для эритропоэза (образования гемоглобина). Кроме того, оно является неотъемлемым компонентом многих ферментов, необходимых для развития головного мозга и чрезвычайно важных для работы мышц сердца и скелетных мышц (в частности, миоглобина).
Подобно кальцию и многим другим минералам, 80% железа, имеющегося в организме доношенного ребенка, накапливается плодом на сроке гестации между 24 и 40 нед со скоростью 1,6—2 мг/кг/сут. Общее содержание железа к моменту рождения составляет 75 мг/кг независимо от размеров ребенка; 75% железа находится в эритроцитах, 15% — в печени.
Железо может усваиваться организмом как в органической, так и в неорганической форме. Органическая форма в виде ферритина или гемопротеинов отличается высокой биодоступностью и содержится в печени и «красных» мышцах. Для новорожденных детей, диета которых не содержит мяса, эти продукты не могут служить источником железа. Неорганическую форму железа (или двухвалентное железо) часто используют в виде добавки к пище.
Она может быть подвержена хелированию и преципитации при взаимодействии с другими компонентами пищи, что снижает ее биодоступность. В частности, так действуют фитаты, фосфаты, таннаты, оксалаты и карбонаты. Как показали исследования с применением стабильных изотопов железа, количество неорганического железа, которое всасывается у недоношенных детей, составляет 34—42%. Это превышает количество железа (7-12%), поступающего в организм доношенного ребенка.
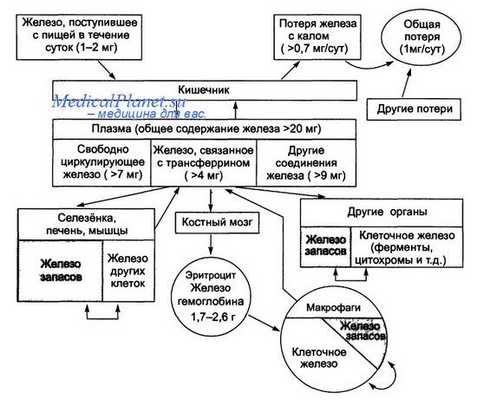
Схема обмена железа в организме взрослого человека
К факторам, усиливающим абсорбцию у недоношенных детей, относят постнатальный возраст, дефицит железа, введение железа (в т.ч. в составе сертифицированных смесей) между приемами пищи, нормальное содержание витамина С в организме. К факторам, уменьшающим абсорбцию железа, относят искусственное вскармливание (такие дети чаще имеют дефицит железа по сравнению с получающими грудное молоко) и гемотрансфузии. Гестационный возраст, постконцептуальный возраст и терапия эритропоэтином оказывают минимальный эффект на усвоение организмом железа.
Всасывание железа у взрослых происходит на апикальной поверхности энтероцитов двенадцатиперстной кишки. Органическое (или гемовое) железо транспортируется в энтероцит через недавно открытый белок-переносчик гема 1. Дальнейший путь железа после проникновения его в энтероцит до конца не изучен, хотя известно, что фермент гемоксигеназа, который высвобождает железо из протопорфиринового кольца, находится в микросомальной части энтероцита.
Гораздо больше известно о всасывании негемового железа. Один из путей заключается в превращении трехвалентного железа в двухвалентное на щеточной кайме энтероцитов при участии фермента дуоденальной редуктазы трехвалентного железа. Затем транспортер бивалентных металлов 1 переносит редуцированную форму железа через апикальную мембрану.
Когда железо попадает в энтероцит, оно может накапливаться в виде ферритина для дальнейшего использования или утрачивается при «слущивании» стареющего энтероцита. Внутриклеточное негемовое железо может быть транспортировано в кровь через базолатеральную мембрану с помощью транспортера негемового железа ферропор-тина, который является важнейшим экспортером внутриклеточного железа. Ферропортин расположен на базолатеральной поверхности энтероцитов, гепатоцитов и макрофагов.
После попадания в кровь железо соединяется с трансферрином и переносится к месту использования или накопления. Предшественники эритроцитов имеют большое количество рецепторов трансферрина 1 (TfR1), что позволяет им иметь преимущества в захвате циркулирующего железа. Стареющие эритроциты поглощаются макрофагами. Макрофаги экспортируют восстановленное железо с помощью ферропортина (того же переносчика, который содержится в дуоденальных энтероцитах). Железо накапливается в печени, которая захватывает его из портальной системы с помощью TfR1.
Суточная потребность организма в железе
Организм человека обладает способностью распределять доступное железо между органами, исходя из приоритетной потребности в нем. При дефиците железа в первую очередь расходуются его запасы в печени, затем — в скелетных мышцах и кишечнике. При выраженном дефиците железа сначала истощаются его запасы в сердечной мышце, затем — в головном мозге и, наконец, в эритроцитах. Железодефицитная анемия является тяжелой формой дефицита железа.
Эритроциты имеют большую потребность в железе даже по сравнению с головным мозгом, несмотря на возможные отрицательные неврологические последствия для ребенка, обусловленные дефицитом железа в мозговой ткани. Железо играет важную роль в процессах пролиферации нейронов, миелинизации, метаболизма энергии, нейротрансмиссии и работе различных ферментов в ЦНС. Существует система приоритетов по распределению и расходованию железа в пределах одного органа, что было показано в экспериментах на головном мозге новорожденных детенышей крысы. Наиболее чувствительными к дефициту железа в перинатальном периоде оказались гиппокамп и зона коры головного мозга.
Эритроциты являются приоритетным местом использования железа в организме, очевидна их исключительная функция в транспортировке кислорода в организме. Кислород обратимо присоединяется к гемоглобину в условиях высокого парциального давления кислорода в легких и высвобождается из этой связи при относительно низком парциальном давлении кислорода в тканях. На аффинность кислорода влияет ряд факторов, в т.ч. концентрация 2,3-дифосфоглицерата и рН.
Для осуществления обратимой связи кислорода с гемоглобином железо гемовой части должно находиться в двухвалентной форме. В эритроцитах существует специальный механизм для поддержания железа в редуцированной двухвалентной форме, однако в условиях действия лекарств, обладающих окислительной активностью, или токсинов, а также при генетических нарушениях в эритроцитах или аномалиях самого гемоглобина данные защитные механизмы не работают и гемоглобин не выполняет свою функцию. Высвобождение кислорода в мышцах частично зависит от концентрации миоглобина в тканях. Так же, как и в случае с гемоглобином, дефицит железа тормозит синтез миоглобина.
Низкое содержание миоглобина в мышцах, подобно низкой концентрации гемоглобина в крови, ухудшает высвобождение кислорода.
Читайте также:
- Паллиативное лечение. Умышленная смерть пациента
- Перкуссия селезенки. Техника перкуссии селезенки
- Сомногенные структуры при эпилепсии. Механизмы генерализованной эпилепсии
- Сочетанные повреждения при травме трахеи и бронхов. Частота
- Лечение при постполицитемическом миелофиброзе с миелоидной метаплазией (МММ) - эффективность
