Метастазы опухолей в плод и матку у беременной - клиника, лечение
Добавил пользователь Алексей Ф. Обновлено: 25.01.2026
Рак эндометрия у беременной - клиника, лечение
Чрезвычайно редко у беременных выявляют рак эндометрия (РЭ). Диагностируют его во время выскабливания при искусственном или самопроизвольном аборте. Морфологический анализ операционного материала помогает выявить лейомиосаркомы (включая миксоидную лейомиосаркому), эндометриальную стромальную саркому и карциносаркому.
При эндометриоидных аденокарциномах рекомендуют проводить обширную гистерэктомию с двусторонней аднексэктомией, при необходимости — адъювантную ЛТ.
В 1972 г. Karlen и соавт. проанализировали опубликованные данные с 1900 г. и обнаружили 6 случаев РЭ у беременных. В 2004 г. Itoh и соавт. обследовали 29 больных, 11 из которых были старше 35 лет. У 21 женщины либо не было вовсе, либо была лишь минимальная инвазия в миометрий.
У 18 женщин опухоль была G1 по классификации FIGO, у 3 — G2. В этой группе была женщина в возрасте 28 лет, получавшая высокие дозы медроксипрогестерона ацетата после выскабливания слизистой оболочки матки и выявления диффузной сложной гиперплазии с атипией и очагами высокодифференцированной аденокарциномы со стромальной инвазией.
Впоследствии у нее наступила беременность, после родов была проведена тотальная абдоминальная гистерэктомия. При гистологическом исследовании выявили высокодифференцированную аденокарциному, не выходящую за пределы эндометрия. Поскольку большинство женщин при инвазивных злокачественных новообразованиях стараются сохранить фертилыюсть, можно ожидать увеличение риска рецидива во время беременности.

Все больные с минимальной инвазией (n = 21) имели благоприятный прогноз и продолжительность жизни от 3 мес. до 10 лет (на момент публикации). Большинство злокачественных новообразований эндометрия у беременных характеризуется высокой дифференцировкой, минимальным или полным отсутствием инвазии в миометрий и благоприятным прогнозом. Такую же морфологическую и клиническую картину обнаруживают при раке эндометрия (РЭ) I типа у полных женщин.
Полагают, что повышение уровня сывороточного прогестерона во время беременности ингибирует рост рака эндометрия (РЭ). Это вызвало предположение о том, что, вероятно, все сообщенные случаи аденокарциномы у беременных на самом деле феномен Ариас-Стеллы (наличие в эндометрии атипических клеток, характеризующихся набуханием, вакуолизацией протоплазмы).
Остальные 8 из 29 больных имели глубокую инвазию в миометрий или прорастание опухолью стенки матки. По степени дифференцировки (FIGO) пациентки распределились следующим образом: G1 — 3, G2 — 2 и G3 — 3, включая 1 случай ссрозно-папиллярного РЭ; по стадиям FIGO — от Iс до IV. Из 8 больных с глубокой инвазией в миометрий и отрицательной экспрессией ЭР и ПР 2 женщины умерли.
Неэндометриоидные аденокарциномы и высокодифференцированные опухоли эндометрия часто отрицательны по экспрессии ЭР и ПР. Такие опухоли имеют плохой прогноз и сходны с РЭ II типа, наблюдаемого у больных, не страдающих ожирением. Таким образом, РЭ не всегда имеет благоприятный прогноз у беременных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Рак шейки матки при беременности
Рак шейки матки при беременности — это злокачественное новообразование, которое происходит из трансформационной зоны, экзоцервикса, эндоцервикса и выявляется в период беременности. Более чем в двух третях случаев протекает бессимптомно. При манифестном течении проявляется контактной кровоточивостью, спонтанными влагалищными кровотечениями, лейкореей, болью внизу живота, нарушением функции тазовых органов. Диагностируется на основании данных гинекологического осмотра, ПЦР, цитологического анализа, кольпоскопии, гистологии биоптата. Для лечения используют органосохраняющие и радикальные хирургические вмешательства, лучевую и химиотерапию.
МКБ-10
Общие сведения
Рак шейки матки (РШМ) — самая распространенная онкопатология, выявляемая у беременных. 1-3% расстройства диагностируется именно в гестационном периоде. В зависимости от региона распространенность заболевания составляет от 1,2 до 10 случаев на 10 000 беременностей. Гестация наступает у 3,1% пациенток с ранее установленным диагнозом РШМ. Болезнь чаще выявляют у сексуально активных курящих женщин, которые начли интимную жизнь до 16 лет, имеют более 2-3 половых партнеров в год, инфицированы вирусом папилломатоза человека (ВПЧ, HPV), а зачастую и другими генитальными инфекциями (хламидиозом, трихомонозом, сифилисом, гонореей, уреаплазмозом).
Причины
В подавляющем большинстве случаев злокачественное перерождение слизистой экзо- и эндоцервикса начинается задолго до гестации. Неоплазия ассоциирована с вирусами папилломатоза человека, передаваемыми при половых контактах. ДНК-содержащие папилломатозные вирусы определяются у 95% пациенток с подтвержденным диагнозом рака шейки матки. В 65-75% случаев провоцирующим фактором считаются вирусные агенты 16 и 18 серотипов, реже — HPV 31, 33, 35, других типов высокого и среднего риска. Инфицированность ВПЧ в женской популяции составляет 5-20%. У большинства пациенток вирус длительно персистирует без каких-либо клинических проявлений.
Факторы, способствующие повышению его патогенности и началу онкопроцесса, пока не выявлены. Несмотря на теоретическую возможность ускорения канцерогенеза на фоне физиологического снижения иммунитета при беременности, убедительные данные о негативном влиянии гестации на течение злокачественного процесса в шейке матке на сегодняшний день отсутствуют. Более того, по наблюдениям специалистов в сфере онкогинекологии, у двух третей беременных отмечается регресс предраковых состояний.
Обнаружению РШМ в период гестации благоприятствует ряд обстоятельств. Во-первых, многие пациентки из группы риска вне беременности крайне редко посещают медицинские учреждения с профилактической целью. Постановка на учет в женской консультации с целью получения медицинской помощи и социальных выплат предполагает регулярное наблюдение специалиста и выполнение скрининговых обследований, в ходе которых может быть обнаружен рак. Во-вторых, к 20-й неделе гестационного срока у большинства беременных происходит смещение кнаружи зоны трансформации и стыка цилиндрического шеечного эпителия с плоским влагалищным. В результате участок слизистой шейки, чаще всего поражаемый раком, становится хорошо заметным и доступным для проведения цитологического скрининга, кольпоскопии и других исследований.
Патогенез
Хотя вероятность заражения папилломавирусной инфекцией достигает 75%, у 90% женщин иммунная система быстро элиминирует возбудителя. В 10% случаев вирусные частицы персистируют в базальных эпителиальных клетках и могут регрессировать. Лишь у некоторых пациенток под влиянием неустановленных факторов ВПЧ начинает прогрессировать. ДНК вирусов встраивается в геном клеток эпителия шейки, что приводит к нарушению механизмов апоптоза и злокачественной морфологической трансформации — от легкой и умеренной дисплазии до выраженных диспластических изменений и карциномы in situ. Вирусные гены Е5 и Е6 оказывают блокирующий эффект на антионкогены p53 Rb нормальных клеточных элементов шейки матки.
Из-за инактивации опухолевого супрессора запускается бесконтрольная пролиферация опухолевых клеток. Кроме того, под влиянием белка, в синтезе которого участвует ген Е6, активируется теломераза, что способствует возникновению бессмертных клеточных клонов и развитию опухолей. Одновременно за счет блокирования циклинзависимой киназы р21 и р26 белком, производимым геном Е7, начинается активное деление поврежденных клеток. В последующем раковые клетки распространяются со слизистой на другие ткани маточной шейки, опухоль прорастает в смежные органы и метастазирует.
Классификация
Систематизация форм рака шейки матки при беременности основана на тех же критериях, что и у небеременных пациенток. С учетом типа пораженного эпителия опухоли могут быть экзофитными плоскоклеточными, происходящими из экзоцервикса (выявляются у 53,6% беременных), эндофитными аденокарциноматозными, образованными клетками эндоцервикса (диагностируются у 25,7% пациенток). В 20,7% случаев неоплазия шейки при гестации является смешанной. Для разработки оптимальной тактики ведения беременности важно учитывать стадию рака:
- Стадия 0. При прекарциноме (опухоли in situ) процесс локализован в эпителиальном слое, атипия клеток соответствует пограничному состоянию между дисплазией III степени и истинной злокачественной неоплазией. Прогноз для вынашивания беременности наиболее благоприятен, после родов возможны малоинвазивные операции.
- СтадияI. Рак не выходит за пределы шейки. Опухолевый очаг определяется микроскопически (IA, микроинвазивный рак) или макроскопически (IB). Возможно продолжение гестации и естественное родоразрешение по согласию пациентки с выполнением консервативных или радикальных вмешательств в послеродовом периоде.
- СтадияII. Карцинома распространилась на тело матки, верхнюю часть влагалища (IIA) и параметрий (IIB). Стенки таза и нижняя треть вагины в процесс не вовлечены. При гестационном сроке свыше 20 недель беременность можно пролонгировать не более чем на 8 недель до достижения плодом жизнеспособности и завершить кесаревым сечением.
- СтадияIII. Рак распространился на нижнюю треть влагалища (IIIA), доходит до стенок таза, возможно блокирование почки и возникновение гидронефроза (IIIB). Лечение рекомендуется начинать как можно раньше. В 1 триместре беременность прерывают, во 2-3 —выполняют кесарево сечение с расширенной экстирпацией матки.
- СтадияIV. В онкопроцесс вовлечена слизистая прямой кишки и мочевого пузыря либо опухоль вышла за пределы таза (IVA), имеются отдаленные метастазы (IVB). При беременности встречается редко. Обнаружение неоперабельной опухоли является основанием для проведения кесарева сечения при жизнеспособном плоде с последующей лучевой и химиотерапией.
Симптомы РШМ при беременности
Преинвазивные и малоинвазивные формы неоплазии, выявляемые у 70% беременных, протекают бессимптомно. У женщин с начальными стадиями инвазивного рака (IB, IIA) отмечаются контактные кровянистые выделения после вагинального осмотра, полового акта. Кровотечения из поврежденных сосудов неоплазии в I триместре часто ошибочно расцениваются как угрожающий спонтанный выкидыш, во II-III — как преждевременная отслойка или предлежание плаценты. Возможно появление прозрачных белей. При опухолях с распадом выделения становятся зловонными.
Боль в нижней части живота, принимаемая за угрозу прерывания беременности, возникает редко. Появление болезненности в пояснично-крестцовой области, ягодице, задней поверхности бедра обычно свидетельствует об инфильтрации тазовой клетчатки. При сдавливании опухолью мочеточников нарушается отток мочи, при прорастании мочевого пузыря, прямой кишки наблюдаются появление примесей крови в моче и кале, их отхождение через вагину.
Осложнения
При инвазивных видах рака повышается вероятность самопроизвольного прерывания гестации выкидышем или преждевременными родами. Значительная деформация органа опухолью может спровоцировать развитие истмико-цервикальной недостаточности. У пациенток, имеющих кровоточащие неоплазии, сильнее выражена анемия беременных. Уровень перинатальной смертности повышается до 11,5%. Завершение беременности естественными родами при наличии крупного объемного новообразования существенно увеличивает вероятность разрывов маточной шейки, массивных послеродовых кровотечений, гематогенного метастазирования рака. Поэтому в таких случаях рекомендовано кесарево сечение.
Диагностика
Основные задачи диагностического поиска — исключение или подтверждение злокачественности патологического процесса и точное определение стадии рака. В период гестации рекомендуется использовать методы обследования, не представляющие угрозы для плода, что усложняет постановку правильного диагноза. Наиболее информативными являются:
- Осмотр на кресле. Исследование в зеркалах позволяет обнаружить макроскопически видимые изменения экзоцервикса, трансформационной зоны, обнаружить новообразования, выступающие в полость влагалища из цервикального канала. Возможно выявление контактной кровоточивости неоплазии.
- ПЦР скрининг на ВПЧ. Хотя инфицированность вирусом папилломы не свидетельствует об опухоли шейки, получение положительного анализа повышает онконастороженность. ПЦР-диагностика дает возможность определить спектр серотипов возбудителя, провести их типирование.
- Цитология соскоба шейки матки. При беременности забор материала проводится с осторожностью, чтобы предупредить кровотечение, сохранить шеечную пробку, исключить повреждение плодных оболочек. Исследование направлено на определение дисплазии, атипии, малигнизации.
- Кольпоскопия. Дополняет результаты цитологического теста. Расширенная кольпоскопия производится при наличии лабораторных признаков предракового или ракового состояния для обнаружения в слизистой оболочке шейки патологического очага перед выполнением прицельной биопсии и контроля над забором материала.
- Гистологическое исследование биоптата. Применяется для определения вида опухоли и степени ее дифференцировки. Для снижения травматизации маточной шейки и уменьшения вероятности кровотечения беременным обычно проводят клиновидную биопсию. По мнению многих акушеров-гинекологов, забор материала не следует осуществлять ранее 2 триместра.
Для оценки состояния прямой кишки, тазовой клетчатки, мочевого пузыря, регионарных лимфоузлов могут быть рекомендованы УЗИ малого таза, цистоскопия, ректороманоскопия, МРТ отдельных органов, МРТ лимфатических узлов. При подозрении на метастазы предпочтительным методом обследования является МРТ всего тела. Лучевые методы диагностики беременным женщинам с подозрением на рак маточной шейки назначают ограниченно из-за возможного повреждающего воздействия на плод. Заболевание дифференцируют с эрозиями, полипами, кондиломами, кистами, цервицитом, эктопией, эктропионом, дисплазией, опухолями влагалища, спонтанным выкидышем, предлежанием плаценты. Пациентку осматривает онкогинеколог, по показаниям — уролог, проктолог.
Лечение РШМ при беременности
Рак III-IV стадии является показанием для прерывания гестации на любом сроке. До 20-й недели назначается наружная лучевая терапия, провоцирующая спонтанный выкидыш при дозе 4000 сГр. После 20-недельного срока выполняется кесарево сечение и субтотальная резекция матки независимо от жизнеспособности плода. Основные методы лечения при раке маточной шейки у беременных такие же, как и вне гестационного периода:
- Органосохраняющие операции. Показаны молодым пациенткам с карциномой in situ и раком IA стадии (при проникновении в строму не глубже 3 мм), желающим сохранить фертильность. Конизация выполняется спустя 4-8 недель после медицинского аборта или через 7-9 недель после влагалищных или абдоминальных родов.
- Простая гистерэктомия. Удаление матки с сохранением придатков рекомендовано женщинам с преинвазивным и малоинвазивным раком, которые не имеют репродуктивных планов. Операция проводится как самостоятельное вмешательство в I-м триместре и одномоментно с кесаревым сечением при решении выносить беременность.
- Расширенная гистерэктомия. Является операцией выбора при раке IB-II стадий. В 1-м триместре осуществляется, в том числе, для прерывания беременности, во 2 и 3-м производится одновременно с хирургическим родоразрешением. Спустя 2-3 недели женщине рекомендована адъювантная лучевая терапия.
- Сочетанная химиолучевая терапия. Применяется при злокачественном новообразовании шейки матки III-IV стадий. Внешнее облучение позволяет не только воздействовать на опухолевый процесс, но и прервать гестацию до 20 недели. Химиопрепараты и радиометоды не используют при решении женщины сохранить плод.
Прогноз и профилактика
При диагностике у беременной рака шейки матки прогноз всегда серьезный. Наилучших результатов удается достичь при неинвазивных формах неоплазии. Пятилетняя выживаемость пациенток с раком I стадии, выявленным во время беременности, не отличается от аналогичного показателя для небеременных женщин и достигает 88%. При опухоли II стадии на протяжении 5 лет выживает до 54% онкобольных (против 60-75% женщин с диагностированным раком маточной шейки вне беременности), при III стадии — до 30-45%. При инвазивных опухолях отсрочка лечения в связи с желанием сохранить беременность ухудшает прогноз выживаемости на 5% на каждый месяц пролонгированной гестации.
После органосохраняющих операций рак рецидивирует у 3,9% пациенток, а новая беременность наступает у 20,0-48,4%. Отдаленными последствиями конизации являются истмико-цервикальная недостаточность, бесплодие, формирование ректовагинальных, уретро- и пузырно-влагалищных свищей. Профилактика предусматривает соблюдение правил сексуальной гигиены с использованием методов барьерной контрацепции, отказом от беспорядочных половых связей, регулярное диспансерное наблюдение ВПЧ-инфицированных пациенток, своевременное лечение предраковых состояний.
1. Инвазивный рак шейки матки и беременность. Клинические рекомендации ESGO, 2017)/ Жорданиа К.И., Паяниди Ю.Г., Хохлова С.В., Козаченко В.П., Адамян Л.В.// Онкогинекология. – 2018 - №2.
2. Гинекологический рак в сочетании с беременностью/ Урманчеева А.Ф.// Практическая онкология. – 2009 – Т.10, №4.
3. Фоновые заболевания, предрак и рак шейки матки у беременных женщин/ Степанова Р.Н., Коломеец Е.В., Тарасова Л.П.// Ученые записки Орловского государственного университета. – 2011 - №3.
4. Методы диагностики и лечения предрака шейки матки, ассоциированного с беременностью/ Доброхотова Ю.Э. , Венедиктова М.Г. , Боровкова Е.И. , Данелян С.Ж., Саранцев А.Н. , Морозова К.В. , Оруджова К.Ф.// РМЖ.Мать и дитя. – 2017 - №15.
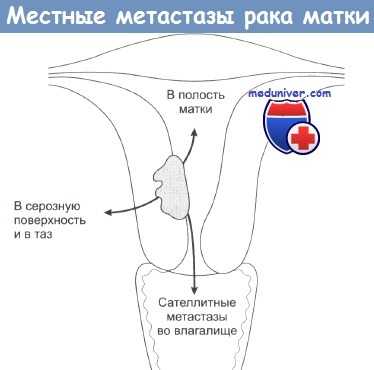
Злокачественные опухоли матки
Злокачественные опухоли матки – новообразования шейки и тела матки, развивающиеся из клеток эпителиальной, мышечной или соединительной ткани, имеющие склонность к инвазивному росту, прорастанию окружающих органов и сосудов, рецидивированию и образованию метастазов. На развитие патологии могут указывать выделения из половых путей (водянистые, кровянистые, гноевидные), схваткообразные или постоянные боли, нарушения мочеиспускания и дефекации. Диагностика злокачественных опухолей матки основывается на данных гинекологического осмотра, кольпоскопии, УЗИ, онкоцитологии, биопсии, гистероскопии, РДВ. В лечении сочетают хирургические, лучевые методы, химиотерапию, гормонотерапию.
Термином «злокачественные опухоли матки» объединяют группу морфологически разнородных опухолей, исходящих из эндометрия, мышечного или соединительного слоя матки. В гинекологии и онкологии к ним относят аденокарциному, рак и саркому (лейомиосаркому) матки. Злокачественные опухоли могут поражать тело и шейку матки. Рак шейки матки (РШМ) является самым распространенным онкологическим заболеванием женских половых органов; наибольшая частота РШМ наблюдается в перименопаузе, однако заболеванию подвержены и женщины репродуктивного возраста. Рак тела матки встречается примерно в 10 раз реже РШМ, главным образом, у пациенток старше 50 лет. В последние годы отмечается увеличение доли злокачественных опухолей матки в структуре женской онкологической заболеваемости, что ставит вопросы профилактики и раннего выявления патологии в ряд наиболее актуальных медико-социальных проблем.
Причины злокачественных опухолей матки
Заболеваемость злокачественными опухолями матки тесно связана с возрастом, состоянием менструальной, репродуктивной и половой функции, социально-бытовыми условиями, географическими и другими факторами. Немаловажная роль в развитии рака матки принадлежит гормональным нарушениям, в первую очередь, гиперэстрогении и лютеиновой недостаточности.
Факторами риска РШМ являются раннее начало половой жизни, частая смена сексуальных партнеров, незащищенный секс. Инициировать фоновые предраковые процессы, которые имеют большой риск трансформации в инвазивный рак, могут вирусы – высокоонкогенные штаммы ВПЧ и ВПГ 2 типа. К изменениям шейки матки, которые расцениваются как факультативный предрак, относят истинную эрозию и псевдоэрозию, лейкоплакию, плоские кондиломы, полипы цервикального канала.
На состояние эпителия шейки матки большое влияние оказывает микробиоценоз влагалища. Поэтому ЗППП, рецидивирующие неспецифические кольпиты и цервициты приводят к изменению микроэкологии влагалища, нарушению защитных физиологических барьеров половых путей. Возникновению злокачественных опухолей шейки матки в немалой степени способствуют курение, профессиональные вредности, наследственность.
В патогенетическом аспекте рак тела матки рассматривается как преимущественно гормональнозависимая патология. С этой позиции в зоне наибольшего риска по возникновению рака тела матки находятся пациентки с феминизирующими опухолями яичников, СПКЯ, аденомиозом, миомой матки, дисфункциональными маточными кровотечениями. В качестве фоновых предраковых процессов выделяют полипы и атипическую гиперплазию эндометрия. Кроме этого, вероятность возникновения злокачественных опухолей матки больше у женщин с отсутствием в анамнезе беременностей, родов и грудного вскармливания, с поздно наступившей менопаузой, проживающих в промышленных городах. Саркома матки, как правило, развивается из быстрорастущей фибромиомы.
Из экстрагенитальной патологии злокачественным опухолям матки чаще всего сопутствуют заболевания печени (печеночная недостаточность, гепатиты, жировой гепатоз, цирроз), эндокринные нарушения (сахарный диабет, ожирение), гипертоническая болезнь. Известно, что при увеличении массы тела на 10-25 кг по сравнению с нормой, риск развития рака эндометрия возрастает в 3 раза, а при наборе свыше 25 кг лишнего веса – в 9 раз.
Классификация злокачественных опухолей матки
Злокачественные новообразования тела матки могут быть представлены следующими морфологическими типами: аденокарциномой (до 80% опухолей), плоскоклеточным, железистоплоскоклеточным, недифференцированным раком и лейомиосаркомой. Рак эндометрия может иметь экзофитный, эндофитный или смешанный рост.
Клиническая классификация
Клиническая классификация выделяет 4 стадии рака тела матки:
0 стадия — атипическая гиперплазия эндометрия (предрак).
I стадия — опухоль локализуется в пределах тела матки:
- Iа – ограничена эндометрием
- Iб – прорастает в миометрий менее чем 1 см
- Iв – прорастает в миометрий глубже, чем на 1см, но не затрагивает серозную оболочку
II стадия — опухоль распространяется на тело и шейку матки (цервикальный канал).
III стадия — опухоль выходит за пределы матки, но локализуется в пределах малого таза:
- IIIа – прорастает серозную оболочку матки, могут определяться метастазы в регионарные лимфоузлы или придатки
- IIIб – прорастает параметральную клетчатку, могут определяться метастазы во влагалище
IV стадия — опухоль выходит за пределы малого таза, прорастает мочевой пузырь и/или прямую кишку.
Стадификация рака шейки матки
0 стадия — цервикальная интраэпителиальная неоплазия.
I стадия — опухоль локализуется в пределах шейки матки:
- Iа – инвазия в строму на глубину не более 3 мм
- Iб – инвазия в строму на глубину более 3 мм
II стадия — опухоль распространяется на верхнюю и среднюю треть влагалища, тело матки или параметральную клетчатку.
III стадия — опухоль распространяется на стенки и нижнюю часть влагалища, параметральную клетчатку вплоть до стенок таза, метастазирует в лимфоузлы малого таза.
IV стадия — опухоль прорастает мочевой пузырь и/или прямую кишку, дает отдаленные метастазы.
Симптомы злокачественных опухолей матки
Рак шейки матки
Начальные формы рака шейки матки протекают бессимптомно или со слабо выраженными проявлениями. Для злокачественных опухолей данной локализации характерны кровянистые выделения разной интенсивности (чаще мажущие), которые в репродуктивном возрасте носят ациклический характер, а в период менопаузы – характер беспорядочных, продолжительных кровотечений. Кровянистые выделения часто появляются после полового акта, дефекации, физической нагрузки. Между кровотечениями больные обращают внимание на появление обильных водянистых белей, которые в поздних стадиях становятся серозно-кровянистыми, с гнилостным запахом.
Болевые ощущения при злокачественных опухолях шейки матки локализуются внизу живота, в области крестца и поясницы, распространяются на бедро и прямую кишку. Вначале болевой синдром возникает по ночам, затем становится постоянным, а боли принимают нестерпимый характер. При сдавлении опухолевым конгломератом лимфатических и кровеносных сосудов появляются отеки наружных половых органов и нижних конечностей. При запущенных формах РШМ нарушаются функции прямой кишки и мочевого пузыря, при опухолевой инвазии органов появляются примеси крови в моче и кале, образуются мочевые или прямокишечные свищи.
Рак тела матки
Злокачественные опухоли, локализующиеся в теле матки, имеют следующие характерные проявления: кровянистые выделения из половых путей, боли в животе и нарушение функции смежных органов. К наиболее ранним признакам рака матки относят появление мажущих или обильных кровяных выделений. Они могут иметь форму метроррагии, меноррагии или периодических кровотечений в менопаузе. Иногда неоплазия манифестирует белями серозно-кровянистого или гноевидного характера.
На ранних этапах развития злокачественных опухолей матки возникают боли схваткообразного характера. После очередного болевого приступа, как правило, появляются или усиливаются патологические выделения из полости матки. На поздних стадиях боли становятся постоянными, интенсивными – они обусловлены сдавлением нервных сплетений малого таза раковым инфильтратом. Несколько позже появляются симптомы нарушения функции мочевого пузыря и прямой кишки: учащение мочеиспускания, тенезмы, затруднение опорожнения кишечника. При далеко зашедшем онкопроцессе присоединяется раковая интоксикация, развивается кахексия.
Саркома матки
Относится к неэпителиальным злокачественным опухолям матки. Может поражать как шейку, так и тело матки. Часто формируется внутри фиброматозных узлов, поэтому может напоминать клинику одной из форм фибромиомы матки. На долю саркомы приходится около 3-5 % всех злокачественных опухолей матки. Отсутствие капсулы обусловливает быстрый инвазивный рост новообразования.
Первыми клиническими признаками обычно становятся нарушения менструального цикла или ациклические кровотечения, которые иногда носят характер профузных. Характерен выраженный болевой синдром и быстрое увеличение матки в размерах. На поздних этапах развивается анемия, раковая кахексия, асцит. Саркома матки рано дает отдаленные метастазы, главным образом в легкие, печень и позвоночник.
Распознать злокачественные опухоли матки на ранних стадиях, основываясь лишь на собранном анамнезе и клинической картине, практически невозможно ввиду неспецифичности симптомов и жалоб. Поэтому в ходе обследования пациенток применяются дополнительные инструментальные и лабораторные методы, позволяющие уточнить строение, локализацию и распространенность неоплазии.
На первом приеме гинеколог, наряду со стандартным опросом, уточняет наличие и число беременностей, родов и абортов у пациентки; перенесенные гинекологические заболевания (особенно фоновые процессы, половые инфекции), характер протекания менструального цикла. При осмотре с помощью зеркал обращают внимание на видимые изменения тканей шейки матки, ее подвижность и форму. Влагалищное или ректовагинально исследование при раке эндометрия или саркоме позволяет обнаружить плотную, увеличенную в размерах матку, наличие инфильтратов в параметрии.
Для ранней диагностики РШМ большое значение имеет исследование мазка на онкоцитологию, проведение расширенной кольпоскопии, прицельной биопсии шейки матки. Своевременно выявить предраковые процессы и начальные стадии рака тела матки помогает УЗИ органов малого таза. Для подтверждения диагноза рака эндометрия проводится аспирационная биопсия, гистероскопия с РДВ и гистологическим исследованием соскоба.
Для определения стадии злокачественной опухоли матки и обнаружения отдаленных метастазов может потребоваться дополнительная диагностика (рентгенография грудной клетки, цистоскопия, ректороманоскопия, МРТ малого таза и т. д.). Дифференциальную диагностику осуществляют с туберкулезом и сифилитической язвой шейки матки, гиперпластической трансформацией эндометрия, субмукозной миомой матки, хорионкарциномой.
Лечение
Лечебная тактика в отношении злокачественных опухолей матки избирается с учетом множества критериев: локализации, стадии, гистологической формы опухоли, возраста пациентки и др. В зависимости от перечисленных составляющих может применяться хирургическое вмешательство, лучевая терапия, химиотерапия, гормонотерапия, а также комбинированное лечение.
При преинвазивном РШМ объем вмешательства может быть ограничен конизацией шейки матки. У женщин репродуктивного возраста осуществляется удаление матки без придатков, у пациенток старше 50 лет – пангистерэктомия. При РШМ I стадии хирургический этап обычно дополняется послеоперационной лучевой терапией, при РШМ II стадии – пред- и послеоперационным облучением. В более поздних стадиях применяется только наружная и внутриполостная лучевая терапия, симптоматическое лечение.
Основной объем хирургического лечения рака тела матки - гистерэктомия с аднексэктомией, которая при необходимости дополняется лимфаденэктомией. В до- и послеоперационном периоде также применяется лучевое лечение. При обнаружении в уделенной опухоли рецепторов прогестерона назначается гормональная терапия гестагенами. Химиотерапия используется при распространении злокачественной опухоли матки за пределы тазовой области, однако ее эффективность весьма ограничена.
Профилактика
Профилактика злокачественных опухолей матки заключается в своевременном выявлении и лечении предраковых состояний, систематическом прохождении профилактических осмотров с проведением Пап-теста, предупреждении ЗППП. Важно следить за весом, артериальным давлением, уровнем гликемии, заниматься лечением экстрагенитальной патологии, избавиться от вредных привычек. Для защиты от РШМ девочек-подростков в будущем предлагается профилактическая вакцинация против высокоонкогенных штаммов ВПЧ.
Миома матки при беременности
Миома матки при беременности — это доброкачественное объемное образование миометрия, возникшее до начала гестации и способное осложнить ее течение. У большинства пациенток клиническая симптоматика отсутствует. При крупных неоплазиях заболевание может проявляться тяжестью в нижней части живота, запорами, учащением дефекации и мочеиспускания, отечностью ног и гениталий. Диагностируется с помощью УЗИ матки. Для консервативного лечения миоматозных узлов используют спазмолитики, токолитики, антиагреганты. При наличии показаний возможно выполнение консервативной миомэктомии.
Миома матки определяется у 0,2-6% беременных, при этом более 2/3 пациенток находятся в возрасте старше 30 лет, у половины из них это первая беременность. В последние годы отмечается омоложение заболевания с все частым выявлением опухолей миометрия у больных 27-29 лет. Большинство молодых пациенток имеют отягощенную наследственность, согласно данным исследований, если у женщины была обнаружена миома в позднем репродуктивном возрасте или пременопаузе, ее дочь обычно заболевает на 10-15 лет раньше. В 10-40% случаев течение гестации и родов при наличии миоматозных узлов является осложненным, в наиболее тяжелых случаях возможны потеря плода и матки.
Специалисты в сфере гинекологии предлагают ряд теорий образования миоматозных узлов, однако на сегодняшний день причины развития миомы у небеременных и беременных женщин продолжают уточняться. По мнению многих авторов, предрасполагающими факторами к началу неопластических процессов в миометрии вне зависимости от наличия гестации являются:
- Дисгормональные расстройства. Дисбаланс половых гормонов наблюдается при заболеваниях яичников (хронических оофоритах, аднекситах, кистах, эндометриозе), нарушениях гипоталамо-гипофизарной регуляции, эндокринной патологии (сахарном диабете, гипотиреозе, аутоиммунном тиреоидите, заболеваниях надпочечников), избыточной массе тела.
- Посттравматические изменения волокон миометрия. У пациенток, ранее перенесших аборты, диагностические выскабливания, операции на матке, другие инвазивные процедуры возможно повышение пролиферативной активности клеток мышечного слоя. Преобладание процессов неогенеза над апоптозом способствует образованию гладкомышечных узлов (миом).
- Отягощенная наследственность. Доказана роль генетических мутаций в развитии патологии. Хромосомные аберрации выявляются у 30-73% больных. Миоматоз чаще обнаруживается при точечных аберрациях генов ESR1, ESR2, при которых изменяется чувствительность эстрогеновых рецепторов, и MED12, влияющего на синтез белка-регулятора активности других генов.
Дополнительным фактором риска у беременных становится изменение уровня половых гормонов в локальном кровотоке матки, направленное на поддержание гестации. По данным наблюдений, в первые 8 недель гестационного срока усиливается гиперплазия и гипертрофия клеток миометрия, что сопровождается ростом опухоли. Определенную роль могут играть нарушения на центральном уровне нейрогуморальной регуляции, связанные с психологической реакцией на беременность и более выраженные у тревожно-мнительных женщин.
Ключевым звеном образования и роста миомы матки при беременности является нарушение процессов пролиферации, апоптоза и связанного с ними ангиогенеза. Согласно наиболее распространенной теории, усиленная экспрессия рецепторов эстрогена миоцитов (ER-α и ER-β) в первые недели беременности стимулирует пролиферацию гладкомышечных клеток, которые начинают формировать микроскопически и макроскопически определяемые узловые образования. Дальнейший рост опухоли меньше зависит от гормональной стимуляции и регулируется собственными аутокринопаракринными механизмами. Важной особенностью патогенеза миомы у беременных и возможных осложнений заболевания является угнетение клеточной гиперплазии узлов и ускоренная деструкция мышечных клеток в их центральной зоне, начинающиеся с 8 недели гестации. Объем новообразования может оставаться прежним за счет отека, вызванного нарушениями лимфо- и гемодинамики.
При размещении плаценты над крупным интрамуральным новообразованием патологические процессы при беременности происходят не только в тканях миомы, но и субплацентарном ложе. Отмечаются меньшая извитость и укорочение спиральных сосудов, снижение количества анастомозов, увеличение объема межворсинчатого фибриноида. Ворсины частично останавливаются в развитии, остаются патологически незрелыми. Компенсаторные механизмы представлены усиленным ангиоматозом терминальных ворсин, увеличением числа синцитиальных почек. Возможны тромбозы и инфаркты плацентарного ложа, гипоплазия плаценты с развитием фетоплацентарной недостаточности. Истончение слоя миометрия между децидуальной оболочкой и центрипетально растущей миомой повышает вероятность истинного врастания ворсин хориона в стенку матки.
При беременности формы миомы матки обычно систематизируют с учетом локализации узла, его размещения в мышечном слое, особенностей основания субсерозных и субмукозных опухолей, количества и размера неоплазий. Именно эти факторы больше всего влияют на развитие гестации и риск возникновения осложнений. По расположению относительно миометрия акушеры-гинекологи различают следующие виды миом:
- Субмукозные. Миоматозный узел размещен под эндометрием и растет в полость матки. При подслизистых миомах чаще всего нарушаются процессы плацентации. Опухоли больших размеров оказывают давление на плод и его оболочки, что может привести к прерыванию беременности и деформациям скелета ребенка.
- Интрамуральные. Новообразование формируется в средней части мышечного слоя. Влияние на беременность обычно оказывает при большом размере узла. Основные осложнения связаны с патологическими изменениями субплацентарной площадки, плаценты, реже — с давлением неоплазии на растущий плод.
- Субсерозные. Опухоль развивается из наружной части миометрия, ее рост направлен в сторону брюшной полости. На гестацию влияет редко. Смещение миомы, расположенной на ножке, повышает риск перекрута новообразования с последующим некрозом. Крупные неоплазии сдавливают соседние органы.
В 5% случаев миомы локализуются в шейке матки, что приводит к возникновению истмико-цервикальной недостаточности у беременных. Клинически значимым является деление миом на единичные и множественные, небольшие и крупные (от 5 см), на ножке или широком основании. Более серьезный прогноз отмечается у женщин с несколькими узлами, опухолями больших размеров или новообразованиями на ножке. Широкое основание субмукозной миомы ухудшает течение беременности только при расположении над ней плаценты. Деление неоплазий по гистологическому строению на лейомиомы, фибромиомы, фибромы прогностического значения при гестации обычно не имеет.
Симптомы
При отсутствии осложнений заболевание у беременных, особенно на начальных этапах, протекает бессимптомно и выявляется случайно во время планового УЗИ-скрининга. При наличии крупных миом возможно ощущение дискомфорта, давления, тяжести внизу живота, несоответствие окружности живота сроку беременности. Учащение мочеиспускания, запоры или более частые позывы к дефекации, отеки ног, наружных гениталий, появление геморроя, вызванные сдавливанием подсерозной опухолью мочевого пузыря, прямой кишки и магистральных вен, большинство пациенток связывают с развитием беременности или заболеваниями гестационного периода (варикозной болезнью, вульварным варикозом).
Вероятность осложненного течения заболевания повышается при наличии узлов размерами свыше 5-7 см, их локализации в области шейки, перешейка, нижней части тела матки, множественном миоматозе, размещении плаценты в проекции новообразования. В 42-58% случаев при миоме отмечается угроза спонтанного раннего выкидыша, риск преждевременных родов достигает 12-25%. Возможно возникновение таких акушерских осложнений, как фетоплацентарная недостаточность с задержкой развития плода, низкое расположение плаценты, ее преждевременная отслойка при нормальной локализации, плотное прикрепление или истинное приращение плацентарной ткани.
Деформация опухолью полости матки способствует формированию аномалий костной системы плода и его неправильному предлежанию. У некоторых беременных подслизистая неоплазия препятствует прохождению ребенка по родовым путям. В родах у пациенток с миомами чаще наблюдается слабость родовых сил, дискоординированная родовая деятельность, возможны разрывы матки и ее шейки, гипотонические кровотечения, послеродовая субинволюция матки. При наличии миом частота мертворождений увеличивается вдвое. Основными неакушерскими осложнениями миоматоза при беременности являются некроз узла, перекрут его ножки. Риск малигнизации неоплазии в гестационном периоде минимальный.
Основной задачей диагностического поиска при миоме у беременных является оценка факторов, способных осложнить гестацию и роды, — количества и размеров узлов, их локализации и расположения по отношению к плаценте. Некоторые традиционные методы диагностики миомы матки при беременности применяются ограниченно. Во время гинекологического осмотра можно выявить несоответствие размеров матки сроку беременности, прощупать крупные субсерозные опухоли на ее передней стенке. Ангиография матки, КТ органов малого таза и другие рентгенологические исследования не рекомендованы из-за возможного повреждающего воздействия на плод. Категорически запрещено проведение гидросонографии и гистероскопии. Для уточнения данных о миоме у беременной обычно применяют:
- УЗИ матки. Миоматозные узлы имеют вид округлых гетерогенных образований с четкими ровными контурами. При преобладании в составе низкодифференцированных гладкомышечных клеток неоплазия является гипоэхогенной, о наличии большого количества соединительнотканных волокон свидетельствует гиперэхогенность. Метод позволяет четко определить размеры опухоли, количество узлов и их расположение.
- УЗДГ сосудов матки. Преимуществом допплерографического исследования является возможность изучения как особенностей кровоснабжения миоматозной неоплазии, так и маточно-плацентарного кровотока. Поскольку при расположении плаценты в области новообразования возрастает риск аномалий ее развития, оценка кровоснабжения обеспечивает своевременное выявление нарушений трансплацентарной динамики.
МРТ матки выполняют по показаниям в сложных диагностических случаях не ранее 4 месяца гестации. Дифференциальную диагностику миомы проводят с аденомиозом, раком и саркомой матки, полипами эндометрия, опухолями яичников, забрюшинными новообразованиями, трофобластической болезнью. При необходимости беременной назначают консультации уролога, онколога, хирурга.
Лечение миомы матки при беременности
Основной врачебной задачей при сопровождении беременной с миоматозным узлом является пролонгация гестации до безопасных для рождения ребенка сроков. Схема медикаментозной терапии миомы при беременности включает препараты, которые снижают тонус миометрия, улучшают кровоток в маточной стенке и опосредованно — в фетоплацентарном комплексе:
- Спазмолитики. Рекомендованы производные папаверина с выраженным миотропным эффектом и умеренным сосудорасширяющим действием. Лекарственные средства этой группы за счет ингибирования фосфодиэстеразы и внутриклеточного накопления цАМФ угнетают поступление ионов кальция в миоциты, снижая тонус и сократительную активность гладкомышечных волокон.
- β2-симпатомиметики. Селективные адреностимулирующие препараты обладают выраженным токолитическим эффектом, хорошо расслабляют миометрий, не влияя на сердечно-сосудистую систему и не ухудшая маточно-плацентарный кровоток. За счет активации аденилатциклазы и увеличения уровня цАМФ снижают внутриклеточную концентрацию кальция и сократительную способность миоцитов.
- Антиагреганты. Целесообразность назначения средств с антитромботическим эффектом обусловлена необходимостью профилактики тромботического некроза миомы. Благодаря усилению антиагрегантных свойств простагландинов и подавлению активности фосфодиэстеразы препараты предотвращают агрегацию тромбоцитов и стимулируют умеренную периферическую вазодилатацию.
Оперативное лечение (консервативная миомэктомия) при беременности проводится в исключительных случаях при атипичном (шеечном, перешеечном) расположении гладкомышечных узлов, больших и гигантских одиночных или множественных опухолях, препятствующих нормальному развитию ребенка, нарушении питания новообразования с признаками его деструкции.
Плановая миомэктомия осуществляется на 16-19 неделях гестации, когда физиологическая прогестероновая защита является максимальной. Из-за высокого риска прерывания беременности удаление миомы после 22 недели не рекомендуется. При перекруте ножки и некрозе опухоли хирургическое вмешательство выполняется экстренно по жизненным показаниям. Крайне редко при начавшемся самопроизвольном прерывании беременности с массивным кровотечением и технической невозможностью выскабливания из-за шеечно-перешеечной локализации узла производится экстирпация матки с плодным яйцом.
Большинству беременных с миомой рекомендованы естественные роды с укорочением периода изгнания. Показанием к плановому кесареву сечению является множественный миоматоз с большими неоплазиями, особенно при их размещении в нижнем сегменте. Экстренное оперативное родоразрешение проводится по акушерским показаниям при клинически узком тазе, терапевтически резистентной слабости родовой деятельности, косом или поперечном положении плода, выпадении петель пуповины, угрозе разрыва матки. В ряде случаев осуществляется расширенное вмешательство с миомэктомией или удалением матки.
1. Миома матки вне и во время беременности. Клиника, диагностика, хирургическое лечение и реабилитация. Учебное пособие/ Краснопольский В.И., Буянова С.Н., Логутова Л.С., Щукина Н.А., Юдина Н.В., Чечнева М.А. – 2014.
3. Особенности течения беременности и родов у пациенток с миомой матки/ Эгамбердиева Л.Д., Тухватшина Н.И., Мухаметзянова Л.М. // Практическая медицина. – 2017.
4. Оценка ведения беременности и родов у женщин с миомой матки/ Бабаджанова Г.С., Мирзаева Д.Б., Гуломова М.А.// Биология и интегративная медицина. – 2017.
Беременность и онкология

Беременность не может быть провокатором онкологических заболеваний. У женщин в положении рак встречается с частотой, не выходящей за рамки общей статистики. На стадии беременности чаще всего обнаруживают рак шейки матки и молочной железы, а уже во вторую очередь все иные виды. Но очаги онкологических заболеваний могут возникнуть задолго до обнаружения. Беременность становится лишь поводом для обследования, в ходе которого обнаружен рак.
Диагностика во время беременности

К безопасной для плода диагностике относится метод ультразвукового исследования (УЗИ) и магнитно-резонансная томография (МРТ). Насчет МРТ у гинекологов есть разногласия, поэтому в ряде клиник этот метод может быть исключен либо применяться с большой осторожностью. Но доказанных противопоказаний для эмбриона магнитный резонанс не имеет. Рентген беременным можно делать выше диафрагмы с использованием свинцового фартука. До того же уровня можно применять компьютерную томографию (КТ), например, для исследования легких, головного мозга, щитовидной железы. Естественно не наносит никакого вреда беременным и плоду анализ крови на онкомаркеры. Биопсия с последующим цитологическим и гистологическим исследованием также активно используется при обследовании беременных с подозрениями на раковые опухоли.
К неразрешенным методам диагностики относится позитронно-эмиссионная томография (ПЭ КТ), поскольку ее влияние на зародыш до конца не изучено.
У беременных частота выявления онкозаболеваний не выходит за рамки статистической для популяции. Многое зависит от возраста беременной женщины. К сожалению, с возрастом рак встречаются чаще у людей в целом. Соответственно и беременные не являются исключением.
Лечение рака во время беременности
Будущим матерям очень важно знать, что большинство видов онкологии напрямую не угрожают плоду. Только меланома и лейкоз могут вызывать метастазы у плода, но и это случается крайне редко (в мире известно не более сотни случаев метастазирование этих видов рака в плаценту и эмбрион). Но определенную опасность может представлять лечение онкологии в период вынашивания.
Химиотерапия относится к жестким видам лечения, оказывающем влияние на весь организм в целом. Разумеется, используемые химические препараты, подавляющие рост раковых клеток, могут вызывать пороки у эмбриона, несмотря на природный защитный барьер. Вероятность развития пороков у плода тем выше, чем дольше и интенсивнее проводится химиотерапия. Больше всего рисков возникает, если такое лечение назначают уже в первом триместре. Но есть схемы, которые имеют показания при беременности, например, при таком виде рака, как синдром Ходжкина.
Во втором и третьем триместре эмбрион менее уязвим при химиотерапии. Но препараты могут вызывать задержку развития эмбриона. В медицинской литературе описаны случаи внутриутробной гибели плода. Несмотря на то, что это редкие в практике случаи, они дают основания с большой осторожностью подходить к использованию препаратов химиотерапии.
После 14-й недели беременности процессы формирующие органы у эмбриона завершаются. С этого момента введение схем ПХТ (паллиативной химиотерапии) становится значительно безопаснее для плода. До начала органогенеза, в частности в имплантационный период, химиотерапия воздействует соответственно закону «все или ничего». На сроке 2-8 недель уровень врожденных аномалий при химиотерапии доходит до 20%. Препараты в первую очередь оказывают негативное влияние на нервную систему и органы чувств (глаза, уши).
Лучевая терапия, как и воздействие химическими препаратами, несет в себе определенный риск для эмбриона. Поэтому при составлении схем и определении методики лечения рака у беременных решение принимают, взвешивая степень пользы и вреда. Лучевая терапия – важный этап в борьбе с многими видами рака. На ранних сроках беременности, когда зародыш еще мал и защищен от облучения толщей материнских тканей, этот метод не наносит ему вреда при дозах, не превышающих 100 мГр. Эти данные были получены в результате масштабных исследований применения лучевой терапии на животных, а также на основании практики влияния метода на людей в т.ч. и внутриутробного периода. Радиоактивные методики могут привести к гибели зародыша на самых ранних стадиях – до имплантации и в ее процессе.
Один из главных факторов риска операций для женщин в положении – тромбоэмболические осложнения. Перенесшим хирургическое вмешательство рекомендовано профилактическое лечение таких осложнений. При операциях на матке распространена практика применения токолитиков.
Влияние онкологических заболеваний на плод
Медицина пока не может объяснить всех механизмов воздействия основных методик лечения рака у матери на развивающийся в ее утробе эмбрион. Само заболевание не проникает метастазами в плод (за редким исключением). Опасность для ребенка представляют агрессивные методы, которые применяются для лечения рака. Медицинская наука не дает однозначного ответа на то, как влияет препарат или облучение на плод. Известны случаи, когда у близнецов, растущих в утробе матери, проходящей курс химиотерапии, наблюдались абсолютно разные последствия.
Дети, рожденные от матерей, проходивших курсы химиотерапии даже начиная с первого триместра, в большинстве рождаются здоровыми. Отклонения у них встречаются в порядке статистических. В зарубежной литературе приводятся результаты 20-летних исследований, в ходе которых изучалось 58 беременностей женщин с гемоблистозными видами рака. Дозы химических препаратов они получали уже в первом триместре. Из общего числа исследуемых произошло два выкидыша и два случая мертворождения. У остальных не наблюдалось врожденных аномалий, пороков умственного, физического или полового развития. За время наблюдения некоторые дети успели стать родителями, и их потомство тоже не имело врожденных патологических признаков.
Ранняя диагностика онкологии у беременных способствует улучшению прогноза. В таком случае чаще удается побороть основное заболевание (рак) у женщины и не дать ему развиться до стадии, угрожающей жизни ее и ребенка, которого она вынашивает. Избавление от беременности в большинстве случаев не улучшает прогноз для матери, у которой после лечения резко снижается фертильность вплоть до бесплодия.
Говоря о влиянии рака на эмбрион, нельзя не затронуть психологический аспект состояния беременной женщины, которой поставили диагноз злокачественного заболевания. На фоне эмоционального потрясения могут происходить выкидыши, преждевременны роды, поэтому к таким пациенткам нужен особый подход.
Читайте также:
- КТ при атрезии хоан
- Причины предменструального синдрома. Этиология ПМС
- Погружения с применением гелиево-кислородных смесей. Декомпрессия при применении гелиево-кислородных смесей
- Конвекситальное субарахноидальное кровоизлияние (кСАК) на КТ, МРТ
- Кортикальная дисплазия - классификация, клиника, диагностика
