Методика иммунохимического исследования парапротеинов - принципы
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Метод исследования
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Суточную мочу, среднюю порцию суточной мочи.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Исключить (по согласованию с врачом) прием мочегонных препаратов в течение 48 часов до сбора мочи.
Общая информация об исследовании
Белок Бенс-Джонса – это группа моноклональных свободных легких цепей иммуноглобулинов, которые могут быть определены в моче или в крови. Их появление характерно для лимфопролиферативных заболеваний, таких как множественная миелома. Эта особенность была впервые описана английским врачом Генри Бенс-Джонсом при исследовании образца мочи, что и дало такое название. Впоследствии стало известно, что белок Бенс-Джонса – это, в действительности, гомогенная группа свободных легких цепей иммуноглобулинов, синтезируемых одной плазматической клеткой (моноклональных). Белок Бенс-Джонса – это собирательное название мономеров, димеров, тетрамеров и других полимерных структур, состоящих из легких цепей иммуноглобулинов.
Свободные цепи иммуноглобулинов – это полипептиды с молекулярной массой 22 кДа, которые синтезируются плазматическими клетками и, соединяясь с тяжелыми цепями, образуют молекулы иммуноглобулинов различных классов: IgG, IgM, IgA и других. В зависимости от строения константного домена, различают два класса легких цепей – лямбда (λ) и каппа (κ) цепи. Каждый иммуноглобулин может иметь только один класс легких цепей – или лямбда, или каппа. В норме плазматические клетки синтезируют больше легких, чем тяжелых цепей. Легкие цепи, не вошедшие в состав иммуноглобулинов, называются свободными. Свободные каппа-цепи, как правило, существуют в виде мономера, имеют небольшой размер и поэтому относительно легко фильтруются в первичную мочу. Лямбда-цепи, напротив, обычно существуют в форме димера, что затрудняет их фильтрацию в почечных клубочках. В редких случаях как каппа-, так и лямбда-цепи могут образовывать тетрамеры – крупные комплексы белков, которые в мочу не проникают. В норме практически все количество легких цепей, поступивших в почечные канальцы, подвергается реабсорбции и лишь их незначительная часть выделяется с мочой (не более 0,75-1,8 мг/л). Появление избытка свободных легких цепей иммуноглобулинов в моче (появление белка Бенс-Джонса) может свидетельствовать об их чрезмерной продукции плазматическими клетками (гаммапатии) или о нарушении процесса почечной реабсорбции (заболевания почек). Обнаружение белка Бенс-Джонса может быть использовано для диагностики и контроля лечения этих заболеваний.
Белок Бенс-Джонса определяется у 50-70 % пациентов с множественной миеломой, 30-40 % пациентов с макроглобулинемией Вальденстрема и у 90 % пациентов с первичным амилоидозом. Другими состояниями, при которых может наблюдаться белок Бенс-Джонса в моче, являются лимфома, лейкоз (чаще хронический лимфолейкоз или плазмаклеточный лейкоз), рак поджелудочной железы, медуллярная карцинома щитовидной железы, доброкачественная гаммапатия неясного генеза. При отсутствии какой либо причины появления этого белка в моче говорят об идиопатической протеинурии Бенс-Джонса.
Свободные легкие цепи иммуноглобулинов не могут быть определены с помощью обычного анализа мочи – для этого используются специальные тесты. Как правило, лабораторная диагностика при подозрении на гаммапатию начинается с обычного электрофореза белков плазмы и мочи. Этот шаг необходим для определения концентрации М-белка (парапротеина) и начальной дифференциальной диагностики гаммапатий. Электрофорез, однако, недостаточно чувствительный метод. По этой причине на втором этапе обследования рекомендуется проведение более чувствительного теста – иммунофиксации белков мочи. Это позволяет избежать диагностических ошибок, учитывая, что гаммапатии могут иметь нормальный результат электрофореза белков. Метод иммунофиксации позволяет идентифицировать белки на электрофореграмме без потери наглядности и четкости классической электрофоретической картины. В месте расположения белка, прореагировавшего с родственной ему антисывороткой, образуется преципитат, который полностью сохраняет форму и положение изучаемой фракции. Предварительно отмыв несвязавшиеся белки солевым раствором, пластины окрашивают. Зону миграции белка уточняют, соотнося положение преципитата, образованного этим белком, с контрольной фореграммой.
Помимо высокой специфичности и разрешающей способности, достоинством метода является его высокая чувствительность. Это объясняется накоплением белка (антител) в зоне градиента при образовании специфического преципитата и минимальной диффузией антигена при реакции с антисывороткой. При иммунофиксации можно выявить следовые М-градиенты, которые не видны на окрашенной электрофореграмме. Основная сложность - подбор адекватного разведения образца для получения плотного, хорошо видимого преципитата. Если образец разведен недостаточно, то преципитат может раствориться в избытке антигена (исследуемый белок). При слишком большом разведении образца образовавшийся преципитат можно не увидеть. В обоих случаях имеет место ложноотрицательный результат.
Белок Бенс-Джонса также может не определяться в моче на ранней стадии заболевания, когда избыток свободных легких цепей еще может быть реабсорбирован в почечных канальцах (вплоть до 1 г в день при нормальной функции почек), и в редких случаях, когда свободные легкие цепи образуют тетрамеры, не фильтрующиеся в почечном клубочке.
Ложноположительный результат может быть получен при приеме некоторых лекарственных средств (например, аспирин и пенициллин в высоких дозах), хронической почечной недостаточности или при некоторых системных заболеваниях (ревматоидный артрит, СКВ, полимиозит).
Учитывая эти ограничения метода иммунофиксации, интерпретация результатов должна проводиться с учетом дополнительных анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
- Для диагностики и контроля лечения моноклональных гаммапатий (множественной миеломы, болезни легких цепей, макроглобулинемии Вальденстрема).
Когда назначается исследование?
При подозрении на наличие злокачественного гематологического заболевания;
при проведении дифференциального диагноза между множественной миеломой, остеопорозом, метастазами в кости и рядом других заболеваний, сопровождающихся множественными переломами и болями в костях.
Что означают результаты?
Легких цепей (белка Бенс-Джонса) и моноклональных иммуноглобулинов не обнаружено. Протеинурии не обнаружено.
- первичный амилоидоз;
- моноклональная гаммапатия неясного генеза;
- криоглобулинемия;
- синдром Фанкони;
- гиперпаратиреоз;
- множественная миелома;
- остеомаляция;
- макроглобулинемия Вальденстрема;
- медуллярный рак щитовидной железы;
- аденокарцинома поджелудочной железы;
- лимфома;
- лейкоз;
- идиопатическая протеинурия Бенс-Джонса.
- норма;
- эффективное лечение заболевания.
Что может влиять на результат?
- Стадия заболевания: белок Бенс-Джонса может не определяться в моче на ранней стадии заболевания;
- прием аспирина и пенициллина в высоких дозах может приводить к получению ложноположительного результата;
- наличие системных заболеваний (ревматоидный артрит, СКВ, полимиозит) и хронической почечной недостаточности может приводить к получению ложноположительного результата;
- наличие тетрамеров лямбда- или каппа-легких цепей (не попадающих в мочу) может приводить к получению ложноотрицательного результата.
Важные заменчания
Белок Бенс-Джонса в моче обнаруживается при ряде злокачественных гематологических заболеваний. Однако его отсутствие не позволяет исключить наличие онкологического заболевания. Кроме того, результат может быть ложноположительным в случае наличия у пациента аутоиммунного заболевания. Чтобы верно интерпретировать результат исследования, нужна комплексная оценка результатов остальных анализов, а также других медицинских данных.
Также рекомендуется
6 Альбумин в сыворотке
20 Белок общий в сыворотке
17 Белок общий в моче
9 Белковые фракции в сыворотке
21 Иммунофиксация иммуноглобулинов сыворотки крови с антисыворотками IgG, A, M K, L с количественным определение парапротеина
Методика иммунохимического исследования парапротеинов - принципы
Иммунохимическое исследование, проводимое при подозрении на наличие моноклональной секреции, представляет собой комплексный анализ, состоящий из двух этапов.
На этапе скрининга проводят электрофоретическое исследование сыворотки и концентрированной мочи, а также определяют количество иммуноглобулинов основных трех классов (G, А, М) и соотношение к/h. В типичных случаях, которые характеризуются высоким уровнем моноклональной секреции (особенно IgG и IgA) и снижением содержания по-ликлональных иммуноглобулинов, такого объема исследований достаточно для выявления и характеристики парапротеина.
Если уровень секреции невысок или по результатам скрининг-тестов не все ясно, то с учетом данных, полученных на первом этапе, планируют продолжение исследования с применением других методов, прежде всего ИФ и ИЭФ.
Выявление М-градиента — ключевой момент при диагностике моноклональной секреции, поэтому для проведения электрофореза должен быть выбран вариант с высокой чувствительностью и хорошим разрешением. Этим требованиям отвечает электрофорез в геле агарозы. Трудности при выявлении М-градиента могут быть связаны с несколькими моментами.
Прежде всего при низком содержании парапротеина М-градиент может быть не виден или слегка заметен на электрофореграмме. Кроме того, часть М-градиентов, особенно образованных белками Бенс-Джонса и А-парапротеинами, мигрирует в зоне а- и р-глобулинов и может маскироваться нормальными белками этих зон. В ряде случаев на электрофореграмме выявляются так называемые ложные М-градиенты, образование которых связано с высоким содержанием белков неиммуноглобулиновой природы.
Например, С-реактивный белок может давать небольшую гомогенную полосу в центре у-зоны. Лизоцим обусловливает образование небольшого градиента в зоне медленных у-глобулинов, что встречается при хроническом моноцитарном лейкозе. Полоса фибриногена при исследовании плазмы или при нарушениях свертывания крови может имитировать М-градиент в у1-зоне. Резкое повышение уровня а2-макроглобулина может быть ошибочно принято за М-градиент в а2-зоне. Наконец, наличие свободного гемоглобина в гемолизированном образце ведет к появлению интенсивной полосы в зоне b1-глобулинов.

Дополнительную полосу в зоне b-глобулинов дают также генетические варианты трансферрина. Большое количество крупных иммунных комплексов и наличие криоглобулинов вызывают образование нерастворимого осадка в области стартовой лунки, что также может быть ошибочно расценено как М-градиент. Во всех этих ситуациях используют иммунохимические методы, чаще всего иммунофорез, которая в большинстве случаев позволяет прояснить картину.
При подозрении на моноклональную секрецию обязательно электрофоретическое исследование концентрированной мочи, даже если общепринятыми биохимическими методами протеинурия не выявлена. Дело в том, что при выявлении протеинурии из-за низкой чувствительности биохимических реакций не всегда удается обнаружить белок Бенс-Джонса. Термопреципитация в кислой среде, которая считается качественной пробой на присутствие этого белка, также малочувствительна и неспецифична, поэтому результаты часто бывают ложными.
Электрофорез концентрированной мочи, сопровождаемый в случае необходимости иммунохимическим исследованием, обладает наибольшей чувствительностью и специфичностью при выявлении парапротеинурии и, кроме того, позволяет охарактеризовать тип протеинурии.
При клинических проявлениях криоглобулинемии необходимо сразу после взятия крови поместить пробирку в термостат при температуре 37 С и инкубировать до полного образования сгустка, иначе криоглобулин, в состав которого может входить моноклональный белок, будет утерян. Криоглобулины, имеющие клиническое значение, образуют преципитат при температуре 4 °С уже через 12—24 ч. Если криопреципитат появляется через 4—7 дней, то клинические проявления маловероятны.
Определенной проблемой является измерение уровня парапротеина в сыворотке крови и моче. В настоящее время оптимальным методом считается денситометрия фореграмм, поскольку прибор дает возможность выделить пик, соответствующий М-градиенту, и рассчитать содержание в нем белка. Нефелометрия также может быть использована для определения уровня парапротеина. Однако следует помнить, что этот метод позволяет установить только суммарное количество парапротеина и поликлональных иммуноглобулинов того же класса, поэтому при успешной терапии, когда количество парапротеина снижается, а уровень поликлональной секреции повышается, данные нефелометрического исследования относительно изменения уровня парапротеина менее достоверны, чем результаты денситометрии.
При повторных обследованиях одного и того же больного не следует менять метод определения.
Радиальная иммунодиффузия в связи с особенностями, подробно рассмотренными ранее, не рекомендуется для определения уровня парапротеинов.
Направление и глубина диагностического поиска при иммунохимической диагностике в немалой мере обусловливаются особенностями клинической картины и данными предварительного лабораторного исследования. В связи с этим в направлении на иммунохимическое исследование необходимо указывать те изменения, по поводу которых данное исследование предпринимается.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Значение иммунохимического анализа в диагностике парапротеинемий
Моноклональные иммуноглобулины и(или) их фрагменты являются маркерами миеломной болезни, макроглобулинемии Вальденстрема, секретирующих В-клеточных лимфом, AL-амилоидоза и других лимфопролиферативных заболеваний. Выявление моноклональной секреции — одна из немаловажных компонент при диагностике этих состояний. Однако выявление парапротеина само по себе не равнозначно диагнозу В-лимфопролиферативного заболевания, а тем более не обусловливает назначение специального лечения.
С широким распространением иммунохимической диагностики, особенно высокоразрешающего электрофореза, стало ясно, что у 50—60 % пациентов с моноклональной гаммапатией в момент ее выявления отсутствуют какие-либо признаки В-клеточной опухоли. Это состояние принято обозначать как моноклональную гаммапатию неопределенного значения — МГНЗ (MGUS — Monoclonal Gammopathy of Undetermained Significance). МГНЗ характеризуется клинико-лабораторными признаками, в том числе иммунохимическими.
В частности, уровень парапротеина в сыворотке крови, как правило, ниже 35 г/л для IgG и 20 г/л для IgA и IgM, причем, что очень важно, уровень секреции стабилен в динамике, а продукция белка Бенс-Джонса отсутствует или крайне незначительна — менее 1 г в сутки.
При длительном наблюдении за больными установлено, что через 25 лет приблизительно у 40 % из них развиваются миелома, макроглобулинемия и другие родственные им заболевания. Интервал между выявлением парапротеина и развитием клинической картины заболевания составляет от 2 до 29 лет (в среднем 8,5—10,5 года при разных нозологических формах). В большинстве случаев (73 %) МГНЗ связана с продукцией моноклонального IgG. IgA найден в 11 %, IgM — в 14 % случаев.
У 14 % пациентов с моноклональной секрецией IgG клинические проявления возникли через 10 лет, у 29 % — через 20 лет наблюдения, с секрецией IgA — у 18 и 37 % соответственно. При секреции парапротеина класса М в 23 % случаев заболевание проявилось через 10 лет и в 52 % — через 20 лет.
Не существует каких-либо признаков, на основании которых в момент выявления МГНЗ можно было бы установить прогноз для каждого больного, поэтому всех пациентов относят к группе риска, подлежащей постоянному наблюдению. Появление значительной секреции белка Бенс-Джонса (более 1 г в сутки), нарастание уровня сывороточного парапротеина в динамике, угнетение синтеза нормальных иммуноглобулинов являются признаками развития злокачественного процесса.
Частоту повторных исследований определяют индивидуально, но в первое время их проводят не реже одного раза в 3 мес, тем более что иммунохимическое исследование абсолютно безопасно для пациента и относительно недорого.
Уровень секреции парапротеинов является одним из критериев при определении стадии миеломной болезни, поскольку позволяет оценить опухолевую массу по секреции маркерного белка. Это справедливо не для всех случаев миеломной болезни, особенно для миеломы Бенс-Джонса и D-миеломы, когда секреция может оставаться на следовом уровне даже при значительной массе опухоли.
Изменение уровня парапротеина в ходе лечения миеломы — один из ключевых моментов при оценке эффективности цитостатической терапии.
Помимо опухолевой секреции, иммунохимическое исследование позволяет охарактеризовать тип и степень протеинурии, а также определить уровень секреции поликлональных иммуноглобулинов, что помогает выявить сопутствующую нефропатию и гуморальный иммунодефицит, а также принять меры для предотвращения связанных с ними осложнений.
При некоторых заболеваниях наличие парапротеина имеет прогностическое значение. Например, парциальная красноклеточная аплазия костного мозга в присутствии моноклонального IgG протекает, как правило, более благоприятно.
Иммунофиксация плазмы, биологических жидкостей, парапротеинов - принципы, эффективность
Иммунохимически идентифицировать белки на электрофореграмме без потери наглядности и четкости классической электрофоретической картины позволяет метод иммунофиксации (ИФ).
При выполнении иммунофиксации на одной и той же пластине с агарозным гелем проводят несколько электрофоретических разделений исследуемого образца, после чего один из треков окрашивают сразу после окончания фореза (он служит контролем), а на поверхность остальных наносят антисыворотки определенной специфичности.
В месте расположения белка, прореагировавшего с родственной ему антисывороткой, через некоторое время (обычно в пределах часа) образуется преципитат, который полностью сохраняет форму и положение изучаемой фракции. Предварительно отмыв несвязавшиеся белки солевым раствором, пластины окрашивают. Зону миграции белка уточняют, соотнося положение преципитата, образованного этим белком, с контрольной фореграммой.
Иммунофиксацию широко используют в диагностике моноклональной секреции. К наиболее типичным ситуациям относятся:
1) иммунохимическая идентификация небольших М-градиентов, особенно при нормальном содержании поликлональных иммуноглобулинов;
2) выявление и идентификация скрытых М-градиентов, когда моноклональный белок мигрирует в зоне а- или b-глобулинов и маскируется нормальными белками этих фракций, особенно при низком уровне продукции.
В ряде случаев иммунофиксация позволяет распознать так называемые ложные М-градиенты — электрофоретически гомогенные полосы, напоминающие М-градиент, но не относящиеся к иммуноглобулинам. Отсутствие специфического преципитата в зоне такой полосы при реакции с антисыворотками к Н- и L-цепям иммуноглобулинов позволяет отвергнуть предположение о наличии парапротеина в исследуемом образце.
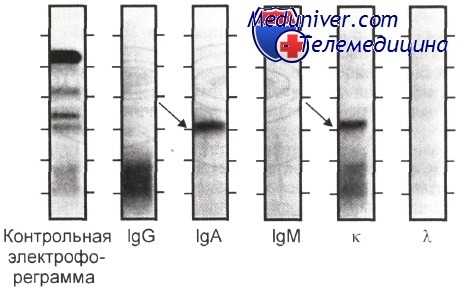
Выявление и характеристика М-градиента в сыворотке крови методом иммунофиксации в геле агарозы.
При проявлении электрофореграмм антисыворотками к а- и к-цепям иммуноглобулинов в b2-зоне выявлен М-градиент, образованный парапротеином Ак (указан стрелкой).
Иммунофиксация является методом выбора при анализе множественной секреции, если в образце присутствуют два и более М-градиентов.
Помимо высокой специфичности и разрешающей способности, достоинством метода является также его высокая чувствительность. Это объясняется двумя факторами: накоплением белка (антител) в зоне градиента при образовании специфического преципитата и минимальной диффузией антигена при реакции с антисывороткой. При иммунофиксации можно выявить следовые М-градиенты, которые не видны на окрашенной электрофореграмме.
Основная методическая трудность — подбор адекватного разведения образца для получения плотного, хорошо видимого преципитата. Если образец разведен недостаточно, то преципитат может раствориться в избытке антигена (исследуемый белок). При слишком большом разведении образца образовавшийся преципитат можно не увидеть. В обоих случаях имеет место ложноотрицательный результат.
В последние годы благодаря исключительно высокой информативности метода и появлению коммерческих диагностических наборов, укомплектованных высокоаффинными антисыворотками (что приводит к получению стабильных результатов), иммунофиксация в большинстве диагностических ситуаций оттеснила на второй план традиционный иммуноэлектрофорез (ИЭФ).
Чувствительность иммунофиксации можно значительно повысить, если использовать для разделения белков противоточный изотахофорез (ИТФ) на ацетат-целлюлозной мембране, предложенной Г. И. Абелевым и соавт.. Это метод электрофореза в неоднородной системе буферов, имеющих общий катион, но разные анионы.
При изотахофорезе (ИТФ) ионы разделяемого образца располагаются в порядке уменьшающейся электрофоретической подвижности между двумя видами анионов буфера: «ведущим» (с более высокой подвижностью) и «замыкающим» (с меньшей подвижностью). Изотахофорез (ИТФ) позволяет одновременно с разделением концентрировать в 10—100 раз белки, находящиеся в высокоразбавленных растворах.
В связи с этим метод хорошо подходит для выявления и индентификации белка Бенс-Джонса в моче, а также для исследования малобелковых биологических жидкостей, доступных в небольшом объеме, ограничивающем предварительное концентрирование (церебральная и слезная жидкости, слюна и т. д.).
ГлавнаяHelixbook Скрининг миеломной болезни и парапротеинемий (иммунофиксация сыворотки крови с пентавалентной сывороткой)
Скрининг миеломной болезни и парапротеинемий (иммунофиксация сыворотки крови с пентавалентной сывороткой)
Данный тест предназначен для обнаружения моноклонального иммуноглобулина (парапротеина) с помощью сочетания таких методов, как клинический электрофорез и иммунофиксация. В результате разделения белков сыворотки крови путем электрофореза парапротеин (также его называют М-пиком Или М-градиентом) претерпевает миграцию в виде компактной полосы, что делает его заметным на фоне других белков фракций. Метод иммунофиксации позволяет достоверно выявить моноклональный иммуноглобулиновый компонент и определить его абсолютное содержание в сыворотке крови.
Синонимы русские
Электрофоретическое разделение белков сыворотки крови, клинический электрофорез и иммунофиксация, скрининг болезни Рустицкого-Калера, скрининг миеломы, скрининг миеломатоза, скрининг ретикулоплазмоцитоза, скрининг генерализованной плазмоцитомы.
Синонимы английские
Serum protein electrophoresis , immunofixation electrophoresis, multiple myelomascreening, plasmacellscancerscreening, plasmacell myeloma screening, monoclonal gammopathy screening.
- Не курить в течение 30 минут до исследования.
Диагностика миеломной болезни проводится с помощью симбиоза двух методов исследования – клинического электрофореза и иммунофиксации – и заключается в выявлении присутствия парапротеина в сыворотке крови для его последующего типирования. С помощью данного исследования можно выявить не только миеломную болезнь, но и другие лимфопролиферативные заболевания, а также амилоидоз, полинейропатию, гемолитические анемии, криоглобулинемию, поражения почек.
Основным признаком данных заболеваний с точки зрения лабораторной диагностики является увеличение синтеза иммуноглобулина. Метод электрофореза позволяет разделить белки сыворотки крови и выделить иммуноглобулин – в результате расщепления он выделяется на фоне других белковых фракций в виде мигрирующей полосы. Этот иммуноглобулин называется парапротеином (также его называют моноклональным иммуноглобулином, М-пиком или М- градиентом). Именно он является онкомаркером при наличии у пациента гематоонкологических заболеваний.
Клинические проявления миеломной болезни связаны с разрушением костей – это могут быть патологические переломы, боли в костях, анемический синдром, снижение гемоглобина в крови, синдром гипервязкости, тромбозы и кровотечения. Разрушение костей приводит к увеличению количества кальция в крови, что в свою очередь влечет за собой кальциевые отложения в почках, легких и на слизистой желудка. Также при миеломной болезни наблюдаются частые бактериальные инфекции у пациента – это связано с падением количества нормальных иммуноглобулинов и нарушениями процесса образования антител.
Наличие множественной миеломы напрямую связано с пролиферацией плазмацитов, способных секретировать парапротеин или его фрагменты. На момент диагноза концентрация моноклонального иммуноглобулина в сыворотке крови чаще всего превышает 25 г/л. Контроль и наблюдение за изменением уровня концентрации парапротеина позволяет проводить мониторинг состояния пациента и оценку эффективности лечения миеломы. При наличии заболевания контрольные анализы для наблюдения за изменением уровня концентрации парапротеинана на фоне терапии должны проводиться каждые 3 месяца.
При миеломе парапротеин в сыворотке крови в 60 % случаев представлен IgG, 20 % приходится на IgA. Эти 20 % относятся к определению миеломы Бенс-Джонса – в этом случае необходимо также проконтролировать продукцию свободных легких цепей (каппа или лямбда) и их наличие в моче. Достаточно редко (в 2–4 % случаев) при наличии миеломы может также отмечаться присутствие биклонального парапротеина.
Лимфома, при которой активно продуцируется моноклональный IgM, называется макроглобулинемией Вальденстрема. При данном типе лимфомы опухолевые клетки диффузно распределяются в селезенке, костном мозге и лимфоузлах. Увеличивается вязкость крови и проявляется ряд клинических симптомов: слепота, спутанность сознания, склонность к кровоточивости, гипертензия, сердечная недостаточность – это связано с повышением концентрации моноклонального IgM до 30 г/л и более. При других типах лимфомконцентрация парапротеинов класса IgM обычно не превышает 30 г/л, хотя они и обнаруживаются у 20 % пациентов.
Помимо перечисленного, моноклональный парапротеин может быть обнаружен при некоторых неопухолевых заболеваниях. Это может быть эссенциальная криоглобулинемия, парапротеинемическая хроническая полинейропатия, холодовая гемолитическая анемия, АL-амилоидоз почек и внутренних органов, болезнь отложения легких цепей. Также парапротеин в сыворотке крови обнаруживается при болезни Кастелмана, POEMS-синдроме и микседематозном лишае.
В случае если парапротеинемия не прогрессирует во множественную миелому или другое заболевание в течение 5 лет, речь идёт о доброкачественной парапротеинемии. В этом случае концентрация парапротеина обычно ниже 3 г/л.
Согласно статистике, парапротеинемия чаще всего выявляется у пациентов старше 50 лет. У лиц старше 65 лет выявляемость заболевания достигает 4-10 %. В большинстве случаев это бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ) – это парапротеинемия без других признаков онкогематологического заболевания. В этом случае не требуется постоянный мониторинг концентрации.
При выявлении парапротеинемии у пациентов моложе 50 лет необходимо проводить контрольные повторные обследования. Это связано с повышенным риском развития множественной миеломы. В случае обнаружения концентрации парапротеина выше 15 г/л необходимо провести ряд дополнительных исследований: электрофорез 24-часового образца мочи и иммунофиксация каждые 3-6 месяцев.
- Диагностика причины клинической симптоматики (болей в спине, спонтанных переломов, частых бактериальных инфекций, полиневрита, гемолитической анемии, нефротического синдрома, кожной пурпуры, синдрома повышенного СОЭ, гиперкальциемии, амилоидоза внутренних органов, эндокринопатии, органомегалии).
- Мониторинг уровня концентрации парапротеинов при моноклональнойгаммапатии невыясненного значения.
- Оценка эффективности проводимой терапии при миеломе и других гаммапатиях.
Референсные значения: парапротеина (IgG, A, M, каппа/лямбда) не обнаружено.
Парапротеин в сыворотке крови присутствует в случае наличия у пациента:
- транзиторной парапротеинемии;
- моноклональной гаммапатии невыясненного значения;
- доброкачественной парапротеинемии;
- парапротеинемической полинейропатии;
- криоглобулинемии;
- холодовой гемолитической анемии;
- AL-амилоидоза или болезни отложения легких цепей;
- миседематозного лишая;
- POEMS-синдрома (полинейропатии с органомегалией);
- множественной миеломы;
- макроглобулинемии Вальденстрема;
- лимфомы и ХЛЛ (хронического лимфолейкоза);
- болезни тяжелых цепей.
Отсутствие парапротеина в сыворотке крови позволяет практически полностью исключить вероятность диагноза "гаммапатия" (для подтверждения необходимо исключить присутствие белка Бенс-Джонса в моче).
Важные замечания
Интерпретация результатов исследования не является диагнозом и содержит информацию для лечащего врача для использования информации наряду с другими источниками (анамнеза, истории болезни, других исследований).
50 Клинический и биохимический анализ крови - основные показатели
Кто назначает исследование?
Онколог, терапевт, гематолог, нефролог, уролог.
Литература
1. Лапин С.В. Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. Издательство"Человек", СПб- 2010.
2. Tietz Clinical guide to laboratorytests. 4-th ed. Ed. Wu A.N.B.- USA,W.B Sounders Company, 2006,1798 p.
3. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Organ Specific Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2011.
4. Conrad K, Schlosler W., Hiepe F., Fitzler M.J. Autoantibodies in Systemic Autoimmune Diseases: A Diagnostic Reference/ PABST, Dresden – 2007.
5. Gershvin ME, Meroni PL, Shoenfeld Y. Autoantibodies 2 nd ed./ Elsevier Science – 2006.
6. Shoenfeld Y., Cervera R, Gershvin ME Diagnostic Criteriain Autoimmune Diseases / Human Press – 2008.
Читайте также:
- Лабораторная диагностика сиклемии (серповидноклеточной анемии) - анализы
- Патологическая регенерация (восстановление) глазодвигательного нерва
- Доброкачественные опухоли щитовидной железы. Фолликулярный рак щитовидной железы.
- Первичный остеоартроз плечевого сустава: атлас фотографий
- Лечение базальноклеточной карциномы. Рекомендации
