Методы определения генетических мутаций
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Сложность выявления генных мутаций связана, во-первых, с рецессивностью большинства мутаций (вероятность их фенотипического проявления ничтожно мала), а во вторых с летальностью многих из них (мутанты не выживают).
Все множество методов выявления генных мутаций можно разделить на две группы: методы генетического анализа и биохимические методы.
1. Методы генетического анализа основаны на скрещивании возможных носителей мутации с тестерными линиями (линиями-анализаторами). Самый простой метод – это скрещивание носителей предполагаемой мутации с соответствующей рецессивно-гомозиготной линией, т.е. обычное анализирующее скрещивание.
Однако этот метод не позволяет выявить неизвестные мутации, а также летальные мутации. Поэтому создаются специальные тестерные линии для учета летальных мутаций.
Например, у мушки дрозофилы синтезирована тестерная линия М–5 (Мёллер–5), которая характеризуется особой структурой X–хромосом у самок. В этих хромосомах имеются аллели с определенным фенотипическим проявлением (доминантный аллель B – полосковидные глаза; рецессивный аллель w a – абрикосовые глаза; кроме того, имеется еще один аллель – sc, контролирующий отсутствие щетинок, но он в анализе обычно не учитывается). В хромосомах М–5 изменен порядок генов: имеется одна большая инверсия и одна малая, расположенная внутри большой (инверсии будут рассмотрены ниже); такое строение хромосом исключает появление кроссоверных особей при скрещивании мушек М–5 с другими линиями.
Для выявления мутаций используются самцы дикого типа – с нормальными X–хромосомами (аллели В + и w + – нормальные красные глаза, sc + – нормальные щетинки; нормальный порядок генов). Эти самцы подвергаются обработке мутагенами (факторами, повышающими частоту мутаций). В результате в их половых клетках часть X–хромосом мутирует, т.е. в них возникают мутации. Обработанные самцы скрещиваются с самками М–5. В первом поколении (F1) все самки имеют полосковидные темно-красные глаза, а самцы – абрикосовые полосковидные глаза. Кроме того, часть самок получает от отцов по нормальный X–хромосоме, а часть – по мутантной X–хромосоме. Все самцы получают от матерей М–5 только немутантные хромосомы с аллелями В и w a . В F1 рецессивные мутации у самок, даже если они есть, не дают летального эффекта, поскольку они находятся в гетерозиготном состоянии: мутантная X–хромосома дикого типа от отца сочетается с немутантной М–5–хромосомой от матери.
Затем гибриды первого поколения скрещиваются между собой, и потомство каждой самки выращивается отдельно. Часть самок несет немутантную X–хромосому дикого типа, и в их потомстве обнаруживаются немутантные самцы дикого типа. Однако некоторая часть самок несет мутантную X–хромосому дикого типа с летальной мутацией; соответственно их сыновья, получившие такие хромосомы, не выживают, и самцы дикого типа в потомстве самок–носительниц не обнаруживаются.
Ниже приведены схемы скрещивания, иллюстрирующие принцип использования метода Мёллер–5 (символом l обозначены летальные мутации).
| Р: | ♀ w a B // w a B | × | ♂ w + B + // Y | – обработка самцов |
| абрикосовые полосковидные | красные нормальные | – окраска и форма глаз | ||
| GP: | w a B | w + B + | – немутантная X –хромосома | |
| w + B + l | – мутантная X –хромосома | |||
| Y | – Y–хромосома |
| F1: | ♀ w + B + // w a B | ♀ w + B + l // w a B | ♂ w a B // Y |
| красные полосковидные глаза; без летальных мутаций | красные полосковидные глаза; носители летальных мутаций | абрикосовые полосковидные глаза |
1 вариант скрещивания – без летальных мутаций
| F1: | ♀ w + B + // w a B | × | ♂ w a B // Y | |
| красные полосковидные глаза | Абрикосовые полосковидные глаза | |||
| G1: | w + B + | w a B | ||
| w a B | Y | |||
| F2: | ♀ w + B + // w a B | ♀ w a B // w a B | ♂ w + B + // Y | ♂ w a B // Y |
| Красные полосковидные глаза | абрикосовые полосковидные глаза | красные нормальные глаза | абрикосовые полосковидные глаза |
2 вариант скрещивания – при наличии летальных мутаций
| F1: | ♀ w + B + l // w a B | × | ♂ w a B // Y |
| красные полосковидные глаза | абрикосовые полосковидные глаза | ||
| G1: | w + B + l | w a B | |
| w a B | Y |
| F2: | ♀ w + B + l // w a B | ♀ w a B // w a B | ♂ w + B + l // Y | ♂ w a B // Y |
| красные полосковидные глаза | абрикосовые полосковидные глаза | самцы не обнаруживаются (летали) | абрикосовые полосковидные глаза |
В настоящее время, кроме тестерной линии М–5 используются и другие тестерные лини мушек дрозофил и других модельных объектов. Например, существуют тест-системы, позволяющие выявлять мутации X-хромосомах самцов в первом же поколении, а также мутации в аутосомах. Применение этих линий позволяет изучать закономерности мутационного процесса, однако классический генетический анализ далеко не всегда можно использовать для выявления мутаций в популяциях человека и многих других организмов.
2. Биохимические методы выявления мутаций исключительно разнообразны и основаны на применении различных методик.
а). Методики, основанные на выявлении определенных биохимических продуктов мутантных генов. Легче всего выявлять мутации по изменению активности ферментов или по утрате какого-либо биохимического признака. Например, у микроорганизмов на селективных питательных средах выявляются ауксотрофные формы, не способные синтезировать определенные вещества (по сравнению с нормальными, прототрофными формами).
б). Методики, основанные на непосредственном выявлении измененных нуклеиновых кислот и белков с помощью гель-электрофореза в сочетании с другими методиками (блот-гибридизации, авторадиографии).
Методы определения генетических мутаций
Прогностическое тестирование генетической мутации. Методы диагностики носительства мутаций
Методы ДНК-диагностики носительства мутаций у клинически здоровых лиц, принадлежащих к группе риска, принципиально не отличаются от аналогичных подходов, используемых для ДНК-диагностики заболевания на развернутой стадии. При наличии возможности проведения ДНК-диагностики эта процедура становится центральным звеном медико-генетического консультирования у лиц из группы риска, трансформируя определенные теоретические величины рассчитанного риска либо в сторону многократного повышения (вплоть до 100% при обнаружении мутации), либо, напротив, в сторону полного исключения риска наследственного заболевания.
Определение генотипа клинически здоровых консультируемых лиц, обозначаемое термином прогностическое (предсказательное) тестирование, представляет собой едва ли не первый пример в истории клинической медицины, демонстрирующий возможность научно обоснованного прогноза будущей судьбы клинически здорового человека за многие годы до ожидаемого дебюта тяжелого (нередко - неизлечимого) заболевания. Поэтому закономерно, что осуществление прогностического ДНК-тестирования связано с решением серьезных правовых и этических вопросов, рассматриваемых во второй части настоящей главы.
Медико-генетическое консультирование у родственников пробанда существенно осложняется возможностью новой мутации у больного со спорадическим случаем болезни. Совокупность связанных с этой возможностью проблем наиболее удобно рассмотреть на примере ПМД Дюшенна и Бекера. Не менее трети всех случаев данных форм мышечной дистрофии обусловлены спонтанными мутациями de novo в гене дистрофина [Darras В. et al. 1988], в связи с чем вопросы коррекции величины генетического риска для новых мутаций являются особенно актуальными и наиболее изученными именно при ПМД Дюшенна/Бекера.
В случае мутации de novo прогноз для членов консультируемой семьи с ПМД Дюшенна/Бекера зависит от того, на каком этапе гамето- или онтогенеза данная мутация возникла. Если новая мутация в гене дистрофина возникает в зрелой яйцеклетке, будет иметь место истинный спорадический случай болезни; при этом все клетки больного, имеющие одну и ту же материнскую хромосому, будут иметь идентичный мутантпый генотип. Если же мутация возникает после оплодотворения (т.е. на стадии эмбриогенеза), то клетки-потомки мутантного клона будут иметь идентичную мутацию в гене дистрофина, тогда как другая популяция клеток организма останется нормальной.
Указанное явление носит название соматического мозаицизма. В случае соматического мозаицизма тяжесть и распространенность симптоматики определяются соотношением нормального и мутантного клеточных клонов организма и тем, какие ткани развиваются из мутантного клона (чем раньше в эмбриогенезе возникла мутация, тем большее число тканей будут вовлечены в патологический процесс). В обеих рассмотренных ситуациях заболевание проявляется как спорадический случай, а риск повторного появления мутантной хромосомы у братьев-сестер пробанда не отличается от общепопуляционного.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Существуют различные методы, позволяющие выявлять генетические мутации. Блоттинг по Саузерну, описанный выше, используют для определения крупных геномных мутаций. В других методах применяют ПЦР-амплифицированную или клонированную ДНК Мутации могут быть обнаружены непосредственно с помощью секвенирования (определения первичной структуры макромолекул ДНК) или с использованием радиоизотопных и флюоресцентных систем.
Они также могут быть выявлены при сравнении последовательности опухолевой ДНК с ДНК, выделенной из нормальных тканей, или путем сравнения с последовательностью нормальной ДНК, описанной в литературе (например, в базах данных, размещенных в Интернете).
Анализ конформационного полиморфизма одноцепочечной ДНК — радиоизотопная методика определения мутаций, основанная на изменении формы (конформации) мутантной ДНК, которые могут быть выявлены при электрофорезе. Для этого нормальную и опухолевую ДНК клонируют с помощью ПЦР, денатурируют и исследуют с помощью гель-электрофреза. Мутантная ДНК меняет свою конформацию, принимая форму, отличную от нормальной, и приобретает отличную от нормальной подвижность при электрофорезе.
Эти изменения легко определяются при радиоавтографии. Рисунок ниже иллюстрирует методику анализа конформационного полиморфизма одноцепочечной (однонитевой) ДНК.
Виды и механизмы генных мутаций
Денатурационная высокоэффективная жидкостная хроматография — новый метод выявления мутаций, не требующий применения радиоактивных веществ. При этом исследовании нормальную и опухолевую ДНК амплифицируют (клонируют) с помощью ПЦР, смешивают и денатурируют для образования смеси одноцепочечных молекул ДНК. Затем проводится медленный отжиг, в результате которого вновь образуется двунитевая ДНК.
При спаривании нити нормальной ДНК с нитью опухолевой в месте мутации происходит нарушение спаривания — так называемый гетеродуплскс. Этот гетеродуплекс обладает температурой плавления, отличающейся от таковой для нормальной и опухолевой ДНК, т. с. гомодуплексных молекул, и благодаря этому его можно легко определить с помощью хроматографии.
Другие методы выявления мутаций — денатурирующий градиентный гель-электрофорез, аллель-специфический олигонуклеотидный анализ и аллель-специфическая амплификация — основаны на выявлении разницы в последовательностях нормальной и опухолевой ДНК.

Каждый из этих методов (за исключением прямого секвенирования) представляет собой средство скрининга на наличие мутации, но не определяет ее тип или характер нарушения последовательности. В настоящее время разработаны приборы и методы, позволяющие исследовать крупные фрагменты генома и экспоненциально повышающие наши возможности в выявлении мутаций.
К ним относятся молекулярно-генетический анализ ДНК (microarray analysis) с помощью генных чипов, или биочипов, и трансгеномная система WAVE DNA Fragmentation Analysis System, разработанная в Калифорнии компанией Transgenomic.
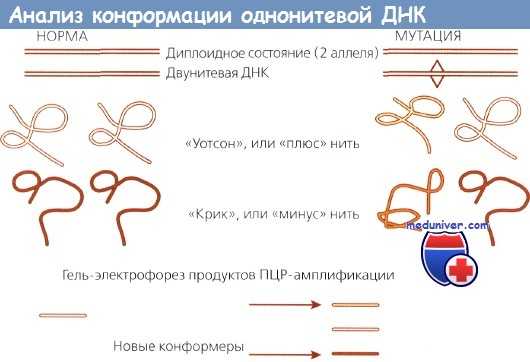
Анализ конформации однонитевой ДНК.
Слева - нормальные аллели имеют одинаковую последовательность и, соответственно, одинаковую конформацию, образуют две одинаковые полоски.
Справа представлен мутантный аллель. Темный и светлый отрезки имеют несколько различающуюся последовательность и в связи с этим мигрируют в геле с разной скоростью.
В результате образуются четыре полоски. Эта техника чувствительна для определения различий в несколько пар оснований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Основные подходы к пренатальной диагностике генных болезней. Прямая диагностика генных аномалий.
Методы молекулярной диагностики — продукт и основной инструмент анализа первичной структуры, т.е. последовательности нуклеотидов в молекуле ДНК — основы генома (наследственного аппарата) человека. Первый этап грандиозной Международной научной программы по расшифровке молекулярной структуры ДНК человека был завершен в 2000 г. созданием «чернового варианта генома человека». В настоящем разделе мы ограничимся изложением лишь основных принципов ДНК-методов. Более детально с техникой молекулярных исследований можно ознакомиться в специальных монографиях и руководствах.
Основу методов ДНК-диагностики, направленных на идентификацию мутаций или молекулярное маркирование мутантных хромосом, составляет полимеразная цепная реакция синтеза ДНК (ПЦР). Исторически более ранний метод блот-гибридизации по Саузерну в настоящее время применяется значительно реже, хотя и используется для идентификации некоторых мутаций, прежде всего динамических мутаций», ведущих к болезням экспансии (синдром ломкой Х-хромосомы, миотоническаядистрофия, хорея Гентингтона, ряд нейродегенеративных заболеваний), а также гемофилии А и некоторых других заболеваний.
Метод ПЦР предложен в 1983 г. американским исследователем Карри Муллисом, удостоенным за это открытие Нобелевской премии в 1993 г. Метод позволяет избирательно синтезировать (амплифицировать) in vitro относительно небольшие участки ДНК, длиной от нескольких десятков до нескольких тысяч пар нуклеотидов, используя в качестве матрицы любые образцы ДНК, содержащие амплифицируемую последовательность.
Необходимым условием для проведения ПЦР является знание нуклеотидной последовательности амплифицируемой области ДНК, так как специфический выбор этого участка осуществляют путем гибридизации матричной ДНК с двумя искусственно синтезированными праймерами - олигонуклеотидными последовательностями ДНК, обычно длиной от 15 до 30 п.о., комплементарными 3'-концам амплифицируемого участка на смысловой и антисмысловой нитях ДНК соответственно. Расстояние между праймерами определяет длину синтезируемых молекул. Подробно с техникой постановки ПЦР можно ознакомиться в руководствах.
Метод ПЦР стал одним из основных в молекулярной диагностике наследственных болезней. Разработаны и широко используются на практике различные варианты этого метода, позволяющие быстро и эффективно идентифицировать мутации, изучать ДНК-полиморфизмы, применяемые для молекулярного маркирования мутантных хромосом.
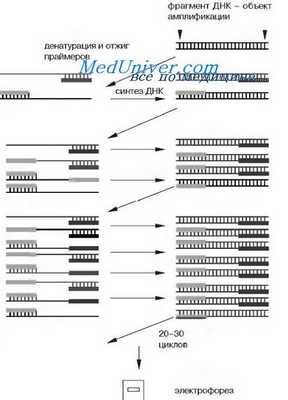
Принципиальная схема полимеразной цепной реакции
В настоящее время существуют два основных подхода к пренатальной диагностике, как и вообще к диагностике генных болезней:
- прямая диагностика, основанная на непосредственной идентификации мутаций в определенном гене;
— косвенная (непрямая) диагностика, в основе которой лежит маркирование мутантного гена (иногда называемая маркированием «больной» хромосомы, несущей мутантный ген) с помощью молекулярных маркеров.
Прямая диагностика генных аномалий
Основу прямой диагностики составляет идентификация мутаций в самом гене. Преимущества метода - высокая (приближающаяся к 100%) точность диагностики, возможность проведения ПД, а также анализа информативности (пригодности для молекулярной диагностики) семьи и выявления гетерозиготных носителей при отсутствии больного ребенка.
При отсутствии мажорных мутаций гена требуется детальный молекулярный анализ (сканирование) первичной структуры гена с целью обнаружения мутаций, что можно отнести к недостаткам метода.
В основе любого моногенного заболевания лежат нарушения функций гена, вызванные различными мутациями в его смысловой части, т.е. в последовательности гена, кодирующей синтез белка (кДНК). Тип и спектры мутаций, как и их фенотипическое выражение (тяжесть заболевания) специфичны для каждого гена и в значительной степени определяются уникальными особенностями его первичной структуры (последовательностью нуклеотидов).
Известно также, что частота разных мутаций в каждом гене различна. Существуют часто встречающиеся «мажорные» мутации, диагностическая ценность которых особенно высока, и «минорные» (единичные спорадические), регистрирующиеся крайне редко. Для многих генов, ответственных за наследственные заболевания, спектры мутации хорошо изучены и разработаны оптимальные алгоритмы их идентификации. Так, например, мажорной для гена муковисцидоза является мутация delF508, встречающаяся почти в 50% всех мутантных хромосом у больных муковисцидозом в России, для гена фенилаланингидроксилазы — это мутация R408W, обнаруженная у45% больных фенилкетонурией в России, для гена дистрофина характерны достаточно протяженные делеции, регистрируемые в 60% Х-хромосом у больных миодистрофией Дюшенна и т.д.
Более подробно алгоритмы молекулярной диагностики различных моногенных болезней приведены в специальных руководствах, обзорах.
Генетические нарушения у человека и методы их выявления

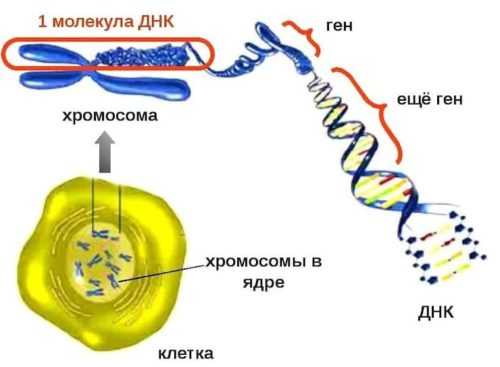
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения.
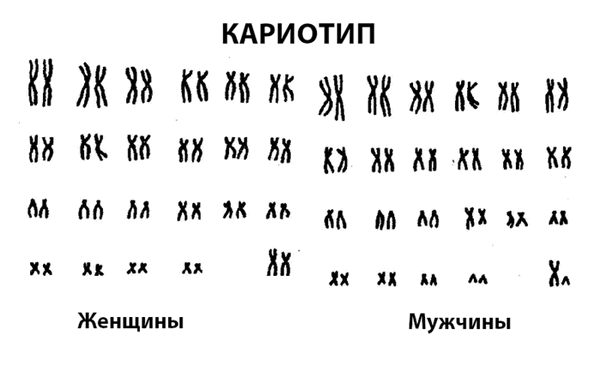
Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута – ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая – Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе – изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
- Хромосомные аберрации – нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).
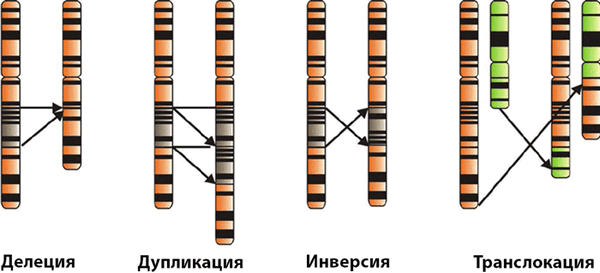
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:
- микроделеции и микродупликации, когда утрачивается или дублируется очень маленький участок хромосомы;
- болезни обмена, вызванные нарушением последовательности «букв» генетического кода в отдельных генах;
- митохондриальные заболевания, связанные с нарушениями в генетическом материале митохондрий;
- низкопроцентный мозаицизм, когда клеток с неправильным кариотипом очень мало;
- мутации в отдельных генах, которые не приводят к изменению внешнего вида хромосом;
- эпигенетические расстройства, при которых структура хромосом и генов не меняется, но изменяется их функция.
Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности – утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами – о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
- сбалансированные хромосомные аномалии, когда в хромосомах происходят изменения, которые не приводят к добавлению или утрате генетического материала. К ним относятся инверсии (разворот участка хромосомы на 180 градусов), реципрокные транслокации (обмен участками между хромосомами), небольшие инсерции (вставки в хромосомах);
- мозаицизм, если клеток с нарушениями в кариотипе менее 15%;
- CNV (copy number variation) – повторы небольших участков генома;
- точечные мутации – замены отдельных «букв» генетического кода;
- экспансия (увеличение) повторов коротких участков в ДНК;
- аномалии метилирования – присоединения особых метильных групп к определенным участкам ДНК, которые меняют активность генов.
Мутации в генах и заболевания, к которым они способны приводить
Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови.
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
- Доминантные гены. Выражаясь простым языком, эти гены более «сильные». Если в клетках присутствует хотя бы одна копия такого гена, его признаки проявятся.
- Рецессивные гены «слабее» доминантных. Если у человека одна копия гена доминантная и одна рецессивная, – проявится признак доминантной. А для проявления рецессивного признака нужно две соответствующих копий.

Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.

Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона – когда берут клетки из плаценты;
- амниоцентез – когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Читайте также:
