Миелома и плазмоцитома позвоночника - лечение, прогноз
Добавил пользователь Алексей Ф. Обновлено: 18.01.2026
Миелома — зло злокачественная опухоль, которая происходит из клеток лимфоидной ткани, а если быть точным — из плазматических клеток. Для нее характерны следующие признаки:
- Инфильтрация костного мозга злокачественным клоном плазматических клеток. В норме в костном мозге располагается около 5 % плазмоцитов, но при миеломе их количество превышает 10%.
- В костях возникают очаги деструкции — из-за токсического действия опухолевых клеток происходит расплавление костной ткани. Это могут быть единичные очаги, либо диффузное поражение.
- В крови и моче обнаруживается специфический белок. У него много названий — М-белок, М-градиент, М-протеин, М-компонент и др. Это моноклональный иммуноглобулин, который имеет высокую молекулярную массу и негативно влияет на весь организм.
Причины миеломной болезни
Причиной миеломы является злокачественное перерождение клеток-предшественниц В-лимфоцитов, при этом образуются специфические мутации. Причины образования данных мутаций пока неизвестны. Пока речь идет только о факторах риска, при наличии которых вероятность развития заболевания увеличивается:
- Мужской пол.
- Возраст старше 40 лет.
- Негроидная раса.
- Наличие в анамнезе моноклональной гаммапатии. У 1% таких пациентов обязательно развивается миелома.
- Наличие вторичных иммунодефицитных состояний. К вторичным иммунодефицитам приводит иммуносупрессивная терапия, показанная при трансплантации органов, химиотерапия при злокачественных заболеваниях, ВИЧ и др.
- Наличие миеломы у кровных родственников.
- Наличие в анамнезе радиационного воздействия, в том числе прохождение лучевой терапии.
Виды миеломы
Миелома представляет разнородную группу заболеваний, часть из которых могут долгое время протекать относительно доброкачественно, а другие приводят к быстрому ухудшению состояния больного.
- Симптоматическая миелома. В данном случае имеется развернутая клиническая картина заболевания, с наличием характерных симптомов и признаков, полученных с помощью инструментального обследования.
- Вялотекущая, или тлеющая миелома. При ней нет повреждения костей, но в плазме крови обнаруживается М-протеин в концентрациях, превышающих 30г/л, или в костном мозге количество плазматических клеток превышает 10%.
- Плазмоцитома. Имеется единичный очаг миеломы в костях (солитарная плазмоцитома), либо во внутренних органах — экстрамедуллярная плазмоцитома.
Есть также редкие варианты множественной миеломы:
- Несекретирующая миелома.
- Биклональная миелома.
- Плазмоклеточный лейкоз и др.
Стадии болезни
1 стадия. Имеется анемия легкой степени (гемоглобин не менее 100г/л), кальций остается в норме, количество очагов остеодеструкции не превышает 5, уровень М-протеина низкий.

2 стадия. Анемия усугубляется, гемоглобин может опуститься до 85г/л, повышается уровень кальция до 3 ммоль/л, увеличивается количество очагов расплавления кости (их уже более 5, но менее 20), повышается уровень М-белка, а в моче определяется протеин Бенс-Джонса в количестве 4-12 г/сутки.
3 стадия выставляется, когда есть хотя бы один из следующих признаков:
- Тяжелая анемия, при которой гемоглобин не превышает 85 г/л.
- Уровень кальция в сыворотке крови превышает 3 ммоль/л.
- Уровень М-протеина более 70 г/л.
- Более 30 остеолитических очагов.
Проявления и осложнения миеломы
Проявление заболевания зависит от его стадии. В некоторых случаях оно может никак не проявлять себя, но по мере нарастания опухолевой массы, заболевание будет прогрессировать. При миеломе возникают следующие симптомы:
- Боли в костях. Сначала они носят периодический характер, могут возникать при изменении положения тела. По мере прогрессирования остеодеструкции, боль становится постоянной и очень сильной. В ряде случаев ее характеризуют как нестерпимую.
- Патологические переломы. Возникают без действия выраженного травмирующего фактора. Поскольку при миеломе происходит остеолизис и резорбция кости, нередки спонтанные переломы. Наиболее опасны переломы позвоночника, поскольку они могут приводить к параличам и парезам.
- При потере костной массы происходит «проседание» позвонков, которое сопровождается ущемлением корешков спинномозговых нервов и развитием неврологической симптоматики — боли, парезы, чувство онемения и даже параличи.
- Увеличение кальция в крови (за счет его выхода из костной ткани). При этом наблюдается тошнота, рвота и общая слабость. При выраженной гиперкальциемии может возникнуть спутанность сознания, сопор и даже кома.
- Поражение почек. М-белок имеет большую молекулярную массу, поэтому «забивает» почечные канальцы, что приводит к развитию почечной недостаточности. Ситуацию усугубляет гиперкальциемия, амилоидоз и инфекционные осложнения, которые характерны для миеломы.
- Когда М-белок в крови превышает 50г/л, развивается синдром гипервязкости крови. Он характеризуется кровотечениями, нарушением зрения и сознания.
- Симптомы, характерные для угнетения мозгового кроветворения: анемии, инфекции, кровотечения.
Рецидивируют ли миеломы
К сожалению, на сегодняшний день миелома является неизлечимым заболеванием. Даже после самого мощного лечения — тандемной высокодозной полихимиотерапии с трансплантацией стволовых клеток все равно развивается рецидив. Задача лечения отсрочить его развитие и затормозить прогрессирование заболевания.
Диагностика миеломы
- Лабораторные анализы:
- Общий анализ крови — определение уровня гемоглобина, подсчет лейкоцитарной формулы. Характерным, но не ключевым признаком миеломы является значительное увеличение СОЭ, у 70% больных оно превышает 30 мм/час, у отдельных пациентов — 100мм/час.
- Анализ мочи — определение уровня общего белка и М-протеина в частности.
- Биопсия костного мозга. Проводится подсчет миелограммы с определением процентного количества плазматических клеток, а также молекулярно-генетические тесты, которые позволяют выявить характерные для миеломы мутации.
- Иммунофенотипирование — позволяет выявить клон опухолевых клеток в пунктате костного мозга.
- Рентгенологические методы исследования, в частности рентген костей или компьютерная томография костей. Эти исследования позволяют выявить очаги остеодеструкции и определить их количество.
- МРТ проводится при наличии неврологической симптоматики для оценки поражения корешков спинномозговых нервов опухолевой массой или разрушенным позвонком. Также МРТ является обязательным исследованием при подозрении на солитарную миелому костей.

Лечение
На сегодняшний день лекарств, которые могли бы полностью излечить миелому, нет. Основные усилия направлены на достижение ремиссии и ее пролонгирование. Схема лечения миеломы будет определяться возрастом пациента и его состоянием. Используется несколько подходов к терапии:
- Стандартная химиотерапия с использованием мелфалана, преднизолона и бортезомиба. Такое лечение миеломы показано ослабленным пациентам и людям старше 65 лет, которые не смогут перенести более серьезное лечение. Для пациентов с тяжелой почечной недостаточностью проводят лечение с использованием бортезомиба и дексаметазона. В ряде случаев дексаметазон можно заменить на преднизолон, чтобы снизить токсическое действие. Также используются схемы лечения, включающие талидомид.
- Высокодозная полихимиотерапия. Наилучшие результаты достигаются при применении высокодозной полихимиотерапии (ВПХ) с последующей трансплантацией гемопоэтических стволовых клеток (ТГСК). Такое лечение показано пациентам младше 65 лет, а также пациентам 65- 70 лет при удовлетворительном состоянии и отсутствии противопоказаний. Возрастные ограничения обусловлены высокими рисками трансплантат-ассоциированной летальности, которая в данном случае может достигать 8%. Почечная недостаточность, даже в терминальной стадии, не является противопоказанием к ВПХ с аутотрансплантацией стволовых клеток при наличии в центре возможностей для проведения гемодиализа.
Схема лечения ВПХТ включает несколько этапов:
1 этап индукционный. На этапе индукции ремиссии рекомендуется применять трехкомпонентные схемы, не включающие мелфарман. Обычно это схемы PAD и VCD, но может использоваться и VD. При достижении полной ремиссии или очень хорошей ремиссии, пациенты направляются в трансплантационный центр для проведения ТГСК. Если опухоль оказалась резистентной, назначают терапию второй линии. Если и после нее нет хорошего эффекта, рассматривают вариант высокодозной полихимиотерапии.

2 этап лечения — трансплантационный. Он, в свою очередь, состоит из нескольких этапов:
- Мобилизация гемопоэтических стволовых клеток (ГСК). На этом этапе необходимо собрать, выделить и заготовить достаточное количество CD 34+. Обычно их выделяют из крови (периферические ГСК), но при необходимости допускается забор из костного мозга. Для мобилизации СК применяется химиотерапия циклофосфаном + гранулоцитарный колониестимулирующий фактор (он провоцирует пролиферацию стволовых клеток). Если не удалось собрать достаточное количество СК, или при проведении повторной мобилизации, вместо циклофосфана используют плериксафор.
- Предтрансплантационное кондиционирование. Этот этап должен начинаться не позже 6 недель после забора ГСК. Его целью является улучшение качества противоопухолевого ответа, которого добились на индукционном этапе. Кондиционирование проводится с использованием высоких доз мелфалана.
- После этого проводится ТГСК, которая для пациента выглядит, как обычное переливание крови.
- При миеломе лечение может включать две ТГСК. Такой режим называется тандемная ТГСК. При этом, повторная трансплантация планируется в период 3-6 месяцев после первой (оптимальные сроки — 3 месяца). Особенно она актуальна для пациентов, не достигших полной ремиссии. Помимо трансплантации собственных СК, по показаниям могут применяться СК донора.
Поддерживающая терапия
Поддерживающая терапия назначается как после ТГСК, так и после стандартной ХТ. Ее целью является уничтожение остаточного клона миеломных клеток. Используется леналидомид или бортезомиб.
Хирургическое лечение при миеломе
Хирургическое лечение используется в качестве паллиативных вмешательств при патологических переломах, компрессии спинного мозга или корешков спинногмозговых нервов . С этой целью проводятся различные реконструктивные операции, призванные устранить компрессию и зафиксировать костные отломки в нужном положении. Также могут быть проведены профилактические операции, при которых кости укрепляют с помощью металлических конструкций, не дожидаясь их переломов.
В ряде случаев при солитарной плазмоцитоме операция может применяться как самостоятельное лечение.
Как узнать, что лечение работает
Для оценки эффективности лечения, разработаны специальные критерии, включающие определение плазматических клеток в костном мозге, М-белка в крови и моче, а также количество очагов остеодеструкции. По этим критериям выделяют следующие формы ответа:
- Полная ремиссия — количество ПК входит в норму и не превышает 5%, в сыворотке и моче отсутствует М-белок, нет новых очагов остеодеструкции.
- Почти полная ремиссия — критерии такие же, как у ПП, но при использовании иммунофиксации в моче определяется М-белок.
- Очень хорошая частичная ремиссия — М-белок в крови снижается на 90% от исходного уровня или определяется только с помощью иммунофиксации.
- Частичная ремиссия — М-белок в крови снижается на 50% от исходного уровня, в моче — на 90%. Если это солитарная плазмоцитома, очаги также должны уменьшится на 50%.
Также могут быть варианты минимального ответа, стабилизации процесса, прогрессирования и развития рецидива.
Что будет, если лечение не дает результатов
Если опухоль резистентна к терапии первой линии, используют препараты второй линии с другим механизмом действия. Например, если в первой схеме применялся бортезумаб, его меняют на леналидомид.
При развитии рецидивов, возможно назначение ХТ первой линии, а также использование препаратов с более высокой противоопухолевой активностью в отношении миеломы — помалидомид, карфилзомиб и др.

Побочные эффекты от лечения миеломы
Побочные эффекты при лечении миеломы аналогичны таковым при любой химиотерапии. Сюда входят:
- Тошнота.
- Рвота.
- Общая слабость.
- Общетоксическое действие.
- Диареи.
- Анемии.
- Иммунодефициты.
- Кровотечения.
Боль при миеломе
Костные боли при миеломе являются очень серьезной проблемой. Для их купирования и предупреждения дальнейшей резорбции кости применяют бисфосфонаты. Препаратом выбора является золедроновая кислота. Также для устранения боли используется лучевая терапия и сильные анальгетики, вплоть до наркотических препаратов.
Продолжительность жизни при болезни
Продолжительность жизни определяется формой заболевания, его стадией и ответом на лечение. Тлеющая миелома может годами не прогрессировать и не угрожать жизни пациента. При активной миеломе средняя продолжительность жизни при 1 стадии составляет 6-7 лет, при 2 стадии — 3-4 года, при 3 — 2 года.
Миелома и плазмоцитома позвоночника - лечение, прогноз
Плазмацитома и множественная миелома являются наиболее распространенными первичными злокачественными опухолями позвоночника. Kelley et al., проанализировав данные регистра опухолей за 42-летний период, пришли к выводу, что плазмацитома и множественная миелома составляют 26% всех первичных злокачественных опухолей позвоночника.
Плазмацитома — это одиночное поражение, ограниченное 1-2 очагами, тогда как множественная миелома — это более системное поражение. И та, и другая опухоль являются В-клеточными лимфопролиферативными заболеваниями; мужчины болеют в два раза чаще женщин, пик заболеваемости приходится на возраст 55 лет. Поражаются чаще задние костные элементы позвонков и чаще на уровне грудного отдела позвоночника.
Первичное обследование пациента должно включать обзорную рентгенографию, КТ и МРТ позвоночника. Стандартная рентгенография позволяет оценить выраженность остеолиза, выявить рентгенопрозрачные зоны резорбции. КТ и МРТ помогут определить, соответственно, границы костной деструкции и степень компрессии нервных образований. Иммуноэлектрофорез белков сыворотки крови и мочи позволяет выявить наличие в этих субстратах патологических белков Бенс-Джонса, позволяющих поставить правильный диагноз.
При наличии признаков неврологического дефицита или нестабильности позвоночника хирургическое лечение может заключаться в декомпрессии и/или стабилизации позвоночника. Вертебропластика и кифопластика при данном заболевании применяются при патологических компрессионных переломах, сопровождающихся выраженным болевыми синдромом, без неврологического дефицита и во избежание экстравазации цемента при условии состоятельности задней покровной пластинки тела позвонка.
Тем не менее, начальной терапией выбора у этих пациентов являются лучевая терапия и химиотерапия. Усиление активности остеокластов и снижение активности остеобластов у пациентов с миеломой приводят к усилению костной резорбции и снижению костеобразования.
Стандартом лечения в настоящее время является назначение бисфосфонатов, например, памидроната или золендроновой кислоты, способствующих замедлению процесса костной резорбции. Также могут назначаться костные анаболики, например, бортезомиб,— мишенью этих препаратов являются остеобласты, их применение позволяет замедлить процесс распространения опухоли и улучшить состояние костной ткани в целом. При системном поражении скелета назначается химиотерапия, возможна трансплантация костного мозга.
При солитарных плазмацитомах на фоне лучевой терапии с резекцией очага или без таковой пятилетняя выживаемость пациентов составляет около 60%. Однако эти опухоли в 55-60% в течение ближайших пяти лет трансформируются в множественную миелому, которая в отсутствие лечения приводит к гибели в среднем в течение полугода.
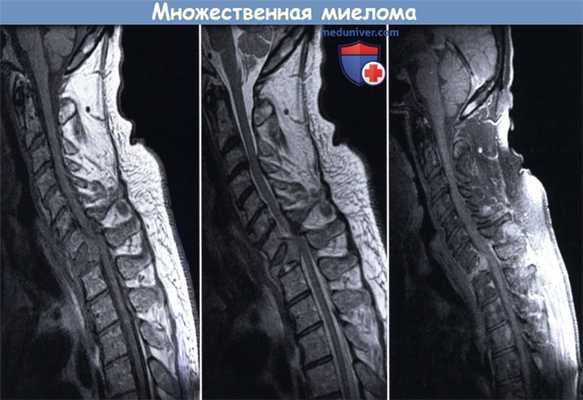
Сагиттальные МР-сканы в режиме Т1 (слева), Т2 (в центре) и Т1 с контрастным усилением (справа) пациента с множественной миеломой:
отмечается, соответственно, гипо- и изоинтенсивность сигнала, несколько гиперинтенсивный сигнал и усиление сигнала за счет контрастирования очага миеломы,
распространяющегося эпидурально и вызывающего компрессию спинного мозга.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника и диагностика миеломы
В течение многих лет болезнь может протекать бессимптомно. Общая слабость, боли в костях, анорексия и другие симптомы развиваются на почве усиленной пролиферации малигнизированных плазматических клеток, образования аномального Ig или гиперкальциемии.
В основном больные жалуются на боли в костях. Примерно у двух третей из них отмечаются различные аномалии скелета. Характерная тупая боль развивается преимущественно в позвоночнике, ребрах или в тазовых костях. Для больных характерны патологические переломы, и нередко первым признаком миеломы является острая боль в спине, возникающая вследствие перелома тела позвонка. Это приводит к развитию острой компрессии позвоночника.
На поздней стадии развития, множественная миелома является наиболее болезненным из всех раков. Из-за многочисленных инфильтратов позвоночник и длинные кости во многих местах становятся ломкими.
На рентгенограмме обычно видна распространенная остеопения или остеопороз (особенно в спинном и поясничном отделах позвоночника, а также в крестцово-подвздошной области) и характерные остеолитические повреждения, иногда с признаками незначительного склероза.
Всегда необходимо проводить полное ренггенографическое обследование скелета, в результате которого часто обнаруживаются скрытые повреждения костей. Наряду с поражением ребер, позвонков и тазовых костей, обычно поражаются и кости черепа, причем это не сопровождается какой-либо симптоматикой до тех пор, пока поражение не принимает обширный характер.
Анализ биоптатов поврежденных участков показывает их инфильтрацию аномальными плазматическими клетками.
Многие больные жалуются на быструю утомляемость и общую слабость, вызванную анемией. Из-за ослабления иммунитета у больных отмечаются периодические бактериальные инфекции. Тошнота, анорексия и обезвоживание организма могут развиться на почве гиперкальциемии, которая приводит к нарушению функции почек.
Синдром гипервязкости характерен для тех больных, у которых за счет повышения уровня аномального Ig происходит увеличение вязкости плазмы крови. Наиболее часто он проявляется при макроглобулинемии Вальденстрема, но нередко характерен для больных миеломой, особенно в случаях IgA, IgM и IgG3 парапротеинемии.

Для синдрома гипервязкости характерна неврологическая симптоматика, обычно головокружение, спутанность сознания и кратковременные приступы ишемии. Кроме того, наблюдается ретинопатия, вызванная растяжением сосудов сетчатки, геморрагии и па-пиллоэдема, а также гиперволемия на фоне возросшего сопротивления сосудов. Часто начинается кровотечение, обусловленные тромбоцитопенией и нарушением системы свертывания крови под влиянием парапротеина.
Клинически они проявляются в виде пурпуры, эпистаксиса, кровоточивости слизистых и кровоизлияниями в сетчатку. Может наблюдаться положительная проба Гесса, снижение тромбоплас-тинового времени и нарушение ретракции кровяного сгустка.
Наряду с компрессией позвоночника, происходящей при поражении позвонков миеломой, у больных также отмечаются другие неврологические осложнения. Поражение спинномозговых нервов на выходе из межпозвонкового отверстия свидетельствует об экстрадуральном распространении опухолевого процесса. При поражении мягких тканей в области глазниц или основания черепа может развиться проптоз или паралич черепного нерва.
Инфильтрация амилоидом может привести к синдрому запястного канала. Нарушение метаболизма фолиевой кислоты может вызывать развитие мегалобластной анемии, хотя у многих больных отмечается макроцитоз неизвестной этиологии и без признаков мегалобластных изменений. Больные жалуются на постоянные инфекционные заболевания, что характерно для миеломы. Инфекции развиваются на почве лейкопении, и недостатка нормальных иммуноглобулинов.
Даже после «успешного» лечения аномальный иммуноглобулин не становится функционально-полноценным, хотя уровень его снижается. У некоторых больных наблюдается нарушение процессов фагоцитоза и клеточного иммунитета.
В результате увеличения содержания белков может возрастать объем плазмы. Это способствует развитию анемии, даже если количество красных клеток крови не очень отличается от нормы. Увеличение СОЭ и их агрегации (по скорости образования «монетных столбиков»), характерные для миеломы, связаны с адсорбцией белка М на поверхности этих клеток.
Обычно значение СОЭ у больных превышает 80 мм/ч. Почти всегда происходит поражение костного мозга, хотя при постановке диагноза целесообразно подтвердить это анализом пунктата. Аномальные плазматические клетки могут составлять до 95% популяции ядерных клеток. Практическая рекомендация: многие гематологи не советуют делать пункцию грудины у больных миеломой.
Это связано с повышенной ломкостью костей и опасностью случайного проникновения в область средостения.
Обычно у больных отмечается гиперкальциемия. Она обусловлена разрушением костей при пролиферации аномальных плазматических клеток, хотя известны и другие факторы, активирующие остеокласты. У многих больных обнаружен фактор, активирующий остеокласты. Примерно у трети больных при постановке диагноза в крови обнаруживается повышенный уровень кальция, и при дальнейшем протекании болезни у них развивается гиперкальциемия.
Действительно, миелома — это такое заболевание, которое особенно часто приводит к глубокой и устойчивой к лечению гиперкальциемии, нередко настолько тяжелой, что могут потребоваться срочные меры. К числу характерных симптомов относятся полиурия, полидипсия, запоры, тошнота и рвота, общее обезвоживание организма, а также психические расстройства. Нередко наблюдается гиперкальциурия.
Крайне часто нарушается функция почек. Если развилась гиперкальциемия и нарушилась функция почек, то возникает порочный круг: происходит дальнейшее усиление почечной дисфункции, гиперкальциемии и потери воды. Также снижается скорость фильтрации через почечные клубочки, и увеличивается обструкция канальцев за счет белковых отложений легких цепей. Все это требует срочного медицинского вмешательства, и методы лечения в отдельной статье на сайте далее.
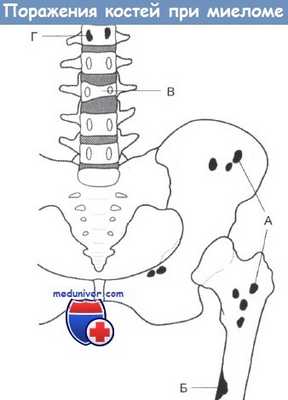
А Типичные повреждения, имеющие характер множественных округлых полупрозрачных пятен без признаков склероза
Б Некоторые повреждения могут достигать значительных размеров и часто вызывают ломкость длинных костей
В Нередко наблюдается остеопороз и разрушение позвонков
Г Исчезновение ножки дуги позвонка - признак инфильтрации, который при осмотре нередко пропускают
При проявлении типичных признаков, таких как поражение костей и костного мозга, анемия, парапротеинемия, гиперкальциемия и присутствие белков Бенc-Джонса, диагноз не представляет затруднений. При менее явной клинической картине необходимо провести дифференциальную диагностику и обратить внимание на следующее.
1. Наличие заболеваний, вызывающих анемию, боли в костях и гиперкальциемию, например метастазирующий рак.
2. Наличие заболеваний, вызывающих перапротеинемию, например МГНЗ, недиагносцированная первичная опухоль, макроглобулинемия Вальденстрема или лимфома.
3. Наличие заболеваний, приводящих к литическому разрушению костной ткани, например карциномы молочной или щитовидной железы, или бронхиальной карциномы.
4. Наличие заболеваний, приводящих к сдавлению позвоночника, таких как метастазирующий рак.
5. Наличие заболеваний, вызывающих анемию и увеличение СОЭ, например болезни соединительной ткани, онкологические и инфекционные заболевания. Следует обратить внимание на такие инфекции, при которых образуются холодовые агглютинины, например на инфекции, вызываемые микоплазмой и на инфекционный мононуклеоз. Правда такие больные обычно бывают молодого возраста.
6. Солитарная плазмацитома.
7. Первичный амилоидоз, который может сопровождаться плазмацитозом в костном мозге, а также протеинурией.
Постановка диагноза затрудняется в случаях незначительных поражений костного мозга, отсутствия парапротеина или при наличии на рентгенограмме единственного поражения кости. В сомнительных случаях можно повторить исследование костного мозга. В то же время, при отсутствии показаний к лечению, следует выбрать тактику выжидательного наблюдения, которая может помочь поставить диагноз.
В некоторых случаях с помощью антител к легкой и тяжелой цепям иммуноглобулина можно обнаружить моноклональность и исключить «реактивный» плазмацитоз.
Патологии, сопровождающиеся моноклональной гаммаглобулинемией, отличные от миеломы:
I. Моноклональные гаммапатии, неизвестного значения
II.Онкологические заболевания лимфоидного и нелимфоидного происхождения:
- Карцинома молочной железы, желудочно-кишечного тракта, яичников, мочевого пузыря, предстательной железы и других органов
- Саркомы мягких тканей
- Меланома
- Неходжкинская лимфома
- Макроглобулинемия Вальденстрема
III. Аутоиммунные заболевания:
- Ревматоидный артрит
- Нодозный полиартериит
Патологические состояния, сопровождающиеся макроглобулинемией:
I. Незлокачественной природы:
- Доброкачественная макроглобулинемия
- Синдром холодовой агглютинации
II. Злокачественной природы:
- Макроглобулинемия Вальденстрема
- IgM миелома
- Неходжкинская лимфома
- Хронический лимфолейкоз
Химиотерапия миеломы и ее эффективность
Если у больного миеломой проявляются такие опасные признаки заболевания, как обезвоживание организма, гиперкальциемия или сдавление позвоночника, то первичное лечение должно быть направлено на корректировку нарушений метаболизма или серьезного локального поражения. В этом случае, в первую очередь, следует использовать терапевтические методы, позволяющие восполнить потерю жидкости и нормализовать уровень кальция, а также локальное облучение, и в ряде случаев лиминэктомию.
Однако у большинства больных клинические симптомы развиваются медленно, и в отличие от описанных случаев, требующих неотложного вмешательства, врач имеет достаточно времени для того, чтобы до начала лечения подтвердить предварительный диагноз.
Несмотря на успехи, достигнутые в последнее время в области разработки лекарственных средств, все еще достаточно часто используется традиционный препарат мелфалан, который назначается перорально. Особенно часто мелфалан выписывают пожилым или ослабленным больным. В результате лечения средняя выживаемость больных увеличивается с 6-12 месяцев (без лечения) до 2-3 лет. Доза препарата варьирует от 6 до 10 мг/м2. Мелфалан назначается в течение 4-7 дней через каждые 46 недель.
Обычно больные хорошо переносят пероральное назначение мелфалана и преднизолона, однако со временем у них увеличивается риск развития острого миелобластного лейкоза, что связано с длительным лечением мелфаланом.
У большинства больных (более 80%) лекарственное лечение приводит к снижению симптоматики, особенно болей, слабости и гиперкальциемии. Обычно уровень парапротеина снижается после первых трех циклов приема препаратов, однако восстановление функциональных свойств нормальных иммуноглобулинов обычно требует длительного времени и происходит не всегда. Другие показатели, такие как уровень гемоглобина, альбумина и мочевины в крови, как правило возвращаются к уровню нормы, и их можно использовать для наблюдения за ходом лечения.

Если больные хорошо реагируют на химиотерапию, то после проведения 6-9 курсов нет необходимости продолжать лечение, поскольку оно не приводит к увеличению лечебного эффекта. К этому времени у них достигается «фаза плато», в течение которой уровень парапротеина более не снижается, и поэтому лечение можно не продолжать. В случае, если болезнь прогрессирует, необходимо выбрать другую тактику лечения.
В течение последних 15 лет велись поиски таких средств лекарственного лечения, которые позволили бы добиться продолжительной ремиссии у большинства больных, а также увеличить их выживаемость. Было испытано много химиотерапевтических рецептур. Обычно в их состав входят алкалоиды винки, различные алкилирующие агенты и доксорубицин, которые применяются совместно с преднизолоном и дексаметазоном, причем два последних компонента назначаются в высоких дозах. Иногда используют иммуномодуляторы, например левамизол (особенно в США) и а-интерферон.
Последний эффективен в лечении больных миеломой, хотя результаты остаются противоречивыми. Альтернативная, более удобная рецептура интенсивной терапии включает дексаметазон и идарубицин в высоких дозах, которые назначаются перорально, иногда вместе с талидоимидом. Так, рецептура, известная под названием Z-Dex, состоит из идарубицина 10 мг/м2, который назначается на 4 дня при ежедневном приеме, и дексаметазон, назначаемый на тот же срок в ежедневной дозе 40 мг. Курс лечения продолжается 3 недели. Хотя есть много данных о более высокой эффективности сложных рецептур, интенсивное (месячное) лечение мелфаланом и преднизолоном дает такие же результаты.
При этом у больных проявляется меньше побочных эффектов. Методы интенсивной терапии труднее использовать для лечения больных пожилого возраста, поскольку у них развивается много побочных эффектов. Для лечения с использованием одной из хорошо известных рецептур (VAD), состоящей из винкристина, доксорубицина (парентерально) и дексамета-зона (в больших дозах), больным требуется вводить катетер Хикмана. Кроме того, они должны долгое время находиться в стационаре, что делает процедуру гораздо менее удобной для широкого применения.
В то же время для больных молодого возраста подходят рецептуры более интенсивной терапии. К числу их относятся АВСМ (доксорубицин, ВХНМ, циклофосфамид и мелфалан), VAD или VMCP-VBAP (винкристин, циклофосфамид, мелфалан и преднизолон с периодической заменой на винкристин, ВХНМ, доксорубицин и преднизолон). В этой категории больных также оказались перспективными результаты лечения высокими дозами мелфалана, в том числе совместно с пересадкой аутологичного костного мозга (ВМТ). После проведения одного курса лечения по этой схеме примерно у трети больных отмечалась полная ремиссия, сопровождающаяся исчезновением малигнизированных плазматических клеток из костного мозга и нормализацией его функции, а также снижением содержания парапротеина до нулевого уровня.
Во многих случаях также восстанавливались функции иммунной системы, чего не наблюдается после применения стандартных схем лечения. В одном из клинических испытаний, проведенных во Франции, сравнивались результаты, полученные при использовании стандартной и интенсивной схем. Интенсивная схема лечения включала назначение препаратов в высоких дозах и пересадку аутологичного костного мозга. Интенсивная схема оказалась эффективной в 81% случаев (у 22% больных был получен 100%-й эффект). При назначении стандартной схемы лечебный эффект проявлялся у 57% больных и лишь у 5% он достигал 100%. Пятилетняя безболезненная выживаемость у больных, прошедших курс интенсивной терапии, составляла 52%, в то время как в группе, леченной по стандартной схеме, этот показатель не превышал 12%.
Эти впечатляющие данные, несомненно, коренным образом изменят существующие схемы лекарственного лечения миеломы, тем более, что для пациентов моложе 65-летнего возраста уже широко применяется пересадка аутологичных стволовых клеток. Пересадка аллогенного костного мозга (если найден подходящий донор) может оказаться эффективной для больных молодого возраста, хотя пока нет единого мнения по этому вопросу. Для предотвращения развития анемии стали чаще использовать эритропоэтин (ЭПО); это позволяет избежать многократных переливаний крови.
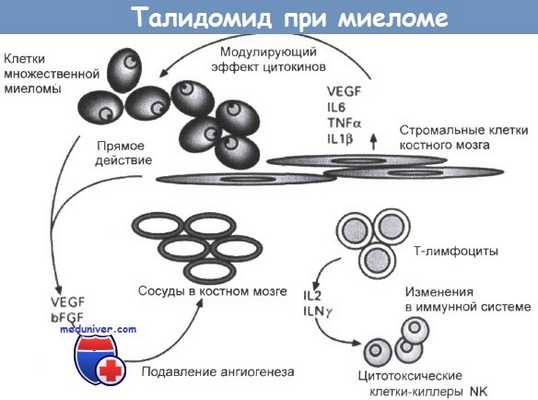
Предложенный механизм противоопухолевой активности талидоимида при его назначении больным с рецидивирующей множественной миеломой, устойчивой к химиотерапевтическим препаратам.
В таблице ниже обобщены все приведенные выше результаты по лекарственному лечению множественной миеломы с учетом противоречивых данных, полученных при пересадке костного мозга.
После прохождения курса первичного лечения необходимо тщательно наблюдать за больными, поскольку обычно лечение необходимо продолжать. Правда, в отдельных случаях повторный курс может потребоваться через много месяцев или лет. Если лечение оказалось эффективным и закончилось, то в случае рецидива целесообразно использовать прежнюю схему, которая часто оказывается столь же эффективной, как и при первичном лечении. При рецидивах в плазме крови обычно увеличивается содержание моноклонального Ig. Впрочем, у некоторых больных этого не происходит, однако у них снова развивается характерная симптоматика.
Если у больных наблюдается анемия, инфекции или болезненные поражения костей, то им следует назначить курс поддерживающей терапии, включающий антибиотики и переливание крови, или проводить паллиативное лечение.
При назначении курса повторной химиотерапии больным пожилого возраста всегда необходим взвешенный подход, и вначале следует убедиться в том, что схема первичного лечения не дает результатов. В последнее время в схему повторной химиотерапии для лечения больных с рецидивами миеломы включают талидоимид. Этому препарату с противоречивой характеристикой нашли новое применение. Талидоимид снижает уровень парапротеина в крови и моче, и его можно назначать перорально в ежедневной дозе 200 мг, причем для устойчивых больных доза может быть увеличена до 800 мг. В ряде случаев препарат применяют в составе рецептуры совместно с циклофосфамидом и дексаметазоном (CDT).
Талидоимид характеризуется умеренной токсичностью, по крайней мере, если назначается в дозах менее 600 мг. Этот антиангиогенный препарат перорального применения может использоваться в качестве поддерживающего средства при лечении миеломы, и сейчас проводятся соответствующие клинические испытания. На рисунке представлена схема, иллюстрирующая механизм цитотоксического действия талидоимида.
Вопросы и ответы по химиотерапии миеломы
| Вопрос | Ответ | Обоснование |
| Что лучше, плацебо или химиотерапия? | Уретан не лучше плацебо; циклофосфамид эффективнее плацебо | Два рандомизированных испытания на группе в 137 больных |
| Является ли мелфалан наиболее эффективным препаратом? | Лечение одним мелфаланом не выявило его преимуществ по критерию прироста выживаемости | Пять рандомизированных испытаний на группе, включавшей 1651 больного |
| Является ли сочетание мелфалана с преднизолоном более эффективным средством, чем один мелфалан? | Авторы исследования склоняются к утвердительному ответу, однако имеющиеся данные не подтверждают преимуществ комбинации по критерию выживаемости | Одно рандомизированное испытание, проведенное на группе из 183 больных |
| Является ли комбинированная химиотерапия более эффективной по сравнению с комбинацией мелфалан-преднизолон? | Различий по выживаемости не выявлено. На комбинированную химиотерапию реагировало большее количество больных | Данные из нескольких центров, полученные на 6633 больных, участвовавших в 27 испытаниях |
| Эффективен ли интерферон в лечении множественной миеломы? | Выживаемость без прогрессирования болезни увеличивается, однако это мало сказывается на общей выживаемости | Данные, полученные по каждому больному в группе, состоящей из 4012 больных, участвовавших в 24 испытаниях |
| Обладает ли раннее лечение больных на начальных стадиях заболевания какими-либо преимуществами по сравнению с их отложенным лечением | Лечение, начатое сразу после постановки диагноза, не приводит к увеличению выживаемости больных, или их восприимчивости к препаратам | Три рандомизированных исследования, проведенных на группе из 365 больных |
| Существуют ли терапевтические методы, которые можно назначать при неэффективности первичного лекарственного лечения? | Ни один из использованных методов не дал хороших результатов | Десять рандомизированных испытаний, проведенных на группе из 808 больных |
| Можно ли назначать интенсивную химиотерапию больным с нарушениями функции почек? | В обеих группах больных 3-летняя выживаемость была одинакова. Для больных с нарушениями почечной функции оптимальная доза мелфалана составляла 140 мг/м 2 | Результаты статистического анализа данных, полученных в группе из 126 человек, включая больных с почечными осложнениями и без них |
Миелома костей
Миелома костей — это не совсем верный термин. Так в народе называют множественную миелому — злокачественное заболевание, одним из симптомов которого является разрушение костной ткани, которое, соответственно, сопровождается возникновением сильных болей.
Заболевание начинает развиваться в костном мозге, который называют фабрикой по производству клеток крови. Одной из его популяций являются плазматические клетки — это зрелые В-лимфоциты, которые в норме должны продуцировать антитела, направленные на борьбу с инфекциями и опухолями. При злокачественном перерождении этих клеток развивается миелома костей, которая характеризуется следующими особенностями:
- Миеломные клетки начинают бесконтрольно размножаться и колонизировать костный мозг. Это приводит к вытеснению здоровых клеток, что сопровождается нарушением кроветворения со всеми вытекающими последствиями в виде анемий, иммунодефицитов и кровоточивости.
- Миеломные клетки продуцируют особый белок (М-белок), который системно действует на организм, приводя к поражению внутренних органов.
- Кроме того, миеломные клетки продуцируют вещества, которые способствуют локальному расплавлению кости и снижению плотности костной ткани.
Поражение костей при миеломе может быть представлено двумя вариантами:
- Единичные очаги остеолизиса. Такой вариант заболевания называется солитарная плазмоцитома.
- При множественной миеломе костей имеются множественные очаги остеодеструкции, количество которых постоянно увеличивается.
Симптомы множественной миеломы
Костные боли. На начальных этапах они не интенсивные, возникают при движениях и перемене положения тела. По мере развития миеломной болезни, боли становятся нестерпимыми и могут вызвать полную обездвиженность больного.
Из-за расплавления костей, в кровь поступает большое количество кальция, что приводит к явлениям интоксикации. Это сопровождается тошнотой, рвотой, кровотечениями, спутанностью сознания, вплоть до комы.
Из-за уменьшения плотности костей и очагов лизиса, возникают патологические переломы. Также по причине уменьшения плотности костей, происходит «проседание позвонков», что сопровождается неврологической симптоматикой — боли, парезы, параличи, чувство онемения и др.
При высоких показателях М-белка развивается синдром гипервязкости крови, для которого характерны кровотечения, нарушение зрения и сознания. Кроме того, такое состояние приводит к почечной недостаточности, которая характеризуется уменьшением количества выделяемой мочи, отеками. На терминальных стадиях происходит нарушение сознания.
Из-за нарушения кроветворения развиваются анемии, иммунодефициты и тромбоцитопении, что сопровождается инфекционными осложнениями, кровотечениями, слабостью и бледностью кожных покровов.
Классификация миеломы
Миелома — это разнородная группа заболеваний, часть из которых могут находиться годами в стабильном состоянии, другие — быстро прогрессируют.
- Плазмоцитома. Ей более всего подходит термин миелома костей. Она характеризуется единичными очагами остеодеструкции, хорошо поддается лечению и может существовать в стабильном состоянии в течение многих лет и даже десятилетий. Но у большинства больных она со временем диссеминирует по всему организму, трансформируясь во множественную миелому.
- Тлеющая миелома. При ней не обнаруживается поражение костей, но в костном мозге количество плазматических клеток превышает 10%, а в крови обнаруживается М-белок в значениях более 30 г/л. Такое состояние также может оставаться стабильным в течение нескольких лет.
- Симптоматическая миелома. Здесь уже имеется развернутая клиническая картина, заболевание характеризуется быстрым прогрессированием и неблагоприятным прогнозом.
Стадии миеломной болезни
1 стадия — характеризуется анемией легкой степени, кальций остается в пределах нормальных значений, М-протеин низкий, количество очагов поражения костей не более 5.

2 стадия. Анемия средней степени (гемоглобин в пределах 85-100 г/л), происходит увеличение кальция (до 3 ммоль/л) и М-белка. Также происходит увеличение количества очагов остеолизиса. Для второй стадии их количество не должно превышать 20.
3 стадию множественной миеломы выставляют, когда обнаруживается хотя бы 1 из следующих симптомов:
- Гемоглобин ниже 85 г/л, что соответствует тяжелой анемии.
- Превышение значения кальция более 3 ммоль/л.
- Уровень М-белка более 70г/л.
- Количество очагов поражения костей более 30.
Диагностика
Для постановки диагноза требуется комплексное обследование, включающее следующие процедуры.
Рентгенография скелета
Данное исследование позволяет определить очаги остеомаляции и, тем самым, уточнить диагноз и стадию развития заболевания. Солитарная плазмоцитома характеризуется единичными очагами остеолизиса. При множественной миеломе будут обнаруживаться множественные очаги остеодеструкции на фоне остеопении (снижения плотности костной массы). В рамках исследования выполняют снимки в двух проекциях, если они малоинформативны, прибегают к компьютерной томографии или МРТ.
Лабораторные исследования
- В общем анализе крови определяется анемия, при распространенных стадиях заболевания наблюдается снижение количества лейкоцитов (лейкопения) и тромбоцитов (тромбоцитопения). Одним из характерных, но неспецифических признаков является резкое увеличение СОЭ. У некоторых больных оно может превышать 100 мм/час.
- В анализе мочи обнаруживается протеинурия (высокое содержание белка), которая развивается из-за нарушения функции почек. При специальных исследованиях выявляются М-белок и белок Бенс-Джонса.
- Одним из специфических методов диагностики является исследование белковых фракций крови, при котором обнаруживаются парапротеинемии — при электрофорезе выявляется дополнительная фракция однородного (моноклонального) белка. Если его количество превышает 15%, это говорит в пользу миеломы.
- Миелограмма — исследование клеток костного мозга. При миеломе в миелограмме будет обнаружено увеличение количества плазматических клеток. В норме они составляют не более 5% от общей популяции, при миеломе их количество превышает 10%.

Лечение
Лечение миеломы костей будет зависеть от вида заболевания и его стадии. Основой лечения солитарной плазмоцитомы является лучевая терапия. Она дает хороший эффект, поскольку миеломные клетки очень чувствительны к облучению. Стандартом является суммарная очаговая доза в 40Гр. Если очаг остеодеструкции превышает 5 см, дозу могут увеличивать до 50 Гр. Эффективность терапии оценивается по склерозированию и реминерализации очага остеолизиса. Такая терапия позволяет стабилизировать заболевание на долгие годы и даже десятилетия, однако все равно сохраняется риск прогрессирования во множественную миелому.
К сожалению, радикальное лечение множественной миеломы на сегодняшний день невозможно. Все усилия направлены на достижение ремиссии и предотвращение развития рецидива или прогрессирования заболевания.
Основным методом лечения множественной миеломы является химиотерапия, и здесь есть несколько подходов, в зависимости от возраста и общего состояния больного. Ослабленным больным и пациентам старше 65 лет, которые не могут перенести интенсивную высокодозную химиотерапию, показано лечение с применением мелфалана, бортезомиба и преднизолона. Если имеется тяжелая почечная недостаточность, мелфалан отменяют. Также, чтобы снизить токсичность, могут быть снижены дозировки.
Пациентам младше 65 лет, а также пациентам в группе 65-70 лет с хорошим соматическим статусом и при отсутствии противопоказаний рекомендуется проводить высокодозную химиотерапию (ВХП) в миелоаблятивных режимах. Такое лечение отличается большей эффективностью даже в случае химиорезистентности к стандартным схемам ХТ, однако оно приводит к полному опустошению костного мозга с угнетением всех ростков кроветворения. Это очень опасно для здоровья, поскольку человек полностью лишается иммунной защиты, плюс возникают кровотечения из-за нехватки тромбоцитов. Чтобы восстановить кроветворение, необходима трансплантация гемопоэтических стволовых клеток (ТГСК). Стволовые клетки можно брать у самого больного, в этом случае говорят об аутотрансплантации, или пересаживать клетки от донора — аллогенная трансплантация.
Аллогенная трансплантация является палкой о двух концах. С одной стороны, пациент получает полноценный противоопухолевый иммунитет, поскольку донорские иммунные клетки будут атаковать клон злокачественных миелоцитов. С другой стороны, есть риск развития реакции трансплантат против хозяина, которая в тяжелых случаях может привести к летальному исходу. В настоящее время аллогенные трансплантации используются для лечения рецидивов после ВПХ.
Высокодозная полихимиотерапия
ВПХ проводится в несколько этапов:
- Индукционная терапия. Цель данного этапа является достижение ремиссии, которая в случае миеломы означает нормализацию количества плазматических клеток в костном мозге, исчезновение М-протеина в крови и моче, а также исчезновение очагов остеодеструкции. С этой целью назначаются 2-3 компонентные химиотерапевтические схемы первой линии. Если пациент хорошо ответил на терапию, и у него наступила полная ремиссия или очень хорошая ремиссия, он направляется на ТГСК. Если результаты неудовлетворительны, и опухоль резистентна к данным схемам, применяют более мощные схемы высокодозной полихимиотерапии в миелоаблятивных режимах, которые позволяют преодолеть опухолевую резистентность.
- Забор стволовых клеток. Для трансплантации используются мезенхимальные СК, которые в небольшом количестве присутствуют в крови. Чтобы увеличить их число, проводят мобилизацию, которая подразумевает применение препаратов, стимулирующих выход СК из костного мозга в кровь. Мобилизацию и сбор СК выполняют между 4 и 6 курсом индукционной терапии. Чтобы снизить опухолевую контаминацию полученного материала, может применяться его очистка с помощью моноклональных антител, но такая процедура все равно не влияет на вероятность развития рецидива.
- Этап кондиционирования. Его целью является максимально полное уничтожение опухолевых клеток. При множественной миеломе кондиционирование проводят с использованием высоких доз мелфалана. Этот этап должен выполняться не позднее, чем через 6 недель после сбора стволовых клеток.
- Трансплантация стволовых клеток. Материал вводится внутривенно с помощью инфузии. Внешне это выглядит как переливание крови. Для улучшения результатов лечения множественной миеломы у пациентов с высокими рисками рецидива и прогрессирования, может быть показана тандемная ТГСК. В этом случае через 3-6 месяцев после первой трансплантации проводят повторную, при этом могут быть использованы собственные или донорские стволовые клетки.
Далее идет поддерживающая терапия. Она назначается как после индукции ремиссии стандартной химиотерапией, так и после ТГСК. Ее целью является подавление роста остаточного клона миеломных клеток, продление ремиссии и предотвращение прогрессирования заболевания.

Прогноз
Прогноз определяется видом миеломы костей и ее стадией. При солитарной плазмоцитоме болезнь может быть стабильной годами. Продолжительность жизни при 1 стадии симптоматической миеломы составляет 6-7 лет, при второй — 3-4 года. Медиана выживаемости при 3 стадии не превышает 2 лет.
Читайте также:
- Затылочный (рефлекторный) фиксационный механизм глаз. Феномен соскальзывания глаз
- Показания и подготовка к артроскопической синовэктомии коленного сустава
- Мягкие ткани при мастоидите. Субпериостальный абсцесс
- Нарушения голоса при ревматизме. Ревматические поражения гортани
- Лекарства влияющие на мочеиспускание. Фармакология мочевыводящего тракта
