Микрофлора нагноения торакальных ран. Антибиотикопрофилактика нагноения ран
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
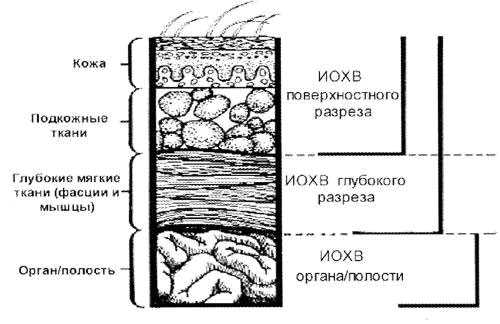
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
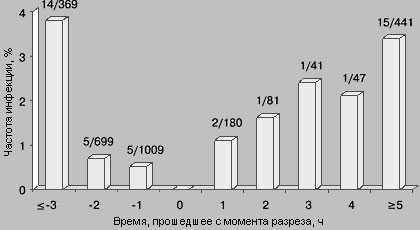
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
Антибиотики в операционной зоне
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (< 1200 в 1 мкл), восстановления функции кишечника (обычно примерно после недельного курса лечения).
Инфицирование послеоперационных ран относится к разряду внутрибольничных инфекций, где возможны разные варианты эмпирической антибиотикотерапии в зависимости от тяжести течения раневой инфекции и особенностей формирования резистентности бактерий к антибиотикам. При неосложненных инфекциях мягких тканей, как правило, обходятся монотерапией, в то время как осложненные инфекции, требующие повторных оперативных вмешательств и нередко приобретающие системный характер, чаще нуждаются в назначении антибиотиков более широкого спектра действия или проведении комбинированной антибиотикотерапии.
При лечении тяжелых и жизнеугрожающих инфекций препаратами выбора становятся аминогликозиды, спектр действия которых охватывает подавляющее большинство аэробных грам(-) и грам(+) бактерий (за исключением стрептококков и пневмококков), а в комбинации с пенициллином они оказывают синергическое бактерицидное действие на энтерококки. Однако, несмотря на их активность против Staphylococcus spp., аминогликозиды не следует применять в качестве стартовой монотерапии при стафилококковой инфекции. Гентамицин наиболее широко применяется в практике, однако имеется много свидетельств о высоком удельном весе резистентных к нему микробных изолятов от стационарных больных, что снижает эффективность лечения хирургической инфекции. Наиболее активным среди аминогликозидов является нетилмицин (нетромицин), который, по нашим данным, превосходит другие антибиотики этой группы и некоторые цефалоспорины 3-го поколения и сопоставим по антимикробной эффективности лишь с фторхинолонами (см. табл. 2). У него наименее выражен ото- и нефротоксический эффект, что позволяет вводить суточную дозу препарата однократно без увеличения частоты побочных осложнений. Такой режим введения существенно увеличивает ударное антимикробное действие нетилмицина и имеет экономические преимущества. По стоимости он гораздо доступнее амикацина и, по нашему опыту, должен занять первостепенное положение среди аминогликозидов в лечении оппортунистических инфекций.
Таблица 2
АНТИБИОТИКОЧУВСТВИТЕЛЬНОСТЬ ГРАМ(-) БАКТЕРИЙ ПРИ ИНФЕКЦИЯХ КОСТЕЙ И МЯГКИХ ТКАНЕЙ (%)
| Антибиотики | E.col (n=28) | KES* (n=48) | Proteus spp. (n=22) | P.aeruginoza (n=37) | Acinetobacter (n=19) |
| Нетромицин | 100 | 90 | 73 | 74 | 88 |
| Амикацин | 75 | 40 | 57 | 67 | 75 |
| Тобрамицин | 58 | 34 | 22 | 63 | 43 |
| Гентамицин | 50 | 36 | 30 | 58 | 27 |
| Цефтазидим | 83 | 40 | 70 | 57 | 40 |
| Ципрофлоксацин | 100 | 88 | 79 | 83 | 80 |
Нельзя обойти вниманием и фторхинолоны, которые все чаще становятся препаратами выбора при системных инфекциях. Среди них ципрофлоксацин (ципробай, ципринол) занял прочное место в хирургической практике, в то время как другие препараты этой группы чаще используются для лечения больных терапевтического профиля. Наличие инфузионной формы препарата существенно повышает его конкурентоспособность при лечении больных в реанимационных отделениях, а возможность проведения так называемой ступенчатой терапии с переходом на пероральный прием антибиотика (без существенного снижения его концентрации в крови из-за высокой биоусвояемости при всасывании) значительно снижает стоимость курса лечения. Область применения ципрофлоксацина в хирургии с одинаковым успехом распространяется на инфекции костей и мягких тканей, интраабдоминальные инфекции, инфекции органов грудной полости и малого таза и, конечно, при лечении сепсиса.
Таким образом, применение антибиотиков в хирургии с профилактической и лечебной целью имеет свои особенности, а знание спектра возбудителей хирургических инфекций и антимикробного действия химиопрепаратов является основой правильного их применения в клинике.
Микрофлора нагноения торакальных ран. Антибиотикопрофилактика нагноения ран
Микрофлора была исследована у 277 больных хроническими нагноениями легких. В зависимости от особенностей предоперационной подготовки было выделено две группы.
Первую группу (80 человек) составили больные, у которых наряду с общеукрепляющей терапией основным видом лечения явились антибиотики широкого спектра действия с учетом чувствительности к ним микрофлоры. В комплексной бронхологической санации кроме антибиотиков использовались протеолитические ферменты.
Во второй группе (197 человек) особенностью предоперационной подготовки являлось исключение антибиотиков и применение иммунизации стафилококковым анатоксином. В качестве антибактериальной терапии при комплексной бронхологической санации использовали Фурагин—К.
Основной флорой бронхиального дерева обеих групп больных являлся стафилококк. Изучение комплекса его патогенных свойств показало, что из 362 штаммов 296 обладали признаками патогенности и являлись гемолитическими и плазмо-коагулирующими, а также обладали высокой гиалуронидаз-ной и лецитиназной активностью.
Монокультура встретилась у 22 больных, у остальных выделены ассоциации из 2—3—4 видов микробов. Наиболее часто встречались ассоциации из 3-х видов микробов (67%) В 26 микробных ассоциациях превалировал стафилококк. (79,7%).
Нам не удалось связать характер течения процесса с видовым составом микробных ассоциаций, а также обнаружить зависимость течения патологического процесса от количества микроорганизмов, участвующих в ассоциации у различных групп больных. В ряде случаев течение процесса у больных с двумя видами микробов было более тяжелым, чем при ассоциациях из 3—4 видов. При изучении ассоциаций микробов у больных с различными формами хронических нагноений характер микрофлоры не имел существенных различий.
Чувствительность микрофлоры определялась к 13 антибиотикам. При поступлении больных процент чувствительных микробных ассоциаций и чистой культуры патогенного стафилококка к антибиотикам в первой и второй группах не имел заметной разницы и был низким. Однако, по сравнению с микробными ассоциациями чувствительность чистой культуры патогенного стафилококка была почти ко всем антибиотикам выше, иногда в два и более раз. Эти данные подтверждают мнение о том, что участвующие в ассоциации дрожжевые грибки, кишечная палочка и другие микробы оказывают взаимное влияние на устойчивость к антибиотикам.
За время предоперационной подготовки (в среднем 30—40 дней в первой группе и 14—20 дней — во второй) характер микрофлоры независимо от вида предоперационной подготовки оставался без изменений. В то же время изменение чувствительности ее к антибиотикам имело определенную связь с особенностями подготовки.
В первой группе больных чувствительность микробных ассоциаций и чистой культуры патогенного стафилококка либо не изменилась, либо снизилась.
Во второй группе больных число чувствительных микробных ассоциаций резко возросло к 8 из 10 антибиотиков, особенно юренщиллину, также возросла чувствительность чистой культуры патогенного стафилококка.
Таким образом, исключение из предоперационной подготовки антибиотиков, сочетание нитрофурановых, сульфаниламидных препаратов на фоне иммунизации стафилококковым анатоксином привело к значительному повышению чувствительности микрофлоры к антибиотикам, особенно пенициллинового ряда и расширило возможности более рационального и эффективного использования их в послеоперационном периоде.
Изучение микрофлоры, как уже было сказано выше, показало, что тяжесть течения заболевания не всегда определяется характером микробных ассоциаций, поэтому естественным оказалось предположить наличие других моментов, отягощающих течение процесса — наличие у больных нарушения иммунных реакций.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Клиническая эффективность нового комбинированного антимикробного препарата (ципрофлоксацин + тинидазол) при лечении больных с инфекциями кожи и мягких тканей
Проведено изучение клинической и микробиологической эффективности комбинированного препарата, представляющего собой фиксированную комбинацию ципрофлоксацина с тинидазолом в виде таблеток (Цифран СТ, Ранбакси, Индия). Препарат получали 40 больных с инфекциями кожи и мягких тканей в составе комплексного хирургического лечения. Клинический эффект наблюдался в97,5% случаев. Переносимость препарата была хорошей, без побочных эффектов.
Ключевые слова: инфекции кожи и мягких тканей, микрофлора, комбинированный препарат ципрофлоксацин/тинидазол, лечение.
Ципрофлоксацин, один из наиболее активных антимикробных препаратов группы фторхинолонов, широко применяется при лечении больных с хирургической инфекцией, в том числе с инфекцией кожи и мягких тканей. В отечественных и зарубежных клинических исследованиях показана высокая эффективность ципрофлоксацина при лечении больных с осложненными инфекциями кожи и мягких тканей 1. В ряде монографий 10, в которых приводятся обобщенные данные, также отмечаются хорошие результаты при применении ципрофлоксацина у больных с такими инфекциями.
Успешное применение ципрофлоксацина у больных с инфекциями кожи и мягких тканей обусловлено широким антимикробным спектром препарата, охватывающим большинство грамположительных и грамотрицательных аэробных бактерий - основных возбудителей этих инфекций. Однако ципрофлоксацин обладает довольно низкой активностью в отношении анаэробных микроорганизмов, в то время как при некоторых осложненных инфекциях кожи и мягких тканей, наряду с традиционными аэробными возбудителями, в ряде случаев встречаются анаэробные микроорганизмы, причем, последние наиболее клинически значимы при таких заболеваниях, как гангрена конечностей у больных сахарным диабетом или атеросклеротическим поражением магистральных сосудов, пролежни, остеомиелит с вовлечением мягких тканей, окружающих кость. При терапии таких заболеваний необходимо применять препараты, проявляющие активность как в отношении аэробных, так и анаэробных микроорганизмов. При отсутствии таких лекарственных средств применяют комбинированную терапию, включающую препараты, действующие на аэробную микрофлору, и препараты с антианаэробной активностью.
Фирмой «Ранбакси» (Индия) разработан комбинированный препарат, содержащий фиксированную комбинацию ципрофлоксацина и препарата с антианаэробной активностью – тинидазола, Цифран СТ. В Институте хирургии им. А.В.Вишневского РАМН проводилось клинико–лабораторное изучение эффективности и переносимости этого комбинированного препарата в таблетках, содержащих 500 мг ципрофлоксацина и 600 мг тинидазола. Результаты исследования представлены в настоящей публикации.
Материал и методы
В исследование были включены 40 больных (17 женщин и 23 мужчины в возрасте от 18 до 85 лет), находившихся на лечении в отделении гнойной хирургии Института. У всех больных, включенных в исследование, были гнойные раны кожи и мягких тканей различного происхождения и локализации, осложненные аэробной или анаэробной (неклостридиальной) инфекцией. В клиническое исследование не включались больные с крайней степенью тяжести инфекционного процесса, с декомпенсацией сердечнолегочной системы.
У многих больных наблюдались сопутствующие заболевания: у 7 – ишемическая болезнь сердца, гипертоническая болезнь, у 4 – хронический бронхит, у 1 – эмфизема легких, у 7 - хроническая венозная недостаточность сосудов нижних конечностей, у 9 – декомпенсированный сахарный диабет, по поводу которых они получали соответствующее лечение.
Распространение гнойного процесса и наличие интоксикации являлись основанием выполнения у всех больных экстренного оперативного вмешательства. После удаления всех девитализированных тканей, промывания послеоперационной раны раствором антисептиков и ее дренирования больным назначали дезинтоксикационную терапию и изучаемый комбинированный препарат. Местное лечение ран проводили под повязками с мазями на полиэтиленгликолевой основе или с растворами йодофоров. После появления в ране грануляций, краевого эпителия выполнялся заключительный этап хирургического лечения – закрытие раны местными тканями или перфорированным свободным кожным лоскутом.
Суточная доза препарата составляла 2 таблетки, назначаемых с интервалом 12 часов. В 17 случаях при тяжелом течении инфекционного процесса использовался метод ступенчатой терапии – вначале применялся внутривенно ципрофлоксацин с метронидазолом в течение 5 суток, а в последующем - лечение продолжали комбинированным препаратом. Общая длительность лечения зависела от выраженности гнойного процесса и интоксикации и колебалась от 7 до 14 дней.
Во всех случаях началу лечения изучаемым препаратом предшествовало клинико-лабораторное обследование больных. Наряду с проведением клинических анализов крови и мочи, изучалось влияние препарата на печень и почки по данным биохимического анализа крови.
До начала лечения, а также после отмены препарата выполнялось микробиологическое исследование мягких тканей ран. При необходимости, помимо изучения состава микрофлоры, проводилось количественное определение микроорганизмов в тканях раны. Дополнительно, по клиническим показаниям, проводилось микробиологическое изучение пунктатов полостей, мочи, крови, мокроты. отделяемого из дренажей.
Выделение, идентификация и определение чувствительности к антимикробным препаратам аэробной микрофлоры проводили согласно методическим рекомендациям [12] При изучении анаэробной микрофлоры использовывали пунктаты закрытых полостей, абсцессов, тканевые биоптаты из глубины ран. Выделение и идентификацию анаэробных бактерий проводили также в соответствии с опубликованными рекомендациями [12].
В конце лечения проводилась оценка клинической и бактериологической эффективности препарата.
Результаты исследований
Включенные в исследование 40 больных были разделены на 5 групп (табл. 1).
Таблица 1
Распределение больных по клиническим группам заболевания
Клинические группы
Число больных
Острые гнойные заболевания мягких тканей (фурункулы, карбункулы, флегмоны)
Научные работы под руководством Л.К. Богуша. Иммунология округлых образований легких
Под руководством Льва Константиновича 70 врачей защитили кандидатские диссертации и 46 — докторские, десятки других ведут диссертационные исследования в настоящее время. В Якутске, на Памире, в Красноярском крае, в Армении, в Магадане, Ташкенте, Уфе, Риге и сотне других городов стоят у операционного стола ученики Богуша.
Жизнь и творческий путь Льва Константиновича, насыщенный многогранной деятельностью может быть образцом служения своему долгу во имя жизни и здоровья нашего народа. Он по праву занимает почетное место в славной плеяде имен отечественных клиницистов, проложив новые пути и заполнив многие белые пятна в хирургии туберкулеза, о чем ярко свидетельствует его избрание в 1957 г. членом-корреспондентом, а в 1963 г. действительным членом Академии медицинских наук.
Партия и правительство высоко оценили вклад, внесенный Львом Константиновичем в развитие отечественной медицинской науки, наградив его орденом Трудового Красного Знамени и присудив ему Ленинскую и Государственную премии и почетное звание заслуженного деятеля науки.
70 лет — путь немалый, но не всегда век определяется ко личеством прожитых лет. Ярким свидетельством этому служит сам Лев Константинович, встречающий свой юбилей в расцвете творческих сил и стремлений.
Памятные даты жизни каждого ученого, отражающие его жизненный путь и творческую деятельность не только служат источником вдохновения для молодого поколения, ищущего свои пути в науке, но по существу — они принадлежат всем народу как даты развития его культуры.
Иммунология округлых образований легких
Несмотря на значительные достижения в дифференциальной диагностике заболеваний легких, еще нередко встречаются случаи, представляющие диагностические трудности. Одним из характерных примеров этого является дифференциальная диагностика так называемых «округлых» образований в легких, среди которых насчитывается более 70 нозологических единиц. Из них в широкой клинической практике наиболее часто встречаются периферический рак, казеомы, абсцессы, хронические неспецифические пневмонии, доброкачественные опухоли и бронхогенные кисты.
На разных стадиях перечисленные патологические образования обычно не дают выраженной клинической картины заболевания и часто выявляются случайно, при профилактических осмотрах и флюорографических обследованиях. Именно на этих стадиях, на которых лечебные мероприятия наиболее эффективны, тщательное клинико-рентгено-бронхологическое исследование, включающее б себя различные виды пункционней и катетеризационной биопсии, не всегда приводит к успеху.
Особую сложность представляет диагностика сочетания различных заболеваний таких, например, как рак и туберкулез, рак и хронические песпецифические пневмонии и т. д. В этих случаях даже цитологическая идентификация процесса из одной зоны поражения не может полностью исключить возможность сочетания двух заболеваний.
Учитывая перечисленные затруднения, с целью дифференциальной диагностики «округлых» образований в легких мы исследовали ряд иммунологических реакций, направленных на изучение характера и степени активности клеточного иммунитета. В первую очередь, естественно, нас интересовали характер и выраженность реакции при злокачественных новообразованиях.
Читайте также:
