Минералокортикоидная функция надпочечников. Эффекты гипотиазида
Добавил пользователь Евгений Кузнецов Обновлено: 31.01.2026
Кора надпочечников, занимающая по объему 80 % всей железы, состоит из трех клеточных зон: наружной клубочковой зоны, образующей минералокортикоиды, средней пучковой зоны, образующей глюкокортикоиды, и внутренней сетчатой зоны, в небольшом количестве продуцирующей половые стероиды. Все кортикостероиды образуются из холестерина крови и синтезируемого в самих корковых клетках. При синтезе кортистероидов образуется порядка 50 различных соединений, однако секретируются в кровь в физиологических условиях лишь 7—9 из них.
Регуляция секреции и физиологические эффекты минералокортикоидов
У человека единственным минералокортикоидом, поступающим в кровь, является альдостерон. Регуляция синтеза и секреции альдостерона осуществляется преимущественно ангиотензином-II, что дало основание считать альдостерон частью ренин-ангиотензин-альдостероновой системы или регуляторной оси, обеспечивающей регуляцию водно-солевого обмена и гемодинамики. Регуляции секреции альдостерона может осуществляться и под влиянием собственной адренокортикальной ренин-ангиотензиновой системы, что объясняет частое несоответствие уровней активности ренина в плазме крови и секреции альдостерона. Поскольку альдостерон регулирует содержание в крови ионов Na+ и К+, обратная связь в регуляции его секреции реализуется прямым влиянием ионов К+ на клубочко-вую зону коры надпочечников. В ренин-ангиотензин-альдостероновой системе обратные связи включаются при сдвигах содержания Na+ в моче дистальных канальцев, объема и давления крови.
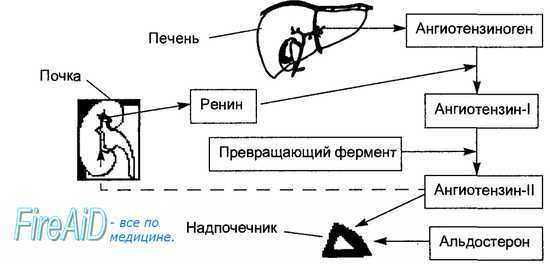
Рис. 6.11. Ренин-ангиотензин-альдостероновая система. Секреция юкстагломерулярными клетками почек в кровь фермента ренина вызывает отщепление пептида ангиотензина-1 от белка плазмы крови ангиотензиногена, образуемого в печени. В сосудистом русле почек, печени, легких, мозга ангиотензин-1 подвергается воздействию превращающего фермента, вызывающего образование из ангиотензина-1 ангиотензина-2. Ан-гиотензин-2 стимулирует секрецию альдостерона клубочковой зоной коры надпочечников. Пунктирной стрелкой обозначена отрицательная обратная связь — подавление секреции ренина ангиотензином-2.
Механизм действия альдостерона, как и всех стероидных гормонов, состоит в прямом влиянии на генетический аппарат ядра клеток со стимуляцией синтеза соответствующих РНК, активации синтеза транспортирующих катионы белков и ферментов, а также повышении проницаемости мембран для аминокислот. Негеномные эффекты гормона реализуются через системы вторичных посредников. Механизм действия альдостерона на клетки почечных канальцев представлен на рис. 6.12. Стимуляция всасывания натрия под влиянием альдостерона происходит не только в нефроне, но и в желудочно-кишечном тракте, протоках желез внешней секреции, желчном пузыре. Негеномные эффекты альдостерона обусловлены стимуляцией мембранного антипорта Na+/H+ в клетках разных типов (гладкие мышцы матки, эпителий дистальных канальцев почек, гладкие мышцы артерий и артериол, клетки крипт кишечника). Эти эффекты обусловлены образованием вторичного посредника диацилглицерола и активацией протеинкиназы С. Повышение уровня внутриклеточного кальция в эндотелиальных и гладкомышечных клетках сосудов под влиянием альдостерона обусловлено активацией вторичного посредника ИФЗ. Альдостерон вызывает в клетках и двукратное повышение уровня цАМФ, модулируя геномные эффекты стероидных гормонов. Быстрые негеномные эффекты альдостерона проявляются и со стороны сердечно-сосудистой системы в виде: повышения сосудистого сопротивления и артериального давления при снижении сердечного выброса, противодействия повышению в гладких мышцах сосудов уровня цАМФ и увеличения чувствительности к прессорным эффектам катехоламинов и ангиотензина II, что дало основание считать альдостерон циркуляторным гормоном стресса.
Альдостерон поддерживает оптимальный водно-солевой обмен между внешней и внутренней средой организма. Одним из главных органов-мишеней гормона являются почки, где альдостерон вызывает усиленную реабсорбцию натрия в дистальных канальцах с его задержкой в организме и повышение экскреции калия с мочой. Под влиянием альдостерона происходит задержка в организме хлоридов и воды, усиленное выведение Н-ионов и аммония, увеличивается объем циркулирующей крови, формируется сдвиг кислотно-основного состояния в сторону алкалоза. Действуя на клетки сосудов и тканей, гормон способствует транспорту натрия и воды во внутриклеточное пространство.
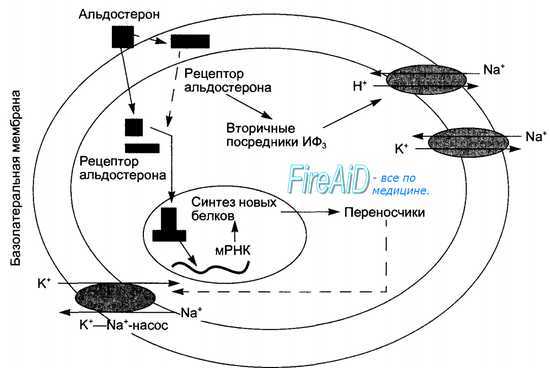
Рис. 6.12. Геномный и внегеномный механизмы действия альдостерона на клетку почечного канальца. Геномный механизм: проникновение молекулы гормона через мембрану внутрь клетки, связывание с цитоплазматическим рецептором, транспорт в ядро, связывание с ядерным рецептором, активация синтеза белков (Na-транспортирующего белка-переносчика) и Na+-К+-анти-порта через люминальную мембрану. Внегеномный механизм: связывание молекулы гормона с мембранным рецептором, образование вторичных посредников (ИФЗ), фосфорилирование и активация Nа+-протонного антипорта через люминальную мембрану.
Минералокортикоиды являются жизненно важными гормонами, гибель организма после удаления надпочечников можно предотвратить, вводя гормоны извне. Минералокортикоиды усиливают воспаление и реакции иммунной системы. Избыточная их продукция ведет к задержке в организме натрия и воды, отекам и повышению артериального давления, потере калия и водородных ионов, вследствие чего возникают нарушения возбудимости нервной системы и миокарда. Недостаток альдостерона у человека сопровождается уменьшением объема крови, гиперкалиемией, гипотензией, угнетением возбудимости нервной системы.
Минералокортикоидная функция надпочечников. Эффекты гипотиазида
Функция надпочечников, обмен уропепсиногена после операции на язве желудка и ее осложнениях
Анализируя литературные материалы о состоянии ГГНС при язвенной болезни в хирургическом аспекте, можно констатировать следующее: А. Т. Пулатов, В. Е. Волков, В. С. Гафаров склоняются к выводу, что непосредственно после резекции желудка имеет место повышение адренокортикальной функции. По наблюдениям Н. П. Цизиной, у больных после этой операции функциональная активность ГГНС оказалась сниженной.
Gerchards, Cesnik, Memco и Sorge утверждают, что количество выделяемых глюкокортикоидов и уропепсиногена у оперированных больных прямо пропорционально тяжести оперативного вмешательства.
Ю. M. Полоус у большинства обследованных больных наблюдал неадекватную реакцию на стимулирующее действие АКТГ и расценивал этот факт как функциональное истощение коркового вещества надпочечников или парадоксальную реакцию возбужденного органа в ответ на раздражитель. Автор отметил, что у больных, имевших до операции признаки адренокортикальной недостаточности, послеоперационный период протекал с различными осложнениями.
После ушивания прободной язвы желудка и двенадцатиперстной, кишки В. Г. Мыкуляк констатировал снижение адренокортикальной функции, а Ю. Н. Кленус — повышение ее, с удовлетворительной резервной способностью коркового вещества.
По наблюдениям О. Г. Сизова и С. З. Клецкина, при анастомозитах имеет место подъем уровня уропепсиногена; увеличение экскреции этого протеолитического фермента было обнаружено у больных при пенетрации язвы в соседние органы (О. Г. Сизов), в то время как В. Г. Мыкуляк отмечал у такого рода больных понижение показателей экскреции 17-кетостероидов и отрицательную пробу Торна.
По данным же О. Ф. Гоцуляк, у больных с пенетрирующими и перфоративными язвами показатели уропепсиногена в большинстве случаев оказались повышенными, при перидуодените и перигастрите содержание протеолитического фермента понижалось и наиболее низким оно было при стенозе привратника.
По мнению Ю. М. Полоус, при язвенной болезни, осложненной рубцовой деформацией (особенно при локализации язвы в желудке), функциональная активность коры надпочечников повышалась, в то время как В. Г. Мыкуляк выявил понижение экскреции 17-кетостероидов при данном осложнении.
М. Д. Смехова и А. Ф. Бунатян наблюдали у больных с пептическими язвами анастомоза адренокортикальную недостаточность (даже в период клинического благополучия). Авторы отмечают, что у больных, перенесших реконструктивную резекцию желудка, ранний послеоперационный период, а иногда и сама операция протекали с различными осложнениями и объясняют их возникновение неполноценной функциональной резервной способностью коры надпочечников.
Сравнивая показатели содержания уропепсиногена после резекции желудка по поводу язвенной болезни и рака желудка, Н. П. Смирнов считает, что после резекции желудка по поводу рака угнетение пепсинообразующей функции культи желудка более выражено, чем после операции по поводу осложненной язвенной болезни. Balabnnski и соавт., Vassilev и соавт., Ginev и Zanzov выявили гипокортицизм у длительно болеющих язвенной болезнью, особенно при тяжелых массивных кровопотерях и после резекции желудка.
В то же время Savulescu и др. как при осложненных хронических язвах, так и при гастродуоденальных кровотечениях установили гиперкортицизм, который в 70—80% случаев сопровождался положительной реакцией на стимуляцию АКТГ и в 100% случаев — эозинопенией в ответ на введение инсулина (проба Милку). В течение первых дней кровотечения имела место абсолютная эозинопения, зависящая от гиперсекреции глюкокортикоидов, а в ближайшие дни после геморрагии — эозинофилия, вызванная снижением секреции стероидных гормонов.
Таким образом, по вопросу о состоянии адренокортикальной функции при осложненной язвенной болезни как до, так и после резекции желудка или ушивания прободной язвы имеется еще много разногласий, что указывает на необходимость дальнейшего изучения этой проблемы.
Как уже указывалось, минералокортикоидная функция надпочечников у больных язвенной болезнью почти не изучена. Имеющиеся данные по этому вопросу весьма скудны и недостаточно убедительны. Представления о состоянии минералокортикоидной функции базировались до последнего времени на косвенных показателях и клинических наблюдениях.
В нашей лаборатории под руководством профессора С. М. Рысса В. А. Горшковым были проведены исследования, направленные на установление уровня экскреции альдостерона у больных язвенной болезнью. Помимо определения суточной спонтанной экскреции альдостерона с мочой, изучалась ответная реакция надпочечников на нагрузку гипотиазидом. Основанием для применения данной методики послужило то обстоятельство, что под влиянием гипотиазида увеличивается выделение надпочечниками альдостерона вследствие снижения объема внеклеточной жидкости и уменьшения содержания натрия в организме. Данная проба позволяет составить представление о резервных возможностях клубочковой зоны коры надпочечников (Б. Б. Бондареико, В. А. Горшков). Кроме того, использовались косвенные тесты: проба с нагрузкой калием по Бояновичу и определение коэффициента натрий/калий слюны.
Минералокортикоидная функция надпочечников, по данным прямого определения альдостерона в моче, изучена у 7 практически здоровых лиц и у 25 больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке. Контрольную группу составили 6 мужчин и одна женщина, а в группе больных — 21 мужчина и 4 женщины. У всех обследованных параллельно определялось содержание натрия и калия в плазме крови и моче.
Показатели спонтанной экскреции альдостерона у здоровых колеблются от 5,7 до 10 мкг/сутки и составили в среднем 8,2±0,44 мкг/сутки. Полученные данные согласуются с литературными (Б. Б. Бондаренко). Показатели экскреции альдостерона у больных находились в пределах от 1,0 до 18,0 мкг/сутки (в среднем 9,2±0,84), причем у 10 из 25 обследованных содержание альдостерона в суточной моче превышало 10 мкг, достигая в отдельных случаях 16 и даже 19 мкг.
Назначение гипотиазида в дозе 3 мг/кг приводило к четким сдвигам в состоянии водно-солевого равновесия как у здоровых, так и у больных язвенной болезнью.
Гипотиазид вызывал значительную потерю внеклеточной жидкости, увеличивался диурез, снижался вес тела и увеличивались показатели гематокрита. Под влиянием гипотиазида резко повышалась экскреция с мочой натрия и калия. Концентрация натрия в плазме крови не изменялась, а концентрация калия снижалась. Падение уровня внеклеточной жидкости и ионов натрия не могло не повлиять на секрецию надпочечниками альдостерона. И действительно, после нагрузки гипотиазидом содержание альдостерона в моче заметно увеличилось у всех лиц контрольной группы и составило в среднем 15,2 ± 2,7 мкг/сутки. В группе больных суточная экскреция альдостерона повысилась у 24 из 26 человек, ее показатели в среднем достигли 1б,2±1,4 мкг/ сутки с колебаниями от 1,3 до 34 мкг.
Таким образом, реакция клубочковой зоны коры надпочечников на внезапное падение объема внеклеточной жидкости у больных язвенной болезнью и здоровых лиц оказалась практически одинаковой. Увеличение экскреции гормона после нагрузки независимо от исходной активности надпочечников свидетельствует о сохранении резервных возможностей клубочковой зоны у больных язвенной болезнью.
Известное представление о функциональном состоянии гломерулярной зоны надпочечников дает анализ зависимости между снижением объема плазмы (рассчитанный по гематокриту) и уровнем альдостерона в моче после нагрузки гипотиазидом. Из представленных здесь данных видно, что содержание альдостерона в моче было тем выше, чем больше была потеря жидкой части плазмы. Наличие прямой зависимости между изучаемыми показателями подтверждается статистически: между этими величинами выявлена прямая корреляционная связь (коэффициент корреляции равен 0,615±0,084).
Поскольку снижение объема внутрисосудистой жидкости является одним из главных факторов, стимулирующих секрецию альдостерона корой надпочечников, следует полагать, что реакция со стороны надпочечников у больных язвенной болезнью была достаточно адекватной.
Применение нагрузки гипотиазидом позволило оценить не только резервные возможности клубочковой зоны коры надпочечников по увеличению уровня альдостерона в моче, но и проследить реализацию этого гомеостатического акта на уровне почечных механизмов. Очевидно, что увеличение секреции альдостерона лишь в том случае будет отвечать заданной регуляции постоянства водно-солевого равновесия, если будет сопровождаться последовательными изменениями в экскреции воды и электролитов с мочой.
При изучении суточного диуреза, натри- и калиуреза в течение 5—6 суток после нагрузки гипотиазидом (период последействия) были выявлены характерные изменения в электролитном составе мочи и ее количестве. Эти изменения касались снижения диуреза и натриуреза; количество экскретируемого калия оказывалось чаще увеличенным по сравнению с исходным уровнем.
При этом снижение диуреза и натриуреза в группе больных язвенной болезнью было выражено значительно резче и наблюдалось в течение более продолжительного времени (1-е, 2-е и 3-й сутки), чем у здоровых (2-е сутки), хотя потеря воды и натрия в день приема гипотиазида в обеих группах была одинаковой. Однако, если экскреция калия в первые сутки после нагрузки у больных была выше, чем у здоровых, то в последующие дни она практически была одинаковой как у той, так и другой группы обследованных. В этом отношении особенно показательны количественные отношения натрия к калию в моче.
В день нагрузки гипотиазидом отношение натрия к калию у больных возрастало незначительно, однако в периоде последействия данный показатель резко снижался и в течение всего времени наблюдения был намного ниже, чем в контрольной группе.
Из приведенных данных следует, что способность к задержке натрия при дефиците этого катиона в организме выражена у больных язвенной болезнью даже больше, чем у здоровых лиц. При оценке состояния минералокортикоидной функции этот факт приобретает важное значение, так как надпочечниковая недостаточность (болезнь Аддисона) сопровождается потерей способности к снижению натриуреза (Л. Соффер и сотр.).
Хотя регуляция электролитного состава мочи осуществляется не только альдостероном, представленные результаты позволяют считать, что именно ему принадлежала значительная роль в развитии последействия гипотиазида. На это, в частности, указывало увеличение количества гормона в моче после нагрузки гипотиазидом со снижением натриуреза и увеличением калиуреза, о том же говорит наличие корреляции между уровнем альдостерона в моче после нагрузки гипотиазидом и потерей калия (корреляционное отношение равняется 0,491±0,11; t=4,45). Данное обстоятельство свидетельствует, что реализация эффекта повышенного количества альдостерона у больных язвенной болезнью не встречает препятствий на уровне почечных канальцев, а следовательно, минералокортикоидная функция надпочечников является полноценной.
Роль минералокортикоидов в лечении больных с хронической надпочечниковой недостаточностью
Хроническая надпочечниковая недостаточность (ХНН) — клинический синдром, обусловленный недостаточным содержанием гормонов коры надпочечников, в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой сис
Хроническая надпочечниковая недостаточность (ХНН) — клинический синдром, обусловленный недостаточным содержанием гормонов коры надпочечников, в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы.
Классификация надпочечниковой недостаточности
Первичная надпочечниковая недостаточность
- Аутоиммунная деструкция коры надпочечников:
- изолированная первичная надпочечниковая недостаточность;
- аутоиммунный полигландулярный синдром 1 типа;
- аутоиммунный полигландулярный синдром 2 типа.
Центральная (гипоталамо-гипофизарная) надпочечниковая недостаточность
Вторичная надпочечниковая недостаточность
- Терапия препаратами глюкокортикоидов.
- В рамках гипопитуитаризма.
- Изолированный дефицит АКТГ.
Третичная надпочечниковая недостаточность (повреждения гипоталамуса различного генеза)
Классическое описание первичной хронической надпочечниковой недостаточности было сделано Томасом Аддисоном в 1855 г., тогда как проведение эффективной заместительной терапии заболевания оказалось возможным только в 30-х гг. ХХ в. Первая попытка лечения больных экстрактом надпочечников, который назначался внутрь, была предпринята R. Stockman в 1867 г. и оказалась неудачной. В 1936 г. E. C. Kendall et al. впервые получили из экстракта коры надпочечников кортикостерон и дегидрокортикостерон в кристаллической форме, а в 1937 г. M. von Steiger и T. Reichstein выделили дезоксикортикостерона ацетат (ДОКСА) и синтезировали его из сигмастерола. С 1939 г. ДОКСА в виде внутримышечных инъекций начали с успехом использовать в лечении первичной хронической надпочечниковой недостаточности. В середине 70-х гг. ДОКСА применялся в виде подкожных подсадок кристаллов по 100 мг, что избавляло пациента от необходимости делать инъекции. Однако это затрудняло подбор дозировки из-за индивидуальной скорости всасывания препарата и невозможности регулирования его действия при нестабильном АД, а сама манипуляция подсадки требовала специальной квалификации персонала. В 1953 г. Freed и Sabo синтезировали пероральный минералокортикоид 9α-фторкортизол (кортинефф), который с тех пор широко используется во всем мире и в конце 70-х гг. пришел на смену препарату ДОКСА, применявшемуся до этого в России [2].
Современная заместительная терапия первичной хронической надпочечниковой недостаточности заключается в обязательном комбинированном назначении препаратов глюко- и минералокортикоидов. Типичной ошибкой является лечение первичной хронической надпочечниковой недостаточности с помощью монотерапии глюкокортикоидами. Часто в этой ситуации, несмотря на увеличение дозы препарата, состояние больных не нормализуется, а дозировки продолжают увеличивать, что в ряде случаев приводит к развитию экзогенного синдрома Кушинга [1, 3].
По данным Нидерландского исследования (P. M. J. Zelissen, 1994), назначение монотерапии глюкокортикоидами можно считать обоснованным не более чем в 6,6% случаев, при этом следует учитывать, что практически все обследованные пациенты получали таблетированный гидрокортизон или кортизон-ацетат, который обладает большей минералокортикоидной активностью, чем синтетические глюкокортикоиды.
При вторичной надпочечниковой недостаточности дефицит минералокортикоидов не наблюдается, и в назначении минералокортикоидов (кортинефф) необходимости, как правило, нет, за исключением тех случаев, когда у пациента имеется выраженная артериальная гипотензия [5].
Заместительная терапия первичной хронической надпочечниковой недостаточности минералокортикоидами подразумевает использование только одного препарата — 9α-фторкортизола (9α-FF, кортинефф). Естественный минералокортикоид альдостерон не назначается для заместительной терапии по той же причине, что и ДОКСА, — из-за полной метаболизации при первом прохождении через печень; кроме того, препарат чистого альдостерона стоит достаточно дорого.
Основные преимущества 9α-FF заключаются в его эффективности при пероральном применении, а также в минералокортикоидной активности. После приема внутрь препарат быстро и полностью всасывается из желудочно-кишечного тракта. Своего пика плазменная концентрация 9α-FF достигает через 1,5 ч после приема. Период полувыведения составляет 18—36 ч, что позволяет имитировать практически не имеющую циркадного ритма секрецию альдостерона, благодаря ежедневному однократному приему 0,05—0,2 мг препарата. Метаболизируется 9α-FF в печени, выделяется с мочой в виде неактивных метаболитов. Интересен тот факт, что, как и сам альдостерон, кортизол и 9α-FF имеют одинаковую аффинность к рецепторам альдостерона в почках. Однако если альдостерон и 9α-FF достигают рецептора, то кортизол, попав в клетку, в результате действия 11-b-гидроксистероиддегидрогеназы превращается в неактивный кортизон. Именно поэтому минералокортикоидная активность 9α-FF в 200—400 раз выше, чем у кортизола, хотя эти соединения отличаются друг от друга всего на один атом фтора, который делает 9α-FF неуязвимым для указанного фермента. Глюкокортикоидными эффектами 9α-FF на практике можно пренебречь, поскольку ощутимо они проявляются, если доза препарата превышает 0,5 мг/сут. Глюкокортикоидный эффект 1мг 9α-FF (10 таблеток кортинеффа) эквивалентен 20 мг гидрокортизона.
Фармакологическое действие кортинеффа заключается в воздействии на дистальную часть почечных канальцев, усилении обратного всасывания ионов натрия и воды, а также увеличении выделения ионов калия и водорода. Кортинефф влияет также на выделение воды и электролитов толстым кишечником, потовыми и слюнными железами. Увеличение объема внеклеточной жидкости и задержка натрия в организме приводят к повышению АД. При длительном применении кортинеффа повышение АД связано с увеличением периферического сопротивления, а не только с его влиянием на водно-электролитный обмен [3].
Кортинефф в дозах, превышающих терапевтические, может угнетать функцию коры надпочечников, у молодых пациентов — функцию вилочковой железы, тормозить секрецию АКТГ гипофизом, а также ускорять процесс отложения гликогена в печени, а при недостаточном количестве белка в пище приводить к отрицательному азотистому балансу. По данным литературы, частым симптомом передозировки 9α-FF являются отеки, которые, как правило, не сопровождаются значительным подъемом АД у пациентов с первичной ХНН. Отечность на фоне терапии носит преходящий характер, развиваясь при первом назначении или увеличении дозы препарата.
Кортинефф назначается один раз в сутки в дозе 0,05—0,1 мг (максимально 0,2 мг), ежедневно утром, после еды, его необходимо запивать большим количеством жидкости. В ряде случаев дозу 9α-FF приходится увеличивать летом, особенно в условиях жаркого климата, что связано с повышением потерь натрия и воды, выводящихся из организма с потом.
Если имел место пропуск приема препарата, следует принять его как можно быстрее. Если же приближается время следующего приема, пропущенную дозу нужно отменить. При необходимости доза препарата уменьшается постепенно. Во время терапии кортинеффом не следует проводить вакцинацию. Препарат может маскировать проявление симптомов инфекционно-воспалительных заболеваний. На фоне применения кортинеффа в высоких дозах обязательно определение концентрации электролитов в плазме крови (Na, K) [4].
На сегодняшний день разработаны следующие критерии адекватности минералокортикоидного компонента заместительной терапии первичной ХНН [1, 3]:
- нормальные уровни калия и натрия плазмы;
- нормальное (комфортное) артериальное давление;
- отсутствие отечности, задержки жидкости (признаки передозировки препарата);
- нормальный или умеренно повышенный уровень активности ренина плазмы (АРП).
Как показало исследование M. Jadoul et al. (1991), артериальное давление при первичной ХНН коррелирует с АРП (см. рисунок) и, таким образом, с дозой 9α-FF. Следовательно, первым шагом в лечении артериальной гипертензии у больных первичной ХНН является ограничение потребления пищевой соли в сочетании с уменьшением дозы 9α-FF. Назначение диуретиков и спиронолактона вместе с кортинеффом не оправдано, поскольку эти препараты действуют как антагонисты [5].
Нами был составлен регистр больных с ХНН г. Москвы. Из 300 человек минералокортикоиды были назначены 180 (60%). Большая часть пациентов, принимающих кортинефф, имеют первичную ХНН аутоиммунной природы или развившуюся вследствие оперативного вмешательства. Относительно низкий процент использования минералокортикоидов свидетельствует о недостаточной информированности врачей различных лечебных учреждений г. Москвы о современных подходах к заместительной терапии первичной ХНН. Доза кортинеффа составляла от 0,1 до 0,2 мг и принималась однократно утром. Побочных эффектов (подъемы АД и задержка жидкости) не наблюдалось.
Следует отметить некоторые особенности заместительной терапии кортинеффом во время беременности. При беременности происходит постепенное и значительное увеличение уровня прогестерона, который является антагонистом минералокортикоидов. Поэтому необходимая доза 9α-FF в этот период может значительно возрастать. Подбор дозы должен осуществляться по уровню калия плазмы и артериальному давлению. Уровень АРП неинформативен, поскольку во время беременности он и в норме значительно повышен. Описаны случаи, когда, основываясь на перечисленных критериях, дозу 9α-FF приходилось увеличивать до 0,3 и даже до 0,6 мг в день (S. Diederich et al., 1994).
Дети, рожденные от матерей, получавших 9α-FF, требуют тщательного медицинского наблюдения из-за опасности развития у них недостаточности функции надпочечников. При назначении препарата женщине в период кормления грудью следует решить вопрос о переводе ребенка на искусственное вскармливание [2, 5].
Надпочечниковая недостаточность представляет собой одну из самых серьезных по своим проявлениям и осложнениям эндокринопатий. Больных с хронической надпочечниковой недостаточностью необходимо обследовать два раза в год. Следует подчеркнуть, что для оценки эффективности заместительной терапии решающую роль имеют клинические данные. Не следует добиваться оптимальных лабораторных показателей за счет назначения высоких доз глюко- и минералокортикоидов, что может привести к передозировке и клиническим симптомам гиперкортицизма. В условиях заместительной терапии прогноз заболевания будет зависеть от ее адекватности, что делает обязательным обучение пациентов приемам самоконтроля и наблюдение за ними в специализированном лечебном учреждении.
По вопросам литературы обращайтесь в редакцию
Г. А. Мельниченко, доктор медицинских наук, профессор
Г. Ф. Александрова, кандидат медицинских наук
М. Б. Анциферов, доктор медицинских наук, профессор
Т. С. Елисеева, С. Ф. Машков
ГУ ЭНЦ, Диабетологический центр РАМН, МоскваГиперальдостеронизм - симптомы и лечение
Что такое гиперальдостеронизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Матвеева М. А., эндокринолога со стажем в 11 лет.
Над статьей доктора Матвеева М. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Гиперальдостеронизм — это синдром, при котором кора надпочечников вырабатывает повышенное количество гормона альдостерона. Он сопровождается развитием артериальной гипертензии и поражением сердечно-сосудистой системы [1] . Нередко артериальная гипертензия, развившаяся на фоне повышенного уровня альдостерона, носит злокачественный характер: крайне плохо поддаётся медикаментозной коррекции и приводит к ранним и серьёзным осложнениям, таким как ранний инсульт, инфаркт миокарда, фибрилляция предсердий, внезапная сердечная смерть и др.
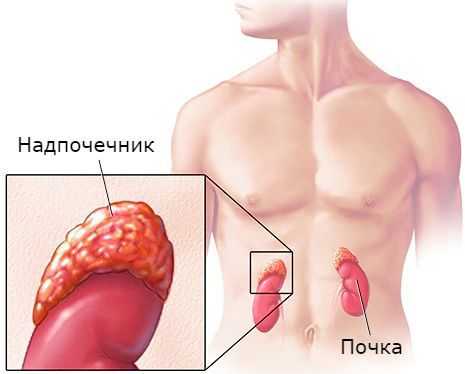
![Надпочечник]()
Гиперальдостеронизм является одной из самых частых причин артериальной гипертензии. По некоторым данным, он выявляется в 15-20 % всех случаев [5] .
В силу стёртой клинической картины данный синдром диагностируется редко. Однако его выявление имеет огромное значение как из-за своей распространённости, так и в связи с возможным своевременным лечением причины артериальной гипертензии и предотвращением тяжёлых сердечно-сосудистых осложнений, улучшая прогноз и качество жизни пациентов.
Кора надпочечников выделяет большое количество альдостерона либо автономно, либо в ответ на стимулы вне надпочечников.
Причинами автономной секреции альдостерона являются заболевания надпочечников:
- аденома (доброкачественная опухоль) надпочечника, продуцирующая альдостерон (синдром Крона);
- двусторонний идиопатический гиперальдостеронизм (точна причина неизвестна);
- односторонняя гиперплазия надпочечника (развивается в результате микро- или макронодулярного разрастания клубочковой зоны коры одного надпочечника);
- семейный гиперальдостеронизм (наследственное заболевание, встречается крайне редко);
- карцинома (злокачественная опухоль) надпочечника, вырабатывающая альдостерон.
Самой частой причиной гиперальдостеронизма является аденома (обычно односторонняя), состоящая из клеток клубочковой зоны. У детей аденомы встречаются редко. Как правило, это состояние у них вызвано раком или гиперплазией (разрастанием) одного надпочечника. У пожилых пациентов аденома встречается реже. Она связана с двусторонней гиперплазией надпочечников [4] [10] .
Вненадпочечниковыми причинами синдрома являются:
- стеноз (сужение) почечной артерии, приводящий к снижению почечного кровотока и, как следствие, гиперсекреции альдостерона;
- почечная вазоконстрикция (сужение любых сосудов почки), в том числе из-за опухолевого процесса;
- застойная сердечная недостаточность, цирроз печени с асцитом (скоплением жидкости в брюшной полости) и др., т. е. состояния, которые приводят к повышению альдостерона за счёт снижения печеночного кровотока и скорости метаболизма альдостерона [10] .
Крайне редко возможно развитие псевдогиперальдостеронизма — артериальной гипертензии и низкого уровня калия в крови, имитирующих симптомы гиперальдостеронизма. Причиной тому является существенная передозировка солодки или жевательного табака, которые влияют на метаболизм гормонов в надпочечниках.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гиперальдостеронизма
Клинические проявления гиперальдостеронизма чаще встречаются в возрасте 30-50 лет, однако описаны случаи выявления синдрома и в детском возрасте [1] .
Основным и постоянным симптомом гиперальдостеронизма является артериальная гипертензия. В 10-15 % она носит злокачественный характер [3] . Клинически гипертония проявляется головокружением, головными болями, мельканием "мушек" перед глазами, перебоями в работе сердца, в особо тяжёлых случаях — даже временной потерей зрения. Систолическое артериальное давление достигает 200-240 мм рт. ст.
Обычно гипертония при данном синдроме устойчива к препаратам, нормализующим давление. Однако этот признак гиперальдостеронизма далеко не всегда становится определяющим, поэтому его отсутствие не исключает диагноз и может привести к диагностической ошибке. Течение артериальной гипертензии при наличии синдрома может быть умеренным и даже мягким, поддающимся коррекции небольшими дозами препаратов. В редких случаях артериальная гипертензия носит кризовый характер, что требует дифференциальной диагностики и тщательного клинического разбора.
Второй признак гиперальдостеронизма — нейромышечный синдром. Он встречается довольно часто. Его основные проявления включают мышечную слабость, судороги, ползанье "мурашек" по ногам, особенно в ночные часы. В тяжёлых случаях могут быть временные параличи, которые внезапно начинаются и исчезают. Они могут длиться от нескольких минут до суток [3] [4] .
Третий признак гиперальдостеронизма, встречающийся не менее чем в 50-70 % случаев, — почечный синдром. Он представлен, как правило, невыраженной жаждой и учащённым мочеиспусканием (часто в ночное время).
Выраженность всех вышеперечисленных проявлений напрямую связана с концентрацией альдостерона: чем выше уровень этого гормона, тем выраженнее и тяжелее проявления гиперальдостеронизма.
Патогенез гиперальдостеронизма
Надпочечники — это парные эндокринные железы, расположенные над верхними полюсами почек. Они являются жизненно необходимой структурой. Так, удаление надпочечников у экспериментальных животных приводило к смерти через несколько суток [2] .
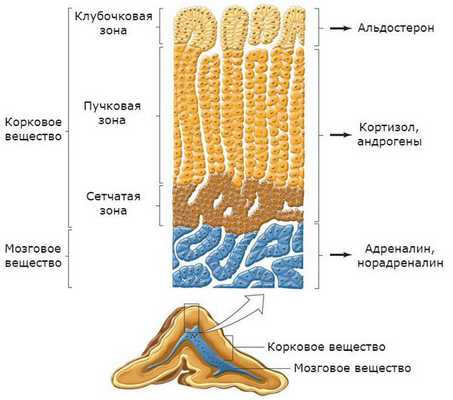
Надпочечники состоят из коркового и мозгового вещества. В корковом веществе, которое составляет до 90 % всей ткани надпочечника, выделяют три зоны:
- клубочковая;
- пучковая;
- сетчатая.
В клубочковой зоне синтезируются минералокортикоиды — подкласс кортикостероидных гормонов коры надпочечников, к коим относится альдостерон. К ней прилежит пучковая зона, вырабатывающая глюкокортикоиды (кортизол). Самая внутренняя зона — сетчатая — секретирует половые гормоны (андрогены) [2] .
![Зоны коркового вещества надпочечника]()
Главным органом-мишенью для альдостерона являются почки. Именно там данный гормон усиливает всасывание натрия, стимулируя выделение фермента Na + /K + АТФазы, таким образом повышая его уровень в плазме крови. Второй эффект воздействия альдостерона — выделение почками калия, снижая его концентрацию в плазме крови.
При гиперальдостеронизме, т.е. при повышенной альдостерона, натрия в плазме крови становится чрезмерно много. Это приводит к повышению осмотического давления плазмы, задержке жидкости, гиперволемию (увеличение объёма жидкости или крови в сосудистом русле), в связи с чем развивается артериальная гипертензия.
Дополнительно высокий уровень натрия повышает чувствительность стенок сосудов к их утолщению, воздействию веществ, повышающих артериальное давление (адреналин, серотонин, кальций и др.) и развитию фиброза (разрастанию и рубцеванию) вокруг сосудов. Низкий уровень калия в крови в свою очередь вызывает поражение почечных канальцев, что приводит к снижению концентрационной функции почек. В результате этого довольно быстро развивается полиурия (увеличение объёма выделяемой мочи), жажда и никтурия (ночное мочеиспускание). Также при низком уровне калия нарушается нейромышечная проводимость и pH крови [1] [3] . Сходным образом альдостерон влияет на потовые, слюнные и кишечные железы [2] .
Из всего выше сказанного можно сделать вывод о том, что основная жизненно важная функция альдостерона — это поддержание физиологической осмолярности внутренней среды, т. е. баланса суммарной концентрации растворённых частиц (натрия, калия, глюкозы, мочевины, белка).
Классификация и стадии развития гиперальдостеронизма
В зависимости от причин гиперсекреции альдостерона выделяют первичный и вторичный гиперальдостеронизм. Подавляющее большинство случаев данного синдрома являются именно первичными.
Первичный гиперальдостеронизм — это повышенная секреция альдостерона, независящая от гормональной системы, которая контролирует объём крови и кровяное давление. Он возникает из-за заболеваний надпочечников.
Вторичный гиперальдостеронизм — это повышенная секреция альдостерона, вызванная вненадпочечниковыми стимулами (заболеваниями почек, застойной сердечной недостаточностью).
Отличительные клинические признаки этих двух типов гиперальдостеронизма указаны в таблице ниже [10] .
Осложнения гиперальдостеронизма
У пациентов с гиперальдостеронизмом крайне часто наступают сердечно-сосудистые поражения и смерть в сравнении с людьми с аналогичной степенью артериальной гипертензии, но вызванной другими причинами [11] [12] . Такие пациенты имеют очень высокий риск развития инфаркта и нарушение ритма сердца, в частности фибрилляции предсердий, что потенциально является фатальным состоянием. Риск внезапной сердечной смерти у пациентов с гиперальдостеронизмом увеличивается в 10-12 раз [13] .
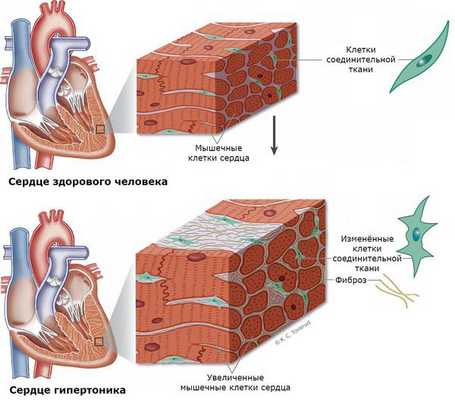
Нередко у пациентов выявляются вызванные гиперальдостеронизмом кардиосклероз, гипертрофия левого желудочка и дисфункция эндотелия (внутреннего слоя сосудов) [3] . Это объясняется прямым повреждающим влиянием альдостерона на миокард и сосудистую стенку. Доказано, что увеличение массы миокарда при гиперальдостеронизме развивается раньше и достигает больших размеров [1] .
![Увеличение миокарда при гипертонии]()
При развитии почечного синдрома (из-за интенсивного выведения почками калия) нарушается выведение ионов водорода. Это приводит к защелачиванию мочи и предрасполагает к развитию пиелита и пиелонефрита (воспаления почек), микроальбуминурии и протеинурии (выделения повышенного уровня альбумина и белка с мочой). У 15-20 % больных развивается почечная недостаточность с необратимыми изменениями работы почек. В 60 % случаев выявляется поликистоз почек [12] [13] .
Неотложным состоянием, связанным с гиперальдостеронизмом, является гипертонический криз. Его клинические проявления могут ничем не отличаться от обычных гипертонических кризов, проявляющихся головными болями, тошнотой, болями в области сердца, одышкой и т. д. Заподозрить нетипичный гипертонический криз в такой ситуации поможет наличие брадикардии (редкого пульса) и отсутствие периферических отёков. Эти данные в корне изменят тактику лечения и направят диагностический поиск в правильном направлении.
Диагностика гиперальдостеронизма
Для того чтобы не пропустить гиперальдостеронизм, вначале крайне важно выделить основные факторы риска, которые помогут заподозрить это заболевание. К ним относятся:
- артериальная гипертония II степени, т. е. стабильное повышение систолического (верхнего) артериального давления более 160/179 мм рт. ст., диастолического (нижнего) — более 100/109 мм рт. ст.;
- артериальная гипертония, устойчивая и/или плохо контролируемая препаратами (хотя этот признак далеко не всегда указывает на патологию);
- сочетание артериальной гипертонии с низким уровнем калия в крови (независимо от приёма мочегонных средств);
- артериальная гипертония и случайно выявленное (при УЗИ и/или КТ) образование надпочечника;
- отягощённый семейный анамнез: развитие артериальной гипертонии и/или острых сердечно-сосудистых катастроф до 40 лет, а также родственники, у которых уже был диагностирован гиперальдостеронизм [1][5] .
Следующий этап диагностики — лабораторное подтверждение. Для этого исследуется альдостерон-рениновое соотношение (АРС). Данное исследование является наиболее надёжным, информативным и доступным. Оно должно проводиться в ранние утренние часы: в идеале не позднее чем через два часа после пробуждения. Перед забором крови необходимо спокойно посидеть 5-10 минут.
ВАЖНО: некоторые препараты могут повлиять на концентрацию альдостерона и активность ренина плазмы, что, в свою очередь, изменит АРС. Поэтому за две недели до сдачи данного анализа важно отменить такие препараты, как спиронолактон, эплеренон, триамтерен, тиазидные диуретики, препараты из группы ингибиторов АПФ, БРА (блокаторов рецепторов ангиотензина) и другие. Врач должен проинформировать об этом пациента и временно назначить другую схему лечения гипертонии.
При положительном АРС необходимо провести подтверждающий тест с физиологическим раствором. Он проводится в условиях стационара, т. к. имеет ряд ограничений и требует исследование уровня альдостерона, калия и кортизола исходно и после 4-часового вливания двух литров физиологического раствора. В норме в ответ на большое количество вводимой жидкости выработка альдостерона подавляется, однако при гиперальдостеронизме подавить гормон таким способом не удаётся.
![Введение физиологического раствора для подтверждения результатов АРС]()
Низкий уровень калия в крови отмечается лишь в 40 % случаев синдрома, поэтому он не может быть надёжным критерием диагностики. А вот щелочная реакция мочи (вследствие повышенного выведения калия почками) является довольно характерным признаком патологии.
При подозрении на семейные формы гиперальдостеронизма проводится генетическое типирование (исследование на предрасположенность) с консультацией генетика [3] [6] .
Третий этап диагностики — топическая диагностика. Она направлена на поиски очага заболевания. Для этого используются различные способы визуализации внутренних органов.
УЗИ надпочечников — низкочувствительный метод диагностики. Предпочтительнее проводить КТ: она помогает выявить как макро- и микроаденомы надпочечников, так и утолщения ножек надпочечников, гиперплазии и другие изменения [14] .
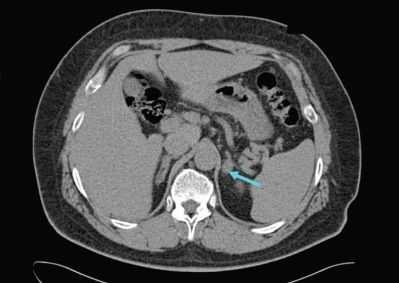
![Аденома левого надпочечника]()
Для уточнения формы гиперальдостеронизма (одностороннего и двустороннего поражения) проводится селективный забор крови из вен надпочечников в специализированных центрах [9] . Это исследование эффективно снижает риск необоснованного удаления надпочечника только по данным КТ [4] .
Лечение гиперальдостеронизма
Оперативное лечение
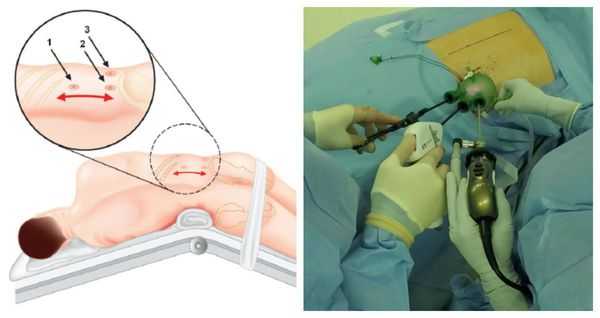
Методом выбора при аденоме надпочечника, синтезирующей альдостерон, и односторонней гиперплазии надпочечника является эндоскопическая адреналэктомия — удаление одного или двух надпочечников через небольшие разрезы.
![Эндоскопическое удаление надпочечника]()
Данная операция выравнивает концентрацию калия в крови и улучшает течение артериальной гипертонии почти у 100 % больных. Полное излечение без использования антигипертензивной терапии достигается примерно у 50 %, шанс контроля артериального давления на фоне адекватной терапии увеличивается до 77 % [1] . В ряде исследований продемонстрировано уменьшение массы миокарда левого желудочка и устранение альбуминурии, что значительно повышает качество жизни таких пациентов.
Однако если гиперальдостеронизм не был диагностирован долгое время, то и после операции артериальная гипертония может сохраняться, а развившиеся сосудистые осложнения могут стать необратимыми, как и поражение почек. Поэтому крайне важно выявлять и лечить гиперальдостеронизм как можно раньше [7] .
Противопоказания к удалению надпочечника:
- возраст пациента;
- небольшая ожидаемая продолжительность жизни;
- тяжёлая сопутствующая патология;
- двусторонняя гиперплазия надпочечников (когда нет возможности провести селективный забор крови из вен надпочечников);
- гормонально-неактивная опухоль надпочечника, ошибочно принятая за источник выработки альдостерона.
Консервативное лечение
При наличии этих противопоказаний, высоком риске операции или отказе от хирургического вмешательства показано консервативное лечение специальными препаратами — антагонистами минералокортикоидных рецепторов (АМКР). Они эффективно снижают артериальное давление и защищают органы от избытка минералокортикоидов [7] [12] .
К этой группе препаратов относится калийсберегающий диуретик спиронолактон, который блокирует минералокортикоидные рецепторы и препятствует развитию фиброза миокарда, связанного с альдостероном. Однако он обладает рядом побочных эффектов, воздействуя ещё и на рецепторы андрогенов и прогестерона: может привести к гинекомастии у мужчин, снижению либидо, вагинальным кровотечениям у женщин. Все эти эффекты зависят от дозы препарата: чем больше доза препарата и длительность его применения, тем побочные эффекты более выражены.
Также существует относительно новый селективный препарат из группы АМКР — эплеренон. Он не воздействует на стероидные рецепторы в отличие от его предшественника, поэтому число неблагоприятных побочных эффектов будет меньше [9] .
При двусторонней гиперпродукции альдостерона показано длительное консервативное лечение. При вторичном гиперальдостеронизме следует лечить основное заболевание и корректировать артериальную гипертонию также с помощью препаратов группы АМКР [12] .
Прогноз. Профилактика
Выявление и адекватное лечение гиперальдостеронизма в большинстве случаев позволяет устранить артериальную гипертонию и связанные с ней осложнения или значительно смягчить её течение. Причём чем раньше синдром будет диагностирован и пролечен, тем благоприятнее прогноз: улучшается качество жизни, снижается вероятность инвалидизации и фатальных исходов [4] . Рецидивы после своевременной односторонней адреналэктомии, выполненной по показаниям, не возникают.
При запоздалой диагностике гипертония и осложнения могут сохраняться даже после терапии.
Гиперальдостеронизм может довольно долго протекать только с симптомами гипертонии.
Постоянно высокие цифры артериального давления (более 200/120 мм рт. ст.), нечувствительность к антигипертензивным препаратам, низкий уровень калия в крови — далеко не обязательные признаки синдрома. А ведь именно на это, зачастую, ориентируются врачи, чтобы заподозрить заболевание, "пропуская" гиперальдостеронизм с относительно "мягким" течением на ранних этапах.
Чтобы решить эту проблему, врачам, которые работают с пациентами с артериальной гипертензией, необходимо выявлять группы высокого риска и прицельно обследовать их на предмет наличия гиперальдостеронизма.
Читайте также: