Моноканаликулярный стент, кольцевой стент при травме слезных канальцев. Применение
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
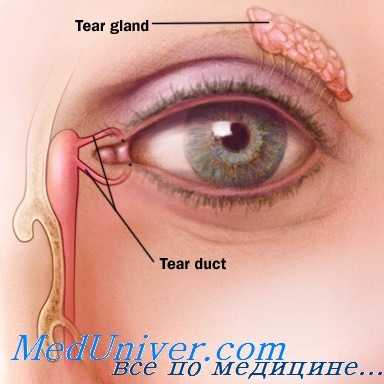
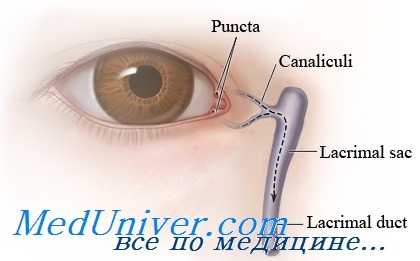
Актуальность. Стеноз слезных протоков - наиболее частая проблема в дакриологии и одна из основных причин дакриоцистита. Патогенетически обоснованным методом лечения дакриостенозов является рассечение спаек и стентирование слезных путей. Начало применения эндоскопии в ринологии дало импульс к использованию эндоназального доступа офтальмологами. В последние годы оптические волокна, предназначенные для эндоскопии, благодаря инновационным технологиям их изготовления, стали значительно тоньше, что сделало возможным их антеградное введение в просвет слезного канальца. Широко известны два типа стентов: полиуретановый (ЗАО «Медсил», РФ) и силконовый (FCI, Франция), отличающиеся не только материалом, из которого изготовлена трубка-стент, но и способом его проведения в лакримальный тракт [2, 4]. Ряд авторов предлагает использовать интубационные методы так же и при дакриоциститах путем реканализации естественного пути слезооттока [1]. Главным недостатком стентов является то, что они обтурируют собой просвет слезных протоков. Это приводит к жалобам пациентов на слезотечение в период нахождения стента в слезных путях. По этой же причине может возникать вторичная альтерация, в том числе и в слезном мешке. В этом смысле более выигрышно выглядит моноканаликулярное стентирование или использование дренажей типа «нунчаки». Однако, в первом случае возникают косметические неудобства, связанные с необходимостью крепления концов стента на лице, во втором — возможна дислокация дренажа в сторону конъюнктивального мешка, ввиду того, что его свободные концы не фиксируются в полости носа, а силиконовая трубка, смоченная слезной жидкостью, легко скользит и мигрирует [6]. Таким образом, основным различием между дренированием и стентированием слезных путей является то, что стент, поддерживая просвет слезных протоков, препятствует пассажу слезы, а дренаж позволяет ей из конъюнктивального мешка через трубку оттекать в полость носа. Также через дренаж можно проводить лечебные промывания.
Сравнительный анализ материалов, из которых изготавливается трубка, показывает, что полиуретан обладает низкими фрикционными свойствами, обеспечивает сохранение просвета слезоотводящих путей, поддерживая их форму. Однако такие стенты быстро колонизируются штаммами различных бактерий и инкрустируются кристаллами солей, а при длительном использовании выделяют токсичные продукты. Все эти обстоятельства ограничивают применение полиуретановых стентов лишь краткосрочным периодом.
Силикон же относится к наиболее биоинертным материалам, обеспечивая максимальную биосовместимость, и по своим физико-химическим свойствам (эластичность, прочность и т.д.) близок к мягким тканям организма и при импланатации вызывет меньше раздражения, чем многие другие синтетические материалы. При этом описаны случаи разрастания грануляций и прорезывания канальцев силиконовыми трубками [2,7], что не встречается при использовании полиуретана [5].
Цель Провести сравнительную оценку стентирования и дренирования слезоотводящих путей, а также определить место трансканаликулярной эндоскопии при дакриостенозах различного уровня.
Материал и методы Проанализированы результаты 500 операций по поводу непроходимости слезных путей разного уровня. Эндоскопическое исследование слезных путей с использованием систем «Flexiscope» (Италия) и «Machida» (Япония) было проведено 56 пациентам с эпифорой, вызванной блокадой слезоотведения на различных уровнях. Процедура выполнялась под местной анестезией в условиях стерильной операционной. Эндоскоп вводился со стороны слезной точки и направлялся антеградно к устью носослезного канала. Для облегчения скольжения эндоскопа использовался вискоэластик. Меняя угол наклона рукоятки эндоскопа, а также посредством манипуляций с веком, достигалась соосность эндоскопа и просвета слезного канальца. Одномоментно с исследованием выполнялись вмешательства, направленные на разрушение препятствий слезооттоку.
В зависимости от конкретной клинической ситуации использовались: полиуретановые стенты и дренажи (ЗАО «Медсил»), силиконовые стенты (FCI), установленные на сроки от 2 недель до 4 месяцев, в том числе последовательно (1-м этапом полиуретановый дренаж, 2-м - силиконовый стент). Возраст пациентов - от 4 месяцев до 85 лет. Мужчин - 23,57%, женщин - 76,43%. По уровню непроходимости пациенты разделились следующим образом: пресаккальный, т.е непроходимость на протяжении и в устье слезных канальцев – 13,76%, постсаккальный, в том числе у новорожденных – 71,38%, непроходимость носила многоуровневый характер в 14,86% случаев. Основным отличием дренажа от стента являлось наличие в стенке дренажной трубки овального отверстия [3]. При использовании данной конструкции отверстие располагается в медиальном углу глаза и обращено латерально для создания условий оттока слезной жидкости по дренажу. Это же отверстие может быть использовано для лечебных промываний слезных путей антибактериальными препаратами, глюкокортикостероидами и ферментами. При необходимости интраоперационно в стенке трубки может производиться дополнительная перфорация, что способно повысить эффективность лечебных промываний. В ходе работы пациенты были также разделены на следующие группы: 1 - после устранения непроходимости слезных путей или формирования анастомоза биканаликулярно установливались полиуретановый или силиконовый стенты, 2 – то же с проведением полиуретанового дренажа, у 3-й группы больных лечение носило этапный характер: вслед за непродолжительным (2-4 недели) дренированием слезных путей проводился силиконовый стент, но уже на более продолжительное время (2-4 месяца).
Трансканаликулярно через дилятированную коническими зондами нижнюю слезную точку в слезно-носовой канал или дакриоцисториностому проводился зонд Ритленга, снабженный внутренним каналом. Через зонд проводилась окрашенная леска-проводник, конец которой под контролем риноскопа извлекался из полости носа при помощи крючка Ритленга. Удалялся зонд Ритленга. Со стороны преддверия носа на леску одевалась дренажная трубка. Удерживая ее на проводнике, тянули за противоположный конец лески до выведения верхнего конца дренажной трубки из нижней слезной точки. Через дилятированную коническими зондами верхнюю слезную точку в слезно-носовой канал или дакриоцисториностому проводился зонд Ритленга. Через зонд проводилась окрашенная леска-проводник, конец которой под контролем риноскопа извлекался из полости носа при помощи крючка Ритленга. Удалялся зонд Ритленга. Верхний конец лески вводился в трубку. Удерживая трубку на леске, тянули за противоположный конец лески, при этом верхний конец трубки вместе с леской внедрялся через верхнюю слезную точку в одноименный слезный каналец, а затем в слезно-носовой канал или дакриоцисториностому, полость носа и выводился наружу через преддверие носа. Леска извлекалась из полости дренажной трубки. Концы трубки подрезались на уровне преддверия носа или погружались в полость носа и там клепировались.
Замена дренажа (группа № 3) производилась через 2-4 недели интубации. Для этого полиуретановый дренаж рассекался в зоне свободного доступа между слезными канальцами. В оба «рукава» трубки вводились лески-проводники, на которых зажимами типа «москит» фиксировались две половины силиконового стента, после проведения которого фрагментированный полиуретановый стент удалялся.
Результаты Трансканаликулярная эндоскопия позволила визуально определить уровень непроходимости слезоотводящих путей. По характеру содержимого слезного мешка, состоянию его слизистой можно было судить о клинической форме дакриоцистита. Эндоскопическая система «Flexiscope» имеет в своем составе режущий наконечник с ротационной подачей, который заключен в общий со световодом кожух. Это позволило одновременно с исследованием производить дозированное рассечение синехий стенок канальцев. Система имеет в качестве дополнительной опции канал и совместимый с ним лазерный световод. Эта технологическая инновация предназначена как для рассечения мягкотканых препятствий слезооттоку, так и для выполнения трепанации кости в случае необходимости формирования дакриоцисториностомы при обструкции вертикального колена слезоотводящего тракта. Преимуществами лакримального эндоскопа фирмы «Machida» являются лучшее качество изображения исследуемых структур и, как следствие, более точная интерпретация полученных в ходе исследования данных, а также меньший вес устройства и удобная геометрия эндоскопа, сконструированного с учетом анатомических особенностей в зоне проводимых манипуляций.
Наилучшие результаты были достигнуты в случаях постсаккальных стенозов новорожденных (98% эффективности). При этом как в 1-ой, так и во 2-ой группе результаты были схожими и отличались лишь сохранением эпифоры в период нахождения трубки в слезных путях у новорожденных из 1-ой группы. Ни в одном из этих случаев не потребовалось пролонгирования интубации более 2 недель.
Использование интубационных методов при дакриоциститах у взрослых оказалось целесообразным при неосложненном течении воспаления и на его начальном этапе (катаральный дакриоцистит). Мы убедились в том, что в этих случаях краткосрочное дренирование полиуретановой трубкой предпочтительно, при этом на стенку дренажа наносились дополнительные отверстия так, чтобы пассивному и активному орошению подвергались полость слезного мешка и устье слезно-носового протока. Сопоставление результатов операций у этих пациентов показало рост эффективности на 20% в группе №2 по сравнению с группой №1.
В ходе дакриоцисториностомии стентирование и дренирование применялось в следующих случаях: многоуровневые дакриостенозы, наличие спаек по ходу и в устье слезных канальцев, флегмона слезного мешка, лакримальные свищи, дакриоцистоцеле, сопутствующая ринопатология, выраженное интраоперационное кровотечение, травмы, рецидивы. Усредненное распределение положительных исходов хирургического лечения в трех группах исследования у таких пациентов было – 89%, 93,4%, 94,2% соответственно и зависело от тяжести исходного состояния.
После операций по поводу канальцевой обструкции основной жалобой пациентов 1-ой группы было слезотечение и слезостояние, которое сохранялось до тех пор, пока стент заполнял слезоотводящий тракт. Позже стент удалялся и проводились лечебные промывания 2-3 раза в неделю в течение 1 месяца. В 72% случаев восстановление нормального слезооттока после завершения лечения было достигнуто. Пациентам 2-ой группы на протяжении всего периода дренирования проводилось промывание слезных путей через окно в трубке, которое было доступно у внутреннего угла глаза. Также эту процедуру было возможно проводить и ретроградно через концы трубки, выведенные из полости носа. Эффективность лечения в группе №2 превысила 80%. Кроме того, значительно меньшее число пациентов 2-ой группы жаловалось на слезотечение в период нахождения дренажа в слезных путях.
Травматические повреждения канальцев и врожденные атрезии очень вариативны и отличаются главным образом протяженностью облитерированного участка слезных протоков. Часто таким пациентам приходится производить протезирование канальцев или накладывать лакориностому. Интубационные методы в таких случаях не отличаются высокой эффективностью, однако статистически достоверным оказалось их преимущество при условии длительной интубации дренажами и стентами, отличающимися по своим физико-химическим свойствам (группа №3). Способность полиуретановых дренажей (в отличие от силиконовых) создавать хороший каркас для поврежденных канальцев, сохранение перфораций, нанесенных на стенку трубки, и проходимости особенно важны в ранний послеоперационный период, когда эпителизируются раневые поверхности. Биоинертность, фрикционность, смачиваемость силиконовой трубки позволяли удерживать ее в слезных путях пациентов этой группы длительное время. Данный метод позволил восстановить слезоотведение, примерно, в половине трудноизлечимых случаев рецидивирующих пресаккальных дакриостенозов
Выводы Эндоскопия слезных протоков обладает высокой информативностью и с успехом может заменить такие травматичные методы исследования уровня окклюзии слезных путей как диагностическое зондирование и бужирование, а также контрастную рентгенографию. Использование эндоскопии в ходе реканализирующих операций открывает дополнительные перспективы в хирургии лакримальных структур с точки зрения ее малоинвазивности.
Стентирование и дренирование сопоставимо по эффективности, однако дренирование открывает дополнительные возможности для более полноценного лечения дакриостенозов. Лакримальные стенты и дренажи, отличаясь по своим физико-химическим свойствам, не являются взаимоисключающими при лечении дакриостенозов. Они, имея каждый свои преимущества, могут с успехом использоваться в режиме "one by one".
Моноканаликулярный стент, кольцевой стент при травме слезных канальцев. Применение
Восстановление слезных канальцев при травме. Принципы
При любом повреждении в области медиального края глазной щели должен был произведен тщательный осмотр на предмет выявления повреждения слезных канальцев. При отсутствии полной уверенности в том, повреждены ли канальцы, следует расширить слезные точки и прозондировать их зондом Боумена 0 или 00, стараясь избежать ложного хода. Если зонд проходит правильно, то, скорее всего, слезоотводящие пути интактны.
Хирургическое восстановление слезных канальцев
Для восстановления поврежденных канальцев существует множество методов. Среди них моноканаликулярный стент, биканаликулярный кольцевой стент и биканаликулярный стент Кроуфорда. Стент обеспечивает адекватное восстановление поврежденных краев канальцев, обычно его устанавливают на 3—6 месяцев. При установке внеоперационной обычно не используют стент Кроуфорда, так как его установка часто требует применения седативных средств.
Установка моноканаликулярного стента требует наличия только одного канальца. Это особенно важно для небольшого процента людей, не имеющих общего канальца, когда затруднен биканаликулярно-кольцевой способ интубации. Биканаликулярные стенты, такие как стент Кроуфорда и кольцевой стент, более устойчивы, и их смещение менее вероятно.
При выборе любого из этих методов операционное поле моют, анестезируют и обкладывают стерильными салфетками. Особое внимание уделяют выделению концов травмированных канальцев, для этого ткани осматривают при помощи хирургической лупы или в операционный микроскоп. Чаще всего их довольно легко обнаружить, ориентируясь на то, что края поврежденного канальца беловатые, «сверкают эпителиальной белизной».
Если не удалось таким образом обнаружить место разрыва, то существует несколько приемов для его идентификации:
1. Окраска травмированной области при помощи стерильной флуоресцеиновой полоски поможет обнаружить место разрыва канальцев.
2. Введение окрашенного физиологического раствора или вискоэластика через интактные пути покажет пассаж жидкости через травмированный конец канальца.
3. Можно ввести воздух через слезную точку и наблюдать выделение пузырьков из разорванного конца.
4. Если проксимальный конец травмированного канальца все же не выделен, надо после погружения в мазь с содержанием стероидов и антибиотиков ввести зонд типа «поросячий хвост» через интактную слезную точку и аккуратно закрутить его по направлению поврежденного канальца, следуя нормальному анатомическому строению последнего. Конец зонда будет выведен в месте разрыва канальца. Пробу следует проводить осторожно, чтобы избежать ложного хода.
Когда просвет поврежденного канальца найден, следует приступать к его восстановлению. Каждую методику мы опишем отдельно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Моноканаликулярный стент (Mini Monoka) используют при повреждениях наружных 2/3 одного канальца.
• Находят просветы поврежденного канальца, как было описано выше.
• Моноканаликулярный стент подрезают до нужного размера таким образом, чтобы конец капилляра находился в слезном мешке (приблизительно 12 мм).
• Слезную точку расширяют и продвигают стент через оба поврежденных конца.
• Глубокие мягкие ткани сшивают узловыми швами 7—0 полигликолиевой кислоты. Швы накладывают близко к поврежденным концам канальца для лучшего сближения. При слишком большом напряжении используют 5—0 полигликолиевую кислоту.
• Кожу сшивают прерывными (узловыми) швами 7—0 полигликолиевой кислоты или нейлоном.
• Два прерывных 8—0 викриловых шва накладывают через медиальный и латеральный концы основания стента для того, чтобы фиксировать его к краю века.
Кольцевой стент при травме слезных канальцев
Данный метод заключается в установке силиконового биканаликулярного стента в канальцевую систему, используя зонд типа «поросячий хвост». Его применение было описано ранее, и он используется не только при канальцевых повреждениях, но и при реконструкции внутреннего угла глаза с захватом слезоотводящих путей по Moh.
• Зонд типа «поросячий хвост» проводят через неповрежденный каналец и выводят через поврежденный проксимальный конец.
• Участок зонда прошивают 6—0 проленовым швом (иглу удаляют).
Затем зонд удаляют, натягивая шов через каналец.
• Противоположный конец зонда проводят через противоположную слезную точку и выводят через дистальный разорванный конец. Другим концом 6—0 проленовой нити прошивают участок зонда и удаляют его, протягивая шов через слезную точку. 6—0 проленовая нить служит проводником, по которому проводят силиконовый стент.
• Используя часть силиконового стента Кроуфорда (внутренний шов удаляют), стент проводят вокруг 6—0 проленового шва и через канальцевую систему. Покрытие стента мазью с антибиотиком облегчит его установку. Нужно постараться не перекручивать шов, так как перекруты значительно усложняют процесс. Стент вставляют в одну слезную точку и продвигают через поврежденный край, затем выводят через другую слезную точку.
• Оба конца силиконового стента захватывают в иглодержатель для предотвращения прошивания, а также для того, чтобы стент не сорвался. Когда канальцевая система полностью канюлирована, следует заняться восстановлением целостности окружающих мягких тканей, как было описано выше. Если предпринять такие действия до завязывания стента, то удастся избежать оставления слишком длинного стента, который может травмировать роговицу.
• После восстановления целостности мягких тканей подбирают нужный размер стента и концы его захватывают иглодержателем. Затем стент подрезают до нужного размера силиконовым стриппером. Силиконовый стриппер позволяет отделить силиконовую трубку от лежащего под ним проленового шва. Стриппер захватывают указательным пальцем и большим пальцем берут за самые нижние отверстия инструмента для лучшего контроля. Трубку обхватывают и инструмент аккуратно оттягивают кверху.
• Когда стент подрезан до нужного размера, его подвязывают к проленовому шву тремя узелками.
• Узелок аккуратно поворачивают к слезному мешку, используя зажимы и иглодержатели.
Лечение взрывных переломов глазницы. Рекомендации
В начальном посттравматическом периоде пациенты получают системную антибиотикотерапию (обычно цефалоспорины первого поколения), назальные деконгестанты и пакеты со льдом. Некоторые предпочитают отложить хирургическое лечение «взрывных» переломов на 7—10 дней для уменьшения отека и рассасывания кровоизлияний. Для разработки хирургического подхода необходима консультация хирурга-окулопластика.
Диплопия часто является следствием кровоизлияний и отеков в тканях нижней прямой мышцы и, в таком случае, разрешается спонтанно. Время проведения и показания для хирургического вмешательства являются предметом обсуждения. Выделяют следующие показания для проведения хирургического вмешательства:
1. Признаки ущемления нижней прямой мышцы глаза или околомышечных тканей с явлениями диплопии
2. Заметный энофтальм через 7—10 дней после травмы
3. Травмы с высоким риском последующего энофтальма:
а. обширные переломы дна и/или медиальной стенки
б. комбинированные переломы дна и медиальной стенки глазницы
Если диплопия сохраняется по прошествии 7—10 дней, для подтверждения ущемления мышцы выполняют форсированный тест. Лидокаином или тетракаином проводят местную анестезию глазного яблока книзу от лимба. Глазное яблоко захватывают пинцетом за конъюнктиву и поворачивают кверху. При положительном тесте глазное яблоко повернуть невозможно, что указывает на ущемление нижней прямой мышцы, нижней косой мышцы или фиброзной околомышечной ткани. Форсированный тест также проводится для определения, является ли мышечная дисфункция следствием отека или гематомы.
Глазное яблоко захватывают зажимом за конъюнктиву и пациента просят смотреть в направлении исследуемой мышцы (обычно вниз — при поражении нижней прямой мышцы). Таким образом, врач сможет определить, действует ли мышца.
Намного легче и эффективнее проводить коррекцию энофтальма в ранние сроки, так как по прошествии определенного времени энофтальм осложняется атрофией орбитальной жировой клетчатки и укорочением наружных мышц глаза. Операция выполняется под общей анестезией. Доступ к дну глазницы можно получить через трансконъюнктивальный или субцилиарный разрез. Обнажают надкостницу нижнего орбитального края, и надкостницу глазницы осторожно приподнимают от дна и медиальной стенки. Ущемленные ткани аккуратно высвобождают при помощи тупых инструментов, например, периостального элеватора Freer.
Хирург ищет задний край перелома дна для установки орбитального имплантата. В качестве имплантата используют множество материалов, включая нейлон (супрамид), пористый полиэтилен, тефлон, кость и др. Целью является реконструкция нормального контура стенок глазницы и репозиция орбитальных тканей в глазницу. Следует соблюдать осторожность, чтобы не повредить подглазничный нерв, который хорошо заметен на дне глазницы. Доступ к медиальной стенке глазницы осуществляется через дно или транскарункулярный разрез. При обширных переломах медиальной стенки часто требуется установка имплантата.
Небольшие переломы медиальной стенки обычно не требуют восстановления, они редко вызывают ущемление мышц. Надкостницу сшивают, так же как конъюнктиву или кожу. Могут быть оставлены шелковые швы на реберном крае нижнего века (обеспечивающие натяжение), которые фиксируются к коже лба в течение первой послеоперационной недели. Это поможет предотвратить ретракцию нижнего века и обеспечит защиту глаза в течение раннего послеоперационного периода. Пациенты получают подробные инструкции не выдувать воздух с силой через нос и избегать чрезмерной физической нагрузки.
Некоторые переломы глазницы требуют немедленного хирургического вмешательства, в таких случаях отсрочка на 7—10 дней невозможна. Они носят название «переломы-ловушки», некоторые авторы описывают их как «взрывные» переломы типа «white-eyed».13 Переломы такого типа обычно наблюдаются у детей и молодых людей при неполном переломе нижней стенки глазницы. В таких клинических случаях может потребоваться консультация специалиста по окулопластике. Неоскольчатый (в виде петли) перелом дна глазницы сопровождается плотным ущемлением нижней прямой мышцы или околомышечных тканей.
Такой перелом напоминает перелом по типу «зеленой ветки», при котором кость не ломается полностью, а может деформироваться и быстро возвращаться в исходную конфигурацию вследствие высокой эластичности костей в молодом возрасте. Временная деформация дна глазницы вызывает прочное ущемление тканей. У таких пациентов отмечается значительное ограничение подвижности глазного яблока при взгляде вверх. Кроме того, у данных пациентов может наблюдаться окулокардиальный рефлекс с тошнотой, рвотой, брадикардией и блокадой сердца.
Такое состояние может быть опасно для жизни, при симптомах сердечной блокады рекомендуется провести ЭКГ-исследование. Корональная КТ может выявить «отсутствие» нижней прямой мышцы при практически нормальном дне глазницы с локализацией мышцы в верхнечелюстной пазухе. Томограммы могут быть интерпретированы как нормальные, в таком случае необходимо получить мнение нескольких специалистов. При таком переломе может быстро развиться ишемия нижней прямой мышцы с ишемическим некрозом, следствиями которого будут фиброз и потеря функции мышцы. Следовательно, операцию рекомендуется провести в пределах 24—72 часов для предотвращения некроза мышцы и уменьшения риска тяжелой брадикардии вследствие развития окулокардиального рефлекса.
Медиальная стенка глазницы образована преимущественно тонкой бумажной пластинкой решетчатой кости и также легко подвержена переломам; переломы медиальной стенки часто сочетаются с переломами дна глазницы. Изолированные переломы медиальной стенки встречаются намного реже и требуют особого наблюдения, так как могут быстро вызвать нарушения подвижности глаза. Они также являются частой причиной позднего развития энофтальма. Осложнения переломов медиальной стенки глазницы включают ущемление внутренней прямой мышцы, эмфизему глазницы, псевдосиндром Дуэйна, при котором наблюдается втягивание глазного яблока в глазницу, верхнее веко опускается при повороте глаза к носу (абдукции), а также может возникнуть поздний энофтальм.17 Хирургическое вмешательство требуется при обширных переломах медиальной стенки глазницы и при ущемлении мышцы костными отломками.
Переломы крыши глазницы обычно наблюдаются в результате серьезных травм, например, после дорожно-транспортных происшествий или падений с высоты. Такие переломы могут сочетаться с повреждением лобной пазухи и внутричерепных структур. В числе осложнений могут быть истечение цереброспинальной жидкости, внутричерепное кровоизлияние, дисбаланс наружных мышц глаза с болезненным ограничением подвижности при взгляде вверх, птоз, травматическое энцефалоцеле, менингит и абсцесс мозга. Верхняя поднадкостничная гематома может вызвать смещение глаза книзу. При простом переломе крыши глазницы без перелома внутренней пластинки черепной кости доступ к нему может быть осуществлен через разрез со стороны надбровной дуги. Более сложные переломы требуют консультации нейрохирурга и/или оториноларинголога.
Назоэтмоидальные переломы являются результатом контузионной травмы, направленной в среднюю часть лица. Переломы костей носа и решетчатой кости обычно сопровождаются расширением внутреннего угла глазной щели (травматический телекантус) и уплощением переносицы. Переломы, захватывающие слезоотводящие пути, сопровождаются обструкцией носослезного протока и слезотечением. Переломы медиальной стенки глазницы могут распространяться в переднюю черепную ямку. Такие переломы часто захватывают решетчатую пластинку с проникновением костных отломков в переднюю черепную ямку и сопровождаются ринореей цереброспинальной жидкости.
При продолжающейся ринорее СМЖ требуется консультация нейрохирурга. Хирургическое вмешательство при травматическом телекантусе или обструкции носослезного протока выполняет специалист по окулопластике.
Переломы латеральной стенки глазницы также наблюдаются при серьезных травмах, обычно после дорожно-транспортных происшествий, падений или ударов тупыми предметами. Такие переломы редко сопровождаются нарушениями подвижности глаза, но могут также требовать хирургического восстановления при значительных косметических дефектах или при соприкосновении костных отломков с содержимым глазницы.
Наблюдаются также тройные переломы, так называемые переломы «треножника», с захватом скуловой кости. Обычно такие переломы происходят в трех местах: по линии лобно-скулового шва, по скуловой дуге и по нижнему краю глазницы около скуловерхнечелюстного шва. При этом скуловая дуга смещается с уплощением скулового бугра, расширением и смещением книзу латерального края глазницы, увеличением орбиты с энофтальмом; кроме того наблюдается гипестезия щеки и верхних зубов на соответствующей стороне. Уплощение щеки может быть скрыто отеком тканей лица. Перелом может распространяться на дно глазницы с ущемлением ее содержимого и развитием диплопии.
Пациенты часто жалуются на затруднение жевания (тризм), которое является следствием повреждения височно-нижнечелюстного сустава. Большинство хирургов рекомендуют выполнять хирургическое вмешательство в ранние сроки, так как позднее восстановление усложняется развитием фиброза и может потребовать проведения остеотомии.
Переломы в средней части лица называются переломами Ле Форт. При переломе Ле Форт I вовлекается нижний отдел верхней челюсти, глазница не повреждается. Переломы Ле Форт II, также называемые пирамидальными переломами, включают перелом верхней челюсти, костей носа, нижнего края глазницы, медиальной стенки и дна глазницы, а также могут захватывать слезоотводящие пути. Перелом Ле Форт III, называемый также черепно-лицевым разобщением, захватывает кости носа, медиальную и латеральную стенки глазницы и скуловую дугу. При таком переломе лицевой скелет соединен с черепом только мягкими тканями. Вовлечение глазницы при II и III типах может осложняться ущемлением глазодвигательных мышц и развитием диплопии.
Ранние послеоперационные осложнения после восстановления переломов дна и медиальной стенки глазницы включают присоединение инфекции, кровотечение, потерю зрения и развитие диплопии. При слишком большом размере имплантата может развиться компрессия зрительного нерва. Пациенты с ущемлением глазодвигательных мышц часто имеют преходящую послеоперационную диплопию вследствие геморрагии и отека тканей. При старом переломе могут развиваться рубцевание и фиброз нижней прямой мышцы, и в таком случае, даже при полном высвобождении мышцы, может сохраняться диплопия. Таким пациентам может потребоваться операция по коррекции косоглазия для восстановления бинокулярного зрения. Перед проведением таких операций обычно требуется выждать достаточное время (обычно 6 месяцев) для послеоперационного восстановления функции мышцы.
Поздние осложнения обычно связаны с орбитальным имплантатом. Среди них присоединение инфекции, смещение и экструзия. Кроме того, может образоваться интраорбитальная киста, особенно при наличии в орбите остатков слизистой оболочки пазухи. В редких случаях в окружающей имплантат капсуле может развиться позднее кровотечение, при этом пациенты жалуются на боль, ощущение давления, воспаление и проптоз.
Восстановление старых переломов затруднено, т.к. они обычно осложняются развитием фиброза ущемленных тканей и атрофией жировой клетчатки. Тем не менее, часто имеют место хорошие результаты. Другие возможности хирургического лечения включают коррекцию косоглазия для восстановления бинокулярного зрения и блефаропластику верхнего века с целью маскировки энофтальма на травмированной стороне.
Лакримальные имплантаты в хирургии слезоотводящих путей

В настоящем обзоре рассматриваются различные варианты лакримальных имплантатов, которые используются в хирургии слезоотводящих путей. Описаны актуальные и применявшиеся ранее методики восстановления слезоотведения, способы реканализации и операции дакриоцисториностомии наружным и эндоназальным способами с применением дренажей различных форм, размеров и дизайна, что часто определяет исход операции и степень её эффективности. Лакримальные имплантаты постоянно модифицируются и совершенствуются. Показания к имплантации, сроки экстубации до сих пор чётко не определены. Методики восстановления слезоотведения, применение лакримальных дренажей, наиболее эффективные модели имплантата, показания и противопоказания, проведение экспериментальных исследований — все эти вопросы ещё ждут своего дальнейшего изучения.
Ключевые слова
Полный текст
Введение
Заболевания слёзных органов составляют 25 % случаев всех заболеваний глаз. Мучительное слезотечение приводит к длительному дискомфорту, моральным переживаниям и ограничению работоспособности молодого населения. Инфицирование на фоне застоявшейся слезы способствует воспалению слезоотводящих путей и развитию тяжёлых гнойных кератитов вплоть до угрозы гибели глаза [18].
Исторические аспекты восстановления слезоотведения
Проблема нарушений слезоотведения была актуальной с давних времён, и уже тогда были предложены первые способы лечения [30, 39].
В 1857 г. W. Bowman (1816–1892) сконструировал набор зондов различного диаметра, который и в наши дни активно используется в современной дакриологии при зондировании слезоотводящих путей [18].
Зондирование слезоотводящих путей (СОП) долгое время считалось эффективным методом лечения нарушений слезоотведения [15]. В настоящее время эффективность этого метода подвергается сомнению [18, 42], но ряд исследователей описывают хорошие результаты при данном способе лечения [17].
На смену зондированию в конце XIX в. пришла хирургическая операция по созданию нового эпителиального соустья между слёзным мешком и слизистой носа — дакриоцисториностомия (ДЦР) [39, 56].
В 1893 г. G.W. Caldwell предложил создать соустье между слезоотводящими путями и полостью носа на уровне носо-слёзного протока в области нижней носовой раковины, резецировав её передний конец [30].
Позднее, в 1904 г. А. Toti разработал операцию дакриоцисториностомии наружным доступом [56], модификацию которой применяют и в настоящее время [32].
Ринолог J. West совместно с офтальмологом R. Randolph в 1910 г. разработали операцию ДЦР внутриносовым доступом. Данный метод был описан в работах других авторов, доказав свою эффективность и результативность [60].
Анализ данных, полученных после операций различными доступами и методиками, показал положительные результаты: эффективность лечения составила 65–100 % после наружной ДЦР и 84–94 % при эндоскопической эндоназальной ДЦР (ЭЭДЦР) [48]. Частота рецидивов, по данным автора, при наружной ДЦР составляет 9–23 % против 2–16 % при ЭЭДЦР [13]. Таким образом, эндоназальные методики не уступают по эффективности наружной ДЦР и позволяют добиться хороших результатов.
С появлением новых материалов в XX в. получила распространение операция реканализации [2], которая заключается в зондировании слезоотводящих путей и последующей временной интубации просвета имплантатом — шёлковым, металлическим, эластическим, латексным [11], полиэтиленовым [10], пластиковым [9], нейлоновым, металлическим, полиуретановым или силиконовым [2, 34, 42]. Такое хирургическое вмешательство менее травматично и более физиологично восстанавливает естественный слезоотток без выполнения технически сложной операции [2].
Лакримальные имплантаты — современные способы профилактики заращения дакриостомы
Несмотря на эффективность оперативного лечения, рецидивы и заращение искусственного соустья привели к проблеме дренирования и интубации дакриостомы (до 30 % случаев).
Преобладание процессов грануляции с формированием рубца [2], длительный воспалительный процесс в области дакриостомы, образование синехий между латеральной стенкой полости носа и средней носовой раковиной являются причинами рецидивов после операции [23]. По данным авторов, процессы репарации и эпителизации созданного в ходе операции соустья завершаются в среднем к 60-м суткам после операции [1]. Интубация различными стентами сформированного соустья позволяет предупредить развитие избыточных репаративных процессов, способствуя длительному функционированию созданных путей слезоотведения [2].
Необходимой биологической безопасностью отличаются синтетические полимерные материалы (нейлон, полихлорвинил, полиуретан, силикон), благодаря чему имплантация трубок в слезоотводящие пути получила столь широкое распространение [12].
J. Henderson в 1950 г. впервые применил в качестве лакримального имплантата полиэтиленовую трубку [40]. A. Huggert использовал эти имплантаты в биканаликулярной интубации, которые в том же виде применяются и по сей день [41]. Концы трубок автор проводил в полость носа через слёзные канальцы, где скреплял их друг с другом с формированием соединяющей петли между нижней и верхней слёзными точками. В 1966 г. H. Bjork применил данную методику при ЭДЦР [28].
D. Gibbs в 1967 г. при операции ДЦР использовал для интубации силиконовые имплантаты [37]. Силикон наиболее мягкий и биосовместимый материал, при его интубации уменьшилась частота осложнений (разрывы слёзных точек и канальцев, повреждение роговицы), связанные с жёстким полиэтиленом. Силикон обладает такими физико-химическими свойствами, как прочность и эластичность, не вызывает раздражения, не подвержен резорбции, фиксируется в полости носа, а его видимая часть во внутреннем углу глаза абсолютно незаметна для окружающих. Такие свойства силикона позволяют безопасно и эффективно проводить интубацию СОП. Данная техника интубации широко применима при наружной и эндоназальной ДЦР. В последние годы биканаликулярная интубация силиконовыми имплантатами стала рутинной процедурой с целью профилактики заращения соустья.
Однако, учитывая возможные осложнения (образование грануляций в полости носа и слёзных канальцев, рассечение слёзных точек, повреждение роговицы) и высокую стоимость имплантатов, многие авторы в течение длительного времени обсуждают целесообразность и чёткие показания к интубации дакриостомы [54, 58]. Ряд авторов указывают на отсутствие различий между результатами операций дакриоцисториностомии с интубацией и без неё [35].
Несоответствие диаметра соустья и биканаликулярных силиконовых имплантатов привело к созданию более сложных конструкций для интубации дакриостомы.
В 1962 г. Б.Ф. Черкунов [19] применил резиновый колпачок из детской соски с прорезями для тампонады дакриостомы, чтобы предотвратить адгезию её краёв. Колпачок упирался в наружную стенку слёзного мешка, но не препятствовал промыванию СОП и оттоку слезы. Дренаж удалялся на 6–7-е сутки при наружной ДЦР.
В.Г. Белоглазов при ЭДЦР использовал имплантат из полихлорвиниловой трубки [3]. Максимально короткий, он вводился в купол слёзного мешка посредством небольшого сформированного «козырька» и фиксировался в области вскрытого носо-слёзного протока, заходя за края слёзного мешка на 2–3 мм.
Конструкцию из силикона для интубации СОП применил M. Elie. Она состояла из тонкой части, имплантированной в нижний слёзный каналец, и более толстой, которая вводилась в слёзный мешок и дакриостому [33].
М.Ю. Султанов при наружной ДЦР предложил использовать вкладыш в виде полукольца для фиксации слизистых оболочек, изготовленный из сивилена и полиэтилена [16].
A. Aguirre Vila-Coro для имплантации по время операции ДЦР применял педиатрический силиконовый катетер Foley No. 8 с надувным баллоном, баллон при этом располагался в слёзном мешке, а сам катетер — в носовой полости. После полного заживления баллон сдували и удаляли через нос [22].
В литературе также встречаются результаты успешной имплантации отологических Т-образных имплантатов при эндоназальной хирургии [45].
Группа авторов предложила дренаж, применяемый при трансканаликулярной лазерной эндоскопической дакриоцисториностомии, который представляет собой силиконовую трубку цилиндрической формы, концы которой фиксируются в полости слёзного мешка посредством элементов в виде «оперения стрелы» и в полости носа. Вдоль дренажа выполнены дополнительные желобки для дополнительного оттока слёзной жидкости. Имплантация дренажа производится с помощью пластикового инжектора [5].
Срок экстубации дакриостомы до сих пор остаётся дискутабельным вопросом. В среднем он составляет 2 месяца после операции [14], но возможно и его увеличение до 6 месяцев [36]. При этом прямой корреляции успешного исхода операции со сроком экстубации не выявлено [27]. Осложнения вследствие длительной интубации дакриостомы приводят, по мнению авторов, к рецидивам заболевания и требуют дальнейшего тщательного изучения [26].
Лакримальные имплантаты и способы интубации в лечении дакриостенозов
Дакриостеноз — неполное сужение слезоотводящих путей, представляющее собой актуальную проблему в разделе дакриологии. Данная патология приводит не только к слезотечению и длительному дискомфорту, но и является частой причиной развития дакриоцистита.
Существует много модификаций дренирования слезоотводящей системы при дакриостенозах или в ходе дакриостомии [31, 53], способов проведения дренажа в СОП, применяемых инструментов, интубационных наборов и материалов, из которых изготовлены конструкции [47, 52].
Специальная система для интубации Quiсkert была разработана в 1970 г. На суженный конец зонда, изготовленного из серебра и длиной 14 см, до его середины прикрепляют с помощью клея силиконовую трубку в качестве имплантата, свободный конец зонда закруглён. Интубацию проводят после предварительной дилатации слёзных точек, окулярную часть трубки фиксируют швом к веку [52].
Данную систему описали R. Pashby et al. [51], которые представили 94,7 % успешных исходов операции при стенозированном слёзном мешке, стриктурах слёзных канальцев, аномалиях анатомического строения СОП.
Система Crawford, предложенная в 1977 г. [31], применялась при врождённых облитерациях носо-слёзного протока и травматических дакриостенозах. Она состоит из двух стальных гибких зондов-проводников диаметром 0,4 мм, на которых нанизана полая силиконовая трубка диаметром 0,64 мм. Утолщения в виде оливы на свободных концах позволяют менее травматично проводить интубацию СОП, а стальные гибкие проводники обеспечивают удобство при использовании. Эффективность реканализации с помощью системы Crawford в ряде работ достигала 66–89 % [55].
В 1996 г. P. Ritleng разработал свою систему для проведения биканаликулярного стентирования. Вместо стальных наконечников к силиконовым трубкам крепятся полипропиленовые проводники длиной 60 см. Благодаря плавному соединению силиконовой трубки с проводником обеспечивается малотравматичная и лёгкая в исполнении имплантация. После предварительной дилатации слёзной точки зонд аккуратно проходит в слёзные пути, полипропиленовые проводники вводят в носовую полость и силиконовый имплантат извлекают из-под нижней носовой раковины. Полипропиленовые проводники отрезают, а концы силиконовых трубок завязывают парой узлов в носовой полости [53].
Данная методика остаётся на сегодняшний день самой востребованной в дренажной хирургии СОП. Силиконовый стент при интубации позволяет длительно удерживать сформированный просвет их стенозированного участка, не вызывая при этом воспалительной реакции и пролежней слёзной точки и канальца [46].
В.Д. Ярцев и др. предлагают для лучшей эпителизации реканализированных СОП использовать перфорированную силиконовую трубку, в которую вводят лекарственный препарат в виде геля. Это позволяет сформировать хороший каркас, а лечебный гель эвакуируется из трубки под естественным давлением и равномерно заполняет СОП. Дистальный конец обтурируют для блокирования выхода лекарственного геля в полость носа. Проксимальный конец фиксируют в проекции полулунной складки. Проведённая после лечения дакриорентгенография подтвердила достоверное увеличение диаметра СОП в местах их стенозирования [21].
Несмотря на позитивные результаты, в литературе неоднократно описываются сведения о возможных осложнениях, связанных с интубацией слёзных путей. Развитие гранулём, прорезывание слёзных точек и канальцев, каналикулиты, аллергическая реакция на силиконовый дренаж, дислокация и выпадение стента, повреждения роговицы, носовое кровотечение возможны при использовании трансканаликулярных силиконовых имплантатов [4, 8]. Чтобы избежать возможных осложнений, связанных с силиконовыми имплантатами, был предложен биодеструктирующийся (рассасывающийся) дренаж из нити викрила, оснащённый диспроспаном и хитозаном. Имплантированный трансканаликулярно в сформированное соустье, он рассасывался в течение 2,5–3 месяцев. Автор сообщает о его хорошей биосовместимости с тканями глаза и стабилизации образованного пути оттока слёзной жидкости [7].
С.Ф. Школьник предложил использовать при интубации СОП систему, включающую зонд и крючок Ritleng, гибкую трубку из рентгенконтрастного полиуретана длиной 200 мм и леску-направитель длиной 400 мм. После введения зонда Ritleng в просвет СОП стилет извлекают, вводят леску-направитель, которую с помощью крючка Ritleng проводят в носовую полость. Затем с назальной стороны прикрепляют полиуретановую трубку к леске-направителю и ретроградно выводят через слёзную точку. Другую часть проводят таким же образом, но через противоположную слёзную точку, антеградно [20].
Применение полиуретановых дренажей, по мнению автора, позволяет создать хороший каркас для повреждённых канальцев, а наличие перфораций на стенке трубки, через которую возможно введение лекарственных веществ, способствует хорошей эпителизации раневой поверхности. Эффективность методики имплантации подтверждена в 71,0–91,3 % случаев. Полиуретановый материал обладает низкими фрикционными свойствами, обеспечивая сохранение просвета СОП. Но при длительном использовании дренаж начинает выделять токсичные продукты и колонизируется бактериями, что ограничивает его применение при необходимости длительной интубации СОП [20].
При нарушении проходимости СОП вследствие повреждения только одной слёзной точки или повреждении одного слёзного канальца рядом авторов была предложена моноканаликулярная интубация [38, 50]. Силиконовый имплантат после зондирования одной слёзной точки при данной методике R.S. Gonnering предлагал фиксировать швом к коже века [38]. Впоследствии ряд авторов применили моноканаликулярную систему, в которой силиконовая трубка крепится к обтуратору слёзной точки, что позволяет надёжно фиксировать стент [6, 50].
Методики моноканаликулярной интубации на сегодняшний день включают в себя такие системы, как Monoka и Mini-Monoka (Monostent (Eagle Vision Inc., Memphis, TN), nad Mini-Monoka stents (FCI Ophthalmics, Marshfield Hills, MA)).
Система Monoka представляет собой силиконовый имплантат, проксимальный конец которого расширен в виде «шляпки». С помощью расширенного конца происходит фиксация в области слёзной точки. Однако ряд авторов указывают на невысокую эффективность метода и высокую частоту осложнений, таких как протрузия трубки, язва роговицы, миграция трубки в слёзный каналец и преждевременная экстубация [6, 44]. Дальнейшее усовершенствование конструкции имплантата позволило достаточно эффективно и безопасно проводить моноканаликулярную интубацию СОП, оставляя интактным второй слёзный каналец [34].
Система Masterka для моноканаликулярной имплантации представляет собой силиконовый имплантат, натянутый на металлический зонд, что позволяет просто и эффективно проводить интубацию СОП. Силиконовый имплантат (внешний диаметр — 0,93 мм) имплантируют в слёзные протоки посредством катетеризации. Данная методика позволяет восстанавливать канальцы после травматических повреждений, без эпифоры [34].
Для формирования путей слезоотведения при обструкции канальцев, травматических деформациях L.T. Jones в 1965 г. осуществил операцию конъюнктиводакриоцисториностомии с использованием трубок Jones [43].
Операция лакориностомии заключается в обеспечении оттока слезы путём формирования тоннеля от медиального угла глаза до соустья слёзного мешка и носовой полости [43]. Трубка изготовлена из стекла Pyrex для эффективного дренажа слёз, долговечна и, по мнению автора, характеризуется высокой биосовместимостью.
Новая модификация трубок StopLoss Jones Tube (SLJT компании FCI) состоит из гибкого силиконового внутреннего кольца диаметром 3,5–4 мм, которое предотвращает экструзию. Длина трубки подбирается индивидуально. Экструзия трубки является наиболее распространённым осложнением при интубации Jones Tubes. По данным авторов, эффективность интубации трубками Jones зависит от типа трубки и размера кольца. Экструзия трубки чаще возникает при использовании гладких и матовых трубок и размере силиконового кольца 3,5 мм, а не 4 мм. В 43 % случаях трубки пришлось в течение 20 месяцев заменить [25].
В литературе упоминаются разные сроки имплантации слезоотводящих путей при дакриостенозах. M.G. Welsh рекомендует оставлять лакримальные имплантаты на 6 месяцев [59]. Тех же сроков придерживаются C.S. Lim et al. [49].
По данным R.W. Arnold [24], S.M. Brown [29], удалять лакримальный имплантат желательно не позднее чем через 3 месяца после имплантации. Авторы обосновывают это тем, что реэпителизация СОП происходит в течение двух недель. A. Veloudios [57] и P. Kominek et al. сравнили разные сроки экстубации (от 3 до 66 месяцев) и не обнаружили статистически достоверных различий, указывая на достаточную безопасность длительной интубации [46].
Заключение
Анализируя данные литературы, можно сделать вывод, что в настоящее время активно ведутся исследования в области дренажной хирургии слезоотводящих путей. Лакримальные имплантаты постоянно модифицируются и совершенствуются. Создаются новые системы и методики для проведения интубации. Различные материалы и их свойства, применяемые в создании имплантатов, играют немаловажную роль в процессах заживления и формирования путей слезоотведения. Форма, размер, материал, дизайн имплантата часто определяют исход операции и степень её эффективности.
Многие авторы в своей хирургической практике активно используют силиконовые имплантаты, которые в данный момент занимают лидирующие позиции при интубации дакриостомы при наружной и эндоназальной дакриоцисториностомии и при операции реканализации слезоотводящих путей. Одни хирурги постоянно используют биканаликулярные имплантаты, доказывая эффективность операции при данной манипуляции. Однако другие авторы подвергают сомнению необходимость имплантации, её эффективность. Образование грануляционной ткани, воспалительные процессы, прорезывание силиконовых трубок, повреждение роговицы представляют собой грозные осложнения и приводят к рецидивам заболевания. Таким образом, показания к имплантации, сроки экстубации до сих пор чётко не определены.
Изучение источников литературы по применению различных дренажей не даёт однозначного ответа на вопрос, какая модель имплантата наиболее эффективная. Небольшое число исследований по тому или иному дренажу, немногочисленные группы сравнения и непродолжительные сроки наблюдения предполагают необходимость поиска и дальнейшего изучения вопроса.
Читайте также:
