МРТ лонного сочленения и приводящих мышц во фронтальной проекции в норме
Добавил пользователь Morpheus Обновлено: 16.01.2026
Авторы: Логутова Л.С. 1 , Чечнева М.А. , Лысенко С.Н. , Черкасова Н.Ю.
1 ГБУЗ МО «Московский областной НИИ акушерства и гинекологии», Москва; ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва
Для цитирования: Логутова Л.С., Чечнева М.А., Лысенко С.Н., Черкасова Н.Ю. Ультразвуковая диагностика состояния лонного сочленения у женщин. РМЖ. Мать и дитя. 2015;23(1):42.
Определенное место в структуре аномальных родов занимает патология костного таза. Патологическое расширение или появление болевых ощущений в симфизе классифицируют как дисфункцию лонного сочленения (ЛС) (симфизиопатия, симфизит). Данное осложнение, возникающее во время гестации, рассматривают в структуре синдрома тазовых опоясывающих болей при беременности ( pelvic girdle pain (PPGP)). При обследовании большой популяции женщин доказано, что до 50% беременных испытывают тазовые боли, которые могут являться следствием изменений сочленений таза, чаще лонного, и требуют дополнительного обследования. В 25% наблюдений тазовая боль требует лечения и у 8% женщин ведет к ограничению повседневной деятельности, по сути, к временной инвалидизации. По данным разных авторов, тазовые боли сохраняются в течение 4–6 мес. после родов у 26,5–43% женщин [1, 2].
Несмотря на невысокую частоту встречаемости, грозным осложнением родового акта при симфизиопатии остается разрыв ЛС, восстановление функции тазовых сочленений занимает до 5 мес. после родов. Травма ЛС может сопровождаться разрывом одного из сочленений, повреждением смежных органов [3]. Частота этого осложнения невелика исторически и в настоящее время. В последние десятилетия расхождения и разрывы ЛС встречаются, по данным разных авторов, от 1:380 до 1:3400 родов [4–6].
Анатомия и патогенез
ЛС образуется посредством межлобковой пластинки (lamina interpubica или Discus interpubicus) и волокнистых связок: сверху — lig. pubicum superius, снизу — lig. arcuatum pubis, спереди — lig. fibrosum ant. и сзади — lig. fibrosum post [7].
Одно из наиболее детальных описаний морфологии и структуры ЛС приведено в 1962 г. По его данным, ЛС «обладает половыми особенностями и имеет индивидуальные различия. Наблюдаются все виды соединений — от синхондроза до настоящего сустава. Особенности строения и состояния ЛС… у женщин… безусловно… находятся в тесной связи с эндокринными и функциональными процессами, происходящими в организме». Морфологически хрящевая межлобковая пластинка неоднородна — большая часть ее представлена гиалиновым хрящом, по периферии от межлобковой щели расположена зона фиброзного хряща. С возрастом гиалиновый хрящ вытесняется и в ряде случаев определяется в виде отдельных островков [8].
Половой и гендерный диморфизм структуры ЛС, а также возрастные изменения подтверждают последние литературные данные [9].
N. Lottering и (2013 г.) констатируют возрастные изменения структуры и зон оссификации ЛС при его трехмерной [10].
Патогенез изменений ЛС, в частности при беременности, нельзя назвать досконально изученным.
Некоторые изменения, например расширение, в литературе описаны достаточно подробно. При беременности происходит отечное пропитывание и разрыхление тканей в области сочленения, вследствие чего суставные концы лонных костей приобретают большую подвижность, чем до беременности [11]. Эту точку зрения поддерживают и авторитетные российские исследователи [4, 12, 13].
Вследствие разрыхления симфиза во время беременности полость в межлобковой хрящевой пластинке может увеличиться до значительных размеров, иногда с расхождением костей симфиза на 1–2 см. Некоторые авторы полагают, что это явление и у беременных можно рассматривать и с точки зрения нарушения обмена веществ, и трактовать как начальные стадии остеомаляции. Нарушения структуры и функции ЛС могут происходить под влиянием и других этиологических факторов (сифилис, tbc, желтуха, геморрагический диатез, артрит) [8].
Как один из основных факторов изменения сочленений таза во время беременности рассматривается влияние гормонов, в основном релаксина, однако прямой зависимости между степенью расширения ЛС, уровнями циркулирующих релаксинов и тазовой болью во время беременности не выявлено [14].
Специалисты по спортивной медицине полагают, что поражения симфиза — результат травмы связочного аппарата тазового кольца и мышц бедра и поясницы [15].
Существует теория мышечного спазма в генезе симфизиопатии, который может быть обусловлен нарушениями метаболизма кальция.
Методы диагностики
До недавнего времени «золотым стандартом» в диагностике изменений ЛС считались рентгенологические методы.
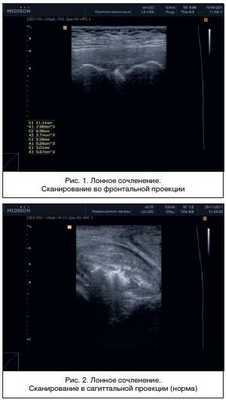
Во время беременности предпочтение отдается ультразвуковой диагностике ЛС (рис. 1). томография используется в основном в спортивной медицине. Преимуществами ультразвукового метода являются доступность, возможность оценить не только степень расхождения ЛС, но и, в отличие от рентгенологического метода, определить состояние мягких тканей, связочного аппарата.
Ультразвуковой метод исследования ЛС у беременных, предложенный в течение последних 20 лет рядом авторов для диагностики и прогноза при симфизиопатиях, в основном сводится к измерению ширины симфиза. Сам по себе этот показатель не отражает степень патологических изменений в симфизе, а также плохо или совсем не коррелирует с клиническими проявлениями и жалобами и не позволяет спрогнозировать самое грозное осложнение симфизита — расхождение или разрыв лона в родах. В результате проведенного исследования мы можем предложить новые ультразвуковые симптомы, отражающие структурные изменения ЛС при симфизите у беременных, перспективные в плане их использования для дифференциальной диагностики.
Материалы и методы
Обследовано 195 пациенток, разделенных на 3 основные группы:
1 группа — беременные и родильницы без клинических признаков дисфункции ЛС:
- 1А — при доношенном сроке беременности (n=30) — проведено однократное УЗИ ЛС;
- 1В — первобеременные женщины (n=27) — динамическое наблюдение;
- 1С — повторнородящие беременные женщины (n=30) — динамическое наблюдение;
- 1D — после родов (n=18).
2 группа — небеременные женщины фертильного возраста (n=30) без клинических проявлений патологии ЛС.
3 группа — 60 беременных с клиническими проявлениями симфизита.
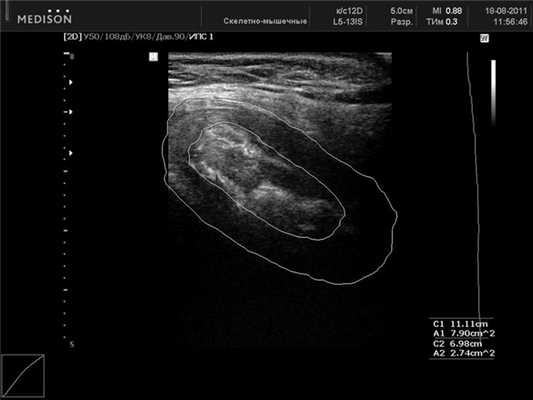
При сагиттальном сканировании ЛС представляет собой овальное образование неоднородной структуры с четко выделяемым «ядром», включающим в себя гиперэхогенные и гипоэхогенные участки. По наружной поверхности хрящевого пояса в большинстве случаев удается дифференцировать по верхнему краю lig. pubicum superius, снизу — lig. arcuatum pubis, спереди — lig. fibrosum anterior и сзади — lig. fibrosum posterior (рис. 2).
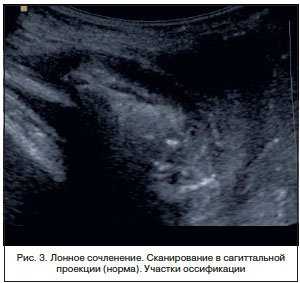
При сравнении ультразвуковой картины с данными морфологических исследований можно предположить, что гипоэхогенный ободок симфиза представляет собой гиалиновую часть хрящевого диска, гиперэхогенное «ядро» — участки замещения фиброзным хрящом. В структуре хрящевого пояса могут обнаруживаться гиперэхогенные включения округлой или неправильной формы, единичные или сгруппированные — зоны оссификации (рис. 3). Линейные размеры ЛС у женщин при ультразвуковом исследовании представлены в таблице 1.
Как и другие исследователи, мы увидели, что во время беременности происходит увеличение ширины ЛС, при этом более значительно в верхних отделах хряща. Ширина симфиза в верхней трети у беременной женщины была в среднем в 1,45 раза больше, чем в нижней (1,23–1,70 раз).
Общая площадь ЛС в среднем в 1,96 (1,81–2,09) раза больше площади сечения «хрящевого ядра» лонного симфиза. Ширина симфиза в верхней трети в послеродовом периоде была в среднем в 1,31 раза больше, чем в нижней трети (1,07–1,51 раз).
При сравнении ультразвуковой картины симфиза в группах нерожавших (группа 1B) и повторнородящих (группа 1С) беременных женщин были выявлены следующие существенные особенности:
1) минимальный диастаз лонных костей в группах 1 °C и 1B достоверно не различался (5,4±1,3 (3,7–8,0) мм против 5,4±1,0 (3,8–8,2) мм; p=0,83);
2) максимальный диастаз в группах 1B и 1 °C также достоверно не различался (6,2±1,7 (3,5–10,0) мм против 4,5±9,0 (3,4–9,0) мм; p=0,76);
3) неровность (зазубренность) верхнего края лонной кости наблюдалась у 26% в группе 1B (87% в группе 1 °C);
4) визуализация «апофиза» у 33,3% в группе 1B (43,3% — в группе 1 °C);
5) единичные гиперэхогенные включения в структуре симфиза у 48% в 1B группе (у 93% — в группе 1 °C);
6) сгруппированные гиперэхогенные включения у 22% в группе 1B (40% — в группе 1 °C);
7) толщина верхней связки ЛС в группе 1B составила справа 3,8±1,02 мм, слева — 3,8±0,98 мм (p=0,98); в группе 1 °C — справа 4,2±1,0 мм, слева — 4,4±1,0 мм (p=0,46). Различие по толщине верхней связки между группами 1B и 1 °C было статистически не достоверно справа (p=0,20), но достоверно слева (p=0,04). При измерении верхней связки в середине над симфизом последняя утолщена у женщин группы 1 °C (7,8±1,7 мм против 6,6±1,5 мм) (p=0,01).
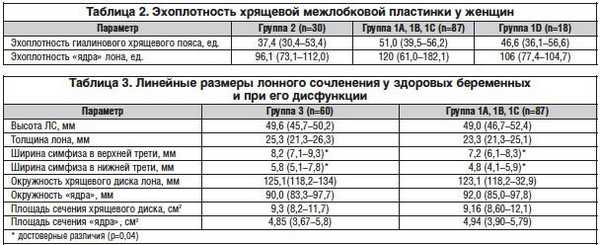
В качестве дополнительного метода исследования нами была изучена эхоплотность хрящевой межлобковой пластинки у женщин. Построение гистограмм плотности тканей ЛС у всех обследованных пациенток проводилось в одинаковых режимах сканирования. Проведено измерение эхоплотности межлобкового хрящевого диска в различных зонах. Достоверных различий плотности ткани внутри групп не выявлено. Результаты исследования представлены в таблице 2.
Таким образом, относительная эхографическая плотность фиброзного «ядра» ЛС выше плотности гиалинового хряща.
В результате исследования нами обнаружено, что к концу беременности ЛС претерпевает следующие изменения: умеренный диастаз лона относительно лона небеременных женщин, увеличение эхоплотности хрящевого диска — как гиалиновой, так и хрящевой части.
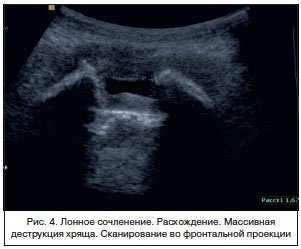
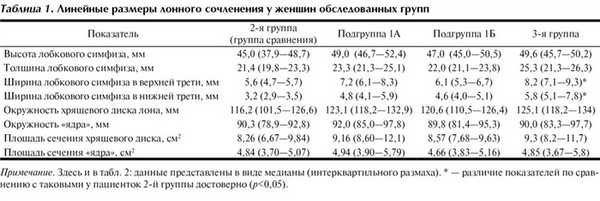
Наибольший интерес представляет исследование 3 группы — пациенток с клиническими проявлениями дисфункции ЛС во время беременности. У 60 беременных с разной степенью выраженности болевого синдрома и ограничения движения при традиционном обследовании достоверные отличия ширины ЛС от нормы, признаки расхождения лона, выявлены в 2 (3,3%) наблюдениях (рис. 4). Результаты измерений представлены в таблице 3.
Как видно из представленного материала, средние значения линейных размеров симфиза не имеют достоверных различий в разных клинических группах, за исключением ширины симфиза. В этом результаты исследования не противоречат ранее представленным литературным данным. Однако, даже при статистически достоверных показателях, разница ширины симфиза в норме и при патологии находится в пределах погрешности измерений, допустимых при использовании ультразвукового метода. Следовательно, данный метод исследования не отражает степени поражения тканей ЛС при так называемом «симфизите».
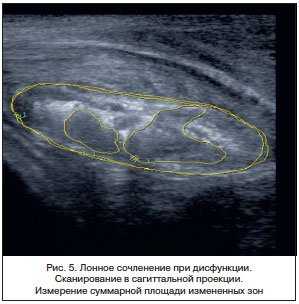
У всех пациенток с клиническими признаками дисфункции ЛС при сагиттальном сканировании хрящевого диска обнаружены изменения в структуре фиброзной части хрящевой межлобковой пластинки в виде неправильной формы очагов с гипо- и анэхогенной структурой. Для оценки эхографической картины были произведены измерение площади фиброзной части хрящевого диска, площади каждого очага с помощью функции обводки линейного контура, расчет суммарной площади измененных участков, измерение эхоплотности патологических зон (рис. 5). Средние значения эхоплотности очагов составили 64,5 (11–132) ед. при средней эхоплотности фиброзного «ядра» ЛС 126,6 ед. (52–187), выявлено очаговое снижение эхоплотности ткани фиброзного хряща от 2 до 4 раз по сравнению с нормальной эхокартиной (табл. 4). Использование функции гистограммы для оценки «эхоплотности» тканей более корректно и показательно, если сравнение уровня градации серого производится не между разными пациентками, а в пределах одного скана. Данное исследование показывает, что в основе нарушения функции ЛС во время беременности лежат морфологические изменения, связанные с течением самой беременности. Формирование гипоэхогенных зон в структуре фиброзного хряща связано, вероятно, с повышением гидрофильности тканей за счет воспалительных или аутоиммунных нарушений макроорганизма.
Выводы
Проведенное нами исследование показало, что для диагностики состояния ЛС во время беременности и своевременной оценки его дисфункции необходимо не только оценивать ширину симфиза, но и исследовать его внутреннюю структуру.
Гестационные изменения ЛС характеризуются умеренно выраженным расширением, повышением относительной эхоплотности фиброзной части хрящевого диска. Исследование выявило ряд отличительных особенностей строения симфиза у повторнородящих женщин, вероятно, связанных с предшествующими родами.
Клинические проявления дисфункции ЛС во всех случаях сопровождаются появлением неоднородности структуры, выделением в его структуре участков сниженной эхогенности. Своевременность диагностики морфологических изменений и оценка степени их выраженности позволят обеспечить благоприятный исход родов для матери и новорожденного.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
МРТ лонного сочленения и приводящих мышц во фронтальной проекции в норме
Представлены фронтальные МР-томограммы таза, полученные от задней поверхности к передней. Вдоль наружного и внутреннего краев запирательного отверстия визуализируются наружная и внутренняя запирательные мышцы. Большая приводящая мышца занимает наиболее заднее положение среди всех приводящих мышц. Ее наиболее верхние волокна ориентированы горизонтально и прикрепляются к проксимальному отделу бедренной кости медиальнее места прикрепления большой ягодичной мышцы. В передне-заднем направлении короткая приводящая мышца расположена между большой и длинной приводящими мышцами, поэтому эти мышцы могут не визуализироваться на одной фронтальной томограмме. Волокна короткой приводящей мышцы идут книзу и латерально. Бедренный нерв лежит в подвздошно-поясничной борозде между мышечными брюшками и не сопровождается сосудами до выхода из таза. В бедренном треугольнике нерв проходит латеральнее бедренной артерии. Гребенчатая мышца расположена латеральнее длинной и короткой приводящих мышц. Гребенчатая мышца имеет наиболее медиальную точку прикрепления на задней поверхности бедренной кости книзу от сухожилия подвздошно-поясничной мышцы. Верхняя ветвь лобковой кости является первым ориентиром, помогающим идентифицировать длинную приводящую мышцу и отличить ее от короткой приводящей мышцы. Длинная приводящая мышца является медиальной границей бедренного треугольника. Таким образом, в качестве ориентира для дифференциации длинной и короткой приводящих мышц во фронтальной плоскости могут быть использованы сосуды. Термин «малая приводящая мышца» используется иногда для обозначения короткой горизонтальной головки большой приводящей мышцы. Дугообразная связка представляет собой сравнительно мощную структуру, которая обеспечивает дополнительную прочность нижнему отделу лонного сочленения. Выступ на верхней ветви лобковой кости известен, как гребень лобковой кости. Визуализируется начало сухожилия длинной приводящей мышцы от апоневроза по переднему краю лобковой кости. Визуализируется начало передней головки прямой мышцы бедра от передней нижней подвздошной ости. Длинная приводящая мышца расположена в непосредственной близости к лонному сочленению. Нарушение функции или повреждение длинной приводящей мышцы может являться причиной нестабильности лонного сочленения. На этом срезе визуализируется сравнительно небольшая верхняя лобковая связка. Длинная головка прямой мышцы бедра берет начало от передней нижней подвздошной ости. Задняя головка начинается от передне-наружного края вертлужной впадины кверху от капсулы сустава. На этой томограмме отчетливо визуализируется лобковый бугорок. Лобковый гребень представляет собой верхнюю порцию тела лобковой кости медиальнее бугорка. Общее сухожилие внутренней запирательной мышцы и поперечной мышцы живота прикрепляется к лобковому гребню. На этой томограмме хорошо визуализируется паховая связка, идущая сверху вниз и снаружи внутрь. Обратите внимание на сосуды, которые пройдя под связкой, попадают в бедренный треугольник. Латеральный отдел передней брюшной стенки состоит из трех слоев. Поперечные волокна брюшных мышц являются наиболее глубокими и ориентированы горизонтально. Средний слой, представленный внутренней косой мышцей, составляют мышечные волокна, проходящие от подвздошного гребня в верхне-медиальном направлении. Наружные косые волокна направлены сверху вниз и снаружи внутрь. Прямые мышцы живота занимают наиболее медиальное положение среди мышц брюшной стенки. Они разделены белой линией. Нижние надчревные сосуды проходят вдоль латерального отдела этих мышц.
Аксиальные томограммы, полученные сверху вниз. Прямая мышца живота является парной мышцей, расположенной по средней линии. На этом уровне брюшки наружной и внутренней косых и поперечной мышц живота больше не визуализируются. Апоневрозы этих мышц слились. Паховая связка представляет собой нижний край апоневроза наружной косой мышцы. Она направлена сверху вниз и снаружи внутрь. На аксиальных томограммах она визуализируется по латеральному краю слившихся апоневрозов. Паховая связка является ориентиром, делящим таз и бедро. На аксиальных томограммах структуры, расположенные латеральнее связки, относятся к области бедра. Структуры, расположенные медиальнее и глубже связки, относятся к области таза. Наружные подвздошные сосуды расположены под паховой связкой. После прохождения паховой связки сосуды становятся общими бедренными. Теперь бедренные сосуды располагаются в бедренном треугольнике. Бедренный нерв расположен на медиальной поверхности подвздошно-поясничной мышцы и приближается к артерии. Начало гребенчатой мышцы на гребне верхней ветви лобковой кости имеет наиболее верхнее положение среди всех приводящих мышц. Мышца оборачивается вокруг верхней и передней поверхностей верхней ветви лобковой кости. Вдоль переднего отдела таза визуализируется запирательное отверстие. Через него проходят запирательные сосуды и нерв. Визуализируется бедренный нерв—наиболее латеральная структура бедренного треугольника. По переднему краю лобковой кости различим тонкий апоневроз прямой мышцы живота. Хорошо различим возвышающийся на передней поверхности тела лобковой кости лобковый бугорок. Этот бугорок служит местом медиального прикрепления паховой связки. Место начала наружной запирательной мышцы включает в себя запирательную мембрану. Хорошо визуализируется ее начало от лонного края отверстия. Длинная приводящая мышца начинается длинным сухожилием от небольшой области переднего отдела тела лобковой кости книзу от лобкового гребня. Общий апоневроз прямой мышцы живота и длинной приводящей мышцы формирует тяж с сигналом низкой интенсивности вдоль переднего края лобковых костей. Короткая приводящая мышца берет начало от передней поверхности нижней ветви лобковой кости непосредственно дистальнее лонного сочленения. Короткая приводящая мышца расположена глубже и латеральнее длинной приводящей мышцы. Короткая приводящая мышца расположена кпереди от наружной запирательной мышцы и на аксиальных томограммах их иногда трудно дифференцировать. Спереди назад в верхнем отделе бедра мышцы расположены в следующем порядке: гребенчатая, длинная приводящая и короткая приводящая соответственно. Во фронтальной проекции гребенчатая и длинная приводящая мышцы лежат в одной плоскости. Гребенчатая мышца будет прикрепляться на задней поверхности бедренной кости непосредственно дистальнее места прикрепления подвздошно-поясничной мышцы. Для лучшей визуализации передних мышц эффективно получение косых аксиальных томограмм (рекомендовано в дополнение к сагиттальным срезам, перпендикулярно крестцу). Прямая мышца живота и длинная приводящая мышца участвуют в формировании общего апоневроза вдоль переднего края лобковой кости. Отделение апоневроза является важным признаком атлетической пубалгии. Гребенчатая мышца проходит в задненаружном направлении, а длинная приводящая мышца на этом срезе является наиболее передним аддуктором. Гребенчатая мышца расположена медиальнее общих бедренных сосудов, а подвздошно-поясничная мышца—латеральнее, что является полезным ориентиром. Несмотря на то что прямая мышца живота и длинная приводящая мышца делят между собой апоневроз, длинная приводящая мышца имеет более косой рычаг, а различные оси направления работы мышц могут приводить к тангенциальному напряжению апоневроза. На этом срезе визуализируется наружная запирательная мышца, берущая свое начало от запирательной мембраны, а также от нижней ветви лобковой кости. Она отделена от внутренней запирательной мышцы запирательной мембраной.
Московский областной НИИ акушерства и гинекологии
Ультразвуковая диагностика состояния лонного сочленения у женщин
Журнал: Российский вестник акушера-гинеколога. 2012;12(6): 55‑59
Логутова Л.С., Чечнева М.А., Петрухин В.А., Лысенко С.Н., Климова И.В., Ефанов А.А. Ультразвуковая диагностика состояния лонного сочленения у женщин. Российский вестник акушера-гинеколога. 2012;12(6):55‑59.
Logutova LS, Chechneva MA, Petrukhin VA, Lysenko SN, Klimova IV, Efanov AA. Ultrasound diagnosis of the symphysis pubis in women. Russian Bulletin of Obstetrician-Gynecologist. 2012;12(6):55‑59. (In Russ.).
На основании обследования 48 пациенток без клинических проявлений патологии лонного сочленения (ЛС) (30 беременных с доношенным сроком беременности и 18 родильниц), 30 небеременных женщин фертильного возраста без клинических проявлений патологических изменений в ЛС, а также 15 беременных с доношенным сроком беременности и клиническими проявлениями "симфизита" изучены диагностические возможности определения структуры ЛС при помощи ультразвукового метода. Традиционным методом ультразвуковой диагностики принято считать фронтальное сканирование с измерением ширины сочленения. Проведенное исследование демонстрирует возможность изучения структуры хряща ЛС при сагиттальном сканировании и выявления патологических зон в проекции фиброзного "ядра" хрящевого диска.
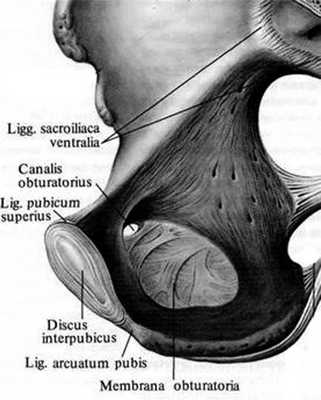
Лонное сочленение (ЛС), symphysis ossis pubis, служит для соединения между собой обеих лобковых костей таза. Соединение образуется посредством волокнисто-хрящевой межлобковой пластинки (lamina fibro-cartilaginca interpubica или discus interpubicus) и волокнистых связок: сверху - lig. pubicum superius, снизу - lig. arcuatum pubis, спереди - lig. fibrosum ant. и сзади - lig. fibrosum post(рис. 1) [2]. Рисунок 1. Анатомия лонного сочленения [2].
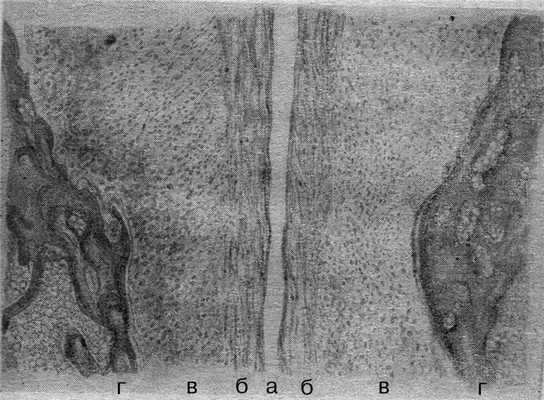
Одно из наиболее детальных описаний морфологии ЛС приведено М.Ф. Айзенбергом (1962). По его данным, ЛС «обладает половыми особенностями и имеет индивидуальные различия. Наблюдаются все виды соединений - от синхондроза до настоящего сустава. У детей и лиц мужского пола ЛС представлено чаще в виде бессуставного сращения - симфиза. Появление же щели в центре фиброзного хряща, делающей его несколько подвижным, превращает это соединение в так называемый полусустав. В тех случаях, когда щель проходит через всю высоту и толщину фиброзного хряща и смыкается с периферическими связками, соединение становится подвижным. Особенности строения и состояния лонного сочленения у женщин, безусловно, находятся в тесной связи с эндокринными и функциональными процессами, происходящими в организме». По данным М.Ф. Айзенберга (1962), морфологически хрящевая межлобковая пластинка неоднородна: большая ее часть представлена гиалиновым хрящом, по периферии от межлобковой щели расположена зона фиброзного хряща. С возрастом гиалиновый хрящ вытесняется и в ряде случаев определяется в виде отдельных островков (рис. 2). Рисунок 2. Морфология лонного сочленения у пациентки фертильного возраста (по М.Ф. Айзенбергу). а - щель лонного сочленения; б - фиброзный хрящ; в - гиалиновый хрящ; г - кость.
Некоторые изменения ЛС, например расширение, в литературе описаны достаточно широко. Вследствие разрыхления симфиза во время беременности полость, расположенная в межлобковой хрящевой пластинке, может увеличиваться до значительных размеров, а иногда при этом происходит и расхождение костей симфиза на 1-2 см [8]. Наблюдения с применением рентгенологического метода показали, что расширение сочленения при беременности является физиологическим и незначительно повышает его эластичность и подвижность 4.
Нарушения структуры и функции ЛС могут происходить под влиянием и других этиологических факторов (сифилис, туберкулез, желтуха, геморрагический диатез, артрит) (М.Ф. Айзенберг, 1962). Некоторые авторы полагают, что это явление и у беременных можно рассматривать с точки зрения нарушения обмена веществ и трактовать как начальные стадии остеомаляции. C. Schoellner [7] отмечает, что при беременности происходит отечное пропитывание и разрыхление тканей в области сочленения, вследствие чего суставные концы лонных костей приобретают бо`льшую подвижность, чем до беременности. Патологическое расширение или появление болевых ощущений в лобковом симфизе классифицируют как дисфункцию ЛС (симфизиопатия, симфизит) [2]. Частота этого осложнения невелика: 1-9:300 беременностей. Наиболее тяжелым осложнением родового акта при нарушении функции лобкового симфиза является его разрыв, что наблюдается редко: 1 на 10 000, 30 000 и даже на 60 000 родов. A. Stumpf (1907) приводит описание 124 случаев разрыва лонного сочленения, причем в 95 случаях имело место оперативное вмешательство. По данным И.Ф. Жорданиа (1929), тяжелые повреждения ЛС в 15% наблюдались при нормальных родах, а в 85% - после оперативного пособия. Несмотря на невысокую распространенность, разрыв ЛС остается грозным осложнением родового акта - восстановление функции тазовых сочленений занимает до 5 мес после родов. Травма ЛС может сопровождаться разрывом одного из крестцово-подвздошных сочленений, повреждением клитора, уретры, мочевого пузыря, образованием подкожных кровоизлияний, нагноением и развитием сепсиса (М.Ф. Айзенберг). В связи с этим своевременная диагностика дисфункций ЛС и определение показаний к абдоминальному родоразрешению должны служить снижению акушерского травматизма.
Основные методы диагностики состояния ЛС в настоящее время, помимо клинического осмотра, - рентгенологический и ультразвуковой. По данным C. Schoellner и соавт. [7], при УЗИ ширина ЛС у небеременных равняется 4,07 мм, у беременных варьирует от 3 до 16 мм и в среднем составляет 6,32 мм. Согласно данным K. Bjoklund и соавт. [5], при УЗИ ширина ЛС в 35 нед беременности у женщин без клинических проявлений патологии равняется в среднем 4,5 мм. В исследовании U. Scriven и соавт. [6] при УЗИ ширина симфиза после родов у женщин колебалась от 4,5 до 5,1 мм. Таким образом, основным диагностическим критерием состояния ЛС, по данным литературы, считается допустимая граница ширины ЛС -10 мм.
При рентгеновском исследовании ширина ЛС у женщин в верхней трети составляет от 13 до 34 мм, в средней - уменьшается и доходит до 9-34 мм, а в нижней трети в большинстве случаев увеличивается, колеблясь в пределах от 10 до 36 мм [6].
В связи с ограниченными возможностями применения рентгенологических методов диагностики у беременных, УЗИ приобретает особое значение.
Цель исследования - оценка возможностей ультразвукового метода в диагностике и дифференциальной диагностике состояния ЛС у женщин.
Материал и методы
Всего были обследованы 93 пациентки, разделенные на три группы: 1-ю группу составили 48 пациенток без клинических проявлений дисфункции ЛС. В подгруппу 1А 1-й группы вошли 30 беременных с доношенным сроком беременности, в подгруппу 1Б - 18 родильниц; 2-я группа - группа сравнения - состояла из 30 небеременных женщин фертильного возраста без клинических проявлений патологии ЛС; 3-ю группу составили 15 беременных с доношенным сроком беременности и клиническими проявлениями «симфизита».
УЗИ ЛС проводили во фронтальной (рис. 3) Рисунок 3. Лонное сочленение. УЗ-сканирование во фронтальной проекции. и сагиттальной (рис. 4) Рисунок 4. Лонное сочленение без признаков дисфункции. УЗ-сканирование в сагиттальной проекции. проекциях при помощи трансабдоминального конвексного мультичастотного датчика с частотой 2-6 МГц или линейного датчика 5-12 МГц. Использование линейного датчика ограничено у тучных пациенток. Проводились измерения высоты, толщины симфиза и ширина его в верхней и нижней трети. Кроме того, мы исследовали площадь сечения межлобкового хрящевого диска (discus interpubicus), отношение этой величины к площади сечения всего сочленения, размер хрящевого пояса лобкового симфиза. Полученные результаты сравнивали с ранее полученными рентгенологическими и эхографическими данными. В качестве дополнительного метода исследования изучалась эхоплотность хрящевой межлобковой пластинки у женщин. Построение гистограмм плотности тканей ЛС у всех пациенток обследованных групп проводилось в одинаковых режимах сканирования. Гистограмма представляет собой тип диаграммы, отражающей распределение эхосигналов и позволяет сравнивать относительную плотность ткани по уровню градации «серой шкалы» в условных единицах. Учитывая максимальную зависимость получаемых значений эхоплотности от индивидуальных настроек аппарата, считали целесообразным использование не абсолютных показателей данного параметра, а относительных условных единиц. В основу математической обработки материала были положены непараметрические методы математической статистики с вычислением медианы интерквартильного размаха (значений 25-го и 75-го перцентилей) для каждого показателя. Сравнение групп наблюдения друг с другом производили с помощью ряда непараметрических критериев (Вилкоксона-Манна-Уитни, Смирнова, Фишера, χ 2 ).
Результаты и обсуждение
Ультразвуковая структура лонного сочленения. При УЗИ в поперечном сечении в положении датчика на передней поверхности лона лобковый симфиз представляет собой неоднородное, средней эхогенности образование, расположенное между эхотенями лобковых костей. В центре симфиза визуализируется более эхоплотное «ядро» ЛС, неоднородное за счет чередования участков различной эхогенности. «Ядро» окружено более гипоэхогенным хрящевым ободком. Над ним визуализируется в большинстве случаев lig. pubicum superius. На данных ультразвуковых срезах возможно измерить ширину ЛС как по верхнему, так и по нижнему краю. Ориентиром служат лобковые кости.
При сагиттальном сканировании ЛС представляет собой овальное образование неоднородной структуры с четко выделяемым «ядром», включающим гипер- и гипоэхогенные участки. По наружной поверхности хрящевого пояса в большинстве случаев удается дифференцировать по верхнему краю lig. pubicum superius, снизу - lig. arcuatum pubis, спереди - lig. fibrosum anterior и сзади - lig. fibrosum posterior. Они служат ориентирами при измерении размеров лобкового симфиза. При сравнении ультразвуковой картины с данными проведенных ранее (М.Ф. Айзенберг, 1962) морфологических исследований можно предположить, что гипоэхогенный ободок симфиза является гиалиновой частью хрящевого диска, гиперэхогенное «ядро» - участки замещения фиброзным хрящом. В структуре хрящевого пояса могут обнаруживаться гиперэхогенные включения округлой или неправильной формы, являющиеся, вероятнее всего, зонами оссификации (см. рис. 4). Сагиттальные ультразвуковые срезы у края правой или левой лобковых костей представляют собой более или менее однородную овальную гипоэхогенную структуру ткани хрящевого диска с гиперэхогенным (дающим тень) краевым срезом лобковой кости. Линейные размеры ЛС у женщин при ультразвуковом исследовании представлены в табл. 1.
Как и другие исследователи, мы обнаружили, что во время беременности происходит увеличение ширины ЛС, при этом более значительно в верхних отделах хряща. Ширина симфиза в верхней трети у беременной женщины была в среднем в 1,45 раза больше, чем в нижней трети (1,23-1,70) и имела тенденцию к уменьшению у родильниц. Ширина симфиза в верхней трети в послеродовом периоде была в среднем в 1,31 раза больше, чем в нижней трети (1,07-1,51).
Окружность ЛС в поперечном сечении в 1,36 раза превышала окружность «ядра» (1,32-1,42). Общая площадь лонного сочленения в среднем в 1,96 (1,81-2,09) раза была больше площади сечения «ядра» лобкового симфиза.
В результате проведенного исследования можно сделать вывод, что традиционная диагностика не дает полного представления о физиологических и патологических процессах, происходящих в структуре ЛС во время беременности.
В качестве дополнительного метода исследования нами было предложено изучение эхоплотности хрящевой межлобковой пластинки у женщин. Построение гистограмм плотности тканей ЛС у всех пациенток обследованных групп проводилось в одинаковых режимах сканирования. Проведено измерение эхоплотности межлобкового хрящевого диска в различных зонах. Достоверных различий коэффициентов плотности ткани внутри групп не выявлено. Результаты исследования представлены в табл. 2.
Таким образом, относительная эхографическая плотность фиброзного «ядра» ЛС выше плотности гиалинового хрящевого пояса у небеременных в 1,5 раза, в группе беременных без клинических признаков дисфункции сочленения - в 1,8 раза, у родильниц - в 2 раза.
В результате исследования нами обнаружено, что к концу беременности лонное сочленение претерпевает следующие изменения: увеличивается ширина хрящевого пояса, возникает умеренный диастаз ЛС относительно ЛС небеременных женщин. Кроме того, происходит увеличение эхоплотности хрящевого диска - как гиалиновой, так и хрящевой его части.
Наибольший интерес представляет исследование группы пациенток с клиническими проявлениями дисфункции ЛС во время беременности. В группе из 15 беременных с разной степенью выраженности болевого синдрома и ограничения движений при традиционном обследовании не выявлено достоверных отличий ширины ЛС от нормальных показателей, т.е. не выявлено признаков расхождения лобкового симфиза.
Как видно из представленного материала, средние значения линейных размеров симфиза не имеют достоверных различий в разных клинических группах, за исключением ширины лобкового симфиза. В этом результаты исследования не противоречат ранее представленным данным литературы. Однако даже при статистически достоверных показателях разница ширины симфиза в норме и при патологии находится в пределах погрешности измерений, допустимых при использовании ультразвукового метода. Следовательно, данный метод исследования не отражает степени поражения тканей ЛС при так называемом симфизите.
У пациенток с дисфункцией ЛС при сагиттальном сканировании хрящевого диска обнаружены изменения в структуре фиброзной части хрящевой межлобковой пластинки в виде неправильной формы очагов с гипо- и анэхогенной структурой. Размеры и степень выраженности не всегда были прямо пропорциональны тяжести клинической симптоматики «симфизита». Для оценки эхографической картины были произведены измерение площади фиброзной части хрящевого диска, площади каждого очага с помощью функции обводки линейного контура, расчет суммарной площади измененных участков, измерение эхоплотности патологических зон (рис. 5). Рисунок 5. Лонное сочленение при дисфункции. УЗ-сканирование в сагиттальной проекции. Средние значения эхоплотности очагов составили 21,4 усл. ед. (13,2-32,0) при средней величине эхоплотности фиброзного «ядра» лонного сочленения у беременных без клинических признаков дисфункции ЛС - 96,1 (73,1-112,0) усл. ед. Таким образом, выявлено очаговое снижение эхоплотности ткани фиброзного хряща в 4,4 раза по сравнению с таковой у беременных, не имеющих клинических признаков дисфункции ЛС. Данное исследование позволяет предположить, что в основе нарушения функции ЛС во время беременности лежат морфологические изменения, связанные с течением самой беременности, а травматические повреждения ЛС в родах наступают как следствие первичных изменений структуры тканей. Формирование гипоэхогенных зон в структуре фиброзного хряща связано, вероятнее всего, с повышением гидрофильности тканей за счет воспалительных или аутоиммунных нарушений макроорганизма.
Выводы
1. Проведенное исследование показало, что для диагностики состояния ЛС во время беременности и своевременной оценки его дисфункции необходимо не только оценивать ширину симфиза, но и исследовать его внутреннюю структуру.
2. Гестационные изменения ЛС характеризуются умеренно выраженным расширением, повышением относительной эхоплотности фиброзной части хрящевого диска.
3. Клинические проявления дисфункции ЛС во всех случаях сопровождаются появлением неоднородности структуры, выделением в его структуре участков сниженной эхогенности.
4. Своевременность диагностики морфологических изменений ЛС и оценка степени их выраженности позволят обеспечить благоприятный исход родов для матери и новорожденного.
Симфизит как междисциплинарная проблема
Авторы: Глазунов П.А. 1 , Трофименко И.А. 2 , Жиляев Е.В. 1, 3, 4
1 АО «ЕМЦ», Москва, Россия
2 Европейский медицинский центр, Москва
3 ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
4 РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
Для цитирования: Глазунов П.А., Трофименко И.А., Жиляев Е.В. Симфизит как междисциплинарная проблема. РМЖ. Медицинское обозрение. 2015;23(25):1520-1522.
В статье освещены вопросы диагностики симфизита, как междисциплинарной проблемы
Для цитирования. Глазунов П.А., Трофименко И.А., Жиляев Е.В. Симфизит как междисциплинарная проблема // РМЖ. 2015. No 25. С. 1520–1522.
Боль в области костей таза может появляться по разным причинам. Традиционно уже на этапе сбора анамнеза врач старается дифференцировать боль механического и воспалительного типов, что важно для диагностики и дальнейшего лечения. Однако в некоторых случаях процесс постановки верного диагноза может быть достаточно трудным. Ниже мы приводим клиническое наблюдение пациента со специфическими жалобами и историей нашего диагностического поиска.
Пациент Г., 69 лет, обратился к ревматологу с жалобами на боль в области лобкового симфиза, иррадиирущие в правую паховую область, усиливающиеся при ходьбе, перемене положения тела в кровати, подъеме из положения лежа.
Из анамнеза известно, что считает себя больным с февраля 2015 г. (за 2 мес. до обращения), когда через несколько дней после травмы в быту (падение с лестницы на спину) появились боли в области лобкового симфиза, усиливающиеся при ходьбе, с иррадиацией в правую, а иногда и левую паховые области. Температура тела – до 37,8°С. Пациент обратился в одну из клиник г. Москвы, где при обследовании были выявлены лейкоцитоз 19,1×109/л, повышение СОЭ до 50 мм/ч, повышение уровня С-реактивного белка более 200 мг/л. В общем анализе мочи лейкоцитурия – 735–736 в поле зрения, эритроциты – 35–36 в поле зрения, лейкоцитарная эстераза +++, ПСА общий – 0,115 нг/мл. Состояние было расценено как обострение мочевой инфекции на фоне хронического постлучевого цистита. Пациент был госпитализирован, на фоне проведения парентеральной антибактериальной терапии (цефтриаксон 2 г/сут + амикацин 1,5 г/сут) достигнута нормализация температуры тела, снизилась интенсивность болей в области лона, отмечено уменьшение лейкоцитоза до 12,0х109/л и СОЭ до 40 мм/ч, снижение числа лейкоцитов и эритроцитов в общем анализе мочи. Пациент был выписан для продолжения лечения амбулаторно.
У больного в анамнезе: 2009 г. – рак простаты (аденокарцинома класса 4+5 по Глисону). Была произведена радикальная позадилонная резекция простаты, проводилась лучевая терапия (брахитерапия, наружная лучевая терапия). В дальнейшем диагностировался хронический постлучевой цистит. В послеоперационном периоде – деформация шейки мочевого пузыря, стриктура уретры, недержание мочи. В 2013 г. проведена трансуретральная резекция мочевого пузыря в связи с его развившейся обструкцией.
После выписки пациент продолжал испытывать постоянную боль в области лобкового симфиза, число лейкоцитов в периферической крови нормализовалось, сохранялась повышенная СОЭ до 60 мм/ч. При компьютерной томографии отмечено умеренное расширение суставной щели лонного сочленения – до 7 мм. По переднему контуру лонного сочленения уплотнение мягких тканей без четких контуров, размерами около 45 х 35 мм, тяжистость прилежащей подкожно-жировой клетчатки. На фоне остеофитов определяется краевая деструкция коркового слоя передних отделов лонных костей в области лонного сочленения. В теле правой подвздошной кости отмечается остеосклеротический очаг размерами до 10 мм, с неровными контурами. Предстательная железа с послеоперационными изменениями, в центральном отделе – жидкостной дефект, по краям – кальцинаты. Субхондральные отделы вертлужной впадины склерозированы. Определяются выраженная кальцификация и тендиноз по краю подвздошных гребней, в области больших вертелов бедренных костей. Предположен опухолевый (расценен как более вероятный) или воспалительный процесс.
По рекомендации онколога выполнена сцинтиграфия скелета с Тс-99m-меченным пирофосфатом – данных, свидетельствующих о метастазах и артрите, не получено. Зона лобкового симфиза не оценена ввиду естественной концентрации контраста в мочевом пузыре.
При осмотре ревматологом состояние средней тяжести за счет болевого синдрома. Хромает на правую ногу при ходьбе. При осмотре периферические суставы не изменены. Пальпация остистых отростков позвонков на всем протяжении безболезненна. Ограничения движений в шейном отделе позвоночника нет. Объем движений в грудном и поясничном отделах позвоночника не удается оценить ввиду усиливающейся боли в области лобкового симфиза при попытке провести оценивающие тесты. Пальпация лобкового симфиза болезненна. Движения в правом тазобедренном и коленном суставах ограничены, т. к. усиливается боль в лобке и правой паховой области. Кожа в этом месте не изменена, локальной гиперемии нет. Тест изометрического напряжения мышц таза положительный.
С целью обезболивания пациенту был рекомендован прием НПВП, эффект положительный.
При дополнительном лабораторном обследовании: прокальцитонин Через несколько дней пациент обратился в клинику в связи с острой задержкой мочи, которая разрешилась самостоятельно, после отхождения «сгустка» темно-красного цвета. Пациент осмотрен урологом, выполнена цистоскопия: ближе к шейке мочевого пузыря в зоне уретропузырного анастомоза на 6 часах условного циферблата выявлен язвообразный дефект, выполненный фибрином, диаметром около 2 см. Там же обнаружены зоны кровоточивости с небольшими свежими сгустками крови. Шейка мочевого пузыря сужена, деформирована.
Пациент был направлен на МРТ малого таза с контрастированием (рис. 1). По передней стенке сформированного «предпузыря» определяется дефект размерами 7×8 мм, сообщающийся с расширенным до 10 мм лонным сочленением. Смежные поверхности лонных костей – с признаками отека костного мозга. По нижнему краю расширенного и заполненного жидкостью лонного сочленения определяются два свищевых хода, которые идут на 8 часах условного циферблата (протяженность – до 28 мм) и на 4 часах (протяженность – до 18 мм) книзу и кнаружи с обеих сторон от основания полового члена и слепо заканчиваются в отводящих мышцах. В ветвях седалищных костей – зоны отека костного мозга, в наружных запирательных, приводящих мышцах у лонного сочленения – зоны воспалительной инфильтрации (отмечается накопление контрастного препарата). В пришеечном отделе мочевого пузыря – выраженный отек слизистой оболочки, по левой боковой стенке пузыря на 6 мм кнаружи от устья левого мочеточника – дивертикул 8×9×12 мм. В латеральных массах крестца выявляются симметричные, обширные, продольно ориентированные зоны выраженного отека костного мозга.
С учетом данных МРТ состояние было расценено как остеомиелит лонных костей с источником инфекции в мочевых путях.
Пациент был госпитализирован в урологический стационар, для снижения давления в мочевом пузыре была установлена цистостома. Антибактериальная терапия не проводилась. Через 14 дней наблюдалась явная положительная динамика в виде снижения интенсивности болей, некоторого снижения СОЭ и уровня СРБ. Запланировано оперативное вмешательство для восстановления герметичности мочевого пузыря.
Остеомаляция – диффузное заболевание скелета, обусловленное нарушением минерализации кости. Причинами его могут быть дефицит кальция (наиболее часто), дефицит фосфора (фосфатный диабет у детей и онкогенная остеомаляция у взрослых вследствие высокой продукции фосфоруретических факторов), блокирование образования кристаллов пирофосфата кальция в костях экзогенными веществами (бифосфонатная, алюминиевая остеомаляция). В обсуждаемом случае все причины, кроме первой, могут быть достаточно уверенно исключены.
Наиболее частыми причинами дефицита кальция являются дефицит витамина D, нарушение образования кальцитриола, мальабсорбция, нарушенная реабсорбция кальция в почечных канальцах. У пациента обнаружено значительное снижение содержания измеряемого метаболита витамина D кальцидиола (25-гидроксихолекальциферол) – 6 нг/мл (норма – 30–60 нг/мл) и суточной экскреции кальция – 0,68 ммоль (норма – более 2,5 ммоль). Указанные результаты с учетом нормального уровня неорганического фосфата в крови подтвердили предположение о дефиците кальция на фоне дефицита витамина D. Для коррекции дефицита кальция и витамина D традиционно используются комбинированные препараты.
Настоящий случай показался нам весьма необычным, особенно для практики врача-ревматолога. Характер жалоб, а также лабораторная картина требовали проведения широкого дифференциального диагноза. Данное наблюдение представляется нам хорошим поводом привлечь внимание ревматологов и терапевтов к проблеме боли в области лона, диагностирование которой может оказаться серьезным испытанием для врача.
1. Braun J., Bollow M., Remlinger G. et al. Prevalence of spondylarthropathies in HLA-B27 positive and negative blood donors // Arthritis Rheum. 1998 Jan. Vol. 41 (1). Р. 58–67.
2. Trontzas P., Andrianakos A., Miyakis S. et al. Seronegative spondyloarthropathies in Greece: a population-based study of prevalence, clinical pattern, and management. The ESORDIG study // ClinRheumatol. 2005 Nov. Vol. 24 (6). Р. 583–589.
3. De Angelis R., Salaffi F., Grassi W. Prevalence of spondyloarthropathies in an Italian population sample: a regional community-based study // Scand J Rheumatol. 2007 Jan-Feb. Vol. 36 (1). Р. 14–21.
4. Choi H., McCartney M., Best T.M. Treatment of osteitis pubis and osteomyelitis of the pubic symphysis in athletes: a systematic review // Br J Sports Med. 2011 Jan. Vol. 45 (1). Р. 57–64.
5. Pauli S., Willemsen P., Declerck K., Chappel R., Vanderveken M.,Osteomyelitis pubis versus osteitis pubis: a case presentation and review of the literature // BrJSportsMed. 2002. Vol. 36. Р. 71–73.
6. Bouza E., Winston D.J., Hewitt W.L. Infectious osteitis pubis // Urology.1978. Vol. 12. Р. 663–669.
7. Lupovitch A., Elie J.C., Wysocki R. Diagnosis of acute bacterial osteomyelitis of the pubis by means of fine needle aspiration // ActaCytol. 1989. Vol. 33. Р. 649–651.
Читайте также:
- Значение протеиндисульфидизомеразы (ПДИ) в сворачивании белка
- Синтез глюкокортикоидов и изменения слизистой желудка
- Глухонемота. Проблемы социализации глухонемых
- Происхождение первично-множественных опухолей. Морфология первично-множественного рака
- Грыжесечение при ущемленных грыжах. Принципы операций при ущемленных грыжах.
