МРТ при внедолевой секвестрации у новорожденного
Добавил пользователь Владимир З. Обновлено: 27.01.2026
– порок формирования легких, заключающийся в обособлении от основного органа рудиментарного участка легочной ткани с автономным кровотоком, не участвующего в процессе газообмена.
Клиника при секвестрации легкого может быть скудной; при обострении инфекционного воспаления включает лихорадку, слабость, одышку, кашель со слизисто-гнойной мокротой, кровохарканье; при сдавлении пищевода и желудка - нарушение прохождения пищи.
Диагноз основан на данных рентгенографии и КТ легких, бронхографии, бронхоскопии, ангиопульмонографии. При секвестрации легкого лечение только оперативное – секвестрэктомия, сегментэктомия или лобэктомия.
Классификация секвестрации легкого
Различают 2 формы секвестрации легкого: внутридолевую (интралобарную – ИЛС) и внедолевую (экстралобарную – ЭЛС). При интралобарной легочной секвестрации кистозный участок располагается среди функционирующей паренхимы легкого в границах висцерального листка плевры (чаще всего в области медиально-базальных сегментов нижней доли левого легкого) и васкуляризуется одним или несколькими аберрантными сосудами. ИЛС можно рассматривать как врожденную кисту с аномальным кровообращением. Секвестрированные легочные кисты имеют эпителиальную выстилку и жидкое или слизистое содержимое, часто первично не связаны с бронхиальным деревом. В кистозно-измененном участке секвестрации легкого рано или поздно возникает нагноение.
При экстралобарной форме легочный секвестр имеет отдельный плевральный листок и изолирован от основного органа, являясь полностью эктопированной тканью (добавочной легочной долей). ЭЛС чаще наблюдается в левой половине грудной клетки (в 48% случаев), в правой (20%), в переднем (8%) или заднем (6%) средостении, поддиафрагмально (18%), в брюшной полости (10%), интраперикардиально (единичные случаи). ЭЛС обеспечивается кровью исключительно через артерии большого круга кровообращения (грудную или брюшную аорту). Микроскопически ткань ЭЛС включает множество неразвитых одинаковых бронхиол, ацинусов, состоящих из альвеолярных ходов неправильной формы и обычных или расширенных альвеол. В четверти случаев ЭЛС диагностируется пренатально, в 2/3 случаев - в первые 3 месяца жизни ребенка.
Встречаемость внутридолевой секвестрации легкого примерно в 3 раза выше, чем внедолевой, иногда возможно их одновременное присутствие у одного больного. ЭЛС в 3–4 раза чаще выявляется у мальчиков, чем у девочек.
По клиническим критериям выделяют 3 формы секвестрации легкого:
Секвестрация легкого является сложным пороком, вызванным комбинированным нарушением формирования различных бронхолегочных структур. Аномалия развивается в результате тератогенных влияний в раннюю внутриутробную фазу.
Источником развития легочного секвестра являются добавочные выпячивания первичной кишки, рудименты дивертикула пищевода, отделившиеся от организующихся легких и затем теряющие связь с первичной кишкой и бронхиальным деревом. Иногда может оставаться связь рудимента легкого с пищеводом или желудком с помощью соустья-тяжа (бронхолегочно-кишечная мальформация).
Согласно теории тракции, развитию секвестрации легкого способствует нарушение редукции ветвей первичной аорты с трансформацией их в аномальные сосуды. Через эти сосудистые ветви зачаточные фрагменты легкого отграничиваются от нормальной легочной закладки.
Секвестрация легкого часто комбинируется с другими пороками развития: ЭЛС - с неиммунной водянкой плода, анасаркой, гидротораксом новорожденного; ИЛС – с врожденной аденоматоидной мальформацией легкого 2-го типа, рабдомиоматозной дисплазией, трахео- и бронхопищеводными свищами, воронкообразной деформацией грудной клетки, открытым средостением, диафрагмальной грыжей, гипоплазией почки, дефектами позвоночника и тазобедренных суставов.
Симптомы
Клиническая картина секвестрации легкого определяется локализацией секвестра, наличием или отсутствием его связи с дыхательными путями, степенью развития гипоплазии легочной ткани и воспалительных изменений. Симптомы интралобарной секвестрации легкого редко проявляются на этапе новорожденности и раннего детства, развиваясь обычно в более старшем возрасте при инфицировании, воспалении, нагноении и прорыве кистозного секвестра.
При нагноении кисты и абсцессе порочной доли легкого заболевание начинается остро с лихорадки, слабости, потливости, умеренного болевого синдрома, одышки при нагрузке, непродуктивного кашля, а при прорыве гнойника - с выделения значительного объема гнойной мокроты. Иногда возможно кровохарканье и легочные кровотечения, часты плевральные осложнения. Течение секвестрации легкого обычно приобретает хронический характер с повторяющимися вялыми обострениями и ремиссиям. При ИЛС может иметь место клиника рецидивирующей пневмонии.
Экстралобарная секвестрация легкого часто протекает асимптомно и начинает беспокоить больного только в подростковом и более позднем возрасте. Внедолевые секвестры могут провоцировать сдавление пищевода, желудка и других органов, что может проявляться одышкой, цианозом, нарушением эвакуации пищи. Риск инфекционного процесса крайне низок.
Секвестрация легкого может осложниться пневмомикозом, туберкулезом, профузным легочным кровотечением и массивным гемотораксом, формированием опухоли, развитием острой сердечной недостаточности по причине объемной перегрузки сердца за счет артериовенозного шунтирования в секвестрированной кисте.
Диагностика
Ранняя диагностика секвестрации легкого затруднена из-за схожести ее клинико-рентгенологических симптомов с таковыми при другой легочной патологии. Диагноз устанавливают по совокупности данных обзорной рентгенографии и КТ легких, бронхографии, бронхоскопии, УЗИ брюшной полости, аортографии, ангиопульмонографии.
Рентгенологически интралобарная секвестрация легких (в отсутствии связи с бронхом и воспаления) определяется как затенение неправильной формы разной степени интенсивности с просветлением в толще или как полостное образование с горизонтальным уровнем жидкости или без него. При обострении вокруг секвестра в нижней доле легкого отмечается выраженная деформация сосудисто-бронхиального рисунка, умеренная перифокальная инфильтрация легочной ткани. При бронхографии наблюдается деформация и смещение бронхов, соседних с пораженным сегментом легкого.
Бронхоскопическая картина секвестрации легкого, сообщающейся с дыхательными путями, соответствует катарально-гнойному эндобронхиту на стороне пораженного легкого.
Брюшнополостная ЭЛС выявляется на УЗИ как четко отграниченное образование однородной эхогенности с кровоснабжением через ветви крупных артерий. Диагноз окончательно подтверждается МСКТ легких и ангиопульмонографией с установлением наличия, количества и топографии аномальных сосудов, питающих область секвестрации. Радиоизотопное сканирование печени и перитонеография помогают отграничить правостороннюю секвестрацию легких от патологии органов ЖКТ. Секвестрация легкого нередко выявляется в ходе хирургического вмешательства по поводу хронического гнойного процесса в легком.
Дифференциальный диагноз при секвестрации легкого проводится с деструктивной пневмонией, туберкулезным процессом, кистой или абсцессом легкого, бронхоэктазами, опухолью грудной полости.
Лечение
При секвестрации легких требуется проведение оперативного вмешательства – удаление аномального участка легочной ткани. При выявлении бессимптомной внутридолевой секвестрации легких возможно выполнение сегментэктомии, однако чаще всего требуется удаление всей пораженной легочной доли (обычно нижней) – лобэктомия. Тактика хирургического лечения внедолевой формы заключается в удалении секвестрированного участка (секвестрэктомии).
Наличие при секвестрации легких аномальных крупных артериальных сосудов нетипичной локализации делает важным тщательную предварительную диагностику во избежание их интраоперационного повреждения и развития тяжелого угрожающего жизни кровотечения.
Прогноз при интралобарной форме в отсутствие гнойно-септических процессов – удовлетворительный, при экстралобарной секвестрации легкого брюшнополостной локализации, как правило, лучше, чем при ее внутригрудном расположении.
Секвестрация легкого
Секвестрация легкого, так называемое добавочное легкое, представляет собой порок развития, характеризующийся тем, что часть аберрантной легочной ткани не имеет связи с бронхиальным деревом и кровоснабжается артериями большого круга кровообращения отходящими от аорты.
Выделяются два типа:
Эпидемиология
Некоторые авторы предполагают наличие предрасположенности у мужского пола (когда речь идет о внедолевой легочной секвестрации). Возраст зависит от типа секвестрации.
Клиническая картина
Внедолевая секвестрация часто выявляется еще в периоде новорожденности за счет сопутствующего респираторного дистресс синдрома, цианоза или инфекции дыхательных путей. Внутридолевая секвестраця проявляется в позднем детском или подростковом периодах в виде рецидивирующих легочных инфекций.
Патология
Легочную секвестрацию можно разделить на две группы основываясь на отношении аберрантного сегмента легочной ткани к плевре:
- внутридолевая секвестрация
- встречается чаще и составлет 75-85% всех случаев [4,5,7]
- встречается в детском возрасте или подростковом периоде в виде рецидивирующих инфекций
- менее частая, составляет 15-25% всех случаев [4,5,7]
- обычно проявляется в период новорожденности в виде респираторного дистресс синдрома, цианоза и инфекций
- чаще встречается у мальчиков (М:Ж ~4:1)
- примерно в ~10% случаев бывает поддиафрагмальной
Оба типа схожи в отсутствии связи с бронхиальным деревом и легочными артериями, но имеют отличие в локализации по отношению к плевре. В большинстве случаев аберрантная легочная ткань кровоснабжается ветвью аорты. Венозный отток зависти от типа:
- внутридолевая секвестрация
- венозный отток обычно осуществляется в легочные вены, но иногда возможен отток в систему парной-непарной вен, воротную вену, правое предсердие или нижнюю полую вену
- аномальная ткань прилегает к нормальной легочной ткани и не отделена от нее плеврой
- венозный отток осуществляется через системные вены в правое предсердие
- отделена от окружающей легочной ткани собственной плеврой
Генетика
Почти все случаи спорадические.
Локализация
Легочная секвестрация преимущественно встречается в нижних долях. 60% внутридолевых секвестраций встречается в левой нижней доле и 40% в правой нижней доле. Внедолевая секвестрация почти всегда встречается в левой нижней доле, однако в 10% случаев внедолевая секвестрация может локализоваться поддиафрагмально [8].
Сочетанная патология
Сочетанная патология чаще сопутствует внедолевой секвестрации (50-60%):
- врожденная кистозноаденоматозная мальформация легкого
- врожденные пороки сердца
- врожденные диафргагмальные грыжи
- синдром ятагана [15]
Диагностика
Рентгенография
- часто проявляется в виде участка снижения пневматизации треугольной формы
- при присоединении инфекции возможно формирование кистозных просветлений
- при обоих типах наличие воздушной бронхограммы может указывать на связь с бронхиальным деревом (сформированную в результате инфекционной деструкции) или с пищеводом или желудком, как части комбинированного порока
Секвестрированная ткань обычно имеет более эхогенна по отношению к здоровой легочной ткани. При антенатальном УЗИ внедолевая секвестрация визуализируется с 16 недель в виде солидного, хорошо отграниченного эхогенного образования треугольной формы [8]. ЦДК может визуализировать афферентный сосуд. При поддиафрагмальной локализации секвестрация может визуализироваться в виде эхогенного образования брюшной полости.
Секвестрация легкого
Секвестрация легкого – это врожденная аномалия, при которой сегмент легочной ткани не соединяется с бронхиальной системой и, как правило, не участвует в процессе газообмена. Кровоснабжение секвестрированного отдела легкого осуществляется сетью кровеносных сосудов, отходящих от большого круга кровообращения: аорты или ее ответвлений. В норме эти сосуды отсутствуют. Секвестрация легких – достаточно редкая аномалия. Среди всех врожденных заболеваний органов дыхания ее доля составляет 0.5 – 3%. Секвестрация чаще локализуется в нижнем отделе легких.
Легочный секвестр представляет собой кисту или группу кист, заполненных слизистой жидкостью. Он может располагаться внутри здоровой легочной ткани, такое состояние называется внутридолевой секвестрацией. Кроме того, секвестр может находиться внутри грудной клетки, имея вид добавочной легочной доли или недоразвитого легкого. Данное патологическое состояние называют внедолевой секвестрацией. Внедолевой секвестр обычно располагается в грудной клетке, но может локализоваться и в брюшной полости. Он также может срастаться с внутренними органами (пищеводом, желудком и др.), нарушая их функциональную способность.
Зачастую легочная секвестрация сочетается с другими пороками развития: врожденными аномалиями сердца, позвоночника тазобедренных суставов, почек и т.д.
Секвестрация легкого у детей может протекать бессимптомно на протяжении нескольких лет. Однако секвестрированные участки имеют тенденцию к инфицированию, и рано или поздно у ребенка развивается воспаление секвестра и пневмония. Воспаление легких обычно имеет тяжелое течение и впоследствии рецидивирует.
Диагностика
Во многих случаях секвестрация легких диагностируется в процессе пренатальной диагностики. Она различима на УЗИ плода.
На рентгеновском снимке легких, который обычно выполняют при пневмонии, секвестрация диагностируется далеко не всегда. При рецидивирующих пневмониях, когда возникает подозрение на наличие секвестра, специалисты в области детской пульмонологии в Израиле, рекомендуют выполнить компьютерную томографию грудной клетки. Компьютерная томография отличается высокой точностью и помогает обнаружить кистозные изменения в легочной ткани, не видимые на рентгеновском снимке. Также она позволяет визуализировать сеть аномальных кровеносных сосудов, подходящих к секвестру. Для получения дополнительной информации о кровоснабжении секвестра проводят аортографию. К другим диагностическим мероприятиям относятся УЗИ и магнитно-резонансная томография грудной клетки.
Лечение секвестрации легких в Израиле
Секвестрация легких лечится хирургическим путем. После завершения процесса диагностики, когда установлено наличие и точная локализация секвестра, проводится плановая хирургическая операция. Она заключается в резекции секвестра и перевязке питающих его кровеносных сосудов.
В больнице «Сафра» оперативное лечение секвестрации по возможности производят с применением эндохирургической техники, при которой нет необходимости в обширном разрезе грудной клетки. Эндоскоп – оптический прибор, позволяющий хирургу видеть в подробностях операционное поле – вводят через небольшой разрез. Инструменты для манипуляций на легком также вводятся через маленькие разрезы в межреберных промежутках. Эндохирургическое вмешательство считается минимально инвазивным, то есть не наносящим ущерба окружающим тканям. После операционная реабилитация после таких вмешательств протекает быстрее, а риск развития осложнений намного ниже, чем при открытых операциях.
Секвестрация легкого
Секвестрация легкого
МКБ-10 коды
Описание
Секвестрация легкого. Порок формирования легких, заключающийся в обособлении от основного органа рудиментарного участка легочной ткани с автономным кровотоком, не участвующего в процессе газообмена. Клиника при секвестрации легкого может быть скудной; при обострении инфекционного воспаления включает лихорадку, слабость, одышку, кашель со слизисто-гнойной мокротой, кровохарканье; при сдавлении пищевода и желудка - нарушение прохождения пищи. Диагноз основан на данных рентгенографии и КТ легких, бронхографии, бронхоскопии, ангиопульмонографии. При секвестрации легкого лечение только оперативное – секвестрэктомия, сегментэктомия или лобэктомия.
Секвестрация легкого
Дополнительные факты
Классификация
Причины
Секвестрация легкого является сложным пороком, вызванным комбинированным нарушением формирования различных бронхолегочных структур. Аномалия развивается в результате тератогенных влияний в раннюю внутриутробную фазу. Источником развития легочного секвестра являются добавочные выпячивания первичной кишки, рудименты дивертикула пищевода, отделившиеся от организующихся легких и затем теряющие связь с первичной кишкой и бронхиальным деревом. Иногда может оставаться связь рудимента легкого с пищеводом или желудком с помощью соустья-тяжа (бронхолегочно-кишечная мальформация).
Согласно теории тракции, развитию секвестрации легкого способствует нарушение редукции ветвей первичной аорты с трансформацией их в аномальные сосуды. Через эти сосудистые ветви зачаточные фрагменты легкого отграничиваются от нормальной легочной закладки.
Секвестрация легкого часто комбинируется с другими пороками развития: ЭЛС - с неиммунной водянкой плода, анасаркой, гидротораксом новорожденного; ИЛС – с врожденной аденоматоидной мальформацией легкого 2-го типа, рабдомиоматозной дисплазией, трахео- и бронхопищеводными свищами, воронкообразной деформацией грудной клетки, открытым средостением, диафрагмальной грыжей, гипоплазией почки, дефектами позвоночника и тазобедренных суставов.Клиническая картина
Клиническая картина секвестрации легкого определяется локализацией секвестра, наличием или отсутствием его связи с дыхательными путями, степенью развития гипоплазии легочной ткани и воспалительных изменений. Симптомы интралобарной секвестрации легкого редко проявляются на этапе новорожденности и раннего детства, развиваясь обычно в более старшем возрасте при инфицировании, воспалении, нагноении и прорыве кистозного секвестра.
При нагноении кисты и абсцессе порочной доли легкого заболевание начинается остро с лихорадки, слабости, потливости, умеренного болевого синдрома, одышки при нагрузке, непродуктивного кашля, а при прорыве гнойника - с выделения значительного объема гнойной мокроты. Иногда возможно кровохарканье и легочные кровотечения, часты плевральные осложнения. Течение секвестрации легкого обычно приобретает хронический характер с повторяющимися вялыми обострениями и ремиссиям. При ИЛС может иметь место клиника рецидивирующей пневмонии.
Экстралобарная секвестрация легкого часто протекает асимптомно и начинает беспокоить больного только в подростковом и более позднем возрасте. Внедолевые секвестры могут провоцировать сдавление пищевода, желудка и других органов, что может проявляться одышкой, цианозом, нарушением эвакуации пищи. Риск инфекционного процесса крайне низок.
Ассоциированные симптомы: Кашель. Кровохарканье. Одышка. Потливость.Диагностика
Ранняя диагностика секвестрации легкого затруднена из-за схожести ее клинико-рентгенологических симптомов с таковыми при другой легочной патологии. Диагноз устанавливают по совокупности данных обзорной рентгенографии и КТ легких, бронхографии, бронхоскопии, УЗИ брюшной полости, аортографии, ангиопульмонографии.
Рентгенологически интралобарная секвестрация легких (в отсутствии связи с бронхом и воспаления) определяется как затенение неправильной формы разной степени интенсивности с просветлением в толще или как полостное образование с горизонтальным уровнем жидкости или без него. При обострении вокруг секвестра в нижней доле легкого отмечается выраженная деформация сосудисто-бронхиального рисунка, умеренная перифокальная инфильтрация легочной ткани. При бронхографии наблюдается деформация и смещение бронхов, соседних с пораженным сегментом легкого. Бронхоскопическая картина секвестрации легкого, сообщающейся с дыхательными путями, соответствует катарально-гнойному эндобронхиту на стороне пораженного легкого.
Брюшнополостная ЭЛС выявляется на УЗИ как четко отграниченное образование однородной эхогенности с кровоснабжением через ветви крупных артерий. Диагноз окончательно подтверждается МСКТ легких и ангиопульмонографией с установлением наличия, количества и топографии аномальных сосудов, питающих область секвестрации. Радиоизотопное сканирование печени и перитонеография помогают отграничить правостороннюю секвестрацию легких от патологии органов ЖКТ. Секвестрация легкого нередко выявляется в ходе хирургического вмешательства по поводу хронического гнойного процесса в легком.Дифференциальная диагностика
Дифференциальный диагноз при секвестрации легкого проводится с деструктивной пневмонией, туберкулезным процессом, кистой или абсцессом легкого, бронхоэктазами, опухолью грудной полости.
Лечение
При секвестрации легких требуется проведение оперативного вмешательства – удаление аномального участка легочной ткани. При выявлении бессимптомной внутридолевой секвестрации легких возможно выполнение сегментэктомии, однако чаще всего требуется удаление всей пораженной легочной доли (обычно нижней) – лобэктомия. Тактика хирургического лечения внедолевой формы заключается в удалении секвестрированного участка (секвестрэктомии). Наличие при секвестрации легких аномальных крупных артериальных сосудов нетипичной локализации делает важным тщательную предварительную диагностику во избежание их интраоперационного повреждения и развития тяжелого угрожающего жизни кровотечения.
Прогноз при интралобарной форме в отсутствие гнойно-септических процессов – удовлетворительный, при экстралобарной секвестрации легкого брюшнополостной локализации, как правило, лучше, чем при ее внутригрудном расположении.Поддиафрагмальная экстралобарная секвестрация легкого в комбинации с дупликационной кистой желудка у новорожденного
![Обложка]()
Введение. Наибольшие трудности при лечении секвестрации встречаются при комбинации ее с другими заболеваниями и пороками развития.
Материалы и методы. В статье описан редкий клинический случай комбинации врожденных пороков развития: поддиафрагмальной экстралобарной секвестрации легкого и дупликационной кисты желудка. Проведение скринингового ультразвукового обследования на сроке 21 неделя выявило наличие солидного образования с кистозным компонентом в левом забрюшинном пространстве с наличием отходящей от аорты артерии. Проведена мультиспиральная компьютерная томография с болюсным контрастированием при рождении, которая подтвердила наличие поддиафрагмально расположенного кистозного компонента с наличием питающей артерии, отходящей от аорты. Учитывая топику расположения и характер образования, нельзя было исключить неопластический процесс. Лабораторное исследование в объеме определения онкомаркеров отклонений не выявило. Методом лечения данной патологии является оперативный. В нашем случае оперативное лечение осуществлено в объеме лапаротомии, удалении кисты и внелегочного секвестра. Гистологическое исследование подтвердило секвестрацию легкого и дупликационной кисты желудка.
Заключение. Современные методы диагностики позволяют на ранних этапах пренатального скринингового обследования выявить наличие порока развития до его клинического проявления и определить локализацию легочного секвестра, дупликационных кист с вариацией по всей пищеварительной трубке. Оперативное лечение, как открытым способом, так и с использованием малоинвазивных технологий, является основным методом лечения данных пороков и дает хороший клинический результат. Также представлен литературный обзор редких клинических вариантов секвестрации легкого у детей.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Секвестрация легкого (СЛ) — редкий врожденный порок развития легких, при котором патологический участок легочной ткани, частично или полностью отделившийся на ранних стадиях эмбриогенеза от основного легкого, развивается самостоятельно и имеет отдельное кровоснабжение аномальной артерией, отходящей от аорты или ее ветвей. Частота встречаемости в структуре пороков легких на долю СЛ приходится, по разным данным, 0,15–6 % [1].
Принято подразделять СЛ на две формы: интралобарная и экстралобарная. Интралобарная секвестрация встречается в 75 % случаев. Экстралобарную форму СЛ, зачастую, подразделяют на супра- и инфрадиафрагмальную локализации, последняя встречается лишь в 9,7 % случаев среди всех экстралобарных СЛ. Также в литературе имеются единичные описания интрадиафрагмальной локализации СЛ [2].
Сочетанные пороки развития при данной патологии встречаются довольно часто, порядка 65 % случаев [3], однако в основном представлены бронхогенными кистами, кистозно-аденоматозными мальформациями и грыжами пищеводного отверстия диафрагмы [4, 5]. Однако сочетание СЛ с дупликационными кишечными кистами имеет лишь единичные отражения в мировой литературе.
Приведенный клинический случай демонстрирует крайне редкую поддиафрагмальную экстралобарную форму секвестрации легкого в комбинации с дупликационной кистой желудка у новорожденного [6].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент А., мальчик, в возрасте 6 сут, поступил в детское хирургическое отделение в ноябре 2019 г. с рабочим диагнозом: «Экстралобарная секвестрация(?) Киста брюшной полости(?)».
Из анамнеза: ребенок от первой беременности, первых естественных родов на сроке гестации 41 нед., вес при рождении 3980 г. Антенатально по результатам ультразвукового исследования и магнтино-резонансной томографии плода на сроке гестации в 21 неделю выявлено солидное образование с кистозным компонентом, размером до 4 см в диаметре, в левом забрюшинном пространстве с наличием отходящей от аорты артерии. Ребенок после рождения переведен для дообследования в отделение патологии новорожденных.
В общем анализе крови и мочи, биохимическом анализе крови патологических изменений не выявлено. При исследовании уровня онкомаркеров отклонений не выявлено: альфа-фетопротеин — 2125,00 МЕ/мл, β-ХГЧ — 5,13 МЕ/л.
При ультразвуковом исследовании органов брюшной полости и почек выявлено, что между телом поджелудочной железы и воротами селезенки визуализируются гиперэхогенное неоднородной структуры с четким контуром округлое образование размерами 37 × 28 × 27 мм с прилегающим к нему анэхогенным образованием с четким контуром, извитой S-образной формы без кровотока 28 × 16 × 14 мм.
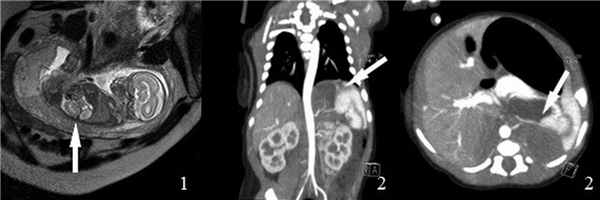
Выполнена мультиспиральная компьютерная томография органов грудной клетки и брюшной полости с внутривенным болюсным контрастированием: поддиафрагмально в парамедианных отделах слева определяется образование с преобладающим кистозным компонентом, общими размерами 51 × 21 × 37 мм, стенки и перегородки умеренно накапливают контрастный препарат. От аорты к образованию отходит мелкая артерия. Печень не увеличена. Контуры ровные, четкие (рис. 1).
![]()
Рис. 1. Магнитно-резонансная томограмма плода (а) и постнатальная мультиспиральная компьютерная томограмма органов грудной клетки (b) и брюшной полости (с) с внутривенным болюсным контрастированием с визуализацией образования, имеющего кистозно-солидную структуру и питающий сосуд, отходящий напрямую от аорты (обозначено белой стрелкой)
Fig. 1. Fetal MRI (а) and postnatal CT of chest (b) and abdomen (с) with contrast with visualization of mass that has a cystic-solid structure and a vessel that departs directly from the aorta (indicated by a white arrow)
Учитывая топику расположения образования и его структуру, не было возможности однозначно исключить неопластический процесс, проводился дифференциальный диагноз с нейробластомой.
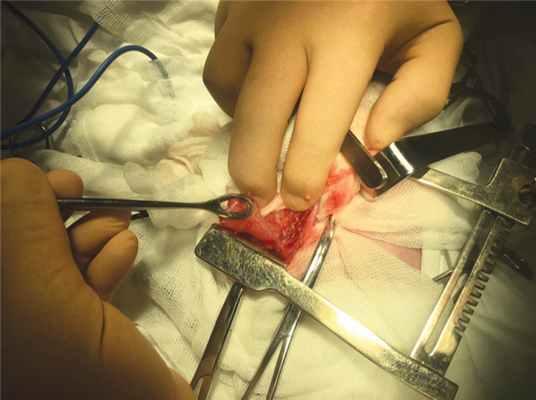
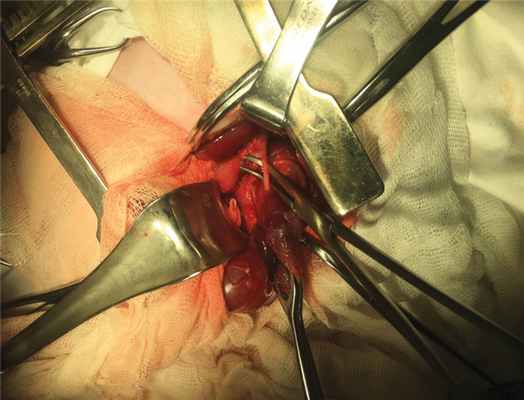
Под интубационным наркозом в положении пациента на спине после обработки операционного поля произведена лапаротомия из левого подреберья. При ревизии органов брюшной полости выпота не выявлено. Желудок, селезенка отведены книзу и медиально, после чего выявлено объемное кистозное образование, интимно прилегающее к задней стенке желудка и хвосту поджелудочной железы, размерами 2,0 × 1,0 см (рис. 2). При мобилизации образования от задней стенки желудка и поджелудочной железы с коагуляцией мелких питающих сосудов образовался дефект в желудке размерами 1,0 × 1,0 см, что означало наличие общей стенки у образования и желудка. Дефект ушит двухрядным швом. После удаления кисты, кзади, забрюшинно, выявлено плотно-эластичной консистенции образование, также прилегающее к телу и хвосту поджелудочной железы и заднелатеральной поверхности диафрагмы. Поэтапно, с минимальными техническими трудностями, образование выделено из окружающих тканей забрюшинного пространства, выявлена питающая артерия, отходящая от брюшного отдела аорты, которая лигирована и пересечена (рис. 3). Образование удалено. Гемостаз. Сухо. В ложе ранее расположенных образований установлена дренажная силиконовая трубка. На рану послойно наложены швы. Субдермальный шов. Асептическая повязка.
![]()
Рис. 2. Вид дупликационной кисты в момент ее выделения, видна общая стенка с желудком
Fig. 2. View of the duplication cyst, the common wall with the stomach is visualised
![]()
Рис. 3. Инфрадиафрагмальный секвестр легкого с питающим аберрантным сосудом
Fig. 3. Infradiaphragmatic lung sequestrum with an aberrant vessel
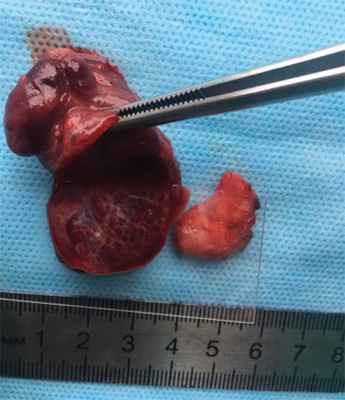
Макропрепараты представлены образованием брюшной полости кистозного характера, размерами 2,0 × 1,0 см, с наличием желеобразного прозрачного содержимого и забрюшинным образованием, размерами 4,0 × 3,0 см, имеющим на разрезе структуру по типу легочной ткани (рис. 4).
![]()
Рис. 4. Макропрепараты удаленных легочного секвестра и дупликационной кисты желудка
Fig. 4. Gross specimen of excised pulmonary sequestrum and duplication cyst of the gaster
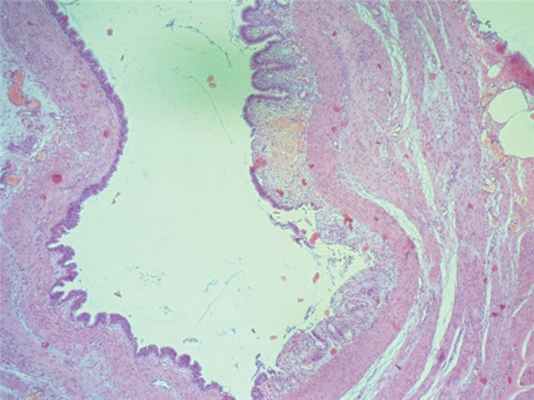
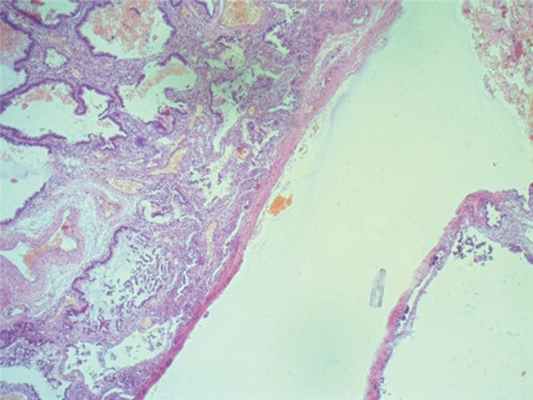
При гистологическом исследовании выявлено: морфологическая картина фрагмента ткани кистозного образования, стенка которого представлена гладкомышечными волокнами, покрытыми слизистой оболочкой из многорядного цилиндрического эпителия, с формированием на отдельных участках примитивных желез желудочного типа, соответствует дупликационной кисте желудка (рис. 5). Морфологическая картина фрагмента ткани солидного образования, имеющего строение ткани легкого, представленной большим числом кистозных полостей, выстланных однорядным цилиндрическим эпителием бронхиального типа, в просвете части из которых определяется лимфоцитарно-макрофагальная инфильтрация и сладжированные эритроциты, а в интерстиции очаговые кровоизлияния, полнокровие сосудов, соответствует легочному секвестру (рис. 6).
![]()
Рис. 5. Гистологическая картина дупликационной кисты желудка
Fig. 5. The histological picture of the duplication cyst of the stomach
![]()
Рис. 6. Гистологическая картина легочного секвестра
Fig. 6. The histological picture of the lung sequestrum
Симптоматическая, инфузионная, антибактериальная терапия (Меронем в дозе 85 мг 3 раза в день, в/в, 5 дней).
В послеоперационном периоде ребенок на протяжении 7 сут находился в детском отделении реанимации и интенсивной терапии. Тяжесть состояния была обусловлена течением послеоперационного периода, гастроинтестинальной недостаточности, инфекционным токсикозом. Получал антибактериальную (Сультасин, Меронем), противогрибковую терапию, гастропротекторы. Дренаж удален на третьи сутки после операции.
Послеоперационная рана зажила первичным натяжением. При проведении контрольного ультразвукового исследования брюшной полости структурной патологии, свободной жидкости не выявлено. На 12-е сутки после операции ребенок выписан в удовлетворительном состоянии. Период госпитализации был увеличен в связи с необходимостью получения результатов гистологического исследования. Осложнений в послеоперационном периоде выявлено не было.
ОБСУЖДЕНИЕ
Секвестрация легкого — редкий врожденный порок развития легких, при котором патологический участок легочной ткани, частично или полностью отделившийся на ранних стадиях эмбриогенеза от основного легкого, развивается самостоятельно и имеет разную вариацию кровоснабжения [7, 8].
Принято подразделять СЛ на две формы: интралобарная и экстралобарная. При интралобарной секвестрации патологический участок располагается в ткани легкого, имея единую висцеральную плевру, данный вариант порока является наиболее частым и встречается в 75 % случаев.
Экстралобарная форма СЛ встречается заметно реже и представлена аберрантным участком легочной ткани, который имеет отдельное от здорового легкого покрытие висцеральной плеврой. Данную форму СЛ зачастую подразделяют на супра- (порядка 90 %) и инфрадиафрагмальную (порядка 10 %) локализации, однако в литературе встречаются и другие терминологические обозначения: интраторакальная и интраабдоминальная формы [9, 10].
В большинстве случаев секвестрированный участок имеет один питающий сосуд, отходящий от грудного или брюшного отдела аорты, реже встречается наличие нескольких питающих сосудов. Венозный дренаж, как правило, не нарушен и при интралобарной форме осуществляется через легочные вены в 98 % случаев, гораздо реже — в непарную и полунепарную вены. Для экстралобарной формы характерно дренирование венозной крови чаще через нижнюю полую вену, непарную и полунепарную вены [9].
Сочетанные пороки развития у детей с СЛ встречаются довольно часто, порядка 65 % случаев, однако в основном представлены бронхогенными кистами, кистозно-аденоматозными мальформациями и грыжами пищеводного отверстия диафрагмы [10].
Сочетание СЛ с дупликационными кишечными кистами имеет лишь единичные отражения в мировой литературе, в том числе и с дупликационной кистой желудка. Кишечные дупликационные кисты также являются одной из редких аномалий развития, которая входит в группу удвоений желудочно-кишечного тракта и, в большинстве случаев, имеет общую стенку с кишечной трубкой. Анатомически данные кисты могут располагаться на любом участке желудочно-кишечного тракта от полости рта до анального канала [11]. Гистологическое строение дупликационных кист предполагает наличие хорошо развитой гладкомышечной стенки и выстилки, представленной желудочным или кишечным эпителием.
Зачастую, в связи с редкостью СЛ, постановка точного диагноза может быть затруднительной, особенно если у ребенка имеются сочетанные пороки развития [12]. Однако применение методов лучевой визуализации помогает достаточно точно определить патологический участок легочной ткани, в особенности при его типичном расположении в пределах грудной клетки, и установить верный диагноз [13].
Также с развитием науки и техники широко в общемировой практике представлена пренатальная диагностика СЛ посредством ультразвукового исследования и магнитно-резонансной томографии плода, позволяющая на ранних этапах эмбриогенеза верифицировать точный диагноз [14].
Наиболее эффективным методом лечения СЛ является ее хирургическое удаление, в том числе с применением малоинвазивных технологий [15–19]. Однако расположение подобного рода образований за пределами грудной клетки может затруднить постановку верного диагноза, поскольку локализация, в том числе представленная в данной статье, характерна и для некоторых опухолевых образований, исключение которых должно быть обязательно включено в диагностический ряд.
ЗАКЛЮЧЕНИЕ
Современные методы диагностики, а также опыт врачей лучевой диагностики позволяют на ранних этапах пренатального скринингового обследования выявить наличие порока развития до его клинического проявления и определить локализацию ЛС, дупликационных кист с вариацией по всей пищеварительной трубке. В выше описанном случае учитывая топику забрюшинного расположения, характер рентгенологической и ультразвуковой картины не исключал наличия нейробластомы, в связи с чем от применения эндоскопической хирургии было необходимо воздержаться. Однако оперативное лечение, как открытым способом, так и с использованием малоинвазивных технологий, является основным методом лечения данных пороков и дает хороший клинический результат.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы данной статьи подтвердили отсутствие конфликта интересов и финансовой поддержки, о которых необходимо сообщить.
Conflict of interest. The authors of this article confirmed the lack of interest and financial support, which should be reported.
Читайте также: