Нарушение дыхания во сне. Дыхание Cheyne-Stokes при сердечной недостаточности
Добавил пользователь Валентин П. Обновлено: 18.01.2026
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Центральное апноэ сна у пациентов с хронической сердечной недостаточностью
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2019;119(4‑2): 99‑104
В статье рассматривается связь дыхания Чейна—Стокса — одной из форм нарушения дыхания во сне и хронической сердечной недостаточности (ХСН) с низкой фракцией выброса левого желудочка. Описываются симптомы заболевания, уровень смертности, варианты лечения. Подробно представлено влияние СиПАП-терапии, БиПАП, адаптивной сервовентиляции на пациентов с дыханием Чейна—Стокса и ХСН. Как альтернативный вариант терапии дыхания Чейна—Стокса рассматривается диуретик ацетазоламид, подавляющий у больных ХСН центральное апноэ сна и уменьшающий связанные с ним дневные симптомы.
О том, что нарушения дыхания во время сна характерны для пациентов с хронической сердечной недостаточностью (ХСН), клиницистам известно давно. Впервые такой специфический вариант нестабильного патологического дыхания, сопровождавшегося эпизодами апноэ, был описан врачами J. Cheyne [1] и W. Stokes [2] еще в XIX веке и в дальнейшем получил свое название в честь этих исследователей.
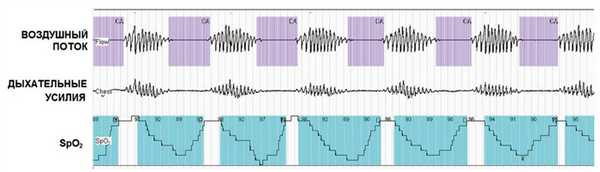
На сегодняшний день под дыханием Чейна—Стокса подразумевают специфическую респираторную патологию, которая является частным случаем синдрома центрального апноэ сна. Заболевание характеризуется чередованием циклов, состоящих из периода постепенного нарастания легочной вентиляции и последующего ее убывания вплоть до возникновения апноэ или гипопноэ. Продолжительность такого респираторного цикла обычно составляет от 60 до 90 с (рис. 1). Рис. 1. Респираторная полиграфия во время сна у пациента с ХСН и дыханием Чейна—Стокса (фрагмент записи длительностью 5 мин). Регистрируется специфический веретенообразный рисунок дыхания с характерным чередованием периодов гипервентиляции, гиповентиляции и апноэ. Отсутствие дыхательных движений грудной клетки во время эпизодов апноэ говорит о их центральном характере (наблюдение авторов). Диагностическими критериями этого варианта периодического дыхания являются наличие 5 и более центральных апноэ или гипопноэ за час сна и характерный веретенообразный рисунок дыхания при наличии у пациента тяжелых сердечно-сосудистых или неврологических заболеваний [3, 4].
По данным разных авторов [5—7], дыхание Чейна—Стокса наблюдается у 15—37% пациентов с ХСН и низкой фракцией выброса левого желудочка (ЛЖ). Обычно этот вариант патологического дыхания возникает только во время сна, и лишь у отдельных наиболее тяжелых больных может наблюдаться и в состоянии бодрствования [4]. Напротив, среди больных с умеренной дисфункцией ЛЖ центральные нарушения дыхания во время сна — относительно редкое явление.
Дыхание Чейна—Стокса часто приводит к микропробуждениям — коротким мозговым активациям в фазу гипервентиляции, которые большей частью не сохраняются в памяти пациента, но вызывают фрагментацию сна, а также к ассоциированной с дыхательными паузами гипоксемии. Клинически это может быть представлено жалобами на поверхностный неосвежающий сон, периодические пробуждения с чувством нехватки воздуха и дневную разбитость. Избыточная дневная сонливость также возможна, но менее характерна по сравнению с обструктивным апноэ сна. Следует подчеркнуть, что во многих случаях субъективная симптоматика может вообще отсутствовать или маскироваться схожими симптомами ХСН [3].
К основным предикторам возникновения дыхания Чейна—Стокса во время сна можно отнести пожилой возраст пациентов, мужской пол, низкий уровень РаСО2 в бодрствовании, фибрилляцию предсердий и значимую систолическую дисфункцию Л.Ж. При этом абсолютная величина фракции выброса ЛЖ не является фактором, напрямую определяющим риск возникновения дыхания Чейна—Стокса при ХСН [5, 8]. Кроме того, результаты исследования M. Zilberman и соавт. [9] показали достоверную связь между уровнем гемоглобина и тяжестью центрального апноэ сна у пациентов с ХСН. Таким образом, анемия при ХСН также может играть самостоятельную роль в возникновении центральных нарушений дыхания во время сна.
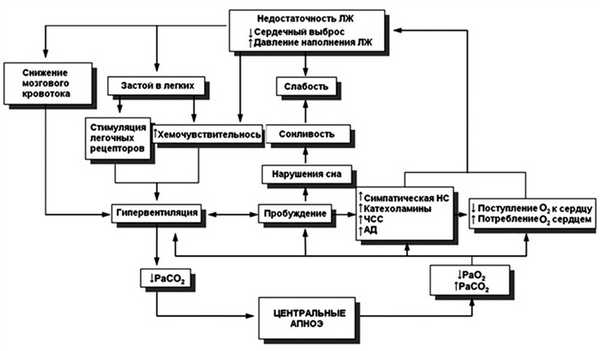
Механизмы, ответственные за развитие дыхания Чейна—Стокса, до настоящего времени обсуждаются специалистами (рис. 2). Рис. 2. Патогенез и физиологические последствия дыхания Чейна—Стокса (по [11]). Симпатическая НС — симпатическая нервная система; ЧСС — частота сердечных сокращений; АД — артериальное давление. Полагают, что дыхание Чейна—Стокса характеризуется чередованием повышенной и пониженной респираторной стимуляции в зависимости от колебаний РаСО2 относительно значения, являющегося пороговым для возникновения апноэ. Периодическое дыхание возникает в том случае, когда близки значения концентрации углекислого газа в крови и порога возникновения апноэ, так как в таком случае даже небольшие изменения вентиляции легких приводят к колебаниям уровня PaCO2 выше или ниже того уровня, который необходим для нормального дыхания или возникновения апноэ [10]. Кроме того, у пациентов с ХСН появление дыхания Чейна—Стокса может быть связано с нарушением работы системы контроля дыхания в результате застойных явлений в легких, гиперчувствительности центральных и периферических хеморецепторов, сниженного церебрального кровотока и, возможно, ряда других факторов. Также предполагают, что низкий сердечный выброс приводит к увеличению времени циркуляции крови между легкими и центральными хеморецепторами, что, в свою очередь, может провоцировать возникновение апноэ центрального генеза за счет замедления ответа на изменения PaCO2 [11].
Прогностическое значение ночного дыхания Чейна—Стокса для пациентов с ХСН остается предметом дискуссии. Спорным остается вопрос: являются ли центральные нарушения дыхания во время сна просто показателем тяжести течения ХСН, вызывают независимые негативные последствия или вообще носят компенсаторный характер. Исследования, посвященные этому вопросу, зачастую ограничены по числу пациентов, значительно различаются дизайном, диагностическими критериями и терапевтическими подходами. Потому их результаты оказываются предсказуемо противоречивы и их достаточно трудно сравнивать.
Ряд авторов [12, 13] пришли к заключению об отсутствии связи между центральным апноэ сна и смертностью пациентов с ХСН. Так T. Roebuck и соавт. [13] наблюдали 78 больных с тяжелой ХСН, у которых рассматривался вопрос о пересадке сердца. Дыхание Чейна—Стокса отмечалось почти у ½ из них. Тем не менее наличие дыхательных нарушений во время сна у пациентов даже со столь тяжелой ХСН не коррелировало с показателями смертности. В недавно опубликованной работе M. Naughton суммирует накопленные в литературе данные и приходит к заключению, что дыхание Чейна—Стокса при ХСН способствует приросту сердечного выброса, обеспечивает периоды отдыха дыхательной мускулатуре и в целом оказывает кардиопротективный эффект [14]. В итоге своих рассуждений автор делает вывод, что дыхание Чейна—Стокса при ХСН является компенсаторным механизмом и не требует лечения.
Другие специалисты [15—17], напротив, сходятся во мнении, что дыхание Чейна—Стокса является независимым предиктором сердечно-сосудистой смертности при ХСН. При этом вероятность летального исхода напрямую коррелирует с числом патологических респираторных событий, возникающих у пациента во время сна, и значимо возрастает при индексе апноэ/гипопноэ более 20—30 эпизодов в час. Например, P. Lanfranchi и соавт. [15] при обследовании 62 пациентов с ХСН обнаружили, что в подгруппе с дыханием Чейна—Стокса смертность была выше, причем вероятность летальности оказалась прямо пропорциональной тяжести дыхательных нарушений во время сна. Аналогично, в работе S. Javaheri и соавт. [17] на примере 88 пациентов было установлено, что дыхание Чейна—Стокса независимо ассоциировано с худшей выживаемостью больных ХСН. В рамках продолжающейся дискуссии S. Javaheri и соавт. [18] обращают внимание на тот факт, что дыхание Чейна—Стокса при ХСН запускает целый ряд патологических процессов и в том числе приводит к повышению адренергической активности. Это значительно ухудшает прогноз и делает периодическое дыхание при ХСН со сниженной фракцией выброса ЛЖ независимым предиктором смерти.
Таким образом, большинство специалистов на сегодняшний день сходятся во мнении, что наличие дыхания Чейна—Стокса является независимым фактором, значимо увеличивающим риск смертности у пациентов с ХСН. Это скорее всего связано с провоцируемой дыхательными нарушениями избыточной активацией симпатической нервной системы (рис. 2), но не исключено, что также могут быть задействованы и иные, не известные еще механизмы [11].
Согласно актуальным международным рекомендациям [19—21], стандартом лечения центрального апноэ сна на фоне ХСН являются оптимизация фармакотерапии сердечной недостаточности, назначение неинвазивной вентиляционной поддержки положительным давлением, оксигенотерапия, а также медикаментозная коррекция нарушений дыхания во время сна.
Данные большого числа исследований [22, 23] выявили, что эффективное лечение ХСН сопровождается значительным уменьшением тяжести центральных нарушений дыхания во время сна. Тем не менее современные исследования продолжают наблюдать высокую встречаемость дыхания Чейна—Стокса во время сна у больных ХСН, находящихся на оптимальной терапии, соответствующей текущим рекомендациям. Так, в исследовании O. Oldenburg и соавт. [24], включавшем 700 пациентов со стабильной ХСН, центральное апноэ сна было выявлено более чем у 1/3 больных. Таким образом, распространенность дыхания Чейна—Стокса при ХСН остается высокой, несмотря на успехи современной медицины в лечении таких пациентов.
На сегодняшний день терапией первого выбора при лечении центрального апноэ сна и дыхания Чейна—Стокса у пациентов с ХСН зарубежные эксперты [19, 21] по умолчанию считают неинвазивную вентиляцию с постоянным положительным давлением — СиПАП. Механизмы, благодаря которым СиПАП-терапия может устранять центральные апноэ сна, не до конца ясны. Возможно, это связано с нормализацией РаСО2 во время сна у пациентов, исходно склонных к гипокапнии [25], а также благодаря возрастанию фракции выброса ЛЖ [26].
Наши современные представления о роли СиПАП-терапии при лечении дыхания Чейна—Стокса у пациентов с ХСН основываются на результатах наиболее крупного и длительного многоцентрового исследования CANPAP [27]. Согласно полученным результатам, СиПАП значительно уменьшает тяжесть центрального апноэ сна при ХСН, улучшает показатели оксигенации крови во время сна и снижает активность симпатической нервной системы, что приводит к улучшению сократительной функции ЛЖ и увеличивает переносимость физических нагрузок, но не влияет на выживаемость этих пациентов. Однако проведенный в дальнейшем дополнительный анализ итогов CANPAP [28] показал, что конечный эффект лечения значительно отличается в зависимости от того, каков был исходный ответ на СиПАП-терапию. Было установлено, что выживаемость пациентов, у которых СиПАП-терапия эффективно устраняла дыхание Чейна—Стокса, достоверно выше по сравнению как с контролем, так и с больными, не ответившими на лечение положительным давлением. Продолжение СиПАП-терапии при сохраняющемся на фоне проводимого лечения центральном апноэ сна, напротив, ухудшает прогноз в отношении выживания. Таким образом, применение СиПАП-терапии для лечения дыхания Чейна—Стокса у пациентов с ХСН остается методом выбора, но лишь при условии адекватного терапевтического ответа на начатое лечение, которым следует считать остаточный индекс апноэ/гипопноэ менее 15 патологических респираторных эпизодов в час. Только в этом случае СиПАП-терапия положительно сказывается на прогнозе выживания у таких пациентов. С учетом сравнительной простоты и доступности этого терапевтического вмешательства СиПАП следует рассматривать в качестве стандартного способа коррекции дыхания Чейна—Стокса, но при ее неэффективности или непереносимости следует выбирать другие методы лечения.
Неинвазивная респираторная поддержка в режиме адаптивной сервовентиляции (АСВ) наиболее корректно взаимодействует с собственным дыхательным рисунком пациента, позволяет не только компенсировать периоды гиповентиляции и апноэ, но и нивелировать гиперпноэ. Это обеспечивает высокую эффективность и хорошую переносимость такого лечения. В ряде исследований [29, 30] было обнаружено преимущество АСВ по сравнению с СиПАП-терапией и другими методами, применяемыми для лечения дыхания Чейна—Стокса. Однако в ходе масштабного многоцентрового исследования SERVE-HF [31], включавшего 1325 пациентов с систолической сердечной недостаточностью и центральным апноэ сна, было установлено, что применение АСВ у этих больных эффективно устраняет нарушения дыхания, но ведет к возрастанию сердечно-сосудистой летальности. С учетом вновь полученных данных концепция применения АСВ у этой группы пациентов была радикально пересмотрена: АСВ в настоящее время не рекомендуется для лечения больных дыханием Чейна—Стокса и ХСН с низкой фракцией выброса ЛЖ [20].
Неинвазивная вентиляция двумя уровнями положительного давления (БиПАП) с контролем фоновой частоты дыхания (режим ST) продемонстрировала высокую эффективность при лечении центральных нарушений дыхания у пациентов с ХСН [29]. Однако в свете результатов исследования SERVE-HF [31] можно говорить о том, что длительная многоуровневая респираторная поддержка при ХСН оказалась скомпрометирована, так что и этот метод лечения следует применять с большой осторожностью.
По результатам ряда исследований [32, 33] было установлено, что малопоточная оксигенотерапия существенно уменьшает тяжесть центрального апноэ сна при ХСН и в значительной степени предотвращает гипоксемию, ассоциированную с остаточными респираторными событиями. Также было показано, что кислородная поддержка во время сна приводит к повышению фракции выброса ЛЖ, возрастанию толерантности к физическим нагрузкам и улучшению качества жизни таких больных [32, 34]. Однако есть данные [35], что применение кислородной поддержки у пациентов с ХСН и исходно нормальным насыщением крови кислородом может иметь ряд негативных гемодинамических последствий, включая ухудшение сократительной функции Л.Ж. Таким образом, использование оксигенотерапии во время сна у пациентов с дыханием Чейна—Стокса, которое не ассоциировано со значимой гипоксемией, представляется неоправданным.
Назначение теофиллина также позволяет значимо уменьшить тяжесть центрального апноэ и улучшить оксигенацию крови во время сна у пациентов с ХСН [36]. Основным фактором, лимитирующим такое лечение, является наличие у препарата проаритмических свойств, что обусловливает риск опасных нарушений сердечного ритма у этой категории пациентов.
Показано, что диуретический препарат ацетазоламид уменьшает количество центральных респираторных событий и улучшает оксигенацию крови во время сна у больных ХСН и дыханием Чейна—Стокса. Клинически это проявляется улучшением качества сна, уменьшением дневной утомляемости и сонливости. Каким образом ацетазоламид может подавлять дыхание Чейна—Стокса, не до конца ясно. Высказывается предположение, что в первую очередь это происходит за счет развивающегося при его приеме метаболического ацидоза. В результате изменяется чувствительность периферических хеморецепторов и возрастает разница между текущей величиной PаCO2 и его нижним пороговым значением, необходимым для возникновения центрального апноэ, что и приводит к стабилизации дыхания. Одновременно положительный эффект ацетазоламида может реализовываться непосредственно через его диуретическое действие, что приводит к уменьшению застойных явлений и улучшает течение сердечной недостаточности в целом [37, 38].
ХСН различного генеза остается частым основанием для госпитализации и ведущей причиной смерти больных с заболеваниями сердечно-сосудистой системы. Средняя выживаемость после появления первых симптомов сердечной недостаточности за последнее десятилетие не изменилась, несмотря на значительный прогресс, достигнутый в лечении этих больных.
Центральное апноэ сна при ХСН является актуальной проблемой, которая пока недооценена отечественными практическими врачами. Высокая встречаемость дыхания Чейна—Стокса среди пациентов с ХСН и накопленный массив данных о негативном влиянии центрального апноэ сна на выживаемость этих больных обусловливают необходимость своевременной диагностики и адекватного лечения этой респираторной патологии.
В большинстве современных руководств в качестве наиболее эффективных и безопасных способов лечения дыхания Чейна—Стокса рассматриваются СиПАП-терапия и кислородная поддержка. Из них только для СиПАП-терапии существует достаточная доказательная база, подтверждающая факт снижения сердечно-сосудистой смертности при лечении дыхания Чейна—Стокса. Однако следует иметь в виду, что, по данным проведенных исследований, только ½ пациентов с ХСН способны адаптироваться к ночной вентиляции положительным давлением и нормально переносят это лечение. И только ½ из тех, кто в итоге получают СиПАП-терапию, демонстрируют адекватное уменьшение индекса апноэ/гипопноэ до необходимой целевой величины. Таким образом, ¾ пациентов с ХСН и центральным апноэ сна в итоге нуждаются в альтернативном лечении. Кислородотерапия, напротив, хорошо переносится больными и достаточно эффективна, но смысл ее назначения пациентам без значимых гипоксемических эпизодов во время сна представляется сомнительным.
Назначение ацетазоламида уменьшает тяжесть дыхания Чейна—Стокса и одновременно патогенетически оправданно с точки зрения оптимизации фармакотерапии ХСН, при этом препарат безопасен и, что немаловажно, такое лечение наименее затратно с финансовой точки зрения. Применение ацетазоламида представляется перспективным, но необходимы дополнительные исследования, которые позволят объективно оценить влияние такого лечения на сердечно-сосудистые риски и прогноз у пациентов с ХСН и дыханием Чейна—Стокса.
Поддерживается Проектом повышения конкурентоспособности ведущих российских университетов среди ведущих мировых научно-образовательных центров.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Сведения об авторах:
Нарушение дыхания во сне. Дыхание Cheyne-Stokes при сердечной недостаточности
Отек легких и дыхание Cheyne-Stokes при сердечной недостаточности. Общее состояние при сердечной недостаточности
Развивается в результате транссудации жидкости в альвеолярные пространства вследствие резкого увеличения гидростатического давления в капиллярах на фоне сниженной функции сердца или повышения внутрисосудистого объема. Признаком отека легких могут стать кашель или нарастающее диспноэ. Самая острая форма отека легких сопровождается крайне выраженной одышкой и выделением мокроты с кровью. Если вовремя не принять срочные меры, острый отек легких может привести к летальному исходу.
Дыхание Cheyne-Stokes. Такой тип дыхания также называют периодическим, или циклическим, дыханием, которое характерно для прогрессирующей стадии сердечной недостаточности и обычно сопровождается пониженным минутным объемом сердца (МОС). Причиной дыхания Cheyne-Stokes является пониженная чувствительность дыхательного центра к артериальному Рсо2. В нем выделяют фазу апноэ, в течение которой артериальное Ро2 снижается, а артериальное Рсо2 повышается. Эти изменения в артериальной крови раздражают угнетенный дыхательный центр, вызывая гипервентиляцию и гипо-капнию, что сменяется рецидивом апноэ.
Пациент или его семья могут принять дыхание Cheyne-Stokes за острое диспноэ или за временную остановку дыхания.
У пациентов с сердечной недостаточностью также могут присутствовать симптомы со стороны желудочно-кишечного тракта (ЖКТ). Основными жалобами являются анорексия, тошнота и чувство быстрого насыщения, сопровождающееся болью в животе и ощущением переполнения желудка, что может быть связано с отеком стенки кишечника и/или с застойной печенью. Застой в печени и растяжение ее капсулы может вызвать боль в правом подреберье. Церебральные симптомы, такие как спутанность сознания, дезориентация, расстройство сна и настроения, могут наблюдаться у пациентов с острой СН (ОСН), в частности у пожилых пациентов с церебральным атеросклерозом и пониженной церебральной перфузией. Никтурия характерна для СН и может стать причиной бессонницы.
Общее состояние при сердечной недостаточности
При оценке состояния пациентов с сердечной недостаточностью всегда необходимо проводить тщательное физикальное обследование с целью определения причины СН и оценки степени тяжести. Получение дополнительной информации о гемо-динамическом профиле, реакции на лечение, а также определение прогноза течения болезни являются важными сопутствующими целями физикального обследования.
При легкой или умеренной степени сердечной недостаточности пациент не испытывает недомогание в покое, за исключением чувства дискомфорта в положении лежа более нескольких минут. При более тяжелой степени СН пациент может испытывать затруднение дыхания и не всегда способен закончить речь из-за нехватки воздуха. Систолическое артериальное давление может быть нормальным или высоким, но, как правило, снижается при прогрессировании СН из-за тяжелой ДЛЖ. Пульсовое артериальное давление (ПАД) может повышаться вследствие общего сужения кровеносных сосудов.
Синусовая тахикардия является неспецифическим показателем, вызванным гиперсимпатикотонией. Сужение периферических кровеносных сосудов приводит к охлажению конечностей, а избыточная симпатическая активность — к цианозу губ и ногтей.
Дыхательный синдром Чейн-Стокса. Синдром гиповентиляции во сне. Пиквикский синдром.
Дыхательный синдром Чейн-Стокса (ДСЧС). Выраженная сердечная недостаточность и в некоторых случаях инсульт с повреждением дыхательного центра продолговатого мозга («синдром проклятия Ундины») могут сопровождаться ПСГ-признаками, напоминающими таковые при синдроме ЦСА. Они представляют собой циклические, прибывающие и убывающие, флюктуирующие паттерны эпизодов ЦСА, перемежающиеся эпизодами гиперпноэ (дыхание типа Чейн-Стокса). В норме у взрослых уровень РаС02 возрастает во сне примерно на 7 мм рт. ст. Существует гипотеза, что снижение сократительной функции сердца ведет к удлинению времени циркуляции с центральной задержкой ответа на такое колебание уровня РаС02 во сне. Это и приводит к появлению дыхания типа Чейн-Стокса. В большинстве случаев, однако, не удается обнаружить специфический анатомический субстрат, позволяющий ясно объяснить этот феномен.
Анамнез и объективное исследование дыхания Чейн-Стокса. Большинство экспертов считают, что для диагностики ДСЧС во сне необходимо наличие у пациента выраженной сердечной недостаточности или нарушения мозгового кровообращения. Такие больные могут жаловаться на инсомнию с нарушением нормального течения сна. При выраженности первичного заболевания дыхание типа Чейн-Стокса может наблюдаться и в состоянии бодрствования. Необходимо тщательное обследование с целью выявления повреждения ствола мозга и хронической сердечной недостаточности.
ПСГ. Должны быть, по крайней мере, три отчетливых периода циклического дыхания по типу «нарастание-убывание», каждый длительностью более 10 секунд. Расстройство считается выраженным, когда отдельные периоды дыхания типа Чейн-Стокса продолжаются 10 и более минут подряд. О степени тяжести можно судить по отношению продолжительности дыхания типа Чейн-Стокса к общему времени сна. Чаще всего дыхание типа Чейн-Стокса наблюдается в фазе медленного сна. Отмечаются параллельные колебания частоты дыхания, ЧСС и АД. Пробуждения происходят чаще всего в период максимального гиперпноэ. Дыхание типа Чейн-Стокса в состоянии бодрствования является более значимым фактором риска смерти, чем дыхание типа Чейн-Стокса только во сне.
Дифференциальный диагноз дыхания Чейн-Стокса. ДСЧС может существовать одновременно с ОСА. Характерные клинические признаки сердечной недостаточности или нарушения мозгового кровообращения, а также периоды циклического дыхания по типу «нарастание-убывание» позволяют дифференцировать ДСЧС от ОСА. Метаболические нарушения, например, при почечной недостаточности, могут сопровождаться появлением дыхания Чейн-Стокса. Клинические проявления и анамнез помогают дифференцировать ДСЧС от индуцированного высокогорьем периодического дыхания во сне.
Другие исследования при дыхании Чейн-Стокса. РаС02 артериальной крови, измеренное у бодрствующего пациента в лежачем положении, часто ниже нормы или находится на нижней границе нормы. При исследовании функций легких вентиляционный ответ на С02 повышен. Кроме рентгенографии грудной клетки, ЭКГ и определения сердечных изоферментов, могут быть информативны исследования сердечной функции, т. к. дыхание Чейн-Стокса регистрируется примерно у половины всех больных с сердечной недостаточностью и фракцией выброса левого желудочка ниже 40 %. МРТ коры и ствола головного мозга показана при наличии анамнеза и клинических признаков черепно-мозговой травмы.

Синдром гиповентиляции во сне (СГС).
Наиболее характерным признаком данного синдрома является повышение во сне уровня РаС02 с последующей гипоксемией. Синдром приобретенной гиповентиляции может быть вызван ожирением («пиквикский синдром»), а также заболеваниями, при которых наблюдается поражение легких и дыхательной мускулатуры (хронические обструктивные заболевания легких и нервно-мышечные заболевания с поражением дыхательной мускулатуры). При отсутствии указанных причин предполагают, что эти нарушения обусловлены внутренней дисфункцией дыхательного центра продолговатого мозга, и их относят к синдрому центральной альвеолярной гиповентиляции.
Анамнез. Идиопатическая гиповентиляция появляется в начале периода полового созревания и вызывает инсомнию и сонливость. Другие формы гиповентиляции могут появляться в любом возрасте в связи с повреждением ствола мозга и шейного отдела спинного мозга, поражением клеток передних рогов спинного мозга, при полиомиелите, вегетативных дисфункциях, мышечных дистрофиях и заболеваниях, поражающих грудную клетку и диафрагму. У пациентов могут наблюдаться эритроцитоз, легочное сердце или легочная гипертензия вследствие тяжелой хронической гипоксемии.
Объективное исследование. Определяют индекс массы тела, проводят исследование рото- и носоглотки, выполняют целенаправленный поиск симптомов сердечных и цереброваскулярных заболеваний. Исследуют костно-мышечную систему в поисках кифосколиоза.
ПСГ. Гиповентиляция проявляется продолжительными периодами ограничения дыхательных движений и связанным с этим устойчивым снижением насыщения крови кислородом, что иногда обнаруживается даже при исследовании РаС02 артериальной крови у бодрствующего пациента в лежачем положении. На оксиметрической кривой гиповентиляция определяется в виде удлиненных (более 1 минуты) периодов снижения респираторных усилий, связанных с продолжительным снижением насыщения крови кислородом более чем на 10 %. Эта постепенная десатурация может отображаться независимо либо с наложением классического паттерна ОСА в виде «частокола». Снижение насыщения крови кислородом обычно усугубляется в быстрой фазе сна. Поскольку клинически значимый СГС может развиться в результате всего нескольких удлиненных эпизодов гиповентиляции, рутинное использование индекса дыхательных расстройств (ИДР) приводит к большой недооценке степени тяжести СГС. По этой причине некоторые эксперты рекомендуют ставить диагноз тяжелой формы СГС, когда более половины общего времени сна проходит с насыщением крови кислородом менее 85 %. С помощью ИДР может быть рассчитан также «индекс гиповентиляции», если считать каждое снижение сатурации крови на 3 % в каждом периоде гиповентиляции отдельным эпизодом. Иногда возникают трудности в дифференциации периодов гиповентиляции и центральных апноэ с помощью обычных ПСГ-методик. Все большее распространение в качестве метода диагностики СГС приобретает мониторирование РаС02 в конце выдоха.
Другие исследования. Измерение газов артериальной крови должно выполняться у бодрствующего пациента в лежачем положении. При СГС и заболеваниях с хроническим ограничением потока воздуха РаС02в состоянии бодрствования часто превышает 45 мм рт. ст. Во время сна обычно наблюдается повышение уровня РаС02 более 10 мм рт. ст. В начале заболевания легочные функции могут быть нормальными, за исключением сниженного респираторного ответа на гиперкарбию и гипоксемию. Позднее может наблюдаться хроническое повышение уровня гемоглобина и гематокрита. На рентгенограмме грудной клетки могут обнаруживаться признаки бивентрикулярной сердечной недостаточности. На ЭКГ могут появляться признаки гипертрофии правого желудочка, и давление заклинивания легочных капилляров может быть повышено. Для исключения эндокринных заболеваний, связанных с избыточной массой тела, например, гипотиреоза, необходимо назначить исследование функции щитовидной железы. При наличии клинических показаний, например, для исключения бокового амиотрофического склероза, могут быть полезны МРТ коры и ствола головного мозга или ЭМГ с определением СПНВ.
- Вернуться в оглавление раздела "Неврология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ЦАС, связанное с дыханием Cheyne-Stokes, — это форма периодического дыхания, при котором периоды апноэ и гипопноэ центрального генеза чередуются с периодами гипервентиляции, при этом дыхательный объем то повышается, то понижается. ФР развития ЦАС у пациентов с СН — мужской пол, возраст > 60 лет, наличие ФП и гипокапнии.
Дыхание Cheyne-Stokes возникает у пациентов с СН вследствие усиления хемочувствителыюсти к раздражителям центральных и периферических рецепторов, а также повышенной активности легочных вагусных рецепторов раздражения, стимулируемых застоем крови в легких. Когда пациент с сердечной недостаточностью принимает горизонтальное положение, повышенный отток венозной крови от конечностей способствует централизованному скоплению жидкости с последующим усилением застоя крови в легких.
Это стимулирует вагусные рецепторы раздражения в легких и рефлекторно вызывает гипервентиляцию. ЦАС обычно начинается во сне с усиления вентиляции легких и снижения Расо2, вызванного спонтанным возбуждением ЦНС. При падении Расо2 ниже порогового значения, необходимого для стимуляции дыхания, центральное действие па дыхательные мышцы прекращается, и возникает ЦАС. Апноэ сохраняется до тех пор, пока Расо2 не превысит пороговое значение, необходимое для стимуляции дыхания.
В отличие от ОАС, для прекращения ЦАС возбуждения ЦНС не требуется. Возбуждение ЦНС часто следует за возобновлением дыхания, и, таким образом, периодическое дыхание обеспечивается путем стимулирования гипервентиляции и дальнейшего снижения РаСо2 ниже порога наступления апноэ. Исследования выявили, что продолжительность последующей фазы дыхания при ЦАС обратно пропорциональна СВ и отражает задержку передачи изменений парциального давления газа в артериальной крови от легких к периферическим хеморецепторам.
Соответственно, у пациентов с СН и ЦАС продолжительность фазы вентиляции больше, чем у пациентов с ЦАС и нормальной функцией ЛЖ. Однако следует подчеркнуть, что развитие ЦАС не зависит от увеличения времени кровообращения, скорее, влияние увеличенного времени кровообращения при ЦАС отражено в продолжительности фазы гиперпноэ и всего цикла периодического дыхания. Сразу после возникновения гипервентиляции и апноэ усиливается активация дыхательных хеморецепторов, застой крови в легких, возбуждение ЦНС и вызванная апноэ гипоксия, которая служит причиной колебания Расо2 выше и ниже порога наступления апноэ. Вдыхание смеси, обогащенной СО2 для повышения Расо2, устраняет ЦАС.
Главное клиническое значение ЦАС при CН заключается в его связи с повышенной летальностью. Неясно, является лыхание Cheyne-Stokes с ЦАС признаком выраженного заболевания с плохой функцией АЖ или само ЦАС дополнительно отрицательно влияет на клинический исход. Тем не менее множественные исследования подтвердили, что ЦАС остается независимым ФР летального исхода и необходимости пересадки сердца даже при контроле потенциально отягчающих ФР.
Механизм неблагоприятного клинического исхода у пациента с СН потенциально может быть связан с явной нейрогуморальной активацией (особенно норадреналина). Исследования подтвердили, что дыхание Cheyne-Stokes может исчезнуть при адекватном лечении СН. Однако, если у пациента сохраняется нарушение дыхания во сне (нарушения засыпания или поддержания сна), несмотря на оптимизацию лечения СН, пациенту следует назначить полисомнографию.
В настоящее время не существует единого мнения относительно того, следует ли лечить ЦАС и каким образом. В некоторой степени ЦАС — проявление выраженной СН, поэтому сначала следует оптимизировать медикаментозное лечение, включающее диуретик для снижения давления наполнения сердца, а также ИАПФ, БРА и b-АВ, которые могут облегчить тяжесть ЦАС. Однако в некоторых случаях метаболический алкалоз, возникающий из-за приема диуретика, может предрасполагать к развитию ЦАС, снижая разницу между РаСО2 циркулирующей крови и пороговым значением РаСО2, необходимым для развития апноэ.
Отсутствуют прямые доказательства того, что лечение нарушений дыхания во сне предупреждает развитие СН, но было выяснено, что лечение дисфункции АЖ с помощью приборов СРАР улучшает структуру и функцию ЛЖ у пациентов с ОАС или ЦАС. Несмотря на это, данный вид лечения не продлевал жизнь пациента в ходе исследования CANPAP (Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial).
В ходе этого исследования пациенты с СН и ЦАС были произвольно распределены на две группы: проходящие лечение с прибором СРАР или без него (в среднем в течение 2 лет). Исследование было досрочно остановлено, т.к. показатели смертности и количество пересадок сердца были слишком низкими для того, чтобы зафиксировать разницу на основе ожидаемых показателей, использованных для определения величины выборки исследования. Не было выявлено различий по первичной конечной точке пи в показателях смертности и количестве пересадок сердца (р = 0,54), ни в частоте госпитализаций в обоих группах (0,56 vs 0,61 госпитализаций/нациенто-лет; р = 0,45). Необходимы дополнительные исследования для оценки эффективности этих видов лечения пациентов с СН.
Дыхание Чейна-Стокса при сердечной недостаточности: польза или вред?

Дыхание Чейна-Стокса получило свое название в честь описавших его еще в середине XIX века у пациентов с тяжелой сердечной недостаточностью и инсультом шотландского военного врача Джона Чейна и ирландского врача, профессор Уильяма Стокса.
Выглядит дыхание Чейна-Стокса следующим образом. Редкие поверхностные вдохи и выдохи постепенно становятся более частыми и глубокими. После того, как интенсивность дыхания достигает своего максимума, дыхательные движения вновь начинают ослабевать, иногда вплоть до полного их прекращения и остановки дыхания – эпизода центрального апноэ. Поле чего аномальный дыхательный цикл вновь повторяется.
Физиология этого процесса такова. При снижении легочной вентиляции и последующем апноэ происходит нарастание концентрации углекислого газа в крови, дыхательный центр возбуждается, следствием чего становится возобновление дыхания и период компенсаторной гипервентиляции, ведущий к другой крайности – значительному снижению уровня углекислого газа в крови. Это снова приводит к угнетению дыхания и апноэ.
Длительное время считалось, что дыхание Чейна-Стокса при сердечной недостаточности не просто отражает тяжелое состояние пациента, но и является самостоятельным фактором, повышающим риск смерти. Следовательно, его надо лечить. Наиболее эффективным и технологичным методом лечения дыхания Чейна-Стокса стала адаптивная сервовентиляцтия. Это вариант масочной вспомогательной вентиляции при котором прибор максимально адаптируется к особенностям дыхания пациента: помогает полноценно возмещать нехватку дыхания при гипопноэ и апноэ, но отключается на то время, пока человек сам нормально дышит. Однако при проведении больших исследований был получен неожиданный и парадоксальный результат – адаптивная сервовентиляция у пациентов с хронической сердечной недостаточностью в результате значительного снижения функции левого желудочка сердца вызывает увеличение смертности. В результате споры о роли дыхания Чейна-Стокса и подходах к его лечению разгорелись с новой слой.
«Дыхание Чейна-Стокса: друг или враг?» – публикация с таким названием под авторством М. Нотона стала началом бурной дискуссии, которая ведется до сих пор. Ученый выдвинул идею, что периодическое дыхание Чейна-Стокса у больных с хронической сердечной недостаточностью можно считать компенсаторным механизмом. Однако вскоре Ш. Джавахери были представлены контраргументы, доказывающие, что это серьезная патология, угрожающая пациентам с нарушенной функцией сердечной мышцы.
Аргументы «За»
М. Нотон считает, что феномен Чейна-Стокса проявляет себя при сердечной недостаточности и косвенно указывает на ослабление сердечной мышцы и ее неспособность перекачивать достаточное количество крови.
Ученый доказывает, что уникальный механизм этого дыхательного расстройства позволяет снизить последствия несостоятельности сердца как перекачивающего кровь насоса. Сохранению сердечной функции способствует следующее. Из-за возникающей после эпизода апноэ гипервентиляции увеличивается объем легких, а за счет создавшегося положительного давления усиливается выброс крови из сердца. Одновременно подавляется чрезмерная симпатическая активность нервной системы. Кроме того, приходит в норму кислотно-щелочное состояние крови. Отсутствие дыхательных усилий во время центрального апноэ обеспечивает периодический отдых для дыхательных мышц.
Аргументы «Против»
У оппонентов есть свои «козыри». Они ссылаются на исследования, которые указывают на связь дыхания Чейна-Стокса с различными патологическими последствиями, в том числе с гиперадренергическим состоянием, крайне опасным при больном сердце. И это состояние является обратимым при эффективном лечении центрального апноэ сна. Подавляя дыхание Чейна-Стокса мы в итоге устраняем чрезмерное возбуждение симпатической системы. То же самое происходит при лечении обструктивного апноэ сна посредством СиПАП-терапии.
Гипервентиляция, возникающая после каждого эпизода апноэ, еще больше повышает нагрузку на дыхание. В то же время отмечается усиление колебаний внутригрудного давления, что создает еще большее препятствие для доступа крови к сердцу. Устраняя периодическое дыхание, мы устраняем аномальную гипервентиляцию и увеличиваем эффективность работы диафрагмальных мышц. Все это доказывает, что дыхание Чейна-Стокса является опасным врагом для больных со снижением выброса крови из левого желудочка.
Оба ученых, доказывая свою позицию, приводят немало аргументов, подробно описывают механизмы возникновения прерывистого дыхания и анализируют потенциальные связи этого расстройства с сердечной недостаточностью. Но при этом ни одна из работ пока не может претендовать на окончательную истину, это лишь дискуссия специалистов. Каждая из концепций требует более подробного изучения и проведения дополнительных исследований.
Читайте также:
- Морфология пивного сердца. Патологическая анатомия пивной кардиомиопатии
- Интратрахеальное поступление полония. Накопление радиоактивных веществ в критичных органах
- КТ, МРТ при синоназальном нейроэндокринном раке
- Оптические оксиметры. Устройство пульсового оксиметра
- Признаки сочетания грибка ногтей и псориаза
