Нарушение слуха при синдроме MERRF и MELAS
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Митохондриальная энцефалопатия , лактоацидоз и приступы, подобные инсульту ( MELAS ), являются одним из семейства митохондриальных заболеваний , которые также включают синдром MERRF и наследственную оптическую невропатию Лебера . Впервые он был охарактеризован под этим названием в 1984 году. Особенностью этих заболеваний является то, что они вызваны дефектами митохондриального генома, который наследуется исключительно от женщины-родителя.
СОДЕРЖАНИЕ
Признаки и симптомы
МЕЛАС - это заболевание, которое поражает многие системы организма, особенно мозг, нервную систему (энцефало-) и мышцы (миопатия). В большинстве случаев признаки и симптомы этого расстройства появляются в детстве после периода нормального развития. Дети с MELAS часто имеют нормальное раннее психомоторное развитие до появления симптомов в возрасте от 2 до 10 лет. Хотя это и менее распространено, младенческое начало может проявляться в виде задержки развития, задержки роста и прогрессирующей глухоты. Начало у детей старшего возраста обычно проявляется в виде повторяющихся приступов мигренеподобной головной боли, анорексии, рвоты и судорог. Также часто обнаруживается, что дети с MELAS имеют низкий рост.
У большинства людей с MELAS в организме накапливается молочная кислота , и это состояние называется лактоацидозом . Повышенная кислотность крови может привести к рвоте, болям в животе, сильной усталости (утомляемости), мышечной слабости, потере контроля над кишечником и затрудненному дыханию. Реже люди с MELAS могут испытывать непроизвольные мышечные спазмы (миоклонус), нарушение координации мышц ( атаксия ), потерю слуха, проблемы с сердцем и почками, диабет, эпилепсию и гормональный дисбаланс.
Дифференциальная диагностика
Представление некоторых случаев аналогично синдрому Кирнса – Сейра .
Эпилепсию миоклонуса, связанную с рваными красными волокнами (MERRF), можно спутать с MELAS, поскольку они оба связаны с припадками, психическим ухудшением и миопатией с рваными красными волокнами при биопсии. Пациенты с MERRF также могут иметь потерю слуха, нарушение зрения, вторичное по отношению к атрофии зрительного нерва, и низкий рост. Характерный миоклонический приступ при MERRF может помочь сузить диагноз, но следует рассмотреть возможность генетического тестирования, чтобы различить эти 2 состояния.
Синдром Ли также может проявляться прогрессирующим неврологическим ухудшением, судорогами и рвотой, в основном у маленьких детей.
Генетика
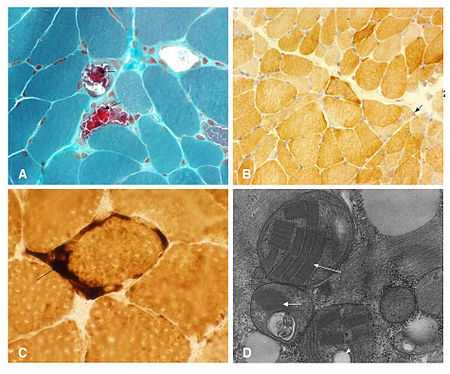
Биопсия мышц человека с диагнозом MELAS, но не имеющего известной мутации. (а) Модифицированное окрашивание трихромом Гомори, показывающее несколько рваных красных волокон (наконечник стрелки). (b) Окрашивание цитохром с оксидазой, показывающее слегка окрашенные волокна типа 1 и волокна типа II, более темные волокна и несколько волокон с аномальными скоплениями митохондрий (стрелка). Обратите внимание на цитохром-с-оксидазонегативные волокна, которые обычно наблюдаются при митохондриальной энцефалопатии, лактоацидозе и приступах, подобных инсульту (MELAS). (c) Окрашивание сукцинатдегидрогеназой, показывающее несколько рваных синих волокон и интенсивное окрашивание митохондрий кровеносных сосудов (стрелка). (d) Электронная микроскопия, показывающая аномальное скопление митохондрий с паракристаллическими включениями (острие стрелки), осмиофильными включениями (острие стрелки) и митохондриальные вакуоли (острие стрелки).
MELAS в основном вызывается мутациями в генах митохондриальной ДНК , но также может быть вызван мутациями в ядерной ДНК.
НАДН-дегидрогеназа
Некоторые из генов ( MT-ND1 , MT-ND5 ), затронутых в MELAS, кодируют белки, которые являются частью NADH-дегидрогеназы (также называемой комплексом I) в митохондриях, что помогает преобразовывать кислород и простые сахара в энергию.
Передача РНК
Другие гены ( MT-TH , MT-TL1 и MT-TV ) кодируют митохондриальные специфические РНК переноса ( тРНК ).
Мутации в MT-TL1 вызывают более 80 процентов всех случаев MELAS. Они нарушают способность митохондрий вырабатывать белки, использовать кислород и производить энергию. Исследователи не определили, как изменения в митохондриальной ДНК приводят к специфическим признакам и симптомам MELAS. Они продолжают исследовать эффекты мутаций митохондриальных генов в различных тканях, особенно в головном мозге.
Наследование
Это состояние наследуется по митохондриальному образцу, который также известен как материнское наследование и гетероплазмия . Этот образец наследования применим к генам, содержащимся в митохондриальной ДНК. Поскольку яйцеклетки, но не сперматозоиды, вносят вклад в митохондрии развивающегося эмбриона, только самки передают своим детям митохондриальные условия. Митохондриальные нарушения могут возникать в каждом поколении семьи и затрагивать как мужчин, так и женщин, но отцы не передают митохондриальные признаки своим детям. В большинстве случаев люди с MELAS наследуют измененный митохондриальный ген от своей матери. Реже заболевание возникает в результате новой мутации в митохондриальном гене и встречается у людей без семейного анамнеза MELAS.
Диагностика
МРТ: Мультифокальные инфаркто-подобные области коры на разных стадиях ишемической эволюции, области, которые не соответствуют какой-либо известной сосудистой территории. Первоначальные поражения часто возникают в затылочных или теменных долях с возможным поражением мозжечка, коры головного мозга, базальных ганглиев и таламуса.
Уровень лактата часто повышен в сыворотке и спинномозговой жидкости. МР-спектроскопия может показать повышенный пик лактата в пораженных и даже непораженных областях мозга. Биопсия мышц показывает рваные красные волокна. Однако сначала следует провести генетическую оценку, что в большинстве случаев устраняет необходимость в биопсии мышц. Диагноз может быть молекулярным или клиническим:
- Инсультоподобные эпизоды до 40 лет
- Энцефалопатия с судорогами или деменцией
- Лактоацидоз крови * или рваные красные волокна при биопсии мышц
Из-за митохондриальной гетероплазмии, анализ мочи и крови предпочтительнее, чем только кровь.
Лечебного лечения нет. Заболевание остается прогрессирующим и приводит к летальному исходу.
Пациентов лечат в зависимости от того, какие участки тела поражены в конкретное время. Были использованы ферменты , аминокислоты , антиоксиданты и витамины .
Также могут помочь следующие добавки:
- CoQ10 был полезен некоторым пациентам с MELAS. Никотинамид был использован, потому что комплекс l принимает электроны от NADH и в конечном итоге передает электроны CoQ10.
- Сообщалось, что рибофлавин улучшает функцию пациента с комплексным дефицитом l и мутацией 3250T-C.
- Введение L-аргинина в острый и межприступный периоды может представлять собой потенциальную новую терапию этого синдрома для уменьшения повреждения мозга из-за нарушения вазодилатации внутримозговых артерий из-за истощения оксида азота .
Эпидемиология
Точная частота возникновения MELAS неизвестна. Это одно из наиболее распространенных состояний в группе митохондриальных заболеваний. В совокупности митохондриальные заболевания встречаются примерно у 1 из 4000 человек.
MELAS-синдром ( Митохондриальная энцефалопатия с лактат-ацидозом и инсультоподобными эпизодами )
MELAS-синдром – это генетическое заболевание с поражением центральной нервной системы, мышечной ткани и различных органов. В основе патологии лежит нарушение тканевого дыхания и дефект энергетического метаболизма. Клиническая картина отличается гетерогенностью, включает острые эпизоды, напоминающие инсульт, эпилептические приступы, непереносимость физических нагрузок вследствие мышечной слабости. Для диагностики применяются МРТ, ЭЭГ, ЭНМГ и другие исследования. Окончательный диагноз устанавливается при обнаружении точечных мутаций в митохондриальной ДНК. Лечение заключается в назначении метаболических препаратов и симптоматической терапии.
МКБ-10
Общие сведения
MELAS-синдром (митохондриальная энцефалопатия с лактат-ацидозом и инсультоподобными эпизодами) относится к болезням, обусловленным генетическим дефектом митохондриальной ДНК. При этом синдроме нарушается энергопродукция в митохондриальной дыхательной цепи. Заболевание впервые было описано в 1984 году. По разным данным, патология встречается с частотой от 1:15 000 до 1:20 000 человек. Гендерные различия отсутствуют. Средний возраст дебюта – 6-10 лет.
Причины
Причиной возникновения патологии являются точечные мутации митохондриальной ДНК. На сегодняшний день известно около 10 генов, при дефекте которых наблюдается манифестация MELAS-синдрома. Наиболее часто выявляются мутации в генах, кодирующих транспортную РНК. Чаще всего (80-90% случаев) обнаруживается мутация A3243G в гене MTTL1 транспортной РНК аминокислоты лейцина.
Из-за дефекта нарушается синтез митохондриальных белков. Наличие мутации необязательно гарантирует фенотипическое проявление заболевания, что связано с феноменом гетероплазмии, то есть, одновременного наличия в клетке, органе или организме нормальной и мутантной митохондриальных ДНК. Большое количество дефектных ДНК повышает вероятность клинической манифестации синдрома.
Патогенез
Генетически детерминированный дефект синтеза митохондриальных белков (ферментов тканевого дыхания) приводит к нарушению процессов окислительного фосфорилирования – последней стадии расщепления биологических субстратов: жирных кислот, углеводов. Окислительное фосфорилирование считается главным звеном энергетического метаболизма, обеспечивает образование подавляющего количества энергоносителей – молекул АТФ.
Сбой этих процессов происходит в каждой митохондрии с дефектной ДНК. Поскольку митохондрии представлены практически во всех клетках организма, поражение носит мультисистемный характер. Сильнее всего страдают органы и ткани с высокой энергетической потребностью: центральная и периферическая нервная система, миокард, скелетные мышцы.
В мышцах энергетический дефицит (тканевая гипоксия) приводит к избыточному образованию молочной кислоты. В генезе острых церебральных нарушений лежит дефицит оксида азота вследствие накопления в гладких мышцах сосудов фермента цитохромоксидазы. При недостаточности оксида азота возникает вазоконстрикция, агрегация тромбоцитов.
Классификация
По выраженности клинических проявлений выделяют 3 формы MELAS-синдрома:
- Бессимптомное носительство – наличие генетической мутации и изменений при биопсии мышц на фоне полного отсутствия клинических признаков заболевания.
- Олигосимптоматическая – обнаруживаются отдельные компоненты синдрома: мышечная слабость, головные боли и пр.
- Манифестная – яркая клиническая картина с острыми эпизодами.
Симптомы
Обычно вначале манифестируют неврологические симптомы, которые возникают уже в 6-15 лет. Наиболее типичными считаются инсультоподобные эпизоды (метаболический инсульт). Частые проявления – гемианопсия (выпадение половины поля зрения), нарушение равновесия, восприятия или воспроизведения речи, изменения сознания.
У половины пациентов отмечаются фокальные или генерализованные тонико-клонические эпилептические припадки, головные боли, напоминающие мигрень (односторонние, пульсирующие). Характерные черты таких приступов – возраст больных менее 40 лет, провоцирование инфекционным заболеванием, быстрый регресс симптоматики и частое рецидивирование.
Реже наблюдаются острые психозы и гемипарезы. Из других неврологических проявлений можно выделить задержку нервно-психического развития, заторможенность, когнитивные нарушения. Вследствие атрофии зрительных нервов постепенно ухудшается зрение. Еще один специфичный признак MELAS-синдрома – выраженная мышечная слабость и плохая переносимость физической нагрузки.
Часто встречаются боли, судороги в мышцах. Мышечные спазмы также могут вызываться снижением концентрации кальция в крови вследствие гипопаратиреоза. У многих пациентов наблюдается постепенное ухудшение слуха (нейросенсорная тугоухость), возникает сахарный диабет. Кардиологические признаки заболевания включают кардиомиопатии, аритмии, хроническую сердечную недостаточность.
Осложнения
MELAS-синдром является тяжелым заболеванием, характеризующимся широким спектром неблагоприятных последствий. Наиболее частые осложнения, приводящие к летальному исходу, связаны с митохондриальной энцефалопатией. К ним относятся повторные «метаболические инсульты» и эпилептические статусы. Небольшая часть пациентов впадает в кому.
У больных повышен риск развития жизнеугрожающих нарушений ритма (желудочковая тахикардия, фибрилляция), остановки сердца. Нейросенсорная тугоухость и атрофия зрительного нерва могут привести к полной потере слуха и зрения. В единичных случаях возникает кишечная непроходимость, хроническая почечная и печеночная недостаточность.
Больных с MELAS-синдромом курируют врачи-неврологи, педиатры. При общем осмотре обращает на себя внимание низкий рост, выраженная гипотония, гипотрофия мышц. Заподозрить заболевание позволяет сочетание миопатии с острыми неврологическими расстройствами у пациента молодого возраста. Дополнительное обследование, направленное на уточнение диагноза, включает:
- Лабораторные исследования. В биохимическом анализе крови определяется высокий уровень молочной кислоты, глюкозы и гликированного гемоглобина, уменьшение концентрации кальция. При анализе крови на гормоны обнаруживают снижение содержания соматотропного и паратиреоидного гормонов. В общем анализе мочи часто выявляется протеинурия.
- МРТ головного мозга. Повреждения мозга визуализируются как очаги неправильной формы с четкими контурами и слабо повышенной интенсивностью МР-сигнала. Отмечаются признаки объемного воздействия на субарахноидальное пространство. Нередко выявляются кальцинаты в базальных ганглиях с преимущественной локализацией в затылочной и теменной областях. При повторном проведении МРТ обнаруживается флюктуация или исчезновение очагов.
- МР-спектроскопия. Магнитно-резонансная спектроскопия головного мозга показывает значительное снижение высокоэнергетических фосфорных соединений и увеличение концентрации лактата.
- ЭЭГ. На электроэнцефалограмме просматривается замедление основной активности, диффузные нарушения биоэлектрических процессов головного мозга, признаки островолновой активности, усиливающейся на фоне гипервентиляции.
- ЭНМГ. Электронейромиография подтверждает наличие неспецифических признаков – сокращение длительности потенциала и амплитуды двигательных единиц, блок и замедление проведения нервного импульса.
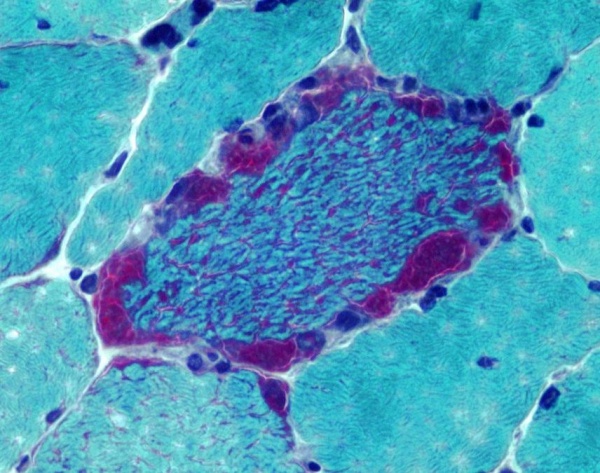
- Биопсия мышц. Наиболее типичные морфологические изменения – феномен «рваных красных волокон» (миофибриллы с большим числом пролиферирующих измененных митохондрий), склероз перимизия, регионарные некрозы. Отмечается положительная гистохимическая окраска на цитохромоксидазу и сукцинатдегидрогеназу.
- Исследование ДНК. Решающий диагностический тест для верификации синдрома MELAS. В лимфоцитах периферической крови чаще других выявляется мутация A3243G гена MTTL1.
Дифференциальный диагноз острых эпизодов проводят с ишемическими инсультами, субарахноидальным кровоизлиянием, острыми инфекционными менингоэнцефалитами. Миопатический синдром следует отличать от наследственных мышечных дистрофий, полимиозита. Патологию также нужно дифференцировать с другими митохондриальными заболеваниями.
Лечение MELAS-синдрома
Радикальное лечение не разработано. Все методы терапии направлены на улучшение состояния пациента и носят лишь паллиативный характер. Необходима диета с ограничением содержания углеводов. Диетическое питание требуется для снижения уровня глюкозы, негативно влияющей на параметры энергетического обмена, и для коррекции сахарного диабета. Применяются следующие медикаменты:
- Метаболические препараты. Для улучшения окислительного фосфорилирования в митохондриях назначается комплексное энерготропное лечение, включающее лекарства, способствующие переносу электронов в дыхательной цепи (коэнзим Q10, янтарная кислота), кофакторы ферментов энергетического обмена (рибофлавин, никотинамид), антиоксиданты (аскорбиновая кислота, токоферол).
- Предшественники и донаторы оксида азота. Во время инсультоподобного эпизода эффективными оказались медикаменты, повышающие уровень оксида азота в крови (L-аргинин, цитруллин), способствующие вазодилатации и улучшению микроциркуляции.
- Препараты для коррекции КЩР. Средства, снижающие уровень лактата в крови (корректоры лактат-ацидоза) используются только в остром периоде у пациентов с очень высоким содержанием в крови молочной кислоты. Их назначение требует большой осторожности из-за способности оказывать токсическое действие на нервную ткань. Возможно внутривенное введение гидрокарбоната натрия.
- Глюкокортикостероиды. Применение гормонов коры надпочечников (преднизолон) приводит к значительному регрессу неврологической симптоматики.
- Средства для коррекции гормональных нарушений. При развитии у сахарного диабета рекомендованы сахароснижающие препараты (метформин, глибенкламид), а при их неэффективности – инсулинотерапия. При возникновении гипопаратиреоза в схему лечения добавляют кальций и витамин Д.
- Противоэпилептические препараты. Широко используемые в эпилептологии производные вальпроевой кислоты строго противопоказаны, поскольку ингибируют энергетический метаболизм. Предпочтение отдается клоназепаму, ламотриджину, топирамату.
В зависимости от клинической картины назначают кардиотропные средства (бета-блокаторы, антиаритмики, ингибиторы АПФ), корректоры печеночной недостаточности (альбумин и медикаменты, подавляющие образование аммиака), сеансы гемодиализа. Следует максимально избегать применения препаратов, угнетающих митохондриальную функцию (барбитураты, хлорамфеникол, статины), поскольку это приводит к ухудшению состояния больного.
Прогноз и профилактика
Синдром MELAS – тяжелое прогрессирующее заболевание с высокой частотой летальных исходов. Продолжительность жизни у людей с бессимптомным носительством и олигосимптоматической формой не отличается от таковой в общей популяции. При манифестной форме, по различным данным, срок жизни составляет от 7 до 40 лет с момента дебюта болезни.
Методы первичной профилактики не разработаны. Поскольку неврологические приступы достаточно часто провоцируются острой инфекцией, для их предотвращения рекомендуется постановка прививок от гриппа и меры общей профилактики, направленные на повышение сопротивляемости организма (регулярные физические нагрузки, закаливание).
1. Митохондриальная энцефалопатия с инсультоподобными эпизодами и лактат-ацидозом (синдром MELAS): критерии диагностики, особенности эпилептических приступов и подходы к лечению на примере клинического случая/ Ямин М.А., Черникова И.В., Арасланова Л.В., Шевкун П.А.// Неврология, нейропсихиатрия, психосоматика – 2017 – №9.
2. Неврологические нарушения при митохондриальной энцефаломиопатии - лактат-ацидозе с инсультоподобными эпизодами (синдроме MELAS)/ Харламов Д.А., Крапивкин А.И., Сухоруков В.С., Куфтина Л.А., Грознова О.С.// Российский вестник перинатологии и педиатрии – 2012 - №4.
3. Инсультоподобное течение митохондриальной энцефаломиопатии (синдром MELAS)/ Смирнова И.Н., Кистенёв Б.А., Кротенкова М.В., Суслина З.А.// Нервные болезни – 2006 - №1.
4. Инсульты при митохондриальных заболеваниях/ Пизова Н.В.// Неврология, нейропсихиатрия, психосоматика – 2017 - №9.
Синдром MERRF ( Миоклонус-эпилепсия с рваными красными волокнами )
Синдром MERRF – это редкое генетическое заболевание, которое вызвано структурными и биохимическими дефектами митохондрий, характеризуется тяжелым поражением центральной нервной системы и мышечной ткани. Клиническая картина может отличаться даже внутри одной семьи. Симптомы включают различные виды эпилептических припадков, нарушение координации, мышечную слабость. Подтверждающими диагностическими методами являются гистологическое исследование мышечного биоптата и ДНК-анализ. Специфического лечения не существует, проводится симптоматическая терапия нейрометаболическими, противосудорожными средствами, препаратами, улучшающими митохондриальную функцию.
Синдром MERRF относится к группе наследственных митохондриальных энцефаломиопатий. MERRF представляет собой аббревиатуру, означающую «миоклонус (М) эпилепсия (Е) с рваными (R) красными (R) волокнами (F)». Заболевание впервые было описано японским неврологом Н. Фукухара в 1980 году. По различным эпидемиологическим данным, распространенность синдрома MERRF составляет от 0,25:100000 до 1,5:100000 населения. Наследование происходит только по материнской линии, при этом оба пола страдают с одинаковой частотой.
Возникновение синдрома MERRF вызвано точечными мутациями митохондриальной ДНК, а именно, изменениями нуклеотидной последовательности. Наиболее частыми считаются замена аденина на гуанин в положении 8344 транспортной РНК лизина или замена тимина на цитозин в положении 8356. Это приводит к нарушению образования митохондриальных белков.
Клиническое развитие синдрома MERRF зависит от количества дефектных ДНК, т.е. чем больше митохондриальных ДНК, имеющих мутацию, тем выше риск заболевания. Также возможно абсолютно бессимптомное носительство мутантных генов. Какие-либо значимые факторы риска, способные спровоцировать манифестацию данной патологии, отсутствуют.
В результате генетической мутации в митохондриях происходит сбой синтеза ферментов дыхательной цепи (цитохромоксидазы, сукцинатдегидрогеназы и др). Нарушаются процессы окислительного фосфорилирования – наиболее важного этапа в энергетическом обмене клеток, который обеспечивает образование основного количества молекул АТФ (универсального источника энергии для клеток).
Данные явления протекают практически во всех клетках организма. Наиболее сильно поражающий эффект сказывается на органах с высокой энергетической потребностью – центральной нервной системе и мышцах. Вследствие тканевой гипоксии в мышцах накапливается избыток молочной кислоты, что приводит к повреждению мышечных волокон.
В современной неврологии четких официальных разделений синдрома MERRF на отдельные формы не принято. В зависимости от количества точечных мутаций и клинических проявлений можно выделить следующие разновидности:
- Бессимптомная – имеется генетическая мутация с возможностью передачи по наследству при полном отсутствии симптомов.
- Латентная – «мягкое течение» без вовлечения нервной системы. Пациентов может беспокоить умеренная мышечная слабость.
- Манифестная – яркая клиническая картина с тяжелым течением и неблагоприятным прогнозом.
Синдром MERRF может дебютировать практически в любом возрасте. Начало в детском возрасте ассоциировано с более неблагоприятным прогнозом. Ранними признаками считаются повышенная мышечная утомляемость, ухудшение переносимости физических нагрузок, ноющие боли в икроножных мышцах. Из-за постепенного прогрессирования миопатии мышечная слабость приобретает более выраженный характер – пациент испытывает трудности при подъеме по лестнице, ходьбе. В тяжелых случаях больной с большим усилием может подняться с постели.
Типичны эпилептические припадки, которые могут быть разнообразными – непроизвольные подергивания мышц лица или рук без потери сознания (миоклонии), пароксизмы по типу кивков головой, генерализованные тонико-клонические припадки с потерей сознания. Миоклонии часто провоцируются резкими звуками или вспышкой света. Нарушается координация, возникает неустойчивость при ходьбе, стоянии.
Существенно страдают когнитивные функции, снижается память, концентрация внимания. Постепенно ухудшается зрение и слух. В ряде случаев наблюдаются периферические невропатии, проявляющиеся онемением, ощущением жжения, покалывания (парестезиями) в конечностях. Очень редко встречаются кожные образования – липомы, гемангиомы, бородавчатые невусы.
Синдром MERRF считается тяжелым заболеванием с большим числом осложнений. Наиболее неблагоприятными из них являются эпилептический статус и отек головного мозга. Вследствие тяжелой миопатии мышц глотки возможно нарушение глотания и попадание пищи в дыхательные пути, что приведет к развитию аспирационной пневмонии. Также из-за слабости дыхательных мышц возникает дыхательная недостаточность.
Атрофия зрительных нервов и пигментная дегенерация сетчатки у части пациентов вызывает полную потерю зрения. При ранней клинической манифестации ребенок значительно отстает в физическом и нервно-психическом развитии. Нарушение равновесия повышает риск падений и переломов. Очень редко наблюдается хронический панкреатит и сахарный диабет.
Пациентов с синдромом MERRF курируют врачи-неврологи. Больные детского возраста находятся под совместным наблюдением детских невропатологов и педиатров. При осмотре обращается внимание на общее снижение мышечного тонуса, ослабление сухожильных и наличие патологических рефлексов (Бабинского, Оппенгейма), невыполнение координационных тестов – позы Ромберга, пяточно-коленной, пальце-носовой проб. Дополнительное обследование включает:
- Лабораторные исследования. В биохимическом анализе крови отмечается увеличение концентрации молочной кислоты. В ликворе выявляется высокое содержание белка.
- ЭЭГ. На электроэнцефалограмме удается обнаружить эпилептиформную активность – генерализованные комплексы спайк-волна, диффузные медленные волны.
- Томография. На МРТ головного мозга видна атрофия коркового и белого вещества больших полушарий и мозжечка, кальцификация базальных ганглиев.
- ЭНМГ. При проведении электронейромиографии отмечается снижение амплитуды и длительности потенциалов двигательных единиц, что свидетельствует о поражении мышечной ткани.
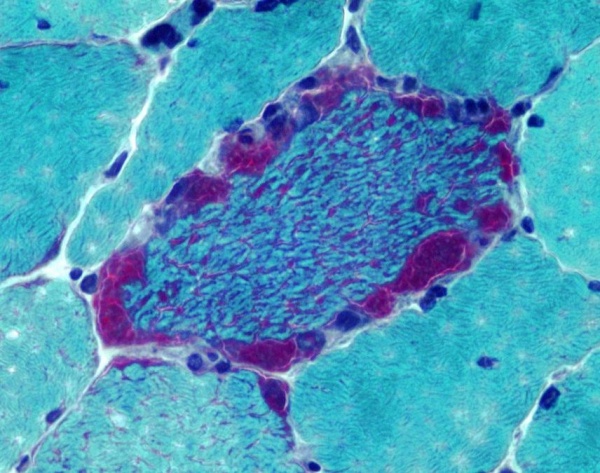
- Гистологическое исследование. Один из главных диагностических тестов синдрома MERRF. В мышечном биоптате выявляются признаки атрофии – уменьшение размеров мышечных волокон, их бледное окрашивание, склероз эндомизия и перимизия. При окраске гистологических срезов по методу Гомори более чем в 5% мышечных волокон обнаруживается наличие «рваных красных волокон».
- ДНК-анализ. Основной метод для верификации диагноза. При молекулярно-генетическом исследовании находят мутации в митохондриальной ДНК – A8344G или Т8356С.

Дифференциальная диагностика
Синдром MERRF следует дифференцировать с другими митохондриальными заболеваниями (MELAS-синдром), а также с наследственными метаболическими расстройствами, поражающими мышечные ткани и нервную систему:
- миоклонус-эпилепсией Унферрихта-Лундборга;
- болезнью Лафоры;
- болезнями накопления (болезнь Гоше, лейкодистрофии, ганглиозидозы).
Лечение синдрома MERRF
На сегодняшний день эффективных способов терапии данной патологии не существует. Все мероприятия носят симптоматический и паллиативный характер, направлены на улучшение состояния пациента. Для замедления атрофических процессов в мышечной ткани обязательны занятия лечебной физкультурой. Регрессу симптоматики способствует диета с ограничением углеводов.
Детям с умственной отсталостью рекомендуются индивидуальные консультации дефектолога, психолога, логопеда. Лекарственная терапия проводится по общим принципам лечения митохондриальных болезней и включает 2 основные группы медикаментов:
- Метаболические препараты. С целью улучшения процессов клеточного дыхания применяется комплекс из энерготропных препаратов («митохондриальный коктейль»), в который входят кофакторы ферментов (витамины группы В), средства, стимулирующие перенос электронов в дыхательной цепи (коэнзим Q10) и антиоксидантов (аскорбиновая кислота, токоферол).
- Антиконвульсанты. Для предупреждения эпилептических припадков назначаются противосудорожные лекарственные средства – клоназепам, ламотриджин, топирамат. Вальпроевая кислота и ее производные строго противопоказаны, так как они угнетают митохондриальную функцию. Их применение приводит к резкому ухудшению состояния больного.
Продолжительность жизни, вероятность летального исхода при синдроме MERRF может сильно варьировать у разных пациентов. При малосимптомном течении (отсутствие поражения нервной системы, умеренная миопатия), систематическом проведении нелекарственного и лекарственного лечения продолжительность жизни может не отличаться от таковой в общей популяции.
При развернутом течении прогноз крайне неблагоприятный. Летальный исход наступает в течение 10-15 лет от начала заболевания. Основными причинами смерти выступают эпилептический статус, аспирация, дыхательная недостаточность. Единственным специфическим методом профилактики является пренатальная диагностика и прерывание беременности.
1. Наследственные болезни нервной системы: Рук. для врачей/ Под ред. Ю.Е. Вельтищева, П.А. Темина. - 1998.
4. Молекулярно генетическая характеристика болезней дыхательной цепи митохондрий у детей: Автореферат диссертации/ Цыганкова П.Г. - 2012.
Митохондриальная миопатия
Митохондриальные миопатии — это группа заболеваний мышц, которые возникают в результате нарушения функции тканевого дыхания при патологиях митохондрий. Болезни проявляются нарастающей мышечной слабостью, атрофией мускулатуры, прогрессирующими двигательными расстройствами, которые могут сопровождаться судорогами, поражениями сердца, ухудшением слуха и зрения. Диагностика предполагает лабораторные (исследование мышечных биоптатов, генетическое тестирование, биохимические анализы), инструментальные методы (ЭМГ, церебральное МР-сканирование). Лечение включает симптоматические препараты, физиотерапию, ЛФК.
Термин «митохондриальная миопатия» объединяет в себе несколько патологий со сходным патогенезом. Наиболее часто дети страдают синдромами MELAS, MERRF, синдромом Кернса-Сайра с хронической прогрессирующей наружной офтальмоплегией. Изучение молекулярно-генетических особенностей этих болезней началось в 1980-х гг. Распространенность патологий у детей составляет около 11,5 случая на 100 тыс. населения. Из-за мультисистемности поражения, клинического полиморфизма, вариабельности течения этот вид миопатии представляет серьезные трудности в диагностике.
Миопатии обусловлены наследственными либо спорадическими мутациями в митохондриальной ДНК или в ядерных генах, контролирующих работу митохондрий. Известно более 300 вариантов генных дефектов — однонуклеотидных замен, делеций, вызывающих нарушения функционирования митохондрий. Митохондриальные миопатии имеют ряд генетических аспектов, выделяющих их среди всех наследственных заболеваний. Принципиальные различия:
- Материнское наследование. Эмбрион получает всю цитоплазму с содержащимися в ней органеллами от матери, поэтому только она может передать ребенку мутантную мтДНК. В то же время, при мутациях ядерной ДНК наследование происходит по аутосомно-рецессивному, аутосомно-доминантному или Х-сцепленному типу.
- Гетероплазмия. При митохондриальной миопатии в клетках мышечной ткани одновременно присутствует мутантный и нормальный генетический материал в разном процентном соотношении, чем объясняется вариабельность клинических проявлений у членов одной семьи при наследственной форме болезни.
- Митотическая сегрегация. При делении клеток, содержащих мутантные митохондриальные гены, мтДНК распределяется между дочерними клетками случайным образом, неравномерно.
Митохондрия — универсальная органелла, присутствующая во всех клетках, кроме эритроцитов. Она имеет дыхательную цепь, которая включает 5 ферментных комплексов из нескольких десятков субъединиц каждый. Ферменты обеспечивают окислительное фосфорилирование для синтеза АТФ — аденозинтрифосфата, выступающего основным источником энергии в организме.
При митохондриальных заболеваниях может быть 4 варианта патогенетических механизмов развития. Как правило, при поражениях мышц наблюдаются дефекты электронного транспорта и окислительного фосфорилирования, что сопровождается нарушениями образования энергетических молекул. Другие варианты расстройств включают нарушения обмена пирувата, дефекты метаболизма жирных кислот, дисфункцию цикла Кребса.
При миопатиях отмечаются полисистемные расстройства. Мышечная и нервная ткань, больше других зависимые от энергопроизводства, страдают в первую очередь. Поражение проявляется нарушениями обмена веществ в мышцах, дегенеративными процессами, атрофией миофибрилл и их замещением соединительной тканью. Со временем патологический процесс распространяется на сердечную мышцу, эндокринную систему, почки и печень, что определяет различные «маски» миопатии.
Симптомы митохондриальной миопатии
Патологии манифестируют у детей раннего возраста, иногда они присутствуют с рождения. Общим признаком является миопатический синдром, который включает прогрессирующую мышечную слабость, снижение тонуса скелетной мускулатуры, непереносимость физических нагрузок. Типично отставание в моторном развитии: дети поздно начинают сидеть, ползать, ходить, у них сохраняется неуклюжесть движений, проблемы с поддержанием равновесия.
Клинические особенности определяются типом заболевания. При синдроме MERRF мышечная слабость сопровождается разнообразными судорожными приступами (атоническими, тонико-клоническими, миоклоническими), расстройствами координации вследствие мозжечковой атаксии. Для синдрома MELAS характерны повторные инсульты, умственная отсталость, нейросенсорная тугоухость.
У детей распространен синдром Кернса-Сайра, при котором клинические признаки дополняются расстройствами глотания, нарушениями работы проводящей системы сердца, снижением слуха. Хроническая прогрессирующая наружная офтальмопатия может возникать как компонент болезни Кернса-Сайра, так и развиваться изолированно, что чаще бывает в старшем возрасте.
Отличительными особенностями миопатического синдрома являются необратимость, неуклонное прогрессирование. Сначала мышечная слабость появляется в проксимальных отделах конечностей, затем поражает все тело ребенка: в процесс вовлекается гладкая мускулатура органов дыхания и пищеварения, что чревато дыхательной недостаточностью, аспирационными пневмониями, тотальным параличом. Такие пациенты теряют способность к самообслуживанию, требуют круглосуточного ухода.
Миопатии осложняются деформациями позвоночника, искривлениями нижних конечностей на фоне слабости мышечного корсета. Вследствие атрофии зрительных нервов у больных с синдромом MERRF возникает слепота. Опасным последствием многих вариантов митохондриальной патологии являются инсульты, эпилептический статус, мозговой отек, которые становятся основными причинами летального исхода.
Первичное обследование детей с подозрением на митохондриальную миопатию проводится у невролога, для уточнения диагноза показана консультация генетика. При осмотре учитывается неврологический статус ребенка, показатели мышечной силы и тонуса, уровень развития когнитивных навыков. Постановка диагноза требует комплексного обследования, включающего следующие методы:
- Электромиография. Исследование демонстрирует уменьшение амплитуды и длительности регистрируемых потенциалов двигательных единиц (ПДЕ), что указывает на разнокалиберность мышечных волокон с их мозаичной атрофией, гипертрофию небольшой части миофибрилл.
- Исследование биоптатов мышц. Патогномоничным признаком митохондриальной миопатии является феномен «рваных красных волокон», который определяется при специальной окраске биоптатов трихромом по Гомори.
- МРТ головного мозга. Нейровизуализация назначается при подозрении на центральный характер мышечных нарушений, для исключения сопутствующих нейродегенеративных поражений ЦНС, которые нередко встречаются при митохондриальных болезнях.
- Цитоморфоденситометрия. Анализ необходим для оценки активности митохондрий в лимфоцитах ребенка, показывает снижение числа органелл при увеличении их объема, уменьшение оптической плотности гранул, нарушения ферментативной активности.
- Генетический анализ. Учитывая разнообразие митохондриальных миопатий, для подтверждения диагноза обязательно выполняется секвенирование митохондриальной ДНК. При исследовании проверяется наличие мутаций, которые чаще всего провоцируют заболевание у детей.
- Биохимические исследования. Заподозрить мышечные поражения, связанные с нарушенным окислительным фосфорилированием, удается по увеличению показателей лактата и пирувата в крови, цереброспинальной жидкости.
Лечение митохондриальных миопатий
В клинической неврологии отсутствуют эффективные методы терапии патологии у детей. Суть медицинской помощи сводится к уменьшению моторного дефицита, своевременной коррекции осложнений, стимуляции обменных процессов в митохондриях. Наибольшую результативность демонстрируют следующие группы медикаментов:
- Аминокислоты. L-аргинин рекомендован неврологами в острой фазе для улучшения кровоснабжения мозга при осложнении миопатии инсультом, в резидуальном периоде болезни для предупреждения повторных приступов ишемии нервной ткани.
- Энерготропные препараты. Чтобы улучшить энергообеспечение тканей ребенка, эффективны препараты с левокарнитином, янтарной кислотой, коэнзимом Q10, широко используется комплекс витаминов группы В, аскорбиновая кислота, альфа-токоферол.
- Антиконвульсанты. При сочетании миопатии с эпилептическими пароксизмами показаны противосудорожные препараты группы сульфат-замещенных моносахаридов, бензодиазепинов, ограничено применяются барбитураты. Вальпроаты для лечения детей с митохондриальными нарушениями не назначаются.
Важным компонентом лечения у детей является нейродиетология, которая предполагает исключение веществ, оказывающих негативное влияние на обменные процессы (терапия «обхождения блока»). Рекомендована кетогенная диета, другие виды высокожировых диет. По показаниям проводится лечебное энтеральное или парентеральное питание, в тяжелых случаях устанавливается гастростома.
Для коррекции моторных нарушений применяется расширенный комплекс физиотерапии: ультразвуковая терапия, электромиостимуляция, электрофорез с ингибиторами ацетилхолинэстеразы. Хороший эффект демонстрирует лечебный массаж, индивидуально подобранный комплекс ЛФК. Чтобы избежать перегрузки ослабленных мышц, широко используются занятия в бассейне. Также требуется ортопедическая коррекция, подбор специальной обуви ребёнку .
Поскольку митохондриальные миопатии пока являются неизлечимыми болезнями, прогноз неблагоприятный. Улучшить качество жизни пациентов удается с помощью комплексной реабилитации, однако при развернутой клинической картине смерть нередко наступает в детском или молодом возрасте. Для профилактики семейным парам с отягощенной наследственностью необходимо медико-генетическое консультирование при планировании беременности.
1. Митохондриальные болезни: миопатии, энцефаломиопатии и энцефаломиелополиневропатии/ В.М. Казаков, А.А. Скоромец, Д.И. Руденко, Т.Р. Стучевская// Неврологический журнал. — 2018. — №6.
3. Влияние дисфункции митохондрий на клинические проявления наследственных миопатий/ Д.А. Харламов, В.С. Сухоруков// Российский вестник перинатологии и педиатрии. — 2013. — №4.
4. Митохондриальные миопатии в сочетании с кардиомиопатией. Новые подходы к лечению/ О.С. Страхова, Ю.М. Белозеров, С.В. Перминов, В.В. Давыдкин// Альманах клинической медицины. — 2001. — №4.
Митохондриальные заболевания
Митохондриальные заболевания (МЗ) — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках.
Историческая справка:
Понятие «митохондриальные болезни» сформировалось в медицине в конце ХХ века. В первую очередь были изучены болезни, связанные с мутациями митохондриальной ДНК, открытой в начале 60-ых годов. Полная первичная структура митохондриальной ДНК человека была опубликована в 1981 го¬ду и уже в конце 80-ых годов была доказана ведущая роль ее мутаций в развитии ряда наследственных заболеваний. К последним относятся: наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонусэпилепсия с "рваными" красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), синдром Кернса-Сейра (пигментный ретинит, наружная офтальмоплегия, блокада сердца, птоз, мозжечковый синдром), синдром Пирсона (поражение костного мозга, панкреатическая и печеночная дисфункции) и многие другие.
В меньшей степени изучены наследственные митохондриальные дефекты, связанные с повреждением ядерного генома.
Патогенез.
Митохондрии отвечают за выработку большей части энергии, необходимой для функционирования клеток. Фактически они являются настолько важным источником энергии, что в каждой клетке их сотни. При МЗ могут «выключиться» как часть митохондрий, так и все они, что приводит к прекращению выработки необходимой энергии
Поскольку наиболее энергоемкими являются нервные и мышечные клетки, при МЗ наиболее распространены мышечные и неврологические проблемы, такие, как мышечная слабость, непереносимость физических нагрузок, потеря слуха, нарушения баланса и координации, эпиприступы.
Митохондриальные зааболевания, вызывающие выраженные мышечные проблемы, именуют митохондриальными миопатиями (myo - означает «мышца», а pathos – «болезнь»), а те, которые вызывают как мышечные, так и неврологические проблемы – митохондриальными энцефаломиопатиями (encephalo – «мозг»)
Когда клетка заполнена дефектными митохондриями, она не только лишена АТФ, но в ней могут накапливаться неиспользуемые молекулы топлива и кислород, что приводит к катастрофическим последствиям. В этом случае избыточные молекулы топлива используются для синтеза АТФ неэффективно, в результате чего могут образовываться потенциально опасные продукты, такие, как молочная кислота (Это также происходит, когда клетки испытывают недостаток кислорода, например – мышечные клетки при усиленных физических нагрузках). Накопление молочной кислоты в крови – лактатацидоз – ассоциировано с мышечной усталостью, и может вызывать повреждение нервной и мышечной тканей.
При этом неиспользуемый в клетке кислород может трансформироваться в разрушительные соединения, именуемые реактивными формами кислорода, включая т. н. свободные радикалы (Они являются мишенью для т. н. антиоксидантных препаратов и витаминов).
Синтезированная в митохондриях АТФ – основной источник энергии для сокращения мышечных и возбуждения нервных клеток (т. к. клетки этих тканей наиболее метаболически активны, энергетически зависимы). Таким образом, нервные и мышечные клетки особенно чувствительны к дефектам митохондрий. Комбинированный эффект от потери энергии и накопления токсинов в этих клетках, надо полагать, и вызывает развитие симптомов митохондриальных миопатий и энцефаломиопатий
Клиника
В случаях, когда человек с мутацией в митохондриальном гене несет смесь нормальной и мутантной ДНК - мутации поначалу могут вообще не иметь внешних проявлений. Нормальные митохондрии до поры до времени обеспечивают клетки энергией, компенсируя недостаточность функции митохондрий с дефектами. На практике это проявляется более или менее длительным бессимптомным периодом при многих митохондриальных заболеваниях. Однако рано или поздно наступает момент, когда дефектные формы накапливаются в количестве, достаточном для проявления патологических признаков. Возраст манифестации заболевания варьирует у разных больных. Раннее начало заболевания приводит к более тяжелому течению и неутешительному прогнозу.
Характерные признаки митохондриальных цитопатий:
•скелетные мышцы: низкая толерантность к физической нагрузке, гипотония, проксимальная миопатия, включающая фациальные и фарингеальные мышцы, офтальмопарез, птоз
•сердце: нарушения сердечного ритма, гипертрофическая миокардиопатия
•центральная нервная система: атрофия зрительного нерва, пигментная ретинопатия, миоклонус, деменция, инсультоподобные эпизоды, расстройства психики
•периферическая нервная система: аксональная нейропатия, нарушения двигательной функции гастроинтестинального тракта
•эндокринная система: диабет, гипопаратиреоидизм, нарушение экзокринной функции панкреас, низкий рост
Таким образом, типичны для митохондриальных заболеваний вовлеченность разных органов и одновременное проявление внешне не связанных между собой аномалий. Примерами служат:
1. Мигрени с мышечной слабостью
2. Наружная офтальмоплегия с нарушением проводимости сердечной мышцы и мозжечковой атаксией
3. Тошнота, рвота с оптической атрофией и кардиомиопатией
4. Низкорослость с миопатией и инсультоподобным и эпизодами
5. Экзокринная дисфункция поджелудочной железы с сидеробластной анемией
6. Энцефало- миопатия с диабетом
7. Диабет с глухотой
8. Глухота с наружной офтальмоплегией, птозом и ретинопатией
9. Задержка развития или потеря навыков и офтальмоплегия, офтальмопарез
Характер и тяжесть клинических проявлений митохондриальных болезней определяется:
• тяжестью мутации мтДНК;
• процентным содержанием мутантной мтДНК в конкретных органах и тканях;
• энергетической потребностью и функциональным резервом органов и тканей, содержащих мтДНК (их “порогом чувствительности” к дефектам окислительного фосфори лирования).
Миопатия
Основные симптомы митохондриальной миопатии – истощение мышц и их слабость, и непереносимость физических нагрузок.
У некоторых индивидов слабость наиболее выражена в мышцах, контролирующих движения глаз и век. Два наиболее частых следствия такой слабости – это постепенный паралич движения глаз (прогрессирующая наружная офтальмоплегия, ПНО), и опущение верхних век (птоз). Зачастую люди автоматически компенсируют ПНО движениями головы для того, чтобы смотреть в различных направлениях, и могут даже не подозревать о каких либо проблемах. Птоз потенциально более неприятен, поскольку может ухудшить зрение, а также придает лицу апатичное выражение, но он может быть скорректирован хирургическим путем, либо использованием специальных очков с устройством для подъема века
Митохондриальные миопатии могут также вызывать слабость других мышц лица и шеи, что приводит к заплетающейся речи и трудностям с глотанием. В этих случаях могут помочь речевая терапия (занятия с логопедом) или включение в рацион питания таких продуктов, которые легче проглатываются.
Непереносимость физических нагрузок, также именуемая усталостью напряжения - это необычное чувство утомления в ответ на физическую активность. Степень этой непереносимости существенно варьируется у разных людей. Некоторые могут испытывать проблемы только при занятиях физкультурой, таких например, как оздоровительный бег, в то время как у других возникают сложности с выполнением повседневных дел, например с выходом к почтовому ящику или поднятием пакета молока.
Энцефаломиопатия
Митохондриальная энцефаломиопатия, как правило, включает некоторые из вышеупомянутых симптомов миопатии, дополненными одним или несколькими неврологическими симптомами. Также как и при миопатии, наблюдается значительная вариабельность симптомов обоего типа и тяжести течения у разных индивидов.
Среди наиболее частых симптомов митохондриальной энцефаломиопатии – нарушения слуха, мигренеподобные головные боли и эпиприступы. По крайней мере, в одном синдроме головные боли и эпиприступы часто сопровождается инсультоподобными эпизодами
Дополнительно к поражению глазных мышц, митохондриальная энцефаломиопатия может поражать как сами глаза, так и участки головного мозга, ответственные за зрение. Например, потеря зрения вследствие оптической атрофии (дегенерации зрительного нерва) или ретинопатии (дегенерации некоторых клеток, выстилающих глазное дно) – обычные симптомы митохондриальной энцефаломиопатии. По сравнению с мышечными проблемами, эти эффекты с большей вероятностью приводят к серьезным нарушениям зрения
Довольно часто митохондриальная энцефаломиопатия вызывает атаксию, или сложности с балансом и координацией.
Диагностика.
Ни один из отличительных симптомов митохондриального заболевания – мышечная слабость, непереносимость нагрузок, ухудшение слуха, атаксия, эпиприступы, неспособность к обучению, катаракта, диабет и низкорослость – не является уникальным именно для такого заболевания. Однако комбинация трех или более из этих симптомов у одного индивида свидетельствует в пользу митохондриального заболевания, особенно если симптомы затрагивают более одной системы организма
Физикальное обследование обычно включает в себя тесты на силу и выносливость, такие например, как повторяющиеся сжатия-разжатия кулака, или подъем и спуск по небольшой лестнице. Неврологическое обследование может включать в себя проверку рефлексов, зрения, речи и базовых когнитивных способностей.
Существует ряд рутинных клинических методов исследования, которые можно использовать при подозрении на митохондриальную цитопатию:
•лактатный ацидоз является практически постоянным спутником митохондриальных болезней (только этот признак является недостаточным для постановки диагноза, так как он может выявляться и при других патологических состояниях; в этом отношении может быть полезным измерение уровня лактата в венозной крови после умеренной физической нагрузки, например на велоэргометре)
•ЭМГ-исследование - само по себе данное исследование также не могут быть маркером митохондриальной цитопатии; вместе с тем нормальная или близкая к нормальной ЭМГ у пациентов с выраженной мышечной слабостью может быть подозрительной в отношении митохондриальной патологии.
•ЭЭГ – данные ЭЭГ не является достаточно специфическими
•биопсия скелетных мышц - является наиболее информативным методом при постановке диагноза митохондриальной цитопатии - помимо обнаружения RRF при трехцветной окраске по Гомори, полезными являются другие гистохимические и иммунологические исследования: окраска на цитохромс-оксидазу и сукцинатдегидрогеназу, иммунногистохимические исследования с применением антител к отдельным субъединицам дыхательного комплекса; мышечная ткань удобна для биохимического исследования респираторной цепочки, а также как материал для генетического исследования.
Образцы мышечных биоптатов целесообразно делить на три части – одна для микроскопического исследования (гистология, гистохимия и электронная микроскопия), вторая для энзимологического и иммунологического анализа (изучение характеристик компонентов дыхательной цепи) и третья – непосредственно для молекулярно-генетического анализа. Поиск известных мутаций на мышечном материале позволяет в большинстве случаев успешно осуществлять ДНК-диагностику болезни. При отсутствии из вестных мутаций мтДНК в мышечной ткани следующим этапом является развернутый молекулярно-генетический анализ – секвенирование всей цепи мтДНК (или кандидатных генов ядерной ДНК) с целью выявления нового варианта мутации.
•электронно-микроскопическое исследование скелетных мышц - дает прекрасные результаты, поэтому данный метод надо использовать, если имеется такая возможность
Лечение.
Что касается терапии митохондриальных цитопатий, то речь может идти пока только о симптоматической.
Лечение митохондриальных болезней проводится обычно по двум основным направлениям:
•повышение эффективности энергетического обмена в тканях (тиамин, рибофлавин, никотинамид, коэнзим Q10 (кудесан), L-карнитин (элькар), препараты кальция и магния. , витамин С, цитохром С)
•предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, a-липоевая кислота) и мембранопротекторов.
В практику входят всё новые препараты комбинированного действия, такие, например, как идебенон (Нобен) – улучшенный структурный аналог коэнзима Q10, благоприятно влияющий на активность дыхательного пути и обладающий выраженным антиоксидантным, антиапоптотическим и нейротрофическим действием.
Очевидно, что расширение терапевтического арсенала при митохондриальных болезнях диктует настоятельную необходимость того, чтобы практические врачи различных специальностей (неврологи, психиатры, педиатры, генетики, гематологи и др. ) были хорошо знакомы с алгоритмом диагностики этих заболеваний.
Читайте также:
