Нарушения обмена глицина
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Нервная система при нарушении обмена аминокислот с разветвленными цепями (АКРЦ)
Болезнь кленового сиропа (БКС), метилмалоновая ацидурия, пропионовая ацидурия, изовалериановая ацидурия и другие вторичные по отношению к метаболизму АКРЦ органические ацидурии в совокупности составляют наиболее часто встречающиеся врожденные дефекты метаболизма аминокислот. Заболевания имеют много общих симптомов и обычно соответствуют одному из трех клинических типов; тяжелой форме у новорожденных, интермиттирующей форме с поздним началом и хронической прогрессирующей форме. Рецидивирующая кома (основное проявление данных заболеваний) связана с непосредственным токсическим воздействием накопившихся метаболитов, в то время как хроническое накопление может препятствовать развитию центральной нервной системы или метаболизму головного мозга, приводя к задержке развития (Morton et al., 2002; Deodato et al., 2006; Vockley и Ensenauer, 2006).
а) Биохимические и генетические изменения. Эти заболевания являются результатом дефекта ферментов, участвующих в метаболизме лейцина, валина и изолейцина. Три нейтральных АКРЦ изначально метаболизируются обычным путем: вслед за транасаминированием происходит тиамин-зависимое декарбоксилирование, дефицит которого отмечается при БКС (этап 1). Дефект декарбоксилирования является причиной накопления АКРЦ и соответствующих кетокислот. В дальнейшем пути катаболизма АКРЦ расходятся. Лейцин метаболизируется до ацетоацетата и ацетил-кофермента А. Специфическая ферментная недостаточность возможна на каждом этапе. Дефицит изовалерил-кофермент А дегидрогеназы является причиной изовалериановой ацидурии (этап 2), изовалерат является высокотоксичным веществом.
Дефицит 3-метилкротонил-кофермент А карбоксилазы, биотин-зависимого фермента, (этап 3) приводит к 3-метил-кротонил-глицинурии в результате мутации декарбоксилазы апофермента или аномального метаболизма биотина. 3-метилглутаконовая ацидурия I типа (этап 4) является другим редким заболеванием, вызванным дефектом катаболизма лейцина (Ly et al., 2003). Катаболизм валина и изолейцина протекает с образованием пропионил-кофермента А и матилмалонил-кофермента А. Метионин и треонин, жирные кислоты с нечетным количеством углеродных остатков и боковая цепью холестеринового радикала, являются другими предшественниками пропионил-кофермента А. Пропионил-кофермент А образует метилмалонил-кофермент А с участием биотин-зависимой декарбоксилазы (этап 5), дефицит которой вызван мутацией декарбоксилазы апофермента (пропионовая ацидурия) или аномальным метаболизмом биотина. Метилмалонил-кофермент А в два последовательных этапа под действием метил-кофермент А эпимеразы (Dobson et al., 2006), а затем под действием В12-зависимой метилмалонил-кофермент А мутазы (этап 6) превращается в сукцинил-кофермент А.
Дефицит активности каждого фермента приводит к метилмалоновой ацидурии. Аномальный метаболизм витамина В12 является причиной различных форм метилмалоновой ацидурии. До соединения пропионил-кофермента А описаны дефекты каждого этапа катаболизма изолейцина и валина, приводящие к ряду метаболических нарушений (Nguyen et al., 2002; Matern et al., 2003; Poll-The et al. 2004b; Salomons et al., 2007). Многие накапливаемые интрамитохондриальные метаболиты кофермента А являются субстратами эстерификации карнитина, процесса, который приводит к накоплению специфических ацилкарнитинов, выявляемых в цельной крови с помощью двойной масс-спектрометрии. Следовательно, большинство описанных заболеваний поддаются массовому неонатальному скринингу (Tarini, 2007).
Почти все заболевания данной группы наследуются аутосомно-рецессивным путем; дефицит 2-ме-тил-3-гидроксибутирил кофермент А дегидрогеназы является сцепленным с Х-хромосомой заболеванием. Антенатальная диагностика может проводиться путем оценки метаболитов в амниотической жидкости, определения активности специфических ферментов в образцах ворсин хориона и амниотических клетках и/или выявления патогенетических мутаций. По результатам программ скрининга новорожденных в сочетании с исследованиями мутаций было выявлено, что у ряда участвовавших в скрининге пациентов с изовалерьяновой ацидурией или 3-метилкротонглицинурией выявлялся слабо выраженный или даже бессимптомный фенотип.
б) Нейропатология. Имеющиеся результаты патологоанатомических исследований свидетельствуют об атрофии и различных гистологических изменениях мозга. Губчатая дегенерация белого вещества является неспецифическим повреждением, выявляемым у новорожденных. Часто описываемая у пациентов с метилмалоновой или пропионовой ацидурией дегенерация базальных ганглиев является заметным признаком среди детей старшего возраста с некрозом бледного шара, губчатыми и кистозными полостями. Серое вещество головного мозга и мозжечка и зубчатое ядро могут быть повреждены за счет диффузной вакуолизации вокруг нейронов и внутри нейтрофилов (Feliz et al., 2003). Субкортикальный отек головного мозга во время острой метаболической декомпенсации часто является причиной смерти у пациентов с БКС. Описано небольшое количество случаев кровоизлияний в мозжечок.
Патогенез поражения мозга при нарушениях обмена АКРЦ изучен плохо. В острой стадии заболевания накопление токсических метаболитов может быть причиной депривации энергии в связи с ингибированием определенных ферментов, участвующих в окислении пирувата в цикле Кребса или в митохондриальной дыхательной цепи. Восприимчивость базальных ганглиев к депривации энергии может объяснять их частичное поражение при таких заболеваниях, в особенности при метилмалоновой и пропионовой ацидуриях. При БКС высокий уровень лейцина может привести к дефекту синтеза катехоламина, вторичного по отношению к дефекту захвата головным мозгом нейтральных аминокислот и триптофана. Таким же образом взаимодействие метилмалоновой кислоты с сукцинатом может приводить к снижению синтеза гамма-аминомасляной кислоты (ГАМК). Необратимые изменения могут быть результатом взаимодействия с синтезом миелина вследствие дефекта транспорта всех нейтральных аминокислот (Schwab et al., 2006). Кроме того, накопленные пропионил-кофермент А и метилмалонил-кофермент А являются предшественниками синтеза жирных кислот с нечетным количеством углеродных остатков и длинноцепочечными жирными кислотами с метиловым радикалом. Их объединение в липидные слои может быть причиной аномального синтеза липидной мембраны в центральной нервной системе.
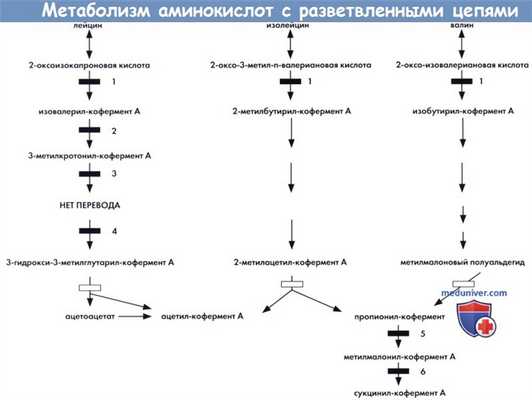
Метаболизм аминокислот с разветвленными цепями, свидетельствующий о происхождении некоторых известных наследственных метаболических нарушений.
1 — декарбоксилаза АКРЦ (болезнь кленового сиропа).
2 — изовалерил-кофермент А дегидрогеназа (изовалериановая ацидурия).
3 - 3-метилкротонил-кофермент А карбоксилаза β-метилкротонилглицинурия).
4 - 3-метилглутаконил-кофермент А гидратаза β-метилглутаконовая ацидурия I типа).
5 — пропионил-кофермент А карбоксилаза (пропионовая ацидурия).
6 — метилмалонил-кофермент А мутаза (метилмалоновая ацидурия).
в) Клинические проявления:
1. Тяжелые формы заболевания у новорожденных. Типичная клиническая картина представлена неуклонной деградацией без явных причин у новорожденных младенцев после бессимптомного периода, продолжающегося несколько дней. Первыми признаками является плохое сосание и трудности при кормлении с последующим развитием необъяснимой и прогрессирующей комы. В коматозном состоянии у большинства пациентов отмечается аксиальная гипотония с периферической дистонией, хореоатетозы, эпизоды опистотонуса и «боксирующих» и «велосипедных» движений конечностей. Судороги могут развиваться на более поздних стадиях заболевания. У больных детей может развиваться отек мозга с выбуханием родничка, что вызывает подозрения в наличии инфекции центральной нервной системы. На ЭЭГ часто отмечается паттерн вспышкаподавление. Биохимические аномалии включают метаболический ацидоз и кетонурию в сочетании с гипераммониемией и гиперлактацидемией. Общий краткосрочный прогноз улучшается. В дальнейшем, несмотря на лечение, часто возникают интеркуррентные эпизоды с клиническими проявлениями, сходными с проявлениями поздних интермиттирующих форм.
2. Интермиттирующие формы заболевания с поздним началом. Приблизительно у трети пациентов нарушения обмена АКДЦ отмечаются в детском и даже в подростковом или взрослом возрасте. Повторяющиеся приступы развиваются часто, хотя в промежутках пациент может казаться практически здоровым. Начало заболевания в большинстве случаев провоцируется состояниями, усиливающими белковый катаболизм (инфекцией, травмой и т.д.), или усиленным потреблением белка, но могут развиваться без явной причины. Рецидивирующие эпизоды комы или летаргии с атаксией являются основными проявлениями. Чаще всего кома не сопровождается другими аномальными неврологическими признаками. Кетоацидоз и различные аномалии уровня глюкозы в крови свидетельствуют о метаболическом характере заболевания. Тем не менее, у небольшого количества пациентов заболевание может проявляться гемиплегией и гемианопсией или признаками и симптомами отека мозга, имитирующими цереброваскулярные события или опухоли центральной нервной системы.
Часто отмечаются аномалии ЭЭГ: медленные дельтаволны, утрата нормального альфа-ритма, легкие неспецифические нарушения ритма или крупные аберрантные паттерны. Очаговая активность (при наличии) обычно локализуется в височной области.
У возрастающего количества пациентов с органическими ацидуриями и, в особенности, метилмалоновой и пропионовой ацидуриями отмечается острый прогрессирующий экстрапирамидный синдром вследствие двустороннего некроза базальных ганглиев. Чаще всего данные повреждения встречаются в бледном шаре, но могут поражать другие базальные ганглии (Chemelli et al., 2000).
3. Хронические прогрессирующие формы. Гипотония, мышечная слабость, неспецифическая задержка развития и припадки в редких случаях являются единственными проявлениями изовалериановой, метилмалоновой или пропионовой ацидурии. Чаще всего данные изменения сочетаются с симптомами со стороны пищеварения и питания и плохой прибавкой веса. С другой стороны, данные хронические неврологические формы могут быть проявлением 3-метилкротонглицинурии, которая характеризуется неподдающимися лечению припадками, гипотонией, микроцефалией и задержкой развития (при рано начинающихся формах) или метаболической лейкодистрофией с эпизодами, подобными болезни Рея (у детей старшего возраста). Кроме того, многие бессимптомные случаи были выявлены с помощью скрининга методом тандемной масс-спектрометрии среди новорожденных. 3-метилглутаконовая ацидурия I типа может проявляться легкими неврологическими нарушениями (Nguyen et al., 2002). Малоновая ацидурия может проявляться изолированной задержкой развития или задержкой развития в сочетании с припадками, мышечной слабостью и кардиомиопатией (Salomons et al., 2007). Описаны редкие случаи 2-метилбутирилглицинурии и изобутирилглицинурии, проявлявшиеся мышечной слабостью и некоторой задержкой умственного развития.
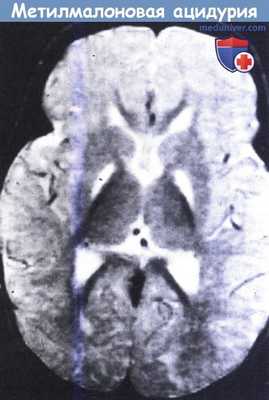
Метилмалоновая ацидурия.
На МРТ в Т2-режиме видны симметричные участки усиления сигнала в области бледного шара у восьмимесячного ребенка.
Также отмечаются признаки отсроченной миелинизации.
г) Биохимическая диагностика. Диагностика основана на выявлении аномальных промежуточных субстратов и сопутствующих веществ, образующихся в результате метаболического блока. У пациентов с БКС хроматография аминокислот характеризуется высоким уровнем лейцина, валина и изолейцина в плазме и моче, а также наличием аллоизолейцина. С другой стороны, все остальные блоки ферментов приводят к накоплению в плазме и экскреции с мочой органических кислот и диагностируются с помощью газожидкостной хроматографии и масс-спектрометрии, в то время как аминокислотная хроматография не позволяет поставить диагноз. Тандемная масс-спектрометрия позволяет диагностировать данные нарушения за счет выявления аномальных параметров ацилкарнитина, формирующихся в результате накопления специфических ацилкарнитинов. Для окончательной диагностики требуется оценка специфической ферментной активности в фибробластах или лейкоцитах и/или идентификация патогенной мутации в пораженных генах.
д) Лечение. Целью лечения является снижение количества токсических метаболитов (Ogier de Baulny et al., 2005). В периоде новорожденности в случае наиболее остро протекающего заболевания детям требуется активное питание, часто в сочетании с экзогенной детоксикацией. Долгосрочная диетотерапия предполагает ограничение потребления белка при сбалансированной по остальным компонентам диете. В связи с тем, что некоторые витамины являются кофакторами специфических ферментных превращений, очень большие дозы данных витаминов должны систематически тестироваться в каждом случае. Данное терапевтическое тестирование позволяет выявить пациентов, реагирующих на применение витаминов, у которых заболевание выражено в меньшей степени и необходима менее строгая диета. При лечении органических ацидурий систематически применяется поддерживающая терапия L-карнитином. При изовалериановой ацидурии и 3-метилкротонилглицинурии применение L-глицина и L-карнитина увеличивает экскрецию метаболитов с мочой и является эффективным средством детоксикации.
Несмотря на раннюю диагностику и лечение, в любом возрасте у таких детей сохраняется риск развития угрожающего жизни метаболического дисбаланса и неврологических последствий. Кроме того, у многих пациентов с метилмалоновой и пропионовой ацидурией отмечается прогрессирующая неврологическая дисфункция с нарушением интеллекта, атаксией, мышечной слабостью и недостаточностью питания. Другие осложнения затрагивают почки, поджелудочную железу и сердце. Учитывая данные долгосрочные осложнения, проводится трансплантация печени и почек. Трансплантация не способна предотвратить острую неврологическую деградацию и некроз базальных ганглиев (Leonard et al., 2001; Chakrapani et al., 2002).
Нарушения обмена глицина
Некетотическая гиперглицинемия - наследственное заболевание, связанное с дефицитом ферментной системы, осуществляющей трансформацию глицина в серин, и проявляющееся высоким уровнем глицина в биологических жидкостях при отсутствии кетоза.
Эпидемиология
Некетотическая гиперглицинемия описана J. Balfe и соавт. и T. Gerritsen и соавт. в 1965 г. Частота составляет 1 на 55 000 новорождённых.
Классификация
Известно три генетически гетерогенных типа некетотической гиперглицинемии: обусловленные дефектом P-протеина (большинство случаев), T-протеина и H-протеина. В зависимости от сроков манифестации и степени тяжести выделяют классическую неонатальную, атипичную позднюю (ювенильную) и транзиторную неонатальную формы болезни.
Некетотическая гиперглицинемия связана с генетически детерминированным дефектом ферментной системы. осуществляющей трансформацию глицина в серин. Указанная система включает четыре белковых компонента: P-протеин (локализация гена GLDC ― 16q24), T-протеин (локализация гена GCST ― 9p22), H-протеин (локализация гена GCSH ― 3p21.2-p21.1) и L-протеин (локализация гена не установлена). Тип наследования ― аутосомно-рецессивный.
Дефект ферментной системы, катализирующей перевод глицина в серин, ведёт к накоплению глицина в клетках головного мозга. Эта аминокислота ― один из нейромедиаторов центральной нервной системы, оказывающий ингибирующее действие на синапсы, а также модулирующее влияние на специфические рецепторы мозговой ткани.
Неонатальная форма характеризуется острой манифестацией в первые дни жизни ребёнка и высокой летальностью. Основные признаки: вялость, мышечная гипотония, сниженная двигательная активность, выраженная сонливость, слабый крик, нарушение сосания, отказ от еды, миоклонические судорожные приступы. Состояние детей прогрессивно ухудшается, сонливость сменяется летаргией, появляются респираторные нарушения с периодическими апноэ. Сухожильные и периостальные рефлексы резко снижены, угасают безусловные рефлексы, развивается опистотонус. В ряде случаев описаны гидроцефалия, лёгочная гипертензия.
При более редко встречающейся ювенильной форме первые признаки болезни отмечают приблизительно в возрасте 1 года: задержка статикомоторного развития, мышечная гипотония, которая может смениться дистонией, спастической диплегией. В более позднем возрасте диагностируют умеренную умственную отсталость, неловкость движений, аутизм, эхолалию, нарушения поведения с приступами агрессии.
У небольшой части детей заболевание протекает в форме транзиторной неонатальной гиперглицинемии. У этих пациентов рано (с первых дней жизни) появившиеся типичные клинические и лабораторные признаки неонатальной некетотической гиперглицинемии быстро купируются к возрасту 2-8 нед. Дальнейшее развитие детей протекает благоприятно, какие-либо клинические симптомы поражения ЦНС отсутствуют, содержание глицина в крови и ликворе остаётся на нормальном уровне. На основании клинической симптоматики, выраженности обменных нарушений не представляется возможным отличить транзиторную гиперглицинемию от классической неонатальной. Имеются сведения, что дети с транзиторной формой болезни являются не гомозиготными, а гетерозиготными носителями мутантных аллелей генов GLDC или GCSH.
Лабораторная диагностика
Типичные обменные нарушения: повышение уровня глицина в крови (в 10-20 раз), моче и ликворе (в 10-30 раз) при отсутствии ацидоза, кетоза, органической ацидурии. Диагностическое значение имеет отношение содержания глицина в спинномозговой жидкости к его содержанию в плазме крови, превышающее 0,06.
Инструментальные методы
На ЭЭГ определяются характерные изменения типа "вспышка-супрессия". КТ головного мозга выявляет агенезию мозолистого тела, пахигирию, зоны пониженной плотности в веществе мозга.
Дифференциальную диагностику следует проводить с органическими ацидемиями, аминоацидопатиями, митохондриальными заболеваниями, перинатальным гипоксически-ишемическим поражением ЦНС.
Немедикаментозное лечение
Изолированная диетотерапия с низким содержанием белка, серина и глицина малоэффективна.
Медикаментозное лечение
Комплекс лечения детей включает назначение аргинина (250 мг/кг в сутки), бензоата натрия (300-500 мг/кг в сутки), обладающего способностью связывать глицин с образованием гиппуровой кислоты. Кроме того, применяют нитрат стрихнина в дозе 0,25-0,3 мг/кг в сутки, оказывающий стимулирующее влияние на центральную нервную систему и нивелирующий угнетающее действие глицина. В комбинации с этим препаратом используют кетамин или декстрометорфан в дозе 5-10 мг/кг в сутки (новорождённым и детям грудного возраста) с целью блокирования глутамат-рецепторов головного мозга. Дополнительно назначают препараты магния, пиридоксин (50 мг/сут) и 5-формилтетрагидрофолат (10 мг/сут).
Показания к консультации специалистов
Больных должны наблюдать педиатр, генетик, невропатолог.
Комплексное лечение способствует выведению детей из критического состояния и снижает уровень летальности. Однако у больных нередко отмечают задержку психоречевого развития, нарушения поведения.
Профилактика заболевания в семьях повышенного риска не разработана. Определение активности глицин-расщепляющей ферментной системы и молекулярно-генетическое исследование ткани хориона демонстрирует большое количество ложноотрицательных результатов.
Cаркозинемия
Определение и общие сведения
саркозинемия - нарушение обмена веществ, характеризуется повышенной концентрацией саркозина в плазме и моче вследствие дефицита саркозиновой дегидрогеназы.
Показатель распространенности оценивается от 1: 28000 до 1: 350000 новорожденных.
Клинические проявления
Саркозинемия - доброкачественное состояние без существенных клинических проблем.
Мутации в гене саркозиновой дегидрогеназы, расположенной в хромосоме 9q34.
Генетическая консультация
Передается по аутосомно-рецессивному типу.
Триметиламинурия
Синонимы: синдром рыбного запаха
Триметиламинурия является метаболическим заболеванием, которое характеризуется нарушением катаболизма триметиламина. Триметиламин вырабатывается в кишечнике при переваривании некоторых видов пищи (яйца, печень, бобовые, рыба и некоторые овощи) и имеет характерный рыбный запах. При его выделении с потом, мочей, с репродуктивными жидкостями и при дыхании, - пациенты “пахнут рыбой”, что приводит к определенным социальным и психологическим проблемам.
Триметиламинурия чаще встречается у женщин и наследуется по аутосомно-рецессивному типу.
Этиология и патогенез
Триметиламинурия возникает в результате мутаций в гене FMO3.
Триметиламинурия характеризуется прежде всего рыбным запахом тела пациента различной степени интенсивности, запах может усиливаться перед и во время менструации у женщин, при повышенной потливости, стрессе и пр.
Пациенты, как правило, не имеют каких-либо дополнительных симптомов и в остальном здоровы.
Диагностика
Диагноз клинический, анализ мочи (высокий уровень триметиламина в моче) и генетическое тестирование подтверждают диагноз. Пренатальная диагностика возможна.
Несмотря на отсутствие лечения, триметиламинурия часто купируется за счет уменьшения поступления триметиламина с пищей с помощью ограничивающей диеты. Продукты, которые содержат триметиламин и его предшественники (холин, лецитин, и триметиламиноксид), - коровье молоко (при высокой доле пшеницы в кормах), яйца, печень, почки, горох, бобы, арахис, соевые продукты, брюссельская капуста, брокколи, капуста и цветная капуста., некоторые морепродукты.
Возможно таже назначение антибиотиков в низких дозах, слабительных, активированный уголь, рибофлавина (витамин В2). Мыло с умеренным рН (между 5,5 и 6,5), может способствовать удалению триметиламина с поверхности кожи.
Долгосрочный прогноз хороший. Пациенты имеют нормальную продолжительность жизни и помимо рыбного запаха не имеют других проблем со здоровьем.
Гиперпролинемия 2 типа
Синонимы: дефицит дельта-1-пирролин-5-карбоксилатдегидрогеназы
Гиперпролинемия 2 типа является аутосомно-рецессивным расстройством метаболизма пролина из-за дефицита пиролин-5-карбоксилатдегидрогеназы. Состояние часто доброкачественное, но клинические признаки могут включать в себя судороги, интеллектуальный дефицит и легкую задержку развития.
Гиперпролинемия 1 типа
Синонимы: дефицит пролиноксидазы
Гиперпролинемия 1 типа является врожденным нарушением метаболизма пролина, характеризующееся повышенным уровнем пролина в плазме и моче.
Распространенность неизвестна. Гиперпролинемия 1 типа передается как аутосомно-рецессивный признак и вызвана мутациями в гене пролиндегидрогеназы или пролин-оксидазы (PRODH или POX, 22q11.2).
Заболевание считается доброкачественным, но сообщалось о случаях с сопутствующими аномалиями почек, эпилептическими припадками и другими неврологическими проявлениями, а также с некоторыми формами шизофрении.
Дефицит диметилглициндегидрогеназы
Дефицит диметилглициндегидрогеназы является чрезвычайно редким расстройством метаболизма глицина, которое характеризуется клинически мышечной утомляемостью и рыбным запахом.
Дефицит диметилглициндегидрогеназы наследуется аутосомно-рецессивным способом. На сегодняшний день описан единственный случай заболевания.
Публикации в СМИ
Глицинемия — наследственная болезнь ( r ), обусловленная нарушением обмена аминокислот и сопровождающаяся повышенным содержанием глицина в крови и моче, кетоацидозом. Известно более десяти вариантов болезни: • изолированная некетотическая I, 238300, GLDC (Р белок системы катаболизма глицина), 9p24 9p23; • изолированная некетотическая II: 238310, AMT (H белок системы катаболизма глицина, аминометилтрансферазы), 3p21.3 3p21.2; • кетотическая I: 232000, PCCA (недостаточность пропионил КоА карбоксилазы), 13q32; • кетотическая II: 232050, PCCB (недостаточность пропионил КоА карбоксилазы), 3q21 q22. Мультиферментная система катаболизма глицина (КФ 2.1.2.10) содержит не менее четырёх белков (P, H, T и L). Основная масса больных с глицинемией имеет дефект P-белка (пиридоксальфосфатзависимая глицин декарбоксилаза).
Клиническая картина зависит от наличия или отсутствия кетоза.
• Общие признаки •• Агенезия мозолистого тела •• Адинамия •• Приступы икоты •• Мышечная гипотония •• Периодические миоклонусы •• Умственная отсталость •• Слабый крик •• Смерть в раннем детстве.
• При кетоацидотических формах — рвота, кетоз, гипераммониемия, тромбоцитопения, нейтропения.
• При недостаточности пропионил-КоА карбоксилазы (также кетотическая форма) — необычное лицо с пухлыми щеками и контуром верхней губы в виде «лука Амура». Лабораторно: гиперглицинемия, гиперглицинурия, снижение экскреции оксалатов с мочой.
Лабораторные исследования. Повышенное содержание глицина в крови и моче, одновременно увеличивается содержание в плазме лейцина, изолейцина и валина.
Лечение. Немедленное и резкое уменьшение белка, получаемого с пищей (полностью исключают кетогенные аминокислоты — лейцин, изолейцин, валин, треонин и метионин) •Регидратация с увеличением количества электролитов и бикарбонатов
Синонимы • Болезнь гликоколовая • Гиперглицинемия • Глициноз.
МКБ-10 • E72.5 Нарушения обмена глицина
Код вставки на сайт
Глицинемия
Нервная система при некетотической гиперглицинемии (НКГ, глициновая энцефалопатия)
Некетотическая гиперглицинемия (НКГ) или глициновая энцефалопатия является врожденным дефектом катаболизма аминокислот, при котором в жидкостях организма накапливается большое количество глицина. Классический фенотип проявляется угрожающим жизни заболеванием, развивающимся в период новорожденности, при котором большинство пациентов умирают. У выживших отмечается тяжелая задержка умственного развития и обычно припадки.
Атипичные варианты с различным возрастом начала и вариабельными клиническими проявлениями характеризуются более благоприятным прогнозом. В редких случаях встречается транзиторная форма заболевания у новорожденных, характеризующаяся нормализацией биологических показателей (Applegarth и Тоопе, 2001; Hoover-Fong et al., 2004; Pearl et al., 2005).
а) Биохимические изменения. Глицин принимает участие во множестве биохимических реакций, среди которых наиболее важной для гомеостаза глицина является конверсия глицина-серина. Данная реакция затрагивает два обратимых ферментных этапа, один из которых поддерживается гидрометилтрансферазой серина, а другой — системой распада глицина. Последний этап, обеспечивающий катаболизм, поврежден при НКГ.
Серин + Тетрагидрофолат = Глицин + метилентетрагидрофолат;
Глицин + Тетрагидрофолат + Н2O = метилентетрагидрофолат + С2O + NH3.
Система распада глицина находится в почках и головном мозге и включает четыре белковых компонента, называемых Р (пиридоксаль-фосфат-зависимая декарбоксилаза, ПФДК), Т (нуждающаяся в тетрагидрофолате аминометилтрансфераза, АМТ), Н (белок-переносчик водорода в системе распада глицина, ВСРГ) и L (липоамид дегидрогеназа). У большинства (75-80%) пациентов с НКГ отмечается дефект Р-белка, у оставшихся чаще всего встречается дефект Т-белка, дефицит Н-белка отмечается редко. L-белок не изменяется при данном заболевании (Applegarth и Тоопе, 2001, 2004).
б) Генетические изменения. Независимо от того, какой белок поврежден, НКГ является наследственным аутосомным рецессивным заболеванием. Клонировано три гена GLDC, АМТ и GCSH и выявлены различные мутации. За исключением трех часто встречающихся среди финнов мутаций гена GLDC, большинство неродственных пациентов гетерозиготны и большая часть мутаций обнаруживается в единичных случаях. Антенатальная диагностика может проводиться путем непосредственного ферментного исследования свежих ворсин хориона.
в) Нейропатологические изменения. Наиболее заметным проявлением является отсутствие миелинизации, часто сочетающееся с аномальной морфологией головного мозга. В 10 из 16 случаев при исследовании головного мозга (Dobyns, 1989) было выявлено аномальное формирование извилин, гипоплазия, агенез мозолистого тела, кольпоцефалия или гипоплазия мозжечка. Отмечается выраженная губчатая лейкодистрофия. Описанные признаки сходны с мальфомациями головного мозга, отмечаемыми при оценке трансгенной модели НКГ у мышей (Applegarth и Тоопе, 2001).
г) Патогенез. Несмотря на то, что механизм, лежащий в основе неврологической дисфункции, не до конца изучен, глицин сам по себе играет важную роль в патогенезе. Глицин является ингибирующим нейротрансмиттером с рецепторами преимущественно в спинном мозге и стволе мозга. Специфическим антагонистом данного типа рецепторов глицина является стрихнин, а конкурентным ингибитором—бензиодиазепины. Данная ингибирующая нейротрансмиссия может объяснять гипотонию и апноэ.
Другой стрихнин-нечувствительный участок, связанный с NMDA-рецептором играет основную роль в возбуждающей передаче в коре и среднем мозге. Опосредуемое NMDA нейротоксическое воздействие заметно усиливается глицином, а чрезмерная активация NMDA-рецепторов может непосредственно приводить к нейротоксическому действию (Hoover-Fong et al., 2004).
Демиелинизация головного мозга также может привести к дефекту взаимопревращения глицин-серин со снижением продукции одноуглеродных единиц, метаболизм которых активно протекает с период миелинизации (Hayasaka et al., 1987).
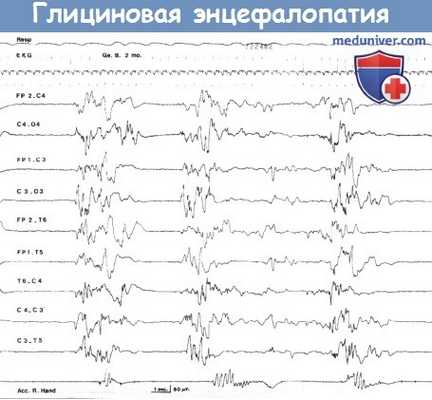
Глициновая энцефалопатия (некетотическая гиперглицинемия):
типичные вспышки-подавления на ЭЭГ 2-месячного мальчика.
Заметны судорожные движения правой руки, синхронные с вспышками ЭЭГ (нижняя кривая).
д) Клинические проявления:
1. Классический фенотип с началом в раннем возрасте. Данная форма является наиболее частой при ГКН. Симптомы могут появляться в течение часов после рождения или в течение первых дней жизни. Вначале появляются сонливость и мышечная слабость, затем возникает поверхностное дыхание, которое вскоре сменяется приступами апноэ. Больные дети вялые и нечувствительны к внешним стимулам, но у них часто встречаются изменчивые миоклонусы и слабо выраженные парциальные припадки. Паттерн «вспышка-подавление» на ЭЭГ, несмотря на неспецифичность, является важным диагностическим проявлением.
Большинство пациентов умирает в раннем возрасте. У некоторых детей эпизоды апноэ и угнетения дыхания носят транзиторный характер, и они могут выжить. Тем не менее, эффективные методы лечения не разработаны, а у выживших детей всегда развивается тяжелая эпилептическая энцефалопатия, и смерть наступает в течение первых лет жизни. У пациентов отмечается спастический церебральный паралич, связанный в большинстве случаев с младенческими судорогами и реже с парциальными судорогами. Периодический паттерн на ЭЭГ чаще всего исчезает через несколько месяцев и сменяется атипичной гипсаритмией или множественными эпилептическими разрядами.
На КТ и МРТ видна прогрессивная атрофия мозга и отсрочка миелинизации супратенториального белого вещества. Частым признаком является агенез или гипоплазия мозолистого тела. Пик концентрации глицина, выявляемый при протонной магнитно-резонансной спектроскопии позволяет проводить неинвазивное измерение концентрации глицина в головном мозге при классической ГКН (Huisman et al., 2002; Korman et al., 2004; Dinopoulos et al., 2005).
2. Атипичные случаи. Выделено три основных типа: неонатальный, младенческий и с поздним началом (Dinopoulos et al., 2005). Проявления новорожденного типа сходны с признаками классической формы ГКН, но дальнейшее психомоторное развитие значимо лучше.
Младенческий тип является наиболее частой формой атипичного ГКН. Заболевание часто ошибочно диагностируется как статическая энцефалопатия. После периода новорожденности, который может протекать без осложнений, у детей развивается задержка развития, которая может прогрессировать с формированием умственной отсталости от умеренной до глубокой степени (60% случаев). У большинства отмечаются некоторые признаки поражения верхних мотонейронов, нарушения мелкой моторики, недостаточность экспрессивной речи, гиперактивность и агрессивное поведение (Steiner et al., 1996).
Приблизительно в 50% случаев развиваются припадки различных типов. Острая деградация, индуцируемая интеркуррентным фебрильным заболеванием или травмой, у некоторых пациентов проявлялась в виде сонливости, гипотонии, атаксии и припадков, которые часто плохо поддаются контролю, или необычными симптомами, такими как миоклонические спазмы, аномальные скручивающие движения, возбужденный бред, хорея, атаксия и паралич вертикального взора.
Формы заболевания с поздним началом встречаются редко и более гетерогенны. Заболевание манифестирует после двух лет или даже во взрослом возрасте преимущественно в виде легких когнитивных нарушений и поведенческих проблем. В небольшом количестве случаев описана спиноцеребеллярная дегенерация и атрофия зрительного нерва. Причина гиперглицинемии при позднем начале заболевания не определена, так как отсутствуют ферментные и генетические подтверждения.
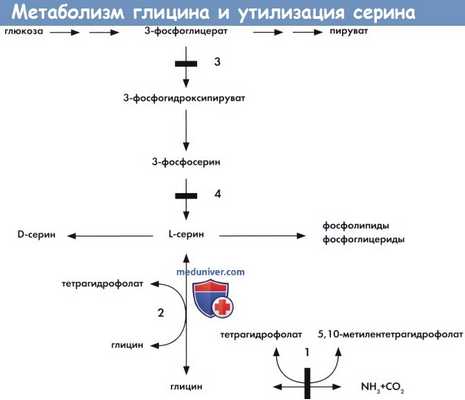
Метаболизм глицина, биосинтез и утилизация серина:
1 —система распада глицина.
2 —гидрометилтрансфераза серина.
3 - 3-фосфоглицерат дегидрогеназа.
4 - 3-фосфосерин фосфатаза
е) Диагностика. Диагноз подтверждается при выявлении повышенного уровня глицина в плазме и спинномозговой жидкости, высоком соотношении содержания глицина в спинномозговой жидкости/плазме, что является наиболее специфичной аномалией. Вторичная гиперглицинемия с ингибированием системы распада глицина связана с аккумуляцией нескольких метаболитов (например, органических кислот, вальпроата). Клинические изменения и быстрый скрининг органических кислот в моче и показателей ацилкарнитина в плазме позволяет исключить большую часть других метаболических заболеваний.
Точная диагностика при классических формах заболевания без остаточной ферментной активности основана на ферментных исследованиях печени или трансформированных лимфобластов. При атипичной и транзиторной форме заболевания может отмечаться нормальная активность ферментов в лимфобластах и следует оценивать ферментную активность в печени и/или проводить всесторонний молекулярный анализ (Applegarth и Тоопе, 2001, 2004).
ж) Лечение. Эффективного лечения не существует. Стрихнин назначается для ингибирования периферических рецепторов глицина. Применение бензоата натрия в высоких дозах направлено на снижение уровня глицина в плазме и спинномозговой жидкости. Дексометорфан, кетамин и триптофан являются антагонистами возбуждающего эффекта глицина на NMDA-рецепторы. Все указанные препараты применялись изолированно или в сочетании без стойкого улучшения (Dinopoulos et al., 2005; Korman et al., 2006).
Другим заболеванием, связанным с нарушением обмена нейротрансмиттера глицина, является гиперэкплексия (или стартовая болезнь), сцепленная с мутациями α1 или β субъединиц рецептора глицина (Rees et al., 2002).
Наследственные нарушения обмена аминокислот. Фенилпировиноградная олигофрения
Наследственные нарушения обмена аминокислот представляют собой наиболее изученную группу генетически детерминированных энзимопатий. Они обусловлены рецессивными мутациями генов, локализованных в аутосомах. При большинстве заболеваний известны молекулярные механизмы, приводящие к формированию патологии.
В основе патогенеза заболеваний этой группы лежит избирательное снижение активности фермента, участвующего в метаболизме той или иной аминокислоты. В результате энзиматического дефекта аминокислоты не утилизируются в организме, а в тканях и биологических жидкостях накапливаются недоокисленные продукты нарушенного метаболизма, обладающие токсическим действием на ткани и органы, в первую очередь на нервную систему.
Большинство нарушений обмена аминокислот проявляется в первые недели и месяцы жизни диспентическим синдромом, неврологическими симптомами и изменениями кожи.
Совершенствование методов диагностики позволило установить частоту этой группы заболеваний и определить их значение и удельный вес в структуре патологии раннего возраста. Частота наследственных нарушений обмена аминокислот колеблется от 1 : 10 000 до 1 : 100 000 новорожденных. Частота гетерозиготных носителей патологического гена составляет в общей популяции 1 : 100 — 1 : 400.
В настоящее время апробирована и внедряется в практику лечебных учреждений этапная биохимическая система диагностики наследственных нарушений обмена аминокислот. Первый этап обследования с помощью качественных проб и полуколичественных методов ставит своей целью выявление группы детей с повышенным содержанием аминокислот в крови и увеличенной экскрецией их с мочой (тотальный скрининг). Эти дети подлежат динамическому наблюдению. Им проводят количественное биохимическое исследование крови и мочи (второй этап), целью которого является идентификация патологии.
Усилия, направленные на раннюю диагностику, оправданы возможностью патогенетической терапии, основным принципом которой является «разгрузка» дефектной ферментной системы посредством исключения из рациона аминокислоты, не метаболизирующейся в организме.
В профилактике заболеваний, обусловленных нарушением обмена аминокислот, большое значение имеют медико-генетическое консультирование, выявление гетерозиготных носителей патологического гена и антенатальная диагностика. Гетерозиготные носители определяются с помощью нагрузочных тестов, выявляющих слабость той или иной ферментной системы. При гетерози-готности мутантного гена активность детерминируемого им фермента, хотя и обеспечивает нормальную жизнедеятельность организма, но ниже, чем у гомозигот по нормальному гену.

Фенилпировиноградная олигофрения (ФПО)
Наследственное заболевание, обусловленное нарушением обмена фенилаланина, описано A. Foiling в 1934 г. Встречается с частотой 1 : 10 000 новорожденных.
В основе патогенеза заболевания лежит дефект (отсутствие или инактивация) фермента фенилаланин-4-гидроксидазы в печени, катализирующего реакцию гидроксилирования фенилаланина в тирозин. Накопление в организме фенилаланина и его патологических производных приводит к вторичным нарушениям обмена веществ. Накопление в мозговой ткани кетокислот блокирует ферментный метаболизм мозга. Недостаточное усвоение фенилаланина приводит также к дефициту тирозина и нарушению синтеза меланина и катехоламинов.
Патоморфологическое исследование выявляет демиелинизацию и глиозное перерождение центральной нервной системы.
Признаки заболевания появляются в период новорожденности или несколько позже. Характерен внешний вид больных: светлые волосы, голубые глаза, отсутствие пигментации кожи. Часто наблюдаются экссудативный диатез, дерматиты, экземы. От больных исходит специфический «затхлый мышиный» запах. Дети вялые, адинамичные или, наоборот, беспокойные, беспричинно кричат, тревожно спят, плохо сосут, часто срыгивают.
Основной клинический симптом болезни — задержка психического развития, которая может быть выражена в различной степени. У некоторых детей на фоне снижения общего уровня психического развития отмечаются периоды улучшения: появляется улыбка, гуление, слежение за предметом. Спустя короткий промежуток времени эти функции снова угасают. Часто наблюдаются развернутые или малые судорожные припадки, которые появляются обычно во втором полугодии жизни. Двигательные нарушения на ранней стадии характеризуются снижением мышечного тонуса. В более старшем возрасте у некоторых больных отмечаются мышечная дистония и гипертония. Сухожильные рефлексы высокие с расширенными зонами, клонусы стоп. Затем могут присоединяться координаторные нарушения, гиперкпнезы. Дети поздно начинают сидеть, ходить. Походка спастико-атактическая.
Изменения со стороны черепномозговых нервов включают косоглазие, нистагм. Отмечается нарушение зрительно-моторной координации.
В плазме крови больных повышен уровень фенилаланина (до 0,15 г/л и выше) и кетокислот. Встречаются также менее тяжелые формы заболевания, обусловленные патогенетически иными нарушениями метаболизма фенилаланина.
Скринирующими тестами на ФПО являются проба Феллинга и тест с 2,4-динитрофенилгидразином. Следует отметить, что эти тесты могут быть положительными и при других нарушениях обмена аминокислот, а также при отсутствии клинических признаков заболевания. Более специфическим является тест Гатри.
Дифференциальный диагноз ФПО у детей раннего возраста проводят с другими нарушениями аминокислот, последствиями асфиксии, внутричерепной родовой травмы и инфекционных поражений центральной нервной системы. ФПО дифференцируется от транзиторной фенилкетонурпи и нарушения обмена других аминокислот с помощью хроматографии. Широкое применение получили белковые гидролизаты, такие, как лофенолак, кетонил, гипофенат, цимогран, минафен, а также смеси альфа-аминокислот. Диетический рацион считается правильным, если уровень фенилаланина в крови не превышает 0,02— 0,06 г/л.
Гетерозиготные носители патологического гена выявляются с помощью нагрузочных тестов с фенилаланипом. Частота их в популяции составляет в среднем 1:50—1:70. Предпринимаются попытки антенатальной диагностики ФПО путем определения концентрации фенилаланина в амнотической жидкости.
- Вернуться в оглавление раздела "Неврология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
- Лучевая диагностика травмы уретры
- Лечение рубцовой алопеции. Рекомендации
- Влияние примесей алкоголя на скорость всасывания. Влияние конституции на скорость всасывания алкоголя
- Сидеробластические анемии - причины, классификация
- Рекомендации по анализу рентгенограммы акромиально-ключичного сустава в ПЗ проекции
