Нефелометрия плазмы, биологических жидкостей, парапротеинов - принципы, эффективность
Добавил пользователь Дмитрий К. Обновлено: 16.01.2026
Электрофорез и иммунофиксация пентавалентной антисывороткой с оценкой содержания М-компонента с помощью денситометрии.
M-gradient, screening; Serum electrophoresis and immunofixation with multivalent antiserum and quantification of M-gradient; M-Gradient, Screening. Serum Protein Electrophoresis (SPEP), Immunofixation with Polyvalent Antiserum, Quantification of M-Protein (without Typing).
Краткое описание исследования «М-градиент, скрининг. Электрофорез сыворотки и иммунофиксация с поливалентной антисывороткой и количественной оценкой М-градиента»
Иммуноглобулины – белки, обладающие активностью антител (способностью специфично связывать определенные антигены). В отличие от большинства белков сыворотки крови, которые вырабатываются в печени, иммуноглобулины продуцируются плазматическими клетками – потомками стволовых клеток-предшественниц В-лимфоцитов в костном мозге. По структурным и функциональным различиям выделяют пять классов иммуноглобулинов – IgG, IgA, IgM, IgD, IgE и ряд субклассов. Поликлональное увеличение количества иммуноглобулинов – нормальный ответ на инфекции.
Моноклональные гамммапатии – состояния, когда клоном плазматических клеток или В-лимфоцитов (популяцией клеток, берущих начало от одной В-клетки-предшественницы) продуцируется аномально большое количество однородного иммуноглобулина. Такие состояния могут быть доброкачественными (когда нет тенденции к неконтролируемому росту популяции таких клеток и увеличению продукции соответствующего моноклонального белка) или злокачественными (когда популяция клеток склонна к постоянному неконтролируемому росту и, как следствие, повышению концентрации соответствующего моноклонального белка и развитию патологии разных органов и систем организма). Моноклональные гаммапатии выявляют по появлению аномальной полосы белка при электрофорезе сыворотки или мочи (М-белок).
Молекулы иммуноглобулинов состоят из одной или более структурных единиц, построенных по единому принципу − из двух идентичных тяжелых цепей (различающихся для IgG, IgM, IgA, IgD, IgE) и двух идентичных легких пептидных цепей – каппа или лямбда. Разновидности тяжелых цепей являются основой деления иммуноглобулинов на классы. Цепи иммуноглобулинов имеют константные и вариабельные участки, последние связаны с антигенной специфичностью.
Иммуноглобулин, продуцируемый одним клоном клеток, имеет идентичную структуру, представляет один класс, подкласс, характеризуется идентичным составом тяжелых и легких цепей. Поэтому если в сыворотке присутствует аномально большое количество моноклонального иммуноглобулина, в процессе электрофоретического разделения белков сыворотки крови он мигрирует в виде компактной полосы, которая выделяется на фоне стандартной картины распределения белковых фракций сыворотки. При описании результатов электрофореза белков сыворотки его называют также парапротеином, М-пиком, М-компонентом, М-белком или М-градиентом. По структуре такой моноклональный иммуноглобулин может быть полимером, мономером или фрагментом молекулы иммуноглобулина (в случае фрагментов чаще это легкие цепи, реже – тяжелые).
Выявление моноклональных парапротеинов проводится методом электрофореза белков. Иногда фибриноген и СРБ, мигрирующие при электрофорезе в гамма- или бета-фракциях, могут быть ошибочно расценены как парапротеины. Иммуноглобулиновую природу выявленного моноклонального компонента подтверждают с помощью иммунофиксации разделенных белков специфической поливалентной преципитирующей антисывороткой, направленной против иммуноглобулинов (см. тест № 4050). При подтверждении присутствия моноклонального иммуноглобулина проводится денситометрия и определяется его количественное содержание. Для полноценной идентификации (типирования) моноклонального компонента требуется развернутое исследование с помощью электрофореза и иммунофиксации с развернутой панелью антисывороток против IgG, IgA, IgM, каппа и лямбда цепей (см. тест № 4051 ). В диагностике и прогнозе учитывают класс выявленного парапротеина, его концентрацию в момент установления диагноза, скорость повышения его концентрации в динамике. Наличие парапротеина является маркером ряда гематоонкологических заболеваний.
Множественная миелома – классическое гематологическое заболевание, обусловленное злокачественной пролиферацией плазмоцитов, секретирующих моноклональный иммуноглобулин (парапротеин) или его фрагменты. Плазматические клетки чаще пролиферируют диффузно в костном мозге, заболевание приводит к остеолитическим поражениям костей, редукции других клеток костного мозга, что ведет к анемии, тромбоцитопении, лейкопении, ингибирует развитие нормальных клонов плазматических клеток. Пациенты могут обращаться с локальными симптомами патологии костей (боли, переломы) или неспецифичными симптомами (потеря массы тела, анемия, кровотечения, повторные инфекции или почечная недостаточность). У большинства больных на момент установления диагноза концентрация парапротеина превышает 25 г/л. При миеломе парапротеин в сыворотке крови чаще всего представлен IgG (60%), реже IgA (20%) и около 20% приходятся на миелому Бенс-Джонса, связанную с продукцией свободных легких цепей каппа или лямбда (20%), которые могут быть обнаружены в моче. Иногда при миеломе может встречаться биклональный парапротеин, представленный иммуноглобулинами разных классов или одного класса, но содержащий легкие цепи разных классов. Редко отмечается IgD и IgE миелома. Определение концентрации парапротеина используют для контроля эффективности лечения миеломы, такой мониторинг при миеломе на фоне терапии должен осуществляться каждые три месяца. Если содержание парапротеина снизилось ниже детектируемого, повторное измерение целесообразно проводить через шесть или двенадцать месяцев.
Макроглобулинемия Вальденстрема представляет собой лимфому с гиперпродукцией моноклонального IgM. Лимфоплазмацитарные опухолевые клетки с характерным иммунофенотипом диффузно распределены в лимфатических узлах, селезенке и костном мозге. Высокая концентрация моноклонального IgM часто превышает 30 г/л и приводит к увеличению вязкости крови и ряду клинических проявлений, включающих спутанность сознания, слепоту, склонность к кровоточивости, сердечную недостаточность и гипертензию. При макроглобулинемии часто отмечается парапротеинемическая полинейропатия, холодовая гемолитическая анемия и криоглобулины. При других разновидностях лимфом и хроническом лимфолейкозе парапротеины класса IgM отмечается у 20% больных, однако концентрация парапротеина обычно ниже 30 г/л.
Болезнь тяжелых цепей (болезнь Франклина) сопровождается синтезом только тяжелой цепи IgG-гамма, без сопутствующей легкой цепи. Это крайне редкое заболевание проявляется отеком мягкого неба и лимфоидной инфильтрацией. Также редко отмечается болезнь тяжелых цепей альфа, при которой возникает хроническая диарея, нарушение всасывания, обусловленные лимфоидной инфильтрацией стенки кишки.
Моноклональный парапротеин может быть обнаружен при ряде неопухолевых заболеваний, в частности, при эссенциальной криоглобулинемии (чаще IgM), парапротеинемической хронической полинейропатии, холодовой гемолитической анемии, АL-амилоидозе почек (свободные цепи лямбда) и внутренних органов, болезни отложения легких цепей. Парапротеин в сыворотке крови отмечается также при болезни Кастелмана (IgM-лямбда), POEMS-синдроме (полинейропатия с органной мегалией) и микседематозном лишае (IgG-каппа).
Что может повлиять на результат теста «М-градиент, скрининг. Электрофорез сыворотки и иммунофиксация с поливалентной антисывороткой и количественной оценкой М-градиента»
При скрининговых обследованиях частота выявления парапротеинемии резко увеличивается в популяции после достижения 50 лет и достигает 4-10% у лиц старше 65 лет. Однако большинство впервые выявленных парапротеинемий в общей популяции представляют собой бессимптомные моноклональные гаммапатии невыясненного значения (МГНЗ). Концентрация парапротеина при МГНЗ существенно ниже 30 г/л и обычно не превышает 10-15 г/л. Кроме того, при МГНЗ парапротеин выявляется на фоне поликлональных иммуноглобулинов, т. е. угнетения нормального синтеза других иммуноглобулинов не происходит. Термин «МГНЗ» указывает на случаи парапротеинемии без других признаков онкогематологического заболевания, которые требуют ежегодного мониторинга, чтобы не пропустить момента озлокачествления процесса. При выявлении парапротеинов у обследованных моложе 50 лет необходимы еще более частые повторные обследования, поскольку у них отмечается высокий риск развития множественной миеломы. Если концентрация М-белка составляет более 15 г/л, вне зависимости от возраста рекомендуется проводить расширенное обследование, включающее электрофорез 24-часового образца мочи и иммунофиксацию каждые 3-6 месяцев, поскольку риск злокачественной трансформации очень высок. Выделяют доброкачественную парапротеинемию, которая характеризуется сохранением парапротеина без прогрессирования во множественную миелому или другое заболевание в течение пяти лет наблюдения. При транзиторной парапротеинемии концентрация парапротеина обычно ниже 3 г/л.
С какой целью проводят исследование «М-градиент, скрининг. Электрофорез сыворотки и иммунофиксация с поливалентной антисывороткой и количественной оценкой М-градиента в крови»
Электрофорез белков сыворотки крови и иммунофиксацию поливалентной антисывороткой для подтверждения наличия и количественной оценки М-белка используют в диагностике миелом.
М-градиент, скрининг. Электрофорез сыворотки и иммунофиксация с поливалентной антисывороткой и количественной оценкой М-градиента
М-градиент, типирование. Электрофорез сыворотки крови и иммунофиксация с панелью антисывороток (IgG/A/M/каппа/лямбда) c количественной оценкой М-градиента
Электрофорез и иммунофиксация с панелью антисывороток (к IgG, IgA, IgM, каппа и лямбда цепям) с денситометрией и оценкой содержания М-компонента.
Синонимы: Электрофоретическое разделение белков сыворотки крови; Клинический электрофорез и иммунофиксация; Парапротеины (м-градиент) в сыворотке крови.
Serum protein electrophoresis; Immunofixation electrophoresis (IFE) ; Detection of kappa and lambda light chain monoclonal proteins in human serum; Immunofixation for characterizing monoclonal proteins (M8proteins) in human serum.
Краткое описание теста «М-градиент, типирование. Электрофорез сыворотки крови и иммунофиксация с панелью антисывороток (IgG/A/M/каппа/лямбда) c количественной оценкой М-градиента»
Моноклональные гамммапатии – состояния, когда клоном плазматических клеток или В-лимфоцитов (популяцией клеток, берущих начало от одной В-клетки-предшественника) продуцируется аномально большое количество однородного иммуноглобулина. Такие состояния могут быть доброкачественными (когда нет тенденции к неконтролируемому росту популяции таких клеток и увеличению продукции соответствующего моноклонального белка) или злокачественными (когда популяция клеток склонна к постоянному неконтролируемому росту и, как следствие, повышению концентрации соответствующего моноклонального белка и развитию патологии органов и систем организма). Моноклональные гаммапатии выявляют по появлению аномальной полосы белка при электрофорезе сыворотки или мочи (М-белок).
Иммуноглобулин, продуцируемый одним клоном клеток, имеет идентичную структуру, представляет один класс, подкласс, характеризуется идентичным составом тяжелых и легких цепей. Поэтому, если в сыворотке присутствует аномально большое количество моноклонального иммуноглобулина, в процессе электрофоретического разделения белков сыворотки крови он мигрирует в виде компактной полосы, которая выделяется на фоне стандартной картины распределения белковых фракций сыворотки. При описании результатов электрофореза белков сыворотки его называют также парапротеином, М-пиком, М-компонентом, М-белком или М-градиентом. По структуре такой моноклональный иммуноглобулин может быть полимером, мономером или фрагментом молекулы иммуноглобулина (в случае фрагментов чаще это легкие цепи, реже – тяжелые). Легкие цепи способны проходить через почечный фильтр, и могут быть обнаружены при электрофорезе мочи.
Выявление моноклональных парапротеинов основано на применении электрофореза белков. Иногда фибриноген и СРБ, мигрирующие при электрофорезе в гамма-или бета-фракциях, могут быть ошибочно расценены как парапротеины. Иммуноглобулиновую природу выявленного моноклонального компонента подтверждают с помощью иммунофиксации разделенных белков специфической поливалентной преципитирующей антисывороткой, направленной против иммуноглобулинов (см. тест № 4050). При подтверждении присутствия моноклонального иммуноглобулина проводится денситометрия и определяется его количественное содержание. Для полноценной идентификации (типирования) моноклонального компонента требуется развернутое исследование с помощью электрофореза и иммунофиксации с развернутой панелью антисывороток против IgG, IgA, IgM, каппа и лямбда цепей (см. тест № 4051). В диагностике и прогнозе учитывают класс выявленного парапротеина, его концентрацию в момент установления диагноза, скорость повышения его концентрации в динамике. Наличие парапротеина является маркером ряда гематоонкологических заболеваний.
Множественная миелома – классическое гематологическое заболевание, обусловленное злокачественной пролиферацией плазмоцитов, секретирующих моноклональный иммуноглобулин (парапротеин) или его фрагменты. Плазматические клетки чаще пролиферируют диффузно в костном мозге, заболевание приводит к остеолитическим поражениям костей, редукции других клеток костного мозга, что ведет к анемии, тромбоцитопении, лейкопении, ингибирует развитие нормальных клонов плазматических клеток. Пациенты могут обращаться с локальными симптомами патологии костей (боли, переломы) или неспецифичными симптомами (потеря массы тела, анемия, кровотечения, повторные инфекции или почечная недостаточность). У большинства больных на момент установления диагноза концентрация парапротеина превышает 25 г/л. При миеломе парапротеин в сыворотке крови чаще всего представлен IgG (60%), реже IgA (20%) и около 20% приходятся на миелому Бенс-Джонса, связанную с продукцией свободных легких цепей каппа или лямбда (20%), которые могут быть обнаружены в моче. Иногда при миеломе может отмечаться биклональный парапротеин, представленный иммуноглобулинами разных классов или одного класса, но содержащий легкие цепи разных классов. Редко отмечается IgD и IgE миелома. Определение концентрации парапротеина используют для контроля эффективности лечения миеломы, такой мониторинг при миеломе на фоне терапии должен осуществляться каждые три месяца. Если содержание парапротеина снизилось ниже детектируемого, повторное измерение целесообразно проводить через шесть или двенадцать месяцев.
Макроглобулинемия Вальденстрема представляет собой лимфому с гиперпродукцией моноклонального IgM. Лимфоплазмацитарные опухолевые клетки с характерным иммунофенотипом диффузно распределены в лимфатических узлах, селезенке и костном мозге. Высокая концентрация моноклонального IgM часто превышает 30 г/л и приводит к увеличению вязкости крови и ряду клинических проявлений, включающих спутанность сознания, слепоту, склонность к кровоточивости, сердечную недостаточность и гипертензию. При макроглобулинемии часто отмечается парапротеинемическая полинейропатия, холодовая гемолитическая анемия и криоглобулины. При других разновидностях лимфом и хроническом лимфолейкозе парапротеины класса IgM отмечается у 20% больных, однако концентрация парапротеина обычно ниже, чем 30 г/л.
С какой целью применяют исследование «М-градиент, типирование. Электрофорез сыворотки крови и иммунофиксация с панелью антисывороток (IgG/A/M/каппа/лямбда) c количественной оценкой М-градиента»
Электрофорез белков сыворотки крови и иммунофиксацию с панелью антисывороток используют в диагностике миелом для подтверждения наличия М-белка, определения его типа, количественной оценки.
Что может повлиять на результаты теста «М-градиент, типирование. Электрофорез сыворотки крови и иммунофиксация с панелью антисывороток (IgG/A/M/каппа/лямбда) c количественной оценкой М-градиента»
Нефелометрия плазмы, биологических жидкостей, парапротеинов - принципы, эффективность
Иммуноэлектрофорез плазмы, биологических жидкостей, парапротеинов - принципы, эффективность
Классический иммуноэлектрофорез по Грабарю — один из наиболее ранних методов, использовавшихся для иммунохимической идентификации компонентов белковых смесей, в частности биологических жидкостей. Он включает в себя 2 этапа.
Сначала проводят электрофорез исследуемого образца в геле агара (или агарозы), затем вдоль оси электрофорез, по бокам полосы и на всем ее протяжении в геле вырезают траншеи, в которые вносят антисыворотки различной специфичности. Во время инкубации, которая занимает около 18 ч, происходит встречная диффузия антигенов (исследуемые белки) и антител с образованием линий преципитации, каждая из которых соответствует одной системе антиген — антитело.
По расположению линий, их форме, интенсивности можно судить о качественных особенностях исследуемых белков и в некоторой степени об их количестве. Используя моноспецифические сыворотки, можно исследовать свойства отдельных компонентов белковых смесей, например сыворотки.
До недавнего времени иммуноэлектрофорез широко применяли для выявления и идентификации парапротеинов, но сейчас в большинстве ситуаций используют метод иммунофореза, которая значительно превосходит иммуноэлектрофорез по чувствительности и наглядности получаемых результатов.
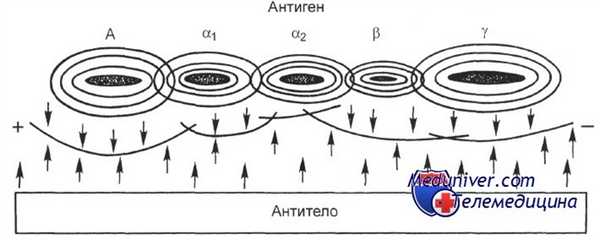
Образование линий преципитации при иммуноэлектрофорезе.
А — альбумин; а,, а2, b и у — глобулины разной подвижности.
Относительно низкая чувствительность иммуноэлектрофореза связана с воздействием характера диффузии исследуемых компонентов на результирующую картину, а также с маскирующим воздействием антигенно родственных белков (например, поликлональных иммуноглобулинов и их фрагментов, других парапротеинов при множественных градиентах), присутствующих в образце.
При массивной моноклональной секреции, особенно с сопутствующим иммунодефицитом, иммуноэлектрофорез вполне подходит для анализа патологических белков. Кроме того, иммуноэлектрофорез является методом выбора при диагностике БТЦ, поскольку условия формирования преципитата в иммуноэлектрофорезе таковы, что позволяют выявить структурно дефектные белки БТЦ на фоне антигенно родственных, но полноценных в структурном отношении поликлональных иммуноглобулинов того же класса.
Один из вариантов классического иммуноэлектрофореза — метод иммуноселекции. Он отличается от иммуноэлектрофореза тем, что электрофоретическое разделение белков проводят в геле, уже содержащем определенную моноспецифическую антисыворотку. При таком разделении белки соответствующей антигенной структуры избирательно осаждаются, образуя характерный преципитат по оси электрофореза, тогда как остальные белки свободно диффундируют в геле и на следующем этапе реакции выявляются другими моноспецифическими антисыворотками, вносимыми в борозды, как и в классическом варианте иммуноэлектрофорез.
Этот метод очень удобен, например, для выявления незначительной секреции белков БТЦ, когда при обычном иммуноэлектрофорезе картина неубедительна.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
При использовании нефелометрии реакция антиген (исследуемый белок) — антитело (моноспецифическая антисыворотка) протекает в жидкой фазе, а образовавшиеся в результате реакции иммунные комплексы выпадают в виде нерастворимого осадка, вызывая помутнение среды. Для повышения эффективности реакции и ее ускорения реагенты помещают в раствор коллоида (обычно полиэтиленгликоля), в присутствии которого реакция заканчивается уже через несколько минут.
О количестве образовавшегося иммунного преципитата судят по мутности пробы (относительно контроля).
При нефелометрическом анализе мутность раствора определяют, регистрируя количество рассеянного света при прохождении хорошо сфокусированного монохроматического луча через исследуемый раствор. Учет реакции производят после ее окончания (по конечной точке) или по мере образования осадка. Эта модификация, называемая кинетической нефелометрией, более предпочтительна.
Для проведения нефелометрии в клинической практике удобно использовать автоматизированные системы, адаптированные для проведения серийных диагностических исследований, отвечающих критериям контроля качества. Анализаторы отличаются природой источника излучения (ртутная лампа, лазерный элемент, вольфрамовый источник), характером учета реакции (в конечной точке или по кинетике реакции) и другими техническими характеристиками, сказывающимися в конечном счете на чувствительности и точности измерений, а также на удобстве работы с прибором.
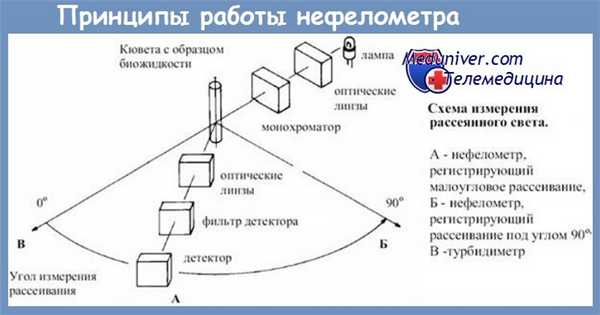
При использовании методов, основанных на регистрации изменения оптических свойств среды, образец и реагенты должны быть оптически прозрачны и не содержать веществ, образующих нерастворимые соединения с полиэтиленгликолем (например, гепарин).
Важные требования к антисывороткам — высокое сродство к антигену, обеспечивающее образование устойчивого преципитата, и высокое содержание специфических антител, поскольку при избытке антигена образуются растворимые иммунные комплексы.
Таким образом, привлекательными сторонами нефелометрии являются быстрота и точность измерения, большая пропускная способность автоматизированных систем, однако необходимы специальные оборудование и реагенты. Принципиальным преимуществом метода относительно радиальной иммунодиффузии (РИД) при исследовании иммуноглобулинопатий является то, что результаты измерений практически не зависят от размера молекул иммуноглобулинов или их фрагментов, поскольку скорость диффузии не влияет на результат.
Следует отметить, что влияние структурных дефектов молекулы на количество и качество образовавшегося преципитата не может быть исключено.
Читайте также:
- Лабораторная диагностика идиопатической тромбоцитопенической пурпуры - анализы
- Измерение церебрального метаболизма. Методы
- Диагностика болезни Педжета и фиброзной дисплазии верхушки пирамиды височной кости
- Септицемия. Общая гнойная инфекция без метастазов в ветеринарии
- Спонтанный, позиционный, меняющийся нистагм. Патологические глазодвигательные реакции (ПГДР)
