Лабораторная диагностика идиопатической тромбоцитопенической пурпуры - анализы
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Для получения максимального количества данных с целью диагностики ИТП, являющейся диагнозом исключения, проводятся обязательные лабораторные тесты.
- Рекомендуется всем пациентам назначение общего анализа крови для верификации диагноза [1 - 7].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4)
Комментарии: объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; обязателен оптический подсчет количества тромбоцитов (по Фонио), определение количества ретикулоцитов, исследование морфологии эритроцитов, тромбоцитов, нейтрофилов по мазку, СОЭ; необходимо обращать внимание на наличие агрегатов тромбоцитов для исключения тромбоцитопении потребления и "ложной" тромбоцитопении при использовании консерванта этилендиаминтетрауксусная кислота (ЭДТА). При ИТП имеется только изолированная тромбоцитопения, допустимы признаки постгеморрагической железодефицитной анемии (ЖДА) и ретикулоцитоз после массивной кровопотери.
- Рекомендуется всем пациентам проведение биохимического анализа крови (общий белок, альбумины, глобулины, мочевая кислота, холестерин, мочевина, креатинин, билирубин общий, прямой и непрямой, щелочная фосфатаза, АСТ, АЛТ, ГГТ, ЛДГ, сывороточное железо, глюкоза, ТТГ) для оценки функционального состояния внутренних органов и выявления сопутствующей патологии [1 - 7].
- Рекомендуется всем пациентам проведение коагулограммы для дифференциальной диагностики ИТП с различными формами нарушений плазменного гемостаза, нарушениями реологических свойств крови и вторичными приобретенными тромбоцитопениями [1 - 7].
Комментарии: Расширенная коагулограмма включает: АЧТВ, протромбиновый индекс, тромбиновое время, фибриноген, антитромбин III, фибринолиз, протеин C, протеин S, Д-димер, фактор Виллебранда, агрегация тромбоцитов с АДФ, коллагеном, ристомицином.
- Для исключения вторичной тромбоцитопении всем пациентам рекомендуется исследование крови на ВИЧ, антител к вирусам гепатитов B и C [4, 10].
Комментарии: Серологические тесты повторно выполняются при рецидиве ИТП, неэффективности терапии, уточнении диагноза. Проведение полимеразной цепной реакции (ПЦР) на вирусы гепатитов B и C следует выполнять при положительных серологических тестах.
- Для исключения вирус-индуцированной тромбоцитопении всем пациентам рекомендуется исследование крови на герпес-вирусы [4, 9, 11].
Комментарии: Проведение полимеразной цепной реакции (ПЦР) на эти вирусы следует проводить при положительных серологических тестах, при подозрении на рецидив, латентную инфекцию или персистенцию вируса.
- Для исключения иммунодефицитных состояний всем пациентам рекомендуется количественный иммунохимический анализ крови (иммуноглобулины G, M, A) [4, 12].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: тромбоцитопения может сопровождать иммунодефицитные состояния.
- Рекомендуется диагностика Helicobacter pylori любым доступным методом (уреазный дыхательный тест, иммуноферментный анализ, иммунохроматографический метод или метод вестерн-блот), как одной из причин тромбоцитопении, у пациентов с отягощенным язвенным анамнезом или клиническими проявлениями язвенной болезни желудка и двенадцатиперстной кишки [4, 13].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
- Рекомендуется исследование костно-мозгового кроветворения для исключения других заболеваний гематологической и негематологической природы. Цитологическое исследование (пункция костного мозга) проводится всем пациентам, гистологическое исследование (трепанобиопсия) - по показаниям [4 - 6, 9].
Комментарии: Исследование костного мозга позволяет исключить острые лейкозы, миелодиспластический синдром и апластическую анемию (АА), метастазы опухолей в костный мозг и др. Для ИТП характерно повышенное или нормальное количество МКЦ, их нормальные или гигантские формы без морфологических аномалий. Гистологическое исследование костного мозга показано при рецидивирующих и резистентных формах ИТП (в течение 6 мес), перед спленэктомией, у пациентов старше 60 лет, при малом числе МКЦ в миелограмме, подозрении на вторичный генез тромбоцитопении.
- Рекомендуется прямая проба Кумбса при анемическом синдроме и билирубинемии для исключения синдрома Фишера-Эванса (сочетания аутоиммунной гемолитической анемии и иммунной тромбоцитопении) [4 - 6, 9].
- Рекомендуется определение маркеров тромбофилии с целью исключения тромбофилии и тромбоцитопении потребления вследствие повышенного тромбообразования [4 - 6, 9].
Комментарии: исследование мутаций генов, кодирующих фактор коагуляции II-протромбин (F2), фактор коагуляции V (F5) - Лейденовская мутация, ингибитор активатора плазминогена (PAI-1), фактор коагуляции VII (F7), фибриноген (FBG), рецептор интегрина (ITGA2-альфа2), тромбоцитарный фактор фибриногена (ITGB3-b), метилентетрагидрофолатредуктаза (MTHFR), редуктаза метионин синтетазы (MTRR) и метионин синтетаза (MTR) следует проводить при отягощенном тромботическом анамнезе, наличии агрегатов тромбоцитов в мазке крови, нормальной агрегации тромбоцитов при глубокой тромбоцитопении и подозрении на тромбоцитопению потребления и всем беременным с тромбоцитопенией.
- Для уточнения диагноза и проведения дифференциальной диагностики вторичных иммунных тромбоцитопений всем пациентам рекомендуется определение уровня тромбоцитассоциированных антител, волчаночного антикоагулянта, антител к кардиолипинам (IgM и IgG), антител к бета-2-гликопротеину 1 (IgM и IgG), антинуклеарных антител, антител к нативной (двуспиральной) ДНК, антител к тироидной пероксидазе (ТПО) [14].
Комментарии: Эти методы исследования имеют важное значение при определении тактики ведения пациентов. При подозрении на вторичность иммунной тромбоцитопении и при положительных результатах тестов в анамнезе периодичность повтора этих исследований - 1 раз в 12 нед. На фоне приема ГКС информативность результатов снижается.
Идиопатическая тромбоцитопеническая пурпура
1. Настоящий клинический протокол устанавливает общие требования к диагностике и лечению идиопатической тромбоцитопенической пурпуры и предназначен для оказания медицинской помощи пациентам старше 18 лет в стационарных и амбулаторных условиях организаций здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
2. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных в Законе Республики Беларусь от 18 июня 1993 года «О здравоохранении» в редакции Закона Республики Беларусь от 20 июня 2008 года (Ведамасцi Вярхоўнага Савета Рэспублiкi Беларусь, 1993 г., № 24, ст. 290; Национальный реестр правовых актов Республики Беларусь, 2008 г., № 159, 2/1460), а также следующие определения:
тромбоцитопения – снижение количества тромбоцитов в крови ниже 150 х 10[9]/л при нормальных границах значений 150–450 х 10[9]/л;
идиопатическая тромбоцитопеническая пурпура – заболевание, характеризующееся снижением уровня тромбоцитов ниже 100 х 10[9]/л и обусловленное выработкой антител к антигенам тромбоцитов. Наименование нозологической формы заболевания (шифр по Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра, принятой в 1989 году сорок третьей сессией Всемирной ассамблеи здравоохранения): D69.3 Идиопатическая тромбоцитопеническая пурпура.
3. По степени тяжести тромбоцитопении подразделяют на:
легкую тромбоцитопению – количество тромбоцитов в крови от 100 до 150 х 10[9]/л;
умеренную тромбоцитопению – количество тромбоцитов в крови от 50 до 100 х 10[9]/л;
тяжелую тромбоцитопению – количество тромбоцитов в крови менее 50 х 10[9]/л.
4. По длительности заболевания идиопатическую тромбоцитопеническую пурпуру подразделяют на:
впервые выявленная;
персистирующая – длительность заболевания от 3 до 12 месяцев (не достигшие ремиссии пациенты, рецидивы);
хроническая – длительность заболевания более 12 месяцев.
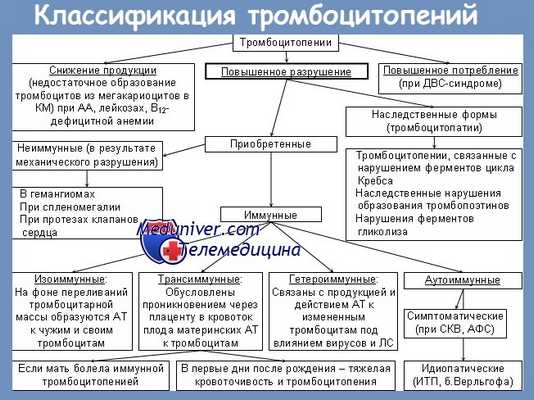
5. Патогенетически тромбоцитопении обусловлены ускоренным распадом или потреблением тромбоцитов, снижением их продукции, секвестрацией (депонированием) тромбоцитов.
5.1. Ускоренное разрушение или потребление тромбоцитов, встречается у пациентов: с иммунными тромбоцитопениями (идиопатические тромбоцитопении (далее – ИТП)); симптоматическими тромбоцитопениями (тромбоцитопения при системной красной волчанке); при диссеминированном внутрисосудистом свертывании; при возникновении микроангиопатических синдромов (HELLP-синдром, тромботическая тромбоцитопеническая пурпура, гемолитический уремический синдром); гестационная тромбоцитопения.
5.2. Снижение образования тромбоцитов (сопровождается уменьшением количества мегакариоцитов в костном мозге) встречается у пациентов с лейкозами, при апластической анемии, при дефиците фолиевой кислоты, при приеме лекарственных средств, при вирусных инфекциях.
5.3. Секвестрация (депонирование) тромбоцитов – накопление тромбоцитов в увеличенной селезенке пациента. Наблюдается при циррозах, лимфомах, болезни Гоше и других.
Диагностика
ДИАГНОСТИКА ИДИОПАТИЧЕСКОЙ ТРОМБОЦИТОПЕНИЧЕСКОЙ ПУРПУРЫ
6. Первичная диагностика ИТП проводится в организациях здравоохранения врачами различных специальностей.
6.1. Диагностическими критериями постановки диагноза ИТП являются:
снижение количества тромбоцитов в общем анализе крови;
появление петехиально-пятнистой кровоточивости на кожных покровах и слизистых.
6.2. Верификация диагноза ИТП и дифференциация с вторичными тромбоцитопениями осуществляется в организациях здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
7. К группе риска развития вторичных тромбоцитопений относятся пациенты со следующими патологическими состояниями:
наличие заболевания, вызванного вирусом иммунодефицита человека, наличие вирусного гепатита, других инфекций, а также аутоиммунных заболеваний, иммунодефицитных состояний, лимфопролиферативных заболеваний, после вакцинации;
заболевания печени (включая алкогольный цирроз печени);
прием лекарственных средств (нестероидные противовоспалительные лекарственные средства, противотуберкулезные лекарственные средства, противоопухолевые лекарственные средства), злоупотребление алкоголем, употребление хинина (в том числе в напитках);
заболевания крови (миелодиспластический синдром, лейкемии, фиброз костного мозга, апластическая анемия, мегалобластная анемия, метастатическое поражение костного мозга);
трансфузии компонентов крови (посттрансфузионная пурпура);
врожденная тромбоцитопения (синдромы Вискота Олдрича, Бернара Сулье, тип IIb болезни Виллебранда и другие).
8. Клиническая картина ИТП.
8.1. Клиническим проявлением ИТП является только геморрагический синдром по типу петехиально-пятнистой кровоточивости.
8.2. Наличие выраженной спленомегалии свидетельствует о вторичной тромбоцитопении.
8.3. Лихорадка, потеря массы тела, гепатомегалия, лимфаденопатия свидетельствуют о возможном наличии ВИЧ-инфекции, системной красной волчанки, лимфопролиферативного заболевания как причин вторичной тромбоцитопении.
9. Обязательная диагностика:
9.1. общий анализ крови:
для ИТП характерна изолированная тромбоцитопения без изменений со стороны других ростков кроветворения;
для ИТП нехарактерны изменения морфологии клеток крови и лейкоцитарной формулы. Изменения морфологии клеток крови и лейкоцитарной формулы определяются при вторичной тромбоцитопении: шизоциты при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме; увеличенное количество гигантских тромбоцитов или малых тромбоцитов при врожденной тромбоцитопении, наличие агрегатов тромбоцитов в мазках крови – в пользу псевдотромбоцитопении, связанной со стабилизацией крови этилендиаминтетрауксусной кислотой;
9.2. цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) или гистологическое исследование препарата костного мозга для исключения причин вторичной тромбоцитопении у пациентов с симптомами системного заболевания кроветворной ткани, а также для обоснования целесообразности выполнения спленэктомии;
9.3. для исключения вторичной тромбоцитопении клинически неотличимой от ИТП проводится исследование на наличие: антител к вирусам иммунодефицита человека (HIV); гепатита С (анти-HCV); антигена вируса гепатита В (HBsAg);
9.4. для исключения наследственных иммунодефицитных заболеваний, как причин вторичной тромбоцитопении проводится количественное определение сывороточных иммуноглобулинов;
9.5. для диагностики аутоиммунной гемолитической анемии и в случае предполагаемой терапии анти-D-иммуноглобулином проводится прямая проба Кумбса.
10. Дополнительная диагностика:
проведение скрининговых тестов на антифосфолипидный синдром;
определение антитиреоидных антител и функции щитовидной железы:
исследования по особым показаниям: количественное или качественное определение ДНК (РНК) вирусов гепатита А, В, С, D, G; ДНК цитомегаловируса; вируса Эпштейн-Барр; антител к вирусам гепатита В (анти-HBsAg) и другим вирусам или бактериям.
Лечение
ЛЕЧЕНИЕ ИДИОПАТИЧЕСКОЙ ТРОМБОЦИТОПЕНИЧЕСКОЙ ПУРПУРЫ
Лечение ИТП проводится в организациях здравоохранения, имеющих в своем составе гематологические отделения или гематологические консультативные кабинеты.
11. При определении показаний к началу терапии ИТП учитывают:
выраженность кровоточивости;
наличие сопутствующих заболеваний (артериальная гипертензия, сахарный диабет, хроническая сердечно-сосудистая недостаточность, ожирение, остеопороз и другие);
возможные осложнения планируемой терапии;
профессиональные риски травматизации;
толерантность к побочным эффектам предлагаемой терапии;
необходимость оперативных вмешательств;
мотивацию пациента к лечению;
употребление лекарственных средств, которые могут спровоцировать кровоточивость на фоне тромбоцитопении (непрямые антикоагулянты, противовоспалительные лекарственные средства, ненаркотические анальгетики);
возраст пациента (старше 60 лет);
кровотечения в анамнезе.
12. Лечение не показано пациентам с уровнем тромбоцитов в общем анализе крови более 50 х 10[9]/л при отсутствии кровоточивости, обусловленной дисфункцией тромбоцитов, травмами, оперативными вмешательствами, сопутствующими заболеваниями, антикоагулянтной терапией.
13. Терапия первой линии (начальная терапия для впервые выявленных пациентов).
13.1. Стандартная начальная терапия.
13.1.1. Кортикостероиды для системного применения в одном из следующих вариантов:
дексаметазон в дозе 40 мг/сутки, перорально в 1 прием в течение 4 дней, 1–4 дни цикла с интервалом 14–28 дней, 3–4 цикла;
метилпреднизолон в дозе 30 мг/кг/сутки внутривенно в виде 1 часовой инфузии в течение 3 дней. Снижение дозы ступенчато 20 мг/кг/сутки внутривенно 4–6 дни, 10 мг/кг/сутки внутривенно 7–9 дни с переходом на пероральный прием преднизолона в дозе 1 мг/кг/сутки;
преднизолон в дозе 0,5–2 мг/кг/сутки перорально до подъема уровня тромбоцитов выше 30–50 х 10[9]/л. При достижении эффекта необходимо быстрое снижение дозы вплоть до его отмены. При отсутствии эффекта продолжительность терапии преднизолоном не должна превышать 4 недель.
13.1.2. Иммуноглобулин человека нормальный (для внутривенного введения): для исходного лечения используется доза 0,4 г/кг, вводимая 5 дней подряд или от 0,4 до 1 г/кг однократно, или в течение 2 последовательных дней. При необходимости в дальнейшем можно вводить 0,4 г/кг с интервалами от 1 до 4 недель для поддержания достаточного уровня тромбоцитов.
Ответ на терапию достигается в течение от 24 часов до 2–4 дней от начала. Эффект транзиторный, уровень тромбоцитов в общем анализе крови пациента возвращается к исходному уровню в течение 2–4 недель.
Для пациентов с дефицитом иммуноглобулина А обязательны лекарственные средства с минимальным содержанием иммуноглобулина А (не более 0.2 мг/мл).
14. Ургентная терапия. Показания к экстренному восстановлению гемостатически достаточного уровня тромбоцитов возникают при необходимости оперативных вмешательств, угрозе или развитии кровотечения в центральную нервную систему, желудочно-кишечный тракт, мочевыделительную систему.
14.1. Для остановки кровотечения применяют введение высоких доз иммуноглобулина человеческого нормального (для внутривенного введения) – 1 г/кг, в том числе в сочетании с кортикостероидами.
14.2. Высокие дозы метилпреднизолона 30 мг/кг/сутки внутривенно в виде 1 часовой инфузии.
14.3. Применение с гемостатической целью трансфузии донорских тромбоцитов, а также экстренная спленэктомия.
14.4. Мероприятия общего порядка: отмена лекарственных средств, снижающих функцию тромбоцитов; медикаментозное прекращение менструации; минимизация травматичности оперативного вмешательства; применение ингибиторов фибринолиза для предупреждения рецидивирующих кровотечений, кровотечений при проведении оперативного вмешательства и лечении зубов: аминокапроновая кислота по 1–4 г каждые 4–6 часов (до 24 г в сутки) внутрь.
15. Терапия второй линии. При неэффективности применения кортикостероидов и иммуноглобулина человеческого нормального (для внутривенного введения) переходят к терапии второй линии.
15.1. Спленэктомия является методом выбора в рамках терапии второй линии. Спленэктомию выполняют не ранее, чем через 6 месяцев после установления диагноза.
16. Наличие противопоказаний к спленэктомии или отсутствие согласия пациента на операцию делают необходимым применение медикаментозной терапии второй линии.
16.1. Моноклональные антитела.
Ритуксимаб применяют в дозе 375 мг/м[2] 1 раз в неделю, внутривенно капельно (начальная скорость инфузии 50 мг/ч, при отсутствии реакций гиперчувствительности возможно повышение скорости на 50 мг/ч каждые 30 мин (до 400 мг/ч)), курс лечения составляет 4 недели.
Высокий уровень ответа дает сочетание ритуксимаба с высокими дозами дексаметазона.
Ритуксимаб абсолютно противопоказан пациентам с активным гепатитом В.
Назначение ритуксимаба возможно только решением консилиума с обязательным участием врачей-гематологов после получения информированного согласия пациента.
16.2. Элтромбопаг (агонист рецепторов тромбопоэтина) назначается в дозах 25, 50 и 75 мг/сутки внутрь однократно. Лекарственное средство показано пациентам с хронической ИТП, у которых была проведена спленэктомия и которые не отвечают на лечение кортикостероидами и иммуноглобулинами, а также пациентам, имеющим противопоказания к спленэктомии, как терапии второй линии.
Элтромбопаг назначается на длительное время для поддержания числа тромбоцитов свыше 50 х 10[9]/л. Ответ у всех групп пациентов достигается через 1–2 недели терапии. Терапию можно считать неэффективной, если пациент не дает ответа на нее в течение 4-х недель. У пациентов, принимающих элтромбопаг, можно уменьшить объем сопутствующей терапии либо отменить ее полностью.
16.3. Этапы терапии элтромбопагом:
период подбора (титрования) дозы: старт с 50 мг/сутки перорально, шаг вверх/вниз 25 мг/сутки перорально, с временным интервалом 2–3 недели;
период стабильной (после стабилизации числа тромбоцитов) терапии;
период отмены.
16.3.1. При отмене возможно возникновения «рикошетной» тромбоцитопении, которая имеет транзиторный характер (разрешается через 2–3–4 недели), однако в этот период может потребоваться дополнительное назначение кортикостероидов или внутривенного иммуноглобулина для снижения риска кровотечений.
16.3.2. При снижении уровня тромбоцитов менее 50 х 10[9]/л в общем анализе крови, показано возобновление приема (возврат к прежней дозе) элтромбопага, поскольку снижения эффективности элтромбопага при длительном применении и (или) повторных назначениях не наблюдается.
Оптимальным путем профилактики данного явления является постепенная отмена элтромбопага.
При отмене элтромбопага контроль уровня тромбоцитов в общем анализе крови пациента проводится с частотой 1 раз в неделю в период снижения дозы и отмены лекарственного средства, в том числе в течение одного месяца после полной отмены.
17. При подготовке к плановым хирургическим вмешательствам (спленэктомия и другие), при травматических повреждениях с целью снижения риска кровотечений возможно краткосрочное назначение элтромбопага в дозе 50–75 мг/сутки перорально.
18. Лекарственные средства второй линии, назначаемые решением консилиума с участием врачей-гематологов:
циклоспорин в дозе 5 мг/кг в день в течение 6 дней, затем 2,5–3 мг/кг/сутки под контролем уровня лекарственного средства в крови (100–200 нг/мл);
микофенолата мофетил назначают в прогрессирующих дозах от 250 мг до 1000 мг/сутки 2 раза в неделю в течение 3 недель;
даназол назначают в дозе 200 мг 2–4 раза в сутки (10–15 мг/кг/сутки внутрь);
азатиоприн назначают в дозе 150 мг/сутки (1–2 мг/кг/сутки);
циклофосфамид назначают в дозе 1–2 мг/кг в сутки внутрь минимум 16 недель или внутривенно 0,3–1 г/м[2] 1–3 введения каждые 2–4 недели. Назначают пациентам резистентным к глюкокортикостероидам и с рецидивами после спленэктомии, ответ на терапию обычно регистрируется в течение 8 недель;
винкристин назначают в дозе 1–2 мг в неделю, 1–3 недели (до 6 мг) только внутривенно, с интервалом в 1 неделю, доза индивидуальна. Необходима индивидуальная коррекция дозы винкристина на основе клинического ответа на лечение и выраженности токсических эффектов.
19. Лечение пациентов с ИТП в случае отсутствия эффекта после терапии первой или второй линий.
19.1. Элтромбопаг применяют в дозе 25–75 мг ежедневно внутрь.
Лабораторная диагностика идиопатической тромбоцитопенической пурпуры - анализы
Согласно отборной схеме с целью диагноза геморрагического синдрома, лабораторные исследования при идиопатической тромбоцитопенической пурпуре должны начинаться, на первом этапе, с наиболее простых тестов: время кровотечения и время коагуляции, гемограмма с подсчетом тромбоцитов, реакция сгустка. На следующем этапе показаны тесты для этиопатогенетического диагноза клинической формы идиопатической тромбоцитопенической пурпуры.
В разгаре острого приступа идиопатической тромбоцитопенической пурпуры время кровотечения, как и при любой другой форме тромбопенической пурпуры, значительно увеличивается, порой достигая одного часа. При менее суровых случаях, с умеренными сокращениями тромбоцитов, если метод Дюка (Duke) не показывает значительного увеличения, следует применять метод Иви (Ivy). В качестве клинической пробы, тест жгута оказывается интенсивно положительным в период наибольшей тромбоцитопении, иногда оставаясь положительным долгое время, даже если тромбоциты возросли выше критического числа 50—60 000, а пурпура исчезла.
Глобальное время коагуляции и время Howell остаются в норме при любой форме тромбопенической пурпуры, идиопатической или вторичной; ретракция сгустка однако — дефицитная, а в случае значительных сокращений тромбоцитов, ниже 25 000, при нулевой ретракции даже спустя 24—48 часов, начинается фибринолиз без ретракции сгустка.
Тромбэластограмма показывает уже известные характерные изменения, с приближением обоих ветвей кривой, обычно в связи с сокращением числа тромбоцитов и дефицитом ретракции сгустка.
Эти легко выполняемые тесты в медицинских лабораториях любого уровня, сопоставляемые с клиническим характером кожных геморрагии, достаточны для постановки диагноза идиопатической тромбоцитопенической пурпуры.
Число тромбоцитов, детерминируемое в рамках гемограммы путем прямого подсчета или в относительном значении по сравнению с числом эритроцитов показывает сокращения, которые в течение острого периода понижаются ниже 50 000, достигая 20 000 или даже 10 000; в некоторых случаях сокращение настолько большое, что невозможно определить их число, так как существует периферический атромбоцитоз. Состояния атромбоцитоза сопровождаются выраженными кожными и висцеральными расстройствами благоприятствующие менингоцеребральным геморрагиям.
В настоящем опыте существуют однако случаи идиопатической тромбоцитопенической пурпуры с сильно выраженной тромбоцитопенией вплоть до атромбоцитоза, но с незначительными геморрагическими явлениями.

Пониженное число тромбоцитов сопровождается наличием крупных тромбоцитов диаметром в 2—3 микрона, по сравнению с диаметром нормальных тромбоцитов в 1,5 микрона. Вообще средний диаметр не бывает ниже 2 микронов, хотя на мазке встречаются и мелкие, круглые формы. С морфологической точки зрения, тромбоциты менее гранулированные или обладают некоторными эозинофильными грануляциями, отличающимися от грануломера нормальных тромбоцитов. Реже встречаются, наряду с крупными тромбоцитами, мелкие фрагменты цитоплазмы мегакариоцитов, как признак увеличенного турновера тромбоцитов.
Эксплорация тромбоцитопоэза, с изучением мегакариоцитов в костном мозге, представляется необходимой для диагноза идиопатической тромбоцитопении, так как прежние авторы считают мегакариограмму характерной для болезни Верльгофа. Вообще, после первоначальных исследований Франка, считалось, что при идиопатической тромбоцитопении существуют в изобилии медуллярные мегакариоциты. После подсчета при помощи текущих методов на мазке или в счетной камере, утвердилось мнение, что число мегакариоцитов при болезни Верльгофа в 2—3 раза больше, чем в нормальном костном мозге. По сравнению с числом медуллярных кариоцитов, существует около 0,6— 1% мегакариоцитов, в то время как при болезни Верльгофа они насчитывают около 2—3%, что означает в абсолютных цифрах соответственно 40—80 мегакариоцитов/мм3 и 100—300 мегакариоцитов/мм3 при болезни Верльгофа.
Имея в виду классическую патегенетическую гипотезу болезни Верльгофа, считается, что эффект функционального гиперспленизма детерминирует ингибицию в образовании тромбоцитов из-за дефекта созревания мегакариоцитов. По схеме Heilmeyer, в нормальной мегакариограмме появляются 4 группы мегакариоцитов. При болезни Верльгофа преобладают юные формы группы 1 и 2, в размере 50—75%, при этом тромбоцитообразующие формы спадают ниже 10—15% вплоть до исчезновения. Эта мегакариограмма с выраженным отклонением влево считается характерной для дефицита тромбоцитопоэза, признанного ранее как патогенетическое расстройство при идиопатической тромбоцитопении.
Однако уже давно известно, что методы оценки тромбоцитопоэза по миэлограмме на мазках являются весьма произвольными. Попытки оценки числа мегакариоцитов делались и у нас до 1960 г. (Berceanu и Sasarman); подсчет на срезах медуллярных фрагментов является повидимому наиболее достоверным но менее использованным в практике методом.
За последние 10—15 лет систематическое изучение мегакариопоэза и тромбоцитопоэза, даже если и не вошло в клиническую практику, сумело уточнить патогенетические характеристики идиопатической тромбоцитопении как синдрома по поводу повышенного уничтожения тромбоцитов на периферии, некомпенсированного значительным ускорением медуллярного тромбоцитопоэза. Эти данные потребовали внедрения новых специальных тестов для определения продолжительности жизни тромбоцитов путем мечения 51Cr; при помощи этого приема прослеживаются кривые сокращения и исчезновения меченных тромбоцитов из плазмы, параллельно с их включением и секвестрацией в печени и селезенке. Данный метод дополнился детерминированием общей массы мегакариоцитов путем волюметрической оценки на гистологических срезах (Harker и сотр., Ebbe и сотр., Branehog и сотр.); определение скорости производства тромбоцитов соотнесенной к скорости их уничтожения на периферии привело к определению тромбоцитного турновера на основе математических формул (Murphy и сотр., Branehog и сотр.).
В результате этих новых методов удалось установить при идиопатической тромбоцитопении известные изменения новых констант, которые свидетельствуют о повышенном тромбоцитопоэзе с целью компенсации очень высокого тромбоцитолиза: число мегакариоцитов на мм2 фиксированного среза медуллярной ткани равняется 39±2 (норма — 19±2), величина мегакариоцитов равняется 328±10 uм2 (норма 296 uм2); общее, число мегакариоцитов в костном мозге составляет у нормального лица 58 x 105/мм3 костного мозга, в то время как у больных с идиопатической тромбоцитопенией оно составляет 127 х 105мм3 костного мозга.
Темне менее, мегакариограмма в более новых исследованиях Branehog не отличается значительно от классических данных. Она показывает рост юных мегакариоцитов, но понижение по сравнению с нормой тромбоцитообразовательных мегакариоцитов, лишь в относительном значении. В абсолютном значении тромбоцитообразующие мегакариоциты повышены и объясняют увеличенный тромбоцитопоэз, определяемый вышеуказанными методами.
Ниже мы приводим средние значения по 4 группам мегакариоцитов у нормального лицами у больного с идиопатической тромбоцитопенией:
| Гр. I | Гр. II | Гр. III | Гр. IV | |
| Норма | 1,5% | 25,4% | 67,1% | 5,9% |
| ИТП | 6,6% | 34,1% | 51,3% | 8% |
Средний диаметр тромбоцитов у нормального лица ссотавляет 1,70', а при идиопатической тромбоцитопении — 2,65 u.
Значения турновера у нормальных лиц составляют 43000 ± 3000/uл сутки и 105 000 ± 10 000 uл/сутки при идиопатической тромбоцитопении, что означает скорость производства почти в 3 раза больше при идиопатической тромбоцитопении. Повышенная скорость турновера однако не компенсируется скоростью уничтожения, так как продолжительность жизни у нормального лица составляет 6,9±0,3 дней (4,2-8,5), в то время как при идиопатической тромбоцитопении сокращения очень значительны, составляя 0,02—1,83 дня, в среднем 0,57±0,11 дня.
Несмотря на то, что не все эти новые исследования вошли в диагностическую практику идиопатической тромбоцитопении, их изучение имеет важное значение для познания механизма возникновения тромбоцитопении при различных формах идиопатической тромбоцитопении.
Иммуносерологические исследования являются также новыми тестами, доказавшими автоиммунную природу форм идиопатической тромбоцитопении, изменив таким образом классическую патогенетическую концепцию. В первом периоде было налажено множество серологических методов с целью выявления наличия агглютининов, тромбоцитарных лизинов, а также и антител, фиксирующих комплемент (Harrington и сотр., Dausset, Tullis) или антител, дающих положительные реакции в тесте Стеффена на расход антигаммаглобулина (Steffen). Тест Кумбса на тромбоциты, хотя и очень трудный с технической точки зрения, считался положительным в высоком проценте случаев на статистике Stefanini и Dameshek. Проявленный в первое время энтузиазм убавился в дальнейшем, вследствие отрицательных резульаттов, полученных другими авторами, нашедших агглютинины на тепле и на холоде лишь у 5—10% случаев, как они существуют и в нормальных сыворотках (Cohen и сотр., Shulmann). Иммуносерологические тесты имеют здесь значение скорее для патогенетического исследования, чем для диагноза.
В настоящее время, большинство авторов утверждает, что из всех более 20 методов тестирования автоантител при идиопатической тромбоцитопении ни один не оказался настолько специфическим, чтобы его можно было применять как диагностический метод для определения автоиммунной природы идиопатической тромбоцитопении. Даже если и существуют сывороточные антитела, они находятся в низком титре и не оказывают эффектов агглютинации или лизиса на нормальные тромбоциты. Реакции положительной агглютинации вероятно неспецифичны, а детерминированы спонтанной агглютинацией тромбоцитов, которые после промывания высвобождают факторы адгезивности и агглютинации, как ADP; возможно также, что в сыворотке больных идиопатической тромбоцитопенией персистирует тромбин и другие факторы коагуляции (Baldini).
Позднее, при помощи других методов кажется удалось выявить специфические антитела при идиопатической тромбоцитопении, но эти приемы трудно внедрить в текущую практику. Таким является тест на лизис тромбоцитов при пароксизмальной ночной гемоглобинурии меченных 51Cr, которые будучи более чувствительными, высвобождают изотоп как маркер явления тромбоцитолиза вследствие действия цитотоксических сывороточных антител. Hanna и Nelken, нашли посредством двумоментного теста агглютинации неполноценные антитела в 50% случаев, которые можно обнаружить и посредством теста Кумбса с сывороткой анти-Fab, IgG (Mc Millan). Тест Карпаткина, цель которого состоит в высвобождении F3 из нормальных тромбоцитов под действием сыворотки от идиопатической тромбоцитопении, кажется наиболее чувствительным, давая положительные реакции почти в 80% случаев (на 234 больных).
Тест оказывается положительным и при тромбопенических пурпурах, в которых несомненно существуют антитела, то есть при формах изоиммунизации или при формах по поводу сенсибилизации к медикаментам. На основании этого теста Karpatkin считает доказанным автоиммунный механизм и предлагает название аутоиммунной тромбоцитопении (автоиммунной). Несмотря на то, что большинство авторов считает, что ни один метод не является специфическим, в настоящее время признается автоиммунная природа данного заболевания, независимо от того, идет ли речь о первичных идиопатических формах или о вторичных формах на почве вирусных инфекций (Shulmann и сотр., Baldini).
Другие методы, которые использовал первоначально Harrington и разработал затем Shulmann, свидетельствуют о существовании антитромбоцитарных факторов в сыворотке больных, но они трудно применимы в практике. Мы их приводим в порядке значения, так как они изложены в труде «Иммунология, иммунохимия и иммунопатология »(под редакцией Месробяну и Берчану), где приводятся и технические подробности:
1) Тромбоцитопенизирующее действие плазмы или сыворотки больных, иньецированной в дозе 0,4—6 мл/кг веса тела нормальному лицу, с сокращением до 20 000 тромбоцитов, персистирующих 2—3 дня, способной вызывать и пурпуру. Следует подчеркнуть, что тромбоцитопенизирующее действие на лиц, подвергавшихся спленектомии, происходит лишь в результате очень высоких доз — 19 мл/кг веса тела. Эффект оказывается нулевым если предварительно сыворотка абсорбируется с нормальными тромбоцитами.
2) Тромбоцитопенизирующий эффект после инъецирования сыворотки или плазмы у обезьян или кроликов (Berceanu и сотр.).
3) Тромбоцитопенизирующий эффект собственной сыворотки, взятой в период острого приступа, замороженной и затем инъецированной во время периода ремиссии, когда число тромбоцитов нормальное или почти нормальное.
4) Сокращение продолжительности жизни нормальных тромбоцитов, меченых 51Cr и инъецирование больным с идиопатической тромбоцитопенией, является важным тестом, доказывающим присутствие сывороточных тромбоцитопенизириющих факторов, а следовательно автоиммунную природу заболевания; сцинтиграфия селезенки доказывает лишний раз секвестрацию сенсибилизированных тромбоцитов в печени и селезенке.
Современные методы (Davey и Lander, Najean и сотр., Shulmann) прослеживают эволюцию радиоактивных кривых в плазме и органах, определяя таким образом сокращение на половину жизни тромбоцитов и интенсивность их секвестрации в печени и селезенке. Более новые наблюдения показали однако, что существует множество факторов ошибки и что следовательно спленическая секвестрация не является достаточно достоверным тестом, подтверждающим благоприятный эффект спленектомии (Baldini, Aster).
Другие наблюдения показывают однако, что спленическая секвестрация — ценный тест и является характерным для менее суровых форм, в то время как гепатическая секвестрация — признак суровой эволюции благодаря тромбоцитам обильно окутаным антителами (Shulmann и сотр., Aster и Keene). Najean и сотр. утверждают, что гепатическая секвестрация — признак устойчивости к кортикотерапии, но все же полагают, что спленектомия дает хорошие результаты тем, что таким образом удаляется орган, секретирующий автоантитела (Karpatkin и сотр., McMillan и сотр.).
Тесты на клеточный иммунитет, применяемые в последнее время являются особенным аргументом в пользу состояния автоиммунизации, зависящего от лимфоцитов Т, но эти тесты не вошли в клиническую практику. Разработанный Wybran тест показывает, что лимфоциты больных (в 14 из 16 случаев) инкорпорируют 3НТ в инкубации с тромбоцитами от больных или с алогенными тромбоцитами. Интенсивность реакции, которая эквивалентна реакции бластической трансформации in vitro вследствие действия антигенов, вызывающих реакции позднего типа, прямо пропорциональна степени тяжести данной формы идиопатической тромбоцитопении.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) - причины, клиника
Различают следующие основные виды иммунных тромбоцитопений:
1) аутоиммунная;
2) гетероиммунная;
3) аллоиммунная.
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) обусловлена уменьшением продолжительности жизни тромбоцитов и их повышенным разрушением в связи с воздействием антитромбоцитарных аутоантител.
Эта нозологическая форма наиболее распространена среди всех тромбоцитопений и в среднем встречается с частотой 5:100 000 населения в год. Заболевание чаще возникает у женщин 20-40 лет и в большинстве случаев характеризуется длительным индолентным течением (в течение многих месяцев и лет).
Этиология и патогенез аутоиммунных тромбоцитопений
Причиной аутоиммунной тромбоцитопении являются антитромбоцитарные аутоантитела, которые синтезируются преимущественно в селезенке лимфоцитами и плазмоцитами. В 50-80% случаев антитела относятся к IgG, реже IgA или обоим классам иммуноглобулинов. Антитромбоцитарные антитела связываются с антигенами тромбоцитов, расположенными на их мембране (обычно ГП IIb/IIIа и Ib/IX).
Тромбоциты, соединенные с антителами, имеют укороченный период жизни (от десятков минут до 2-3 дней вместо 7-10 дней) и удаляются из кровеносного русла фагоцитами селезенки (реже печени и костного мозга) после соединения с Fc-рецептором. Таким образом, селезенка имеет большое значение в патогенезе аутоиммунной тромбоцитопений:
1) принимает участие в выработке аутоантител;
2) является основным местом деструкции сенсибилизированных тромбоцитов.
При выраженной тромбоцитопений отмечается повышение содержания М-КСФ, стимулирующего фагоцитарную активность макрофагов.
В генезе заболевания имеют значение нарушения клеточного иммунитета, что подтверждается увеличенным уровнем CD8+ и снижением CD4+ лимфоцитов. В ряде случаев (чаще у детей) выявляются аутореактивные Т-лимфоциты, реагирующие с собственными тромбоцитами.
Укорочение жизни тромбоцитов ведет к стимуляции тромбоцитопоэза, в результате чего в костном мозге определяется повышенное количество мегакариоцитов. В тяжелых случаях антитела могут вырабатываться и к мегакариоцитам, обусловливая мегакариоцитарную аплазию.

Клиническая картина аутоиммунной тромбоцитопении
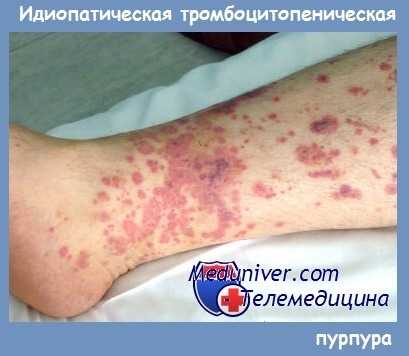
Начало аутоиммунной тромбоцитопении обычно скрытое, без видимой причины. Геморрагический синдром проявляется кожными кровоизлияниями, носовыми кровотечениями, а у женщин, кроме того, — меноррагиями. Кожные кровоизлияния обычно возникают без видимых внешних причин или после незначительных ушибов.
Кровоизлияния имеют вид петехий и экхимозов и чаще возникают на конечностях. При большом количестве экхимозов кожа приобретает характерный внешний вид («шкура леопарда»).
Типичны также кровоизлияния в местах инъекций. Иногда кровоизлияния возникают на лице, губах и конъюнктиве. Появление таких геморрагий свидетельствует о риске развития кровоизлияния в головной мозг и требует своевременной и адекватной терапии.
Нередко у больных наблюдаются кровотечения при экстракции зубов, которые начинаются сразу же после вмешательства, могут продолжаться несколько часов или даже дней. После остановки, в отличие от гемофилии, кровотечения не рецидивируют.
При объективном обследовании выявляются положительные пробы на ломкость капилляров («щипка», «жгута»). Увеличения размеров лимфатических узлов, печени и селезенки не отмечается (в отличие от ряда симптоматических тромбоцитопений).
При тяжелых и длительных кровотечениях может развиваться анемический синдром (слабость, быстрая утомляемость, одышка при физических нагрузках, усиленное сердцебиение и др.), выраженность которого зависит от тяжести анемии.
Течение аутоиммунной тромбоцитопений, как правило, волнообразное, с периодами обострений и ремиссий, во время которых уровень тромбоцитов может нормализоваться. В ряде случаев заболевание компенсировано и манифестирует только при воздействии провоцирующих факторов, чаще всего на фоне инфекции.
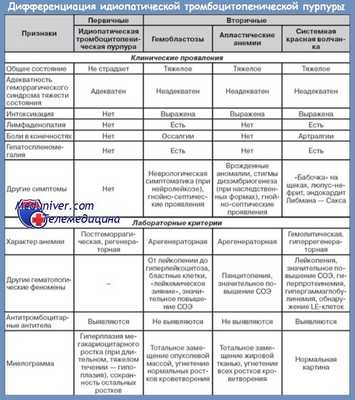
Дифференциальная диагностика идиопатической тромбоцитопенической пурпуры
Дифференциальная диагностика идиопатической тромбоцитопенической пурпуры требует в первую очередь выделения форм тромбоцитопений: повышенный периферический лизис, сокращение продолжительности жизни и преувеличенный медуллярный тромбоцитопоэз, при котором богатое мегакариоцитарное население с функциональными но и с юными формами означает повышенный тромбоцитарный турновер.
Характер идиопатической болезни следует устанавливать по этиологическому условию, в котором невозможно выявить при помощи анамнеза и лабораторных тестов тромбоцитопенизирующую причину, выражающуюся либо посредством периферического тромбоцитарного лизиса, либо сокращением производства тромбоцитов. С этой точки зрения дифференциальная диагностика должна отличать формы тромбоцитопений по поводу дефицита производства от форм по поводу тромбоцитарного лизиса.
За некоторыми исключениями, тромбоцитопении по поводу медуллярной дисфункции являются вторичными: токсические или инфекционные аплазирующие причины, медуллярные инфильтрации при лейкемиях, лимфомы, метастазы, а также и медуллярный лимфоидный склероз, остеомиэлосклероз, гепатоспленический туберкулез и пр. К этому добавляются менее суровые вторичные тромбоцитопении, обычно без пурпуры, при анемии Бирмера и пароксизмальной ночной гемоглобинурии.
Рассматривая современную концепцию форм идиопатической тромбоцитопенической пурпуры по поводу акцентуирования периферического тромбоцитарного лизиса, их следует отличать от вторичных форм по поводу сокращения тромбоцитов в известных патологических тромбоцитопенизирующих состояниях, в том числе: синдром гиперспленизма, затем тромбоцитопении при вирусных инфекциях или других септических состояниях с прямым диструктивным действием на тромбоциты.
Затем существуют тромбоцитопении при уремиях и преходящие тромбоцитопении при больших геморрагиях с массивными потерями кровяного объема, тромбоцитопении по поводу экстракорпореальной перфузии и по поводу анафилактического шока.
Высокохарактерными являются тромбоцитопении при идиопатической тромбоцитопенической пурпуре, синдроме Evans, а также и тромбоцитопении по поводу изоиммунизации у новорожденных или пострансфузионные. Особое место занимают тромбопенические пурпуры благодаря действию медикаментов, в ряду которых отличаются формы по поводу прямого действия медикаментов на тромбоциты или по поводу токсического действия на мегакариоциты, которые отличаются от тромбоцитопении по поводу иммуносенсибилизирующего действия медикаментов.
Обе группы тромбоцитопении, по поводу изоиммунизации и по поводу сенсибилизации к медикаментам, являются характерными формами, которые следует дифференцировать, при помощи специальных тестов от идиопатической тромбоцитопенической пурпуры.
Пурпуры по поводу гиперспленизма обычно ассоциированы с гемоцитопениями, детерминированными повышенной секвестрацией при конгестивных спленомегалиях по поводу спленопортальной блокаде, обычно при хроническом гепатите и циррозе, или из-за обструкций спленической вены, а также из-за некоторых интраспленических циркуляторных расстройств (Teodorescu и Berceanu); к секвестрационному механизму добавляется иногда образование антиглобулиновых автоантител, как при идиопатической тромбоцитопенической пурпуре.
Практически, первичные идиопатические тромбоцитопенические пурпуры, появляющиеся в 50% случаях, следует отличать от тромбоцитопенических пурпур, идиопатических на первый взгляд, но которые появляются спустя 1—4 недели после вирусной инфекции. Кроме этого следует тщательно исследовать не появляется ли кажущаяся идиопатическая форма в рамках другого автоиммунного заболевания.
Таким образом идиопатические тромбоцитопенические пурпуры с первичными или вторичными поствирусными формами, или же в рамках других автоиммунных заболеваний образует ту клиническую и гематологическую единицу, в которой патогенез по-видимому единый, то есть путем иммунилогического механизма. Признавая аутоиммунную природу для всех форм, даже если и не выявляются автоантитела, необходимо установить при дифференциальной диагностике несколько клиникогематологических форм со специальной этиологией.
Читайте также:
- Подготовка к гистерорезектоскопии. Психопрофилактика перед гистерорезектоскопией
- Нарушения менструаций при аденоме гипофиза. Диагностика и лечение
- КТ при расщепленном атланте
- Симптомы пищевого отравления - лечение и профилактика
- Схемы химиотерапии болезни Ходжкина - монохимиотерапия, полихимиотерапия
