Нефротический синдром. Функция нефронов при хронической почечной недостаточности
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Нефротический синдром. Функция нефронов при хронической почечной недостаточности
а) Нефротический синдром. Выделение белка с мочой вследствие повышенной проницаемости клубочков. При заболеваниях почек часто встречается состояние, называемое нефротический синдромом, для которого характерна значительная потеря белка с мочой. В некоторых случаях оно возникает при отсутствии других выявленных нарушений почечных функций, однако наиболее часто эта патология связана с определенной степенью почечной недостаточности.
Причиной потерь белка с мочой является повышенная проницаемость мембраны клубочков, поэтому любая патология, которая увеличивает проницаемость этой мембраны, способна вызвать развитие нефротического синдрома. Такими заболеваниями являются: (1) хронический гломерулонефрит, при котором происходит первичное поражение клубочков, часто сопровождаемое существенным повышением проницаемости фильтрационной мембраны; (2) амилоидозу приводящий к отложению патологического белка в стенках кровеносных сосудов, что является причиной тяжелых повреждений базальной мембраны клубочков; (3) нефротический синдром при болезни минимальных изменений^ когда при световой микроскопии в мембранах клубочков не удается выявить значительной патологии.
Нефропатия минимальных изменений связана с потерей отрицательного заряда, которым в норме обладает базальная мембрана почечных клубочков. С помощью иммунологических методов также показано, что в некоторых случаях потеря отрицательного заряда может обусловливаться связыванием с базальной мембраной антител. Потеря отрицательного заряда базальной мембраной клубочков позволяет белкам плазмы, особенно альбумину, проходить в первичную мочу. В норме белки плазмы не способны проходить через почечный фильтр, поскольку отрицательный заряд на поверхности базальной мембраны клубочков с помощью электростатических сил отталкивает отрицательно заряженные молекулы белков плазмы.
Нефропатия минимальных изменений наиболее часто встречается у детей в возрасте от 2 до 6 лет, но может возникать и у взрослых. Повышенная проницаемость капиллярной мембраны клубочков иногда приводит к потере до 40 г белка плазмы в сутки, что крайне опасно для организма маленького ребенка, поскольку содержание белка в плазме в этом случае падает ниже 2 г/дл, а онкотическое давление — ниже 10 мм рт. ст. (в норме оно составляет 28 мм рт. ст.). В результате такого падения онкотического давления большое количество жидкости переходит из капилляров в ткани, вызывая развитие тяжелых отеков.
Функция нефронов при хронической почечной недостаточности
а) Потеря функционирующих нефронов требует от еще сохранившихся выделять больше жидкости и растворенных веществ. Предположение о том, что снижение числа нормально функционирующих нефронов, сопровождаемое падением СКФ, должно также сопровождаться значительным уменьшением выделения воды и растворенных веществ, является вполне обоснованным. Несмотря на это у больных, почки которых потеряли до 75% функционирующих нефронов, способность поддерживать выделение воды и электролитов, не накапливая их в жидких средах, сохраняется на нормальном уровне. Однако дальнейшее снижение числа нефронов приводит к задержке жидкости и электролитов. Уменьшение числа действующих нефронов ниже уровня 5-10% считается летальным.
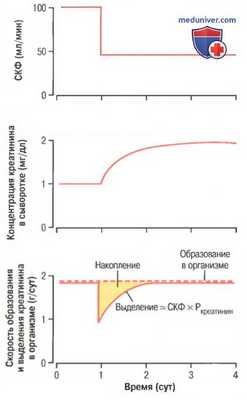
В противоположность электролитам накопление некоторых продуктов метаболизма происходит почти в соответствии с числом потерянных нефронов. Причина накопления в организме мочевины и креатинина заключается в том, что их выделение в основном зависит от фильтрации в клубочках. Эти вещества в отличие от электролитов интенсивно не реабсорбируются. Креатинин, например, не реабсорбируется совсем, его выделение равно количеству, прошедшему через почечный фильтр.
Скорость фильтрации креатинина = СКФ х Концентрация креатинина в плазме = Скорость выделения креатинина с мочой.
При снижении СКФ выделение креатинина с мочой временно также уменьшается, вызывая его накопление в жидких средах и плазме, которое длится до тех пор, пока скорость выделения креатинина не возвратится к величине, соответствующей скорости его образования в организме (для облегчения понимания просим вас изучить рисунок ниже).
Влияние уменьшения скорости клубочковой фильтрации в 2 раза на концентрацию креатинина в сыворотке и скорость выделения его с мочой при постоянной скорости образования креатинина в организме
Таким образом, при установлении равновесия выделение креатинина из организма, несмотря на уменьшение СКФ, будет равно количеству, образованному в организме. Восстановление нормальной скорости выделения креатинина происходит вследствие увеличения его концентрации в плазме (для облегчения понимания просим вас изучить рисунок ниже).
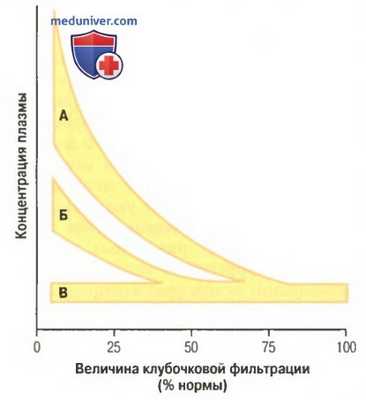
Варианты приспособительных реакций выделения различных веществ при хронической почечной недостаточности.
Кривая А отражает приблизительные изменения концентрации веществ, которые фильтруются, но плохо реабсорбируются, например креатинин и мочевина.
Кривая Б приблизительно соответствует концентрации для таких растворенных веществ, как фосфаты и ураты.
Кривая В приблизительно соответствует содержанию таких веществ, как ионы Na+ и Cl-
Выделение некоторых растворенных веществ, например фосфатов, уратов и ионов водорода, часто поддерживается на нормальном уровне до тех пор, пока СКФ не составит 20-30% нормы. При дальнейшем падении СКФ концентрация этих веществ в плазме (см. рисунок выше, кривая Б), растет непропорционально снижению СКФ. Поддержание относительно постоянной концентрации этих веществ в плазме при падении СКФ осуществляется за счет постепенного увеличения их выделения. Это происходит благодаря снижению реабсорбции или в некоторых случаях — за счет увеличения секреции этих веществ в канальцах.
Концентрация ионов Na+ и Сl в плазме поддерживается практически на постоянном уровне даже при значительном уменьшении СКФ(см. рисунок выше, кривая В). Данная задача выполняется за счет существенного уменьшения реабсорбции этих ионов в канальцах. Например, при утрате 75% функционирующих нефронов каждый сохранившийся должен выделять по сравнению с нормой в 4 раза больше ионов натрия и воды (для облегчения понимания просим вас изучить таблицу ниже).
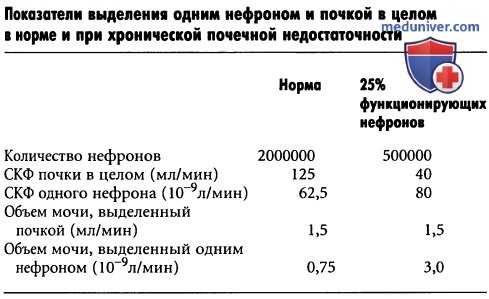
Эта адаптация частично происходит из-за увеличения притока крови к почкам и возрастания СКФ в сохранившихся нефронах благодаря гипертрофии кровеносных сосудов и клубочков, а также функциональным изменениям, которые вызывают вазодилатацию. Даже при большом снижении суммарной СКФ показатели выделения благодаря снижению интенсивности реабсорбции воды и растворенных веществ в канальцах могут по-прежнему соответствовать норме.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хронический гломерулонефрит. Поражение паренхимы почек при пиелонефрите
а) Поражение клубочков при гломерулонефрите как причина хронической почечной недостаточности. Хронический гломерулонефрит> может встречаться при заболеваниях, которые вызывают воспаление и повреждение капилляров клубочков. В отличие от острой формы этой патологии хронический гломерулонефрит относят к категории медленно прогрессирующих заболеваний, часто приводящих к необратимым изменениям в ткани почки. Причиной хронического гломерулонефрита может стать как непосредственно острое заболевание почек, так и вторичное поражение при системных заболеваниях, например при системной красной волчанке.
В большинстве случаев хронический гломерулонефрит начинается с отложения иммунных комплексов на базальной мембране клубочков. В противоположность острой форме заболевания стрептококковая инфекция составляет лишь небольшой процент среди причин хронического гломерулонефрита. В результате накопления комплексов антиген-антитело, откладываемых в мембранах клубочков, возникает воспаление, приводящее к постепенному утолщению мембран, в итоге заканчивающееся разрастанием фиброзной ткани.
Последующие этапы заболевания характеризуются значительным снижением коэффициента фильтрации вследствие уменьшения числа функционирующих капилляров и утолщения мембран клубочков. Для конечных стадий заболевания характерна замена клубочков фиброзной тканью, что сопровождается снижением фильтрационной способности.

б) Поражение паренхимы почки при пиелонефрите как причина хронической почечной недостаточности. Непосредственное или вызванное другим заболеванием поражение паренхимы почки называют интерстициальным нефритом. Основными причинами развития данной патологии могут являться повреждения сосудов, клубочков и канальцев, в результате разрушаются отдельные нефроны.
Непосредственное повреждающее действие на паренхиму почек оказывают также яды, лекарственные препараты и бактериальная инфекция. Повреждение паренхимы почек, вызванное бактериальной инфекцией, называют пиелонефритом. Его развитие может быть вызвано различными видами бактерий, однако особая роль здесь принадлежит Е. coli, причиной заражения служит фекальное загрязнение мочевыводящих путей.
Бактерии попадают в паренхиму почки с током крови либо, что является наиболее частым способом, восхождением инфекции вверх по мо-чевыводящим путям.
В норме мочевой пузырь способен легко освобождаться от бактериального загрязнения, но при патологии существуют два условия, которые препятствуют этому процессу: (1) невозможность полного опорожнения пузыря при мочеиспускании, способствующее скоплению в нем остаточной мочи; (2) существование физической преграды, препятствующей истечению мочи.
Нарушение способности пузыря освобождаться от бактерий приводит к их размножению в просвете и воспалению. Такое состояние называют циститом. Возникшее воспаление может не распространяться, оставаясь местным, однако у некоторых больных бактерии все же способны достичь лоханок почки. Причиной этого служит патологический заброс мочи вверх по одному или обоим мочеточникам во время мочеиспускания. Обратное движение мочи называют пузырно-мочеточниковым рефлюксом, оно является следствием недостаточного сокращения стенок пузыря в месте впадения мочеточников во время мочеиспускания. В результате небольшое количество мочи, содержащей бактерии, направляется вверх к почке и может достичь лоханок, инфицируя мозговой слой и способствуя развитию в нем воспалительной реакции.
Пиелонефрит развивается в мозговом слое почки, поэтому на начальных этапах заболевания деятельность мозгового слоя почек страдает в большей степени, чем функция коры. Способность выделять концентрированную мочу у больных пиелонефритом бывает часто нарушена, т.к. одной из главных функций мозгового слоя является обеспечение противотока жидкости, необходимого для концентрирования мочи.
При длительном течении заболевания бактериальное инфицирование оказывает повреждающее действие не только на мозговой слой, но и на канальцы, клубочки и другие почечные структуры, вследствие этого происходит потеря значительной части функционирующей ткани почек, способствуя развитию хронической почечной недостаточности.
Нефротический синдром
Нефротический синдром – это симптомокомплекс, развивающийся на фоне поражения почек, включающий массивную протеинурию, нарушения белково-липидного обмена и отеки. Патология сопровождается гипоальбуминемией, диспротеинемией, гиперлипидемией, отеками различной локализации (вплоть до анасарки и водянки серозных полостей), дистрофическими изменениями кожи и слизистых. В диагностике важную роль играет клинико-лабораторная картина: изменения в биохимических анализах крови и мочи, ренальная и экстраренальная симптоматика, данные биопсии почки. Лечение нефротического синдрома консервативное, включающее назначение диеты, инфузионной терапии, диуретиков, антибиотиков, кортикостероидов, цитостатиков.
МКБ-10
Общие сведения
Нефротический синдром может развиваться на фоне широкого круга урологических, системных, инфекционных, хронических нагноительных, метаболических заболеваний. В современной урологии данный симптомокомплекс осложняет течение заболеваний почек примерно в 20% случаев. Патология чаще развивается у взрослых (30-40 лет), реже у детей и пожилых пациентов. Наблюдается классическая тетрада признаков: протеинурия (свыше 3,5 г/сут.), гипоальбуминемия и гипопротеинемия (менее 60-50 г/л), гиперлипидемия (холестерин более 6,5 ммоль/л), отеки. При отсутствии одного или двух проявлений говорят о неполном (редуцированном) нефротическом синдроме.
Причины
По происхождению нефротический синдром может быть первичным (осложняющим самостоятельные заболевания почек) или вторичным (следствием заболеваний, протекающих с вторичным вовлечением почек). Первичная патология встречается при гломерулонефрите, пиелонефрите, первичном амилоидозе, нефропатии беременных, опухолях почек (гипернефроме).
Вторичный симптомокомплекс может быть обусловлен многочисленными состояниями: коллагенозами и ревматическими поражениями (СКВ, узелковым периартериитом, геморрагическим васкулитом, склеродермией, ревматизмом, ревматоидным артритом); нагноительными процессами (бронхоэктазами, абсцессами легких, септическим эндокардитом); болезнями лимфатической системы (лимфомой, лимфогранулематозом); инфекционными и паразитарными заболеваниями (туберкулезом, малярией, сифилисом).
В ряде случаев нефротический синдром развивается на фоне лекарственной болезни, тяжелых аллергозов, отравлений тяжелыми металлами (ртутью, свинцом), укусов пчел и змей. Иногда, преимущественно у детей, причину нефротического синдрома выявить не удается, что позволяет выделить идиопатический вариант заболевания.
Патогенез
Среди концепций патогенеза наиболее распространенной и обоснованной является иммунологическая теория, в пользу которой свидетельствует высокая частота возникновения синдрома при аллергических и аутоиммунных заболеваниях и хороший отклик на иммуносупрессивную терапию. При этом образующиеся в крови циркулирующие иммунные комплексы являются результатом взаимодействия антител с внутренними (ДНК, криоглобулинами, денатурированными нуклеопротеидами, белками) или внешними (вирусными, бактериальными, пищевыми, медикаментозными) антигенами.
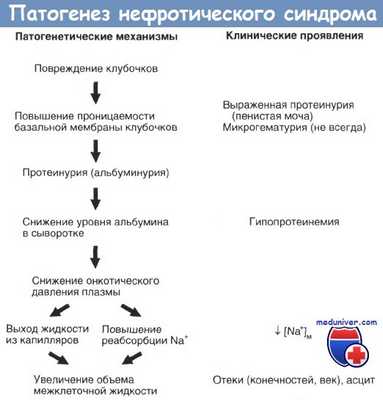
Иногда антитела образуются непосредственно к базальной мембране почечных клубочков. Осаждение иммунных комплексов в ткани почек вызывает воспалительную реакцию, нарушение микроциркуляции в клубочковых капиллярах, развитие повышенной внутрисосудистой коагуляции. Изменение проницаемости клубочкового фильтра при нефротическом синдроме ведет к нарушению абсорбции белка и его попаданию в мочу (протеинурия).
Ввиду массивной потери белка в крови развивается гипопротеинемия, гипоальбуминемия и тесно связанная с нарушением белкового обмена гиперлипидемия (повышение холестерина, триглицеридов и фосфолипидов). Появление отеков обусловлено гипоальбуминемией, снижением осмотического давления, гиповолемией, уменьшением ренального кровотока, усиленной продукцией альдостерона и ренина, реабсорбцией натрия.
Макроскопически почки имеют увеличенные размеры, гладкую и ровную поверхность. Корковый слой на разрезе бледно-серый, а мозговой - красноватый. Микроскопическое изучение тканевой картины почки позволяет увидеть изменения, характеризующие не только нефротический синдром, но и ведущую патологию (амилоидоз, гломерулонефрит, коллагенозы, туберкулез). Собственно нефротический синдром в гистологическом плане характеризуется нарушениями структуры подоцитов (клеток капсулы клубочков) и базальных мембран капилляров.
Симптомы
Признаки нефротического синдрома однотипны, несмотря на различие вызывающих его причин. Ведущим проявлением служит протеинурия, достигающая 3,5-5 и более г/сутки, причем до 90% выводимого с мочой белка составляют альбумины. Массивная потеря белковых соединений вызывает снижение уровня общего сывороточного белка до 60-40 и менее г/л. Задержка жидкости может проявляться периферическими отеками, асцитом, генерализованным отеком подкожной клетчатки (анасаркой), гидротораксом, гидроперикардом.
Прогрессирование нефротического синдрома сопровождается общей слабостью, сухостью во рту, жаждой, потерей аппетита, головной болью, тяжестью в пояснице, рвотой, вздутием живота, поносом. Характерным признаком служит олигурия с суточным диурезом менее 1 л. Возможны явления парестезии, миалгия, судороги. Развитие гидроторакса и гидроперикарда вызывает одышку при движении и в покое. Периферические отеки сковывают двигательную активность больного. Пациенты вялые, малоподвижные, бледные; отмечают повышенное шелушение и сухость кожи, ломкость волос и ногтей.
Нефротический синдром может развиваться постепенно или бурно; сопровождаться менее и более выраженной симптоматикой, что зависит от характера течения основного заболевания. По клиническому течению различаются 2 варианта патологии – чистый и смешанный. В первом случае синдром протекает без гематурии и гипертензии; во втором может принимать нефротически-гематурическую или нефротически-гипертоническую форму.
Осложнения
Осложнениями нефротического синдрома могут стать периферические флеботромбозы, вирусные, бактериальные и грибковые инфекции. В отдельных случаях наблюдается отек мозга или сетчатки, нефротический криз (гиповолемический шок).
Диагностика
Ведущими критериями распознавания нефротического синдрома служат клинико-лабораторные данные. Объективный осмотр выявляет бледные («перламутровые»), холодные и сухие на ощупь кожные покровы, обложенность языка, увеличение размеров живота, гепатомегалию, отеки. При гидроперикарде отмечается расширение границ сердца и приглушение тонов; при гидротораксе – укорочение перкуторного звука, ослабленное дыхание, застойные мелкопузырчатые хрипы. На ЭКГ регистрируется брадикардия, признаки дистрофии миокарда.
В общем анализе мочи определяется повышенная относительная плотность (1030-1040), лейкоцитурия, цилиндрурия, наличие в осадке кристаллов холестерина и капель нейтрального жира, редко – микрогематурия. В периферической крови – увеличение СОЭ (до 60-80 мм/ч), преходящая эозинофилия, увеличение числа тромбоцитов (до 500-600 тыс.), небольшое снижение уровня гемоглобина и эритроцитов. Нарушение свертываемости, выявляемые с помощью исследования коагулограммы, могут выражаться в небольшом повышении или развитии признаков ДВС-синдрома.
Исследование биохимического анализа крови подтверждает характерную гипоальбуминемию и гипопротеинемию (менее 60-50 г/л), гиперхолестеринемию (холестерин более 6,5 ммоль/л); в биохимическом анализе мочи определяется протеинурия свыше 3,5 г в сутки. Для выяснения степени выраженности изменений почечной ткани может потребоваться проведение УЗИ почек, УЗДГ почечных сосудов, нефросцинтиграфии.
С целью патогенетической обоснованности лечения нефротического синдрома крайне важно установление причины его развития, в связи с чем требуется углубленное обследование с выполнением иммунологических, ангиографических исследований, а также биопсии почки, десны или прямой кишки с морфологическим исследованием биоптатов.
Лечение нефротического синдрома
Терапия проводится стационарно под наблюдением врача-нефролога. Общими лечебными мероприятиями, не зависящими от этиологии нефротического синдрома, служат назначение бессолевой диеты с ограничением жидкости, постельного режима, симптоматической лекарственной терапии (диуретиков, препаратов калия, антигистаминных средств, витаминов, сердечных средств, антибиотиков, гепарина), инфузионное введение альбумина, реополиглюкина.
При неясном генезе, состоянии, обусловленном токсическим или аутоиммунным поражением почек, показана стероидная терапия преднизолоном или метилпреднизолоном (перорально или внутривенно в режиме пульс-терапии). Иммуносупрессивная терапия стероидами подавляет образование антител, ЦИК, улучшает почечный кровоток и клубочковую фильтрацию. Хорошего эффекта лечения гормонорезистентного варианта патологии позволяет добиться цитостатическая терапия циклофосфамидом и хлорамбуцилом, проводимая пульс-курсами. В период ремиссии показано лечение на специализированных климатических курортах.
Прогноз и профилактика
Течение и прогноз тесно связаны с характером развития основного заболевания. В целом устранение этиологических факторов, своевременное и правильное лечение позволяет восстановить функции почек и достичь полной стабильной ремиссии. При неустраненных причинах синдром может принимать персистирующее или рецидивирующее течение с исходом в хроническую почечную недостаточность.
Профилактика включает раннее и тщательное лечение почечной и внепочечной патологии, которая может осложниться развитием нефротического синдрома, осторожное и контролируемое применение лекарственных средств, обладающих нефротоксическим и аллергическим действием.
Поражения почечных канальцев. Глюкозурия, аминоацидурия, фосфатурия
В статьях на сайте ранее отмечалось (просим вас пользоваться формой поиска выше), что транспорт веществ через мембраны эпителия канальцев осуществляется с помощью нескольких механизмов. В разделе сайта по выделению в почках говорилось о том, что в клетке синтез любого белка кодируется определенным геном, расположенным в ядре клетки. Если необходимый ген отсутствует или является дефектным, эпителиоциты канальцев могут быть частично или полностью лишены белка, необходимого для транспорта растворенного вещества. Существует ряд наследственных нарушений транспорта отдельных веществ или целых групп соединений через мембраны эпителия канальцев. Кроме того, тяжелые нарушения функции канальцев могут быть вызваны повреждением мембраны эпителиоцитов в результате действия токсинов или ишемии ткани почки.
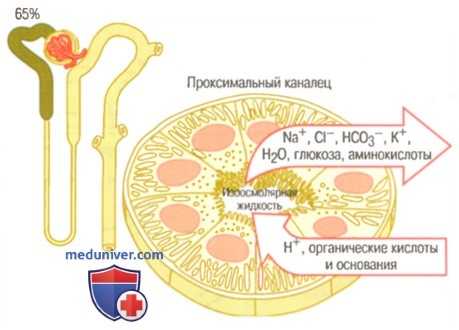
Ультраструктура клетки и главные особенности транспорта в проксимальном канальце. Проксимальные канальцы реабсорбируют около 65% натрия, хлора, бикарбонатов, калия, а также почти всю глюкозу и аминокислоты, попавшие в первичную мочу. Здесь также происходит секреция в просвет канальцев органических кислот, оснований и протонов
а) Глюкозурия - невозможность почек реабсорбировать глюкозу. При этом состоянии концентрация глюкозы в крови может быть нормальной, однако транспортный механизм реабсорбции в канальцах может быть существенно ограничен или отсутствовать. Поэтому, несмотря на нормальный уровень глюкозы в крови, она в большом количестве ежедневно выделяется с мочой. Глюкозурия является состоянием с относительно благоприятным течением, ее следует в первую очередь дифференцировать от тяжелой патологии, которая также связана с присутствием глюкозы в моче (сахарным диабетом).
б) Аминоацидурия - нарушение реабсорбции аминокислот. Реабсорбция многих аминокислот осуществляется с использованием общих переносчиков, а для некоторых из них существуют свои отдельные транспортные системы. Состояние, при котором нарушена реабсорбция всех аминокислот, называемое неселективной аминоацидурией, встречается редко; более часто отмечаются нарушения специфических транспортных систем, выражающихся в виде: (1) идиопатической цистинурии, когда большое количество аминокислоты цистеина не реабсорбируется и попадает в конечную мочу, где выпадает в виде кристаллов, формируя почечные камни; (2) глицинурии при которой не реабсорбируется аминокислота глицин; (3) бета-аминоизобутирикоацидурии, которая встречается примерно у 5% населения.
в) Гипофосфатемия, вызванная потерей фосфатов почками. При этой патологии возникает нарушение реабсорбции фосфатов в почечных канальцах, что приводит к существенному снижению количества ионов фосфата в жидких средах. Это состояние обычно не вызывает тяжелых и резких нарушений гомеостаза, поскольку содержание данных ионов во внеклеточной жидкости может меняться в широких пределах, не приводя при этом к нарушению клеточных функций. Наличие низкого уровня фосфатов в течение длительного периода времени приводит к снижению кальцификации костной ткани и рахиту у детей.
Эта разновидность рахита в отличие от его обычной формы, быстро поддающейся лечению витамином D, резистентна к подобной терапии.
г) Нефрогенная форма ацидоза, обусловленная неспособностью канальцев выделять ионы водорода. При этой форме ацидоза клетки канальцев не в состоянии секретировать в просвет канальцев необходимое количество ионов водорода. В результате с мочой выделяется большое количество ионов бикарбоната, что способствует установлению длительного метаболического ацидоза. Этот вариант патологии может быть обусловлен наследственными заболеваниями или возникать в результате обширного поражения почечных канальцев.
Нефрогенная форма несахарного диабета, которая выражается нечувствительностью почек к действию антидиуретического гормона. Изредка встречается патология, при которой почечные канальцы не реагируют на присутствие антидиуретического гормона, вызывая выделение большого количества разведенной мочи. Если потребление жидкости не ограничивать, то подобное состояние осложняется редко. Но если при данной патологии доступ этих больных к воде ограничен, быстро возникают явления обезвоживания организма.
Хроническая почечная недостаточность
Хроническая почечная недостаточность – это постепенное угасание почечных функций, обусловленное гибелью нефронов вследствие хронического заболевания почек. На начальных стадиях протекает бессимптомно, в последующем присоединяются расстройства общего состояния и мочевыделения, отеки, кожный зуд. Постепенное ухудшение функции почек приводит к нарушению жизнедеятельности организма, возникновению осложнений со стороны различных органов и систем. Диагностика включает клинические и биохимические анализы, пробы Реберга и Зимницкого, УЗИ почек, УЗДГ почечных сосудов. Лечение ХПН основано на терапии основного заболевания, устранении симптоматики и повторных курсах экстракорпоральной гемокоррекции.
Хроническая почечная недостаточность (ХПН) – необратимое нарушение фильтрационной и выделительной функций почек, вплоть до полного их прекращения, вследствие гибели почечной ткани. ХПН имеет прогрессирующее течение, на ранних стадиях проявляется общим недомоганием. При нарастании ХПН – выраженные симптомы интоксикации организма: слабость, потеря аппетита, тошнота, рвота, отеки, кожные покровы - сухие, бледно-желтые. Резко, иногда до нуля, снижается диурез. На поздних стадиях развивается сердечная недостаточность, отек легких, склонность к кровотечениям, энцефалопатия, уремическая кома. Показаны гемодиализ и пересадка почки.
Причины ХПН
Хроническая почечная недостаточность может становиться исходом хронического гломерулонефрита, нефритов при системных заболеваниях, наследственных нефритов, хронического пиелонефрита, диабетического гломерулосклероза, амилоидоза почек, поликистоза почек, нефроангиосклероза и других заболеваний, которые поражают обе почки или единственную почку.
В основе патогенеза лежит прогрессирующая гибель нефронов. Вначале почечные процессы становятся менее эффективными, затем нарушается функция почек. Морфологическая картина определяется основным заболеванием. Гистологическое исследование свидетельствует о гибели паренхимы, которая замещается соединительной тканью. Развитию ХПН предшествует период страдания хроническим заболеванием почек длительностью от 2 до 10 и более лет. Течение болезни почек до начала ХПН можно условно подразделить на ряд стадий. Определение этих стадий представляет практический интерес, поскольку влияет на выбор тактики лечения.
Классификация
Выделяют следующие стадии хронической почечной недостаточности:
- Латентная. Протекает без выраженных симптомов. Обычно выявляется только по результатам углубленных клинических исследований. Клубочковая фильтрация снижена до 50-60 мл/мин, отмечается периодическая протеинурия.
- Компенсированная. Пациента беспокоит повышенная утомляемость, ощущение сухости во рту. Увеличение объема мочи при снижении ее относительной плотности. Снижение клубочковой фильтрации до 49-30 мл/мин. Повышен уровень креатинина и мочевины.
- Интермиттирующая. Выраженность клинических симптомов усиливается. Возникают осложнения, обусловленные нарастающей ХПН. Состояние пациента изменяется волнообразно. Снижение клубочковой фильтрации до 29-15 мл/мин, ацидоз, стойкое повышение уровня креатинина.
- Терминальная. Харатеризуется постепенным снижением диуреза, нарастанием отеков, грубыми нарушениями кислотно-щелочного и водно-солевого обмена. Наблюдаются явления сердечной недостаточности, застойные явления в печени и легких, дистрофия печени, полисерозит.
Симптомы ХПН
В период, предшествующий развитию хронической почечной недостаточности, почечные процессы сохраняются. Уровень клубочковой фильтрации и канальцевой реабсорбции не нарушен. В последующем клубочковая фильтрация постепенно снижается, почки теряют способность концентрировать мочу, начинают страдать почечные процессы. На этой стадии гомеостаз еще не нарушен. В дальнейшем количество функционирующих нефронов продолжает уменьшаться, и при снижении клубочковой фильтации до 50-60 мл/мин у больного появляются первые признаки ХПН.
Пациенты с латентной стадией ХПН жалоб обычно не предъявляют. В некоторых случаях они отмечают нерезко выраженную слабость и снижение работоспособности. Больных с ХПН в компенсированной стадии беспокоит снижение работоспособности, повышенная утомляемость, периодическое ощущение сухости во рту. При интермиттирующей стадии ХПН симптомы становятся более выраженными. Слабость нарастает, больные жалуются на постоянную жажду и сухость во рту. Аппетит снижен. Кожа бледная, сухая.
Пациенты с терминальной стадией ХПН худеют, их кожа становится серо-желтой, дряблой. Характерен кожный зуд, сниженный мышечный тонус, тремор кистей и пальцев, мелкие подергивания мышц. Жажда и сухость во рту усиливается. Пациенты апатичны, сонливы, не могут сосредоточиться.
При нарастании интоксикации появляется характерный запах аммиака изо рта, тошнота и рвота. Периоды апатии сменяются возбуждением, больной заторможен, неадекватен. Характерна дистрофия, гипотермия, охриплость голоса, отсутствие аппетита, афтозный стоматит. Живот вздут, частая рвота, понос. Стул темный, зловонный. Больные предъявляют жалобы на мучительный кожный зуд и частые мышечные подергивания. Нарастает анемия, развивается геморрагический синдром и почечная остеодистрофия. Типичными проявлениями ХПН в терминальной стадии являются миокардит, перикардит, энцефалопатия, отек легких, асцит, желудочно-кишечные кровотечения, уремическая кома.
ХПН характеризуется нарастающими нарушениями со стороны всех органов и систем. Изменения крови включают анемию, обусловленную как угнетением кроветворения, так и сокращением жизни эритроцитов. Отмечают нарушения свертываемости: удлинение времени кровотечения, тромбоцитопению, уменьшение количества протромбина. Со стороны сердца и легких наблюдается артериальная гипертензия (более чем у половины больных), застойная сердечная недостаточность, перикардит, миокардит. На поздних стадиях развивается уремический пневмонит.
Неврологические изменения на ранних стадиях включают рассеянность и нарушение сна, на поздних – заторможенность, спутанность сознания, в некоторых случаях бред и галлюцинации. Со стороны периферической нервной системы обнаруживается периферическая полинейропатия. Со стороны ЖКТ на ранних стадиях выявляется ухудшение аппетита, сухость во рту. Позже появляется отрыжка, тошнота, рвота, стоматит. В результате раздражения слизистой при выделении продуктов метаболизма развивается энтероколит и атрофический гастрит. Образуются поверхностные язвы желудка и кишечника, нередко становящиеся источниками кровотечения.
Со стороны опорно-двигательного аппарата для ХПН характерны различные формы остеодистрофии (остеопороз, остеосклероз, остеомаляция, фиброзный остеит). Клинические проявления почечной остеодистрофии – спонтанные переломы, деформации скелета, сдавление позвонков, артриты, боли в костях и мышцах. Со стороны иммунной системы при ХПН развивается лимфоцитопения. Снижение иммунитета обуславливает высокую частоту возникновения гнойно-септических осложнений.
При подозрении на развитие хронической почечной недостаточности пациенту необходима консультация нефролога и проведение лабораторных исследований: биохимический анализ крови и мочи, проба Реберга. Основанием для постановки диагноза становится снижение уровня клубочковой фильтрации, возрастание уровня креатинина и мочевины.
При проведении пробы Зимницкого выявляется изогипостенурия. УЗИ почек свидетельствует о снижении толщины паренхимы и уменьшении размера почек. Снижение внутриорганного и магистрального почечного кровотока выявляется на УЗДГ сосудов почек. Рентгенконтрастную урографию следует применять с осторожностью из-за нефротоксичности многих контрастных препаратов. Перечень других диагностических процедур определяется характером патологии, ставшей причиной развития ХПН.
Лечение хронической почечной недостаточности
Специалисты в сфере современной урологии и нефрологии располагают обширными возможностями в лечении ХПН. Своевременное лечение, направленное на достижение стойкой ремиссии нередко позволяет существенно замедлить развитие патологии и отсрочить появление выраженных клинических симптомов.
Лечение основного заболевания
При проведении терапии больному с ранней стадией ХПН особое внимание уделяется мероприятиям по предотвращению прогрессирования основного заболевания. Лечение основного заболевания продолжается и при нарушении почечных процессов, но в этот период увеличивается значение симптоматической терапии. При необходимости назначают антибактериальные и гипотензивные препараты. Показано санаторно-курортное лечение.
Требуется контроль уровня клубочковой фильтрации, концентрационной функции почек, почечного кровотока, уровня мочевины и креатинина. При нарушениях гомеостаза проводится коррекция кислотно-щелочного состава, азотемии и водно-солевого баланса крови. Симптоматическое лечение заключается в лечении анемического, геморрагического и гипертонического синдромов, поддержании нормальной сердечной деятельности.
Диета
Больным с хронической почечной недостаточностью назначается высококалорийная (примерно 3000 калорий) низкобелковая диета, включающая незаменимые аминокислоты. Необходимо снизить количество соли (до 2-3 г/сут), а при развитии выраженной гипертонии – перевести больного на бессолевую диету. Содержание белка в рационе зависит от степени нарушения почечных функций, при клубочковой фильтрации ниже 50 мл/мин количество белка уменьшается до 30-40 г/сут, при уменьшении показателя ниже 20 мл/мин - до 20-24 г/сут.
Симптоматическая терапия
При развитии почечной остеодистрофии назначают витамин D и глюконат кальция. Следует помнить об опасности кальцификации внутренних органов, вызванной большими дозами витамина D при гиперфосфатемии. Для устранения гиперфосфатемии назначают сорбитол+гидроксид алюминия. Во время терапии контролируется уровень фосфора и кальция в крови. Коррекция кислотно-щелочного состава проводится 5% раствором гидрокарбоната натрия внутривенно. При олигурии для увеличения объема выделяемой мочи назначают фуросемид в дозировке, которая обеспечивает полиурию. Для нормализации АД применяют стандартные гипотензивные препараты в сочетании с фуросемидом.
При анемии назначают препараты железа, андрогены и фолиевую кислоту, при снижении гематокрита до 25% проводят дробные переливания эритроцитной массы. Дозировка химиотерапевтических препаратов и антибиотиков определяется в зависимости от способа выведения. Дозы сульфаниламидов, цефалоридина, метициллина, ампициллина и пенициллина уменьшают в 2-3 раза. При приеме полимиксина, неомицина, мономицина и стрептомицина даже в малых дозах возможно развитие осложнений (неврит слухового нерва и др.). Больным ХПН противопоказаны производные нитрофуранов.
Использовать гликозиды при терапии сердечной недостаточности следует с осторожностью. Дозировка уменьшается, особенно при развитии гипокалиемии. Больным с интермиттирующей стадией ХПН в период обострения назначают гемодиализ. После улучшения состояния пациента вновь переводят на консервативное лечение.
Экстракорпоральные методы детоксикации
Эффективно назначение повторных курсов плазмофереза. При наступлении терминальной стадии и отсутствии эффекта от симптоматической терапии больному назначают регулярный гемодиализ (2-3 раза в неделю). Перевод на гемодиализ рекомендован при снижении клиренса креатинина ниже 10 мл/мин и повышении его уровня в плазме до 0,1 г/л. Выбирая тактику терапии, следует учитывать, что развитие осложнений при хронической почечной недостаточности уменьшает эффект гемодиализа и исключает возможность трансплантации почки.
Прогноз при хронической почечной недостаточности всегда серьезный. Устойчивая реабилитация и существенное продление срока жизни возможно при своевременном проведении гемодиализа или пересадке почки. Решение о возможности проведения этих видов лечения принимается трансплантологами и врачами центров гемодиализа. Профилактика предусматривает своевременное выявление и лечение заболеваний, которые могут стать причиной ХПН.
Читайте также:
